文章信息
- 崔美玉, 耿丽华, 张全斌. 2022.
- CUI Mei-yu, GENG Li-hua, ZHANG Quan-bin. 2022.
- 转录组和蛋白组分析海带褐藻多糖硫酸酯对RAW 264.7细胞的免疫调节作用
- Transcriptomic and proteomic analysis of the immunomodulatory effects of fucoidan extracted from Saccharina japonica in RAW 264.7 cells
- 海洋科学, 46(11): 94-106
- Marine Sciences, 46(11): 94-106.
- http://dx.doi.org/10.11759/hykx20220304004
-
文章历史
- 收稿日期:2022-03-04
- 修回日期:2022-04-20
2. 青岛海洋科学与技术试点国家实验室, 海洋生物与生物技术功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049
2. Marine Biology and Biotechnology Laboratory, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
免疫系统是机体进行免疫应答和发挥免疫功能的重要系统, 可以发现并有效阻止病原体入侵清除病原微生物。巨噬细胞作为一种先天性免疫细胞, 在免疫系统中发挥着重要作用[1], 在非特异性免疫中, 巨噬细胞通过吞噬作用直接清除病原体等有害物质并介导炎症反应; 在特异性免疫中, 巨噬细胞作为抗原呈递细胞, 识别病原体相关分子模式, 将抗原性异物呈递给T细胞或B细胞, 激活机体的免疫应答。巨噬细胞功能的发挥与其表面模式识别受体密不可分, 其中, Toll样受体和清道夫受体是广泛存在于巨噬细胞表面的宿主防御系统的关键模式识别受体, 对先天性免疫系统识别病原体至关重要, 并介导免疫调节反应[2-3]。
海带作为一种大型经济藻类, 含有丰富的营养物质。从海带中制备的褐藻多糖硫酸酯(fucoidan, FPS)是海洋褐藻特有的一类含有岩藻糖的硫酸化多糖, 主要由岩藻糖和半乳糖组成, 也含有一定量的甘露糖、木糖等其他单糖[4]。研究表明褐藻多糖硫酸酯具有多种生物活性, 包括抗炎[5]、免疫刺激[6]、抗氧化[4]和抗凝血[7]以及神经保护等活性[8]。褐藻多糖硫酸酯可激活巨噬细胞, 提高巨噬细胞中一氧化氮(nitric oxide, NO)、一氧化氮合酶(nitric oxide synthase, iNOS)的表达, 以及白介素-6(Interleukin 6, IL-6)、肿瘤坏死因子(Tumor necrosis factor-α, TNF-α)等细胞因子的生成[9-11]。而且, 褐藻多糖硫酸酯促进NO和iNOS的表达, 引起的免疫调节反应, 可能是通过清道夫受体介导的[11]。同时, 也有研究表明褐藻多糖硫酸酯也能通过激活TLR4, 显著增强RAW 264.7细胞的活性, 诱导NO、IL-6和TNF-α的表达[10]。
转录组学是在某一生理条件下, 细胞内所有细胞转录产物的总和。检测在转录组中基因表达的上调和下调能够特异性地说明药物在该过程中所发挥的生物功能, 有利于探究基因变化背后的机制。转录组测序技术具有高通量、高准确性、高灵敏度等优势[12], 目前在免疫学领域被广为应用, 但欲进行精确的生物学研究, 仍需蛋白组学的支持。PRM蛋白质组学是不依赖于抗体、基于质谱的靶向蛋白精准定量技术[13], 具有高分辨和高精度的特点。基于PRM靶向定量蛋白组学, 我们可以通过选取模式识别受体特定的目标肽段直接进行相对定量检测。
目前, 海带来源褐藻多糖硫酸酯免疫调节活性的研究大多是从细胞和动物水平上展开的, 但由于人体是一个相对较复杂的系统, 当受到外部刺激时, 多种组织、器官以及细胞之间相互作用, 共同调节机体生理功能的变化。因此, 在本研究中采用RNA-Seq转录组学和PRM靶向定量蛋白质组学技术, 从整体上探究从海带中制备的褐藻多糖硫酸酯作用于小鼠巨噬细胞后, 巨噬细胞功能的变化以及具体模式识别受体的表达情况, 期望为利用海带开发具有免疫调节作用的功能食品或药物提供理论依据。
1 材料和方法 1.1 材料海带样品来源于山东荣成, 褐藻多糖硫酸酯制备方法参照实验室之前的方法[4], 其岩藻糖含量为29.12%, 硫酸基含量为33.01%, 糖醛酸含量为1.93%, 还含有一定量的半乳糖、甘露糖和葡萄糖等。
低密度脂蛋白(LDL)、1, 1’-双十八酯基-3, 3, 3, 3, 四甲基-吲哚碳菁高氯酸盐标记的乙酰化低密度脂蛋白(DiI-Ac-LDL)、乙酰化低密度脂蛋白(Ac-LDL)、PBS缓冲液(PBS)购自北京索莱宝公司; RPMI 1640培养基购自美国Hyclone公司; 胎牛血清(Gibico)购自美国赛默飞公司; 脂多糖(Lipopolysaccharide, LPS)购自上海源叶; 二甲亚砜(DMSO)、噻唑蓝3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazo-lium bromide, MTT)购自美国Sigma公司; ELISA试剂盒购自武汉博士德公司; TLR4/PE(货号: 12-9041-80)购自美国eBioscience; SR-A/PE(货号: ab275707)购自美国Abcam。
1.2 褐藻多糖硫酸酯作用于RAW 264.7后细胞活力和NO、细胞因子的表达NO表达: 将RAW 264.7细胞按照1×104个/孔的密度接种于96孔板, 每孔加入培养基100 μL。在细胞培养箱中培养至密度60%~80%时, 加入FPS(25, 50, 100和200 μg/mL), 以LPS(1 μg/mL)作为阳性对照组, CON空白对照组不做任何处理, 每组设置3个复孔。继续培养24 h后, 每孔吸取上清液50 μL, 加入至新的96孔板, 再分别各加入50 μL Griess试剂I和Griess试剂II, 摇匀后使用多功能酶标仪, 在540 nm吸光度下检测吸光值。以NaNO2做标准曲线, 计算对照组以及处理组的NO含量。
细胞活力: 细胞加药处理同上, 当给药后培养24 h后, 每孔加入10 μL的MTT溶液(5 mg/mL)。在37 ℃恒温培养箱中继续培养4 h后, 轻轻吸弃上清液, 加入150 μL DMSO后, 在摇床上摇晃5 min, 充分溶解结晶后, 使用多功能酶标仪, 在490 nm吸光度下检测吸光值。把空白对照组的细胞活力定为100%, 处理组的细胞活力相对于空白对照组计算。
ELISA检测细胞因子表达: 根据NO实验筛选出FPS的最佳浓度进行后续实验, 细胞加药处理同上。给药后继续培养24 h, 小心收集上清液, 转移至0.5 mL EP管中, 在4 ℃, 220 × g离心25 min后吸取上清液, 置于−20 ℃保存, 采用ELISA试剂盒检测细胞因子IL-6、IL-1β和TNF-α。
1.3 褐藻多糖硫酸酯作用于RAW 264.7后细胞总RNA的提取将RAW 264.7细胞按照1×105个/孔的密度接种于24孔板中, 当细胞密度达到60%~80%时, 加入FPS (100 μg/mL)或LPS(1 μg/mL), 同时设置空白组, 每组设置3个复孔。在37 ℃恒温培养箱中孵育3 h后, 取出至冰上。弃掉培养基, 迅速用预冷的PBS清洗3次细胞后, 加入1 mL Trizol裂解液, 迅速用细胞刮刀轻轻将细胞刮至一侧, 轻轻吹打混匀至形成清亮透明的液体, 转移至无酶管中, 放于−80 ℃冰箱中保存待测。
1.4 转录组文库的构建和测序小鼠巨噬细胞RAW 264.7真核转录组文库交由拜谱生物科技有限公司(中国, 上海)构建。采用Oligo (dT)磁珠, 从总RNA中富集带有多聚腺苷酸(polyadenylic acid, polyA)的mRNA, 使用离子打断方式, 将RNA打断成长度为300 bp左右的片段。以这些mRNA片段为模板, 使用逆转录酶和随机六碱基引物合成第一条cDNA链, 并以第一条cDNA链为模板合成第二条cDNA链, 再经PCR扩增进行文库片段的富集, 文库大小为450 bp。构建好的文库采用Agilent 2100 Bioanalyzer进行质检, 根据文库所需数量及有效浓度, 混合含有不同Index序列的文库, 统一稀释为2 nmol/L, 通过碱变性后构建单链文库。
构建好的文库利用第二代测序技术(Next-Generation Sequencing, NGS), 采用Illumina测序平台, 对文库进行双末端测序(Paired-end, PE)。
1.5 数据组装和基因功能注释为确保数据的可靠性, 过滤原始下机数据(Raw Data), 得到高质量的序列(Clean Data)。过滤的标准为: 除3′端带接头的序列以及去掉平均质量分数低于Q20的Reads。使用Sringtie软件进行转录本组装, 得到的Unigene文库进行下一步分析。采用Blast软件将Unigene序列与基因本体论联合会建立的数据库(Gene Ontology, GO, http://geneontology.org/)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG, http://www.kegg.jp/)、真核生物直系同源蛋白质聚类(Evolutionary Genealogy of Genes: Non-supervised Orthologous Groups, eggNOG, http://eggnog.embl.de/version_3.0/)、UniProt知识库(UniProt Knowledgebase, UniProtID, http://www.uniprot.org/help/uniprotkb)、国际生物化学会酶学委员会(Enzyme Commission, EC, http://enzyme.expasy.org/)进行比对后, 得到Unigene文库的注释信息。
1.6 差异表达基因及功能富集分析使用Tophat2软件比对参考基因组信息, 由比对结果进一步计算出每个基因的表达量, 对样品进一步进行表达差异分析和富集分析。
基因表达差异分析须同时满足显著性P < 0.05以及表达差异倍数|log2(差异表达倍数)| > 1, 即可视为差异表达基因。为描述基因的分布情况、显著性以及基因的表达倍数差异, 使用ggplots2软件绘制差异表达基因的火山图。并对差异基因进行GO和KEGG富集分析, 其中GO(Gene Ontology)富集可明确其参与的主要分子功能(Molecular Function)、生物学过程(Biological Process)、和细胞组分(Cellular Component)。KEGG(Kyoto encyclopedia of genes and genomes)富集可对基因产物在细胞中的基因产物功能及其代谢途径进行分析。
1.7 褐藻多糖硫酸酯作用于RAW 264.7后细胞总蛋白的提取将RAW 264.7细胞按照1 × 105个/孔的密度接种于24孔板中, 当细胞密度达到60%~80%时, 加入FPS(100 μg/mL)或LPS(1 μg/mL), 同时设置空白组, 每组设置3个复孔。在37 ℃恒温培养箱中孵育3 h, 取出至冰上。弃掉原培养基, 迅速用预冷的PBS清洗3次细胞后, 加入3 mL PBS, 用细胞刮刀将细胞迅速刮取至一侧, 并反复吹打混匀后, 转移至10 mL旋盖的离心管中, 13 800×g离心3 min, 弃掉上层PBS, 将细胞沉淀迅速转移至液氮中冷冻, 之后放于−80 ℃冰箱保存待测。
1.8 蛋白酶解及定量取蛋白样品加入400 μL 8 mol/L尿素, 冰浴中超声波处理, 在4 ℃, 16 000×g下离心20 min后取上清。每个样品取200 μg, 加入二硫苏糖醇, 使其终浓度为10 mmol/L, 在37 ℃反应1 h, 加入吲哚-3-乙酸, 终浓度为50 mmol/L, 避光条件下反应30 min。每个样品加入胰蛋白酶(酶活1: 50), 于37 ℃反应过夜, 定量脱盐后等量混合。
1.9 LC-PRM/MS分析根据转录组学富集的主要通路以及巨噬细胞表面主要的模式识别受体, 选取目标蛋白I型A类清道夫受体(MSRE, UniProtKB: P30204)、II型A类清道夫受体(MARCO, UniProtKB: Q60754)、Ⅲ型A类清道夫受体(SCARA3, UniProtKB: Q8C850)、Ⅴ型A类清道夫受体(SCARA5, UniProtKB: Q8K299)Toll样受体4(TLR4, UniProtKB: Q9QUK6)、Toll样受体2(TLR2, UniProtKB: Q9QUN7)、Toll样受体13(TLR13, UniProtKB: Q6R5N8)进行PRM靶向定量蛋白组学研究。
取适量每例样品的肽段进行LC-PRM/MS分析, 使用Easy nLC 1 200纳声流速色谱系分离。缓冲液为A-0.1%甲酸水溶液, B-0.1%甲酸、乙腈和水混合溶液。流速为300 nL/min。肽段分离后用Q-Exactive HFX质谱仪(Thermo Scientific)进行靶向PRM质谱分析。分析时长为60 min, 正离子检测模式, 母离子的扫描范围为300~1 500 m/z。一级质谱分辨率为70 000 (m/z 200), AGC target为3e6, Maximum IT为200 ms。二级质谱全扫描分辨率为17 500 (m/z 200), AGC target为1e6, Maximum IT为100 ms。对得到的质谱原始下机数据, 使用软件Skyline 4.1进行PRM数据分析。
1.10 褐藻多糖硫酸酯作用于RAW 264.7后SR-A和TLR4的表达将RAW 264.7细胞按照1 × 105个/孔的密度接种于12孔板中, 当细胞密度达到60%~80%时, 每孔分别加入FPS(100 μg/mL)或LPS(1 μg/mL), 同时设置空白组, 在37 ℃恒温培养箱中继续培养24 h后, 弃掉上清, 用PBS清洗细胞3次, 再用500 μL PBS吹打混匀细胞, 转移至1.5 mL的EP管中, 在100×g下离心5 min。取1×106个细胞, 用100 μL缓冲液重悬后, 加入Fc受体阻断剂(每106个细胞2 μL), 在室温孵育10~20 min, 离心将Fc受体阻断剂弃掉。用PBS再清洗一遍细胞, 分别按照相应比例使用抗体孵育缓冲液配制SR-A/PE和TLR4/PE的荧光一抗(每106个细胞100 μL缓冲液), 轻轻涡旋后, 在4 ℃避光孵育1 h。用PBS清洗3次细胞, 用500 μL PBS重悬, 经筛绢过滤后, 采用BD流式细胞仪上机分析, 全程避光, 以防止荧光淬灭。
1.11 褐藻多糖硫酸酯是否与清道夫受体结合将RAW 264.7细胞按照1×105个/孔的密度接种于12孔板中, 当细胞密度达到60%~80%时, 将DiI-Ac-LDL(10 μg/mL)分别和40倍浓度的DiI-Ac-LDL褐藻多糖硫酸酯(400 μg/mL)、阳性对照Ac-LDL (400 μg/mL)以及阴性对照LDL(400 μg/mL), 分别在冰上共同孵育30 min, 全程避光进行。弃掉上清液, 用PBS清洗细胞3次, 再用500 μL PBS重悬细胞, 经筛绢过滤后, 采用流式细胞仪(facs aria 2, BD Biosciences)上机分析。
2 结果 2.1 褐藻多糖硫酸酯对RAW 264.7的细胞活力和NO表达的影响将浓度分别为25、50、100和200 μg/mL的FPS作用于RAW 264.7细胞24 h, 如图 1所示, 褐藻多糖硫酸酯作用于细胞之后均无细胞毒性, 且都能显著性地促进NO的产生, 当FPS在100 μg/mL浓度时, NO的表达量达到最高。
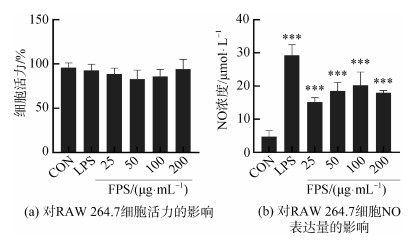 |
| 图 1 褐藻多糖硫酸酯(25、50、100、200 μg/mL)对RAW 264.7的细胞活力和NO表达量的影响 Fig. 1 Cytotoxic effects and NO production of FPS (25, 50, 100, and 200 μg/mL) in RAW 264.7 cells. 注: 以1 μg/mL的LPS作为阳性对照。褐藻多糖硫酸酯作用RAW 264.7细胞24 h后, 采用MTT法检测细胞活力, Griess试剂法检测NO表达量。数据以独立实验的平均值±标准差(样本数=3)表示。*表示P < 0.05, **表示P < 0.01, ***表示P < 0.005。 |
采用ELISA法对褐藻多糖硫酸酯(100 μg/mL)作用于RAW 264.7细胞后, 细胞因子的表达检测结果如图 2所示, 褐藻多糖硫酸酯可明显促进巨噬细胞IL-6、IL-1β和TNF-α的表达。
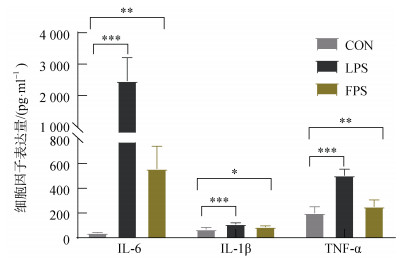 |
| 图 2 褐藻多糖硫酸酯(100 μg/mL)对RAW 264.7的细胞因子表达的影响 Fig. 2 Effects of FPS (100 μg/mL) on the expression of cytokines production in RAW 264.7 cells 注: 以1 μg/mL的LPS作为阳性对照。褐藻多糖硫酸酯作用RAW 264.7细胞24 h后, 采用ELISA法检测细胞因子表达。数据以独立实验的平均值±标准差(样本数=5)表示。*表示P < 0.05, **表示P < 0.01, ***表示P < 0.005。 |
分别从小鼠巨噬细胞RAW 264.7 FPS样品组、LPS阳性对照组、以及CON未处理组中提取RNA, 每组各3个重复, 一共构建了9个转录组文库(CON 1, CON 2, CON 3, LPS 1, LPS 2, LPS 3, FPS 1, FPS 2, FPS 3)。样品经过上机测序后, 得到初始下机数据(raw data), 过滤去除低质量的数据(reads), 每个文库保留3 400万到4 400万个高质量数据(clean reads), 且每个文库中高质量数据占测序总数据的90%以上。Q30(碱基识别准确率在99.9%以上的碱基所占百分比)均在92%以上, 说明高质量数据的质量较好, 准确性较高, 满足后续实验分析的要求(表 1)。
| 样本 | 初始测序数据量/个 | 高质量数据量/个 | 高质量数据占比/% | Q30/% | 与参考基因组比对率/% | 与参考基因组单一比对率/% |
| CON_1 | 45 523 982 | 41 475 310 | 91.10 | 92.63 | 90.69 | 93.84 |
| CON_2 | 45 523 982 | 39 909 194 | 91.65 | 92.99 | 90.97 | 93.82 |
| CON_3 | 42 255 440 | 38 484 452 | 91.07 | 92.57 | 90.65 | 93.91 |
| LPS_1 | 41 040 170 | 37 710 084 | 91.88 | 93.14 | 91.52 | 93.99 |
| LPS_2 | 45 528 792 | 41 735 628 | 91.66 | 93.25 | 91.83 | 93.87 |
| LPS_3 | 39 972 260 | 36 942 120 | 92.41 | 92.23 | 91.46 | 94.09 |
| FPS_1 | 47 341 288 | 43 008 646 | 90.84 | 92.44 | 90.08 | 93.73 |
| FPS_2 | 38 293 184 | 34 826 210 | 90.94 | 93.33 | 91.59 | 93.60 |
| FPS_3 | 39 305 124 | 36 179 138 | 92.04 | 92.98 | 90.69 | 93.68 |
使用TopHat2软件将高质量数据比对到参考基因组上, 匹配率见表 1, 根据比对结果, 可知, 选择的参考基因组合适, 且实验不存在污染。
2.4 差异表达基因分析根据基因表达差异分析的结果(同时满足表达差异倍数|log2(差异表达倍数)| > 1以及显著性P < 0.05), 通过绘制差异表达基因的火山图(图 3), 可知LPS处理后与CON组相比共有差异表达基因2 312个, 其中LPS组相对于CON组的差异表达基因上调1 095个, 下调有1 217个; FPS处理后与CON组相比共有差异表达基因982个, 其中FPS组相对于CON组的差异表达基因上调543个, 下调有439个; FPS处理后与LPS处理后相比共有差异表达基因848个, 其中FPS组相对于LPS组的差异表达基因上调338个, 下调有510个。
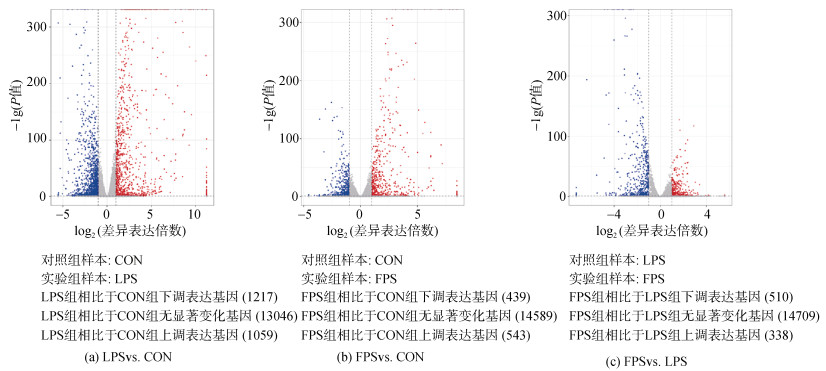 |
| 图 3 LPS vs CON, FPS vs CON和FPS vs LPS差异表达基因火山图 Fig. 3 Volcano map of differentially expressed genes in LPS vs. CON, FPS vs. CON and FPS vs. LPS 注: 火山图的横坐标为log2(差异表达倍数), 纵坐标为–lg(P值)。图中两条竖虚线为2倍表达差异阈值; 横虚线为P=0.05阈值。红点表示该组上调基因, 蓝点表示该组下调基因, 灰点表示非显著差异表达基因。 |
为研究以上差异表达基因的功能, 我们使用topGO进行GO富集分析, 利用GO功能注释的差异基因对每一个功能条目(GO term)的基因列表和基因数目计算, 通过显著富集P < 0.05, 找出差异基因显著富集的功能条目, 从而确定差异基因主要行使的生物学功能。
LPS处理组和CON组相比的差异表达基因(图 4a)与FPS处理组和CON组相比的差异表达基因(图 4b)的GO功能富集大致相似。在细胞组分中, 差异表达基因主要富集在细胞质、囊泡、细胞表面、内膜系统、高尔基体等; 在分子功能上, 差异表达基因主要富集在蛋白结合、细胞因子受体结合、细胞因子活性、酶结合、信号受体结合、阴离子结合、蛋白质酪氨酸/苏氨酸磷酸酶活性等; 在生物过程上, 差异表达基因主要富集在免疫系统的过程、对外部生物刺激的反应、防御反应、免疫反应、物种间的相互作用、先天性免疫应答等。
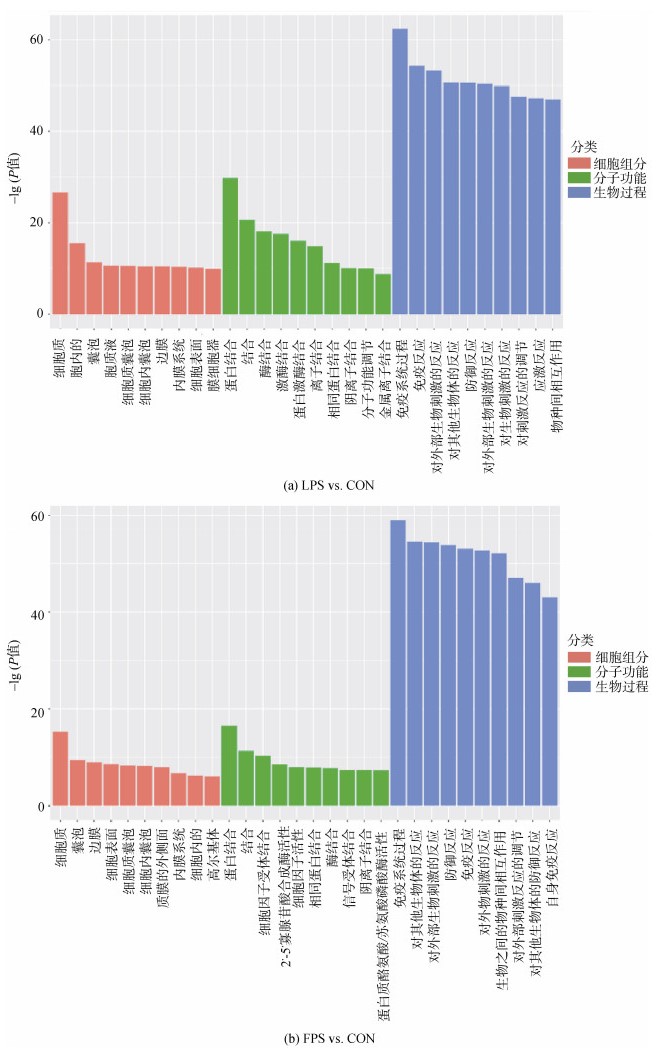 |
| 图 4 LPS vs. CON (a)和FPS vs. CON (b)差异表达基因的GO富集分析柱状图 Fig. 4 GO enrichment histogram of differentially expressed genes of LPS vs. CON (a) and FPS vs. CON (b) |
以KEGG数据库中的通路(pathway)为单位, 应用超几何检验的方法, 通过对通路中富集到的差异基因个数与注释到的基因个数的比值(rich factor, 富集系数)、P值校正值(false discovery rate, FDR)和富集到该通路上的基因个数衡量富集的程度, 找出与整个基因组大背景相比, 差异表达基因中显著性富集的通路。差异表达基因的KEGG通路富集分析气泡图如图 5所示, 选取FDR值最小, 即富集最显著的前20个通路进行展示。
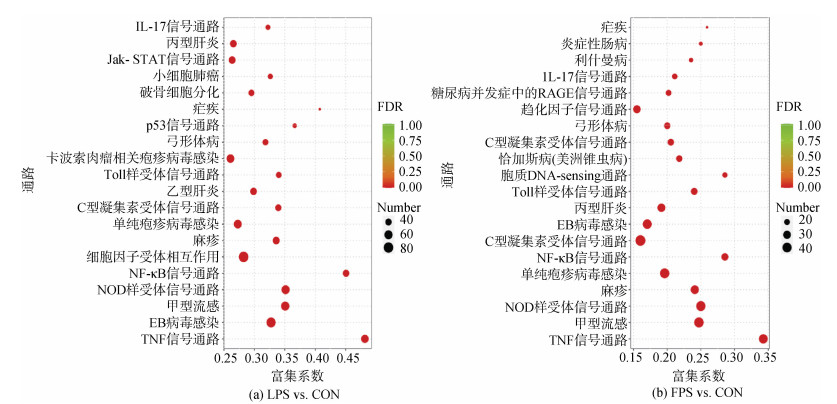 |
| 图 5 LPS vs CON和FPS vs CON差异表达基因的KEGG富集分析气泡图 Fig. 5 KEGG enrichment bubble diagram of differentially expressed genes of LPS vs. CON and FPS vs. CON 注: 气泡图中横坐标富集系数代表指该通路中富集到的差异基因个数与注释到的基因个数的比值。富集系数越大, 表示富集的程度越大。FDR取值范围为0~1, 越接近于零, 表示富集越显著。 |
LPS处理组和CON组相比的差异表达基因(图 5a)与FPS处理组和CON组相比的差异表达基因(图 5b)主要富集的信号通路大致相似。富集在TNF信号通路、NOD样受体信号通路、NF-κB信号通路、细胞因子受体相互作用、C型凝集素受体通路、Toll样受体信号通路等通路, 其中TNF信号通路和NF-κB信号通路富集程度最显著。
2.7 目标蛋白的PRM靶向定量共对LPS阳性对照组、FPS样品组以及CON空白对照组提取蛋白, 每组各3个重复, 根据KEGG富集结果, 差异基因主要富集在Toll样受体、TNF和NF-κB通路, 以及巨噬细胞表面主要模式识别受体为清道夫受体和Toll样受体, 选取MSRE、MARCO、SCARA5、SCARA3和TLR4、TLR2和TLR13这7个目标膜蛋白进行了LC-PRM/MS分析, 得到了7个蛋白的2~5个可信肽段, 进行PRM靶向定量分析, 根据每条肽段的子离子峰面积, 对在不同组中的目标肽段和蛋白含量进行相对定量分析, 结果如图 6所示。
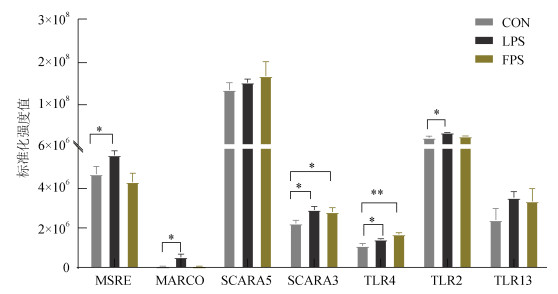 |
| 图 6 褐藻多糖硫酸酯(100 μg/mL)对RAW 264.7不同的模式识别受体表达的影响 Fig. 6 Effects of FPS (100 μg/mL) on the expression of different pattern recognition receptors in RAW 264.7 cells 注: 以1 μg/mL的LPS作为阳性对照。采用LC-PRM/MS检测模式识别受体的表达。数据以独立实验的平均值±标准差(样本数=3)表示。*表示P < 0.05, **表示P < 0.01, ***表示P < 0.005。 |
在选取的7个蛋白中, 当LPS作用于巨噬细胞RAW 264.7后, 清道夫受体中MSRE、MARCO、SCARA3的表达量显著升高, Toll样受体中TLR4、TLR2的表达量显著升高; 当褐藻多糖硫酸酯作用于巨噬细胞RAW 264.7后, 清道夫受体中SCARA3的表达量显著升高, Toll样受体中TLR4的表达量显著升高。
2.8 褐藻多糖硫酸酯对RAW 264.7中SR-A和TLR4表达的影响MSRE、MARCO、SCARA3和SCARA5同属于A类清道夫受体(SR-A), 但由于目前市面上并无针对具体分类的SR-A制备的荧光一抗, 且PRM靶向蛋白组学结果显示当褐藻多糖硫酸酯作用后, SCARA3表达量升高, 故选取SR-A通用一抗进行流式验证。
采用流式细胞仪进一步检测褐藻多糖硫酸酯(100 μg/mL)作用于RAW 264.7细胞后, 模式识别受体SR-A和TLR4的表达。结果如图 7所示, 褐藻多糖硫酸酯可以在促进SR-A和TLR4的表达, 与蛋白质组学的结果相对应。
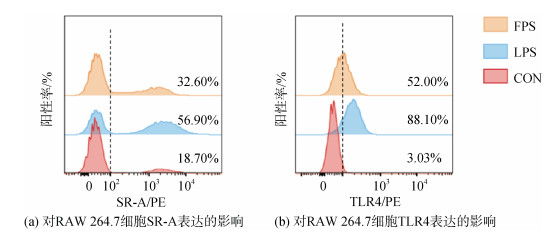 |
| 图 7 褐藻多糖硫酸酯(100 μg/mL)对RAW 264.7细胞SR-A和TLR4表达的影响 Fig. 7 Effects of FPS (100 μg/mL) on the expression of SR-A and TLR4 in RAW 264.7 cells 注: 以1 μg/mL的LPS作为阳性对照。褐藻多糖硫酸酯作用RAW 264.7细胞24 h后, 采用流式细胞仪检测。FlowJo V10软件进行数据分析, 图中数字代表与未处理组相比荧光强度的变化。 |
由于SCARA3不参与巨噬细胞的内化作用, 但褐藻多糖硫酸酯作用后其表达量升高, 故通过竞争结合实验, 进一步探究褐藻多糖硫酸酯引起SCARA3表达量升高的原因。
研究表明, Ac-LDL是包括SR-A在内的多种清道夫受体的配体[14], 这些清道夫受体参与调节巨噬细胞对Ac-LDL的内化, 其中MSRE和MARCO发挥主要作用[15]。用荧光DiI标记Ac-LDL, 采用流式细胞术检测褐藻多糖硫酸酯是否与Ac-LDL竞争性结合清道夫受体。
由图 8可知, Ac-LDL作为清道夫受体的配体, 降低了DiI-Ac-LDL的荧光强度; 而LDL则不能降低DiI-Ac-LDL的荧光强度。FPS同样不能降低DiI-Ac-LDL的荧光强度, 可知FPS不能与Ac-LDL竞争性结合SR-A, 不能影响清道夫受体对Ac-LDL的内化。
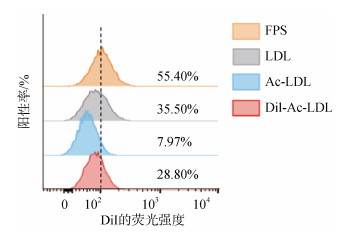 |
| 图 8 褐藻多糖硫酸酯是否与DiI-Ac-LDL竞争性结合清道夫受体 Fig. 8 Determination of FPS produced competitive combination with DiI-Ac-LDL 注: 加入DiI-Ac-LDL(10 μg/mL), 与褐藻多糖硫酸酯(400 μg/mL)、Ac-LDL(400 μg/mL)(阳性对照)或LDL(400 μg/mL)(阴性对照)分别于冰上避光孵育30 min后, 采用流式细胞仪检测。采用FlowJo V10软件进行数据分析, 图中的数字代表与未处理组相比荧光强度的变化。 |
免疫系统在清除和防御病原体中起到关键作用, 维持着机体健康。然而, 当机体对病原菌的抵抗能力不足, 机体免疫系统部分功能受损, 或当恶性肿瘤等疾病发生时, 仅仅依靠人体自身免疫系统发挥作用往往是无法应对的, 因此免疫增强和免疫调节尤为重要。
人体作为一个开放性的复杂大系统, 多种组织、器官及细胞相互作用、相互联系, 共同协调对外部刺激的适应性反应以及进行生理功能调节。以往单纯基于细胞模型对于免疫调节的研究有一定的局限性, 随着近年来生命科学的发展, 转录组学技术和蛋白质组学技术的优势日益显现[16-17], 可以从整体水平上分析当受到免疫刺激时, 细胞内相关基因富集的生物功能、生物过程和信号通路, 以及定量相关蛋白的表达水平。从宏观的角度阐述环境、药物对细胞功能的影响, 了解细胞生命活动的一般规律。
目前, 海藻多糖的免疫调节活性已有一定的研究基础, Nakamura等[11]的研究表明墨角藻来源的褐藻多糖硫酸酯可以显著提高iNOS和NO的表达, 在100 μg/mL时NO和iNOS的表达量最高。因此在本实验中, 我们选取25、50、100和200 μg/mL浓度的褐藻多糖硫酸酯作用于小鼠巨噬细胞RAW 264.7进行试验。通过MTT法检测其对巨噬细胞细胞活力的影响, 结果表明, 褐藻多糖硫酸酯在200 μg/mL的浓度以内对巨噬细胞RAW 264.7没有细胞毒性。而且, 褐藻多糖硫酸酯在此浓度范围都能显著促进RAW 264.7中NO的产生, 具有良好的免疫调节活性, 且在100 μg/mL时, NO的表达量最高, 免疫刺激活性达到平台期, 也能显著促进IL-6、IL-1β和TNF-α的表达。因此, 在后续的转录组和蛋白组等实验中, 我们选取100 μg/mL的浓度进行实验。
通过转录组学的研究, 我们发现在褐藻多糖硫酸酯作用于RAW 264.7细胞后, 褐藻多糖硫酸酯给药组相对于正常组的基因表达存在着显著的差异, CON组和FPS组之间共有差异表达基因982个, 其中相对于CON组, FPS组的差异表达基因上调的有543个, 下调的有439个。通过GO富集和KEGG富集结果, 差异表达相关基因主要参与蛋白结合、离子结合等信号分子与蛋白的识别结合过程, 细胞因子活性、先天性免疫应答等免疫调节功能发挥、细胞因子受体相互作用、TNF信号通路、NF-κB信号通路、Toll样受体信号通路、C型凝集素受体通路等信号通路传导过程, 这些信号通路在免疫功能的发挥上起着不可或缺的作用。当褐藻多糖硫酸酯作用于RAW 264.7细胞后, 通过作用于巨噬细胞膜表面的某些蛋白, 引起NF-κB、TNF、Toll样受体等免疫相关信号通路的变化以及细胞因子的分泌, 进一步引起细胞的免疫调节反应。
同时, 很多研究将褐藻多糖硫酸酯作用于细胞之后, 通过具体细胞实验也进一步佐证了我们的转录组学结果。Ma等[18]表明羊栖菜来源褐藻多糖硫酸酯可引起巨噬细胞NO、活性氧(reactive oxygen species, ROS)以及细胞因子的产生, 引起免疫调节反应。Peng等[19]提出褐藻多糖硫酸酯复合物可以通过调节细胞因子分泌途径, 促进RAW 264.7细胞的增殖, 增强机体的非特异性和特异性免疫。Miyazaki等[9]表明Cladosiphon okamuranus来源的褐藻多糖硫酸酯可能是通过与巨噬细胞膜表面模式识别受体相互作用, 进一步激活C型凝集素-1信号通路, 引起NO、TNF-α的表达, 增强巨噬细胞的免疫功能。
巨噬细胞免疫功能的发挥, 与模式识别受体清道夫受体和Toll样受体能够启动巨噬细胞的免疫应答机制密切相关, 因此我们选取清道夫受体SR-A中的MSRE、MARCO、SCARA3和SCARA5以及Toll样受体中的TLR2, TLR4和TLR13进行研究。A类清道夫受体是一种三聚体II型跨膜蛋白, 参与巨噬细胞复杂的代谢过程。MSRE在巨噬细胞中优先表达, 可以识别Ac-LDL、革兰氏阳性菌和阴性菌等多种配体, 在多种疾病中发挥作用[15]。MARCO也可以结合Ac-LDL, 其在结构上与MSRE的不同之处在于它有一个更大的胶原结构域, 缺乏α-螺旋结构域。且MARCO可以与革兰氏阳性菌和阴性菌相结合, 在先天性免疫中发挥作用[20]。SCARA5在结构上与MSRE和MARCO相似, 虽然参与免疫调节反应, 但与其他清道夫受体有着较大差异, 也不参与Ac-LDL的内化, 其在抑制肿瘤生长、肿瘤血管的生成方面具有重要作用[21]。SCARA3与其他SR-A不同, 不参与Ac-LDL的内化, 其主要功能是保护细胞免受活性氧的损伤[22]。Toll样受体是Ⅰ型跨膜蛋白, 分为胞膜外区, 胞浆区和跨膜区三部分, 是免疫系统天然的模式识别受体, 通过识别病原相关分子模式, 调控免疫应答[23]。TLR4和TLR2位于细胞膜表面, 在免疫应答中相互作用, 通过识别脂蛋白等病原相关分子模式, 激活下游NF-κB、MAPK信号通路, 调节免疫反应[10]。TLR13位于细胞内溶酶体、内质网上, 近年来的研究表明, TLR13可以识别细菌内的23S核糖体保守序列, 具有免疫识别和调控的功能[24]。
在后续LC-PRM/MS对以上7种蛋白的相对定量蛋白组学研究中, 我们发现当褐藻多糖硫酸酯作用于巨噬细胞RAW 264.7后, 可以显著性促进其表面的清道夫受体SR-A中的SCARA3以及Toll样受体中TLR4的表达, 我们也通过流式对模式识别受体SR-A和TLR4的表达量进行了验证, 发现褐藻多糖硫酸酯可以在不同程度上促进SR-A和TLR4的表达。Hsu等[25]发现墨角藻来源的褐藻多糖硫酸酯通过作用于TLR4, 激活下游ROS依赖的内质网应激通路, 进一步抑制肿瘤活力, 抑制癌细胞的生长。同样, 海参来源的褐藻多糖硫酸酯作用于RAW264.7细胞后, 通过TLR2/4激活NF-κB通路, 进一步引起NO、TNF-α和IL-6的表达, 发挥免疫调节作用[10]。
在进行竞争性结合实验时, 我们发现褐藻多糖硫酸酯并不能与Ac-LDL竞争结合SR-A, 说明褐藻多糖硫酸酯并不能直接与MSRE和MARCO结合。同时通过流式表征膜蛋白表达量的结果, 我们发现褐藻多糖硫酸酯可以显著上调SCARA3的表达, 但是SCARA3不参与巨噬细胞的内化, 不是Ac-LDL的受体, 因此进一步佐证了褐藻多糖硫酸酯并不能结合SR-A。然而, Nakamura等[11]表明Sigma提供的墨角藻来源的褐藻多糖硫酸酯可以通过与SR-A结合, 激活p38 MAPK通路和NF-κB依赖通路, 诱导iNOS和NO的产生。我们推测, 产生这一差异的主要原因是两种不同来源的褐藻多糖硫酸酯的化学组成和结构不同。其中, 墨角藻来源的褐藻多糖硫酸酯含有44.1%的岩藻糖, 26.3%的硫酸基, 主链结构为(1→3)和(1→4)连接的α-L-岩藻糖, 且主链中每隔两到三个岩藻糖残基就会有一个支链, 硫酸基取代的位置主要在C-2位和C-3位[26-27]。海带来源的褐藻多糖硫酸酯含有29.12%的岩藻糖, 33.01%的硫酸基, 主链结构主要由(1→3)连接的α-L-岩藻糖组成, 也含有少量的(1→4)连接的α-L-岩藻糖, 支链繁多, 主要为岩藻糖或(1→6)连接的半乳糖, 以及相当量的其他单糖残基; 硫酸基取代位置不均一, 可能存在C-2位、C-3位或C-4位, 双取代的情况常见[4, 28]。因此, 不同来源的褐藻多糖硫酸酯的化学组成和结构的差异, 导致其与SR-A的结合情况不同。
此外, 模式识别受体之间的相互作用也可能导致了这一现象的发生。有研究报道, 褐藻多糖硫酸酯可以通过直接激活TLR4进一步引起下游通路的变化[25]。而且, Xu等[29]在研究中发现TLR2和TLR4介导的p38信号通路可以协同作用共同调节SR-A的水平。Amiel等[30]也表明TLR4介导先天性免疫应答, 通过MyD88信号通路, 进一步调控SR-A的吞噬作用。另外, SCARA3与其他A类清道夫受体的作用不同, 主要参与氧化应激反应, 保护细胞免受活性氧的侵害[22], SCARA3可能是通过这一途径使褐藻多糖硫酸酯发挥免疫调节作用。褐藻多糖硫酸酯是否能与SCARA3直接结合还需进一步验证。
4 结论本文采用组学技术首次报道了海带来源褐藻多糖硫酸酯对巨噬细胞基因水平的整体调控情况, 以及对主要膜蛋白的表达影响。研究结果表明, 褐藻多糖硫酸酯具有良好的免疫调节活性, 可以显著促进NO和细胞因子IL-6、IL-1β和TNF-α的表达。转录组共鉴定出差异表达基因982个, 上调的差异表达基因543个, 下调的差异表达基因439个, 且这些差异表达基因主要富集在信号分子与蛋白的识别结合过程、免疫调节功能发挥以及免疫相关信号通路的传导过程。蛋白组学结果揭示了褐藻多糖硫酸酯可促进巨噬细胞表面膜蛋白清道夫受体SCARA3和Toll样受体TLR4的表达, 流式结果和竞争结合实验对其进行了佐证。研究结果为褐藻多糖硫酸酯在免疫调节和免疫增强中的应用提供了依据。
| [1] |
WYNN T A, CHAWLA A, POLLARD J W. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496(7446): 445-455. DOI:10.1038/nature12034 |
| [2] |
FANG W S, BI D C, ZHENG R J, et al. Identification and activation of TLR4-mediated signalling pathways by alginate-derived guluronate oligosaccharide in RAW264.7 macrophages[J]. Scientific Reports, 2017, 7(1): 1663. DOI:10.1038/s41598-017-01868-0 |
| [3] |
HAMASAKI S, KOBORI T, YAMAZAKI Y, et al. Effects of scavenger receptors-1 class A stimulation on macrophage morphology and highly modified advanced glycation end product-protein phagocytosis[J]. Scientific Reports, 2018, 8(1): 5901. DOI:10.1038/s41598-018-24325-y |
| [4] |
WANG J, ZHANG Q B, ZHANG Z S, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica[J]. International Journal of Biological Macromolecules, 2008, 42(2): 127-132. DOI:10.1016/j.ijbiomac.2007.10.003 |
| [5] |
YE J, CHEN D H, YE Z C, et al. Fucoidan isolated from Saccharina japonica inhibits LPS-induced inflammation in macrophages via blocking NF-kappaB, MAPK and JAK-STAT pathways[J]. Marine Drugs, 2020, 18(6): 328. DOI:10.3390/md18060328 |
| [6] |
HAN J G, SYED A Q, KWON M, et al. Antioxident, immunomodulatory and anticancer activity of fucoidan isolated from Fucus vesiculosus[J]. Journal of Biotechnology, 2008, 136(Sup): S558-S576. |
| [7] |
WANG J, ZHANG Q B, ZHANG Z S, et al. Potential antioxidant and anticoagulant capacity of low molecular weight fucoidan fractions extracted from Laminaria japonica[J]. International Journal of Biological Macromolecules, 2010, 46(1): 6-12. DOI:10.1016/j.ijbiomac.2009.10.015 |
| [8] |
JIN W H, WANG J, JIANG H, et al. The neuroprotective activities of heteropolysaccharides extracted from Saccharina japonica[J]. Carbohydrate Polymers, 2013, 97(1): 116-120. DOI:10.1016/j.carbpol.2013.04.055 |
| [9] |
MIYAZAKI Y, IWAIHARA Y, BAK J, et al. The cooperative induction of macrophage activation by fucoidan derived from Cladosiphon okamuranus and beta-glucan derived from Saccharomyces cerevisiae[J]. Bio chemical and Biophysical Research Communications, 2019, 516(1): 245-250. DOI:10.1016/j.bbrc.2019.06.010 |
| [10] |
JIANG S X, YIN H N, LI R, et al. The activation effects of fucoidan from sea cucumber Stichopus chloronotus on RAW264.7 cells via TLR2/4-NF-kappaB pathway and its structure-activity relationship[J]. Carbohydrate Polymers, 2021, 270: 118353. DOI:10.1016/j.carbpol.2021.118353 |
| [11] |
NAKAMURA T, SUZUKI H, WADA Y, et al. Fucoidan induces nitric oxide production via p38 mitogen-activated protein kinase and NF-κB-dependent signaling pathways through macrophage scavenger receptors[J]. Biochemical and Biophysical Research Communications, 2006, 343: 286-294. DOI:10.1016/j.bbrc.2006.02.146 |
| [12] |
CHEN X, LAI Y L. A censored-Poisson model based approach to the analysis of RNA-seq data[J]. Quan tita tive Biology, 2020, 8(2): 155-171. DOI:10.1007/s40484-020-0208-3 |
| [13] |
AEBERSOLD R, MANN M. Mass-spectrometric exploration of proteome structure and function[J]. Nature, 2016, 537(7620): 347-355. DOI:10.1038/nature19949 |
| [14] |
NISHINAKA T, MORI S, YAMAZAKI Y, et al. A comparative study of sulphated polysaccharide effects on advanced glycation end-product uptake and scavenger receptor class A level in macrophages[J]. Diabetes & Vascular Disease Research, 2020, 17(1): 1479164119896975. |
| [15] |
CANTON J, NECULAI D, GRINSTEIN S. Scavenger receptors in homeostasis and immunity[J]. Nature Reviews Immunology, 2013, 13(9): 621-634. DOI:10.1038/nri3515 |
| [16] |
ZHAI Y F, XU R H, HE P M, et al. A proteomics investigation of 'immune priming' in Penaeus vannamei as shown by isobaric tags for relative and absolute quantification[J]. Fish Shellfish Immunol, 2021, 117: 140-147. DOI:10.1016/j.fsi.2021.07.015 |
| [17] |
QI L J, CHEN Y D, SHI K P, et al. Combining of transcriptomic and proteomic data to mine immune-related genes and proteins in the liver of Cynoglossus semilaevis challenged with Vibrio anguillarum[J]. Compa rative Biochemistry and Physiology - Part D: Geno mics and Proteomics, 2021, 39: 100864. DOI:10.1016/j.cbd.2021.100864 |
| [18] |
MA W P, LI H H, LIU M, et al. Effects of simulated digestion in vitro on the structure and macrophages activation of fucoidan from Sargassum fusiforme[J]. Carbohydrate Polymers, 2021, 272: 118484. DOI:10.1016/j.carbpol.2021.118484 |
| [19] |
PENG Y B, SONG Y F, WANG Q K, et al. In vitro and in vivo immunomodulatory effects of fucoidan compound agents[J]. International Journal of Biological Macromolecules, 2019, 127: 48-56. DOI:10.1016/j.ijbiomac.2018.12.197 |
| [20] |
GOUGHA P J, GORDON S. The role of scavenger receptors in the innate immune system[J]. Microbes and Infection, 2000, 2: 305-311. DOI:10.1016/S1286-4579(00)00297-5 |
| [21] |
史子敏, 朱安义, 洪正东. SCARA5的研究进展[J]. 广东医学, 2018, 39(24): 3724-3726. SHI Zimin, ZHU Anyi, HONG Zhengdong. Research progress of SCARA5[J]. Guangdong Medical Journal, 2018, 39(24): 3724-3726. DOI:10.3969/j.issn.1001-9448.2018.24.033 |
| [22] |
ALQURAINI A, KHOURY J E. Scavenger receptors[J]. Current Biology, 2020, 30(14): R790-R795. DOI:10.1016/j.cub.2020.05.051 |
| [23] |
周庆, 郝璐, 周泽强. 固有免疫系统Toll样受体的研究进展[J]. 生物学杂志, 2016, 33(3): 83-87. ZHOU Qing, HAO Lu, ZHOU Zeqiang. Research progress of Toll-like receptor in innate immune system[J]. Journal of Biology, 2016, 33(3): 83-87. DOI:10.3969/j.issn.2095-1736.2016.03.083 |
| [24] |
LI X D, CHEN Z J. Sequence specific detection of bacterial 23S ribosomal RNA by TLR13[J]. eLife, 2012, 1: e00102. DOI:10.7554/eLife.00102 |
| [25] |
HSU H Y, LIN T Y, LU M K, et al. Fucoidan induces Toll-like receptor 4-regulated reactive oxygen species and promotes endoplasmic reticulum stress-mediated apoptosis in lung cancer[J]. Scientific Reports, 2017, 744990. |
| [26] |
BLACK W A P, DEWAR E T, WOODWARD F N. Manufacture of algal chemicals. IV −Laboratory-scale isolation of fucoidin from brown marine algae[J]. Journal of the Science of Food and Agriculture, 1952, 3(3): 122-129. DOI:10.1002/jsfa.2740030305 |
| [27] |
PATANKAR M S, OEHNINGER S, BARNETT T, et al. A revised structure for fucoidan may explain some of its biological activities[J]. Journal of Biological Chemistry, 1993, 268(29): 21770-21776. DOI:10.1016/S0021-9258(20)80609-7 |
| [28] |
WANG J, ZHANG Q B, ZHANG Z S, et al. Structural studies on a novel fucogalactan sulfate extracted from the brown seaweed Laminaria japonica[J]. Internatio nal Journal of Biological Macromolecules, 2010, 47(2): 126-131. DOI:10.1016/j.ijbiomac.2010.05.010 |
| [29] |
XU W Y, WANG L, WANG H M, et al. TLR2 and TLR4 agonists synergistically up-regulate SR-A in RAW264.7 through p38[J]. Molecular Immunology, 2007, 44(9): 2315-2323. |
| [30] |
AMIEL E, ALONSO A, UEMATSU S, et al. Pivotal advance: Toll-like receptor regulation of scavenger receptor-A-mediated phagocytosis[J]. Journal of Leu kocyte Biology, 2009, 85(4): 595-605. |
 2022, Vol. 46
2022, Vol. 46


