文章信息
- 诸葛福照, 刘晓黎, 孟强, 童真艺, 朱曼曼, 刘晨光. 2022.
- ZHUGE Fu-zhao, LIU Xiao-li, MENG Qiang, TONG Zhen-yi, ZHU Man-man, LIU Chen-guang. 2022.
- 低共熔溶剂提取海洋活性物质研究进展
- Advances in extracting marine active substances using deep eutectic solvents
- 海洋科学, 46(11): 147-159
- Marine Sciences, 46(11): 147-159.
- http://dx.doi.org/10.11759/hykx20220523002
-
文章历史
- 收稿日期:2022-05-23
- 修回日期:2022-06-29
海洋活性物质是指海洋生物体内含有的对生命现象具有影响的物质[1], 包括多糖、蛋白质、脂质、萜烯及酚类化合物等, 在医药[2]、化妆品[3]和保健食品[4]等领域具有广泛的应用。提取海洋活性物质的传统工艺为有机溶剂萃取, 这一方法虽然具有提取工艺简单、成本较低和基体影响小等优点, 但也存在提取效率较低和污染环境等缺点[5]。近年来, 随着绿色化学理念的发展, 科学家尝试寻找一种环境友好的有机溶剂替代物。离子液体(ionic liquid, IL)是由有机或无机阳离子与有机阴离子构成的溶剂体系, 与有机溶剂相比, 具有化学稳定性高、溶剂可回收、挥发性低等优点[6], 但依然存在合成复杂、成本较高和生物降解性差等问题, 难以大规模生产与应用。
Abbott团队[7]首次以季铵盐和酰胺化合物为原料制备了一种物化性质优良的绿色溶剂——低共熔溶剂(deep eutectic solvent, DES)。相比于有机溶剂和IL, DES除部分原料价格较为昂贵外, 具有制备简单、可生物降解和绿色环保等优势, 在生物活性物质提取方面显示出广阔的应用前景[8]。
DES已被广泛应用于陆地及海洋等生物活性物质的提取, 然而, 目前研究学者主要综述了DES在陆地生物活性物质的提取, 而没有针对提取海洋生物体内的活性物质的研究综述。因此, 本文综述了DES在海洋活性物质提取中的应用, 探讨了DES物化性质与提取效率间的对应关系, 以期指导设计各种有效提取海洋活性物质的DES, 为海洋活性物质的高效、绿色提取提供新的策略。
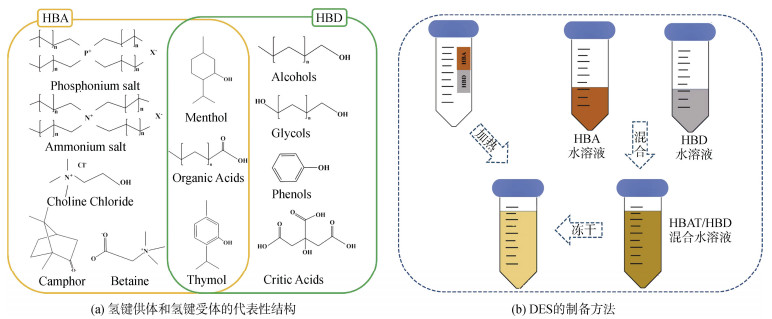
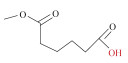
1 低共熔溶剂 1.1 低共熔溶剂的制备低共熔溶剂通常由氢键供体(hydrogen bond donor, HBD)如羧酸、硫脲、氨基酸、尿素、糖类与氢键受体(hydrogen bond acceptor, HBA)如氯化胆碱等季铵盐、甜菜碱等两性离子(见图 1a)按一定摩尔比混合配制而成, 在室温下以澄清液体的形式存在[9]。其制备方法主要有2种, 一是高温混合法, 将2种物质直接混合, 通过加热搅拌获得澄清溶液[10]; 二是冷冻干燥法, 将2种物质的水溶液混合, 通过冷冻干燥获得黏稠澄清的液体[11](图 1b)。
低共熔溶剂的物化特性直接影响其提取效率, DES有以下3种物化特性。
1) 熔点低。通常DES的熔点低于自身组成组分, 且熔点的高低与氢键供受体之间的氢键以及范德华力的大小呈负相关。相关研究表明, 氯化胆碱的熔点在302~305 ℃左右, 硫脲和尿素的熔点分别为176~178 ℃和132.7 ℃, 而氯化胆碱-硫脲(1:1)DES与氯化胆碱-尿素(1:2)DES的熔点都是90 ℃, 远低于氯化胆碱、硫脲和尿素本身的熔点[13]。DES的低熔点特性拓宽了分离过程中的操作温度范围, 有利于介质的传输, 在分离提取中具有更为广泛的应用。
2) 黏度可调节。在室温下, DES具有较高的黏度, 这可能与各组分之间形成的致密氢键网络有关。此外, 组分类别、氢键供受体的摩尔比、水分含量和温度等也影响DES的黏度[14-16]。因此, 可以通过调控上述因素调节DES的黏度, 来满足不同的生物活性物质的提取应用, 如在单滴微萃取(single drop microextraction)中, 较高黏度的DES有助于其在针头顶端形成较大悬浮液滴, 对提取起到积极作用[17]。然而, 在多数情况下, 高黏度特性会限制DES提取效率, 可通过加入适量的水降低DES的黏度、极性等性质, 从而获得最佳提取效率。Zhang等[18]研究了氯化胆碱和1, 4-丁二醇(1:4)DES中水的含量对于目标产物的提取率的影响, 结果发现目标产物的得率随着DES体系中水含量的增加逐渐提高, 但水含量过高会导致DES极性增加从而减弱DES与目标产物间的氢键作用[19], 降低目标产物的得率。
3) 溶解性良好和极性较宽。DES的极性范围较宽, 这主要受温度、组成成分以及氢键供受体的分子结构影响[20], 一般情况下, DES的极性随温度升高而降低。此外, DES还具有良好的溶解性能, 加入水后的极性发生变化, 从而改变其溶解性能。Morrison等[21]研究了多种物质在DES中的溶解度并与在水中溶解度进行对比, 发现这些物质在DES中溶解度很高, 是在水中的18~460 000倍。这可能是因为DES两种组分之间的协同效应增强了对物质的溶解能力, 使得其可溶解各种物质, 如蛋白质、氨基酸、多糖等。
2 低共熔溶剂在海洋活性物质提取中的应用海洋中含有丰富的活性大分子物质(海洋多糖、蛋白及核酸等)和小分子物质(酚类、萜烯类化合物), 由于其独特的性质, 在化妆品、生物医药、食品等领域广泛应用。为增加其工业应用, 创造更多的商业价值, 对其提取工艺的优化显得尤为重要。因此, 下文总结了DES在海洋活性物质提取中的应用。
2.1 DES在海洋多糖提取中应用海洋多糖是指从海洋生物体内得到的多糖[22-23], 可分为海藻多糖、海洋动物多糖、海洋微生物多糖, 在抗氧化[24]、抗肿瘤[25]、抗衰老[26]、提高免疫力[27]等方面发挥重要作用。表 1展示了DES在海洋多糖提取方面的应用。
| 提取物种类 | DES | 提取原料 | 提取条件 | 结构式 |
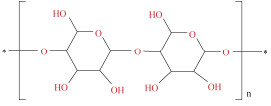
| 纤维素[28] | 咪唑: 甘油(7:3) 咪唑: 氯化胆碱(7:3) 氯化胆碱: 尿素(1:2) 氯化胆碱: 甘油(1:2) 乙酸钠: 尿素(1:2) |
海带渣 | 提取时间24 h 提取温度90 ℃ 固液比1:20 |
|
| 褐藻糖胶[29-30] | 氯化胆碱: 乳酸(1:2) 氯化胆碱: DL-苹果酸(1:1) 氯化胆碱: 柠檬酸(1:1) 氯化胆碱: 1, 4-丁二醇(1:5) 氯化胆碱: 甘油(1:1) 氯化胆碱: 乙二醇(1:2) 氯化胆碱: 尿素(1:2) 氯化胆碱: L-脯氨酸: DL-苹果酸(1:1:1) 氯化胆碱: 丙二醇: 尿素(1:1:1) |
墨角藻 | 含水量32%(v/v) 提取时间35 min 提取温度168 ℃ 固液比39 mg/mL |
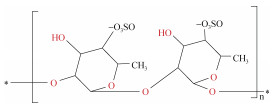
|
| 氯化胆碱: 1, 2-丙二醇 (1:1—1:5) |
铜藻 | 含水量30% (v/v) 固液比1:30 提取温度为70 ℃ 超声辅助30 min |
||
| κ-卡拉胶[31] | 氯化胆碱: 乙二醇(1:2) 氯化胆碱: 尿素(1:2) 氯化胆碱: 甘氨酸(1:2) |
长心卡帕藻 | 含水量10% (v/v) 固液比1:20 提取温度为90 ℃ 提取时间1 h |
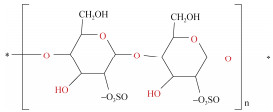
|
| 琼脂糖[32] | 氯化胆碱: 甲酸(1:1) 氯化胆碱: 乙酸(1:1) 氯化胆碱: 己酸(1:1) 氯化胆碱: 辛酸(1:1) 氯化胆碱: 月桂酸(1:1) |
硬江蓠 | 4% DES添加量 提取温度80 ℃ |
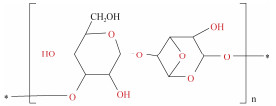
|
| 几丁质[33-35] | 氯化胆碱: 丙二酸(1:2) 氯化胆碱: 尿素(1:1) 氯化胆碱: 甘油(1:2) 氯化胆碱-硫脲(1:1) |
龙虾壳 | 提取温度100 ℃ 不同时间1、2、10 h |
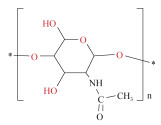
|
| 氯化胆碱: 尿素(1:2) 氯化胆碱: 硫脲(1:2) 溴化胆碱: 尿素(1:2) 氯化胆碱: 甘油(1:2) 氯化胆碱: 乙二醇(1:2) 甜菜碱: 尿素(1:4) |
蟹壳 | 提取温度100 ℃ 超声2 h |
||
| 透明质酸[36] | 乳酸: 果糖(5:1) 乳酸: 尿素(4:1) |
金枪鱼玻璃体 | 提取温度50 ℃ 固液比1:100 提取时间24 h |
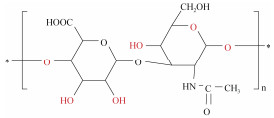
|
| 硫酸软骨素[37] | 薄荷醇: 冰片(1:1) 薄荷醇: 樟脑(1:2) 海藻糖: 甘油(1:1) |
鳕鱼鱼骨 | 提取温度100 ℃ 固液比1:100 提取时间24 h |
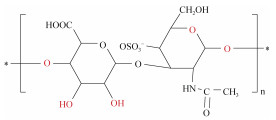
|
纤维素(cellulose)是自然界中分布最广、含量最多的多糖, 纤维素纳米晶(cellulose nanocrystals, CNCs)是利用天然纤维制备的一种纳米级的材料, 被广泛用于增强复合材料的性能。Liu等[28]比较了5种DES结合超声从海带渣中提取制备CNCs的效果, 结果发现咪唑和甘油(7:3)DES具有更好的提取效果, 提取率为91.1%, 纯度为83.6%, 结晶度指数为69.4%, 且基于CNCs的薄膜材料具有更高的机械强度。
褐藻糖胶(fucoidan)是墨角藻、铜藻等褐藻中特有的活性物质, 因其具有抗过敏、抗血栓和抗氧化活性而备受关注[38]。Shang等[29]采用9种DES结合微波辅助从墨角藻(Fucus vesiculosus)中提取褐藻糖胶, 发现氯化胆碱与1, 4-丁二醇(1:5)DES的多糖提取效率达116.33 mg/g, 比常规的冷提取法提高了44.12%, 且所得多糖的抗氧化活性也提高了70.66%。Nie等[30]利用氯化胆碱和1, 2-丙二醇(1:2)DES从铜藻(Sargassum horneri)中提取褐藻糖胶, 提取率达到11.31%, 不仅有效去除了蛋白质和矿物质杂质, 所得多糖的DPPH和ABTS自由基清除能力也分别提高了67.82%和71.28%, 在生产应用中具有重要意义。此外, Li等[39]制备了4种DES用于从海带中提取多糖, 氯化胆碱和尿素(1:2)DES提取褐藻糖胶和海带多糖得率最高, 分别为95.5%和87.6%, 优于微波辅助法的褐藻糖胶提取率(16.08%)和Black方法的海带多糖提取率(86.2%~88.3%)。
卡拉胶(carrageenan)是红藻中重要的商业藻胶, 可分为κ-型(kappa)、ι-型(iota)、λ-型(lambda)等[40], 是食品行业中重要的增稠剂、乳化剂和稳定剂等。Das等[31]使用3种不同的DES从长心卡帕藻(Kappaphycus alvarezii)中提取κ-型卡拉胶, 发现DES法更为简便快捷, 不仅具有更高的得率[(60.25± 1.10)%], 而且所提取的κ-型卡拉胶具有更优的物化性质及流变学性质。DES还可应用于提取红藻中另一种多糖——琼脂糖(agarose)。Sharma等[32]合成了5种DES用于从硬江蓠(Gracilaria firma)中提取琼脂糖, 其中月桂酸和胆碱(1:1)DES的提取的琼脂糖产率最高达14.0%±0.5%, 且质量可与商用的琼脂糖媲美。
2.1.2 海洋动物多糖几丁质(chitin)是自然界中含量仅次于纤维素的第二大多糖, 具有良好的生物相容性与机械性能, 因此在组织工程方面应用广泛[41]。Sharma等[35]首次使用不同的DES超声辅助和加热从蟹壳中提取出几丁质, 结果发现氯化胆碱和硫脲(1:2)DES得率最高(9% w/w)。Zhu等[33]采用氯化胆碱-丙二酸(1:2)DES从龙虾壳中提取几丁质, 其纯度与得率均高于化学法[34], 所得样品分子量可通过提取温度调控[42], 具有优异的物化性质, 在制备薄膜和伤口敷料方面具有良好应用。
透明质酸(hyaluronic acid, HA)是一种酸性粘多糖, 由于其独特的分子结构和理化性质, 在保持组织的水合作用和弹性粘度以及润滑运动部件等方面发挥重要作用[43]。Abdallah等[36]制备了2种DES用于从金枪鱼玻璃体中提取HA。乳酸和果糖(5:1) DES提取效率最高(1.9%)。而且研究发现DES提取的HA不仅不会影响人角膜上皮细胞活力, 还能显著提高细胞内活性氧清除能力和抗菌活性, 降低炎症反应。
硫酸软骨素(chondroitin sulfate, CS)是一种糖胺聚糖家族的多糖, 在医疗、营养保健和骨关节炎的治疗等方面发挥重要作用。Abdallah等[37]以3种DES从鳕鱼鱼骨中提取CS, 发现薄荷醇和冰片(1:2)DES的提取效率最高达37.92 µg/g, 显著高于传统提取方式。
2.2 DES在蛋白质提取中的应用蛋白质是有机体生命活动的物质基础[44]。海洋中含有丰富且独特的蛋白质资源, 如藻红蛋白、胶原蛋白。目前, DES在提取海洋蛋白质方面已取得一定的成果(见表 2)。
| 提取物种类 | DES | 提取原料 | 提取条件 | 结构式 |
| 总蛋白[45] | 甜菜碱: 丙二醇(1:3) 甜菜碱: 甘油(1:2) 甜菜碱: 乙二醇(1:3) |
沙丁鱼加工残渣 | 固液比1:80 提取温度80 ℃ 提取时间18 h |
|
| 1, 2-丙二醇: 氯化胆碱: 水 (1:1:1) |
二形栅藻 | DES提取250 r/min 提取时间24 h 固液比1:100 温度RT US 40 min 频率20 kHz 范围70% |
||
| 辛酸: 十二烷酸(1:1) | 二形栅藻 | DES提取250 r/min 提取时间24 h 固液比1:100 温度RT |
||
| R-藻红蛋白[46] | 氯化胆碱: 尿素(1:1) 氯化胆碱: D-葡萄糖(1:1) 氯化胆碱: 甘油(1:1) 氯化胆碱: D-果糖(1:1) 化胆碱: D-山梨糖醇(1:1) 氯化胆碱: 乙二醇(1:1) |
条斑紫菜 | 固液比1:10 提取时间20 min |
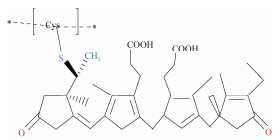
|
| 胶原蛋白[47] | 氯化胆碱: 草酸(1:1) 氯化胆碱: 乙二醇(1:2) 氯化胆碱: 甘油(1:2) 氯化胆碱: 乳酸(1:2) 氯化胆碱: 醋酸(1:2) 氯化胆碱: 尿素(1:2) |
鳕鱼皮 | 固液比1:100 提取温度45 ℃ 提取时间4 h |
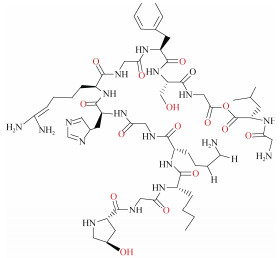
|
鱼类加工下脚料或废弃物是被忽视的具有重要商业价值的原料, 特别是其内含丰富的活性成分[48]。Rodrigues等[45]使用甜菜碱和丙二醇(1:3)DES从沙丁鱼加工残渣中提取了总蛋白, 其产量高达162.2 mg/g, 远高于水提取法(145.7 mg/g), 这可能归因于DES较小的极性, 更有利于总蛋白沉淀, 从而提高了总蛋白的产量。此外, 所得总蛋白的抗氧化性和抗菌活性分别增加了3倍和250倍, 这主要是因为极性小的DES可提取更丰富的疏水氨基酸, 其疏水核的存在对于促进抗菌肽与微生物细胞壁和膜的相互作用至关重要。
Bastiaens等[49]制备了1, 2-丙二醇、氯化胆碱和水(1:1:1)DES并结合超声辅助从二形栅藻(Scenedesmus dimorphus)中提取总蛋白, 其提取率达27%。Giorgia等[50]使用辛酸和十二酸脂肪酸(1:1)DES从相同的微藻中提取总蛋白, 大大提高了总蛋白的提取率。
R-藻红蛋白(R-phycoerythrin, R-PE)是一种海洋生物活性蛋白, 主要存在于红藻门中[51], 具有抗氧化、抗炎、抗衰老和免疫调节等多重生物活性[52], 已广泛应用于食品、化妆品和医学等领域。Xu等[46]制备了氯化胆碱-尿素(1:1)DES用于从条斑紫菜(Porphyra yezoensis)中提取R-PE, 该方法提取R-PE的最终得率为69.99%, 纯度为3.835(A565/A280), 均高于传统方式(得率27%, 纯度2.890), 且DES对R-PE的高级结构具有更好的保护作用。
胶原蛋白(collagen)是体内各种结缔组织的细胞外基质中最丰富的结构蛋白, 在生物材料、化妆品和组织工程等方面应用广泛[53]。Bai等[47]使用6种不同的DES从鳕鱼皮中提取胶原蛋白。结果发现, 氯化胆碱和草酸(1:1)DES对胶原蛋白的提取效率高达90%, 是醋酸提取效率的4倍, 研究者指出, 这可能与游离质子和DES的黏度相关。随着草酸含量的上升, DES中游离质子的量上升, 因而能够更好地与胶原蛋白中的脯氨酸或羟脯氨酸的亚氨残基形成氢键; 同时, 更低的黏度也有助于增加溶质和溶剂之间的传质效果。此外, 胶原蛋白的提取效率也受氢键供受体摩尔比、提取温度、反应时间和溶剂与固体比的影响。
2.3 DES在DNA提取中应用DNA独特的特性, 可设计为新型纳米材料, 在分子传感、智能药物传递、生物分析和生物医学等方面具有广泛应用。海洋中含有丰富的DNA资源, 如鱼类睾丸, Mondal等[54]采用2种DES从鲑鱼睾丸中提取DNA, 其中胆碱和乙醇酸(1:1)DES对DNA的提取率高达8%, 而且提取的DNA在室温下化学和结构稳定性高, 这主要归因于DNA分子与DES之间氢键和静电相互作用。
2.4 DES在生物柴油提取中应用随着全球化石燃料的日益枯竭和对环境的不利影响, 人们迫切需要一种化石燃料的替代品。生物柴油是目前受较多关注的化石燃料替代物, 可通过多种海洋微藻生产, 能够显著减少碳排放[55]。相较于传统方法, DES在提取生物柴油方面具有绿色环保的优势, 其研究进展如表 3所示。
Tommasi等[56]使用氯化胆碱和不同的氢键供体(草酸、乙酰丙酸、尿素、乙二醇和山梨糖醇)制备了不同的DES, 并结合微波辅助用于从三角褐指藻(Phaeodactylum tricornutum)中提取生物柴油。发现氯化胆碱和羧酸DES提取效果最好, 生物柴油的提取率高达80%, 这主要由于羧酸的存在导致溶剂pH值降低, 从而提高了亲脂性溶质对细胞壁的渗透性。
其他研究学者也发现DES可通过破坏微藻细胞壁从而提高生物柴油的提取率。Lu等[57]使用3种水性DES对小球藻预处理, 发现氯化胆碱-草酸(1:2) DES预处理后脂质回收率从52.23%(未处理生物质)提高到80.90%。Pan等[58]也发现了类似的结果, 他们制备了多种DES采用一步法(油提和酯交换同时进行)从小球藻(Chlorella vulgaris)和绿球藻(Cladophora aegagropila)中提取脂肪酸甲酯(生物柴油主要的物质), 结果发现氯化胆碱-乙酸(1:2)DES提取脂肪酸甲酯的提取率提高了30%。因此DES可作为微藻生物质预处理的传统溶剂的替代品, 在微藻的生物柴油生产中增强其提取率。
2.5 DES在酚类化合物提取中应用酚类化合物(phenolic compounds, PCs)广泛存在于植物和微生物中, 如表 4所示, 根据其化学结构, 可分为酚酸、类黄酮和单宁等[59]。PCs具有抗氧化、抗炎、抗菌、心脏保护等多种生物活性, 广泛应用于制药、食品和化妆品等行业。
| 提取物种类 | DES | 提取原料 | 提取条件 | 结构式 |
| 褐藻多酚[60] | 氯化胆碱: 乳酸(1:1-1:3) 葡萄糖: 乳酸: 水(1:5:3) 甜菜碱: 苹果酸: 水(1:1:1) 甜菜碱: 乳酸: 水(1:1:2) 甜菜碱: 苹果酸: 葡萄糖(1:1:1) 氯化胆碱: 苹果酸: 水(1:1:1) 氯化胆碱: 苹果酸: 水(2:1:1) 甜菜碱: 甘油: 葡萄糖(1:5:1) |
褐藻 | 提取温度50 ℃ 固液比1:5 提取时间2 h |
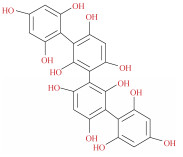
|
| 总酚[61] | 氯化胆碱: 甘油(1:2—1:4) 氯化胆碱: 乙二醇(1:2—1:4) 氯化胆碱: 1, 3-丙二醇(1:2—1:4) 氯化胆碱: 1, 4-丁二醇(1:2—1:4) |
小球藻 | 固液比20:1 提取时间100 min 提取温度60 ℃ |
褐藻多酚(phlorotannin)是一种从褐藻中提取出的PCs, 是由间苯三酚(1, 3, 5-三羟基苯)组成的聚合物, 除表现出抗氧化、抗炎、抗菌和抗肿瘤等特性外, 还具有抑制抗纤溶酶、基质金属蛋白酶等活性。Obluchinskaya等[60]制备了氯化胆碱、乳酸、甜菜碱和葡萄糖等不同摩尔比的10种DES用于从褐藻中提取褐藻多酚, 实现了褐藻多酚最大提取率(72%), 可与传统有机溶剂(乙醇、甲醇、甲醇等)相媲美, 并且可以通过调整DES的黏度改善多酚的提取率。
Mahmood等[61]利用氯化胆碱和多元醇(甘油、乙二醇、1, 3-丙二醇和1, 4-丁二醇)制备了12种DES, 从小球藻内提取PCs。结果发现氯化胆碱和甘氨酸(1:2) DES、氯化胆碱和1, 4-丁二醇(1:3) DES对PCs的提取率是乙酸乙酯和水溶液的2倍。这主要归因于, 一, 与羧酸和酰胺分子相比, 1, 4丁二醇等多元醇含有更丰富的羟基, 可以与PCs形成丰富的氢键。二, 多元醇羟基的位置和亚甲基链的长度影响DES的极性和黏度, 广泛的极性范围影响DES与酚类化合物分子间的相互作用并形成分子间氢键, 增加PCs在DES中的溶解度, 从而使得提取率增加。
2.6 DES在萜烯类化合物提取中应用萜烯类化合物在自然界中广泛分布, 如虾青素、叶黄素等, 由于独特的化学性质, 其具有抗氧化、抗炎和抗肿瘤等多重活性, 在食品、制药和化妆品行业中发挥重要作用。然而, 萜烯类化合物不稳定, 在常规方法提取及使用过程中, 极易丧失生物活性, 因此开发新型的提取方法至关重要[62]。表 5显示了DES在提取海洋萜烯类化合物方面取得的成果。
| 提取物种类 | DES | 提取原料 | 提取条件 | 结构式 |
| 虾青素[63-65] | 薄荷醇: 油酸(2:1) 百里酚: 油酸(3:1) 香叶醇: 油酸(3:1) |
雨生红球藻 | 固液比1:40 提取时间6 h 提取温度60 ℃ |
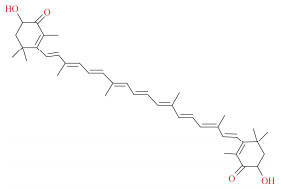
|
| 紫苏醇: 樟脑(1:1) 薄荷醇: 紫苏醇(1:1) 薄荷脑: 樟脑(1:1) 薄荷醇: 桉油精(1:1) 薄荷醇: 肉豆蔻酸(8:1) |
蟹壳残渣 | 转速60 r/min 固液比1:40 提取时间30 min 超声幅度60% |
||
| 氯化胆碱: 甘油(1:2) 氯化胆碱: 草酸(1:2) 氯化胆碱: 乳酸(1:2) 氯化胆碱: 酒石酸(1:2) 氯化胆碱: 苹果酸(1:2) |
虾废料 | 固液比为1:10 超声幅度40% 提取时间45 min |
||
| 叶黄素[16] | 百里酚: 苯甲醇(1:1) | 栅藻 | 固液比1:50 提取温度60 ℃ 提取时间70 min 超声辅助 时间30 min 频率40 kHz, 功率30% |
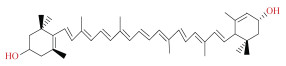
|
虾青素(astaxanthin, ASX)是一种重要的酮类胡萝卜素, 广泛存在于微藻、酵母、虾蟹壳等生物资源中[66]。Pitacco等[64]利用基于油酸和萜烯(百里酚、DL-薄荷醇和香叶醇)的疏水性DES从雨生红球藻中提取ASX, 在没有预处理情况下, ASX的回收率均在60%以上, 明显高于油酸单独萃取的提取率(40%), 这可能是DES导致油酸黏度降低或对ASX的“亲和力”增加导致。值得注意的是, 百里酚和油酸(3:1)DES具有ASX的保护作用, 在光照13.5 h后仍可保存40%的ASX含量, 这归因于百里酚较强的抗氧化活性, 能够保护ASX的稳定性。
Roy等[65]制备了5种DES并超声辅助从虾废料中提取ASX。结果发现氯化胆碱和乳酸(1:2) DES的AXS提取效率可达69.09 mg/g, 远高于Lee等[67]DES提取效率(39.37 mg/g)。这主要是因为超声波破坏了虾粉的氢键结构使得AXS溶于DES中。而且超声影响DES的黏度、表面张力和极性, 从而影响ASX与DES分子的氢键结合能力和相互作用, 进而提高了ASX提取率。进一步将DES提取的ASX用于壳聚糖(CS)的可生物降解薄膜中, 发现使用DES提取的ASX所制备的ASX/CS薄膜比使用传统方式提取的ASX所制备的薄膜具有更好的自由基清除活性、热稳定性和机械性能, 表现出良好的应用前景。
除在藻类中提取ASX外, Rodrigues等[63]使用了基于萜烯的DES从蟹壳中提取ASX, 结果发现薄荷醇和肉豆蔻酸(8:1)DES提取ASX产量最高可达60%, 与索氏提取法相比, 产量增加了657倍, 且使用时间更短(2 h)。而且研究发现使用DES提取的ASX具有抑制结肠直肠癌细胞以及细菌生长的潜力, 可作为功能性成分和天然防腐剂在制药、保健品或化妆品行业中广泛应用。
叶黄素(lutein)是一种类胡萝卜素, 为重要的功能性食品成分, 可预防细胞、器官老化引起的眼部疾病、冠心病及肿瘤疾病等[68]。Fan等[16]制备了6种DES从栅藻中提取叶黄素, 发现百里酚和苯甲醇(1:1)DES从栅藻中回收叶黄素效果最好(6.26± 0.40 mg/g), 远高于乙酸乙酯(3.91±0.21 mg/g)。研究者还指出, DES的用量、组成、提取温度和时间都显著影响叶黄素的提取率, 并且HBA和HBD之间的耦合协同效应提高了DES与叶黄素间氢键相互作用, 从而改善了DES的极性和黏度, 提高了叶黄素的萃取效率。此外DES在回收性能和稳定性方面都比传统的有机溶剂更出色, 是绿色提取和稳定易降解叶黄素的有效替代方案。
3 结语海洋独特的自然环境孕育了独特而多样的生物活性物质, 包括大分子物质如多糖类、蛋白类等和小分子物质如酚类化合物和萜烯类化合物等。基于其多重的生物活性, 使得他们在医药、化妆品、食品等领域得到了广泛的应用。生物活性物质的便捷获取是更好的应用他们的首要条件。低共熔溶剂(DES)作为一种新兴的海洋活性物质提取溶剂, 其既具有廉价易得、易于制备、绿色环保和可生物降解等优点, 还可根据需要人为设计组分及其比例来提高活性物质的提取效率。
本文综述了DES在海洋活性物质包括多糖、蛋白质、DNA、生物柴油、萜烯及酚类化合物的提取方面的应用。首先, DES在提高生物活性物质得率方面发挥了有效作用, 不仅使得物质的提取得率大幅度提升, 对于多糖、蛋白质等一些水不溶性活性物质的提取具有积极的作用, 而且提高了生物活性物质的质量, 如卡拉胶, 可与商用产品媲美; 其次, DES提取在保留及提高活性物质的生物活性方面也具有重要意义, 如增强了透明质酸的抗氧化、抗菌活性, 硫酸软骨素的抗炎活性, 沙丁鱼蛋白的抗氧化、抗菌活性, 稳定了虾青素的抗氧化活性等, 大大提升了活性物质在实际应用中的有效性。最后, DES提取拓宽了生物活性物质的应用, 如DES提取可增强活性物质如纤维素、几丁质基生物材料的机械性能以及壳聚糖/虾青素的热稳定性和机械性能, 大大加强了其在实际应用中的优势。由此可见, DES在生物活性物质特别是海洋生物活性物质提取及应用方面取得了初步的成果, 但依然存在一些不足之处, 认为仍需从以下几个方面进行深入探索, 以更进一步开发DES在海洋生物活性物质提取方面的应用潜能:
1) 定向设计、制备及高效使用DES。一方面针对活性物质的溶解性、结晶度和结构特性等定向的设计DES, 尤其是对一些水溶性差, 有机试剂等传统方式难以实现的活性物质的提取, 依据“相似相溶”等原理将DES应用于更多的生物活性物质的提取。可根据生物活性物质的应用方向和潜在价值, 依据DES形成机制, 制备更加安全、有效、绿色的DES。另一方面, 探究DES高效提取活性物质可能存在的机制, 根据提取机制进一步提高活性物质的提取效率和物质得率。在保证活性物质结构、性质和活性等基础上, 可结合超声和微波辅助等现代工艺进一步提高DES对目标产物的提取效率和物质得率;
2) 提高DES提取活性物质的纯度和质量。在后续的研究中, 我们应构建DES提取的活性物质的质量标准, 更加注重活性物质产物的纯度和质量。应进一步加强活性物质与DES分离的研究, 可以采取如双水相萃取、大孔吸附树脂固液萃取等方式, 进一步提高目的产物的纯度, 满足活性物质的使用质量标准, 确保目的产物实际应用的有效性; 同时应注重DES的回收再利用, 可以通过旋转蒸发、冷凝回流等方式进行DES回收, 确保回收DES的纯度和再使用效率;
3) 拓宽DES提取活性物质的实际应用。一方面将DES提取的活性物质直接应用, 期望其被开发为生物活性药物, 作为抗氧化剂、抗炎药物、抗菌剂等在实际中进行应用; 另一方面, 开发基于DES提取的活性物质的产品, 结合DES本身的优势开发新型的材料, 将其进行功能化转化, 在食品、医药、化妆品等领域进行应用, 实现DES和目的产物的双重应用。
| [1] |
杨超凡, 秦松, 李文军. 海洋生物抗炎活性物质研究进展[J]. 海洋科学, 2020, 44(11): 102-113. YANG Chaofan, QIN Song, LI Wenjun. Advances in anti-inflammatory bioactive substances derived from marine organisms[J]. Marine Sciences, 2020, 44(11): 102-113. |
| [2] |
HUANG H Y, WANG Y C, CHENG Y C, et al. A novel oral astaxanthin nanoemulsion from Haematococcus pluvialis induces apoptosis in lung metastatic melanoma[J]. Oxidative Medicine Cellular Longevity, 2020, 2020: 1-13. |
| [3] |
LIMA S, FREIRE M, OLIVEIRA V, et al. Astaxanthin delivery systems for skin application: A review[J]. Marine Drugs, 2021, 19(9): 511-527. DOI:10.3390/md19090511 |
| [4] |
JAISWAL S. Seaweed polysaccharide in food contact materials (active packaging, intelligent packaging, edible films, and coatings)[J]. Foods, 2021, 10(9): 1-22. |
| [5] |
MCREYNOLDS C, ADRIEN A, CASTEJON N, et al. Green in the deep blue: deep eutectic solvents as versatile systems for the processing of marine biomass[J]. Green Chemistry Letters and Reviews, 2022, 15(2): 382-403. |
| [6] |
VANDA H, DAI Y, WILSON E G, et al. Green solvents from ionic liquids and deep eutectic solvents to natural deep eutectic solvents[J]. Comptes Rendus Chimie, 2018, 21(6): 628-638. DOI:10.1016/j.crci.2018.04.002 |
| [7] |
ABBOTT A P, CAPPER G, DAVIES D L, et al. Novel solvent properties of choline chloride/urea mixtures[J]. Chemical Communications, 2003, 9(1): 70-71. |
| [8] |
REDHA A A. Review on extraction of phenolic compounds from natural sources using green deep eutectic solvents[J]. Journal of Agricultural Food Chemistry, 2021, 69(3): 878-912. DOI:10.1021/acs.jafc.0c06641 |
| [9] |
ZHANG M, ZHANG X, LIU Y, et al. Insights into the relationships between physicochemical properties, solvent performance, and applications of deep eutectic solvents[J]. Environmental Science Pollution Research, 2021, 28: 35537-35563. DOI:10.1007/s11356-021-14485-2 |
| [10] |
POTKA-WASYLKA J, GUARDIA M, ANDRUCH V, et al. Deep eutectic solvents vs ionic liquids: Similarities and differences[J]. Microchemical Journal, 2020, 159(29): 105539-105549. |
| [11] |
GUTIÉRREZ M C, FERRER M L, MATEO C R, et al. Freeze-drying of aqueous solutions of deep eutectic solvents: a suitable approach to deep eutectic suspensions of self-assembled structures[J]. Langmuir, 2009, 25(10): 5509-5515. DOI:10.1021/la900552b |
| [12] |
MAKO P, SUPEK E, GBICKI J. Hydrophobic deep eutectic solvents in microextraction techniques–A review[J]. Microchemical Journal, 2019, 152: 104384. |
| [13] |
CHOURASIA V R, PANDEY A, PANT K K, et al. Improving enzymatic digestibility of sugarcane bagasse from different varieties of sugarcane using deep eutectic solvent pretreatment[J]. Bioresource Technology, 2021, 337(2): 125480. |
| [14] |
ACHKAR T E, FOURMENTIN S, GREIGE-GERGES H. Deep eutectic solvents: An overview on their interactions with water and biochemical compounds[J]. Journal of Molecular Liquids, 2019, 288: 111028. DOI:10.1016/j.molliq.2019.111028 |
| [15] |
FAN C, LIU Y, SEBBAH T, et al. A theoretical study on terpene-based natural deep eutectic solvent: relationship between viscosity and hydrogen-bonding interactions[J]. Glob Chall, 2021, 5(3): 131930-131941. |
| [16] |
FAN C, LIU Y, SHAN Y, et al. A priori design of new natural deep eutectic solvent for lutein recovery from microalgae[J]. Food Chemistry, 2021, 376: 1930-1941. |
| [17] |
CUNHA S C, FERNANDES J. Extraction techniques with deep eutectic solvents[J]. Trac Trends in Analy ti cal Chemistry, 2018, 105: 225-239. DOI:10.1016/j.trac.2018.05.001 |
| [18] |
ZHANG Q, DE OLIVEIRA VIGIER K, ROYER S, et al. Deep eutectic solvents: syntheses, properties and applications[J]. Chemical Society Reviews, 2012, 41(21): 7108-7146. DOI:10.1039/c2cs35178a |
| [19] |
DAI Y, WITKAMP G J, VERPOORTE R, et al. Tailoring properties of natural deep eutectic solvents with water to facilitate their applications[J]. Food Chemistry, 2015, 187: 14-19. DOI:10.1016/j.foodchem.2015.03.123 |
| [20] |
PANDEY A, PANDEY S. Solvatochromic probe behavior within choline chloride-based deep eutectic solvents: effect of temperature and water[J]. Journal Of Physical Chemistry B, 2014, 118(50): 14652-14661. DOI:10.1021/jp510420h |
| [21] |
MORRISON H G, SUN C C, NEERVANNAN S. Characterization of thermal behavior of deep eutectic solvents and their potential as drug solubilization vehicles[J]. International Journal of Pharmaceutics, 2009, 378(1/2): 136-139. |
| [22] |
BORGOGNA M, BELLICH B, CESÀRO A. Marine polysaccharides in microencapsulation and application to aquaculture: "from sea to sea"[J]. Marine Drugs, 2011, 9(12): 2572-2604. DOI:10.3390/md9122572 |
| [23] |
XU S Y, HUANG X. Recent advances in marine algae polysaccharides: isolation, structure, and activities[J]. Marine Drugs, 2017, 15(12): 388-394. DOI:10.3390/md15120388 |
| [24] |
ESSA H L, GUIRGUIS H A. Ultrasonically-extracted marine polysaccharides as potential green antioxidant alternatives[C]. First International Electronic Conference on Applied Sciences, 2020: 23-30.
|
| [25] |
KHALID N, ASGHER M, HUSSAIN F, et al. Exopolysaccharides production from marine Bacillus strains and their antioxidant and bio-flocculant capacities[J]. Archives of Microbiology, 2022, 204(5): 250-256. DOI:10.1007/s00203-022-02851-8 |
| [26] |
PANGESTUTI R, SIAHAAN E A, KIM S K. Photoprotective substances derived from marine algae[J]. Marine Drugs, 2018, 16(11): 399-411. DOI:10.3390/md16110399 |
| [27] |
BAI R G, TUVIKENE R. Potential antiviral properties of industrially important marine algal polysaccharides and their significance in fighting a future viral pandemic[J]. Viruses, 2021, 13(9): 1817-1823. DOI:10.3390/v13091817 |
| [28] |
LIU Z, LI X, WEI X, et al. Extraction, isolation and characterization of nanocrystalline cellulose from industrial kelp (Laminaria japonica) waste[J]. Carbohydrate Polymers, 2017, 173: 353-359. DOI:10.1016/j.carbpol.2017.05.079 |
| [29] |
SHANG X C, CHU D, ZHANG J X, et al. Microwave-assisted extraction, partial purification and biological activity in vitro of polysaccharides from bladder-wrack (Fucus vesiculosus) by using deep eutectic solvents[J]. Separation and Purification Technology, 2021, 259: 118169. DOI:10.1016/j.seppur.2020.118169 |
| [30] |
NIE J G, CHEN D T, LU Y B. Deep eutectic solvents based ultrasonic extraction of polysaccharides from edible brown seaweed Sargassum horneri[J]. Journal of Marine Science and Engineering, 2020, 8(6): 440-449. DOI:10.3390/jmse8060440 |
| [31] |
DAS A K, SHARMA M, MONDAL D, et al. Deep eutectic solvents as efficient solvent system for the extraction of kappa-carrageenan from Kappaphycus alvarezii[J]. Carbohydrate Polymers, 2016, 136: 930-935. DOI:10.1016/j.carbpol.2015.09.114 |
| [32] |
SHARMA M, CHAUDHARY J P, MONDAL D, et al. A green and sustainable approach to utilize bio-ionic liquids for the selective precipitation of high purity agarose from an agarophyte extract[J]. Green Che mistry, 2015, 17(5): 2867-2873. DOI:10.1039/C4GC02498B |
| [33] |
ZHU P, GU Z J, HONG S, et al. One-pot production of chitin with high purity from lobster shells using choline chloride-malonic acid deep eutectic solvent[J]. Car bo hydrate Polymers, 2017, 177: 217-223. DOI:10.1016/j.carbpol.2017.09.001 |
| [34] |
QUIGLEY C. A Comparative analysis of conventional and deep eutectic solvent (DES)-mediated strategies for the extraction of chitin from marine crustacean shells[J]. Molecules, 2021, 26(24): 7603-7628. DOI:10.3390/molecules26247603 |
| [35] |
SHARMA M, MUKESH C, MONDAL D, et al. Dissolution of α-chitin in deep eutectic solvents[J]. RSC Advances, 2013, 3(39): 18149-18155. DOI:10.1039/c3ra43404d |
| [36] |
ABDALLAH M M, LEONARDO I C, KRSTIC L, et al. Potential ophthalmological application of extracts obtained from tuna vitreous humor using lactic acid-based deep eutectic systems[J]. Foods, 2022, 11(3): 342-350. DOI:10.3390/foods11030342 |
| [37] |
ABDALLAH M. Extraction of hyaluronic acid and chondroitin sulfate from marine biomass for their application in the treatment of the dry eye disease[J]. Acta Ophthalmologica, 2019, 97(S263): 35-42. |
| [38] |
SARAVANA P S, CHO Y N, WOO H C, et al. Green and efficient extraction of polysaccharides from brown seaweed by adding deep eutectic solvent in subcritical water hydrolysis[J]. Journal of Cleaner Production, 2018, 198: 1474-1484. DOI:10.1016/j.jclepro.2018.07.151 |
| [39] |
LI G Z, DAI Y L, WANG X Q, et al. Molecularly imprinted polymers modified by deep eutectic solvents and ionic liquids with two templates for the simultaneous solid-phase extraction of fucoidan and laminarin from marine kelp[J]. Analytical Letters, 2018, 52(3): 511-525. |
| [40] |
PIETRAK A. Evaluation of carrageenan, xanthan gum and depolymerized chitosan based coatings for pineapple lily plant production[J]. Horticulturae, 2021, 7(2): 19-27. DOI:10.3390/horticulturae7020019 |
| [41] |
OZEL N, ELIBOL M. A review on the potential uses of deep eutectic solvents in chitin and chitosan related processes[J]. Carbohydrate Polymers, 2021, 262: 117942-117851. DOI:10.1016/j.carbpol.2021.117942 |
| [42] |
HONG S, YUAN Y, ZHANG K T, et al. Efficient hydrolysis of chitin in a deep eutectic solvent synergism for production of chitin nanocrystals[J]. Nanomaterials, 2020, 10(5): 869-881. DOI:10.3390/nano10050869 |
| [43] |
KÖWITSCH A, ZHOU G, GROTH T. Medical application of glycosaminoglycans: a review[J]. Journal of Tissue Engineering and Regenerative Medicine, 2018, 12(1): 23-41. DOI:10.1002/term.2398 |
| [44] |
SIM S Y J, SRV A, CHIANG J H, et al. Plant proteins for future foods: A roadmap[J]. Foods, 2021, 10(8): 1967-1997. DOI:10.3390/foods10081967 |
| [45] |
RODRIGUES L A, LEONARDO I C, GASPAR F B, et al. Unveiling the potential of betaine/polyol-based deep eutectic systems for the recovery of bioactive protein derivative-rich extracts from sardine processing residues[J]. Separation and Purification Technology, 2021, 276: 119267-119277. DOI:10.1016/j.seppur.2021.119267 |
| [46] |
XU Y F, WANG Q F, HOU Y H. Efficient purification of R-phycoerythrin from marine algae (Porphyra yezoensis) based on a deep eutectic solvents aqueous two-phase system[J]. Marine Drugs, 2020, 18(12): 618-631. DOI:10.3390/md18120618 |
| [47] |
BAI C J, WEI Q F, REN X L. Selective extraction of collagen peptides with high purity from cod skins by deep eutectic solvents[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(8): 7220-7227. |
| [48] |
WANG X Q, YU H H, XING R G, et al. Characterization, preparation, and purification of marine bioactive peptides[J]. BioMed Research International, 2017, 2017: 1-16. |
| [49] |
BASTIAENS L. Nutritional profiling and preliminary bioactivity screening of five micro-algae strains cultivated in Northwest Europe[J]. Foods, 2021, 10(7): 1516-1532. DOI:10.3390/foods10071516 |
| [50] |
GIORGIA S, AGNESE C, JESSOP P G, et al. A novel switchable-hydrophilicity, natural deep eutectic solvent (NaDES)-based system for bio-safe biorefinery[J]. RSC Advances, 2018, 8(65): 37092-37097. DOI:10.1039/C8RA08536F |
| [51] |
MUNIER M, MORANÇAIS M, DUMAY J, et al. One-step purification of R-phycoerythrin from the red edible seaweed Grateloupia turuturu[J]. Journal of Chromatography B, 2015, 992: 23-29. DOI:10.1016/j.jchromb.2015.04.012 |
| [52] |
QI H T, LIU Y, QI X, et al. Dietary recombinant phycoerythrin modulates the gut microbiota of H22 tumor-bearing mice[J]. Marine Drugs, 2019, 17(12): 665-681. DOI:10.3390/md17120665 |
| [53] |
JAFARI H, LISTA A, SIEKAPEN M M, et al. Fish collagen: extraction, characterization, and applications for biomaterials engineering[J]. Polymers, 2020, 12(10): 2230-2265. DOI:10.3390/polym12102230 |
| [54] |
MONDAL D, BHATT J, SHARMA M, et al. A facile approach to prepare a dual functionalized DNA based material in a bio-deep eutectic solvent[J]. Chemical Communications, 2014, 50(30): 3989-3992. DOI:10.1039/C4CC00145A |
| [55] |
GUILLERME J B, COUTEAU C, COIFFARD L. Applications for marine resources in cosmetics[J]. Cosmeti cs, 2017, 4(3): 35-39. DOI:10.3390/cosmetics4030035 |
| [56] |
TOMMASI E, CRAVOTTO G, GALLETTI P, et al. Enhanced and selective lipid extraction from the microalga P. tricornutum by dimethyl carbonate and supercritical CO2 using deep eutectic solvents and microwaves as pretreatment[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(9): 8316-8322. |
| [57] |
LU W D, ALAM M A, PAN Y, et al. A new approach of microalgal biomass pretreatment using deep eutectic solvents for enhanced lipid recovery for biodiesel production[J]. Bioresource Technology: Biomass, Bioe ne r gy, Biowastes, Conversion Technologies, Biotransformations, Production Technologies, 2016, 218: 123-128. |
| [58] |
PAN Y, ALAM M A, WANG Z M, et al. One-step production of biodiesel from wet and unbroken microalgae biomass using deep eutectic solvent[J]. Bioresource Technology: Biomass, Bioe ne r gy, Biowastes, Conversion Technologies, Biotransformations, Production Tech no lo gies, 2017, 238: 157-163. |
| [59] |
CORY H, PASSARELLI S, SZETO J, et al. The role of polyphenols in human health and food systems: A mini-review[J]. Frontiers in Nutrition, 2018, 5: 87-101. DOI:10.3389/fnut.2018.00087 |
| [60] |
OBLUCHINSKAYA E D, DAURTSEVA A V, POZHARITSKAYA O N, et al. Natural deep eutectic solvents as alternatives for extracting phlorotannins from brown algae[J]. Pharmaceutical Chemistry Journal, 2019, 53(3): 243-247. DOI:10.1007/s11094-019-01987-0 |
| [61] |
MAHMOOD W M A, LORWIRACHSUTEE A, THEODOROPOULOS C, et al. Polyol-based deep eutectic solvents for extraction of natural polyphenolic antioxidants from Chlorella vulgaris[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(5): 5018-5026. |
| [62] |
CHEN X, YANG H Y, YAN N. Shell biorefinery: Dream or reality?[J]. Chemistry – A European Journal, 2016, 22(38): 13402-13421. DOI:10.1002/chem.201602389 |
| [63] |
RODRIGUES L A, PEREIRA C V, LEONARDO I C, et al. Terpene-based natural deep eutectic systems as efficient solvents to recover astaxanthin from brown crab shell residues[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(5): 2246-2259. |
| [64] |
PITACCO W, SAMORI C, PEZZOLESI L, et al. Extraction of astaxanthin from Haematococcus pluvialis with hydrophobic deep eutectic solvents based on oleic acid[J]. Food Chemistry, 2022, 379: 132156. DOI:10.1016/j.foodchem.2022.132156 |
| [65] |
ROY V C, HO T C, LEE H J, et al. Extraction of astaxanthin using ultrasound-assisted natural deep eutectic solvents from shrimp wastes and its application in bioactive films[J]. Journal of Cleaner Production, 2021, 284: 125417. |
| [66] |
AMBATI R R, PHANG S M, RAVI S, et al. Astaxanthin: Sources, extraction, stability, biological activities and its commercial applications—A review[J]. Marine Drugs, 2014, 12(1): 128-152. DOI:10.3390/md12010128 |
| [67] |
LEE Y R, ROW K H. Comparison of ionic liquids and deep eutectic solvents as additives for the ultrasonic extraction of astaxanthin from marine plants[J]. Journal of Industrial and Engineering Chemistry, 2016, 39: 87-92. DOI:10.1016/j.jiec.2016.05.014 |
| [68] |
OCHOA M, MOJICA L, HSIEH M, et al. Lutein as a functional food ingredient: Stability and bioavailability[J]. Journal of Functional Foods, 2020, 66: 103771. DOI:10.1016/j.jff.2019.103771 |
 2022, Vol. 46
2022, Vol. 46