文章信息
- 任庆敏, 林燕妮, 王寅初, 秦松. 2022.
- REN Qing-min, LIN Yan-ni, WANG Yin-chu, QIN Song. 2022.
- 不同铁浓度对一种颗石藻Emiliania huxleyi的生长及光合作用的影响
- Effects of different iron concentrations on the growth and photosynthesis of Emiliania huxleyi
- 海洋科学, 46(12): 50-62
- Marine Sciences, 46(12): 50-62.
- http://dx.doi.org/10.11759/hykx20201109002
-
文章历史
- 收稿日期:2020-11-09
- 修回日期:2020-12-18
2. 中国科学院大学, 北京 100049;
3. 国家基础学科公共科学数据中心, 北京 100190;
4. 烟台大学, 山东 烟台 264005;
5. 中国科学院海洋大科学研究中心, 山东 青岛 266071
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. National Basic Science Data Center, Beijing 100190, China;
4. Yantai University, Yantai 264005, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
颗石藻是一种单细胞的光合自养钙化微藻, 属于定鞭藻, 是海洋初级生产力的重要组成部分[1]。当今世界海洋中碳酸钙的年产量约为50亿吨, 从中生代开始, 颗石藻一直是世界海洋中主要的碳酸钙生产者, 如今约占海洋碳酸钙总产量的三分之一[2-3]。光照、温度、pH、盐度以及氮、磷营养盐和铁等环境因子是影响颗石藻的种类、密度和分布的主要原因[4]。铁是海洋生态体系中有机体所必需的微量元素, 其对于藻类的新陈代谢、光合作用和呼吸过程中电子的转移、硝酸盐的还原、叶绿素的合成以及活性氧自由基的解毒来说都是必需的元素[5]。在寡营养大洋中, 铁的可用性限制了浮游生物的生长, 从而大大降低了生物碳泵的效率。
国内外在铁对浮游植物光合作用及其他生理生化特征的影响方面已经进行了较多的研究, 但多数实验都围绕蓝藻和硅藻, 对于颗石藻的研究很少。铁限制条件下, 硅藻的细胞体积会减小[6]或增大[7]。缺铁会部分阻断光系统II(PSII)和光系统I(PSI)之间的电子传递, 这是电子供体细胞色素c6浓度较低所致。这种受阻的电子传递可能导致质体醌池的过度减少, 引起PSII和PSI复合物的光化学效率显著降低[8]。铁限制导致细胞叶绿素浓度降低[9-10], 色素结合蛋白含量降低[11], 但体内叶绿素特异性光吸收截面增加[12]。
研究发现很多藻类在铁限制的条件下长期进化而存在一些适应机制。比如硅藻拥有一系列应对铁限制的策略, 使它们能够在低铁条件下存活, 并响应间歇性铁输入而迅速产生水华[13-14]。这些机制包括通过减少富含铁的光合蛋白复合物的丰度来减少代谢铁需求[15]; 用无铁蛋白替代含铁蛋白[9, 16]; 利用高亲和力铁摄取系统; 使用铁储存机制实现奢侈的铁摄取量(即超过实现最大增长率所需的量); 最高的σPSII值和更大的细胞体积[17]等等。
颗石藻相比于硅藻, 似乎具有更少的铁需求量, 但是铁对于赫胥黎艾氏藻Emiliania huxleyi的DNA修复、ROS管理以及维持光合作用的最佳状态是必不可少的, 间接影响碳循环和未来的生态系统功能。E. huxleyi以时间和浓度依赖的方式摄取Fe(III)形式的铁[18], 且其生长所需的铁含量很低, 在含5.4 nmol/L铁的培养基中即可维持较好的生长速率[19]。铁限制条件下活性CO2和HCO3–的摄取率显著降低, 导致生长速率显著降低[20]。与铁限制条件相比, 在高铁条件下, 色素和光合参数增加, 活性氧(ROS)的积累减少, 由过量辐照度引起的DNA损伤最小化[21]。
秘鲁海流系统具有全年持续的沿海上升流, 是最具生产力的海洋生态系统之一, 秘鲁近海的缺氧和静海水中, 沉积物来源的还原铁[Fe(Ⅱ)]构成了溶解铁的主要组成, 浓度高达200 nmol/L[22]。然而, 高营养的秘鲁洋流系统中的浮游植物却可能受到缺铁的限制[23-24], 而且上升流的酸性环境可能加深了铁限制的影响[25]。近岸上升流区域中的颗石藻在整个适应过程中可能同时经历了铁限制与富铁环境, 其对铁的适应范围及对其光合作用的影响需要进一步探索。本文选取了秘鲁近岸分离的E. huxleyi RCC6660和RCC6666为研究对象, 它们属于不同的基因型且有着不同的钙化能力。通过比较不同铁浓度对它们的生长及光合作用的影响, 探究不同E. huxleyi藻株的差异响应表现及低铁适应机制, 进一步揭示钙化外壳在低铁条件下可能对细胞的光保护作用。
1 材料与方法 1.1 实验材料 1.1.1 藻种本实验所用的颗石藻为赫胥黎艾氏藻Emiliania huxleyi RCC6660和RCC6666, 由法国Roscoff藻种中心(
本实验所用培养基是为研究微量金属元素对藻类生理影响而设计的Aquil培养基, 培养基的配制及处理方法参照Price等[26]。其中人工海水及营养盐(NaH2PO4·H2O、NaNO3和Na2SiO3·9H2O)分别使用Chelex 100(Bio-Rad, US)阳离子交换树脂除去溶剂和试剂中引入的铁污染。维生素及用100 μmol/L EDTA螯合的微量金属元素母液使用酸洗的针头过滤器过滤除菌。铁使用EDTA螯合后添加, 培养基的铁浓度分别设置为0、50、100、500、1 000 nmol/L。
实验中所用的水为超纯水(Milliphore, > 18 MΩ·cm–1), 所有容器都经过酸洗, 然后用Q-H2O重复洗涤五次以上[27]。为防止高温灭菌引入的铁污染, 培养基使用0.22 μm孔径的一次性无菌过滤器过滤除菌, 弃掉前200 mL滤液。
1.1.3 培养条件培养基在使用之前, 将盐度调整为35, 通过添加NaHCO3将溶解无机碳(DIC)调整为2 000 μmol·kg–1。藻株使用密闭盖的175 cm2聚碳酸酯细胞培养瓶进行培养, 光照条件为100 μmol photons·m–2·s–1(14L︰10D), 温度为20 ℃。将封闭的培养物每天摇动3次并随机交换位置以确保细胞受光均匀。在正式实验之前, 细胞在对应的铁浓度下进行两次适应性驯化, 即让细胞从103 cells/mL增殖至5×104 cells/mL(不大于105 cells/mL), 以适应实验条件。在正式实验时, 以103 cells/mL的浓度接种, 当细胞浓度到达5× 104 cells/mL(不大于105 cells/mL)时测量光合生理并收样测定其他参数。
1.2 实验方法 1.2.1 细胞生长率与粒径、体积每天固定时间使用0.1 mL浮游生物计数框对细胞计数来确定细胞密度。比率生长速率(μ)如下测定: μ=(lnC2–lnC1)/(T2–T1), 其中C2和C1分别代表T2和T1的细胞浓度。实验结束后取样, 使用流式细胞摄像系统FlowCAM(fluid imaging technologie, US)测量细胞粒径及体积。
1.2.2 细胞色素在GF/F滤膜(Millipore, US)上过滤100 mL培养物, 将膜折叠后放入离心管中, 加入4 mL 100%甲醇并置于4 ℃冰箱中提取过夜, 然后在4 ℃下离心10分钟(6 700 r/min)。使用扫描分光光度计扫描上清液在200~800 nm的吸收[28]。使用下列公式计算叶绿素a(a)[29]、叶绿素c(c)[30]和类胡萝卜素(r)[31]的浓度(μg·mL–1):
| $ a=16.29×(A_{665}–A_{750})–8.54×(A_{652}–A_{750}). $ | (1) |
| $ c=28.8191×(A_{632}–A_{750})–6.0138×(A_{665}–A_{750}). $ | (2) |
| $ r=7.6×(A_{480}–A_{750})–1.49×(A_{510}–A_{750}). $ | (3) |
用玻璃纤维过滤器(Whatman GF/F)过滤所得的滤液进行DIC和营养盐测定。DIC使用总有机碳分析仪(Shimadzu TOC-VCPH)测量; 使用连续流动分析仪(Seal-Branlubbe AA3, Seal Germany)测量硝酸盐和磷酸盐的浓度。
1.2.4 颗粒有机碳(POC)及颗粒有机氮(PON)含量测定颗石藻细胞使用预燃烧(450 ℃, 12 h以上)的玻璃纤维滤膜通过抽滤收集, 每组收集100 mL。测量前添加230 μL的0.1 mol/L盐酸以除去膜上的无机碳, 用以测量POC和PON。滤膜在60 ℃烘箱中烘干2 h之后, 使用锡纸包裹并在元素分析仪中进行测定。将细胞的PON和POC含量乘以生长速率(μ), 以计算PON生产速率(PPIN)和POC生产速率(PPOC)。
1.2.5 叶绿素荧光藻细胞暗适应15 min之后, 使用叶绿素荧光仪(AquaPen-C, 捷克PSI)测量叶绿素荧光参数, 包括最大光化学效率(Fv/Fm)、有效光化学效率(YPSII)和非光化学淬灭(NPQ)。
快速光响应曲线设置6个光强梯度(10, 20, 50, 100, 300, 500 μmol photons·m–2·s–1), 每个光强60 s, 相对电子传递速率(rETR)的计算公式如下[32]:
| $ E=Y_\text{PSII}×p×0.5, $ | (4) |
式中, p指代提供光化学光的光合有效辐射(PAR), E为rETR。将rETR—PAR数据导入到SigmaPlot (v13.0)后, 使用双指数衰减(double exponential decay)方程进行回归拟合[33-34], 并得到各项特征参数, 包括最大相对电子传递速率(rETRmax)、饱和光强和表观光能利用率。
1.3 数据处理采用IBM SPSS Statistics 26.0数据统计软件进行数据, 不同铁浓度处理间的差异用方差分析、多重比较, 两个藻种之间的差异用t-检验分析, 以P < 0.05作为显著性差异。
2 结果与分析 2.1 两株颗石藻的进化分析按照Bendif根据核糖体系统发育定义的三个分支[35], 将RCC6660与RCC6666与其他藻株一起进行系统发育分析(图 1)。结果表明, RCC6660属于α支, 而RCC6666属于β支(图 1)。因此本文中, 为了行文简洁, 赫胥黎艾氏藻Emiliania huxleyi RCC6660与RCC6666分别简称为α株与β株。
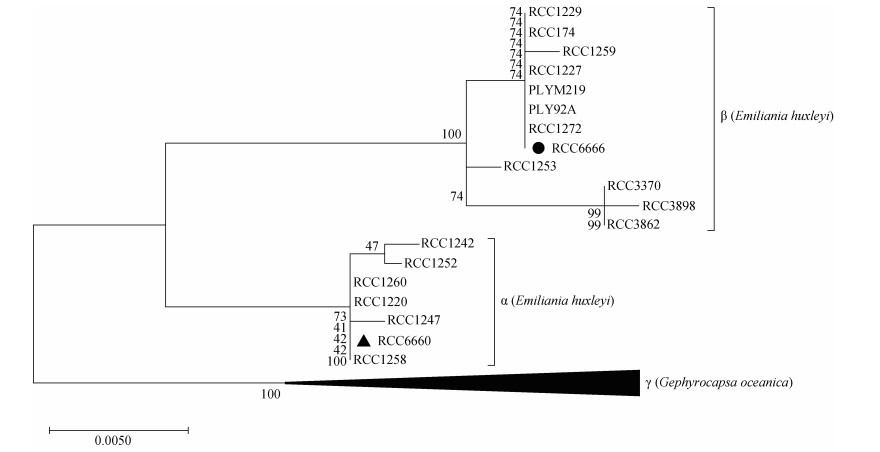 |
| 图 1 基于极大似然法利用线粒体cox3基因序列的艾氏藻系统发育树66606666 Fig. 1 Maximum likelihood phylogeny of the coccolithophores using the mitochondrial cox3 gene sequences 66606666 注: 进化枝显示 100 次重复的自展值支持。藻株 RCC6660 和 RCC6666 在赫胥黎艾氏藻两个基因型分支(α 和 β)中的位置分别用黑色三 角和黑色圆标记。外群(即 γ 枝)由大洋桥石藻(Gephyrocapsa oceanica)RCC1281、RCC1316、RCC1307、RCC1839、RCC1320、RCC1319、RCC1318、RCC1317、RCC1306、RCC1305、RCC1300、RCC1286、RCC1284、RCC1282、RCC1562、RCC1292 组成 |
如图 2所示, α株的比生长率随着培养基中铁浓度的增加表现出递增的趋势, 所以其在铁浓度为1 000 nmol/L时比生长率大于其他组(P > 0.05), 而对于β株, 50 nmol/L才是其最适铁浓度(P > 0.05)。铁浓度为0 nmol/L时, α株的比生长率显著高于β株(P < 0.05), 而在铁浓度为50 nmol/L时, α株的比生长率显著低于β株(P < 0.05)。
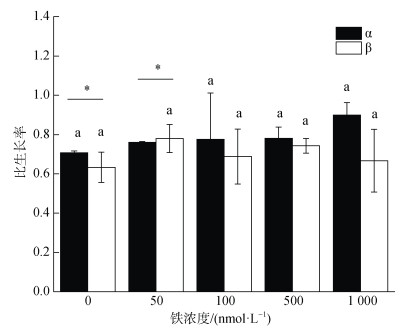 |
| 图 2 五种实验铁浓度对RCC6660(α)和RCC6666(β)的比生长率的影响 Fig. 2 Effects of five experimental iron concentrations on specific growth rates of RCC6660 (α) and RCC6666 (β) 注: 数值为平均值±标准差, n=3。不同字母表示单一藻株不同铁 浓度之间具有显著性差异(P<0.05), 柱状图上的横线表示两个藻 株之间有显著性差异(P<0.05) |
如图 3所示, 两藻株的细胞最小粒径在铁浓度较低时较小, 而在铁浓度大于500 nmol/L时趋于稳定。在铁浓度为0 nmol/L时细胞的细胞粒径最大(P > 0.05), 高铁浓度(> 100 nmol/L)反而抑制了细胞的最大粒径, 使其表现为减小的趋势。在不同铁浓度培养中, α株的最小粒径均小于β株, 且在0 nmol/L和100 nmol/L时具有显著性(P < 0.05), 而α株的最大粒径均大于β株(P > 0.05)。两藻株在铁浓度为100 nmol/L时, 细胞平均粒径和平均体积最大(P > 0.05)。且在各个铁浓度中, α株的平均体积都更大(P > 0.05)。
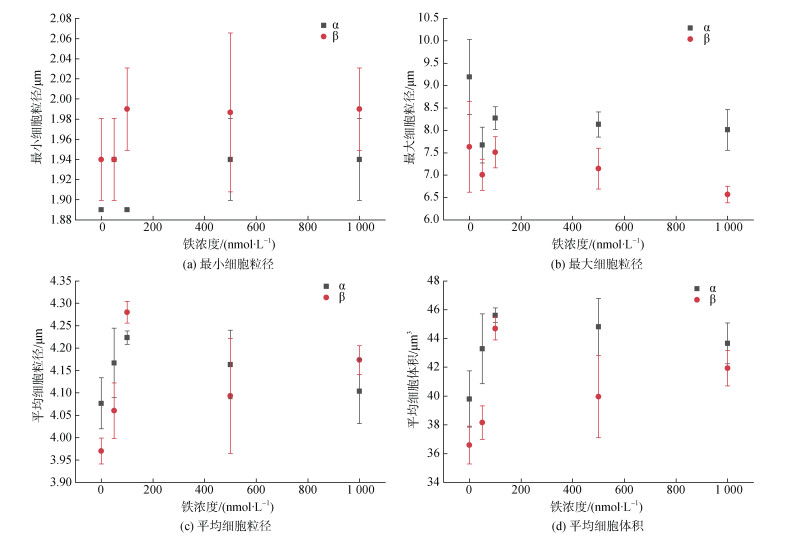 |
| 图 3 五种实验铁浓度对RCC6660(α)和RCC6666(β)的细胞粒径和细胞体积的影响 Fig. 3 Effects of five experimental iron concentrations on cell particle size and cell volume of RCC6660 (α) and RCC6666 (β) 注: 数值为平均值±标准差, n=3 |
不同铁浓度对颗石藻叶绿素a的含量的影响不大, 各个实验组之间不具有显著性差异(见图 4a)。两者比较, 在较低铁浓度(0、50、100、500 nmol/L)下, α株细胞中的含量更高, 而β株在1 000 nmol/L时的叶绿素a含量更高。
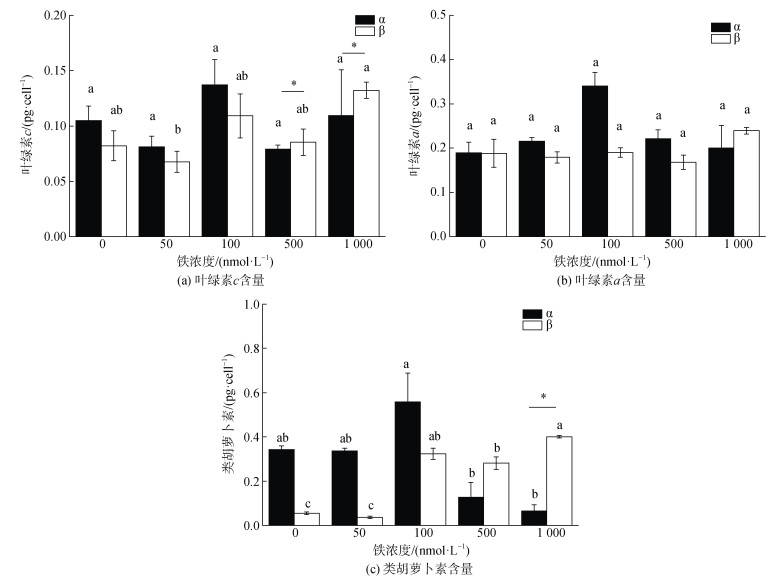 |
| 图 4 五种实验铁浓度对RCC6660(α)和RCC6666(β)中的叶绿素a、叶绿素c及类胡萝卜素的影响 Fig. 4 Effects of five experimental iron concentrations on chlorophyll a, chlorophyll c, and carotenoids of RCC6660 (α) and RCC6666 (β) 注: 数值为平均值±标准差, n=3。不同字母表示单一藻株不同铁浓度之间具有显著性差异(P<0.05), 柱状图上的横线表示两个藻株之间 有显著性差异(P<0.05) |
如图 4b所示, 在0、50和100 nmol/L时, α株的叶绿素c含量高于β株, 而在500和1 000 nmol/L时, α株的叶绿素c含量显著低于β株(P < 0.05)。且β株在1 000 nmol/L时的叶绿素c含量显著高于50 nmol/L (P < 0.05)。
2.4.3 不同铁浓度对类胡萝卜素的影响如图 4c所示, 在0、50和100 nmol/L时, α株的类胡萝卜素含量高于β株, 而在500和1 000 nmol/L时, α株的类胡萝卜素含量低于β株, 与叶绿素c含量变化一致, 且在1 000 nmol/L时存在显著性差异(P < 0.05)。α株在100 nmol/L铁浓度时的类胡萝卜素含量显著高于500 nmol/L和1 000 nmol/L(P < 0.05)。β株在0和50 nmol/L时的类胡萝卜素含量显著低于其他浓度的含量(P < 0.05)。
2.5 对颗石藻氮磷消耗的影响如表 1所示, 培养基中铁浓度为50 nmol/L时, 培养结束后培养基中剩余的磷含量最高, 之后随着铁浓度的增加磷消耗加剧(P > 0.05)。但是在铁浓度0 nmol/L的培养基中培养的细胞竟然消耗了比高浓度铁环境中更多的磷。α株比β株在同样的条件下消耗的磷多。根据氮盐的剩余浓度可知, 硝酸盐的消耗呈现先增后减再增的状态。
| 藻株 | 铁浓度/(nmol·L–1) | ||||
| RCC6660 | 0 | 56.50±11.94 | 15.90±3.31 | 0.21±0.16 | 50.72±19.34 |
| 50 | 76.81±21.47 | 23.73±24.53 | 0.18±0.14 | 46.33±12.91 | |
| 100 | 69.62±10.25 | 5.41±0.28 | 0.42±0.13 | 50.58±4.31 | |
| 500 | 68.43±26.60 | 6.36±0.76 | 0.14±0.12 | 39.67±21.75 | |
| 1 000 | 62.28±11.97 | 10.56±2.82 | 0.34±0.35 | 34.25±9.22 | |
| RCC6666 | 0 | 90.50±8.76 | 29.75±17.41 | 0.29±0.09 | 64.63±31.65 |
| 50 | 104.01±10.19 | 10.76±7.02 | 0.39±0.21 | 55.92±19.72 | |
| 100 | 100.16±16.32 | 11.51±7.28 | 0.02±0.03 | 59.01±14.19 | |
| 500 | 92.15±8.63 | 13.00±9.97 | 0.58±0.16 | 53.71±6.27 | |
| 1 000 | 85.54±3.91 | 11.10±1.67 | 2.54±3.93 | 51.35±14.80 | |
| 注: 数据为实验结束后培养基中的氮(稀释50倍)与磷(稀释2倍)含量, 起始值相同。表中数据为三次重复的平均值±标准差, n=3 | |||||
不同铁浓度条件下培养的α株藻细胞PSII活性没有显著性差异, 但是β株在铁浓度为100 nmol/L时的活性显著低于500 nmol/L时(P < 0.05)。而且在铁限制条件(0 nmol/L)下, α株的Fv/Fm显著低于β株(P < 0.05)(图 5a)。
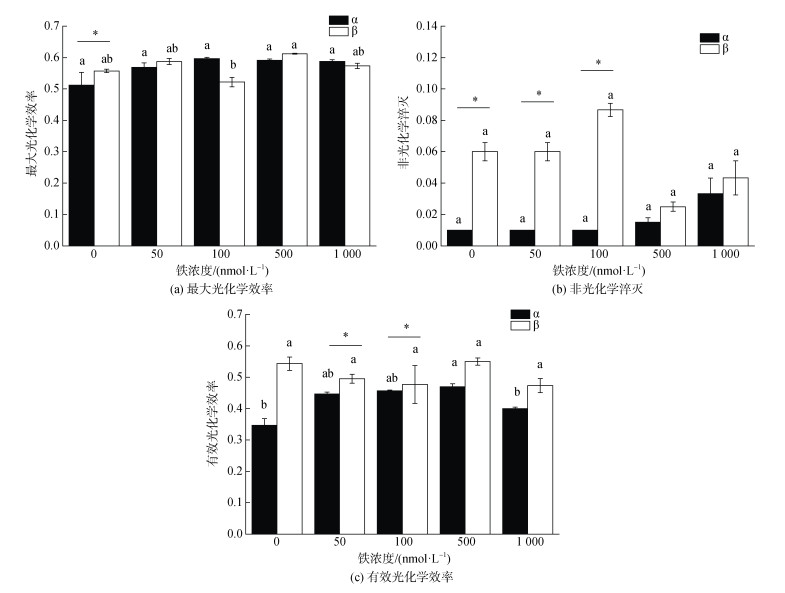 |
| 图 5 五种实验铁浓度对RCC6660(α)和RCC6666(β)的最大光化学效率、有效光化学效率和非光化学淬灭的影响 Fig. 5 Effects of five experimental iron concentrations on Fv/Fm, NPQ, and QY of RCC6660 (α) and RCC6666 (β) 注: 数值为平均值±标准差, n=3。不同字母表示单一藻株不同铁浓度之间具有显著性差异(P<0.05), 柱状图上的横线表示两个藻株之间 有显著性差异(P<0.05) |
从图 5b可以看出, 在五种实验铁浓度下, β株的NPQ都大于α株, 且在铁浓度较低的培养条件(0、50和100 nmol/L)下, β株的NPQ显著大于α株(P < 0.05)且呈较高水平。α株的NPQ随铁浓度增加表现为递增趋势。
如图 5c所示, 两个藻株相比, β株在实验铁浓度下的PSII有效光化学效率更大, 且在50和100 nmol/L时是显著的(P < 0.05)。β株在500 nmol/L时的有效光化学效率显著高于在0 nmol/L和1 000 nmol/L的条件下的(P < 0.05)。
从图 6可以看出, 在5种实验铁浓度下, β株的表观光合效率均高于α株, 且最大电子传递速率在较高铁浓度(100、500和1 000 nmol/L)时也较高, 但是低浓度时反之。两者表观光合效率和最大电子传递速率均无显著性差异。总体来讲, 铁浓度高时, 表观光合效率和最大电子传递速率也呈较高的水平。
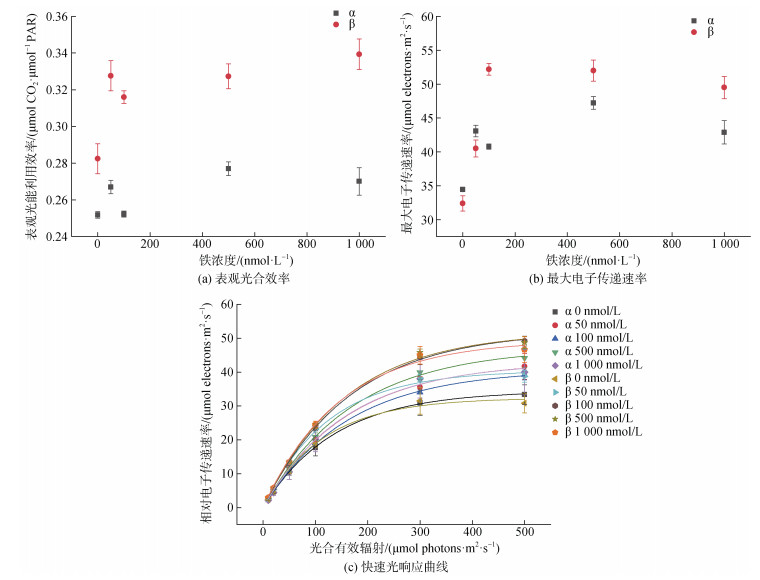 |
| 图 6 五种实验铁浓度对RCC6660(α)和RCC6666(β)的表观光合效率、最大电子传递速率的影响及快速光响应曲线 Fig. 6 Effects of five experimental iron concentrations on apparent photosynthetic efficiency, rETRmax, and the rapid light curve of RCC6660 (α) and RCC6666 (β) 注: 数值为平均值±标准差, n=3 |
如图 7所示, α株的PON含量以及POC与PON的生产率在五种实验铁浓度下均大于β株, 且在500 nmol/L时POC、PON含量和产率达到最大值。在五种实验铁浓度下, β株的POC、PON含量和产率都呈现先减后增再减的趋势。两株藻的POC/PON值也表现出这个趋势且在50 nmol/L和500 nmol/L时具有显著性差异(P < 0.05)。
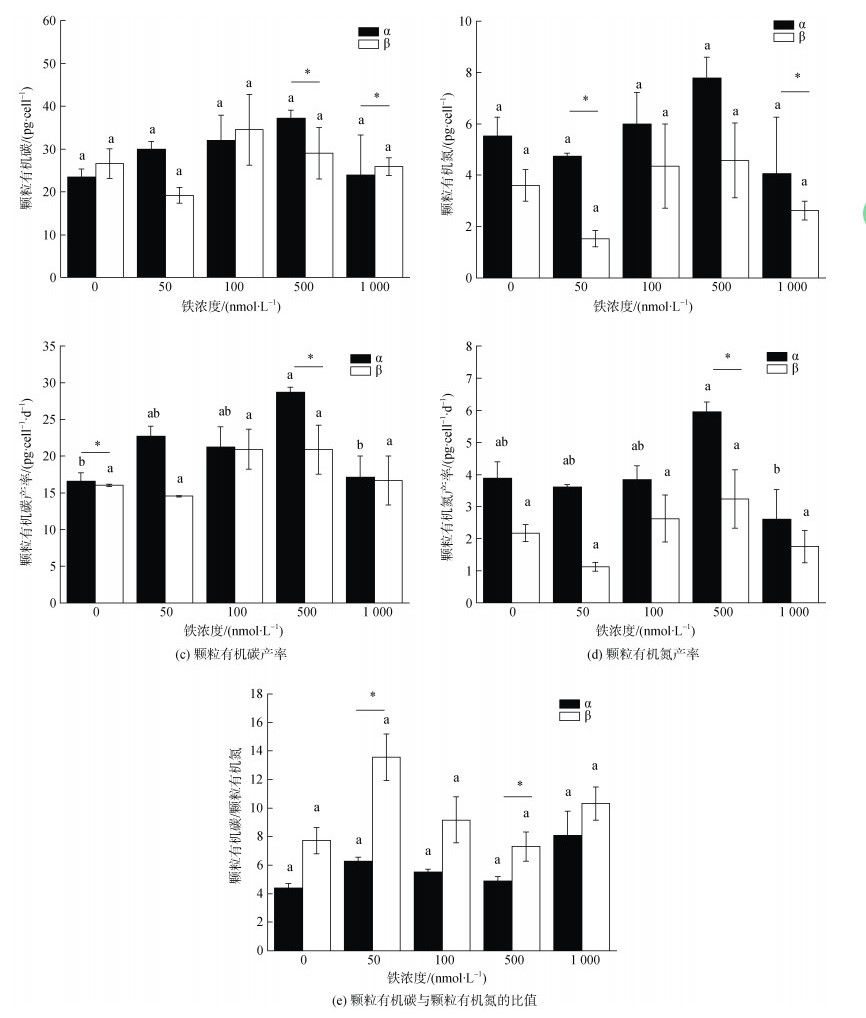 |
| 图 7 五种实验铁浓度对RCC6660(α)和RCC6666(β)的颗粒有机碳与颗粒有机氮含量及产率、两者比值的影响 Fig. 7 Effects of five experimental iron concentrations on specific growth rates of RCC6660 (α) and RCC6666 (β) 注: 数值为平均值±标准差, n=3。不同字母表示单一藻株不同铁浓度之间具有显著性差异(P<0.05), 柱状图上的横线表示两个藻株之间 有显著性差异(P<0.05) |
南美洲秘鲁沿岸的近海洋流所经海域是一个广阔的、高硝酸盐的但铁有限的叶绿素区域, 该地区底层水中有极高浓度的溶解铁(> 50 nmol/L), 在秘鲁南海岸沿岸上升流水域和秘鲁洋流近岸海域中, 溶解铁浓度很低(< 0.1 nmol/L)[36]。颗石藻可能在这片水域逐渐适应, 因而在广范围的铁浓度下的生长率都趋于稳定。在铁浓度较低(0、50、100 nmol/L)时, 两藻株的细胞粒径和体积随着铁浓度的降低而减小, 细胞的比表面积增大, 进而促进了细胞对铁的吸收。此外, 细胞体积小对于生活在低铁环境中的细胞特别有利, 因为它降低了细胞对于铁、氮和光合产物的需求[37], 而且降低了下沉率。总体来看, 在所有铁浓度下, β株的细胞粒径和体积低于α株, 这暗示它可能对铁有更高的要求, 或者对铁浓度的变化反应更敏感。后者也可以从其在色素和颗粒有机物等参数随铁浓度的增加呈现“波浪式”变化的表现可以看出。
3.2 氮磷营养的消耗细胞减少铁需求的另一种方法是使用还原态的氮代替氧化态的氮, 因为硝酸盐的还原需要含铁酶, 如硝酸盐和亚硝酸盐还原酶[14, 38]。本实验中采用硝酸盐作为氮源, 所以铁需求量可能会相对增大[39]。随着铁浓度变化, 两株藻对于氮磷的消耗趋势一致。在0 nmol/L的铁限制环境中, 细胞对于硝酸盐的消耗比1 000 nmol/L的富铁条件下低, 但却消耗了与富铁条件下差不多的磷。在五种实验铁浓度下, α株都比β株消耗的氮磷要多。这表明, α株比β株对氮磷的需求更多, 铁限制条件会降低细胞对于硝酸盐的利用但是不影响磷的利用。铁限制条件下, 细胞可能是部分氮胁迫的。
50 nmol/L下两株藻细胞对硝酸盐的吸收表现出了一个小的峰值, 而对磷的需求却达到了最小值, 此时消耗的N︰P较大。β株在50 nmol/L铁浓度下细胞的PON值显著降低, 表明细胞不能维持其最佳的氮配额。而且尽管C︰N比增加了, POC含量也减少了, 这与之前在硝酸盐中生长的细胞在铁胁迫下表现得一致[37, 40]。然而α株不具备此特征, 其在铁浓度为500 nmol/L时细胞含有较高的POC及PON含量但是C︰N仍显著小于β株。铁会促进碳和氮同化成叶绿素和储能化合物等成分[9, 38, 41], 其机制尚不清楚, 净结果是促进了有机质的积累。
3.3 色素与光保护受铁限制的硅藻降低了叶绿素含量、光合效率[42-43], 所有这些都导致了生长速度的降低。然而判断铁限制的重要指标Fv/Fm[44]以及比生长率[9, 45-46]都没有显著的变化, 或许可以说明颗石藻对铁的极低需求度[19]。两个藻株在不同铁浓度下的细胞色素含量呈现一定的规律。α株在铁浓度为100 nmol/L时叶绿素a、叶绿素c和类胡萝卜素的总含量是最多的, 而β株在铁浓度为1 000 nmol/L时总含量是最多的。这也在一定程度上证明了两株藻铁需求的不同。
细胞中光合色素含量下降似乎是铁胁迫下的普遍行为[44, 47-49], 但在我们的实验中, 叶绿素含量并没有显著降低。色素浓度的这种相对不敏感是铁限制的谜团之一, 尤其是在大量营养素水平较高时[45-46]。但是类胡萝卜素含量变化很大。β株在铁限制条件下类胡萝卜素含量显著降低, 然而α株正好相反, 在富铁环境中细胞的类胡萝卜素含量较低。为什么会产生这样的差异?
铁限制条件下, 真核藻类主要通过叶黄素循环相关的NPQ来耗散叶绿素吸收的过多的过剩光能, 在高光低铁条件下, 非光化学淬灭对光系统的保护作用更加明显且重要[10, 47-49]。类胡萝卜素能通过叶黄素循环调节天线的能量传递, 还在防御光合结构的光氧化破坏和捕光复合体的装配方面发挥重要作用。铁限制条件下, β株的NPQ要显著大于α株。这可能是由于α株是一种高度钙化的细胞[50], 颗石粒组成的外骨骼可以抵挡一部分的紫外光[51], 在铁限制条件下, 高含量的类胡萝卜素及厚的碳酸钙外壳都为细胞在高强度PAR/UVR下提供了多重保护。而β株可能更多地选择增强NPQ的能力以增加热耗散。而这种NPQ可能不是来自叶黄素, 而是捕光天线复合体在PSI与PSII之间的移动或PSII反应中心的淬灭[52]。β株在低铁时趋于生产更少量的类胡萝卜素, 这似乎也是一种光保护手段, 因为捕光色素的增加抑制PSII的修复速率, 加剧光抑制[53]。
3.4 光合电子传递类囊体是铁主要存在的部位, 类囊体电子传递的几乎每一个方面都依赖于铁。铁由于其高还原-氧化电位而在许多金属蛋白中作为电子载体[39]。在浮游植物中, 高比例的铁包含在光合作用装置和线粒体电子传递链的组件中[54-55]。铁限制导致最大电子传递速率和表观光能利用效率都随铁浓度的降低而降低[56-57]。本文的结果也表现出了这个趋势, 但是铁浓度为1 000 nmol/L时颗石藻最大电子传递速率下降, 可能是此浓度超过了光合作用的最适浓度甚至有抑制作用。铁胁迫下细胞捕获和利用光能的能力较弱, 因此缺铁的细胞可能比富铁的细胞更容易受到光化学损伤[5], 这与本实验中光饱和参数也在低铁时降低一致, 细胞在0 nmol/L下耐受强光的能力较弱。
β株在任何铁浓度时都保持更高的光能的利用效率, 这可能也与其钙化作用弱于α株相关, 毕竟钙化是个耗能过程[58]。在铁限制条件(0 nmol/L, 50 nmol/L)下, α株的最大相对电子传递速率rETRmax更大, 拥有较高的光合潜力, 当高铁浓度时β株才占据优势。这可能是由于其低铁时更高的叶绿素含量, α株可能通过过度生产光合作用天线, 增加光子聚焦来克服短期的电子传输效率低下, 从而弥补对效率较低的无铁蛋白质的持续依赖。
4 结论海洋浮游生物的铁供应变化会通过改变碳固存率对大气中二氧化碳的浓度产生重大影响[59], 而颗石藻作为主要的钙化浮游生物, 了解铁限制对其的影响是很重要的。本研究通过比较不同铁浓度对两株不同钙化程度且不同基因型的颗石藻生长及光合作用的影响, 证明了颗石藻通过降低细胞粒径等策略来适应缺铁条件。同时缺铁影响了色素合成及电子传递, 颗石藻为了应对铁限制产生了一系列光保护机制。因为两株藻钙化程度的差异造成了铁限制条件下的差异响应, 因此在之后的研究中, 需要进一步证实是不是钙化作用的差异导致了光合方面的差异表现。
| [1] |
HAY W W, MOHLER H P, ROTH P H, et al. Calcareous nannoplankton zonation of the cenozoic of the gulf coast and caribbean-antillean area, and transoceanic correlation[J]. Protein Science A Publication of the Protein Society, 1967, 19(9): 1649-1661. |
| [2] |
IGLESIAS-RODRIGUEZ M D, HALLORAN P R, RICKABY R E M, et al. Phytoplankton calcification in a high-CO2 world[J]. Science, 2008, 320(5874): 336-340. DOI:10.1126/science.1154122 |
| [3] |
MILLIMAN J D. Production and accumulation of calcium-carbonate in the ocean: budget of a nonsteady state[J]. Global Biogeochemical Cycles, 1993, 7(4): 927-957. DOI:10.1029/93GB02524 |
| [4] |
YANG T N, WEI K Y, GONG G C. Distribution of coccolithophorids and coccoliths in surface ocean off northeastern Taiwan[J]. Botanical Bulletin of Academia Sinica, 2001, 42(4): 287-302. |
| [5] |
GEIDER R J, LAROCHE J. The role of iron in phytoplankton photosynthesis, and the potential for iron-limitation of primary productivity in the sea[J]. Photosynthesis Research, 1994, 39(3): 275-301. DOI:10.1007/BF00014588 |
| [6] |
LEYNAERT A, BUCCIARELLI E, CLAQUIN P, et al. Effect of iron deficiency on diatom cell size and silicic acid uptake kinetics[J]. Limnology and Oceanography, 2004, 49(4): 1134-1143. DOI:10.4319/lo.2004.49.4.1134 |
| [7] |
TAKEDA S, OBATA H. Response of equatorial pacific phytoplankton to subnanomolar fe enrichment[J]. Marine Chemistry, 1995, 50(1/4): 219-227. |
| [8] |
RONCEL M, GONZáLEZ-RODRíGUEZ A A, NARANJO B, et al. Iron deficiency induces a partial inhibition of the photosynthetic electron transport and a high sensitivity to light in the diatom Phaeodactylum tricornutum[J]. Frontiers in Plant Science, 2016, 7: 1050. |
| [9] |
ALLEN A E, LAROCHE J, MAHESWARI U, et al. Whole-cell response of the pennate diatom Phaeodactylum tricornutum to iron starvation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(30): 10438-10443. DOI:10.1073/pnas.0711370105 |
| [10] |
VAN DE POLL W H, VAN LEEUWE M A, ROGGEVELD J, et al. Nutrient limitation and high irradiance acclimation reduce PAR and UV-induced viability loss in the Antarctic diatom Chaetoceros brevis (Bacillariophyceae)[J]. Journal of Phycology, 2005, 41(4): 840-850. DOI:10.1111/j.1529-8817.2005.00105.x |
| [11] |
RUETER J G, UNSWORTH N L. Response of marine synechococcus (cyanophyceae) cultures to iron nutrition[J]. Journal of Phycology, 1991, 27(2): 173-178. DOI:10.1111/j.0022-3646.1991.00173.x |
| [12] |
GREENE R M, GEIDER R J, KOLBER Z, et al. Iron-Induced changes in light harvesting and photochemical energy conversion processes in eukaryotic marine algae[J]. Plant Physiology, 1992, 100(2): 565-575. DOI:10.1104/pp.100.2.565 |
| [13] |
SUNDA W G, HUNTSMAN S A. Iron uptake and growth limitation in oceanic and coastal phytoplankton[J]. Marine Chemistry, 1995, 50(1/4): 189-206. |
| [14] |
MARCHETTI A, SCHRUTH D M, DURKIN C A, et al. Comparative metatranscriptomics identifies molecular bases for the physiological responses of phytoplankton to varying iron availability[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(6): E317-E25. |
| [15] |
STRZEPEK R F, HARRISON P J. Photosynthetic architecture differs in coastal and oceanic diatoms[J]. Nature, 2004, 431(7009): 689-692. DOI:10.1038/nature02954 |
| [16] |
PEERS G, PRICE N M. Copper-containing plastocyanin used for electron transport by an oceanic diatom[J]. Nature, 2006, 441(7091): 341-344. DOI:10.1038/nature04630 |
| [17] |
STRZEPEK R F, BOYD P W, SUNDA W G. Photosynthetic adaptation to low iron, light, and temperature in Southern Ocean phytoplankton[J]. Proceedings of the National Academy of Sciences, 2019, 116(10): 4388-4393. DOI:10.1073/pnas.1810886116 |
| [18] |
HARTNETT A, BOTTGER L H, MATZANKE B F, et al. Iron transport and storage in the coccolithophore: Emiliania huxleyi[J]. Metallomics, 2012, 4(11): 1160-1166. DOI:10.1039/c2mt20144e |
| [19] |
BOYE M, VAN DEN BERG C M G. Iron availability and the release of iron-complexing ligands by Emiliania huxleyi[J]. Marine Chemistry, 2000, 70(4): 277-287. DOI:10.1016/S0304-4203(00)00032-3 |
| [20] |
SCHULZ K G, ROST B, BURKHARDT S, et al. The effect of iron availability on the regulation of inorganic carbon acquisition in the coccolithophore Emiliania huxleyi and the significance of cellular compartmentation for stable carbon isotope fractionation[J]. Geochimica et Cosmochimica Acta, 2007, 71(22): 5301-5312. DOI:10.1016/j.gca.2007.09.012 |
| [21] |
SEGOVIA M, LORENZO M R, INIGUEZ C, et al. Physiological stress response associated with elevated CO2 and dissolved iron in a phytoplankton community dominated by the coccolithophore Emiliania huxleyi[J]. Marine Ecology Progress Series, 2018, 586: 73-89. DOI:10.3354/meps12389 |
| [22] |
SCHLOSSER C, STREU P, FRANK M, et al. H2S events in the Peruvian oxygen minimum zone facilitate enhanced dissolved Fe concentrations[J]. Scientific Reports, 2018, 8(1): 12642-12650. DOI:10.1038/s41598-018-30580-w |
| [23] |
HUTCHINS D A, HARE C E, WEAVER R S, et al. Phytoplankton iron limitation in the humboldt current and peru upwelling[J]. Limnology and Oceanography, 2002, 47(4): 997-1011. DOI:10.4319/lo.2002.47.4.0997 |
| [24] |
MOORE J K, DONEY S C, GLOVER D M, et al. Iron cycling and nutrient-limitation patterns in surface waters of the world ocean[J]. Deep-Sea Research Part II-Topical Studies in Oceanography, 2001, 49(1/3): 463-507. |
| [25] |
SHI D L, XU Y, HOPKINSON B M, et al. Effect of ocean acidification on iron availability to marine phytoplankton[J]. Science, 2010, 327(5966): 676-679. DOI:10.1126/science.1183517 |
| [26] |
PRICE N M, HARRISON G I, HERING J G, et al. Preparation and chemistry of the artificial algal culture medium aquil[J]. Biological Oceanography, 1989, 6(5/6): 443-461. |
| [27] |
MALDONADO M T, PRICE N M. Influence of N substrate on Fe requirements of marine centric diatoms[J]. Marine Ecology Progress Series, 1996, 141(1/3): 161-172. |
| [28] |
缪杭斌. 钙化与非钙化颗石藻对海水酸化与UV辐射的生理学响应[D]. 厦门: 厦门大学, 2017. MIAO Hangbin. Physiological responses of calcifying and non-calcifying coccolithophore strains to seawater acidification and UV radiation[D]. Xiamen: Xiamen University, 2017. |
| [29] |
PORRA R J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophylls a and b[J]. Photosynthesis Research, 2002, 73(1/3): 149-156. DOI:10.1023/A:1020470224740 |
| [30] |
RITCHIE R J. Consistent sets of spectrophotometric chlorophyll equations for acetone, methanol and ethanol solvents[J]. Photosynthesis Research, 2006, 89(1): 27-41. DOI:10.1007/s11120-006-9065-9 |
| [31] |
STRICKLAND J, PARSONS T. A practical handbook of seawater analysis[M]. Ottawa: Fisheries Research Board of Canada, 1972.
|
| [32] |
DUARTE B, SANTOS D, MARQUES J C, et al. Biophysical probing of Spartina maritima photo-system II changes during prolonged tidal submersion periods[J]. Plant Physiology and Biochemistry, 2014, 77: 122-132. DOI:10.1016/j.plaphy.2014.01.023 |
| [33] |
EILERS P H C, PEETERS J C H. A model for the relationship between light-intensity and the rate of photosynthesis in phytoplankton[J]. Ecological Modelling, 1988, 42(3/4): 199-215. |
| [34] |
RALPH P J, GADEMANN R. Rapid light curves: A powerful tool to assess photosynthetic activity[J]. Aquatic Botany, 2005, 82(3): 222-237. DOI:10.1016/j.aquabot.2005.02.006 |
| [35] |
BENDIF E, PROBERT I, DIAZ-ROSAS F, et al. Recent reticulate evolution in the ecologically dominant lineage of coccolithophores[J]. Frontiers in Microbiology, 2016, 7: 784. |
| [36] |
BRULAND K W, RUE E L, SMITH G J, et al. Iron, macronutrients and diatom blooms in the Peru upwelling regime: brown and blue waters of Peru[J]. Marine Chemistry, 2005, 93(2/4): 81-103. |
| [37] |
MUGGLI D L, HARRISON P J. Effects of nitrogen source on the physiology and metal nutrition of Emiliania huxleyi grown under different iron and light conditions[J]. Marine Ecology Progress Series, 1996, 130(1/3): 255-267. |
| [38] |
MILLIGAN A J, HARRISON P J. Effects of non-steady-state iron limitation on nitrogen assimilatory enzymes in the marine diatom Thalassiosira weissflogii (Bacillariophyceae)[J]. Journal of Phycology, 2000, 36(1): 78-86. DOI:10.1046/j.1529-8817.2000.99013.x |
| [39] |
RAVEN J A. The iron and molybdenum use efficiencies of plant-growth with different energy, carbon and nitrogen-sources[J]. New Phytologist, 1988, 109(3): 279-287. DOI:10.1111/j.1469-8137.1988.tb04196.x |
| [40] |
MUGGLI D L, LECOURT M, HARRISON P J. Effects of iron and nitrogen source on the sinking rate, physiology and metal composition of an oceanic diatom from the subarctic Pacific[J]. Marine Ecology Progress Series, 1996, 132(1/3): 215-227. |
| [41] |
TIMMERMANS K R, STOLTE W, DEBAAR H J W. Iron-mediated effects on nitrate reductase in marine-phytoplankton[J]. Marine Biology, 1994, 121(2): 389-396. DOI:10.1007/BF00346749 |
| [42] |
GREENE R M, GEIDER R J, FALKOWSKI P G. Effect of iron limitation on photosynthesis in a marine diatom[J]. Limnology and Oceanography, 1991, 36(8): 1772-1782. DOI:10.4319/lo.1991.36.8.1772 |
| [43] |
MARCHETTI A, HARRISON P J. Coupled changes in the cell morphology and the elemental (C, N, and Si) composition of the pennate diatom Pseudo-nitzschia due to iron deficiency[J]. Limnology and Oceanography, 2007, 52(5): 2270-2284. DOI:10.4319/lo.2007.52.5.2270 |
| [44] |
BEHRENFELD M J, MILLIGAN A J. Photophysiological expressions of iron stress in phytoplankton[J]. Annual Review of Marine Science, 2013, 5(1): 217-246. DOI:10.1146/annurev-marine-121211-172356 |
| [45] |
CARSLEY J E, FISHER A, MILLIGAN W W, et al. Mechanical behavior of a bulk nanostructured iron alloy[J]. Metallurgical and Materials Transactions a-Physical Metallurgy and Materials Science, 1998, 29(9): 2261-2271. DOI:10.1007/s11661-998-0104-3 |
| [46] |
MOSELEY J L, PAGE M D, ALDER N P, et al. Reciprocal expression of two candidate di-iron enzymes affecting photosystem I and light-harvesting complex accumulation[J]. Plant Cell, 2002, 14(3): 673-688. DOI:10.1105/tpc.010420 |
| [47] |
VAN LEEUWE M A, STEFELS J. Photosynthetic responses in Phaeocystis antarctica towards varying light and iron conditions[J]. Biogeochemistry, 2007, 83(1/3): 61-70. |
| [48] |
ALDERKAMP A C, DE BAAR H J W, VISSER R J W, et al. Can photoinhibition control phytoplankton abundance in deeply mixed water columns of the Southern Ocean?[J]. Limnology and Oceanography, 2010, 55(3): 1248-1264. DOI:10.4319/lo.2010.55.3.1248 |
| [49] |
WILSON A, BOULAY C, WILDE A, et al. Light-induced energy dissipation in iron-starved cyanobacteria: roles of OCP and IsiA proteins[J]. Plant Cell, 2007, 19(2): 656-672. DOI:10.1105/tpc.106.045351 |
| [50] |
BEAUFORT L, PROBERT I, DE GARIDEL-THORON T, et al. Sensitivity of coccolithophores to carbonate chemistry and ocean acidification[J]. Nature, 2011, 476(7358): 80-83. DOI:10.1038/nature10295 |
| [51] |
MONTEIRO F M, BACH L T, BROWNLEE C, et al. Why marine phytoplankton calcify[J]. Science Advances, 2016, 2(7): e1501822. DOI:10.1126/sciadv.1501822 |
| [52] |
BEHRENFELD M, MILLIGAN A. Photophysiological expressions of iron stress in phytoplankton[J]. Annual review of Marine Science, 2013, 5(1): 217-246. DOI:10.1146/annurev-marine-121211-172356 |
| [53] |
NISHIYAMA Y, ALLAKHVERDIEV S I, MURATA N. A new paradigm for the action of reactive oxygen species in the photoinhibition of photosystem II[J]. Biochimica et Biophysica Acta-Bioenergetics, 2006, 1757(7): 742-749. DOI:10.1016/j.bbabio.2006.05.013 |
| [54] |
RAVEN J A, EVANS M C W, KORB R E. The role of trace metals in photosynthetic electron transport in O2-evolving organisms[J]. Photosynthesis Research, 1999, 60(2/3): 111-149. DOI:10.1023/A:1006282714942 |
| [55] |
RAVEN J A. Predictions of Mn and Fe use efficiencies of phototrophic growth as a function of light availability for growth and of C assimilation pathway[J]. New Phytologist, 1990, 116(1): 1-18. DOI:10.1111/j.1469-8137.1990.tb00505.x |
| [56] |
PIETSCH D, BERNAT G, KAHMANN U, et al. New insights into the function of the iron deficiency-induced protein C from Synechococcus elongatus PCC 7942[J]. Photosynthesis Research, 2011, 108(2/3): 121-132. |
| [57] |
PANKOWSKI A, MCMINN A. Iron availability regulates growth, photosynthesis, and production of ferredoxin and flavodoxin in Antarctic sea ice diatoms[J]. Aquatic Biology, 2009, 4(3): 273-288. |
| [58] |
JIN P, GAO K, BEARDALL J. Evolutionary responses of a coccolithophorid gephyrocapsa oceanica to ocean acidification[J]. Evolution, 2013, 67(7): 1869-1878. DOI:10.1111/evo.12112 |
| [59] |
MARTIN J H, FITZWATER S E. Iron deficiency limits phytoplankton growth in the north-east Pacific subarctic[J]. Nature, 1988, 331(6154): 341-343. DOI:10.1038/331341a0 |
 2022, Vol. 46
2022, Vol. 46


