文章信息
- 周佳峥, 郭永军, 全峰, 梁健, 李永仁, 黄亚冬, 梁爽. 2022.
- ZHOU Jia-zheng, GUO Yong-jun, QUAN Feng, LIANG Jian, LI Yong-ren, HUANG Ya-dong, LIANG Shuang. 2022.
- 不同水交换量下皱纹盘鲍转录组测序与分析
- Sequencing and analysis of the Haliotis discus hannai transcriptome under different water exchange rates
- 海洋科学, 46(12): 159-168
- Marine Sciences, 46(12): 159-168.
- http://dx.doi.org/10.11759/hykx20201003001
-
文章历史
- 收稿日期:2020-10-03
- 修回日期:2020-11-09
2. 天津市海升水产养殖有限公司, 天津 300270
2. Tianjin Haisheng Aqua-cu-l-ture Limited Company, Tianjin 300270, China
在水产生物养殖过程中, 水交换量对养殖生物的生理状态有显著影响。通常情况下, 水交换量的增加能够改善生物的生长和存活等状态[1-2]。例如, 在皱纹盘鲍幼鲍的养殖过程中, 当水交换量率由流水、24 h/次、48 h/次和72 h/次逐渐降低时, 幼鲍的存活率和增重率也随之下降[3]。提高水交换量被认为能够显著减少养殖生物在摄食、排泄等过程中产生的氨氮、亚硝酸盐等自污染因子的浓度, 同时提高溶解氧、透明度等指标, 从而使水生生物维持一个较好的生理状态, 最终改善其生长、存活情况等[4-5]。例如, 研究换水频率对刺参养殖水质的影响时发现, 日换水率由0、10%、20%、30%、100%逐步提高时, 刺参养殖水体中的氨氮和亚硝酸盐的浓度逐渐降低[2]; 当换水频率为10 d/月时, 则能维持优良的刺参池塘养殖环境[6]。
转录组分析能够了解特定条件下生物体内不同基因的表达情况, 从而解析生物在生长发育过程中或外界环境因子影响下, 其体内的生长发育、抗逆应激等相关基因的反应情况[7-9], 目前已被广泛用于研究水产动物的生理功能(如水产动物毒理学、发育生物学、系统进化生物学等)及免疫功能(包括病毒病、细菌病、寄生虫病免疫生物学)等研究[10-11]。转录组技术在研究水体自污染物质(氨氮、亚硝酸盐等)对水产动物的胁迫效应时也有应用[12]。例如, 氨氮胁迫下的日本沼虾转录组结果显示, 胁迫前后有887个基因呈差异性表达, 且主要富集在16条免疫相关通路中, 如补体和凝血级联、T细胞受体信号通路、Toll样受体信号通路与B细胞受体等通路[13]。
本课题组过去的研究发现, 水交换量的变化能够显著影响皱纹盘鲍的成活率、摄食率和耗氧率情况, 具体表现为: 随着水交换量由1次/d提升到4次/d, 鲍的存活率和摄食量均逐渐提高; 且随着水交换量的提高, 鲍的耗氧率逐渐降低, 1次换水组的鲍耗氧率(0.47±0.05) mg/(g·h)显著高于4次换水组(0.37±0.05) mg/(g·h); 相应地, 1次换水组的水体溶解氧量则小于4次换水组。此外, 水交换量提升降低了鲍养殖水体中的氨氮、亚硝酸氮等自污染因子的浓度[14]。然而, 水交换量变化影响鲍生理状态的分子机制尚不明晰。本文拟采用转录组测序的手段, 研究皱纹盘鲍在不同水交换量的条件下, 其肌肉组织内转录本表达变化, 以阐明不同水交换量对于皱纹盘鲍的生理状态影响的分子机制, 为皱纹盘鲍养殖条件的优化提供理论支撑, 为贝类健康生态养殖的理论奠定基础。
1 材料与方法 1.1 材料实验所用的皱纹盘鲍, 引自福建晋江某养殖公司。壳长(2.24±0.30) cm, 壳宽(1.44±0.21) cm, 壳高(1.32±0.19) cm。低温空运至天津。实验前进行7 d的暂养, 暂养条件为盐度33、pH 7.8、温度(24±1) ℃。暂养期间按皱纹盘鲍体质量的1%投喂鲍配合饲料。暂养期间每天早晚全量换水, 并及时清除死鲍以及残饵粪便, 实验前24 h暂停投喂饵料。
1.2 方法 1.2.1 不同水交换量处理试由上述驯养的群体中, 随机取180只皱纹盘鲍, 平均分成3组, 平均分配于9个100 L的PVC养殖箱中, 按换水频率分为1次每天组、2次每天组、4次每天组(每天全量换水1次、2次、4次, 每组3个平行), 每个换水组实验持续3 d, 实验期间无鲍鱼死亡。
1.2.2 样品取样换水实验结束后, 从每个换水处理组中的PVC整理养殖箱中各取9只鲍(每个平行箱3只), 对其进行肌肉组织的取样: 使用已灭菌并去除RNA酶的剪刀、镊子剪取100 mg左右的肌肉组织, 放入干净的冻存管中, 然后迅速放入液氮中速冻, 之后转移至−80 ℃冰箱保存。
1.2.3 RNA提取对保存的组织进行液氮研磨, 充分研磨后使用Trizol法[15]提取各换水组鲍鱼肌肉组织的总RNA。对每个换水组的9个RNA样品进行三三等量混合, 每组建立3个平行RNA混合样品。各混样总RNA利用Aligent 2000、Nanodrop、琼脂糖凝胶电泳3种方法进行浓度及纯度检测。1次每天组、2次每天组、4次每天组的混合样本分别标记为C0、T2和T4。
1.2.4 转录组测序及分析转录组的建库及测序工作委托北京百迈克生物科技有限公司完成, 每个换水组的鲍建立3个平行的转录组测序文库(共建库9个)并进行测序Illumina 2000双端建库测序。获得原始测序序列(Sequenced reads)后, 进行以下生物信息学分析: Clean Data的分析; Unigene的拼接和功能注释; Unigene功能注释, 包括与NR、Swiss-Prot、KEGG、COG、KOG、GO和Pfam数据库的比对进行; Unigene库基因结构分析主要包括SSR分析、CDS预测和SNP分析; 不同样品中的基因进行基于FPKM的表达量分析; 基于基因在不同样品中的表达量, DEseq识别鉴定差异表达基因; 对差异表达基因进行模式聚类、GO功能注释以及KEGG富集分析。
1.2.5 荧光定量PCR验证从转录组结果里随机选取10个差异基因进行qRT-PCR验证, 根据所挑选的差异表达基因的序列, 遵循引物设计的原则, 使用引物设计软件Beacon designer 7设计两对定量引物。经标准曲线法测定引物的扩增效率, 保证各定量引物的扩增效率类似, 且在95%~105%范围内。以上述反转录合成的cDNA为模板, β-actin基因为内参[16], 在荧光定量PCR仪上进行定量PCR反应。反应体系包括: 1 μL的cDNA模板(10倍稀释), 各1 μL的上下游引物(10pmol L-1), 10 μL的2×DNAmo ColorFlash Master Mix(Thermo, USA), 以及8 μL的灭菌超纯水。反应程序设置为: 95 ℃ 7 min, (95 ℃ 20 s, 60 ℃ 60 s)×35, 72 ℃ 10 min, 每个反应后均检查熔解曲线以确保产物单一性, 每个反应均设置3个重复。
2 结果与分析对9个样品进行Illumina 2000双端建库测序, 共得到207 435 516条原始测序序列, 测序正确率高达99.9%。对原始测序序列进行质量筛选, 即截除Reads中的测序接头、引物序列和低质量值数据等, 共获得61.81 Gb Clean data, 其中各样品GC含量在46.60%~ 47.76%之间, Q30碱基百分比不小于94.39%, 表明测序数据完整性好, 质量高(表 1)。
| 样品名 | 读数 | 碱基数目 | GC含量 | Q30 |
| C01 | 24 462 637 | 7 271 953 224 | 47.16% | 94.55% |
| C02 | 21 052 272 | 6 274 674 986 | 46.99% | 94.55% |
| C03 | 23 012 897 | 6 858 209 710 | 47.76% | 94.58% |
| T2-01 | 25 628 312 | 7 642 332 424 | 47.42% | 94.62% |
| T2-02 | 22 402 887 | 6 683 127 884 | 47.32% | 94.55% |
| T2-03 | 23 422 409 | 6 984 838 288 | 47.35% | 94.55% |
| T4-01 | 22 574 962 | 6 729 302 456 | 46.99% | 94.79% |
| T4-02 | 23 079 636 | 6 875 625 770 | 47.18% | 94.45% |
| T4-03 | 21 799 504 | 6 492 486 544 | 46.60% | 94.39% |
将得到的所有Unigene序列分别与七个数据库对比, 比对结果如表 2所示, 可知在COG、GO、KEGG、KOG、Pfam、Swissprot、eggNOG七个数据库中成功注释的Unigene数量分别为6 518、7 750、9 116、12 139、15 772、11 014、16 863, 最终总共获得20 480个至少在一个数据库中有注释信息的Unigene。其中长度大于等于1 000的Unigene数为16 025个, 长度介于300至1 000之间的Unigene数为4 455个。
| 功能注释数据库 | 注释基因个数 | 注释基因长度 300≤长度 < 1 000 |
注释基因长度 长度≥1 000 |
| COG | 6 518 | 882 | 5 636 |
| GO | 7 750 | 1 269 | 6 481 |
| KEGG | 9 116 | 1 390 | 7 726 |
| KOG | 12 139 | 1 751 | 10 388 |
| Pfam | 15 772 | 2 599 | 13 173 |
| Swissprot | 11 014 | 1 620 | 9 394 |
| eggNOG | 16 863 | 2 972 | 13 891 |
| nr | 19 875 | 4 128 | 15 747 |
| All | 20 480 | 4 455 | 16 025 |
利用皮尔逊相关系数r(Pearson’s correlation coefficient)对样品间相关性的指标评估。如图 1所示, C0、T2、T4各组的生物学重复文库之间的相关性均较高(r2均大于0.98), 而C0和T2, C0和T4的样品文库之间的相关性则较低(r2均小于0.25)。
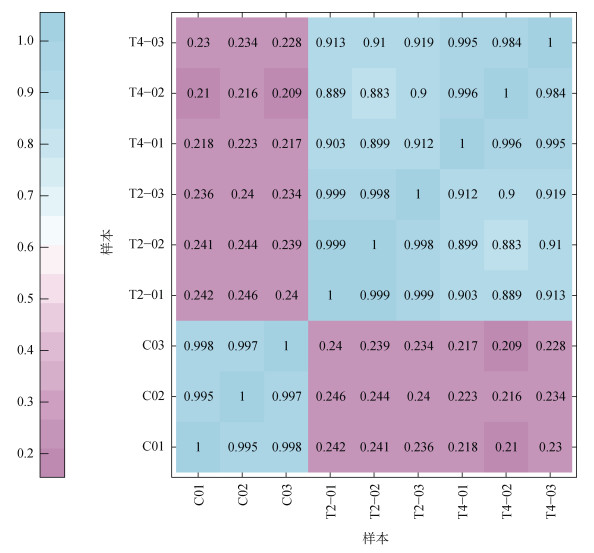 |
| 图 1 样品的相关性热图 Fig. 1 Correlation heatmap of the samples |
如表 3所示, C0和T2、C0和T4、T4和T2的差异表达基因数目分别为4 095、3 617、232, 且1次换水组与多次换水组间(C0和T2和C0和T4)的差异表达基因中, 上调基因的数目明显小于下调基因的数目。
| 差异表达基因集 | 总差异表达基因个数 | 上调基因个数 | 下调基因个数 |
| C0和T2 | 4 095 | 459 | 3 636 |
| C0和T4 | 3 617 | 456 | 3 161 |
| T4和T2 | 232 | 107 | 125 |
分别将单次换水组(C0)和多次换水组(T2和T4)的差异表达基因进行GO功能注释, 按照GO三大类型再次进行分类, 共分为52个功能亚类, 如图 2所示, C0和T2和C0和T4的差异表达基因所注释到的GO类群比较相似: 在生物学过程分类下, 主要富集在细胞学过程(cellular process)、定位(localization)、代谢过程(metabolic process)和单生物进程(single-organism process)等功能; 在细胞组分分类下, 主要富集在细胞(cell)、细胞部分(cell part)、细胞膜部分(membrane part)和细胞膜部分(membrane)等功能; 在分子功能中, 主要富集在催化活性(catalytic activity)、附着(binding)和运输活性(transporter activity)等功能。
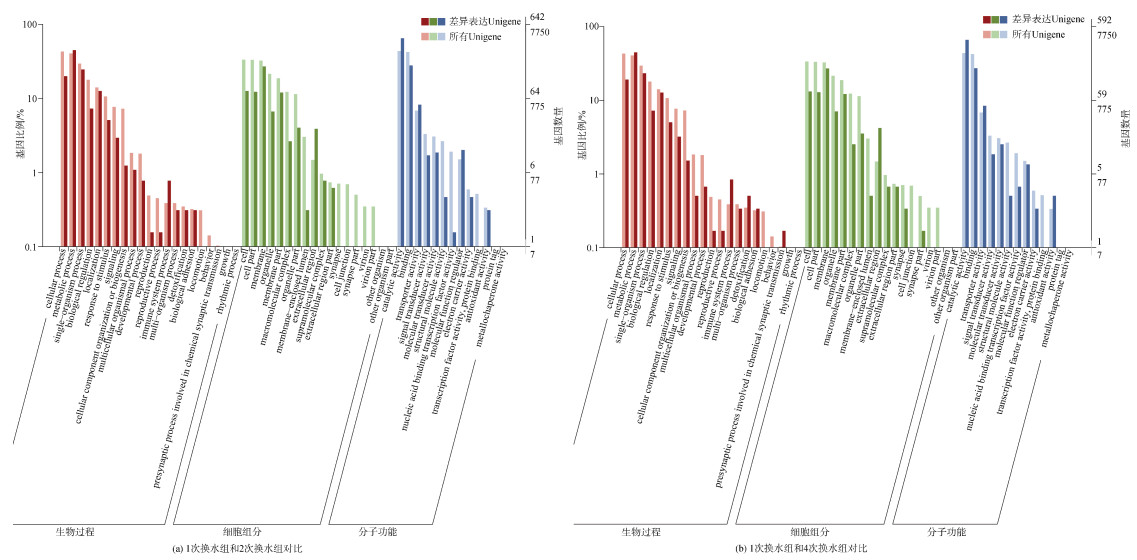 |
| 图 2 差异表达基因本体(GO)富集分析 Fig. 2 GO enrichment analysis of the differentially expressed genes |
分别将单次换水组(C0)和多次换水组(T2和T4)的差异表达基因进行KEGG功能注释, 以此获知不同换水组之间的差异基因可能参与的生理生化代谢通路。结果如图 3所示, C0和T2的差异表达基因主要显著富集于淀粉和蔗糖代谢(starch and sucrose metabolism), 溶酶体(lysosome), 糖胺聚糖降解(glycosaminoglycan degradation), 戊糖和葡萄糖醛酸酯的相互转化(pentose and glucuronate interconversions), 氨基酸和核苷酸糖的代谢(amino sugar and nucleotide sugar metabolism)等通路, C0和T4的差异表达基因主要显著富集于淀粉和蔗糖代谢(starch and sucrose metabolism), 溶酶体(lysosome), 糖胺聚糖降解(glycosaminoglycan degradation), 半乳糖代谢(galactose metabolism), 氨基酸和核苷酸糖代谢(amino sugar and nucleotide sugar metabolism)等通路。
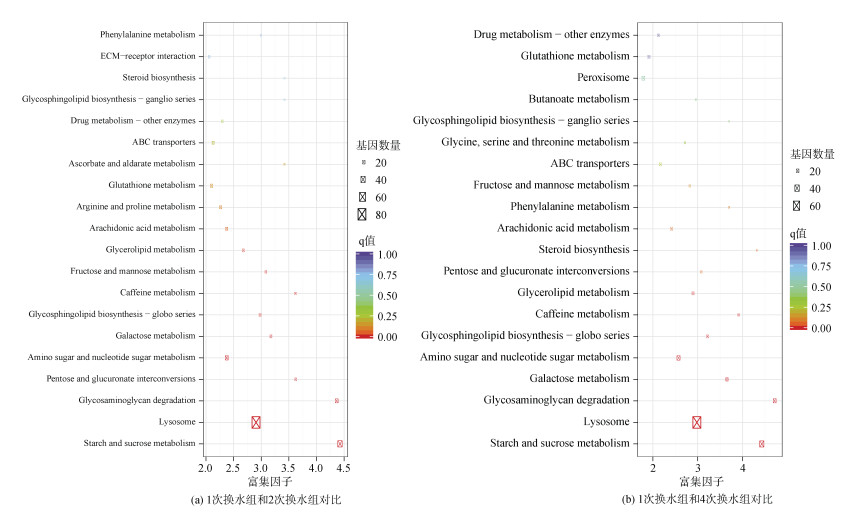 |
| 图 3 差异表达基因京都基因与基因组数据库(KEGG)通路富集散点图 Fig. 3 Scatter diagram of the differentially expressed genes enriched in the KEGG pathways |
根据FPKM(表达量)值, 选取不同水交换量处理组之间差异表达最显著的基因, 对其表达量及NR注释信息进行分析、筛选和统计, 结果如表 4和表 5所示, 在C0和T2差异表达最显著基因中, 与生物消化代谢(胰蛋白酶trypsin等)与组织构成(透明质蛋白perlucin, 黏液相关蛋白mucus-associated protein, 肌球蛋白myosin heavy chain等)等功能相关的基因显著在多次换水组T2和T4中上调表达, 而在1次换水组C0中表达量较低; 而透明质素样蛋白(perlucin-like protein)海藻酸裂解酶(alginate lyase)内切葡聚糖酶4样亚型(endoglucanase 4-like isoform X1)等基因则在多次换水组中表达量较低(表 4)。C0和T4差异表达最显著基因中, 与组织构成(睾蛋白testisin等), 生物消化代谢(胰蛋白酶trypsin等), 信号转导(wnt信号通路受体frizzled 1, RyR受体ryanodine receptor-like等)在多次换水组T2和T4中上调表达, 而在1次换水组C0中表达量较低; 而透明质蛋白(perlucin), 纤维素酶(cellulase), 黏蛋白(mucin-5AC-like isoform X3), 内切葡聚糖酶(endoglucanase 14-like)等基因则在多次换水组中表达量较低(表 5)。
| 基因编号 | 基因NR数据库注释结果 | 表达量(FPKM) | ||
| C0 | T2 | T4 | ||
| 上调差异表达基因 | ||||
| c106371 | trypsin-1 | 14.72 | 415.73 | 253.30 |
| c67080 | perlucin | 25.26 | 624.07 | 0.00 |
| c87655 | perlucin-like | 34.86 | 828.06 | 0.00 |
| c88543 | mucus-associated protein 3, partial | 0.11 | 2 234.39 | 1.67 |
| c94608 | myosin heavy chain, striated muscle-like | 381.93 | 2 234.39 | 1 808.48 |
| c99390 | paramyosin | 185.13 | 1 048.20 | 949.37 |
| c102132 | SCP-like protein | 215.67 | 1 165.83 | 1 202.69 |
| c109646 | calponin | 216.09 | 1 043.07 | 0.00 |
| c99390 | catchin | 227.09 | 1 163.46 | 1 027.28 |
| 下调差异表达基因 | ||||
| c96306 | perlucin-like protein | 99.69 | 0.78 | 0.17 |
| c100598 | alginate lyase | 1 682.94 | 0.81 | 1.76 |
| c113420 | endoglucanase 4-like isoform X1 | 1 327.36 | 0.77 | 2.64 |
| c110515 | cellulase [Haliotis discus] | 119.24 | 0.06 | 0.25 |
| c106713 | cellulase [Haliotis gigantea] | 734.41 | 0.52 | 0.78 |
| c106713 | cellulase [Haliotis discus hannai] | 1 799.59 | 1.50 | 3.12 |
| c91643 | serine protease inhibitor Cvsi-2-like | 1 015.19 | 1.08 | 1.92 |
| 基因编号 | 基因NR数据库注释结果 | 表达量(FPKM) | ||
| C0 | T2 | T4 | ||
| 上调差异表达基因 | ||||
| c83425 | testisin-like | 11.07 | 254.80 | 341.52 |
| c79963 | trypsin inhibitor, putative | 3.42 | 72.21 | 44.38 |
| c106371 | Trypsin-1 | 14.72 | 253.30 | 415.73 |
| c99475 | frizzled 1 | 19.94 | 90.06 | 140.22 |
| c118325 | ryanodine receptor-like | 30.13 | 138.92 | 189.25 |
| c94608 | mucus-associated protein 3, partial | 381.93 | 1 808.48 | 2 234.39 |
| c114072 | titin isoform X2 | 6.32 | 28.81 | 121.04 |
| c99682 | phospholipase B1, membrane-associated | 147.78 | 1 233.54 | 50.04 |
| 下调差异表达基因 | ||||
| c93159 | perlucin 2 | 235.41 | 0.22 | 0.12 |
| c106713 | cellulase | 734.41 | 0.78 | 0.52 |
| c106713 | mucin-5AC-like isoform X3 | 764.54 | 1.02 | 1.50 |
| c112326 | cellulase | 1 799.59 | 3.12 | 1.11 |
| c113420 | endoglucanase 14-like | 1 275.21 | 2.46 | 0.77 |
| c28251 | serine protease inhibitor Cvsi-2-like | 1 015.19 | 1.92 | 0.11 |
| c106652 | endoglucanase 4-like isoform X1 | 1 327.36 | 2.64 | 0.23 |
| c103502 | A disintegrin and metalloproteinase with thrombospondin motifs 18-like | 7.00 | 0.01 | 0.01 |
从转录组数据库随机选取10个差异基因进行荧光定量PCR验证。运用2-ΔΔCt方法对不同水交换量组中的差异表达基因进行相对表达水平定量分析。结果表示, 选取的10个差异表达基因(Unigene编号c100088, c100118, c100155, c100277, c100299, c100496, c100761, c100829, c100882)在三个换水组鲍中的转录本表达量(以FPKM的对数表示)和荧光定量PCR表达量(以倍数变化FC的对数表示)一致(图 4), 表明转录组测序结果是可靠的。
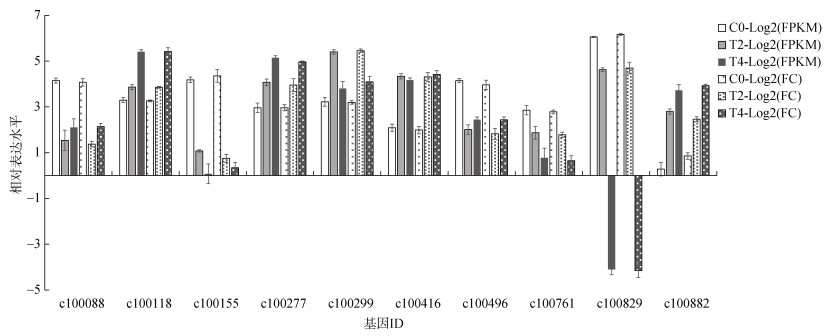 |
| 图 4 荧光定量聚合酶链式反应(PCR)验证结果 Fig. 4 qRT-PCR results 注: FC: 定量PCR差异倍数; FPKM: 转录组表达量 |
随着新一代高通分子测序技术的不断完善和发展与成熟, 转录组研究在水产生物生理过程机制的研究中愈发常见, 已有大量研究将转录组学技术应用于水产生物疾病与免疫学研究[17-18], 繁殖和发育研究[19-20], 毒性和压力过程研究[21-22], 生长和营养[23-24]等方面。本研究利用高通量测序平台, 对在三种不同水交换量条件下养殖的皱纹盘鲍的肌肉进行转录组测序, 得到了质量良好、结果可信的转录组测序结果数据。比较C0和T2、C0和T4与T2和T4数据, 分别检测到4 095、3 617、232个差异表达基因, 说明随着水交换量的增加, 尤其是由1次/d的水交换量提升至2次/d或4次/d时, 显著改变鲍中相关基因的表达水平, 说明换水量的增加对鲍的生理生化过程产生了比较明显的影响, 也印证了使用转录组的手段研究水交换量对于鲍的生理状态的影响机制是可行的。
本研究中, 通过对C0组和T2、T4组的差异表达基因进行GO和KEGG富集分析, 发现差异表达基因主要富集到了与消化和代谢相关的基因通路上, 如淀粉和蔗糖代谢, 糖胺聚糖降解, 戊糖和葡萄糖醛酸酯的相互转化, 氨基酸和核苷酸糖的代谢, 半乳糖代谢等通路。在对不同换水组之间的差异表达最显著的基因进行功能分析时, 同样发现了许多基因的功能属于消化、代谢类, 如胰蛋白酶、内切葡聚糖酶、纤维素酶等。结合我们过去的研究, 在投喂颗粒状饲料的鲍养殖水体中, 1次换水组、2次换水组、3次换水组、4次换水组的水体中的氨氮含量分别为(1.46±0.42) mg/L、(0.93±0.59) mg/L、(0.46± 0.11) mg/L、(0.39±0.26) mg/L[14]。说明了换水量的提高很有可能通过改善水质, 提升了鲍鱼机体对于营养物质的消化和吸收效率。类似地, 日本沼虾在应对不同浓度的氨氮胁迫时, 其糖酵解相关通路、蛋白质消化和吸收相关通路也会发生相应的变化[13], 说明水生生物在水质变化时, 其消化代谢相关生理过程的活性会发生变化, 从而从能量供给的角度帮助机体应对由水质变化带来的不利影响。
此外, 我们发现溶酶体相关通路和基因在不同换水组鲍中有显著的变化。溶酶体是无脊椎动物免疫系统中一个关键性的酶复合体, 由多种抗体、受体和酶成分组成, 包括溶酶体酶、凝集素、抗菌肽等体液免疫因子, 它以杀菌、促进吞噬等方式参与贝类的免疫防御[25-26]。有研究表明, 皱纹盘鲍体内的溶酶体凝集素能够参与对外源病原的识别和消灭过程[27]。杂色鲍的溶酶体酚氧化酶活性在注射副溶血弧菌菌液24 h后显著增加, 且显著受到其他外部环境因子如温度和溶解氧的影响[28-29]。结合本实验的结果, 说明了不同水交换量不仅能够影响皱纹盘鲍的消化代谢功能, 而且可能通过影响其溶酶体相关的免疫系统功能, 从而影响皱纹盘鲍整体的免疫生理状态, 最终使得鲍表现出更好的生理状态。
4 结论本文研究了不同循环水交换量对皱纹盘鲍(Haliotis discus hannai)转录组表达的影响, 研究结果证实了不同水交换频率下, 鲍鱼的肌肉转录本呈现显著的差异性表达。这些差异表达的基因主要功能为能量代谢或免疫反应相关, 预示更高的水交换量可能对皱纹盘鲍代谢和免疫相关通路的激活有利, 未来应进一步聚焦代表性差异表达基因的具体生物学功能。
| [1] |
马贵范, 郭文学, 王玲玲, 等. 养殖密度和换水量及频率对凡纳滨对虾生长的影响[J]. 渔业现代化, 2018, 45(4): 21-26. MA Guifan, GUO Wenxue, WANG Lingling, et al. The effects of aquaculture density and water exchange rate and frequency on the growth of Litopenaeus vannamei[J]. Fishery Modernization, 2018, 45(4): 21-26. DOI:10.3969/j.issn.1007-9580.2018.04.004 |
| [2] |
王光玉, 姜佳惠, 祝楠, 等. 换水率和密度对刺参生长和水质的影响[J]. 渔业现代化, 2017, 44(6): 55-61. WANG Guangyu, JIANG Jiahui, ZHU Nan, et al. Effects of water exchange rate and density on the growth and water quality of sea cucumbers[J]. Fishery Modernization, 2017, 44(6): 55-61. DOI:10.3969/j.issn.1007-9580.2017.06.010 |
| [3] |
杨凤, 雷衍之, 王仁波, 等. 皱纹盘鲍自污染及其对幼鲍生长及成活率的影响[J]. 大连水产学院学报, 2003, 18(1): 1-6. YANG Feng, LEI Yanzhi, WANG Renbo, et al. Selfcontamination of Haliotis discus hannai and its effect on growth and survival rate of juvenile abalone[J]. Journal of Dalian Fisheries University, 2003, 18(1): 1-6. DOI:10.3969/j.issn.1000-9957.2003.01.001 |
| [4] |
唐黎标. 水质对水产养殖的影响和对策[J]. 渔业致富指南, 2017, 18: 36-37. TANG Libiao. The impact of water quality on aquaculture and its countermeasures[J]. Guide to Getting Rich in Fisheries, 2017, 18: 36-37. |
| [5] |
张伟. 水产养殖系统的水质预测预警的应用研究[D]. 大连: 大连海洋大学, 2019. ZHANG Wei. Application research on water quality prediction and early warning of aquaculture system[D]. Dalian: Dalian Ocean University, 2019. |
| [6] |
卢超超, 孙永军, 高勤峰, 等. 不同换水频率对刺参养殖池塘底泥环境的影响[J]. 海洋湖沼通报, 2014(4): 59-66. LU Chaochao, SUN Yongjun, GAO Qinfeng, et al. The impact of different water exchange frequencies on the sediment environment of sea cucumber culture ponds[J]. Transactions of Oceanology and Limnology, 2014(4): 59-66. |
| [7] |
CINGOLANI P. A program for annotating and predicting the effects of single nucleotide polymorphisms, SnpEff: SNPs in the genome of Drosophila melanogaster strain w1118; iso-2; iso-3[J]. Fly, 2012, 6(2): 1-13. |
| [8] |
HUSSING C, KAMPMANN M L, MOGENSEN H S, et al. Comparison of techniques for quantification of nextgeneration sequencing libraries[J]. Forensic ence International Genetics Supplement Series, 2015, 5(4): e276-e278. |
| [9] |
王旭. 基于比较基因组学和转录组学技术揭示单增李斯特菌毒力因子的研究[D]. 上海: 上海海洋大学, 2016. WANG Xu. Research on the virulence factors of Listeria monocytogenes revealed based on comparative genomics and transcriptomics techniques[D]. Shanghai: Shanghai Ocean University, 2016. |
| [10] |
赵婷. 青蛤(Cyclina sinensis)转录组文库测序及免疫相关序列分析[D]. 天津: 天津师范大学, 2014. ZHAO Ting. Sequencing and immune-related sequence analysis of Cyclina sinensis transcriptome library[D]. Tianjin: Tianjin Normal University, 2014. |
| [11] |
黄玉婷. 基于转录组数据的长牡蛎未折叠蛋白反应(UPR)热胁迫响应机制初步研究[D]. 大连: 大连海洋大学, 2018. HUANG Yuting. Preliminary study on the heat stress response mechanism of the unfolded protein response (UPR) of Pacific oyster based on transcriptome data[D]. Dalian: Dalian Ocean University, 2018. |
| [12] |
章琼, 蒋高中, 李冰. 水产动物对氨氮胁迫响应的转录组分析研究进展[J]. 江苏农业科学, 2015, 43(3): 227-230. ZHANG Qiong, JIANG Gaozhong, LI Bing. Transcriptome analysis research progress of aquatic animals' response to ammonia nitrogen stress[J]. Jiangsu Agricultural Sciences, 2015, 43(3): 227-230. |
| [13] |
孙健. 日本沼虾抗氨氮胁迫转录组与代谢组分析[D]. 泰安: 山东农业大学, 2017. SUN Jian. Analysis of transcriptome and metabolome of Macrobrachium nipponense resistance to ammonia nitrogen stress[D]. Taian: Shandong Agricultural University, 2017. |
| [14] |
陈俊男, 郭永军, 梁健, 等. 不同养殖方式对皱纹盘鲍养殖效果及养殖水质的影响[J]. 海洋科学, 2020, 44(3): 104-112. CHEN Junnan, GUO Yongjun, LIANG Jian, et al. The effects of different culture methods on the aquaculture effect and the quality of aquaculture water of Haliotis discus hannai[J]. Marine Sciences, 2020, 44(3): 104-112. |
| [15] |
HUMMON A B, LIM S R, DIFILIPPANTONIO M J, et al. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage[J]. Biotechniques, 2007, 42(4): 472. |
| [16] |
LI J, SUN H, LIU X. Acclimation-dependent expression of heat shock protein 70 in Pacific abalone (Haliotis discus hannai Ino) and its acute response to thermal exposure[J]. Chinese Journal of Oceanology & Limnology, 2012, 30(1): 146-151. |
| [17] |
HUANG L X, LIU W J, JIANG Q L, et al. Integration of transcriptomic and proteomic approaches reveals the temperature-dependent virulence of Pseudomonas plecoglossicida[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 207. |
| [18] |
YE H, LIN Q, LUO H. Applications of transcriptomics and proteomics in understanding fish immunity[J]. Fish & Shellfish Immunology, 2018, 77: 319-327. |
| [19] |
CHAPMAN R W, READING B J, SULLIVAN C V, et al. Ovary Transcriptome profiling via artificial intelligence reveals a transcriptomic fingerprint predicting egg quality in striped bass, Morone saxatilis[J]. PLoS One, 2014, 9(5): e96818. |
| [20] |
AVARRE J C, DUGUÉ R, ALONSO P, et al. Analysis of the black-chinned tilapia Sarotherodon melanotheron heudelotii reproducing under a wide range of salinities: from RNA-seq to candidate genes.[J]. Molecular Ecology Resources, 2013, 14(1): 139-149. |
| [21] |
COLLI-DULA R C, FANG X, MORAGA-AMADOR D, et al. Transcriptome analysis reveals novel insights into the response of low-dose benzo(a)pyrene exposure in male tilapia[J]. Aquatic Toxicology, 2018, 201(3/4): 162-173. |
| [22] |
CHUEH T C, HSU L S, KAO C M, et al. Transcriptome analysis of zebrafish embryos exposed to deltamethrin[J]. Environmental Toxicology, 2016, 32(5): 1548-1557. |
| [23] |
SUN S, XUAN F, GE X, et al. Identification of differentially expressed genes in hepatopancreas of oriental river prawn, Macrobrachium nipponense exposed to environmental hypoxia[J]. Gene, 2014, 534(2): 298-306. |
| [24] |
DIEGO R, CARLOS F, MIGUEL H, et al. Integrative transcriptome, genome and quantitative trait loci resources identify single nucleotide polymorphisms in candidate genes for growth traits in turbot[J]. International journal of molecular sciences, 2016, 17(2): 243. |
| [25] |
CHANDHINI S, REJISH KUMAR V J. Transcriptomics in aquaculture: current status and applications[J]. Reviews in Aquaculture, 2019, 11(4): 1379-1397. |
| [26] |
杜丽, 张巍, 陆逵, 等. 贝类免疫机制研究进展[J]. 动物医学进展, 2008(3): 77-81. DU Li, ZHANG Wei, LU Kui, et al. Research progress in shellfish immune mechanism[J]. Advances in Veterinary Medicine, 2008(3): 77-81. |
| [27] |
WANG N, WHANG I, LEE J. A novel C-type lectin from abalone, Haliotis discus discus, agglutinates Vibrio alginolyticus[J]. Developmental & Comparative Immunology, 2008, 32(9): 1034-1040. |
| [28] |
CHENG W, HSIAO I S, HSU C H, et al. Change in water temperature on the immune response of Taiwan abalone Haliotis diversicolor supertexta and its susceptibility to Vibrio parahaemolyticus[J]. Fish & Shellfish Immunology, 2004, 77: 319-327. |
| [29] |
CHENG W, LI C H, CHEN J C. Effect of dissolved oxygen on the immune response of Haliotis diversicolor supertexta and its susceptibility to Vibrio parahaemolyticus[J]. Aquaculture, 2004, 232(14): 103-115. |
 2022, Vol. 46
2022, Vol. 46


