文章信息
- 宣俊, 李海波, 王超锋, 董逸, 赵苑, 赵丽, 张武昌. 2022.
- XUAN Jun, LI Hai-bo, WANG Chao-feng, DONG Yi, ZHAO Yuan, ZHAO Li, ZHANG Wu-chang. 2022.
- 黑潮及相邻海域表层砂壳纤毛虫分布模式: 以夏季黄海、东海至西太平洋断面为例
- Summertime tintinnid community in the surface waters of the Kuroshio and adjacent waters: A case study along a transect from the Yellow Sea and East China Sea to the West Pacific
- 海洋科学, 46(2): 28-36
- Marine Sciences, 46(2): 28-36.
- http://dx.doi.org/10.11759/hykx20210329002
-
文章历史
- 收稿日期:2021-03-29
- 修回日期:2021-04-20
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049;
4. 中国科学院海洋大科学研究中心, 山东 青岛 266071
2. Laboratory of Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
砂壳纤毛虫是一类具纤毛的单细胞原生动物, 隶属于纤毛门(Ciliophora)-旋毛纲(Spirotrichea)-环毛亚纲(Choreotrichia)-砂壳目(Tintinnida)[1]。砂壳纤毛虫主要摄食微型和微微型的浮游生物, 同时又是中型浮游动物的饵料, 在微食物网和传统食物链之间起到非常重要的连接作用。砂壳纤毛虫具有形态各异、易于辨认的外壳, 壳的特征可以作为种的分类依据。
黑潮源于北赤道流, 是全球较强的西边界流之一, 物理环境高度稳定。黑潮也是影响中国近海暖流区域浮游动物分布的主要暖流, 目前已有很多关于黑潮及其支流的浮游动物的研究[2-5]。黑潮对中国东部陆架边缘海黄海和东海有暖水种输运的作用, 从近岸向外海, 东海浮游动物多样性随着受黑潮影响程度的逐渐增强而升高[5]。
砂壳纤毛虫分为近岸种类和大洋种类(包括暖水型和广布型), 近岸种类从近岸向外海扩散, 大洋种类从大洋向近岸入侵, 两者在陆架海区交汇[6-9]。中国近海砂壳纤毛虫群落已有较多研究[6, 8-9], 但目前从近岸跨越黑潮到大洋砂壳纤毛虫群落的变化还没有相关报道。Li等在东海研究了黑潮西部深海和近岸海域之间砂壳纤毛虫的交汇情况, 发现在50 m以深的外海是大洋群落[8]。在西太平洋, 黑潮位于东海和大洋之间, 我们假设黑潮中的砂壳纤毛虫群落与其两侧有所不同。本文展示了自黄、东海跨越黑潮的断面中砂壳纤毛虫群落的变化, 验证这一假设。
1 材料与方法于2019年8月30日至2019年9月4日, 搭乘“东方红3”号科学考察船在从黄、东海经大隅海峡到毗邻的西太平洋一断面(30°N~34°N, 122°E~145°E)共28个站位(图 1)采集砂壳纤毛虫样品。1—7号站水深为60~80 m, 其他站位水深大于100 m。在每个调查站位, 通过走航供水系统采集表层海水(水深约4 m)80 L(体积V), 用孔径为10 μm的浮游生物网过滤, 将网底管中的样品(约150 mL)转存到样品瓶中, 加入1%酸性Lugol’s溶液固定, 样品置于阴暗处保存。
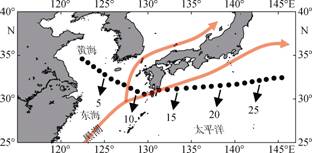 |
| 图 1 采样站位及黑潮洋流示意图 Fig. 1 Locations of sampling stations and schematic of circulation in summer |
用便携式温盐仪(WTW Cond 3210 SET 1, 德国)测量采样站位表层水的温度和盐度。每站取1 L水样用GF/F玻璃纤维滤膜(Whatman, 英国)过滤, 过滤后将滤膜置于−80 ℃冰箱保存。在实验室内用90%的丙酮萃取滤膜上的叶绿素a, 使用Trilogy实验室荧光仪(Model 10, 美国)测定叶绿素a质量浓度(下文简称叶绿素a浓度)。
砂壳纤毛虫样品带回实验室后, 用量筒测量每个样品的体积(VS), 从每个样品中取一定体积(VL)的分样放置于沉降杯中至少24 h, 在倒置显微镜(Olympus IX 71, 日本)下观察, 进行种类鉴定和计数(N)。每个种类至少取20个个体进行拍照和形体测量(体长、口径等), 根据壳的特征和参考分类学文献[10-14]将砂壳纤毛虫鉴定到种。砂壳纤毛虫的丰度(A, ind·L–1)通过公式A= N×(VS /VL)/ V计算。
利用公式Y=ni /N0×fi计算每个种的优势度, 式中Y为第i种的优势度, ni为第i种在所有站位出现的个体数, N0为出现的所有种类的总个体数, fi为第i种在所有站位出现的频率, 当Y > 0.02时认为该种为优势种[15]。
采用Surfer 13和Grapher 10软件绘制作图, 采用IBM SPSS Statistics 19软件进行相关性分析。
2 结果 2.1 温度、盐度和叶绿素a浓度沿断面的变化1—7号站温度(26.2~27.0 ℃)、盐度(29.3~29.9)较低, 叶绿素a浓度(0.20~0.76 μg/L)较高(图 2)。8—14号站温度上升且波动较大(27.0~28.6 ℃); 盐度在8—9号站迅速上升, 10—14号站趋于稳定(33.5~ 34.0); 叶绿素a浓度在8—14号站迅速下降(0.09~ 0.48 μg/L)(图 2)。15—28号站温度、盐度和叶绿素a浓度较稳定(图 2)。根据水文环境及各站位所处的位置, 我们将1—7号站、8—14号站和15—28号站分别定义为大洋边缘区域、黑潮区域和大洋区域。
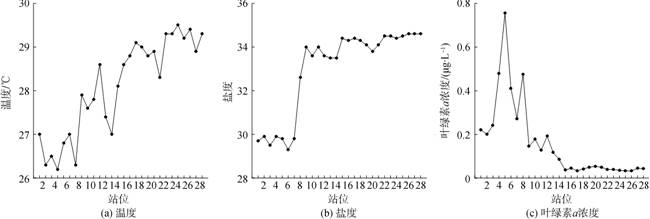 |
| 图 2 各站位表层温度(a)、盐度(b)及叶绿素a浓度(c) Fig. 2 Distribution of temperature, salinity, and chlorophyll a at each station |
所有站位共鉴定砂壳纤毛虫21属42种(表 1)。其中条纹虫属种类数最多, 共7种, 其次为真铃虫属, 共4种。砂壳纤毛虫种丰富度范围为6~24种。种丰富度的最高值在13号站, 最低值则出现在其两侧的5号站和17号站。黄、东海的1—6号站种丰富度较稳定, 7号站开始迅速上升, 再往东侧的站位波动较大(图 3)。
| 学名 | 中文名 | N | Amax | Y |
| 类群Ⅰ | ||||
| Amphorides amphora | 耳瓶瓮状虫 | 20 | 1.86 | 0.012 9 |
| Eutintinnus lusus-undae | 卢氏真铃虫 | 26 | 12.94 | 0.042 9 |
| Eutintinnus stramentus | 杆状真铃虫 | 26 | 27.16 | 0.116 6 |
| Protorhabdonella curta | 缩短原纹虫 | 28 | 63.38 | 0.287 3 |
| 类群Ⅱ | ||||
| Acanthostomella minutissima | 小棘口虫 | 6 | 4.68 | 0.002 5 |
| Ascampbelliella retusa | 钝囊坎虫 | 5 | 0.61 | 0.000 3 |
| Dadayiella ganymedes | 酒杯类管虫 | 13 | 5.21 | 0.015 0 |
| Epiplocyloides reticulata | 网状拟网膜虫 | 7 | 1.56 | 0.001 1 |
| Eutintinnus apertus | 开孔真铃虫 | 7 | 1.19 | 0.001 2 |
| Eutintinnus fraknoii | 佛氏真铃虫 | 4 | 0.43 | 0.000 3 |
| Eutintinnus pacificus | 太平洋真铃虫 | 4 | 25.99 | 0.005 7 |
| Protorhabdonella striatura | 条纹原纹虫 | 4 | 0.20 | 0.000 1 |
| Rhabdonella cornucopia | 尖角条纹虫 | 4 | 0.42 | 0.000 2 |
| Rhabdonella exilis | 纤弱条纹虫 | 3 | 0.61 | 0.000 2 |
| Salpingella faurei | 福雷号角虫 | 3 | 0.69 | 0.000 2 |
| Steenstrupiella robusta | 强壮细瓮虫 | 4 | 1.99 | 0.001 0 |
| 类群Ⅲ | ||||
| Amphorides minor | 小瓮状虫 | 10 | 1.42 | 0.002 3 |
| Ascampbelliella armilla | 镯形囊坎虫 | 22 | 13.30 | 0.038 0 |
| Eutintinnus tubulosus | 管状真铃虫 | 18 | 15.28 | 0.030 3 |
| Protorhabdonella simplex | 简单原纹虫 | 8 | 1.21 | 0.001 0 |
| Rhabdonella amor | 变形条纹虫 | 11 | 0.71 | 0.001 7 |
| Rhabdonella elegans | 优雅条纹虫 | 12 | 1.29 | 0.003 2 |
| Rhabdonella indica | 印度条纹虫 | 4 | 0.35 | 0.000 1 |
| Rhabdonella sanyahensis | 三亚条纹虫 | 19 | 2.58 | 0.010 3 |
| Steenstrupiella gracilis | 纤弱细瓮虫 | 21 | 1.80 | 0.019 2 |
| Steenstrupiella steenstrupii | 斯廷细瓮虫 | 22 | 3.44 | 0.026 4 |
| 类群Ⅳ | ||||
| Amphorellopsis acuta | 尖底类瓮虫 | 9 | 11.64 | 0.009 4 |
| Amphorides brandti | 勃兰氏瓮状虫 | 10 | 12.79 | 0.015 3 |
| Climacocylis scalaroides | 梯状网梯虫 | 3 | 5.17 | 0.001 1 |
| Helicostomella longa | 长形旋口虫 | 14 | 25.58 | 0.039 4 |
| Metacylis corbula | 套篮类杯虫 | 4 | 2.04 | 0.000 8 |
| Metacylis sanyahensis | 三亚类杯虫 | 4 | 1.29 | 0.000 4 |
| Petalotricha aperta | 开孔叶状虫 | 8 | 17.65 | 0.013 2 |
| 偶见种 | ||||
| Codonellopsis meridionalis | 南方类铃虫 | 1 | 0.11 | < 0.000 1 |
| Codonellopsis morchella | 酒瓶类铃虫 | 1 | 0.69 | < 0.000 1 |
| Dictyocysta reticulata | 网状网袋虫 | 2 | 0.20 | < 0.000 1 |
| Epiplocylis labiosa | 厚唇网膜虫 | 1 | 0.08 | < 0.000 1 |
| Poroecus curtus | 短尾孔铃虫 | 1 | 0.20 | < 0.000 1 |
| Proplectella claparedei | 克氏原孔虫 | 2 | 0.12 | < 0.000 1 |
| Rhabdonella conica | 圆锥条纹虫 | 1 | 0.20 | < 0.000 1 |
| Rhabdonella poculum | 杯状条纹虫 | 1 | 1.74 | < 0.000 1 |
| Rhabdonellopsis apophysata | 隆起拟条纹虫 | 1 | 0.08 | < 0.000 1 |
| 注: N为出现站位数, 单位为个, Amax为最大丰度, 单位为ind·L–1, Y为优势度 | ||||
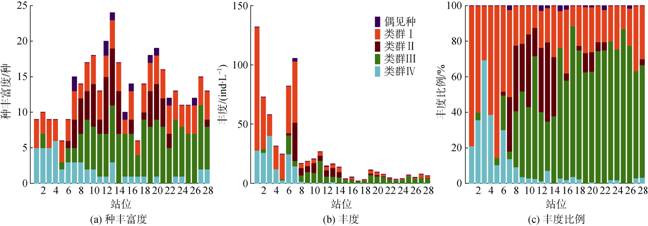 |
| 图 3 各站位不同类群种丰富度(a)、丰度(b)及丰度比例(c) Fig. 3 Abundance, species richness, and abundance percentage variations of different groups along the transect |
砂壳纤毛虫总丰度空间变化趋势与种丰富度差异较大, 自西向东逐渐降低, 在1号站最高(131.94 ind·L–1), 17号站最低(1.97 ind·L–1), 大洋边缘区域的砂壳纤毛虫丰度虽有波动但总体显著高于大洋区域(图 3)。各个种最大丰度的最低值仅有0.08 ind·L–1(厚唇网膜虫和隆起拟条纹虫), 最高值可达63.38 ind·L–1(缩短原纹虫)(表 1)。
共有7种优势种: 缩短原纹虫(Y=0.287 3)、杆状真铃虫(Y=0.116 6)、卢氏真铃虫(Y=0.042 9)、镯形囊坎虫(Y=0.038 0)、管状真铃虫(Y=0.030 3)、长形旋口虫(Y=0.039 4)和斯廷细瓮虫(Y=0.026 4)。在这7个优势种中, 缩短原纹虫优势度最高, 分布最广泛, 在28个站位均有检出; 其次是杆状真铃虫和卢氏真铃虫, 出现在22个站位; 长形旋口虫出现站位数最少, 仅出现在14个站位(表 1)。
2.3 砂壳纤毛虫的分布模式将出现站位数不少于3个, 优势度大于0.000 1的种类定义为常见种(共33种), 其余种类为偶见种(共9种)。根据常见种在大洋边缘区域、黑潮区域和大洋区域的分布模式可划分为4个类群(表 1)。
类群Ⅰ有4种, 在三个区域广泛分布, 出现站位数(大于20个)高于其他3个类群(表 1)。卢氏真铃虫、杆状真铃虫和缩短原纹虫的丰度自西向东逐渐下降, 丰度高值主要出现在1—7号站, 耳瓶瓮状虫的丰度在整个断面上较稳定, 丰度值与其他3个种类相比也相对较小(图 4)。
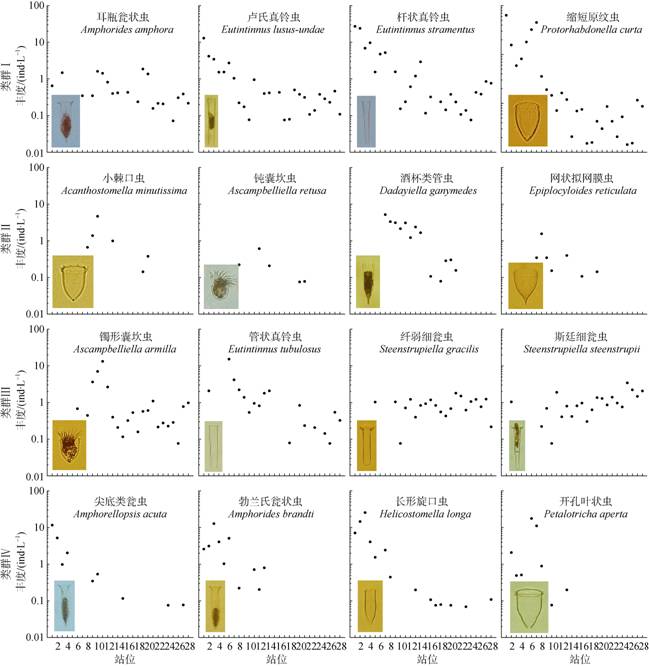 |
| 图 4 根据丰度分布模式划分的4种不同类群代表种砂壳纤毛虫丰度沿断面的分布 Fig. 4 Abundance variation of some typical species in different tintinnid groups along the transect |
类群Ⅱ有12种, 主要出现在黑潮区域, 丰度自西向东逐渐降低。酒杯类管虫出现站位数(13个)最多, 丰度高值出现在7—14号站, 其余种类出现站位数较少(图 4)。
类群Ⅲ有10种, 主要出现在黑潮区域和大洋区域。镯形囊坎虫的丰度高值出现在9—12号站, 其他站位上的丰度相对较低; 管状真铃虫的丰度最高值出现在6号站, 往东侧丰度逐渐降低; 纤弱细瓮虫和斯廷细瓮虫的丰度总体来说较为稳定(图 4)。
类群Ⅳ有7种, 有的种只分布于大洋边缘区域; 有的种丰度高值出现在大洋边缘区域, 在其他两个区域丰度极低(图 4)。尖底类瓮虫、勃兰氏瓮状虫和长形旋口虫的丰度自西向东逐渐下降, 开孔叶状虫的丰度在大洋边缘区域波动较大, 丰度最大值可达17.65 ind·L–1, 最小值仅有0.08 ind·L–1。尖底类瓮虫和长形旋口虫在8号站以东虽然有分布, 它们与类群Ⅰ的区别在于在断面东部出现站位数极少。
2.4 各类群种丰富度、丰度和丰度比例沿断面的变化除偶见种外, 不同类群的种丰富度、丰度和丰度比例自西向东有明显的变化(图 3)。类群Ⅰ的种丰富度较稳定, 丰度和丰度比例自西向东逐渐减小, 大洋边缘区域站位的丰度显著高于其他站位, 1号站最高为105.42 ind·L–1, 8号站以东的站位丰度值均小于5 ind·L–1。虽然1号站的丰度最高, 但是其丰度比例(75.90%)却低于5号站(85.42%)(图 3)。
类群Ⅱ的种丰富度在黑潮区域最高, 其两侧有所下降; 丰度比例较高(> 15.90%)的站位为7—14站, 与其他3个类群相比丰度较低; 在13号站的丰度比例最高(44.58%), 该比例高于该站其他3个类群的丰度比例(图 3)。
类群Ⅲ主要出现在大洋区域, 它的丰度在各站位之间较为稳定, 种丰富度和丰度比例自西向东呈上升趋势, 自15号站往东成为绝对的优势类群。类群Ⅳ种丰富度、丰度和丰度比例在1—7号站较高, 其中3号站丰度(40.33 ind·L–1)和丰度比例(69.49%)均达到最大值(图 3)。
根据砂壳纤毛虫各类群在群落中的组成以及各站位所处的空间位置, 沿断面的砂壳纤毛虫群落可以分为大洋边缘群落、黑潮群落和大洋群落。大洋边缘群落(1—7号站)中类群Ⅰ和类群Ⅳ是主要组成部分, 类群Ⅰ的丰度比例大于类群Ⅳ; 黑潮群落(8—14号站)中类群Ⅰ、类群Ⅱ和类群Ⅲ均有存在, 类群Ⅰ和类群Ⅲ的丰度高于类群Ⅱ; 大洋群落(15—28号站)中类群Ⅰ和类群Ⅲ是主要组成部分, 类群Ⅲ丰度比例最大(> 55%)。
2.5 砂壳纤毛虫总丰度和环境因子的关系砂壳纤毛虫丰度与温度和盐度呈显著负相关, 与叶绿素a浓度呈显著正相关(P < 0.01, 表 2)。随着温度升高, 砂壳纤毛虫丰度逐渐降低(图 5)。7号站与8号站处于盐度锋面上, 盐度相差可达2.8。1— 7号站之间的盐度差值仅有0.6, 丰度差值却高达107.25 ind·L–1; 8—28号站的盐度差值为2.0, 丰度差值仅有24.86 ind·L–1 (图 5)。在叶绿素a浓度为0~0.2 μg/L的区间内, 砂壳纤毛虫丰度随叶绿素a浓度升高而增大, 在叶绿素a浓度大于0.2 μg/L后, 砂壳纤毛虫丰度维持在较高水平(图 5)。
| 温度 | 盐度 | 叶绿素a浓度 | |
| 丰度 | –0.860** | –0.854** | 0.888** |
| 注: **表示相关性极显著(P < 0.01) | |||
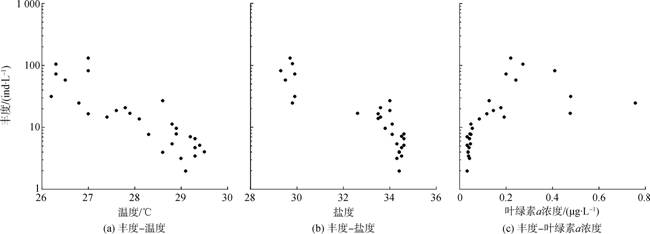 |
| 图 5 砂壳纤毛虫丰度与温度(a)、盐度(b)和叶绿素a浓度(c)之间的关系 Fig. 5 Relationships between tintinnid abundance and temperature, salinity and Chlorophyll a concentration |
我们的研究结果显示在大洋边缘区域、黑潮区域和大洋区域中, 砂壳纤毛虫群落具有明显差异。在黑潮群落中有不同于其两侧的种类, 这一结果与我们的假设相符。在黑潮群落的近岸一侧, 盐度锋面可以作为其边界; 而其大洋一侧没有明显的温度盐度锋面作为界限, 但是可以根据黑潮的历史路径推测大致在14号站附近。同水文资料没有明显过渡类似, 黑潮群落向大洋群落的过渡也没有明显的边界, 是逐渐变化的过程。类群Ⅱ种类在黑潮群落占主导地位, 在大洋群落中零星出现, 一直到断面东部还有少量存在。
黑潮源于北赤道流, 浮游动物具有生物多样性高的特点。黑潮会对东海浮游动物群落进行暖水种的输运, 东海浮游动物多样性随受黑潮影响程度的逐渐减弱而降低[5]。本研究中, 黑潮区域不仅有其他三个类群的砂壳纤毛虫种类, 还有主要在黑潮区域分布的类群Ⅱ种类, 所以砂壳纤毛虫种丰富度在黑潮区域最高。
主要分布在大洋边缘区域的类群Ⅳ种类, 根据砂壳纤毛虫在属的水平上的地理分布类型划分, 长形旋口虫、套篮类杯虫和三亚类杯虫为近岸型, 尖底类瓮虫和勃兰氏瓮状虫属为广布型, 梯状网梯虫和开孔叶状虫为暖水型[16-17]。但是, 在属的水平上划分的生物地理分布类型并不是绝对的, 同一属内的种类分布模式并不相同。本研究中, 我们在种的水平上对砂壳纤毛虫的地理分布模式进行了探究。三亚类杯虫、套篮类杯虫只在出现4个站位中出现, 且丰度最大值在大洋边缘区域。勃兰氏瓮状虫和开孔叶状虫在东海的调查中也被检出, 丰度极低[8]。本研究中其丰度高于东海, 在近岸向大洋扩散的过程中逐渐降低, 所以勃兰氏瓮状虫和开孔叶状虫可能为近岸种类。长形旋口虫和尖底类瓮虫是黄海丰度较大的种, 最大丰度分别可达169.5 ind·L–1和1 623.3 ind·L–1[6], 它们在本研究中一直扩散到断面的最东端, 但是丰度很低。在东海的研究中, 尖底类瓮虫也有分布, 其丰度在近岸最高, 向大洋扩散丰度逐渐降低[8], 本研究的结果与之相似, 所以尖底类瓮虫是近岸种类。Kim等[18]将梯状网梯虫作为大洋暖水入侵的指示种, 该种在东海也有出现且丰度极低[8], 本研究中梯状网梯虫仅在大洋边缘区域靠近黄海的三个站位中出现, 所以将其作为大洋暖水入侵的指示种还需要进一步的研究。
主要在黑潮区域出现的类群Ⅱ种类在东海近岸也有分布, 小棘口虫、钝囊坎虫、酒杯类管虫和网状拟网膜虫在2013年8月丰度最高, 分别为29.9 ind·L–1、6.6 ind·L–1、68.6 ind·L–1和74.7 ind·L–1, 在向北扩散的时候丰度逐渐降低[8]。本文中以上种类的丰度远低于东海的研究, 原因可能是我们的采样站位更靠北, 也有可能是本调查在9月份进行造成的。在东海, 这些种类的分布范围扩散到黑潮主轴以外到达水深50 m的地方, 最大丰度的分布区远离黑潮主轴[8], 而本文中丰度最大值处于黑潮主轴中, 这可能是地形或者黑潮影响海区的差异造成的。
酒杯类管虫在本文断面的北方也有分布, 在朝鲜半岛东岸的Yongil Bay[19], 南岸的Geoje岛近海[18]和日本海中部[9]都有过报道, 在日本东部海域, 这一种类被认为是黑潮的指示种[20]。本研究中酒杯类管虫分布区狭窄, 丰度高值出现在黑潮区域, 在大洋区域丰度极低, 所以酒杯类管虫可以作为黑潮指示种类。根据Kim等[18]的报道, 网状拟网膜虫的分布纬度为28°N~32°N之间, 可以分布到朝鲜半岛南岸海区, 最大丰度达约17 ind·L–1, 但该种在日本海没有发现[9]。本研究中网状拟网膜虫分布范围较窄, 仅在黑潮影响的区域出现, 且丰度较低, 虽然与酒杯类管虫同属类群Ⅱ的种类, 但其能否作为黑潮指示种还要进一步研究。
类群Ⅰ的种类在低盐站位有分布, 而且有的种类在低盐站位中丰度较高, 而类群Ⅲ的种类在低盐站位较少出现, 因此盐度可能是影响它们分布的主要环境因子。类群Ⅰ和Ⅲ的种类在东海都有分布[8], 在日本海极少分布[9]。缩短原纹虫在黄、东海和日本海都没有报道[6, 8-9], 但是它在本文中丰度很大, 且分布广泛, 这一现象值得重视。
4 结论本研究首次穿过黑潮主轴采样, 发现黑潮区域砂壳纤毛虫种丰富度高于两侧, 有不同于两侧的种类。调查区域的砂壳纤毛虫分为4个类群, 其中类群Ⅱ主要分布在受黑潮影响较大的区域, 酒杯类管虫可以作为黑潮的指示种。不同类群在不同区域的丰度和丰度比例的分布模式各有差异, 使得黑潮区域砂壳纤毛虫群落不同于其两侧海区。黑潮自菲律宾以东海区向北到达日本以东海区, 但本研究仅涵盖一部分黑潮区域, 对于受黑潮影响的其他海区还需进一步调查。
| [1] |
LYNN D
. The ciliated protozoa: characterization, classification, and guide to the literature[M]. 3rd edition. Heidelberg: Springer, 2008: 455.
|
| [2] |
徐兆礼. 中国近海浮游动物多样性研究的过去和未来[J]. 生物多样性, 2011, 19(6): 635-645. XU Zhaoli. The past and the future of zooplankton diversity studies in China seas[J]. Biodiversity Science, 2011, 19(6): 635-645. |
| [3] |
陈瑞祥, 林景宏. 中国近海浮游介形类大尺度生态研究Ⅱ. 浮游介形类与水系的相关研究[J]. 海洋学报, 1998, 20(2): 96-101. CHEN Ruixiang, LIN Jinghong. Large-scale ecological study on planktonic ostracoda in China's seas and adjacent waters. II. Correlation between planktonic ostracoda and water systems[J]. Acta Oceanologica Sinica, 1998, 20(2): 96-101. |
| [4] |
徐兆礼. 东海浮游介形类(Ostracods)分布特征[J]. 海洋学报, 2006, 28(2): 101-108. XU Zhaoli. Characteristics for distribution of pelagic Ostracods in the East China Sea[J]. Acta Oceanologica Sinica, 2006, 28(2): 101-108. |
| [5] |
陈洪举, 刘光兴, 黄有松. 黄、东海浮游动物物种多样性分布特征[J]. 中国海洋大学学报(自然科学版), 2015, 45(8): 46-51. CHEN Hongju, LIU Guangxing, HUANG Yousong. Spatial distribution character of zooplankton species diversity in the Yellow Sea and East China Sea[J]. Periodical of Ocean University of China, 2015, 45(8): 46-51. |
| [6] |
CHEN Xue, LI Haibo, ZHAO Yuan, et al. Distribution of different biogeographical tintinnids in Yellow Sea and Bohai Sea[J]. Journal of Ocean University of China, 2018, 17(2): 371-384. DOI:10.1007/s11802-018-3482-1 |
| [7] |
DOLAN J R, RITCHIE M E, RAS J. The "neutral" community structure of planktonic herbivores, tintinnid ciliates of the microzooplankton, across the SE Tropical Pacific Ocean[J]. Biogeosciences Discussions, 2007, 4(3): 297-310. DOI:10.5194/bg-4-297-2007 |
| [8] |
LI Haibo, ZHAO Yuan, CHEN Xue, et al. Interaction between neritic and warm water tintinnids in surface waters of East China Sea[J]. Deep Sea Research II, 2016, 124: 84-92. DOI:10.1016/j.dsr2.2015.06.008 |
| [9] |
LI Haibo, XU Zhiqiang, ZHANG Wuchang, et al. Boreal tintinnid assemblage in the Northwest Pacific and its connection with the Japan Sea in Summer 2014[J]. PloS One, 2016, 11(4): e0153379. DOI:10.1371/journal.pone.0153379 |
| [10] |
KOFOID C A, CAMPBELL A S
. A conspectus of the marine and freshwater Ciliata belonging to suborder Tintinnoinea, with descriptions of the new species, principally from the Agassiz Expedition to the Eastern Tropical Pacific, 1904-1905[M]. Oakland, California, USA: Univer;sity of California Press, 1929: 1-403.
|
| [11] |
KOFOID C A, CAMPBELL A S. Reports on the scientific results of the expedition to the eastern tropical Pacific, incharge of Alexander Agassiz, by the U. S. Fish Commission Steamer "Albatross", from October, 1904, to March, 1905, Lieut.-Commander L. M. Garrett, U. S. N. Commanding. XXXVII. The Ciliata: The Tintinnoinea[J]. Bulletin of the Museum of Comparative Zoology of Harvard College, 1939, 84: 1-473, 471-436. |
| [12] |
MARSHALL S M. Protozoa Order Tintinnida[M]// FRASER J H, HANSEN V K. Fiches d'Identification du Zooplankton[M]. Denmark: Conseil International pour l'Exploration de la Mer, Copenhagen, 1969: 117- 127.
|
| [13] |
张武昌, 丰美萍, 于莹, 等. 世界今生砂壳纤毛虫名录[J]. 生物多样性, 2011, 19(6): 655-660. ZHANG Wuchang, FENG Meiping, YU Ying, et al. Species checklist of contemporary tintinnids (Ciliophora, Spirotrichea, Choreotrichia, Tintinnida) in the world[J]. Biodiversity Science, 2011, 19(6): 655-660. |
| [14] |
张武昌, 丰美萍, 于莹, 等
. 砂壳纤毛虫图谱[M]. 北京: 科学出版社, 2012: 499. ZHANG Wuchang, FENG Meiping, YU Ying, et al . An illustrated guide to contemporary tintinnids in the world[M]. Beijing: Science Press, 2012: 499. |
| [15] |
徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15. XU Zhaoli, CHEN Yaqu. Aggregated intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea[J]. Journal of Ecology, 1989, 8(4): 13-15. |
| [16] |
DOLAN J R, MONTAGNES D J S, AGATHA S, et al
. Biology and ecology of tintinnid ciliates: models for marine plankton[M]. Oxford: Wiley–Blackwell, 2013: 296.
|
| [17] |
PIERCE R W, TURNER J T. Global biogeography of marine tintinnids[J]. Marine Ecology Progress Series, 1993, 94: 11-26. DOI:10.3354/meps094011 |
| [18] |
KIM Y O, SHIN K, JANG P G, et al. Tintinnid species as biological indicators for monitoring intrusion of the warm oceanic waters into Korean coastal waters[J]. Ocean Science Journal, 2012, 47(3): 161-172. DOI:10.1007/s12601-012-0016-4 |
| [19] |
YOO K I, KIM Y O. Taxonomical studies on tintinnids (Protozoa: Ciliata) in Korean coastal waters, 2. Yongil Bay[J]. Korean Journal of Systematic Zoology, 1990, 6: 87-122. |
| [20] |
KATO S, TANIGUCHI A. Tintinnid ciliates as indicator species of different water masses in the western North Pacific Polar Front[J]. Fisheries Oceanography, 1993, 2: 166-174. |
 2022, Vol. 46
2022, Vol. 46


