文章信息
- 尚浩江, 周伟, 胡传明, 申欣, 朱朋昌, 李帅. 2022.
- SHANG Hao-jiang, ZHOU Wei, HU Chuan-ming, SHEN Xin, ZHU Peng-chang, LI Shuai. 2022.
- 光照强度对条斑紫菜贝壳丝状体培养的影响
- Influence of distinctive light intensities on the conchocelis of Neopyropia yezoensis
- 海洋科学, 46(2): 37-45
- Marina Sciences, 46(2): 37-45.
- http://dx.doi.org/10.11759/hykx20210407002
-
文章历史
- 收稿日期:2021-04-07
- 修回日期:2021-10-15
2. 江苏省海洋水产研究所, 江苏 南通, 226007;
3. 上海海洋大学, 上海 201306
2. Jiangsu Marine Fisheries Research Institute, Nantong 226007, China;
3. Shanghai Ocean University, Shanghai 201306, China
条斑紫菜(Neopyropia yezoensis)属红藻门(Rhodophyta), 红藻纲(Rhodophyceae), 红毛菜科(Bangiaceae), Neopyropia属[1], 主要分布于中国浙江舟山群岛以北的东海北部和黄、渤海沿岸、包括日本列岛和朝鲜半岛沿岸等, 是日本、韩国和中国长江以北紫菜人工栽培紫菜的主要种类[2]。2019—2020年条斑紫菜育苗面积102×104 m2, 栽培面积达4.67× 108 m2, 行业年总产量达2×1011元左右(江苏省紫菜协会2020年数据)。在条斑紫菜贝壳丝状体的人工培育过程中, 光照强度的调节对丝状体的生长发育与壳孢子放散起到重要作用, 光照强度过低藻体生长缓慢, 过高则会抑制藻体的光合作用和生长速率[3]。条斑紫菜的配子体世代为叶状体, 孢子体世代为丝状体[4], 自然环境下条斑紫菜的孢子体生长在水下贝壳基质中, 所接受的光照强度较低; 而其配子体生长在潮间带的岩石上, 当潮水退却后就暴露在高光强的生境中。有研究表明, 紫菜配子体阶段过多的激发能可以在PS II与PS I间协调分配, 而在孢子体阶段, 这种协调关系不明显[5], 这可能是紫菜孢子体耐受光强低于配子体的原因之一。
贝壳丝状体的培养光源和培养方式各不相同, 报道的适宜光强也有较大差异。尾形英二等[6]研究表明2 000 Lx的自然光是贝壳丝状体生长的合适光强; 郑宝福等[7]研究显示贝壳丝状体在1 500~6 000 Lx自然光范围内均可较好地生长; 张学成等[8]报道在21 ℃~23 ℃, 14L︰10D光周期的荧光灯条件下, 10~ 200 μmol/m2/s是贝壳丝状体生长的合适光强; 许璞[9]报道2 500~3 000 Lx自然光为适合贝壳丝状体生长的光强; 吕峰等[10]研究表明在18 ℃, 14L︰10D光周期的荧光灯条件下, 10 μmol/(m2·s)是贝壳丝状体生长的适宜光强; 朱建一等[4]报道, 3 000 Lx自然光是贝壳丝状体的适宜光强。上述研究的差异易造成种苗生产中光照条件的管理混乱, 因此有必要针对条斑紫菜种苗不同阶段的适宜光强开展进一步研究, 为条斑紫菜种苗生产中的光照控制理论提供依据, 对条斑紫菜育苗有着指导性意义。
1 材料与方法 1.1 实验材料供试条斑紫菜自由丝状体取自国家级紫菜种质推广品系Y-9101品系, 接种贝壳为文蛤壳。
1.2 实验器材丙林MGZ-120B-3光照培养箱、Nikon-E800生物显微镜、JSM-6510扫描电镜、WALZ-UKEA0388叶绿素荧光仪PAM、远方SFIM-300光谱闪烁照度计、搅拌机、柯尼卡CM-700D色差计等。
1.3 实验方法 1.3.1 丝状体接种与培养将Y-9101条斑紫菜自由丝状体打碎成40~60 μm小段, 接种于放置15枚规格一致的文蛤壳的培养盒内, 接种密度为150个/cm2, 照度计放入培养盒内测量光照值, 设置1.3±1.0、6.3±1.0、12.5±1.0、18.8± 1.0和25±1.0 μmol/(m2·s)5个梯度的光照强度, 培养光源为拟全光谱荧光灯(图 1), 培养温度16 ℃, 海水盐度27‰, 光照周期12D︰12L, 另设一个自然环境对照组(光照强度在1.3~(12.5±1) μmol/(m2·s)之间, 温度与光周期随南通市环境变化而变化)。
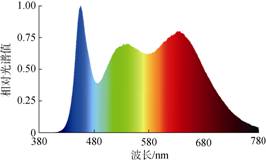 |
| 图 1 培养光源相对光谱曲线 Fig. 1 Relative spectral curve of the cultivation light source |
接种后每周观察丝状体着生情况, 接种6周后肉眼观察, 计数贝壳上的藻斑数量, 计算着生密度(着生密度=藻斑数/贝壳面积), 从而计算出着生效率(着生密度/接种密度, %)。
1.3.3 水平生长面积与纵向生长长度的测定接种2周起测量贝壳丝状体的藻斑直径(藻斑近似圆形), 至藻斑生长交连到一起时停止测量。分别于第55 d与第100 d将贝壳压碎后, 每组随机选取30个藻斑纵切面采用扫描电镜测量纵向生长长度。
1.3.4 光合活性及色度值测定 1.3.4.1 色度值测定接种50 d后, 采用柯尼卡CM-700D色差计测量藻斑色度值。测量采用ø3 mm的目标罩, 选择10°角标准观察者(CIE1964), 光源为D65标准光源, 采用SCI模式(包含镜面反射光), 测得L*、a*、b*值, L*值表示明度, 范围在0(黑)~100(白), 值越大, 色越亮; a*值表示绿色值/红色值, 正值为红色; b*值表示蓝色/黄色值, 正值为黄色。
1.3.4.2 最大量子效率测定样品在测试前暗处理2 h, 将光纤探头直接置于贝壳表面进行测定。先打开测量光(约0.3 μmol/ (m2·s)), 测得最小荧光值(Fo), 随后提供0.88 s约4 000 μmol/(m2·s)饱和脉冲光, 测得最大荧光值(Fm), 最大量子效率(Fv/Fm)计算公式: Fv/Fm=(Fm–Fo)/ Fm, Fv为可变荧光。
1.3.5 贝壳丝状体壳孢子放散测量将接种120 d的贝壳每组取4枚清洗干净, 放入装有50 mL海水的烧杯中, 在(31.3±1) μmol/(m2·s)光强, 12L︰12D的光照培养箱内培养2周, 诱导壳孢子放散。培养2周后, 连续20 d每天下午14: 00测定各光强组壳孢子放散量[11]。放散期培养温度为16 ℃, 光照条件为7: 00—12: 30光强(31.3±1) μmol/(m2·s), 12: 30—18: 30光强(6.3±1) μmol/(m2·s), 18: 30~次日7: 00黑暗条件。计数后清洗贝壳表面, 更换培养海水。
1.3.6 实验数据处理各组实验数据采用GraphPad Prism 7(GraphPad Software Inc., 美国)进行处理。数据显著性分析采用SPSS 22(IBM, 美国)进行单因素方差分析, 设置显著水平P < 0.05。
2 结果 2.1 光强对条斑紫菜贝壳丝状体着生的影响通过扫描电镜及光学显微镜观察, 丝状体藻段接种贝壳基质后, 先将一端粘附在基质表面, 然后从粘附的一端钻入基质中, 钻入方式由接触基质的方式决定, 因此被丝状体着生的贝壳表面出现圆形、椭圆形以及不规则的孔洞(图 2a)。贝壳丝状体形态与自由丝状体差异较大, 主分枝多于2条, 向四周辐射生长, 侧枝多呈对生, 且多出现不定形隆起(图 2b、2c), 纵向主要生长于珍珠层内, 有少量藻丝深入棱柱层(图 2d)。
 |
| 图 2 贝壳丝状体着生于贝壳表面与切面图 Fig. 2 Surface and longitudinal section photographs of N. yezoensis shell conchocelis a. 丝状体钻入贝壳后贝壳表面电镜照片, 标尺=10 μm; b. 贝壳丝状体横向显微照片, 标尺=50 μm; c. 孢子囊枝阶段贝壳的纵切面, 标尺=50 μm; d. 丝状藻丝阶段贝壳纵切面, 标尺=50 μm a. SEM photograph of the shell surface after conchocelis drilling into the shell, scale bar=10 μm; b. Micrographic section of the conchocelis, scale bar=50 μm; c. SEM photograph of the longitudinal sections of the shell under the sporangial branchlets stage, scale bar=50 μm; d. SEM photograph of the longitudinal sections of the shell under the vegetative stage, scale bar=50 μm |
不同实验组均采用相同接种密度, 通过测量着生密度计算与分析不同光强下贝壳丝状体的着生效率。结果显示, 18.8 μmol/(m2·s)光照强度下丝状体着生效率最大, 为(5.6±1)%, 着生密度达(8.4±1.55)个/cm2, 其次为12.5、6.3、25 μmol/(m2·s), 着生效率平均为6.1个/cm2, 1.3 μmol/(m2·s)下着生效率最低, 为(1.1± 0.9)%(图 3)。
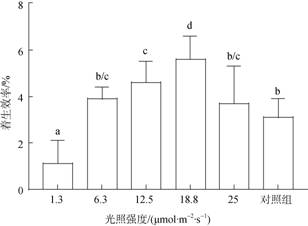 |
| 图 3 不同光照强度下条斑紫菜贝壳丝状体着生效率 Fig. 3 Implanting efficiency of N. yezoensis shell conchocelis at different light intensities 相同大写字母表示不同组间未达显著差异水平(P > 0.05), 下图同 The same capital letters indicated that there was no significant difference between groups (P > 0.05), the same below |
通过对贝壳丝状体水平和纵向生长的连续观测, 分析光强对贝壳丝状体在贝壳中不同发育时期的分布情况。结果如表 1所示。
| 培养光强/(μmol·m–2·s–1) | 培养时间/d | 生长情况 |
| 6.3~25.0 | 10 | 丝状体钻入贝壳 |
| 6.3~25.0 | 14 | 形成藻斑 |
| 1.3 | 28 | 丝状体钻入贝壳 |
| 6.3~25.0 | 30 | 藻斑肉眼可见 |
| 6.3~18.8 | 35 | 水平方向快速生长 |
| 1.3 | 50 | 藻斑肉眼可见 |
| 18.8 | 70 | 藻斑相互重叠 |
根据第70天贝壳丝状体水平生长面积计算各组生长速率: 对照 > 6.3 > 12.5 > 18.8 > 25.0 > 1.3 μmol/(m2·s) (P < 0.05), 即处理组中, 6.3 μmol/(m2·s)生长速度最快, 达到86.6±22.7 μm/d, 1.3 μmol/(m2·s)最慢, 为29.7± 12.5 μm/d。
在接种后55 d, 贝壳丝状体仍多处于营养藻丝阶段, 光强越高, 钻入深度越深, 贝壳丝状体在25.0 μmol/(m2·s)光强下钻入的深度最深, 达(68.6±28.9) μm, 1.3 μmol/(m2·s)光强下最浅, 达(14.2±6.6) μm(图 4)。
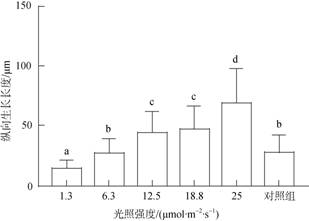 |
| 图 4 接种后55 d不同光强下条斑紫菜贝壳丝状体营养藻丝纵向生长长度 Fig. 4 Longitudinal growth length of N. yezoensis shell conchocelis under the vegetative stage with varied light intensities after 55 days of the implantation |
接种100 d后贝壳丝状体由营养藻丝大多发育为孢子囊枝, 在6.3~18.8 μmol/(m2·s)光强范围内, 孢子囊枝的分布深度基本一致, 为(73±17.7) μm, 高于对照组的(55.4±16.5) μm, 25.0 μmol/(m2·s)光强下钻入深度达到(88.6±36.1) μm(图 5)。
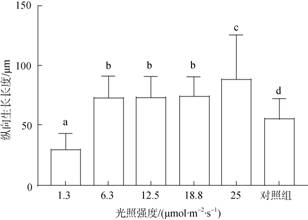 |
| 图 5 接种后100 d不同光强下条斑紫菜贝壳丝状体孢子囊枝纵向生长长度 Fig. 5 Longitudinal growth length of N. yezoensis shell conchocelis under the sporangia branches stage at different light intensities after 100 days of the implantation |
为了研究光强对贝壳丝状体颜色的影响, 采用色差计对培养8周的贝壳丝状体藻斑进行色度值检测。检测结果显示, 6.3~18.8 μmol/(m2·s)光强下丝状体同对照组的L*值无显著性差异, 肉眼可见各组颜色趋于一致, 为黑色; 25.0 μmol/(m2·s)光强下的L*值最大, 藻斑颜色呈浅黄色; 将25.0 μmol/(m2·s)光强下培养的贝壳丝状体放入12.5 μmol/(m2·s)光强下培养2周后, L*值降低, 丝状体颜色变深(图 6)。
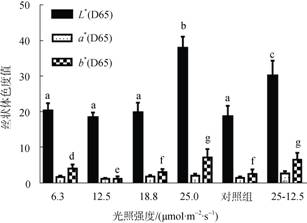 |
| 图 6 不同光强下条斑紫菜贝壳丝状体色度值 Fig. 6 Chromatic value of N. yezoensis shell conchocelis at different light intensities |
应用WALZ-UKEA0388叶绿素荧光仪PAM分析不同光照强度对接种60 d后贝壳丝状体光合活性的影响。结果显示, 贝壳丝状体的实际量子效率和最大光化学量子效率在1.3~18.8 μmol/(m2·s)呈上升趋势, 随光强的升高呈现先上升后下降的趋势, 在18.8 μmol/(m2·s)光强条件下最高, 达到0.59±0.02。25.0 μmol/(m2·s)光强条件下培育贝壳丝状体的Fv/Fm低于1.3 μmol/m2/s光强条件下培育的贝壳丝状体, 为0.48±0.02。为了验证贝壳丝状体在18.8~25.0 μmol/ (m2·s)光强间的光合活性变化趋势, 将18.8 μmol/(m2·s)处理条件下部分接种8周的贝壳放入22.5 μmol/(m2·s)光强下培养2周, 其Fv/Fm值下降为0.52±0.01, 贝壳丝状体在18.8~25 μmol/(m2·s)光强范围内的Fv/Fm值随光强的升高而降低(图 7)。
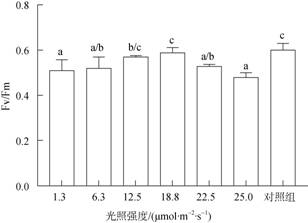 |
| 图 7 不同光强下条斑紫菜贝壳丝状体PS II最大光化学量子效率(Fv/Fm) Fig. 7 Maximum photochemical efficiency (Fv/Fm) of N. yezoensis shell conchocelis at different light intensities |
为了研究不同光强培养下的贝壳丝状体壳孢子放散水平, 连续20 d测定了每个贝壳日放散量。结果显示, 从14 d内壳孢子平均日放散量由大至小为: 对照 > 18.8 > 6.3 > 12.5 > 25.0 > 1.3 μmol/(m2·s), 即除对照组外, 18.8 μmol/(m2·s)光强下的平均日放散量最大, 达14 746个, 1.3 μmol/m2/s光强下的平均日放散量最小, 为4 760个。生产上将日放散量达1 000~ 10 000个时, 作为贝壳丝状体即将出现更高数量级放散的先兆[12], 因此本研究将日放散量大于10 000个的天数计为放散高峰日, 通过对放散高峰日的统计发现, 放散高峰天数由多至少为: 18.8 > 对照 > 6.3 > 12.5=25.0 > 1.3 μmol/ (m2·s), 18.8 μmol/(m2·s)放散高峰天数为12 d, 1.3 μmol/ (m2·s)放散高峰天数为3 d (图 8)。
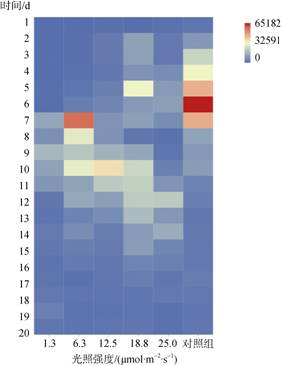 |
| 图 8 不同光强下条斑紫菜贝壳丝状体壳孢子放散量 Fig. 8 Release amount of N. yezoensis shell conchospores at different light intensities |
光照和温度的交互作用对藻类生长具有重要影响, JIANG等[13]报道在低温环境下, 高光强对蓝藻有很强的抑制作用, 温度升高可增加蓝藻对高光强环境的适应能力。阮紫曦等[14]报道, 温度和光强对拟柱孢藻存在显著的交互作用, 光照对生长速率的影响强度与温度有关, 生长速率对温度的响应取决于光强。因此本研究为了探讨光照强度对条斑紫菜贝壳丝状体的影响, 从丝状体接种至壳孢子放散各阶段培育温度均设为16 ℃, 排除了温度变化引起的交互影响。任国忠等[15]报道条斑紫菜营养藻丝在5 ℃~ 30 ℃、孢子囊枝在12.5 ℃~30 ℃、壳孢子在12.5 ℃~ 22.5 ℃范围内均可生长。本研究表明, 16 ℃下条斑紫菜贝壳丝状体可以发育成孢子囊枝并放散壳孢子。
一些藻类可以通过调整其在水体中的深度, 从而达到调节光照强度的目的[16], 如衣藻(Chlamydomonas)在低中光强的环境下表现为正向的趋光性, 在高光强环境中表现为负向的趋光性[17]。紫菜贝壳丝状体的自然生长阶段正值光强较高的夏季, 丝状体通过钻入贝壳基质达到调节光照强度的目的。本研究条斑紫菜贝壳丝状体培育初期, 随着光照强度的增加, 丝状体钻入文蛤贝壳深度增加, 但纵向生长深度基本不超过珍珠层厚度, 只有少量藻丝进入棱柱层, 而相同条件培养下, 丝状体可穿透厚度为300~400 μm的海月贝壳生长, 海月贝壳为方解石结构, 可见光范围内的透光率达80%[18], 文蛤壳珍珠层为文石结构, 棱柱层为方解石结构[19]本研究采用10%浓盐酸溶解文蛤壳外壳角质层, 测得珍珠层与棱柱层透光率达15%±3%, 再溶解棱柱层后测得珍珠层透光率达36%±2%, 因此贝壳丝状体的钻入深度可能与培养基质的结构和透光性相关。
过高的光强会抑制藻体的光合作用和生长速率, 光强越高抑制作用越强。汤文仲等[20]报道长石莼的Fv/Fm值在18~72 μmol/(m2·s)光强范围内随光强增加而升高, 当光强范围提高至72~216 μmol/(m2·s)时, 长石莼的Fv/Fm值随光强增加而下降。张玉荣等[21]报道铜藻幼苗在受到强光胁迫时其Fv/Fm值降至0.4, 当光强减弱后, Fv/Fm值可恢复到初始值0.73。在魏家慧等[22]报道中, 条斑紫菜的营养藻丝和孢子囊枝在15 ℃, 40 μmol/(m2·s)(该研究中最低培养光强)环境下培养3 d, 其Fv/Fm值达0.14与0.19, 均高于100和300 μmol/(m2·s)处理组, 且营养藻丝和孢子囊枝的的Fv/Fm值随光强的升高而降低。而本研究中贝壳丝状体在1.3~18.8 μmol/(m2·s)光强范围内的Fv/Fm值随光强增加而增加, 其后随光照强度的升高而降低, 25 μmol/m2/s下的Fv/Fm值为0.48, 仍高于上述40 μmol/(m2·s)时的Fv/Fm值。因此, 贝壳丝状体的Fv/Fm随着光强增加呈现先上升后下降趋势, 并于18.8 μmol/(m2·s)时达到最大。张涛等[23]研究表明, 条斑紫菜丝状体在20 μmol/(m2·s)光强的叶绿素荧光参数最大, 后随光强的增高而降低, 这与本研究在18.8~25 μmol/(m2·s)光强下条斑紫菜丝状体叶绿素荧光参数的变化趋势一致。
在紫菜育苗过程中, 丝状体的颜色在一定程度上反应了藻体的生长情况。朱建一等[4]和许璞等[9]报道中, 健康的条斑紫菜贝壳丝状体呈紫黑色。孙维华[24]报道中, 正常的紫菜丝状体的颜色呈紫褐色, 光照强度过低时丝状体呈苍白色, 光照强度过高时丝状体呈桃红色。唐兴本等[25]报道, 贝壳丝状体在淡水环境或光照强度过低的条件下, 贝壳丝状体呈紫红色。本实验中, 光强越高, 贝壳丝状体钻入贝壳深度越大。在1.3 μmol/(m2·s)下贝壳丝状体钻入深度为28.9±14.4 μm, 藻斑颜色偏灰黑; 25.0 μmol/(m2·s)光强下钻入深度达88.6±36.1 μm, 少量藻丝进入棱柱层, 藻斑颜色偏浅黄, 当光强由25.0降低到12.5 μmol/(m2·s)培养2周后, 藻斑颜色变深。在6.3~18.8 μmol/(m2·s)光强范围内, 贝壳丝状体水平生长速率高于其他处理组, 且钻入文蛤壳的深度与藻斑颜色趋于一致, 深度达73±17.7 μm, 颜色呈黑色。说明6.3~18.8 μmol/(m2·s)光强范围为贝壳丝状体的适宜生长光照范围。
光照强度是条斑紫菜生长的重要因素, 条斑紫菜在不同生长阶段的光照强度和温度均不相同。朱建一等[4, 26]报道条斑紫菜自由丝状体的适宜培养光强为1 200~2 200 Lx, 贝壳丝状体营养藻丝的适宜生长光强为3 000 Lx, 孢子囊枝阶段的适宜光强为1 500 Lx; 孔晓锐等[27]报道条斑紫菜壳孢子放散时的适宜光照为27 μmol/(m2·s)。本研究的结果显示, 条斑紫菜贝壳丝状体的适宜光照强度为6.3~18.8 μmol/(m2·s), 低于朱建一等[26]报道的自由丝状体适宜生长光强范围, 推测是由于贝壳丝状体较自由丝状体受光均匀, 透光性较强的缘故。
在生产性育苗过程中, 贝壳丝状体接受光照强度受天气、育苗池空间布置等原因易出现较大波动, 且光强测量位置、方向的不同均会引起较大的误差, 因此, 光照强度的调节应进行固定方位的周期性记录, 以提高准确性。同时贝壳育苗池内会因水质、种质等原因容易造成硅藻等杂藻污染, 附着在贝壳表面的杂藻可间接调节光照强度, 光照强度越大, 贝壳表面附生的硅藻量越大, 从而降低贝壳丝状体的光照强度。因此, 在实际生产中, 光线强度的调节需要综合光照强度、天气、育苗池的空间分布、杂藻、贝壳洗刷成本等各种因素。
4 结论本研究结果显示, 条斑紫菜丝状体着生的最适光照强度范围为6.3~18.8 μmol/(m2·s)。从贝壳丝状体的着生效率、生长速度、光合生理及壳孢子放散量来看, 18.8 μmol/(m2·s)更有利于丝状体的着生, 而在1.3与25.0 μmol/(m2·s)光强下丝状体着生效率及生长发育水平均处于低水平状态。
| [1] |
YANG L E, DENG Y Y, RUSSEL S, et al. Redefining Pyropia (Bangiales, Rhodophyta): four new genera, resurrection of Porphyrella and description of Calidia pseudolobata sp. nov. from China[J]. Journal of Phy cology, 2020, 56(4): 862-879. |
| [2] |
张学成, 秦松, 马家海, 等
. 海藻遗传学[M]. 北京: 农业出版社, 2005: 184-187. ZHANG Xuecheng, QIN Song, MA Jiahai, et al . The genetics of marine algae[M]. Beijing: Agricultural Press, 2005: 184-187. |
| [3] |
Kok B. On the inhibition of photosynthesis by intense light[J]. Biochimica Et Biophysica Acta, 1956, 21(2): 234-244. DOI:10.1016/0006-3002(56)90003-8 |
| [4] |
朱建一, 严兴洪, 丁兰平, 等
. 中国紫菜原色图集[M]. 北京: 中国农业出版社, 2017: 59-106. ZHU Jianyi, YAN Xinghong, DING Lanping, et al . Color atlas of Chinese laver[M]. Beijing: China Agriculture Press, 2017: 59-106. |
| [5] |
潘洁, 施定基, 陈建新, 等. 紫菜两个光系统间激发能分配研究对光合进化的启示[J]. 科学通报, 2000, 45(12): 1276. PAN Jie, SHI Dingji, CHEN Jianxin, et al. Study on excitation energy distribution between two Pyropia and its enlightenment to photosynthetic evolution[J]. Chinese Science Bulletin, 2000, 45(12): 1276. DOI:10.3321/j.issn:0023-074X.2000.12.009 |
| [6] |
尾形英二. ノリ糸状体の生長に関する研究[J]. 水讲研究报告, 1961, 10(3): 423-500. EIJI O. Study on the growth of Pyropia yezoensis conchocelis[J]. Water Lecture Research Report, 1961, 10(3): 423-500. |
| [7] |
郑宝福, 陈美琴, 费修绠. 培养光强对条斑紫菜丝状体生长发育的影响[J]. 海洋与湖沼, 1980, 1(4): 362-369. ZHENG Baofu, CHEN Meiqin, FEI Xiugeng. Effects of culture light intensity on the growth and development of Pyropia yezoensis conchocelis[J]. Oceanologia et Limnologia Sinica, 1980, 1(4): 362-369. |
| [8] |
ZHANG X C, BRAMMER E, MARIANNE P, et al. Effects of light photon flux density and spectral quality on photosynthesis and respiration in Porphyra yezoensis(Bangiales, Rhodophyta)[J]. Phycological Research, 2010, 45(1): 29-37. |
| [9] |
许璞, 张学成, 王素娟
. 中国主要经济海藻的繁殖与发育[M]. 北京: 中国农业出版社, 2013: 118-121. XU Pu, ZHANG Xuecheng, WANG Sujuan . Reproduction and development of major economic marine algae in China[M]. Beijing: China Agriculture Press, 2013: 118-121. |
| [10] |
吕峰, 严兴洪, 王小红, 等. 移植量、光密度及温度对条斑紫菜不同品系壳孢子放散量的影响[J]. 江苏农业科学, 2019, 47(10): 186-188. LV Feng, YAN Xinghong, WANG Xiaohong, et al. Effects of transplantation volume, optical density and temperature on the release of conchospores from different strains of Pyropia yezoensis[J]. Jiangsu Agricultural Sciences, 2019, 47(10): 186-188. |
| [11] |
付春辉, 严兴洪, 黄林彬, 等. 条斑紫菜(Porphyra yezoensis)选育品系壳孢子的放散量与耐高温性研究[J]. 海洋与湖沼, 2011, 42(3): 460-466. FU Chunhui, YAN Xinghong, HUANG Linbin, et al. Study on the release amount and high temperature tolerance of ascospores in the breeding line of Porphyra yezoensis[J]. Oceanologia et Limnologia Sinica, 2011, 42(3): 460-466. |
| [12] |
中国科学院海洋研究所
. 条斑紫菜的人工养殖[M]. 北京: 科学出版社, 1978: 23-108. Institute of Oceanology, Chinese Academy of Sciences . Artificial cultivation of Porphyra yezoensis[M]. Beijing: Science Press, 1978: 23-108. |
| [13] |
JIANG H, KONG R, XU X. The N-acetylmuramic acid 6-phosphate etherase gene promotes the growth and cell differentiation in cyanobacteria under light-limiting conditions[J]. Journal of Bacteriology, 2010, 192(8): 2239-2245. DOI:10.1128/JB.01661-09 |
| [14] |
阮紫曦, 于婷, 雷腊梅, 等. 光照-温度交互作用及不同氮源对拟柱孢藻生长的影响[J]. 热带亚热带植物学报, 2018, 26(2): 133-140. RUAN Zixi, YU Ting, LEI Lamei, et al. The effect of light-temperature interaction and different nitrogen sources on the growth of Cylindrosporium sp.[J]. Journal of Tropical and Subtropical Botany, 2018, 26(2): 133-140. |
| [15] |
任国忠, 曾呈奎, 崔广法, 等. 温度对条斑紫菜丝状体生长发育的影响[J]. 海洋科学, 1978, 1(2): 28-38. REN Guozhong, ZENG Chengkui, CUI Guangfa, et al. Effects of temperature on growth and development of Pyropia yezoensis filaments[J]. Marine Sciences, 1978, 1(2): 28-38. |
| [16] |
高坤山
. 藻类固碳[M]. 北京: 科学出版社, 2014: 8-9. GAO Kunshan . Algal carbon fixaution[M]. Beijing: Science Press, 2014: 8-9. |
| [17] |
TAKAHASHI T, WATANABE M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii[J]. Febs Letters, 1993, 336(3): 516-520. DOI:10.1016/0014-5793(93)80867-T |
| [18] |
LI L, ORTIZ C. Pervasive nanoscale deformation twinning as a catalyst for efficient energy dissipation in a bioceramic armour[J]. Nature Materials, 2014, 13(5): 501-507. DOI:10.1038/nmat3920 |
| [19] |
邓志华. 文蛤贝壳层状结构及其性能研究[D]. 长春: 吉林大学, 2011. DENG Zhihua. Study on clam shells structure and properties of layered[D]. Changchun: Jilin University, 2011. |
| [20] |
汤文仲, 李信书, 黄海燕, 等. 不同光强和温度对长石莼(缘管浒苔)光合作用和叶绿素荧光参数的影响[J]. 水产学报, 2009, 33(5): 762-769. TANG Wenzhong, LI Xinshu, HUANG Haiyan, et al. Effects of different light intensities and temperatures on the photosynthesis and chlorophyll fluorescence parameters of Ulva linza (Environmental variabilis)[J]. Acta Fisheries Sinica, 2009, 33(5): 762-769. |
| [21] |
张玉荣, 刘峰, 单体锋, 等. 利用叶绿素荧光技术揭示人工培育的铜藻幼苗对胁迫温度、光照和盐度的反应[J]. 南方水产科学, 2009, 5(2): 1-9. ZHANG Yurong, LIU Feng, SHAN Tifeng, et al. Stress resistance of young seedlings of Sargassum homeri to a variety of temperature, irradiances and salinity revealed by chlorophyll fluorescence measurements[J]. Southern Fisheries Science, 2009, 5(2): 1-9. |
| [22] |
魏家慧, 李国梁, 汪文俊. 条斑紫菜丝状体不同发育时期对光照和温度的光合适应能力[J]. 渔业科学进展, 2020, 41(6): 115-124. WEI Jiahui, LI Guoliang, WANG Wenjun. Pyropia yezoensis filaments at different developmental stages respond to light and temperature[J]. Progress in Fishe ries Science, 2020, 41(6): 115-124. |
| [23] |
张涛, 沈宗根, 李家富, 等. 紫菜不同品系贝壳丝状体叶绿素荧光特性比较[J]. 江苏农业科学, 2012, 11: 238-242. ZHANG Tao, SHEN Zonggen, LI Jiafu, et al. Comparison of chlorophyll fluorescence characteristics of conchocelis of Neopyropia yezoensis[J]. Jiangsu Agricultural Sciences, 2012, 11: 238-242. |
| [24] |
孙维华. 条斑紫菜丝状体培育技术[J]. 水产养殖, 1994, 1(2): 11. SUN Weihua. Cultivation technology of Pyropia yezoensis filaments[J]. Aquaculture, 1994, 1(2): 11. |
| [25] |
唐兴本, 陈百尧, 时勤. 根据贝壳丝状体颜色进行紫菜育苗病害防治[J]. 江西水产科技, 2006, 1(3): 26-27. TANG Xingben, CHEN Baiyao, SHI Qin. Prevention and control of Pyropia seedling diseases based on the color of conchocelis[J]. Jiangxi Fisheries Science and Technology, 2006, 1(3): 26-27. |
| [26] |
朱建一, 郑庆树, 陆勤勤, 等. 条斑紫菜丝状体悬浮培养研究[J]. 水产养殖, 1997, 12(2): 12-14. ZHU Jianyi, ZHENG Qingshu, LU Qinqin, et al. Study on suspension culture of Pyropia yezoensis filaments[J]. Aquaculture, 1997, 12(2): 12-14. |
| [27] |
孔晓锐, 吴菲菲. 条斑紫菜壳孢子附着条件研究[J]. 现代农业科技, 2012, 579(13): 236-237. KONG Xiaorui, WU Feifei. Study on the attachment conditions of Pyropia yezoensis conchospores[J]. Mo dern Agricultural Science and Technology, 2012, 579(13): 236-237. |
 2022, Vol. 46
2022, Vol. 46


