文章信息
- 钟静诗, 张健, 王共明, 刘芳, 刘奎, 王艺欣, 刘海超, 赵云苹. 2022.
- ZHONG Jing-shi, ZHANG Jian, WANG Gong-ming, LIU Fang, LIU Kui, WANG Yi-xin, LIU Hai-chao, ZHAO Yun-ping. 2022.
- 海参皂苷的制备及结构解析研究进展
- Research progress in the preparation and structural analysis of sea cucumber saponins
- 海洋科学, 46(4): 133-142
- Marine Sciences, 46(4): 133-142.
- http://dx.doi.org/10.11759/hykx20200912002
-
文章历史
- 收稿日期:2020-09-12
- 修回日期:2021-04-16
2. 山东省海洋资源与环境研究院, 山东 烟台 264006
2. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China
海参, 又称海黄瓜, 属棘皮动物, 体型呈椭圆柱状, 个体柔软。海参主要分为海参纲和刺身纲, 在我国沿海地区广泛存在。全球有超过1 716种海参的存在, 其中大部分分布在亚洲地区[1]。目前较多学者研究的海参品种主要有Stichopus[2](刺参属)、Holothuria[3](海参属)、Bohadschia[4](白尼参属)、Cucumaria[5](瓜参属)、Actinopyga[6](辐肛参属)和Thelenota[7](梅花参属)。
皂苷是由糖基和配基组成的一类糖苷, 其苷元为三萜或螺旋甾烷类化合物[8], 在植物如人参、桔梗、远志、甘草、柴胡中比较常见[9], 而在动物中发现较少。海洋生物皂苷主要存在于海参、海星等海洋生物体内[10]。海参具有与其他棘皮动物不同的特点, 它们能产生皂苷以抵御捕食者和寄生生物[11], 但目前尚不清楚海参产生皂苷具体的分子机制[12]。
目前, 对海参皂苷的研究主要集中在提取、分离纯化及活性研究方面。根据海参皂苷具有“亲水亲油”的特点, 通常采用溶剂提取法提取, 采用沉淀法和色谱法等手段进行分离纯化。在海参皂苷的生物活性方面, 相关学者研究发现海参皂苷具有抗肿瘤[13]、抗帕金森病[14]、进行免疫调节[15]等多种生物活性。但相较于海参其他生物活性物质, 海参皂苷的研究报道尚少, 且对于皂苷分子结构与其活性之间的构效关系研究相对缺乏。对海参皂苷的提取优化及分子结构的深入研究, 将有助于探明海参皂苷生物活性的分子基础, 并促进其活性的开发和应用。本文对海参皂苷的提取、分离纯化、结构及理化性质进行了综述, 以期为海参皂苷的进一步研究提供参考。
1 海参皂苷的提取 1.1 海参皂苷的提取来源海参皂苷是海参的次生代谢产物, 在体壁、消化腺、生殖腺、呼吸树和居维氏管中都发现了皂苷的存在[16-19]。目前较多学者研究海参体壁、消化腺和居维氏管中的皂苷。袁文鹏等[19]从海参体壁、消化腺中提取海参皂苷进行营养成分的对比。Chumphoochai等[20]从海参体壁和居维氏管中提取海参皂苷并对其活性进行研究。研究表明海参体壁皂苷含量不及海参内脏中的皂苷[19], 但相较于海参体壁, 海参内脏皂苷的研究较少。
除了从海参中提取皂苷外, 海参烫漂后得到的废水也是皂苷的来源之一。海参用热水烫漂能使海参自溶酶失活, 阻止海参的自溶, 但这也导致了一些营养物质如蛋白质、氨基酸、碳水化合物、矿物质、皂苷的丧失。Yin等[21]发现利用热水处理海参会损失大量海参体壁中的皂苷, 损失量约41%。有研究报道称海参和海参烫漂液中都含有海参皂苷, 海参中皂苷含量约为0.81%, 而海参烫漂液中皂苷含量约为0.68%[22]。
1.2 海参皂苷的提取方法皂苷通常可溶于水和醇溶液, 不溶于乙醚、氯仿和苯。根据皂苷性质对海参进行提取, 常见的提取方法为醇溶液提取和在此基础上改善使用大孔树脂进行提取。两种提取方法的流程如图 1所示。
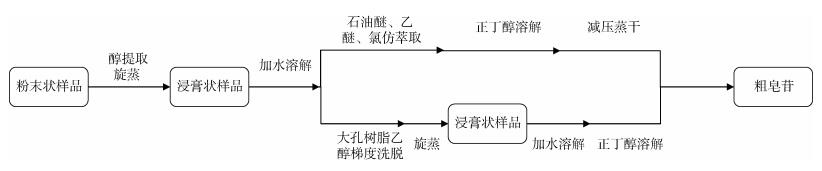 |
| 图 1 常见海参皂苷提取方法流程图 Fig. 1 Flowchart of common extraction methods of sea cucumber saponins |
醇提取法常用提取液有甲醇、乙醇、正丁醇等。除此之外, 有学者使用乙酸乙酯或多种溶剂按一定配比混合提取海参皂苷。目前, 提取海参皂苷使用较多的溶剂为乙醇, 而60%和70%乙醇体系最为常见, 推测与海参皂苷结构具有“两亲性”, 采用60%~70%乙醇相较于其他浓度乙醇提取海参皂苷的效率更高有关。
大孔吸附树脂法和醇提取法的区别在于大孔树脂法采用大孔吸附树脂代替了石油醚、乙醚和氯仿的萃取。相关研究认为, 大孔树脂提取法提取效率较高且能有效地去除混杂的盐类物质[23]。如表 1所示, 在提取仿刺参属皂苷时, 利用大孔树脂法提取得总皂苷20.5 mg·g–1, 明显高于醇提取法的得率。另外, 对海参的预处理有利于提升海参皂苷的得率。有报道称在使用复合酶对海参进行酶解预处理后, 海参皂苷得率提升了一倍[24], 这为海参皂苷提取提供新思路。常见海参皂苷的提取方法具体见表 1。
| 样品 | 产地 | 提取分离 主要方法特点 |
皂苷浓度及提取率 | 参考 文献 |
| 海参属 | 美国关岛 | 甲醇、乙酸乙酯等溶剂 | 黑海参(0.456 g·L–1); 黑乳海参(0.496 g·L–1) | [25] |
| 中国青岛 | 60%乙醇 | 墨西哥海参(0.029%); 岩海参(0.140 %) | [26] | |
| 白尼参属 | 美国关岛 | 甲醇、乙酸乙酯等溶剂 | 黑斑海参(1.181 g·L–1); 蛇目白尼参(1.130 g·L–1) | [25] |
| 辐肛参属 | 美国关岛 | 棘辐肛参(2.106 g·L–1); 白底辐肛参(1.880 g·L–1) | [25] | |
| 仿刺参属 | 韩国 | 70%乙醇 | 济州岛红海参(0.12 mg·g–1, 0.012%); 东海红海参(0.13 mg·g–1, 0.013%); 东海黑海参(0.17 mg·g–1, 0.017%); 黄海黑海参(0.19 mg·g–1, 0.019%); 南海黑海参(0.05 mg·g–1, 0.005%) |
[27] |
| 中国青岛 | 60%乙醇 | 仿刺参(0.019 %) | [26] | |
| 中国长岛蓬莱 | D101大孔吸附树脂 | 总皂苷含量20.5 mg·g–1, 2.05% | [28] | |
| 拟刺参属 | — | 60%乙醇 | 阿拉斯加红参(0.015 %) | [26] |
| 皮氏海参属 | — | 硅胶色谱法 | 获得海参皂苷38.04 mg·g–1, 3.804% | [29] |
| 梅花参属 | 中国广西 | AB-8大孔吸收柱色谱法 | 海参粗皂苷31.2 mg·g–1, 3.12% | [7] |
| 瓜参属 | — | 60%乙醇 | 红极参(0.116 %) | [26] |
| 鲜活海参 | 中国山东 | D101大孔树脂 | 体壁(2.69 mg·g–1, 0.269%); 热水提取后体壁(2.50 mg·g–1, 0.250%) 热水提取后废水(0.43 mg·g–1, 0.043%) |
[21] |
| 注: —: 无对应项目。下同。 | ||||
目前关于海参皂苷测定方法的研究尚少, 测定其他皂苷的常用方法有比色法、薄层色谱法和高效液相色谱法等。比色法具有简便、快捷的优点, 但其准确度会受到其他杂质的干扰; 薄层色谱法利用一定展开剂展开, 再联合运用其他仪器进行定量测定; 高效液相色谱法能有效的分离样品和杂质, 在皂苷的分离和测定中较常使用。薄层色谱法和高效液相色谱法都需标准品进行对照, 然而目前海参皂苷尚不具有高品质标准品, 对海参皂苷检测方法的选择造成一定的局限性。因此, 对海参粗皂苷进行含量测定时, 常采用比色法, 而对单个或几个单体皂苷的含量测定多使用后两种方法。比色法中使用的标准品除了海参皂苷单体外, 还可采用其他植物皂苷或齐墩果酸, 而高效液相色谱法则多采用分离纯化出的海参皂苷。不同方法测定海参皂苷含量通常可改变显色剂、色谱柱等以提高海参皂苷含量测定的准确性, 部分海参皂苷含量的测定方法详见表 2。
| 测定方法 | 标准品 | 实验条件 | 测定波长/nm | 参考 文献 |
|||
| 展开剂 | 显色剂 | 柱前衍生 | 色谱柱 | ||||
| 比色法 | Echinoside A | — | 香草醛-高氯酸 | — | — | 560 | [30] |
| 黄芪皂苷Ⅲ | — | 香草醛-高氯酸 | — | — | 578 | [31] | |
| 3β, 17α-二羟基-8(9), 11(12)-二烯 | — | 香草醛-高氯酸 | — | — | 591 | [32] | |
| 齐墩果酸 | — | 香草醛-冰醋酸 | — | — | 546 | [33] | |
| 花旗参皂苷 | — | 香草醛-冰醋酸 | — | — | [34] | ||
| 皂树皮皂苷 | — | 香草醛-硫酸 | — | — | 540 | [25] | |
| 可变波长 检测法 |
D-奎诺糖 | — | — | 1-苯基-3-甲基-5-吡唑啉酮(PMP) | ZORBAX Eclipse XDBC18 | 250 | [35] |
| 皂素 | — | — | — | 反相C18 | 205 | [36] | |
海参皂苷不具有发色团, 采用紫外分光光度法无法直接对其进行含量测定。因此, 运用比色法对海参皂苷含量进行测定时, 需要通过溶剂与皂苷相互作用产生生色团从而在一定波长内检测出皂苷的含量。由表 2知, 比色法常使用香草醛-高氯酸或香草酸-冰醋酸的显色体系显色。香草醛-酸显色体系的原理可能是海参皂苷在酸的作用下水解使C3位置上的羟基能与香草醛发生羟醛缩合反应而显色。杨志文等[37]在研究人参皂苷的定量分析中也持有相同的观点。
2 海参皂苷的分离纯化通常提取后的海参皂苷为粗皂苷, 包含了多种单体皂苷。为了进一步研究海参皂苷活性及海参皂苷活性与海参单体皂苷之间的关系, 需对海参粗皂苷进行分离纯化。
海参皂苷多数为三萜皂苷, 少数为螺旋甾烷类皂苷。三萜类化合物分离的传统方法主要有分段沉淀法、胆甾醇沉淀法。分段沉淀法使用乙醚、丙醇或其混合物对不同极性海参皂苷进行分离; 胆甾醇沉淀法利用胆甾醇饱和的醇溶液和乙醚分离纯化海参皂苷。分段沉淀法和胆甾醇沉淀法的流程如图 2所示。
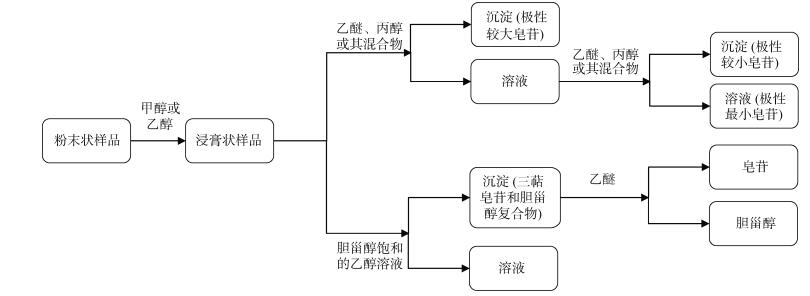 |
| 图 2 海参皂甙分离纯化流程图 Fig. 2 Flowchart of the separation and purification of sea cucumber saponins |
分段沉淀法和胆甾醇沉淀法的区别在于分段沉淀法是通过使用梯度溶剂逐步分离极性不同的皂苷。而胆甾醇沉淀法则是利用胆甾醇先与皂苷结合, 再通过去除胆甾醇得到纯化的海参皂苷。三萜皂苷通常不与甾醇形成稳定的复合物[38], 因此, 胆甾醇沉淀法还可用于三萜皂苷和甾体皂苷的分离。
色谱法是目前分离海参皂苷最常用的方法。用于海参皂苷分离的色谱法主要有大孔吸附色谱法、硅胶色谱法、高效液相色谱法和薄层层析色谱法等。以上方法主要根据皂苷的极性的不同对海参皂苷进行分离。其中大孔吸附色谱柱的方法主要是通过水洗和梯度的醇溶液的洗涤, 分离出糖及水溶性杂质和依次洗脱出极性不同的皂苷。吸附剂的不同决定了该种层析法不同的吸附特性[39]; 硅胶色谱法通常采用氯仿-甲醇-水混合溶液进行梯度洗脱, 其特点是能分离分离度较大的化合物[40]。高效液相色谱法在分离纯化皂苷中最常见, 常用的色谱柱为ODS色谱柱, 洗脱剂为甲醇-水或甲醇。薄层色谱法分离纯化海参皂苷则常用甲醇-水或乙醇进行分离纯化。色谱柱、流动相和洗脱液的选择影响海参皂苷的分离纯化的效果, 部分海参皂苷分离纯化方法见表 3。
| 分离纯化 方法 |
色谱柱 | 流动相 | 洗脱液 | 参考文献 |
| 大孔树脂 | Diaion HP-20 | — | 10%、80%甲醇 | [41] |
| Amberlite® XAD-4 | 水 | 甲醇︰丙酮︰水(4.5︰3.5︰2.5) | [42-43] | |
| HP-20 | — | 水、80%、100%乙醇 | [44] | |
| 硅胶 色谱法 |
— | — | 氯仿︰甲醇︰水(7.5︰2.5︰1, 体积比) | [45] |
| 氯仿︰甲醇︰水(10︰1︰0.1~7︰3︰0.3, 体积比) | [44, 46] | |||
| 高效液 相色谱法 |
反相C18 | 乙腈︰水︰乙酸(25︰75︰0.01) | 80%甲醇 | [45] |
| — | 30%、70%甲醇 | [50] | ||
| — | 甲醇、水 | [44] | ||
| 薄层 色谱法 |
— | — | 甲醇︰水(7︰3, 体积比) | [50] |
| 80%乙醇 | [46] |
凝胶色谱法是根据分子量进行分离的一种层析方法, 海参皂苷分子量的大小主要取决于糖苷部分。凝胶色谱法在海参皂苷的分离纯化中应用的相关报道较少, 利用凝胶色谱法分子筛原理可分离具有不同分子量大小的海参皂苷。由表 3可以看出, 为达到分离纯化的目的, 通常采用多种分离方法结合以得到较纯海参皂苷。
高速逆流色谱是近年来逐步发展的一项新技术, 它与传统的色谱层析主要的不同点在于它是利用液-液萃取对提取物进行分离, 即用于分离的固定相和流动相都为液体。利用高效逆流色谱进行分离能避免固相对提取物的不可逆吸附, 并且它对样品的要求不高, 粗提物就可直接进行分离。目前已有研究报道高速逆流色谱法用于黄酮[47]、生物碱[48]、醌类[49]、香豆木脂素[50]等的分离纯化。近年来, 高速逆流色谱用于皂苷的分离纯化主要集中于柴胡[51]、薯蓣[52]、人参[53]等中药材, 用于海参皂苷的分离纯化较少。
3 海参皂苷的结构分析海参皂苷具有几种特征性的理化性质, 据此可以判断提取纯化的化合物是否为皂苷。海参皂苷在水溶液中震荡能产生持久性的泡沫, 具有发泡性, 原因是海参皂苷是由亲水性的糖链和亲脂性的苷元组成的表面活性剂。皂苷鉴定最常用的显色反应为Libermann-Burchar反应, 又称醋酐浓硫酸反应。若在两层界面之间有紫红色反应, 则说明有苷类物质的存在。Molish反应也能判断提取物中是否含有苷类物质, 其判断依据是液面之间是否存在紫红色环[49]。
根据苷元部分的不同可将海参皂苷分为螺旋甾烷类皂苷和三萜类皂苷。截至2015年, 已经发现的海参皂苷的种类有700余种[44], 其中大多数为三萜皂苷。三萜类皂苷多数由30个C组成, 通常认为皂苷由六个异戊二烯单位聚合而成, 且多数为四环三萜或五环三萜。海参皂苷还可以分为海参烷型皂苷和非海参烷型皂苷, 它们的区别在于海参烷型皂苷含有18(20)-内酯环而非海参烷型皂苷含有18(16)-内酯环或不含有内酯环[54-56]。
组成海参皂苷糖基部分的单糖主要有D-葡萄糖(Glc), D-木糖(Xyl), D-奎诺糖(Qui), 3-O-甲基-D-葡萄糖(MeGlc)和3-O-甲基-D-木糖[55], 皂苷寡糖链通常由2-6个单糖组成[54]。
海参皂苷苷元母核结构式及糖链常见单糖结构式如图 3所示。
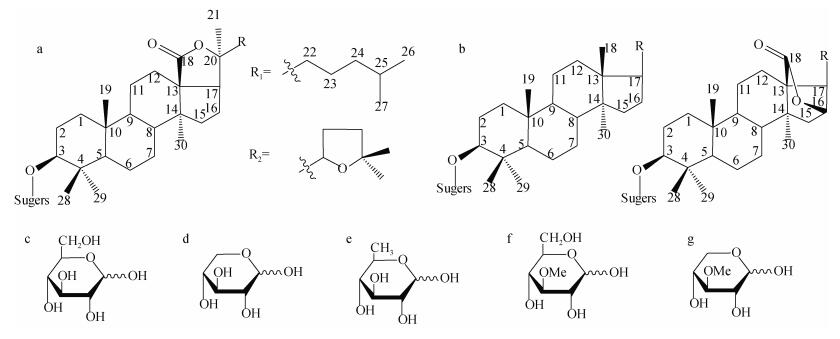 |
| 图 3 海参皂苷母核及其糖基部分常见单糖结构式 Fig. 3 Structures of the aglycon part of sea cucumber saponins and common glycosyl monosaccharides 注: a. 海参烷性皂苷母核; b. 非海参烷型皂苷母核; c. D-葡萄糖; d. D-木糖; e. D-奎诺糖; f. 3-O-甲基-D-葡萄糖; g. 3-O-甲基-D-木糖 |
海参皂苷糖苷中单糖上是否含有硫酸基团以及硫酸基团所处的位置(如木糖C-4位、葡萄糖C-6位、奎诺糖C-3位)、海参皂苷配基及配基侧链中是否含有双键以及双键的数量和位置(如7(8)、9(11)、24(25)、25(26)、位上的双键)、苷元中羟基、环氧基、乙酰基(主要在配基的C-16、C-22、C-23和或C-25上[56])等的数量和类型[54]都使得海参皂苷具有多样性。
另外, Van Dyck等[57]研究发现海参皂苷之间能发生相互转化, 他们分析了holothuria forskali在掠食者应激和未受干扰的条件下对皂苷的影响, 发现两种状态下皂苷的种类不同, 有的皂苷会发生转化形成另一种皂苷。这与Kamyab等[25]的观点一致。
常用的理化性质只能对海参皂苷是否存在进行简单判断, 通过现代仪器分析技术能进一步探究海参皂苷单体的结构。
海参皂苷是苷元为三萜类或螺旋甾烷类化合物的一种糖苷。采用傅里叶红外变换[45]、质谱[58]和核磁共振[59]等技术能解析海参皂苷的结构。红外光谱能通过分子振动产生的吸收频率判断化合物所含基团; 核磁共振能根据原子核的化学位移判断化合物的结构; 质谱能根据化合物的分子离子峰判断出化合物的相对分子质量, 再根据质荷比确定分子式, 最后通过离子峰确定化合物的结构。质谱在定性方面应用广泛, 通过联用气相色谱或液相色谱, 能同时对化合物进行定量分析。
4 展望目前, 海参皂苷的研究尚处于起步阶段, 海参皂苷的提取分离仍缺乏统一且高效的方法, 建立海参皂苷制备的方法是研究海参皂苷的重要且基础性难题。大多数学者采用醇溶液提取海参皂苷, 化学试剂用量大, 对环境污染也较大。表面活性剂具有短时、低成本、优化有效成分、绿色环保等特点[60], 已应用于三七皂苷、薯蓣皂苷、人参皂苷等植物皂苷的提取研究中[61-63]。探究表面活性剂等友好型溶剂提取海参皂苷成为研究海参皂苷制备一个新方向。
另外, 海参皂苷的不同活性及活性强弱与海参皂苷的分子结构有关, 已有研究表明海参皂苷中硫酸基团、羰基对海参皂苷活性有影响[64]。因此, 单体皂苷的分离纯化及其结构解析、单体皂苷结构与活性之间的关系仍是当前海参皂苷研究重点和难点之一。下一步, 采用新型溶剂体系或表面活性剂提取海参皂苷, 利用超声、微波、酶解等现代科学新技术辅助提取, 优化海参皂苷的提取工艺; 采用多种方法相结合及应用高速逆流色谱法等新方法促进海参单体皂苷的分离纯化; 探究皂苷分子结构与活性的关系, 皂苷结构中的功能基团如含硫酸基团、含氧基团等对活性的影响等都是急需解决的研究内容。
近年来, 随着国内外学者对海参皂苷的深入研究, 其多种生物活性如抗肿瘤、抗帕金森和免疫调节等逐渐被人们认知。继续研究海参皂苷丰富的生物学活性, 明确各种活性的分子生物学机制, 对针对性的开发相关功能性产品, 高值化开发利用皂苷, 对保障人类健康, 提升人们的生活质量都具有重要作用。
| [1] |
DARYA M, SAJJADI M M, YOUSEFZADI M, et al. Antifouling and antibacterial activities of bioactive extracts from different organs of the sea cucumber Holothuria leucospilota[J]. Helgoland Marine Research, 2020, 74(1): 4. DOI:10.1186/s10152-020-0536-8 |
| [2] |
CEESAY A, SHAMSUDIN M N, ALIYU–PAIKO M, et al. Extraction and characterization of organ components of the malaysian sea cucumber Holothuria leucospilota yielded bioactives exhibiting diverse properties[J]. Biomed Research International, 2019, 2019(4): 2640684. |
| [3] |
MOGHADAM F D, BAHARARA J, BALANEZHAD S Z, et al. Effect of Holothuria leucospilota extracted saponin on maturation of mice oocyte and granulosa cells[J]. Research in Pharmaceutical Sciences, 2016, 11(2): 130-137. |
| [4] |
ELBANDY M, RHO J R, AFIFI R. Analysis of saponins as bioactive zoochemicals from the marine functional food sea cucumber Bohadschia cousteaui[J]. European Food Research and Technology, 2014, 238(6): 937-955. DOI:10.1007/s00217-014-2171-6 |
| [5] |
TRIPOTEAU L, BEDOUX G, GAGNON J, et al. In vitro antiviral activities of enzymatic hydrolysates extracted from byproducts of the Atlantic holothurian Cucumaria frondosa[J]. Process Biochemistry, 2015, 50(5): 867-875. DOI:10.1016/j.procbio.2015.02.012 |
| [6] |
NIGRELLI R F, JAKOWSKA S. Effects of holothurin, a steroid saponin from the Bahamian sea cucumber (Actinopyga agassizi), on various biological systems[J]. Annals of the New York Academy of Sciences, 1960, 90(17): 884-892. |
| [7] |
HAN Q, LI K F, DONG X P, et al. Function of Thelenota ananas saponin desulfated holothurin A in modulating cholesterol metabolism[J]. Scientific Reports, 2018, 8(1): 9506. DOI:10.1038/s41598-018-27932-x |
| [8] |
周中流, 李春燕, 陈林浩, 等. 天然产物皂苷类化合物生物转化的研究进展[J]. 中国实验方剂学杂志, 2019(16): 173-192. ZHOU Zhongliu, LI Chunyan, CHEN Linhao, et al. Biotransformation of natural saponins[J]. China Journal of Experimental Traditional Medical Formulae, 2019(16): 173-192. |
| [9] |
ZHAO Y C, XUE C H, ZHANG T T, et al. Saponins from sea cucumber and their biological activities[J]. Journal of Agricultural and Food Chemistry, 2018, 66(28): 7222-7237. DOI:10.1021/acs.jafc.8b01770 |
| [10] |
OSBOURN A, GOSS R J M, FIELD R A. The saponins– polar isoprenoids with important and diverse biological activities[J]. Natural Product Reports, 2011, 28(7): 1261-1268. DOI:10.1039/c1np00015b |
| [11] |
BAKUS G. Defensive mechanisms and ecology of some tropical holothurians[J]. Marine Biology, 1968, 2(1): 23-32. DOI:10.1007/BF00351634 |
| [12] |
LI Y L, WANG R J, XUN X G, et al. Sea cucumber genome provides insights into saponin biosynthesis and aestivation regulation[J]. Cell Discovery, 2018, 4(1): 29. DOI:10.1038/s41421-018-0030-5 |
| [13] |
HOANG L, LE T V, TRAN T H H, et al. Triterpene glycosides from the Vietnamese sea cucumber Holothuria edulis[J]. Natural Product Research, 2019, 34(8): 1061-1067. |
| [14] |
MALAIWONG N, CHALORAK P, JATTUJAN P, et al. Anti-Parkinson activity of bioactive substances extracted from Holothuria leucospilota[J]. Biomed Pharmacother, 2019, 109: 1967-1977. DOI:10.1016/j.biopha.2018.11.063 |
| [15] |
AMININ D, PISLYAGIN E, ASTASHEV M, et al. Glycosides from edible sea cucumbers stimulate macrophages via purinergic receptors[J]. Scientific Reports, 2016, 6(1): 39683. DOI:10.1038/srep39683 |
| [16] |
BAHRAMI Y, ZHANG W, CHRISTOPHER M M F. Distribution of saponins in the sea cucumber Holothuria lessoni; the body wall versus the viscera, and their biological activities[J]. Marine Drugs, 2018, 16(11): 423. DOI:10.3390/md16110423 |
| [17] |
SROYRAYA M, KAEWPHALUG W, ANANTACHOKE N, et al. Saponins enriched in the epidermal layer of Holothuria leucospilota body wall[J]. Microscopy Research and Technique, 2018, 81(10): 1182-1190. DOI:10.1002/jemt.23115 |
| [18] |
MITU S A, BOSE U, SUWANSA–ARD S, et al. Evidence for a saponin biosynthesis pathway in the body wall of the commercially significant sea cucumber Holothuria scabra[J]. Marine Drugs, 2017, 15(11): 349. DOI:10.3390/md15110349 |
| [19] |
袁文鹏, 刘昌衡, 王小军, 等. 仿刺参不同部位营养成分的分析及综合评价[J]. 食品工业科技, 2010, 31(5): 348-350. YUAN Wenpeng, LIU Changheng, WANG Xiaojun, et al. Evaluation and analysis of nutritional composition of different parts of sea cucumber Apostichopus joponicus[J]. Science and Technology of Food Industry, 2010, 31(5): 348-350. |
| [20] |
CHUMPHOOCHAI K, CHALORAK P, SUPHAMUNGMEE W, et al. Saponin-enriched extracts from body wall and Cuvierian tubule of Holothuria leucospilota reduce fat accumulation and suppress lipogenesis in Caenorhabditis elegans[J]. Journal of the Science of Food and Agriculture, 2019, 99(8): 4158-4166. DOI:10.1002/jsfa.9646 |
| [21] |
YIN P P, JIA A R, HEIMANN K, et al. Hot water pretreatment-induced significant metabolite changes in the sea cucumber Apostichopus japonicus[J]. Food Chemistry, 2020, 314: 126211. DOI:10.1016/j.foodchem.2020.126211 |
| [22] |
王寿权, 员冬玲, 尹凤交, 等. 海参及其加工废液基本化学成分分析及蛋白质营养评价[J]. 食品研究与开发, 2019, 40(14): 150-154. WANG Shouquan, YUAN Donglin, YIN Fengjiao, et al. Evaluation and analysis of nutritional composition of sea cucumber and its waste liquid[J]. Food Research And Development, 2019, 40(14): 150-154. |
| [23] |
邹峥嵘, 易杨华, 张淑瑜, 等. 海参皂苷研究进展[J]. 中国海洋药物, 2004(1): 46-53. ZOU Zhengrong, YI Yanghua, ZHANG Shuyu, et al. Progress in studies of sea cucumber glycosides[J]. Chi nese Journal of Marine Drugs, 2004(1): 46-53. DOI:10.3969/j.issn.1002-3461.2004.01.012 |
| [24] |
周光东, 位正鹏, 霍健聪, 等. 舟山海域光参酶解嫩化工艺研究[J]. 中国食品学报, 2020, 20(1): 183-189. ZHOU Guangdong, WEI Zhengpeng, HUO Jiancong, et al. Studies on enzymatic tenderizing technology of Cucumaria japonica from Zhoushan sea area[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(1): 183-189. |
| [25] |
KAMYAB E, GOEBELER N, KELLERMANN M Y, et al. Anti-fouling effects of saponin-containing crude extracts from tropical Indo-Pacific sea cucumbers[J]. Marine Drugs, 2020, 18(4): 181. DOI:10.3390/md18040181 |
| [26] |
王婧媛, 王联珠, 郭莹莹, 等. 仿刺参与进口海参营养品质的比较分析[J]. 食品与发酵工业, 2019, 45(16): 250-254. WANG Jingyuan, WANG Lianzhu, GUO Yingying, et al. Comparative analysis of nutritional quality of Apostichopus japonicus and imported sea cucumbers[J]. Food and Fementation Industries, 2019, 45(16): 250-254. |
| [27] |
DAI Y L, KIM E A, LUO H M, et al. Characterization and anti-tumor activity of saponin-rich fractions of South Korean sea cucumbers (Apostichopus japonicus)[J]. International Journal of Food Science and Technology, 2020, 57(6): 2283-2292. DOI:10.1007/s13197-020-04266-z |
| [28] |
ZHANG X M, HAN L W, SHENG W L, et al. Two novel holostane-type glycosides from the viscera of sea cucumber Apostichopus japomocus with antitumor activities[J]. Revue Roumaine de Chimie, 2019, 64(4): 353-359. DOI:10.33224/rrch/2019.64.4.08 |
| [29] |
LI R, ZHANG L Y, LI Z J, et al. Characterization and absorption kinetics of a novel multifunctional nanoliposome stabilized by sea cucumber saponins instead of cholesterol[J]. Journal of Agricultural and Food Chemistry, 2020, 68(2): 642-651. DOI:10.1021/acs.jafc.9b06460 |
| [30] |
董平, 薛长湖, 盛文静, 等. 海参中总皂苷含量测定方法的研究[J]. 中国海洋药物杂志, 2008, 27(1): 28-32. DONG Ping, XUE Changhu, SHENG Wenjing, et al. Study on the determination of total triterpene glycosides in sea cucumbers[J]. Chinese Journal of Marine Drugs, 2008, 27(1): 28-32. |
| [31] |
CHEN D L, YANG X C, CAO W J, et al. Three-liquid- phase salting-out extraction of effective components from waste liquor of processing sea cucumber[J]. Food and Bioproducts Processing, 2015, 96: 99-105. DOI:10.1016/j.fbp.2015.07.002 |
| [32] |
GUO L, GAO Z Y, ZHANG L Q, et al. Saponin-enriched sea cucumber extracts exhibit an antiobesity effect through inhibition of pancreatic lipase activity and upregulation of LXR-beta signaling[J]. Pharmaceutical Biology, 2016, 54(8): 1312-1325. DOI:10.3109/13880209.2015.1075047 |
| [33] |
高子阳, 王瑞, 郭夫江, 等. 不同种类市售海参的总皂苷含量测定[J]. 中国实验方剂学杂志, 2014, 20(15): 89-92. GAO Ziyang, WANG Rui, GUO Fujiang, et al. Determination total saponin content in sea cucumbers[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(15): 89-92. |
| [34] |
陈艳秋. 红刺参皂苷提取及其免疫活性研究[J]. 食品工业, 2015, 36(8): 20-23. CHEN Yanqiu. Study on Extraction of saponin from Apostichopus japonicus and its immune activityp[J]. The Food Industry, 2015, 36(8): 20-23. DOI:10.3969/j.issn.1006-6195.2015.08.002 |
| [35] |
DONG P, XUE C, YU L, et al. Determination of triterpene glycosides in sea cucumber (Stichopus japonicus) and its related products by high-performance liquid chromatography[J]. Journal of Agricultural & Food Chemistry, 2008, 56(13): 4937-4942. |
| [36] |
FU X Y, WEN M, HAN X Q, et al. Effect and potential mechanism of action of sea cucumber saponins on postprandial blood glucose in mice[J]. Biosci Biotechnol Biochem, 2016, 80(6): 1081-1087. DOI:10.1080/09168451.2016.1153950 |
| [37] |
杨文志, 于淑莲, 娄子恒, 等. 论人参总皂苷的科学定量方法[J]. 人参研究, 2007, 2: 7-10. YANG Wenzhi, YU Shulian, LOU Ziheng, et al. The discussion of scientific quantitative method of total ginseng saponins[J]. Ginseng Research, 2007, 2: 7-10. DOI:10.3969/j.issn.1671-1521.2007.02.002 |
| [38] |
刘克明, 佟继铭, 刘永平, 等. 三萜皂苷分离纯化方法的研究进展[J]. 承德医学院学报, 2017, 34(2): 154-156. LIU Keming, TONG Jiming, LIU Yongping, et al. Research progress on purification method of triterpenoid saponin[J]. Journal of Chengde medical college, 2017, 34(2): 154-156. |
| [39] |
孟春英, 王茂剑, 张健, 等. 仿刺参体壁中抗菌肽的分离及抑菌活性[J]. 食品科学, 2016, 37(7): 33-38. MENG Chunying, WANG Maojian, ZHANG Jian, et al. Isolation and activity of antimicrobial peptide from body wall of Apostichopus japonicas[J]. Food Science, 2016, 37(7): 33-38. |
| [40] |
苏永昌, 刘淑集, 吴成业. 海参皂苷的分离提取与生物活性[J]. 福建水产, 2008, 1: 66-69. SU Yongchang, LIU Shuji, WU Chengye. Study on extraction, purification and biological activities of sea cucumber glycosides[J]. Journal of Fujian fisheries, 2008, 1: 66-69. DOI:10.3969/j.issn.1006-5601.2008.01.016 |
| [41] |
YU S R, YE X W, HUANG H C, et al. Bioactive sulfated saponins from sea cucumber Holothuria moebii[J]. Planta Medica, 2015, 81(2): 152-159. DOI:10.1055/s-0034-1383404 |
| [42] |
BAHRAMI Y, FRANCO C M M. Structure elucidation of new acetylated saponins, Lessoniosides A, B, C, D, and E, and non–acetylated saponins, Lessoniosides F and G, from the viscera of the sea cucumber Holothuria lessoni[J]. Marine Drugs, 2015, 13(1): 597-617. DOI:10.3390/md13010597 |
| [43] |
DEMEYER M, WISZTORSKI M, DECROO C, et al. Inter-and intra-organ spatial distributions of sea star saponins by MALDI imaging[J]. Analytical and Bioanalytical Chemistry, 2015, 407(29): 8813-8824. DOI:10.1007/s00216-015-9044-0 |
| [44] |
SONG S S, CONG P X, XU J, et al. Absorption and pharmacokinetic study of two sulphated triterpenoid saponins in rat after oral and intravenous administration of saponin extracts of Pearsonothuria graeffei by HPLC-MS[J]. Journal of Functional Foods, 2016, 25: 62-69. DOI:10.1016/j.jff.2016.05.002 |
| [45] |
ZHANG J J, ZHU K Q. A novel antitumor compound nobiliside D isolated from sea cucumber (Holothuria nobilis Selenka)[J]. Experimental and Therapeutic Me dicine, 2017, 14(2): 1653-1658. DOI:10.3892/etm.2017.4656 |
| [46] |
SONG S S, ZHANG L Y, CAO J, et al. Characterization of metabolic pathways and absorption of sea cucumber saponins, holothurin A and echinoside A, in vitro and in vivo[J]. Journal of Food Science, 2017, 82(8): 1961-1967. DOI:10.1111/1750-3841.13759 |
| [47] |
MA S, HU L, MA C, et al. Application and recovery of ionic liquids in the preparative separation of four flavonoids from Rhodiola rosea by on-line three-dimensional liquid chromatography[J]. Journal of Separation Science, 2014, 37(17): 2314-2321. DOI:10.1002/jssc.201400305 |
| [48] |
ZHANG Q H, SHU X K, JING F, et al. Preparative separation of alkaloids from Picrasma quassioides (D. Don) Benn. by conventional and pH-zone-refining countercurrent chromatography[J]. Molecules, 2014, 19(7): 8752-8761. DOI:10.3390/molecules19078752 |
| [49] |
CHEN T, LIU Y L, ZOU D L, et al. Application of an efficient strategy based on liquid-liquid extraction, high- speed counter-current chromatography, and preparative HPLC for the rapid enrichment, separation, and purification of four anthraquinones from Rheum tanguticum[J]. Journal of Separation Science, 2014, 37(41641): 165-170. |
| [50] |
LIU J L, WANG X Y, ZHANG L L, et al. Two-dimensional countercurrent chromatographyxhigh performance liquid chromatography with heart cutting and stop and go techniques for preparative isolation of coumarin derivatives from Peucedanum praeruptorum Dunn[J]. Journal of Chromatography A, 2014, 1374: 156-163. DOI:10.1016/j.chroma.2014.11.053 |
| [51] |
LEE K J, XU M Y, SHEHZAD O, et al. Separation of triterpenoid saponins from the root of Bupleurum falcatum by counter current chromatography: the relationship between the partition coefficients and solvent system composition[J]. Journal of Separation Science, 2014, 37(23): 3587-3594. DOI:10.1002/jssc.201400871 |
| [52] |
ZHANG X X, ITO Y, LIANG J R, et al. Preparative isolation and purification of five steroid saponins from Dioscorea zingiberensis C. H. Wright by counter-current chromatography coupled with evaporative light scattering detector[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 84: 117-123. DOI:10.1016/j.jpba.2013.02.005 |
| [53] |
张敏, 陈瑞战, 窦建鹏, 等. 人参中的人参皂苷高速逆流色谱法分离[J]. 时珍国医国药, 2012, 23(2): 403-405. ZHANG Min, CHEN Ruizhan, DOU Jianpeng, et al. Separation of ginsenoside from ginseng by High- Speed Counter-current Chromatography[J]. Lishizhen Medicine and Materia Research, 2012, 23(2): 403-405. DOI:10.3969/j.issn.1008-0805.2012.02.068 |
| [54] |
KALININ V I, SILCHENKO A S, AVILOV S A, et al. Sea cucumbers triterpene glycosides, the recent progress in structural elucidation and chemotaxonomy[J]. Phytochemistry Reviews, 2005, 4(2/3): 221-236. |
| [55] |
KALININ V I, SILCHENKO A S, AVILOV S A, et al. Non-holostane aglycones of sea cucumber triterpene glycosides. structure, biosynthesis, evolution[J]. Steroids, 2019, 147: 42-51. DOI:10.1016/j.steroids.2018.11.010 |
| [56] |
BAHRAMI Y, FRANCO C M M. Acetylated triterpene glycosides and their biological activity from holothuroidea reported in the past six decades[J]. Marine Drugs, 2016, 14(8): 147. DOI:10.3390/md14080147 |
| [57] |
VAN DYCK S, CAULIER G, TODESCO M, et al. The triterpene glycosides of Holothuria forskali: usefulness and efficiency as a chemical defense mechanism against predatory fish[J]. Journal of Experimental Biology, 2011, 214(Pt 8): 1347-1356. |
| [58] |
KALININ V I, SILCHENKO A S, AVILOV S A. Taxonomic significance and ecological role of triterpene glycosides from holothurians[J]. Biology Bulletin, 2017, 43(6): 532-540. |
| [59] |
PISLYAGIN E A, MANZHULO I V, GORPENCHENKO T Y, et al. Cucumarioside A(2)-2 Causes macrophage activation in mouse spleen[J]. Marine Drugs, 2017, 15(11): 341. DOI:10.3390/md15110341 |
| [60] |
韩伟, 刘曦, 班颖. 表面活性剂辅助提取技术及其应用进展[J]. 机电信息, 2010(26): 12-15. HAN Wei, LIU Xi, BAN Ying. Surfactant–assisted extraction technology and its application progress[J]. Me chanical and Electrical Information, 2010(26): 12-15. |
| [61] |
陈红惠, TARUN B, 李刚凤, 等. 表面活性剂协同超声波酶法提取三七花总皂苷工艺优化及抗氧化活性研究[J/OL]. 食品与发酵工业: 1-11[0-10-20]. https://doi.org/10.13995/j.cnki.11-1802/ts.024843. CHEN Honghui, TARUN B, LI Gangfeng, et al. Enzymolysis-ultrasound-assisted surfactant extraction and antioxidant activity of saponins from Panax notoginseng flowers[J/OL]. Food and Fermentation Industries: 1-11[2020-10-20]. https://doi.org/10.13995/j.cnki.11-1802/ts.024843. |
| [62] |
李祥, 兀浩, 文星, 等. 表面活性剂及其复配体系对盾叶薯蓣中薯蓣皂苷提取率影响的研究[J]. 中成药, 2013, 35(2): 407-411. LI Xiang, WU Hao, WEN Xing, et al. Study on the effect of surfactant and its compound system on the extraction rate of dioscin in Dioscorea zingiberensis[J]. Chinese Traditional Patent Medicine, 2013, 35(2): 407-411. DOI:10.3969/j.issn.1001-1528.2013.02.051 |
| [63] |
CHOI M P K, CHAN K K C, LEUNG H W, et al. Pressurized liquid extraction of active ingredients (ginsenosides) from medicinal plants using non–ionic surfactant solutions[J]. Journal of Chromatography A, 2003, 983: 153-162. DOI:10.1016/S0021-9673(02)01649-7 |
| [64] |
KALININ V I, PROKOFIEVA N G, LIKHATSKAYA G N, et al. Hemolytic activities of triterpene glycosides from the holothurian order Dendrochirotida: some trends in the evolution of this group of toxins[J]. Toxicon, 1996(34): 475. |
 2022, Vol. 46
2022, Vol. 46


