文章信息
- 张明星, 林东明. 2022.
- ZHANG Ming-xing, LIN Dong-ming. 2022.
- 毛里塔尼亚外海乌贼成熟个体的体征研究
- The body condition of mature common cuttlefish (Sepia officinalis) from the offshore area of Mauritania
- 海洋科学, 46(6): 51-60
- Marine Sciences, 46(6): 51-60.
- http://dx.doi.org/10.11759/hykx20210419001
-
文章历史
- 收稿日期:2021-04-19
- 修回日期:2021-07-30
2. 上海海洋大学 海洋科学学院, 上海 201306;
3. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306;
5. 农业农村部大洋渔业开发重点实验室, 上海 201306
2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fishery Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China;
4. National Distant-water Fisheries Engineering Research Center, Shanghai Ocean University, Shanghai 201306, China;
5. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
乌贼(Sepia officinalis), 隶属于乌贼目(Sepiida), 乌贼科(Sepiidae), 乌贼属(Sepia), 为近海底层栖息种, 最大栖息水深在100 m左右, 广泛分布于东大西洋和地中海海域, 在东大西洋的分布北至设得兰群岛, 南至南非外海[1-2]。与其他头足类鞘亚纲属种相类似, 乌贼亦表现为生长速度快、生命周期短、终生一次繁殖产卵等生活史特性[1]。通常, 乌贼的配子发生为批次成熟、批次排卵[3-4], 繁殖产卵时间可延续数月[5-7], 产卵结束后不久便死去[5, 8]。此外, 乌贼具季节性索饵-产卵洄游习性, 对栖息海域的环境波动变化适应能力强, 其中栖息水温可低至9.5 ℃, 并且在水温30 ℃以内其生长速率随水温升高而增大[8-9]。
毛里塔尼亚位于东大西洋的非洲西北部, 西濒大西洋, 海岸线延长, 外海为加那利海流上升流系统(Canary Current Upwelling System, CCUS)南侧, 营养盐和初级生产力丰富, 是各种海洋生物栖息繁殖的重要天然海域[10]。该海域拥有丰富的头足类资源, 以乌贼、非洲乌贼(Sepia bertheloti)、巨型非洲乌贼(Sepia hierredda)等最为丰富[1]。随着全球渔业资源的开发利用, 毛里塔尼亚外海已经成为头足类开发的重要渔场[11-12]。从20世纪90年代起中国开始在该海域进行头足类渔业开发, 乌贼是主要的捕捞对象[13]。然而, 在商业性渔业开发和全球气候变化背景下, 乌贼群体生长发育的年间波动变化显著, 并且初次性腺成熟体型呈现出趋小的态势[6, 14]。体征(body condition)是动物个体的质量特征[15], 表征个体的健康状况及其在适应环境变化、成功繁衍后代、种群生物量维持等方面的能力[15-17], 并且影响着个体的体型及其生殖价值(reproductive value)[18]。目前, 已有研究发现乌贼成熟个体的生殖能量(以性腺指数为参考指标)需求较高, 可达其体质量的16%[1, 4], 并且性腺成熟后摄食强度亦有所变化[4], 但是随之的体征变化却不甚清楚。为此, 本研究对毛里塔尼亚外海采集的乌贼成熟个体样本, 进行体征及与体型、胃饱满度等之间关系的研究分析, 旨在增进掌握该群体繁殖生物学特性, 为该群体资源的可持续开发利用提供参考。
1 材料与方法 1.1 样品来源乌贼样本来自于中国远洋底层拖网渔船在毛里塔尼亚外海作业期间的渔获物, 采集时间为2015年7月—8月, 采集海域为16.90°W—17.70°W、19.70°N—20.80°N。采样操作是随船调查人员在海上随机采集样本, 经–30 ℃冷冻保藏后运回实验室进行分析。
1.2 生物学测定在实验室室温下, 乌贼样本解冻后进行生物学数据测定, 测定项目包括: 胴长(mantle length, ML)、体质量(body weight, BW)、性别、性腺成熟度、胃饱满度。其中, 胴长为胴体背面前端至末端的中线水平长度, 精确到1 mm; 体质量测定精确到1 g。
性腺成熟度划分参考国际海洋考察理事会(International Council for the Exploration of the Sea, ICES)[19]的划分标准, 结合实验观察, 将乌贼性腺成熟度划分为I期~V期: Ⅰ期-未发育; Ⅱ期-开始发育; Ⅲ期-生理性成熟; Ⅳ期-雌性为功能性成熟产卵, 雄性为功能性成熟排精; Ⅴ期-衰败退化。胃饱满度划分为0级—4级[20]: 0级——空胃; 1级——胃中有少量食物; 2级——胃中有中等程度的食物, 或占胃体积1/2; 3级——胃中充满食物, 但胃壁不膨大; 4级-胃中充满食物, 胃壁膨大。
实验室共测定性腺成熟的乌贼样本831尾(表 1), 其中雌性样本399尾(III期50尾, IV期349尾), 雄性样本432尾(III期302尾, IV期130尾)。
| 性别 | 成熟度 | 尾数 | 胴长/mm | 体质量/g | |||
| 范围 | 平均值±SD | 范围 | 平均值±SD | ||||
| 雌性 | III | 50 | 138~195 | 159.62±12.26 | 287~595 | 399.84±76.29 | |
| IV | 349 | 140~323 | 193.82±30.98 | 245~1762 | 650.38±283.99 | ||
| pooled | 399 | 138~323 | 189.53±31.40 | 245~1762 | 618.98±279.52 | ||
| 雄性 | III | 302 | 135~334 | 207.07±41.97 | 207~1700 | 696.28±360.67 | |
| IV | 130 | 166~343 | 242.49±42.09 | 365~1765 | 951.65±388.27 | ||
| pooled | 432 | 135~343 | 217.73±45.00 | 207~1765 | 773.12±386.94 | ||
按雌性、雄性分类统计, 计算样本个体胴长、体质量分布范围及其平均值。
1.3.2 体质量、胴长关系采用非线性回归方法, 分别进行雌性、雄性样本个体体质量与胴长的幂函数回归分析, 求取体质量与胴长(BW-ML)之间的关系: BW=a·MLb。式中, BW为体质量(g), ML为胴长(mm), a、b为待估算参数。
1.3.3 体征指标根据体质量与胴长(BW-ML)的幂函数回归关系, 求取残差并标准化。质量-长度回归关系的残差值具有基于个体水平又独立于个体大小、且能够反映个体质量特征的特点[21-23]。因此, 体质量与胴长关系的残差值(BW-ML residuals)可作为个体的体征指标(body condition index, BC)[24-25]。
实验数据中未作说明者均以平均值±标准差(Mean±SD)表示, 运用R统计平台进行数据的处理分析。利用Shapiro-Wilk检验进行胴长、体质量、体征等数据的正态性分布检验; 符合正态性分布的数据, 利用单因素方差分析(ANOVA)检验不同发育时期的差异性; 不符合正态性分布的数据, 利用非参数Kruskal-Wallis检验(K-W test)进行不同发育时期的差异性分析。同时, 利用相同的检验方法分析不同胃饱满度时的体征差异性。利用Pearson相关性分析体征与胴长之间的关系。差异性显著水平为P < 0.05。
2 结果 2.1 体质量与胴长分析显示, 乌贼雌性成熟个体的胴长范围为138~323 mm, 平均胴长为189.53 mm±31.40 mm; 体质量范围为245~1 762 g, 平均体质量为618.98 g± 279.52 g(表 1)。生理性成熟期(III期)和功能性成熟产卵期(IV期)之间, 雌性个体的胴长和体质量均存在显著性差异(胴长, F=59.51, P < 0.05; 体质量, F= 38.44, P < 0.05), 其中生理性成熟期的平均胴长和平均体质量分别为159.62 mm ±12.26 mm和399.84 g± 76.29 g, 功能性成熟产卵期的平均胴长和平均体质量分别为193.82 mm±30.98 mm和650.38 g±283.99 g。胴长呈单峰值区间分布, 以140~220 mm的个体占优(图 1a); 体质量与胴长呈显著的幂函数关系, 为BW= 0.0021·ML2.39 (r2=0.87, P < 0.05; 图 1b)。
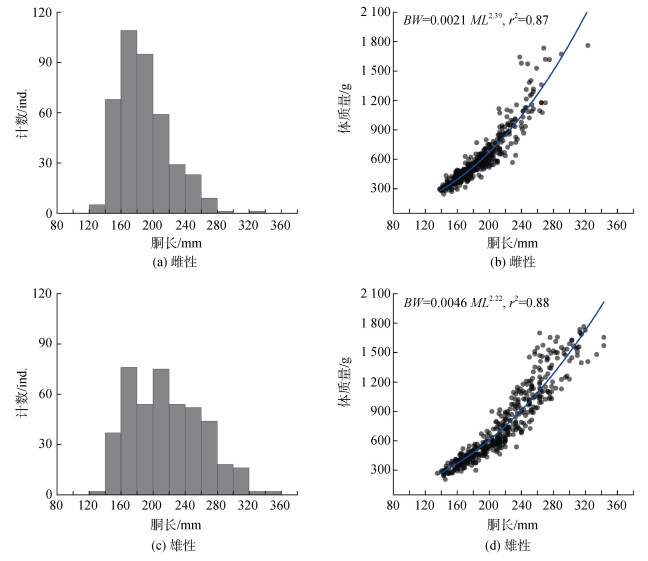 |
| 图 1 乌贼雌雄性个体的体质量与胴长关系 Fig. 1 The relationship between body weight (BW) and mantle length (ML) for both female and male Sepia officinalis |
雄性成熟个体的胴长范围为135~343mm, 平均胴长为217.73 mm±45.00 mm; 体质量范围为207~ 1765 g, 平均体质量为773.12 g±386.94 g (表 1)。功能性成熟排精个体的胴长和体质量显著大于生理性成熟个体(胴长, F=64.611, P < 0.05; 体质量, F=43.49, P < 0.05), 其中功能性成熟排精个体的平均胴长和平均体质量分别为242.49 mm±42.09 mm和951.65 g± 388.27 g, 生理性成熟期的平均胴长和平均体质量分别为207.07 mm±41.97 mm和696.28 g±360.67 g。胴长亦呈单峰值区间分布, 以140~280 mm个体为主(图 1c); 体质量与胴长亦呈显著的幂函数关系, 为BW=0.004 6·ML2.22 (r2= 0.88, P < 0.05; 图 1d)。
2.2 体征分布基于体质量-胴长关系求取的标准化残差结果显示, 乌贼雌性、雄性成熟个体的体征均存在一定的波动变化, 且在功能性成熟产卵期(IV期)的体征波动幅度较大(图 2)。其中, 雌性个体在功能性成熟期的体征为–2.09~2.41(平均值±SD: –0.05±0.80); 生理性成熟期(III期)的体征为–0.70~0.88(平均值±SD: 0.04± 0.37); 但是, 两个时期的体征没有显著差异性(χ2= 0.61, P=0.44)。雄性个体在生理性成熟期的体征为–1.74~2.45(平均值±SD: –0.01±0.80), 功能性成熟排精期的体征为–2.40~2.32(平均值±SD: –0.09±0.95)。与雌性个体相同, 两个时期的体征亦没有显著差异性(χ2=0.77, P=0.38)。
 |
| 图 2 乌贼雌雄性个体的体征分布 Fig. 2 The distribution of body condition of female and male Sepia officinalis |
同时分析显示, 生理性成熟期的雌性、雄性个体体征差异性不显著(χ2=2.35, P=0.13)。在IV期, 雄性个体体征波动幅度较大, 但是与同时期的雌性个体体征没有显著性差异(χ2=0.49, P=0.48)。
2.3 体征与胴长的关系Pearson相关性分析显示, 乌贼雌性成熟个体的体征与胴长呈弱的负相关函数关系(r=–0.06), 然而这种负相关关系不显著(t=–1.18, P=0.24)。同时, 不同发育时期个体体征与胴长亦呈负相关关系(III期, r=–0.18; IV期, r=–0.05; 图 3a), 但是均没有显著的相关性(III期, t=–1.27, P=0.21; IV期, t=–0.83, P= 0.41)。
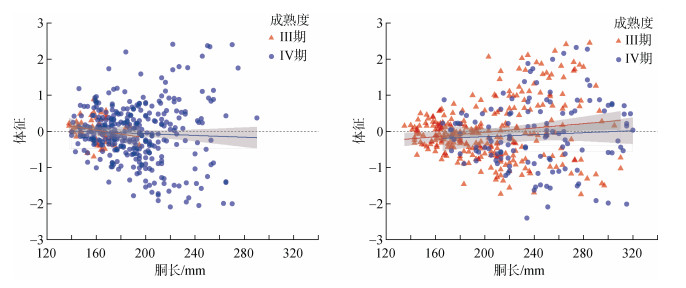 |
| 图 3 乌贼雌雄性个体体征与胴长的关系 Fig. 3 The relationship between body condition and mantle length for female and male Sepia officinalis. |
与成熟雌性个体相反, 成熟雄性个体的体征与胴长呈弱的正相关函数关系但不显著(r=0.09; t=1.95, P = 0.06)。不同发育时期的相关性分析显示(图 3b), III期个体体征与胴长呈显著的正相关性(r=0.15, t=–1.27, P= < 0.05); IV期个体体征亦与胴长呈正相关关系(r= 0.06), 但是不显著(t = 0.66, P = 0.51)。
2.4 体征与摄食的关系胃饱满度分析显示, 乌贼雌性、雄性个体的空胃率比较低(图 4)。其中, 雌性生理性成熟期(III期)个体的空胃率为14.00%, 功能性成熟产卵期(IV期)个体的空胃率为19.82%; 两个时期的个体均以胃饱满度1~2级为主, 分别为70.00%和58.58%(图 4a)。雄性个体在生理性成熟期和功能性成熟产卵期的空胃率分别为34.12%和22.04%; 与雌性个体相同, 雄性个体在生理性成熟期和功能性成熟排精期亦以胃饱满度1~2级为主, 分别为52.89%和55.89%, 并且功能性成熟排精期个体中胃饱满度3级的个体占比也比较高, 为16.53%(图 4b)。
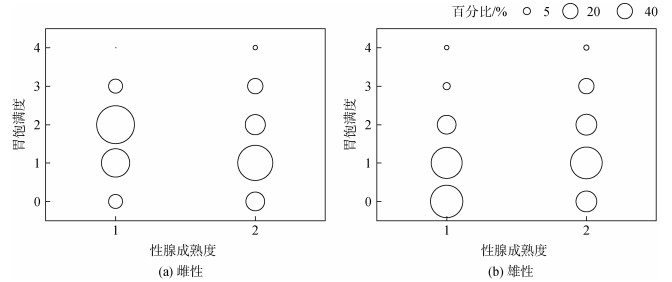 |
| 图 4 乌贼雌雄性个体的胃饱满度分布 Fig. 4 The distribution of stomach fullness degree for female and male Sepia officinalis |
雌性个体中, 生理性成熟个体的体征在不同胃饱满度之间没有显著性差异(χ2=4.69, P=0.32), 功能性成熟产卵期个体的体征则随着胃饱满度增大而显著增大(χ2=41.94, P < 0.05), 并且在胃饱满度0级和1级时波动幅度较大(图 5a-b)。雄性个体中, 生理性成熟期和功能性成熟排精期个体的体征均在不同胃饱满度之间存在显著性差异(III, χ2=17.33, P < 0.05; IV, χ2=10.26, P < 0.05), 随着胃饱满度增大而显著增大, 并且在同一胃饱满度时体征的波动幅度也较大(图 5c-d)。
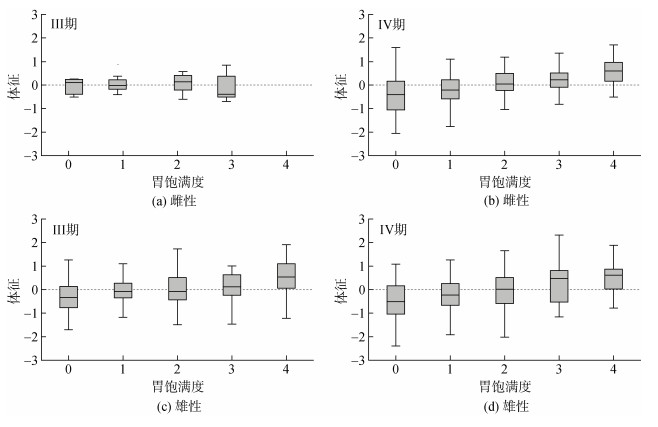 |
| 图 5 不同胃饱满度的乌贼雌雄性个体体征分布 Fig. 5 The distribution of body condition by different stomach fullness degree for female and male Sepia officinalis |
乌贼是东大西洋海域和地中海海域的常见种, 并且在东大西洋海域的分布横跨赤道, 自设得兰群岛向南延至南非外海[1-2]。这种地理分布的跨度, 以及不同地理纬度水域的水文特点形成了乌贼的多个地理群体, 并且具有栖息海域特殊性的体型结构特点[1, 6, 26]。本研究结果显示, 毛里塔尼亚外海乌贼成熟样本的胴长分布呈单峰值区间分布, 结合乌贼生命周期短、终生一次繁殖的生活史特点[1-2], 可以初步推断这些成熟个体来自于同一个地理群体。同时, 本研究乌贼成熟个体的最小胴长较其他海域群体的为大, 最大胴长与其他海域群体的差异则存在性别特殊性(表 2)。然而, 与英吉利海峡、法国比斯开湾、地中海等海域乌贼群体的成熟体型差异情况相同, 毛里塔尼亚外海乌贼群体的成熟体型差异较大, 雌性成熟个体的最小与最大成熟胴长相差可达185 mm, 雄性成熟个体的胴长相差达208 mm(表 2)。这种较大的成熟体型差异也一定地说明了乌贼在性腺发育成熟之后仍保持体细胞的生长。但是, 乌贼雌性、雄性个体的体质量-胴长幂函数关系式b值均小于匀速生长的b=3值, 说明这些成熟个体处于负异速生长阶段[27-28], 体细胞生长应该有所减缓且相对有限。这种相对有限的体细胞生长应该与英吉利海峡、法国比斯开湾、西班牙维戈湾、地中海等海域群体的生长情况相一致, 后者的体质量-胴长幂函数关系式b值亦小于匀速生长的b=3值(表 2)。
| 海域 | 性别 | 成熟胴长/mm | 体质量-胴长关系b值 |
| 英吉利海峡 | 雌性 | 70~270[8] | 2.78[6] |
| 雄性 | 80~360[8] | 2.64[6] | |
| 法国比斯开湾 | 雌性 | 120~290[5] | - |
| 雄性 | 80~350[5] | - | |
| 西班牙维戈湾 | 雌性 | 80~235[29] | 2.69[29] |
| 雄性 | 60~220[29] | 2.69[29] | |
| 地中海东部爱琴海 | 雌性 | 90~241[30] | 2.18[31] |
| 雄性 | 70~324[30] | 2.37[31] | |
| 地中海东部伊斯肯德伦湾 | 不分 | ≤200[32] | 2.88[32] |
| 地中海北部亚得里亚海 | 不分 | 60~180[33] | 2.77[34] |
| 毛里塔尼亚外海 | 雌性 | 138~323* | 2.39* |
| 雄性 | 135~343* | 2.22* | |
| 注: *为本研究。 | |||
通常, 体征是生物个体健康状况的重要表征, 与能量积累、生殖投入、繁殖产卵等密切相关[15, 35]。头足类(除鹦鹉螺种类外)营终生一次繁殖, 性腺开始发育后摄食转化的盈余能量以供给性腺组织生长和配子发生为主, 在生殖能量需求较大时转化肌肉组织存储的能量[22, 24-25], 而且生殖能量对存储能量转化利用的需求具有产卵策略特殊性[36]。一般地, 营瞬时终端产卵策略的种类在性腺发育开始后肌肉组织能量较快速地被转化利用, 体征下降显著[23]; 营间歇性终端产卵和多次产卵策略的种类则转化利用部分肌肉组织存储能量, 体征维持良好状态[22, 24, 37-38]。本研究的乌贼雌性、雄性成熟个体体征尽管在功能性成熟产卵期存在较大的波动变化, 但是与生理性成熟期相比较没有显著的下降趋势, 并且两者在同一性腺发育时期的体征亦没有显著性差异, 说明这些成熟个体保持着健康的肌肉组织结构, 体征维持良好状态, 与间歇性终端产卵者和多次产卵者在性腺成熟后保持良好体征的情况[22, 24, 37-38]相同。已有研究表明, 乌贼的产卵策略介于间歇性终端产卵和多次产卵之间[3-4], 配子异步发育成熟, 繁殖产卵期延长, 可达3.5个月[5-7]。因此, 乌贼在成熟产卵期维持较好的体征可能是配子异步发育、批次产卵的一种选择适应性, 以实现个体的生殖价值最大化[39]。
值得注意的是, 生物个体的体征与其体型密切相关, 后者反映了生物个体在维持体征过程中的能量积累能力, 体型越大者、能量积累能力也越大[40-41]。然而, 本研究的乌贼雌性和雄性成熟个体的体征均与其胴长没有显著的相关性, 尽管前者呈弱的负相关函数关系(r=–0.06)、后者则呈弱的正相关函数关系(r=0.09), 表明乌贼成熟个体的体征不因体型大小而变化。Castro等[42]和Neves等[43]研究发现乌贼群体的摄食生物种类随个体性腺发育而变化, 在性腺发育成熟后主要捕食能量物质高的较大型蟹类和鱼类, 以获取较高的能量积累和相对稳定的体征。毛里塔尼亚外海因上升流丰富、净初级生产力高, 拥有种类多样且资源丰富的饵料生物种类[10]。乌贼为机会型捕食者, 食性贪婪、食物种类繁多[1]。因此, 毛里塔尼亚外海乌贼成熟个体的体征不随体型而变化的情况, 或许是该海域的饵料生物群落结构较为稳定且种类多样丰富, 满足了不同成熟体型个体的能量积累需求以保持稳定的体征。但是, 目前尚未可知这些个体生长发育过程中的饵料生物种类变化情况, 后续需加强胃含物分析, 结合组织脂肪酸生物标志物研究和组织能量积累分析, 以深入掌握该群体的体征变化特性。
生物个体保持摄食活动是维持体征的主要或唯一途径, 为个体存活、生长发育和繁殖提供必需的物质能量基础[44-45]。已有研究发现, 乌贼个体的摄食强度随着性腺发育而增强[42], 在成熟产卵期其胃重量饱满指数(=胃含物去灰分后干质量与湿体质量的比值)显著高于其他性腺发育时期[46]。同时, 乌贼对食物的消化吸收及其能量积累效率高, 如在水温20 ℃时食物消化并用于生长的能量可达其盈余能量积累的35%~80% [47]。本研究也发现, 乌贼雌性和雄性成熟个体的空胃率低, 胃饱满度≥1级的个体占70%~85%; 并且除了生理性成熟的雌性个体之外, 其他个体的体征均随着摄食强度(以胃饱满度等级为表征)增加而趋好。毛里塔尼亚外海常年水温为10~25 ℃[48]。因此, 毛里塔尼亚外海乌贼成熟个体保持较好的体征应该是正常的摄食行为和较高的食物消化吸收效率所致, 以维持相对延长的繁殖产卵活动[5-7], 增加成熟个体的生殖价值。
综上所述, 本研究通过成熟个体的体型、胃饱满度等, 初步阐明了乌贼雌性和雄性个体在性腺发育成熟后的体征变化情况。研究发现, 毛里塔尼亚外海乌贼成熟个体来自于同一个地理群体, 与其他海域群体相同, 其最大与最小成熟胴长差异大。成熟个体的体征保持平稳状态, 在功能性成熟产卵期没有显著的下降趋势。同时, 这些成熟个体体征与体型没有显著的函数关系, 但是与摄食强度密切相关, 胃饱满度越高、体征越好。这些结果表明, 乌贼成熟个体保持体细胞生长, 并通过正常的摄食活动保持较好的体征, 可能是对其配子异步发育、批次产卵且繁殖期延长等繁殖习性的选择适应性, 以实现个体生殖价值最大化。研究结果有助于深入认知毛里塔尼亚外海乌贼群体的生长发育特性, 为科学开发该资源提供重要的资料参考, 也为开展其他头足类的体征生长研究提供借鉴。但是, 本研究并不能完全解释性腺发育成熟至产卵结束后乌贼体征的变化规律, 今后需从能量积累及其组织间的投入分配等方面来研究其体征的变化过程。
| [1] |
GUERRA Á, ROBIN J P, SYKES A, et al. Sepia officinalis in Cephalopod biology andfisheries in Europe: II. Species Accounts[J]. ICES Cooperative Research Report, 2015, 325: 53-72. |
| [2] |
陈新军, 刘必林, 方舟, 等. 头足纲[M]. 北京: 海洋出版社, 2019: 347-348. CHEN Xinjun, LIU Bilin, FANG Zhou, et al. Tou Zu Gang[M]. Beijing: China Ocean Press, 2019: 347-348. |
| [3] |
BOLETZKY S V. Fecundity variation in relation to intermittent or chronic spawning in the cuttlefish, Sepia officinalis L. (Mollusca, Cephalopoda)[J]. Bulletin of Marine Science, 1987, 40(2): 382-387. |
| [4] |
LIN D, XUAN S, CHEN Z, et al. The ovarian development, fecundity and hypothesis on spawning pattern of common cuttlefish Sepia officinalis off Mauritania[J]. Fisheries Research, 2019, 210: 193-197. DOI:10.1016/j.fishres.2018.08.003 |
| [5] |
LE GOFF R, DAGUZAN J. Growth and Life Cycles of the Cuttlefish Sepia Officinalis L. (Mollusca: Cephalopoda) in South Brittany (France)[J]. Bulletin of Marine Science, 1991, 49(1/2): 341-348. |
| [6] |
DUNN M R. Aspects of the stock dynamics and exploitation of cuttlefish, Sepia officinalis (Linnaeus, 1758), in the English Channel[J]. Fisheries Research, 1999, 40(3): 277-293. DOI:10.1016/S0165-7836(98)00223-9 |
| [7] |
SYKES A V, DOMINGUES P M, ANDRADE J P. Effects of using live grass shrimp (Palaemonetes varians) as the only source of food for the culture of cuttlefish, Sepia officinalis (Linnaeus, 1758)[J]. Aquaculture International, 2006, 14(6): 551-568. DOI:10.1007/s10499-006-9054-1 |
| [8] |
GRAS M, SAFI G, LEBREDONCHEL H, et al. Stock structure of the English Channel common cuttlefish Sepia officinalis (Linnaeus, 1758) during the reproduction period[J]. Journal of the Marine Biological Association of the United Kingdom, 2016, 96(1): 167-176. DOI:10.1017/S0025315415001162 |
| [9] |
GUERRA A. Ecology of Sepia officinalis[J]. Vie et Milieu, 2006, 56(2): 97-107. |
| [10] |
DEMARCQ H, SOMOUE L. Phytoplankton and primary productivity off Northwest Africa[J]. IOC Technical Series, 2015, 115: 161-174. |
| [11] |
FAO. The State of World Fisheries and Aquaculture 2016. Contributing to food security and nutrition for all[M]. Rome: FAO, 2016, 200.
|
| [12] |
陈新军. 世界头足类资源开发现状及我国远洋鱿钓渔业发展对策[J]. 上海海洋大学学报, 2019, 28(3): 321-330. CHEN Xinjun. Development status of world cephalopod fisheries and suggestions for squid jigging fishery in China[J]. Journal of Shanghai Ocean University, 2019, 28(3): 321-330. |
| [13] |
黄宪忠. 中国与毛里塔尼亚渔业合作回顾和展望[J]. 渔业信息与战略, 2013, 28(4): 307-311. HUANG Xianzhong. Review and outlook of fisheries cooperation between China and Mauritania[J]. Fishery Information and Strategy, 2013, 28(4): 307-311. DOI:10.3969/j.issn.1004-8340.2013.04.010 |
| [14] |
BLOOR I S M, WEARMOUTH V J, COTTERELL S P, et al. Movements and behaviour of European common cuttlefish Sepia officinalis in English Channel inshore waters: First results from acoustic telemetry[J]. Journal of Experimental Marine Biology and Ecology, 2013, 448: 19-27. DOI:10.1016/j.jembe.2013.06.013 |
| [15] |
GREEN A J. Mass/length residuals: measures of body condition or generators of spurious results?[J]. Ecolo gy, 2001, 82(5): 1473-1483. |
| [16] |
WHITE R G, ROWELL J E, HAUER W E. The role of nutrition, body condition and lactation on calving success in muskoxen[J]. Journal of Zoology, 1997, 243(1): 13-20. DOI:10.1111/j.1469-7998.1997.tb05752.x |
| [17] |
KETOLA T, KOTIAHO J S. Inbreeding, energy use and condition[J]. Journal of Evolutionary Biology, 2009, 22(4): 770-781. DOI:10.1111/j.1420-9101.2009.01689.x |
| [18] |
VLECK C M, VLECK D. Physiological condition and reproductive consequences in adelie penguins[J]. Integrative and Comparative Biology, 2002, 42(1): 76-83. DOI:10.1093/icb/42.1.76 |
| [19] |
ICES. Report of the Workshop on sexual maturity staging of cephalopods, 8-11 November 2010[M]. Livorno, Italy: ICES, 2010: 1-97.
|
| [20] |
陈新军. 渔业资源与渔场学[M]. 第2版. 北京: 海洋出版社, 2014: 1-460. CHEN Xinjun. Fisheries resource and fishing ground[M]. 2nd. Beijing: China Ocean Press, 2014: 1-460. |
| [21] |
MOLTSCHANIWSKYJ N A, SEMMENS J M. Limited use of stored energy reserves for reproduction by the tropical loliginid squid Photololigo sp[J]. Journal of Zoology, 2000, 251(3): 307-313. DOI:10.1111/j.1469-7998.2000.tb01081.x |
| [22] |
MCGRATH B, JACKSON G. Egg production in the arrow squid Nototodarus gouldi (Cephalopoda: Ommastrephidae), fast and furious or slow and steady?[J]. Marine Biology, 2002, 141(4): 699-706. DOI:10.1007/s00227-002-0864-z |
| [23] |
JACKSON G D, SEMMENS J M, PHILLIPS K L, et al. Reproduction in the deepwater squid Moroteuthis ingens, what does it cost?[J]. Marine Biology, 2004, 145(5): 905-916. DOI:10.1007/s00227-004-1375-x |
| [24] |
林东明, 陈新军, 魏嫣然, 等. 阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入[J]. 水产学报, 2017, 41(1): 70-80. LIN Dongming, CHEN Xinjun WEI Yanrana, et al. Energy accumulation of both somatic and reproductive tissues and its allocation to reproduction in Argentinean short-fin squid (Illex argentinus)[J]. Journal of fisheries of China, 2017, 41(1): 70-80. |
| [25] |
韩飞, 陈新军, 林东明, 等. 东太平洋赤道海域茎柔鱼体征生长及生殖投入[J]. 水产学报, 2019, 43(12): 2511-2522. HAN Fei, CHEN Xinjun, LIN Dongming, et al. The body condition and reproductive investment of Dosidicus gigas in the equatorial waters of eastern Pacific Ocean[J]. Journal of Fisheries of China, 2019, 43(12): 2511-2522. |
| [26] |
陈子末, 陈新军, 林东明, 等. 毛里塔尼亚外海乌贼的繁殖力特性研究[J]. 上海海洋大学学报, 2017, 26(4): 597-606. CHEN Zimo, CHEN Xinjun, LIN Dongming, et al. The fecundity of common cuttlefish (Sepia officinalis) in the offshore area of Mauritania[J]. Journal of Shanghai Ocean University, 2017, 26(4): 597-606. |
| [27] |
黄真理, 常剑波. 鱼类体长与体重关系中的分形特征[J]. 水生生物学报, 1999, 23(4): 330-336. HUANG Zhenli, CHANG Jianbo. Fractal characteristics of length-weight relationship in fish[J]. Acta Hydrobiolo gica Sinica, 1999, 23(4): 330-336. DOI:10.3321/j.issn:1000-3207.1999.04.006 |
| [28] |
FROESE R. Cube law, condition factor and weight– length relationships: history, meta-analysis and recommendations[J]. Journal of Applied Ichthyology, 2006, 22(4): 241-253. DOI:10.1111/j.1439-0426.2006.00805.x |
| [29] |
GUERRA A, CASTRO B G. On the life cycle of Sepia officinalis (Cephalopoda, Sepioidea) in the ria de Vigo (NW Spain)[J]. Cahiers de Biologie Marine, 1988, 29: 395-405. |
| [30] |
ÖNSOY B, SALMAN A. Reproductive biology of the common Cuttlefish Sepia officinalis L. (Sepiida: Cephalopoda) in the Aegean Sea[J]. Turkish Journal of Veterinary and Animal Sciences, 2005, 29(3): 613-619. |
| [31] |
LEFKADITOU E, VERRIOPOULOS G, VALAVANIS V. Research on cephalopod resources in Hellas[M]// PAPACONSTANTINOU C, ZENETOS A, VASSILOPOULOU V, et al. State of Hellenic Fisheries. Athens: HCMR Publications, 2007: 440-451.
|
| [32] |
DUYSAK Ö, SENDÃO J, BORGES T, et al. Cephalopod distribution in Iskenderun Bay (Eastern Mediterranean-Turkey)[J]. Journal of Fisheries Sciences, 2008, 2(2): 118-125. |
| [33] |
BETTOSO N, BORME D, FARESI L, et al. New insights on the biological parameters of the exploited cuttlefish Sepia officinalis L. (Mollusca: Cephalopoda) in the northern Adriatic Sea in relation to the main fishing gears employed[J]. Mediterranean Marine Science, 2016, 171(2): 152-162. |
| [34] |
MANFRIN PICCINETTI G, GIOVANARDI O. Données sur la biologie de Sepia officinalis L. dans l'Adriatique obtenues lors de expéditions Pipeta[J]. FAO Fisheries Report, 1984, 290: 135-138. |
| [35] |
FEINER Z S, SHAW S L, SASS G G. Influences of female body condition on recruitment success of walleye (Sander vitreus) in Wisconsin lakes[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2019, 4: 1-14. |
| [36] |
ROCHA F, GUERRA Á, GONZÁLEZ Á F. A review of reproductive strategies in cephalopods[J]. Biological Reviews, 2001, 76(3): 291-304. DOI:10.1017/S1464793101005681 |
| [37] |
LIN D, HAN F, XUAN S, et al. Fatty acid composition and the evidence for mixed income–capital breeding in female Argentinean short-fin squid Illex argentinus[J]. Marine Biology, 2019, 166(7): 90. DOI:10.1007/s00227-019-3534-0 |
| [38] |
CHEN X, HAN F, ZHU K, et al. The breeding strategy of female jumbo squid Dosidicus gigas: energy acquisition and allocation[J]. Scientific Reports, 2020, 10(1): 9639. DOI:10.1038/s41598-020-66703-5 |
| [39] |
MCBRIDE R S, SOMARAKIS S, FITZHUGH G R, et al. Energy acquisition and allocation to egg production in relation to fish reproductive strategies[J]. Fish and Fisheries, 2015, 16(1): 23-57. |
| [40] |
LIN D, CHEN X, CHEN Y, et al. Ovarian development in Argentinean shortfin squid Illex argentinus: group- synchrony for corroboration of intermittent spawning strategy[J]. Hydrobiologia, 2017, 795(1): 327-339. DOI:10.1007/s10750-017-3154-y |
| [41] |
PEIG J, GREEN A J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method[J]. Oikos, 2009, 118(12): 1883-1891. DOI:10.1111/j.1600-0706.2009.17643.x |
| [42] |
CASTRO B G, GUERRA A. The diet of Sepia officinalis (Linnaeus, 1758) and Sepia elegans (D'Orbigny, 1835) (Cephalopoda, Sepioidea) from the Ría de Vigo (NW Spain)[J]. Scientia Marina, 1990, 54(4): 375-388. |
| [43] |
NEVES A, SEQUEIRA V, VIEIRA A R, et al. Feeding habits of the cuttlefish Sepia officinalis during its life cycle in the Sado estuary (Portugal)[J]. Hydrobiologia, 2009, 636(1): 479. DOI:10.1007/s10750-009-9976-5 |
| [44] |
PORTNER E J, MARKAIDA U, ROBINSON C J, et al. Trophic ecology of Humboldt squid, Dosidicus gigas, in conjunction with body size and climatic variability in the Gulf of California, Mexico[J]. Limnology and Ocea no graphy, 2019, 2: 1-17. |
| [45] |
FREEMAN N E, NORRIS D R, SUTTON A O, et al. Raising young with limited resources: supplementation improves body condition and advances fledging of Canada Jays[J]. Ecology, 2020, 101(1): e02909. |
| [46] |
QUINTELA J, ANDRADE J P. Diel feeding rhythms, daily ration and gastric evacuation rates of Sepia officinalis in the Ria Formosa Lagoon (south Portugal)[J]. Bulletin of Marine Science, 2002, 71(2): 665-680. |
| [47] |
GRIGORIOU P, RICHARDSON C A. The effect of ration size, temperature and body weight on specific dynamic action of the common cuttlefish Sepia officinalis[J]. Marine Biology, 2008, 154(6): 1085-1095. DOI:10.1007/s00227-008-1002-3 |
| [48] |
VALDÉS L, DÉNIZ-GONZÁLEZ I. Oceanographic and biological features in the Canary Current Large Marine Ecosy[M]. Paris, France: IOC-UNESCO, 2015: 1-383.
|
 2022, Vol. 46
2022, Vol. 46


