文章信息
- 张文斌, 孙伟, 许歆, 王洪波, 郑碧琪, 鲁超, 李靖, 穆景利. 2022.
- ZHANG Wen-bin, SUN Wei, XU Xin, WANG Hong-bo, ZHENG Bi-qi, LU Chao, LI Jing, MU Jing-li. 2022.
- 某核电厂附近海域生态环境特征及潜在致灾生物研究
- Ecological environment and the potential hazard-causing organisms in the sea area near the nuclear power plant
- 海洋科学, 46(7): 32-43
- Marine Sciences, 46(7): 32-43.
- http://dx.doi.org/10.11759/hykx20211101001
-
文章历史
- 收稿日期:2021-11-01
- 修回日期:2021-12-29
2. 自然资源部海洋生态监测与修复技术重点实验室, 上海 201206;
3. 福建宁德核电有限公司, 福建 宁德 355200;
4. 闽江学院 地理与海洋学院, 福建 福州 350108
2. Key Laboratory of Marine Ecological Monitoring and Restoration Technologies, MNR, Shanghai 201206, China;
3. Fujian Ningde Nuclear Power Co., Ltd., Ningde 355200, China;
4. College of Geography and Oceanography, Minjiang University, Fuzhou 350108, China
核能作为清洁低碳、高效安全的能源, 是我国实现碳中和的一个重要选择。目前国内的核电厂均沿海而建, 取海水进入核电厂作为最终冷却水带走热量[1]。当前核电厂建设前期的海洋生态调查与评价主要是判断核电厂施工和运行对海洋生态环境的可能影响, 缺乏对海洋生物危害核电厂正常运行的针对性研究[2]。事实上, 国内外滨海核电厂已发生多起海洋生物暴发导致取水系统异常的事件。2008—2015年, 世界核电运营者协会(World Association of Nuclear Operators, WANO)公布了60多起核电厂冷却水取水口堵塞导致机组降功率、反应堆手动停堆和反应堆自动停堆的事件, 其中有40多起是由海洋生物暴发和入侵导致的。自2013年以来, 我国渤海、东海、南海海区多处滨海核电厂取水海域分别发生了水母、球形棕囊藻(Phaeocystis globosa)、毛虾(Acetes sp.)、海地瓜(Acaudina molpadioides)等海洋生物影响工程取水的事件, 严重时导致机组的降负荷运行、跳机乃至跳堆[3]。
某核电厂首台机组于2013年4月投入商业运行, 一期工程于2016年7月全面建成。调查表明, 该核电厂投入使用后, 周边海域水质保持较好, 说明核电厂运行对邻近海域水质影响不大[4-5]。然而, 海地瓜曾大规模进入某核电厂取水口的鼓网, 对冷源系统取水造成一定的影响[3]。为了深入了解该核电厂对临近海域水质和生物的影响, 以及潜在致灾生物存在现状和暴发的可能性, 本文对2018年该核电厂附近的海洋生态环境状况进行分析, 并根据海洋生物的生长特点和暴发历史, 提出潜在致灾生物名录, 为核电厂进行海洋生物灾害预防提供基础。
1 材料与方法 1.1 调查海域与采样方法根据某核电厂的布局, 在取水口、港池区和排水口临近海域各布设4个调查站位, 采样时间分别为2018年1月(冬季)、4月(春季)、7月(夏季)和10月(秋季)。
按《海洋监测规范》[6]和《海洋调查规范》[7]对调查海域的水质参数和生物样品进行采集和检测。使用采水器采集表层和底层海水, 分别用于水质参数的测定和浮游植物的分析。利用CTD多参数水质仪对水温(T)、盐度(S)、pH、溶解氧(DO)等水质参数进行测量。量取一定体积的海水经0.45 μm的滤膜过滤, 称量留在滤膜上的悬浮物重量, 计算海水中的悬浮物(SP)浓度。滤液加入三氯甲烷固定后–20 ℃保存, 用营养盐自动分析仪测定铵盐(NH4-N)、硝酸盐(NO3-N)、亚硝酸盐(NO2-N)、磷酸盐(PO4-P)、硅酸盐(SiO3-Si)的浓度。无机氮浓度为NH4-N、NO3-N和NO2-N浓度之和。浮游植物样品使用5%的甲醛溶液固定, 在倒置显微镜下对浮游植物进行种类鉴定和细胞计数。使用浅水Ⅰ型网(孔径0.505 mm)和浅水Ⅱ型网(孔径0.160 mm)分别采集大中型浮游动物和中小型浮游动物样品, 用5%的甲醛溶液固定, 在体视显微镜下进行物种鉴定和计数。1月份未进行大中型浮游动物样品采集, 中小型浮游动物样品因未记录采样滤水量, 无法计算密度, 仅进行物种鉴定。用0.05 m2的挖斗式采泥器获取底泥样品, 通过底栖动物漩涡分选装置筛选底栖动物。样品用75%乙醇固定, 然后在实验室内对底栖生物进行物种鉴定和计数。
1.2 数据分析处理优势种用Mcnaughton优势度指数(Y>0.02)[8]判断, 物种丰富度、物种多样性和物种均匀度分别采用Margalef指数D[9], Shannon-Weaver多样性指数H′[10]和Pielou指数J[11]计算。各指数公式如下:
| $ Y = \frac{{{n_i}}}{N}{f_i}, $ | (1) |
| $ D = \frac{{S - 1}}{{\ln N}}, $ | (2) |
| $ {H}^{\prime }=-\sum\limits_{i=1}^{S}\frac{{n}_{i}}{N}\mathrm{ln}\left(\frac{{n}_{i}}{N}\right) , $ | (3) |
| $ J= \frac{ {H}^{\prime }}{\mathrm{ln}S} , $ | (4) |
式中, N为采集样品中所有物种的总个体数, S为样品中的物种总数, ni为第i种的总个体数, fi为第i种在各站位中出现的频率。
由于调查海域的水深较浅(平均水深6.3 m), 表层海水和底层海水在同一时间的水质参数数值、浮游植物细胞密度和优势种无显著差异, 因此, 取表、底层相关数据的平均值进行后续分析。
水质富营养化的评价采用富营养化指数法[12], 评价公式如下:
| $ E=\frac{耗氧有机物\times 无机氮\times 无机磷}{4500}\times {10}^{6} , $ | (5) |
其中, 耗氧有机物(COD)、无机氮和无机磷(磷酸盐)的质量浓度(以下简称浓度)单位为mg/L。富营养化等级指标划分按如下标准: E < 1, 贫营养; 1≤E≤2, 轻度富营养; 2≤E≤5, 中度富营养; 5≤E≤15, 重富营养; E≥15, 严重富营养[5]。
为了探究环境因子的时空差异, 对环境因子进行主成分分析(principal component analysis, PCA)。采用多元统计分析确定生物群落、个别物种的时空分布与环境因子的相互作用关系。基于去趋势分析(detrended correspondence analysis, DCA)判断, 当第一轴长度小于3, 采用线性模型冗余分析法(redundancy analysis, RDA)进行分析, 当第一轴长度大于3, 采用单峰模型典范对应分析(canonical correspondence analysis, CCA)进行分析[13]。以上分析均在CANOCO 5.0软件包上进行。
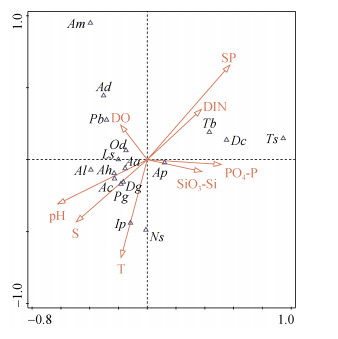
2 结果 2.1 水质参数2018年某核电厂附近海域水质参数变化如图 1所示。水温的变化范围为12.25~33.28 ℃, 最高温出现在7月排水口海域, 最低温出现在1月港池区海域。在1、4、7月, 排水口海域水温高于其他调查海域, 4月排水口海域水温甚至高出取水口水温约4.0 ℃。四季盐度范围为26.86~32.79, 7月最高, 1月最低。总体而言, 港池区海水盐度略高; 1月各区域盐度差异最小, 仅为0.06; 10月各区域盐度差异最大, 港池区比排水口高0.78。pH波动较小, 在7.96~8.20之间, 最高值和最低值分别出现在7月取水口海域和10月排水口海域。溶解氧的变化趋势与水温相反, 1、4月高, 7、10月低。溶解氧质量浓度(以下简称溶解氧浓度)最高值9.20 mg/L出现在1月取水口海域, 最低值6.81 mg/L在7月排水口海域。其中, 1月各区域的溶解氧浓度差异最小(0.28 mg/L), 7月港池区的溶解氧浓度比排水口高1.75 mg/L, 区域差值最大。悬浮物浓度的季节波动较大, 冬季悬浮物含量平均值是其他季节的2~5倍, 最高值和最低值分别出现在1月取水口海域(123.8 mg/L)和4月港池区海域(15.2 mg/L)。
 |
| 图 1 水质参数的季节变化 Fig. 1 Seasonal changes in the water quality parameters |
调查海域磷酸盐、无机氮和硅酸盐的浓度范围分别为0.009~0.046 mg/L, 0.079~0.562 mg/L和0.322~ 1.195 mg/L。三者的季节变化呈现V型趋势, 1、10月较高, 4、7月较低, 最高值均出现在10月排水口海域, 最低值出现在7月港池区海域(磷酸盐和硅酸盐)或取水口海域(无机氮)。不同区域磷酸盐、无机氮和硅酸盐的浓度变化趋势也几乎一致, 其中无机氮浓度在7月相对较低。
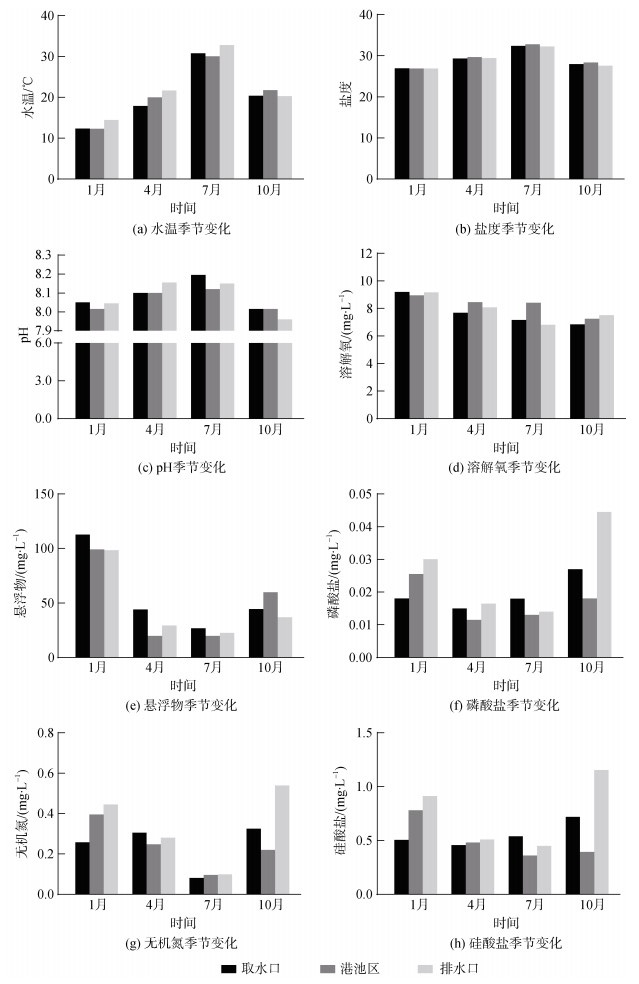
2.2 浮游植物浮游植物细胞密度变化范围为4.14×103~ 2.90×104个/L, 最低值和最高值分别出现在4月排水口海域和10月港池区海域(图 2a)。1月共鉴定出硅藻46种, 甲藻1种, 绿藻1种, 优势种为中肋骨条藻(Skeletonema costatum)和具槽直链藻(Melosira sulcata), 各区域间差异较小。4月共鉴定出硅藻40种, 甲藻7种, 优势种为东海原甲藻(Prorocentrum donghaiense), 浮游植物平均细胞密度不及其他月份的1/2。7月浮游植物样品共鉴定出硅藻35种, 甲藻9种, 蓝藻1种, 优势种较多, 包括中肋骨条藻、尖刺拟菱形藻(Pseudo-nitzschia pungens)、琼氏圆筛藻(Coscinodiscus jonesianus)、海洋曲舟藻(Pleurosigma pelagicum)和小细柱藻(Leptocylindrus minimus)。排水口浮游植物细胞密度显著较高, 分别为取水口和港池区的3倍和2倍。10月共鉴定出硅藻28种, 甲藻10种, 蓝藻1种, 优势种为中肋骨条藻, 港池区浮游植物细胞密度是其他区域的2~3倍。多样性指数H′、均匀度指数J和丰富度指数D呈现相似的变化规律(图 2b): 1月较低, 4、7月较高, 10月急剧降至最低值; 这与浮游植物细胞密度的季节变化规律相反。
 |
| 图 2 浮游植物的细胞密度和群落多样性指数季节变化 Fig. 2 Seasonal changes in phytoplankton cell abundance and the community diversity indices |
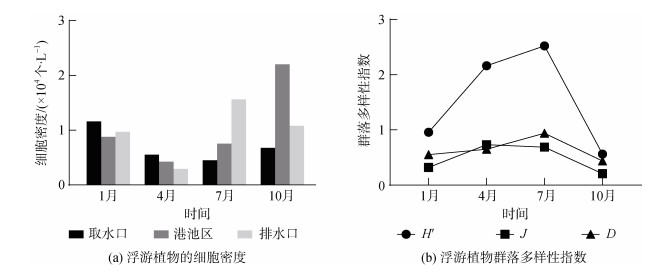
2018年4月调查结果显示, Ⅰ型网样品共鉴定出大中型浮游动物27种, 隶属于11个类群, 优势种为墨氏胸刺水蚤(Centropages mcmurrichi)、中华哲水蚤(Calanus sinicus)和球型侧腕水母(Pleurobrachia globosa)。排水口大中型浮游动物平均密度最低(6.88 ind./m3), 港池区最高(56.50 ind./m3), 因为港池区其中一个站位有高密度的球型侧腕水母和中华哲水蚤(图 3a)。Ⅱ型网采样共获得中小型浮游动物36种, 隶属于10个类群, 优势种为小拟哲水蚤(Paracalanus parvus)。由于在取水口某站位小拟哲水蚤的密度高达29 700 ind./m3, 取水口中小型浮游动物的平均密度(11 640.00 ind./m3)高出港池区(1 232.81 ind./m3)1个数量级(图 3b)。大中型浮游动物比中小型浮游动物物种数少, 但物种多样性H′和均匀度J较高(图 3c、3d), 这与中小型浮游动物群落中存在密度高出其他物种1~2个数量级的绝对优势种(小拟哲水蚤)有关。
 |
| 图 3 Ⅰ型网和Ⅱ型网采集的浮游动物的密度和群落多样性指数季节变化 Fig. 3 Seasonal changes in the density and the community diversity indices of zooplankton collected in typeⅠand type Ⅱ nets |
7月, Ⅰ型网样品共鉴定出大中型浮游动物12个类群51种, 密度变化范围为103.76~400.63 ind./m3, 优势种为球型侧腕水母、刺尾纺锤水蚤(Acartia spinicauda)和薮枝螅水母(Obelia sp.)。取水口大中型浮游动物密度达到调查海域全年最高值, 因为该区域球型侧腕水母和刺尾纺锤水蚤的密度显著高于其他区域。中小型浮游动物(Ⅱ型网样品)共14个类群60种, 密度变化范围为4 174.06~14 948.49 ind./m3, 优势种为针刺拟哲水蚤(Paracalanus aculeatus)、刺尾纺锤水蚤、长腹剑水蚤(Oithona sp.)和小拟哲水蚤。取水口和排水口海域中小型浮游动物密度接近, 港池区有2个站位的针刺拟哲水蚤密度高达12 685.71 ind./m3和16 507.94 ind./m3, 故平均值远高于另外2个海域。大中型、中小型浮游动物群落的多样性指数H′和丰富度指数D均在7月达到高峰, 均匀度指数J前者略微降低、后者显著升高。
10月, Ⅰ型网样品共鉴定大中型浮游动物8个类群37种, 优势种为背针胸刺水蚤(Centropages dorsispinatus)、精致真刺水蚤(Euchaeta concinna)和太平洋纺锤水蚤(Acartia pacifica)。密度变化范围为24.88~125.70 ind./m3, 取水口最高, 排水口最低。中小型浮游动物(Ⅱ型网样品)40种, 隶属于9个类群, 密度变化范围为421.55~1 677.86 ind./m3。其中, 港池区密度比排水口高出1个数量级, 因为港池区海域第一优势种针刺拟哲水蚤较多。此外, 中小型浮游动物优势种还包括太平洋纺锤水蚤、近缘大眼剑水蚤(Corycaeus affinis)、拟长腹剑水蚤(Oithona similis)和小拟哲水蚤。10月大中型浮游动物群落多样性指数H′、均匀度指数J以及丰富度指数D均低于其他月份, 中小型浮游动物多样性指数和均匀度指数与7月接近, 丰富度指数略微降低。
2.4 底栖动物2018年4次调查中, 底栖生物物种数为54~69, 隶属于8个类群, 环节动物门(Annelida)种数最多, 平均栖息密度最高; 棘皮动物门(Echinodermata)个体较大、较重, 平均生物量最高; 豆形短眼蟹(Xenophthalmus pinnotheroides)是全年的优势物种。1月优势种为豆形短眼蟹、丝异须虫(Heteromastus filiforms)、长吻沙蚕(Glycera chirori)和角海蛹(Ophelia acuminata), 各区域底栖动物栖息密度和生物量范围分别为37.50~77.50 ind./m2和7.44~11.07 g/m2, 排水口、港池区和取水口密度依次降低, 生物量分布相反(图 4a、4b)。4月优势种为豆形短眼蟹、角海蛹、奇异稚齿虫(Paraprionospio pinnata)、丝异须虫和长吻沙蚕, 各区域底栖动物栖息密度和生物量范围分别为31.67~84.00 ind./m2和5.85~37.57 g/m2。虽然取水口底栖动物栖息密度最高, 但其生物量远高于其他区域的主要原因是取水口发现了1只成年海地瓜, 而成年海地瓜的质量(50.50 g/ind.)比其他底栖生物个体高1个数量级。7月优势种有长吻沙蚕、绒毛细足蟹(Raphidopus ciliatus)、钩虾(Gammaridae species)、豆形短眼蟹和背毛背蚓虫(Notomastus aberans), 各区域底栖动物栖息密度(23.75~83.00 ind./m2)和生物量(5.79~16.71 g/m2)的变化趋势一致, 取水口、港池区、排水口依次降低。10月优势种为豆形短眼蟹、钩虾、寡鳃齿吻沙蚕(Nephtys oligobranchia)、奇异稚齿虫和丝异须虫, 各区域底栖动物栖息密度和生物量范围分别为89.50~255.00 ind./m2和8.11~44.05 g/m2。虽然取水口底栖动物栖息密度略低于港池区, 但生物量是其3倍, 主要是因为取水口个别站位出现的短吻铲荚螠(Listriolobus brevirostris)(13.10 g/ind.)和棘刺锚参(Protankyra bidentata)(12.24 g/ind.)个体质量较大。排水口底栖动物栖息密度在10月达全年最高, 这是因为某个站位的奇异稚齿虫密度(270.00 ind./m2)高于其他物种1个数量级, 而生物量较大则是因为短吻铲荚螠在绝大多数站位贡献了大于32 g/m2的生物量。
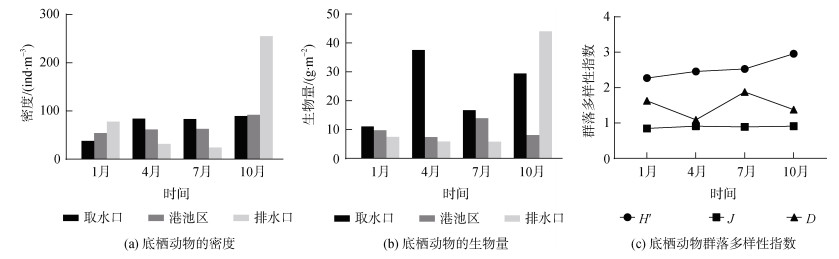 |
| 图 4 底栖动物的密度、生物量和群落多样性指数季节变化 Fig. 4 Seasonal changes in the zoobenthos density, biomass, and community diversity indices |
相比于浮游植物和浮游动物, 调查海域底栖动物群落的物种多样性指数H′(2.27~2.96)、均匀度指数J(0.85~0.91)和丰度指数D(1.09~1.63)总体较高, 季节波动较小(图 4c)。这表明: 底栖动物物种丰度较高且分布较为均匀, 群落多样性水平较高; 底栖环境受污染程度较低, 群落结构处于受轻微扰动状态。
3 讨论 3.1 潜在致灾生物海洋生物通过异常增殖或聚集, 可能堵塞核电厂冷却水取水管道、影响核电厂机组运行安全。因此, 根据核电厂附近海域海洋生物特点, 筛选潜在致灾生物, 将为核电厂的安全预警提供重要的科学支撑。个体或群体大小大于核电厂取水口鼓网的网孔直径(3 mm)、运动能力弱、易聚集或易暴发性增殖的海洋生物, 可能会对核电厂冷源系统产生威胁[1, 14-15]。根据2018年的调查结果, 本研究筛选出某核电厂附近海域影响冷源安全的潜在致灾生物, 并对其风险等级进行划分(表 1)。划分标准如下: 国内外已报道的影响核电厂冷源安全的物种, 以及与致灾生物形态和生活习性相似且曾在某核电厂临近海域大量聚集的物种, 风险等级为“高”; 与致灾生物在形态和生活习性上相似, 堵塞冷源系统可能性较高的物种, 风险等级为“中”。
| 类群 | 物种名 | 拉丁文名 | 生物特性 | 春季 | 夏季 | 秋季 | 冬季 | 风险等级 |
| 浮游植物 | 束毛藻 | Trichodesmium sp. | 藻丝体长1~4 mm,群体可由数百条藻丝体组成[20-21] | * | * | 中 | ||
| 夜光藻 | Noctiluca scintillans | 细胞直径大, 150~2000 um,肉眼可见[21] | * | * | * | 中 | ||
| 浮游动物 | 球星侧腕水母 | Pleurobrachia globosa | 4种水母个体大于3 mm,有聚集特性; 繁殖能力强,生长速度快; 主要成分是水和胶质,易破碎; 运动能力弱,易随水漂流[14, 18] | ** | ** | * | 高 | |
| 双生水母 | Diphyes chamissonis | * | 中 | |||||
| 半口壮丽水母 | Aglaura hemistoma | * | * | 中 | ||||
| 拟细浅室水母 | Lensia subtiloides | * | * | * | 中 | |||
| 异体住囊虫 | Oikopleura dioica | 可通过上皮细胞分泌形成胶质“住屋”,一天最多可以脱落并形成新的住屋16次[22-23] | * | * | * | * | 中 | |
| 软拟海樽 | Doliotltta gegenbauri | 透明胶质状, 由纤维质的被囊包裹, 易聚集 | * | 中 | ||||
| 漂浮小井伊糠虾 | liella pelagicus | 2种糠虾个体约10 mm,有集群现象,在极端天气下可能随水流与多种海生物一起堵塞取水口[24] | * | 中 | ||||
| 长额刺糠虾 | Acanthomysis longirostris | * | 中 | |||||
| 底栖动物 | 海地瓜 | Acaudina molpadioides | 3~20 cm,繁殖力强,受海水搅动易漂浮[25] | * | * | 高 | ||
| 棘刺锚参 | Protankyra bidentata | 10~28 cm,体壁密布锚形骨片,易黏附在取水口拦网[14] | * | * | * | 高 | ||
| 海葵 | Actiniaria sp. | 个体约10 cm,可吸水膨胀吐水收缩[19] | * | 高 | ||||
| 钩倍棘蛇尾 | Amphioplus ancistrotus | 3种蛇尾的盘的直径约10 mm,腕长约为盘直径的4~8倍, 盘易脱落, 腕易断,再生能力强; 喜群居; 繁殖力高; 当外部环境发生变化时易聚集,易暴发[26] | * | * | * | 中 | ||
| 洼颚倍棘蛇尾 | Amphioplus depressus | * | * | * | * | 中 | ||
| 薄倍棘蛇尾 | Amphioplus praestans | * | * | 中 | ||||
| 棒锥螺 | Turritella bacillum | 高134 mm,宽27 mm, 是产量较大的经济物种, 在某核电厂附近海域有较高的栖息密度和生物量[27] | * | * | 中 | |||
| 注: *表示该物种在此季节的调查中出现, **表示该物种为优势种。 | ||||||||
附近海域潜在影响核电厂冷源安全的浮游动物主要为水母。水母的主要成分是水和胶质, 易破碎; 运动能力弱, 易随水漂流; 易受到核电厂巨大取水量产生的卷吸效应的影响, 堵塞核电取水口。国内外关于水母堵塞核电厂取水口的事件常有报道, 如2011年6月, 英国、美国、日本、以色列均出现水母干扰核电厂运行的事件。2014年, 我国北方一核电厂出现海月水母堵塞取水口, 导致机组跳堆或低功率运行[16]。2020年7月, 该核电厂再次因水母入侵取水口, 导致鼓网压差升高、运行人员手动停堆。临近海域水母分布特征的研究表明, 夏季为潜在高风险季节, 其次是春季, 秋季和冬季基本不会因水母而引起核电厂冷源安全事故发生[17]。根据2018年对某核电厂周边海域浮游动物的调查结果, 球型侧腕水母曾在春季和夏季的大中型浮游动物群体中成为优势种, 暴发的可能性较大; 该种高7~12 mm, 宽5~10 mm, 大于鼓网网孔直径; 繁殖能力强, 生长发育速度极快, 每年4—7月是其主要的生殖季节[18]; 综上, 球型侧腕水母的风险等级为“高”。
潜在影响某核电厂冷源安全的底栖动物中, 暴发可能性最大的是海地瓜, 因为某核电厂取水口曾在2015年8、9月发生过海地瓜堵塞事件。2016年, 在某核电厂取水口曾打捞到大量海地瓜, 2018年春、冬季又有海地瓜出现。因此, 海地瓜对某核电厂冷源安全存在较高的威胁。
形态、个体与海地瓜相近的棘刺锚参也是潜在影响该核电厂冷源安全的致灾生物。棘刺锚参一般体长约10~15 cm, 最大可达28 cm, 直径15~20 mm。体呈蠕虫状, 体壁密布锚形骨片, 此骨片使虫体易于黏附在其他物体上, 如取水口拦网[14]。在2018年春、夏、秋季的调查结果中, 某核电厂取水口海域几乎所有站位的底泥中均检出棘刺锚参, 且是秋季底栖动物生物量的主要贡献者之一, 对取水安全有较大的潜在威胁, 风险等级为“高”。
海葵个体大小与海地瓜相当, 可吸水膨胀、吐水收缩[19]。海葵固着生活, 通常不易随水流移动, 但若在外界刺激或者极端天气时, 海葵可以漂浮起来, 随着水流运动, 堵塞鼓网。2016年, 某核电厂取水口疏浚工作中曾发现较多海葵。综上, 海葵的风险等级也较高。
3.2 生物与环境因子的关系某核电厂取水口、港池区和排水口的水质环境存在一定差异。从PCA分析结果(图 5)可以看出, 不同季节的样品聚集程度不同。春季样品(Apr1、Apr2、Apr3)聚集程度最高, 说明各区域水质环境差异较小, 且主要受pH值影响。夏季样品(Jul1、Jul2、Jul3)受温度、盐度和pH影响较大, 港池区的水质环境与取水口、排水口有比较明显的差异。秋季样品(Oct1、Oct2、Oct3)最为分散, 可能与该季节3个区域无机营养盐浓度差异较大有关。冬季样品(Jan1、Jan2、Jan3)受悬浮物和溶解氧的影响较大。
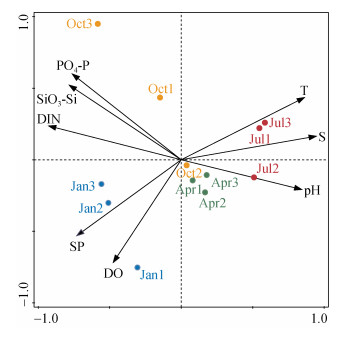 |
| 图 5 环境因子的PCA分析 Fig. 5 PCA analysis of the environmental factors 注: 蓝、绿、红、黄色圆点分别代表1月(冬季)、4月(春季)、7月(夏季)、10月(秋季)的样品, 样品名称中的1、2、3分别代表取水口、港池区和排水口。 |
在春、夏、冬季, 排水口水温比另外两个区域高(图 1a), 可见核电厂排水口的温排水对邻近海域的水温有显著影响。除了夏季, 排水口的无机营养盐浓度均比取水口和港池区高(图 1f—1h), 且在秋、冬季最为显著, 富营养化程度也是相同规律(表 2)。3个区域在秋、冬季存在一定程度的富营养化, 春、夏季均为贫营养。相比于某核电厂建成之前[5], 该海域2018年的水质富营养化程度没有明显上升。
| 区域 | 时间 | E | 富营养化评价 |
| 取水口 | 1月 | 1.39 | 轻度富营养 |
| 4月 | 0.79 | 贫营养 | |
| 7月 | 0.44 | 贫营养 | |
| 10月 | 1.90 | 轻度富营养 | |
| 港池区 | 1月 | 2.52 | 中度富营养 |
| 4月 | 0.51 | 贫营养 | |
| 7月 | 0.22 | 贫营养 | |
| 10月 | 0.70 | 贫营养 | |
| 排水口 | 1月 | 3.13 | 中度富营养 |
| 4月 | 0.88 | 贫营养 | |
| 7月 | 0.30 | 贫营养 | |
| 10月 | 3.16 | 中度富营养 |
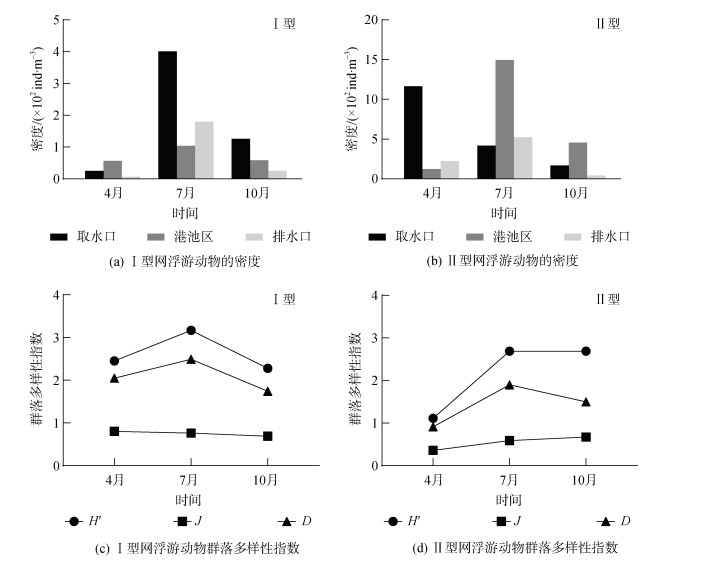
不同生物类群与环境因子的RDA排序分析结果显示(图 6), 浮游植物的细胞丰度与悬浮物、温度和磷酸盐的变化呈一定程度的正相关。其中, 浮游植物的细胞丰度与悬浮物和磷酸盐的浓度正相关性最高(表 3)。结合RDA分析和Spearman相关性分析的结果, 浮游动物的密度受温度和盐度的影响较大, 这与前人对该海域浮游动物与水环境因子关系研究的结果相似[20-28]。浮游植物、悬浮颗粒物和表层沉积物是很多底栖动物的主要食物来源, 而水体中无机营养盐浓度与浮游植物的密度和表层沉积物的分解释放有关, 因此, 底栖动物的密度与悬浮物和无机营养盐有较强的正相关性。将潜在致灾生物的密度与环境变量进行CCA分析(图 7), 发现绝大多数潜在致灾生物的密度变化与温度、盐度、pH和溶解氧密切相关, 包括高风险物种球型侧腕水母和海葵。球型侧腕水母属于亚热带外海种, 喜欢较高的水温和盐度[17, 29-30], 与温度和盐度的相关系数最大, 且为极显著正相关(表 3)。海葵受pH、盐度和温度的影响较大(图 7), 与盐度的变化呈显著正相关(表 3)。
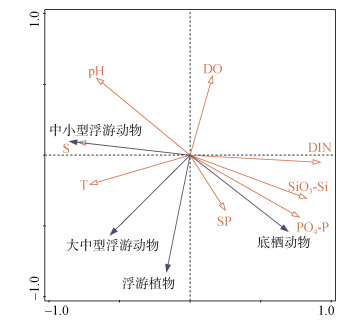 |
| 图 6 不同生物类群与环境变量的RDA排序图 Fig. 6 RDA ordination diagram showing the different biomes in relation to the environmental variables |
| 生物变量 | T | S | pH | DO | PO4-P | DIN | SiO3-Si | SP |
| 浮游植物 | 0 | –0.371 | –0.502 | –0.063 | 0.317 | 0.063 | –0.112 | 0.448 |
| 大中型浮游动物(Ⅰ型网) | 0.859** | 0.775** | 0.402 | –0.831** | –0.362 | –0.683* | –0.437 | –0.641* |
| 中小型浮游动物(Ⅱ型网) | 0.739** | 0.810** | 0.505 | –0.585* | –0.624* | –0.641* | –0.768** | –0.599* |
| 底栖动物 | 0.014 | –0.175 | –0.551 | –0.308 | 0.493 | 0.280 | 0.224 | 0.133 |
| 束毛藻(Ts) | 0.340 | 0.037 | –0.278 | –0.404 | 0.361 | –0.110 | 0.083 | 0.018 |
| 夜光藻(Ns) | 0.612* | 0.412 | 0.513 | –0.533 | –0.071 | –0.237 | 0.083 | –0.433 |
| 海地瓜(Am) | –0.500 | –0.231 | –0.139 | 0.172 | –0.027 | 0.312 | 0.032 | 0.301 |
| 棘刺锚参(Pb) | 0.200 | 0.370 | 0.196 | –0.337 | –0.155 | –0.183 | –0.216 | –0.187 |
| 海葵(Ac) | 0.521 | 0.640* | 0.538 | –0.156 | –0.233 | –0.650* | –0.220 | –0.441 |
| 钩倍棘蛇尾(Aa) | –0.137 | –0.179 | –0.099 | –0.087 | 0.365 | –0.033 | 0.345 | 0.379 |
| 洼颚倍棘蛇尾(Ad) | –0.433 | –0.261 | 0.113 | 0.347 | 0.098 | 0.134 | 0.198 | 0.269 |
| 薄倍棘蛇尾(Ap) | –0.094 | –0.047 | –0.284 | –0.218 | 0.141 | 0.476 | 0.351 | –0.250 |
| 棒锥螺(Tb) | –0.183 | –0.145 | –0.329 | –0.134 | 0.238 | 0.473 | 0.237 | –0.005 |
| 双生水母(Dc) | 0.147 | –0.239 | –0.677* | –0.496 | 0.508 | 0.275 | 0.165 | 0.211 |
| 半口壮丽水母(Ah) | 0.161 | 0.441 | 0.399 | –0.032 | –0.357 | –0.430 | –0.016 | –0.532 |
| 拟细浅室水母(Ls) | 0.557 | 0.591* | 0.414 | –0.636* | –0.196 | –0.381 | –0.202 | –0.456 |
| 异体住囊虫(Od) | 0.268 | 0.392 | 0.370 | –0.384 | –0.161 | –0.181 | 0.015 | –0.348 |
| 软拟海樽(Dg) | 0.393 | 0.393 | 0.486 | –0.306 | 0.044 | –0.480 | 0.131 | –0.218 |
| 漂浮小井伊糠虾(Ip) | 0.131 | 0.131 | 0.397 | 0.044 | –0.132 | 0.044 | 0.044 | –0.131 |
| 长额刺糠虾(Al) | 0.306 | 0.480 | 0.221 | 0.131 | –0.396 | –0.393 | –0.480 | –0.393 |
| 球型侧腕水母(Pg) | 0.718** | 0.810** | 0.530 | –0.697* | –0.475 | –0.577* | –0.296 | –0.817** |
| 注: **表示P < 0.01, *表示P < 0.05。括号内为物种名缩写, 全称见表 1。 | ||||||||
由于对环境条件改变引起海洋生物暴增的预测能力不足, 以及应对取水口堵塞事件的经验和技术储备欠缺, 滨海核电厂冷源堵塞导致机组运行受阻的事件每年均有报道, 尚未得到有效抑制。为了建立有效的监测预警与处置技术体系, 结合某核电厂邻近海域生态环境特征和致灾生物名录, 可以从以下几个方面加以努力:
1) 加强核电厂周边海域潜在致灾生物的暴发机制研究。某核电厂目前围绕海地瓜的生理、生长、分布以及暴发诱因等基础研究较多, 但对其他潜在致灾生物(如水母、海葵和棘刺锚参)的空间分布情况、生殖繁育规律等问题研究较少, 亟需开展相关调查与暴发机制研究。
2) 提升核电厂周边海域潜在致灾生物的监测预警能力。针对取水口海域, 可建立观测塔和海底观测网相结合的关键区域监测平台, 搭载水面高清摄像头、水下高频声呐成像系统、水下高清摄像头、流速流向水文传感器, 对生物群落采用自水底到水面的全方位监控, 实现小尺度范围内的生物数量和群落分布的精确监测和定位。此外, 还应同海洋、海事和气象等相关部门建立长期稳定的合作关系, 以便及时、准确地获得海洋气象、鱼汛、虾汛、大面积浮游物等预报信息。
3) 优化核电厂周边海域潜在致灾生物的驱赶消杀技术和干扰体系。目前, 某核电厂已针对海地瓜开展了一系列防控技术的研究, 发现在取水口投放氯锭可对成年海地瓜产生一定的抑制。此外, 还应针对某核电厂其他潜在致灾生物的特点, 搭建综合实验平台, 对比研究声波、气泡幕、光、电脉冲和杀生剂等不同驱赶消杀技术的效果与影响, 根据实际效果进行分级分区, 开发复合式防控技术。考虑到不同季节海洋生物暴发情况不同, 应在取水口拦截过滤设施上预留安装临时拦截设施的条件, 以采取更有针对性的拦截, 如水母高发期布放对应水母网等。
| [1] |
张国辉, 宋和航, 穆阳阳. 北方核电厂取水口堵塞原因分析及改进措施评价[J]. 核动力工程, 2019, 40(5): 111-117. ZHANG Guohui, SONG Hehang, MU Yangyang. Reason analysis and improvement measures evaluation for water intake blockage at northern nuclear power plants[J]. Nuclear Power Engineering, 2019, 40(5): 111-117. |
| [2] |
於凡, 许波涛, 吴昕, 等. 基于核电冷源安全的海洋生物调查及筛选评价方法研究[J]. 海洋环境科学, 2021, 40(1): 139-143. YU Fan, XU Botao, WU Xin, et al. Study on the method of marine organisms investigation, screening and evaluation based on nuclear power plant cold source safety[J]. Marine Environmental Science, 2021, 40(1): 139-143. |
| [3] |
吴侨军. 核电厂冷源安全的挑战及对策[J]. 电力安全技术, 2019, 21(11): 4-9. WU Qiaojun. Challenges and countermeasures for heat sink safety of nuclear power plants[J]. Electric Safety Technology, 2019, 21(11): 4-9. |
| [4] |
雷廷波. 浅析宁德市近岸海域水质状况[J]. 低碳世界, 2019, 9(10): 19-20. LEI Tingbo. Analysis on the water quality of the coastal waters of Ningde City[J]. Low Carbon World, 2019, 9(10): 19-20. DOI:10.3969/j.issn.2095-2066.2019.10.011 |
| [5] |
陆杰. 宁德市近岸海域富营养化评价[J]. 海峡科学, 2015(2): 5-7. LU Jie. Evaluation of eutrophication in the coastal waters of Ningde City[J]. Straits Science, 2015(2): 5-7. DOI:10.3969/j.issn.1673-8683.2015.02.002 |
| [6] |
中华人民共和国国家质量监督检验检疫局总局. GB 17378.4-2007海洋监测规范第4部分: 海水分析[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB 17378.4-2007 The specification for marine monitoring-Part 4: Seawater analysis[S]. Beijing: Standards Press of China, 2008. |
| [7] |
中华人民共和国国家质量监督检验检疫局总局. GB/T12763.6—2007海洋调查规范第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T12763.6-2007 Specifications for Oceanographic Survey-Part 6: Marine biological Survey[S]. Beijing: Standards Press of China, 2007. |
| [8] |
MCNAUGHTON S J. Relationships among functional properties of Californian grassland[J]. Nature, 1967, 216: 168-169. |
| [9] |
MARGALEF R. Information theory in ecology[J]. General Research, 1958, 3: 36-71. |
| [10] |
SHANNON C E, WEAVER W. The mathematical theory of communication[M]. Urbana, USA: University of Illinois Press, 1949.
|
| [11] |
PIELOU E C. An introduction to mathematical ecology[J]. Bioscience, 1969, 24(2): 7-12. |
| [12] |
邹景忠, 董丽萍, 秦保平. 渤海湾富营养化和赤潮问题的初步探讨[J]. 海洋环境科学, 1983, 2(2): 45-58. ZHOU Jingzhong, DONG Liping, QIN Baoping. A preliminary discussion on eutrophication and red tides in Bohai bay[J]. Marine Environmental Science, 1983, 2(2): 45-58. |
| [13] |
BRAAK C, VERDONSCHOT P. Canonical correspondence analysis and related multivariate methods in aquatic ecology[J]. Aquatic Sciences, 1995, 57(3): 255-289. DOI:10.1007/BF00877430 |
| [14] |
唐娅菲. 滨海核电运行安全典型致灾生物研究——以宁德核电为例[D]. 上海: 上海海洋大学, 2018. TANG Yafei. Study on typical disaster-causing organisms of coastal nuclear power operation safety: Taking Ningde nuclear power as an example[D]. Shanghai: Shanghai Ocean University, 2018. |
| [15] |
张朝文, 关春江, 徐鹏, 等. 辽东湾东部海域核电冷源取水区的风险生物分析[J]. 海洋环境科学, 2019, 38(1): 41-45. ZHANG Chaowen, GUAN Chunjiang, XU Peng, et al. Analysis on risk organisms for the cold source water of nuclear power plant in the eastern waters of Liaodong bay[J]. Marine Environmental Science, 2019, 38(1): 41-45. |
| [16] |
李建文, 刘笑麟, 张锦飞, 等. 提升核电厂冷源安全性的海生物探测技术研究[J]. 电力安全技术, 2017, 19(10): 32-37. LI Jianwen, LIU Xiaolin, ZHANG Jinfei, et al. Research on marine life detection technology to improve the safety of nuclear power plant cold sources[J]. Electric Safety Technology, 2017, 19(10): 32-37. DOI:10.3969/j.issn.1008-6226.2017.10.011 |
| [17] |
邓邦平, 刘衡, 王洪波, 等. 福建宁德晴川湾海域水母群落特征及其潜在生态风险分析[J]. 海洋学报, 2020, 42(4): 128-136. DENG Bangping, LIU Heng, WANG Hongbo, et al. Analysis on the community characteristics and potential ecological risk of jellyfish in the Qingchuan Bay of Ningde, Fujian Province[J]. Haiyang Xuebao, 2020, 42(4): 128-136. DOI:10.3969/j.issn.0253-4193.2020.04.015 |
| [18] |
郑慧苑, 丘书院. 厦门港球型侧腕水母(Pleurobrachia globosa Moser)的生殖[J]. 动物学报, 1990, 36(4): 393-397. ZHENG Huiyuan, QIU Shuyuan. Reproduction of Pleurobrachia globosa Moser in Xiamen Bay[J]. Acta Zoologica Sinica, 1990, 36(4): 393-397. |
| [19] |
许人和. 海葵[J]. 生物学通报, 1984(4): 7-10. XU Renhe. Acfiniaria[J]. Bulletin of Biology, 1984(4): 7-10. |
| [20] |
郭皓. 中国近海赤潮生物图谱[M]. 北京: 海洋出版社, 2004. GUO Hao. Illustrations of planktons responsible for the blooms in chinese coastal waters[M]. Beijing: China Ocean Press, 2004. |
| [21] |
MULHOLLAND M R, CAPONE D G. The nitrogen physiology of the marine N2-fixing cyanobacteria Trichodesmium spp.[J]. Trends in Plant Science, 2000, 4(4): 148-153. |
| [22] |
王永杰. 胶州湾异体住囊虫的生态适应性研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2014. WANG Yongjie. Ecological adaption of Oikopleura dioica in Jiaozhou Bay[D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanology, Chinese Academy of Sciences), 2014. |
| [23] |
LAMBERT G. Ecology and natural history of the protochordates[J]. Canadian Journal of Zoology, 2005, 83(1): 34-50. |
| [24] |
张高明, 於凡, 张启明, 等. 核电站取水口海生物驱赶消杀技术研究[J]. 船电技术, 2019, 39(1): 22-27. ZHANG Gaoming, YU Fan, ZHANG Qiming, et al. Research on marine organism expulsion and elimination nearby water intakes of nuclear power plants[J]. Marine Electric & Electronic Engineering, 2019, 39(1): 22-27. |
| [25] |
程宏. 海地瓜(Acaudina molpadioidea)堵塞核电冷源成因分析及防控措施研究[D]. 上海: 上海海洋大学, 2018. CHENG Hong. Research on the causes, prevention and control measures of bio-blogging on nuclear power cold source by Acaudina molpadioidea[D]. Shanghai: Shanghai Ocean University, 2018. |
| [26] |
张凤瀛, 廖玉麟. 我国的蛇尾[J]. 生物学通报, 1958(11): 16-22. ZHANG Fengying, LIAO Yulin. Ophiuroidea in China[J]. Bulletin of Biology, 1958(11): 16-22. |
| [27] |
唐娅菲, 王金辉, 程宏, 等. 宁德东部海域大型底栖动物生态环境质量评价[J]. 海洋环境科学, 2019, 38(2): 278-285, 302. TANG Yafei, WANG Jinhui, CHENG Hong, et al. Ecoenvironment quality assessment of macrobenthic community in the East Ningde sea waters[J]. Marine Environmental Science, 2019, 38(2): 278-285, 302. |
| [28] |
程宏, 徐炳旭, 刘溢馨, 等. 宁德市东部海域浮游动物群落及其与水环境因子的关系[J]. 海洋开发与管理, 2019, 36(8): 18-23. CHENG Hong, XU Bingxu, LIU Yixin, et al. Zooplankton community and its relation to environmental factors in the eastern sea area of Ningde[J]. Ocean Development and Management, 2019, 36(8): 18-23. |
| [29] |
徐兆礼, 高倩, 陈佳杰, 等. 东海栉水母对温度和盐度生态适应的Yield-Density模型[J]. 生态学杂志, 2008, 27(1): 68-72. XU Zhaoli, GAO Qian, CHEN Jiajie, et al. Yield- Density model on adaptation of Ctenophora to water temperature and salinity in East China Sea[J]. Chinese Journal of Ecology, 2008, 27(1): 68-72. |
| [30] |
张金标. 我国东南近岸海域球型侧腕水母的分布和丰度[J]. 海洋学报, 1984, 5(S1): 840-846. ZHANG Jinbiao. The distribution and abundance of Pleurobrachia globosa in the coastal waters of Southeast China[J]. Acta Oceanologica Sinica, 1984, 5(S1): 840-846. |
 2022, Vol. 46
2022, Vol. 46