文章信息
- 孙梦岩, 詹子锋, 徐雨, 徐奎栋. 2022.
- SUN Meng-yan, ZHAN Zi-feng, XU Yu, XU Kui-dong. 2022.
- 鳞侧尖柳珊瑚Paracis squamata(Nutting, 1910)(八放珊瑚亚纲: 丛柳珊瑚科)的形态学和系统发育研究
- Morphology and phylogenetic analysis of Paracis squamata (Nutting, 1910) (Octocorallia: Plexauridae)
- 海洋科学, 46(8): 48-56
- Marine Sciences, 46(8): 48-56.
- http://dx.doi.org/10.11759/hykx20220125001
-
文章历史
- 收稿日期:2022-01-25
- 修回日期:2022-03-04
2. 青岛海洋科学与技术试点国家实验室海洋生物与生物技术功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
八放珊瑚亚纲(Octocorallia)种类繁多, 含3 400余种, 约75%物种栖息于水深超过50 m的生境中, 从北极到南极海域, 从潮间带到水深6 400 m的深海均有分布[1-3]。以八放珊瑚为代表的冷水珊瑚是深海脆弱海洋生态系统(VMEs)的指标类群, 也是公海保护区划设中的核心类群[4-7]。研究该类群种类构成与分布可为深海生物多样性保护提供科学依据。
有关八放珊瑚的研究大多是针对浅水物种的研究, 主要集中在北大西洋、地中海、印度-太平洋海域浅水区、日本、帕劳、阿拉斯加、夏威夷、加勒比海、墨西哥湾等海域, 目前针对热带西太平洋深海区域的类群研究十分欠缺[8-14]。
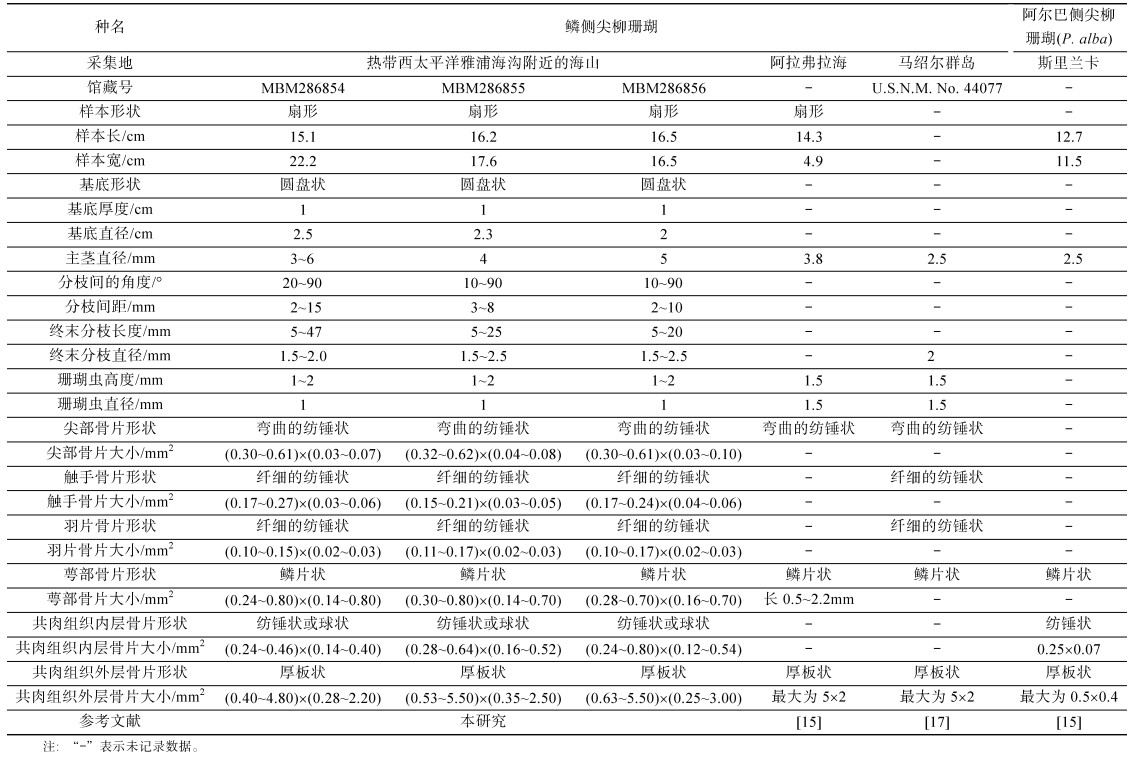
2014年“科学”号考察船对热带西太平洋雅浦海沟附近的雅浦海山进行大型底栖生物调查, 获得3株八放珊瑚样本。通过形态学和分子系统学分析, 鉴定为鳞侧尖柳珊瑚Paracis squamata (Nutting, 1910)。该种于1910年首次报道于印度洋阿拉弗拉海, 被命名为鳞尖柳珊瑚(Acis squamata); 1924年Kükenthal发现于印度尼西亚、日本海域, 并将其转移至侧尖柳珊瑚属(Paracis), 1949年Bayer于太平洋马绍尔群岛的比基尼环礁报道该种, 之后再无相关报道[15-17]。侧尖柳珊瑚属物种的共肉组织均具有两层骨片, 其形状和大小是分类鉴定的重要依据, 但前人仅描述了其共肉组织外层骨片的特征, 缺乏共肉组织内层骨片的信息, 此外还缺乏尖部、触手、羽片、萼部等部位的骨片信息[15-17]。本研究完善了该物种的形态特征描述, 基于该物种的线粒体错配修复蛋白基因(mtMutS)测序分析, 确认了侧尖柳珊瑚属的系统发育地位。
1 材料与方法 1.1 采集地和样品保存本研究的八放珊瑚标本由“科学”号综合可续考察船于2014年12月在热带西太平洋雅浦海沟附近的雅浦海山(即Y3海山), 利用搭载的“发现”号无人遥控潜水器(ROV)采集获得。标本于采集前进行了原位拍照, 采集后在甲板上对新鲜的个体进行拍照, 然后置于75%的酒精中保存。样本现保存于中国科学院海洋生物标本馆。
1.2 形态学观察对样本的整体、分枝、基底以及珊瑚虫间的距离等进行测量, 利用体视显微镜Olympus SZX16观察分枝以及珊瑚虫的形态。然后, 分离出共肉组织和珊瑚虫的触手和萼部, 用次氯酸钠进行消化, 去离子水反复冲洗, 得到各部位的骨片, 并将其转移至碳双面胶带上。样本风干后喷金, 在TM3030Plus扫描电子显微镜(SEM)中5 kV条件下观察拍照[18]。
1.3 形态学术语本研究所用分类学术语参照Bayer等[19], 主要术语解释如下:
珊瑚冠: 珊瑚虫末端部分, 包含口和触手, 在具有收缩性的珊瑚虫中, 可缩回到萼部或共肉组织中。
羽片: 触手的侧面突起。
尖部: 珊瑚冠末端被八列纺锤状骨片所覆盖, 每列纺锤状骨片称作一个尖部。
萼部: 包围珊瑚冠的组织, 通常为圆柱状或疣状突起。
共肉组织: 珊瑚虫之间的群居组织, 由富含骨片的中胶层组成, 并被管系网络和较大的胃管所贯穿。
骨片: 一种钙质成分, 以各种各样的形状存在于中胶层中。
瘤状结节: 骨片表面粗糙的瘤状突起。
终末分枝: 个体最末端的分枝, 不再继续分枝。
分枝末端: 终末分枝的末梢。
基底: 八放珊瑚附着于底质的部分。
1.4 总DNA提取和mtMutS基因扩增剪取每株样本的3~5个珊瑚虫, 用蒸馏水清洗, 风干后放到1.5 mL的离心管中, 利用Qiagen DNA提取试剂盒提取总DNA。本研究采用八放珊瑚亚纲特有的线粒体错配修复蛋白基因mtMutS作为条形码标记, 该标记与后生动物通用的条形码COI基因相比, 具有更高的种间变异[20]。以珊瑚虫的总DNA为模板(1 μL), 上游引物(5′-AGGAGAATTATTCTAAGTATGG-3′)、下游引物(5′-TSGAGCAAAAGCCACTCC-3′)(10 μmol/L)各1 μL, I-5 2× High-Fidelity Master Mix DNA聚合酶12.5 μL, ddH2O 9.5 μL[21-22]。PCR扩增循环条件为: 98℃预变性2 min, 98℃变性20 s, 50℃退火20 s, 72℃延伸15 s, 32个循环, 最后在72℃下进行延伸2 min[18]。结果仅有MBM286854样本成功获得PCR产物, 而另外2个标本重复多次提取DNA和PCR均没有获得PCR产物。PCR产物纯化和测序由擎科生物技术公司进行。
1.5 系统发育分析构建系统发育树的序列除新获序列外均从GenBank下载, 以软珊瑚科的Alcyonium digitatum和A. haddoni的mtMutS基因序列作为外群。在构建的系统发育树中, 序列号列在种名后面。用MAFFT v.7基于G-INS-i运算法则进行序列比对[23]。
比对后的mtMutS基因序列, 用SMS软件基于AIC运算法则选择出最佳进化模型HKY85+G[24]。最大似然法(ML)分析利用PhyML-3.1进行, 置信度来自1 000次非参数自展抽样分析(bootstrap)[25]。利用CIPRES Science Gateway中的MrBayes v3.2.3进行贝叶斯推断(BI)分析[26]。后验概率来自运行10 000 000代的运算(每1 000代进行抽样)。前25%的树样品作为老化树被去掉, 构建1组50%多数一致树。FigTree v1.3.1用来实现进化树图形的可视化[27]。对于ML的自展支持率, 据Hillis和Bull[28], 将数值< 70%视为低支持率, 70%~94%为中等支持率, ≥95%为高支持率。对于贝叶斯后验概率, 根据Alfaro等[29]将数值< 0.95视为低支持率, 数值≥0.95为高支持率。
2 结果 2.1 形态学刺胞动物门Cnidaria Verrill, 1865
珊瑚纲Anthozoa Ehrenberg, 1834
八放珊瑚亚纲Octocorallia Haeckel, 1866
软珊瑚目Alcyonacea Lamouroux, 1812
全轴柳珊瑚亚目Holaxonia Studer, 1887
丛柳珊瑚科Plexauridae Gray, 1859
狭窄柳珊瑚亚科Stenogorgiinae Bayer, 1981
侧尖柳珊瑚属Paracis Kükenthal, 1919
鳞侧尖柳珊瑚Paracis squamata (Nutting, 1910) Kükenthal, 1924
Acis squamata Nutting, 1910: 42, pl. 7, figs. 2, 2a; pl. 20, fig. 50[15].
Acis squamata Nutting, 1912: 81[30].
Paracis squamata Kükenthal, 1924: 158[16].
Acis squamata Thomson and Dean, 1931: 200, pl. 5, fig. 2; pl. 16, fig. 9[31].
Paracis squamata Aurivillius, 1931: 145[32].
模式产地: 印度洋阿拉弗拉海(Arafura Sea), 132°13′E, 5°48′S, 水深304 m[15]。
凭证标本: 样本现保存于中国科学院海洋生物标本馆。样本馆藏号MBM286854, 采样时间2014年12月22日, 137°47.09′E, 8°51.42′N, 水深284 m; 馆藏号MBM286855, 采样时间2014年12月22日, 137°47.09′E, 8°51.42′N, 水深284 m; 馆藏号MBM286856, 采样时间2014年12月12日, 137°47.03′E, 8°51.79′N, 水深550 m。
形态描述: 3个样本活体时均呈黄色, 经酒精保存后呈现灰白色(图 1)。个体均为平面侧生, 以叉状分枝方式形成单扇面或多扇面结构(图 1)。基底附着在多毛类分泌的管壁上(图 1, 箭头所示)。样本MBM286854长15.1 cm, 宽22.2 cm, 具两个扇面; 基底呈圆盘状, 厚度为1 cm, 直径为2.5 cm; 主茎直径为3~6 mm; 分枝间的角度为20°~90°, 间距为0.2~ 1.5 cm; 终末分枝长0.5~4.7 cm, 直径为1.5~2.0 mm (图 1a, b)。样本MBM286855长16.2 cm, 宽17.6 cm, 具2个扇面; 基底呈圆盘状, 厚度为1 cm, 直径为2.3 cm; 主干底部直径为4 mm; 分枝间的角度为10°~ 90°, 间距为3~8 mm; 终末分枝长5~25 mm, 直径为1.5~2.5 mm(图 1c, d)。样本MBM286856长16.5 cm, 宽16.5 cm, 单扇面; 基底呈圆盘状, 厚度为1 cm, 直径为2 cm; 主干底部直径为5 mm; 分枝间的角度为10°~90°, 间距为2~10 mm; 终末分枝长5~20 mm, 直径为1.5~2.5 mm(图 1e, f)。
 |
| 图 1 鳞侧尖柳珊瑚外部形态 Fig. 1 External morphology of Paracis squamata 注: a: MBM286854样本原位图; b: MBM286854采集后的样本; c: MBM286855样本原位图; d: MBM286855采集后的样本; e: MBM286856样本原位图; f: MBM286856采集后的样本; 比例= 5 cm (b, d, f)。 |
珊瑚虫密集地分布于分枝的一侧, 呈短的圆柱状或丘顶状, 高1~2 mm, 直径约为1 mm, 珊瑚虫的间距为0~3 mm(图 2)。珊瑚冠具有8个触手, 触手背部常形成8个尖部, 每个尖部由1对大的弯曲的纺锤状骨片构成, 或含有几个稍小的弯曲的纺锤状骨片, 其在样本MBM286854中的大小为(0.30~0.61) mm × (0.03~0.07) mm(长×宽, 下同)(图 2b, e)。大的骨片边缘不规则, 一侧表面近乎光滑且凹凸不平, 覆盖突起, 有时形成朝向末端的长的刺状或脊状突起; 另一侧覆盖密集的疣突。小的纺锤状骨片表面密布突起, 有的形成大的疣状突起, 两端逐渐变细(图 3a)。触手由纤细的纺锤状骨片构成, 通常稍有弯曲和扁平, 大小为(0.17~0.27) mm × (0.03~0.06) mm, 表面覆盖疣状突起, 边缘有时呈不规则齿状(图 3b)。羽片由纤细扁平的纺锤状骨片构成, 通常稍微弯曲, 大小为(0.10~0.15) mm × (0.02~0.03) mm, 表面覆盖稀疏的疣状突起(图 3c)。珊瑚虫的萼部较低, 由8~10个鳞片状骨片构成, 鳞片状骨片紧密贴合或相互重叠呈“覆瓦状”排列, 将珊瑚虫包围或完全掩盖(图 2c, d)。鳞片状骨片大小为(0.24~0.80) mm×(0.14~0.80) mm, 外表面上部带有小的光滑的圆颗粒疣, 其顶部边缘呈规则不一的齿状; 下部呈现粗糙的瘤状结节; 内表面顶部突起的脊呈放射状; 下部覆盖密集的瘤状结节(图 3d)。共肉组织的骨片分为2层。共肉组织外层骨片呈无规则板状, 骨片边缘紧密贴合或稍有重叠, 骨片大小为(0.40~4.80) mm×(0.28~2.20) mm, 外表面覆盖着光滑的疣状突起, 内表面覆盖着粗糙的瘤状突起(图 4b)。共肉组织内层骨片为带瘤状结节的纺锤状或球状骨片, 大小为(0.24~0.46) mm×(0.14~0.40) mm (图 4a)。样本MBM286855和MBM286856的形态测量结果见表 1。
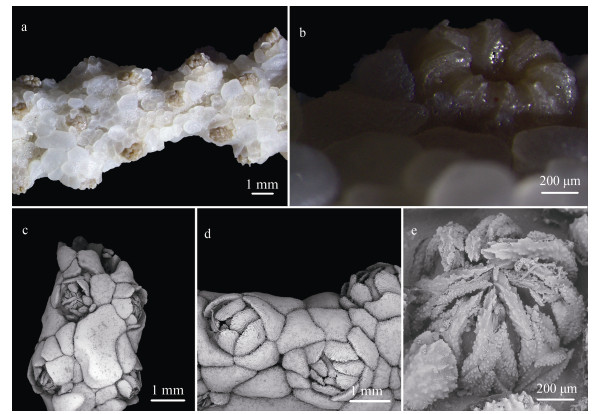 |
| 图 2 鳞侧尖柳珊瑚的分枝及珊瑚虫 Fig. 2 Branches and polyps of Paracis squamata 注: a: 光学显微镜下MBM286854的一段分枝; b: 光学显微镜下MBM286854的珊瑚冠; c: 电子显微镜下MBM286854的一段分枝; d: 电子显微镜下MBM286855的3个珊瑚虫; e: 电子显微镜下MBM286856的珊瑚冠; 比例= 1 mm (a, c, d); 200 μm (b, e)。 |
 |
| 图 3 鳞侧尖柳珊瑚的骨片 Fig. 3 Sclerites of Paracis squamata 注: a: 尖部骨片; b: 触手骨片; c: 羽片骨片: d: 萼部骨片; 比例= 100 μm (a, b, c); 200 μm (d)。 |
 |
| 图 4 鳞侧尖柳珊瑚的共肉组织骨片 Fig. 4 Coenenchyme sclerites of Paracis squamata 注: a: 共肉组织内层骨片; b: 共肉组织外层骨片; 比例=200 μm (a); 400 μm (b)。 |
|
分布: 印度洋阿拉弗拉海, 水深304 m; 印度尼西亚海域, 水深113~400 m; 日本海域, 水深118 m; 太平洋马绍尔群岛比基尼环礁(Bikini Atoll), 水深212~ 219 m; 热带西太平洋雅浦海山, 水深284~550 m[15-17]。
生态特点: 在坚硬的底质上固着生长, 有蛇尾附着。
2.2 系统发育分析新序列上传至NCBI数据库, GenBank的序列号为OM144939。由于构建ML树和BI树的拓扑结构一致, 仅展示ML树的拓扑结构, 把两种树的置信度都显示在分枝节点处(图 5)。基于mtMutS基因构建的系统发育树显示丛柳珊瑚科Plexauridae是个非单系群, 分为2个主要分枝: (1) 狭窄柳珊瑚亚科Steno gorgiinae和丛柳珊瑚亚科Plexaurinae的真丛柳珊瑚属Euplexaura, 以及棘柳珊瑚科Acanthogorgiidae的小尖柳珊瑚属Muricella和棘柳珊瑚属Acanthogorgia聚为一枝; (2) 丛柳珊瑚亚科Plexaurinae余下的属则与褶皱柳珊瑚科Plexaurellidae和柳珊瑚科Gor go niidae的关系较近, 以低置信度聚为另一分枝(图 5)。侧尖柳珊瑚属Paracis内嵌在狭窄柳珊瑚亚科Ste no gorgiinae分枝中, 鳞侧尖柳珊瑚Paracis squamata与Paracis sp.(序列号: DQ302860)以100%置信度聚在一起, 侧尖柳珊瑚属Paracis和鳞尖柳珊瑚属Lepi do muricea以高支持率形成姐妹枝(图 5)。
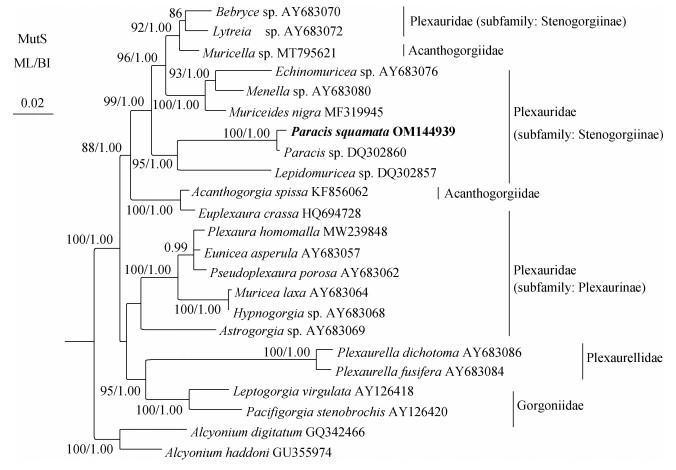 |
| 图 5 基于mtMutS基因构建的丛柳珊瑚科ML和BI系统发育树 Fig. 5 Maximum likelihood and Bayesian inference phylo genetic tree of Plexauridae based on the mtMutS gene 注: 新序列加粗显示。ML置信度 < 70%和BI置信度 < 0.95不显示于树上。 |
侧尖柳珊瑚属目前已知有21个物种, 主要分布在印度-太平洋海域, 大多数为浅水种[33]。该属的特征为分枝侧向生长, 叉状分枝, 末端有时膨大; 珊瑚虫分布密集; 触手底部纺锤状骨片形成尖部; 萼部较低, 骨片为带齿的鳞片状骨片; 共肉组织骨片分为两层, 外层为大的厚板状, 内层为小的纺锤状或球状骨片[16]。本研究的3株珊瑚分枝生长模式、珊瑚虫尖部、萼部和共肉组织骨片形状等形态特征高度一致且符合本属的特征, 将其鉴定为侧尖柳珊瑚属的物种。在系统发育树中, 该物种与侧尖柳珊瑚属未鉴定种Paracis sp.(序列号: DQ302860)以100%置信度形成姐妹枝, 印证了形态学鉴定结果(图 5)。
在侧尖柳珊瑚属中, 鳞侧尖柳珊瑚的主要鉴别特征为萼部具有鳞片状骨片和共肉组织外层具有无规则板状的骨片[15]。本研究珊瑚的骨片特征与原始描述相吻合, 因此, 将其鉴定为鳞侧尖柳珊瑚。该种与形态最相近的阿尔巴侧尖柳珊瑚Paracis alba (Thomson & Henderson, 1905)主要区别在于: 鳞侧尖柳珊瑚共肉组织外层骨片明显大于后者此部位的骨片(最大可达5.5 mm×3.0 mm vs. 最大可达0.5 mm× 0.4 mm), 且该骨片表面覆盖着光滑的疣状突起, 而后者为粗糙的疣状突起(表 1)[15-17]。
鳞侧尖柳珊瑚于1910年由Nutting首次发现于印度洋的阿拉弗拉海; 1924年Kükenthal发现于印度尼西亚、日本海域, 并将其转移至侧尖柳珊瑚属Paracis, 但未提供任何描述; 1949年Bayer于太平洋马绍尔群岛的比基尼环礁也报道该物种[15-17], 此后70多年再无任何报道。前人对该物种的形态特征描述不充分, 欠缺对共肉组织内层骨片的特征描述和关键部位骨片的大小数据[15-17]。本研究对鳞侧尖柳珊瑚进行了全面的形态学描述, 包括所有关键部位的数据测量, 首次描述了共肉组织内层骨片的特征, 为该种的鉴定补足了重要分类性状, 并确认了侧尖柳珊瑚属Paracis的系统发育地位。
在系统发育树中, 侧尖柳珊瑚属Paracis与鳞尖柳珊瑚属Lepidomuricea位于狭窄柳珊瑚亚科Ste no gorgiinae分枝上, 以高置信度形成姐妹枝, 显示侧尖柳珊瑚属与鳞尖柳珊瑚属具有较近的亲缘关系。这与形态学数据相吻合, 两属在丛柳珊瑚科中形态非常相似, 其萼部均具有鳞片状骨片, 边缘紧密贴合或相互重叠呈“覆瓦状”排列, 共肉组织均具有扁平型骨片[16, 34]。但两属在形态上也易于区别, 侧尖柳珊瑚属萼部骨片具有多个齿状突起, 而鳞尖柳珊瑚属则是单个脊状突起; 共肉组织骨片前者为厚的板状, 而后者为薄的片状[16, 34]。本研究基于系统发育分析显示, 基于萼部和共肉组织骨片特征的属级分类是有效的。
| [1] |
DALY M, BRUGLER M R, CARTWRIGHT P, et al. The phylum Cnidaria: a review of phylogenetic patterns and diversity 300 years after Linnaeus[J]. Zootaxa, 2007, 1668: 127-182. DOI:10.11646/zootaxa.1668.1.11 |
| [2] |
PÉREZ C D, NEVES B M, CORDEIRO R T, et al. Diversity and distribution of Octocorallia[C]//STEFANO G, ZVY D. The Cnidaria, Past, Present and Future. New York: Springer: Cham, 2016: 109-123.
|
| [3] |
SCHUBERT N, BROWN D, ROSSI S. Symbiotic versus non-symbiotic octocorals: physiological and ecological implications[C]//ROSSI S, BRAMANTI L, GORI A, OREJAS C. Marine Animal Forests. New York: Springer, Cham, 2017: 887-918.
|
| [4] |
AUSTER P J, GJERDE K, HEUPEL E, et al. Definition and detection of vulnerable marine ecosystems on the high seas: problems with the "move-on" rule[J]. ICES Journal of Marine Science, 2011, 68(2): 254-264. DOI:10.1093/icesjms/fsq074 |
| [5] |
YESSON C, TAYLOR M L, TITTENSOR D P, et al. Global habitat suitability of cold-water octocorals[J]. Journal of Biogeography, 2012, 39(7): 1278-1292. DOI:10.1111/j.1365-2699.2011.02681.x |
| [6] |
WATLING L, AUSTER P J. Seamounts on the high seas should be managed as vulnerable marine ecosystems[J]. Frontiers in Marine Science, 2017, 4: 14. |
| [7] |
XU K. Exploring seamount ecosystems and biodiversity in the tropical Western Pacific Ocean[J]. Journal of Oceanology and Limnology, 2021, 39(5): 1585-1590. DOI:10.1007/s00343-021-1585-9 |
| [8] |
BAYER F M. The shallow-water Octocorallia of the West Indian region[J]. Studies on the Fauna of Curacao and other Caribbean islands, 1961, 12(1): 1-373. |
| [9] |
SáNCHEZ J A, MCFADDEN C S, FRANCE S C. Molecular phylogenetic analyses of shallow-water Caribbean octocorals[J]. Marine Biology, 2003, 142(5): 975-987. DOI:10.1007/s00227-003-1018-7 |
| [10] |
FABRICIUS K E, ALDERSLADE P, WILLIAMS G C, et al. Octocorallia in Palau, Micronesia: effects of biogeography and coastal influences on local and regional biodiversity[C]//KAYANNE H, OMORI M, FABRICIUS K, et al. Coral reefs of Palau. Palau: Palau International Coral Reef Centre, 2007: 79-92.
|
| [11] |
CAIRNS S D, BAYER F M. Octocorallia (Cnidaria) of the Gulf of Mexico[C]//FELDER D L, CAMP D K. Gulf of Mexico–Origins, waters, and biota. biodiversity. Texas: Texas A&M University Press, College Station, 2009, 1: 321-331.
|
| [12] |
WATLING L, FRANCE S C, PANTE E, et al. Biology of deep-water octocorals[J]. Advances in Marine Biology, 2011, 60: 41-122. |
| [13] |
WEIL E, ROGERS C S, CROQUER A. Octocoral diseases in a changing ocean[C]//ROSSI S, BRAMANTI L, GORI A, et al. Marine animal forests. New York: Springer, Cham, 2017: 1-55.
|
| [14] |
BENAYAHU Y, BRIDGE T C, COLIN P L, et al. Octocorals of the Indo-Pacific[C]//LOYA Y, PUGLISEK A, BRITGE T C. Mesophotic coral ecosystems. New York: Springer, Cham, 2019: 709-728.
|
| [15] |
NUTTING C C. The Gorgonacea of the Siboga expedition. Ⅲ. The Muriceidae[M]. New York: Natural Museum, 1910: 1-108.
|
| [16] |
KÜKENTHAL W. Gorgonaria[M]. Berlin: Walter de Gruyter and Co, 1924: 154-161.
|
| [17] |
BAYER F M. The Alcyonaria of Bikini and other atolls in the Marshall group. Part 1: The Gorgonacea[J]. Pacific Science, 1949, 3(3): 195-210. |
| [18] |
XU Y, ZHAN Z F, XU K D. Morphology and molecular phylogeny of three new deep-sea species of Chrysogorgia (Cnidaria, Octocorallia) from seamounts in the tropical Western Pacific Ocean[J]. PeerJ, 2020, 8: e8832. DOI:10.7717/peerj.8832 |
| [19] |
BAYER F M, GRASSHOFF M, VERSEVELDT J. Illustrated trilingual glossary of morphological and anatomical terms applied to Octocorallia[M]. Leiden: Brill Academic Publishers, 1983: 1-75.
|
| [20] |
MCFADDEN C S, BENAYAHU Y, PANTE E, et al. Limitations of mitochondrial gene barcoding in Octocorallia[J]. Molecule Ecology Resource, 2011, 11(1): 19-31. DOI:10.1111/j.1755-0998.2010.02875.x |
| [21] |
HERRERA S, BACO A, SáNCHEZ J A. Molecular systematics of the bubblegum coral genera (Paragorgiidae, Octocorallia) and description of a new deep-sea species[J]. Molecular Phylogenetics and Evolution, 2010, 55(1): 123-135. DOI:10.1016/j.ympev.2009.12.007 |
| [22] |
SáNCHEZ J A, LASKER H R, TAYLOR D J. Phylogenetic analyses among octocorals (Cnidaria): mitochondrial and nuclear DNA sequences (lsu-rRNA, 16S and ssu-rRNA, 18S) support two convergent clades of branching gorgonians[J]. Molecular Phylogenetics and Evolution, 2003, 29(1): 31-42. DOI:10.1016/S1055-7903(03)00090-3 |
| [23] |
KATOH K, STANDLEY D M. MAFFT multiple sequence alignment software version 7: improvements inperformance and usability[J]. Molecular Biology and Evolution, 2013, 30(4): 772-780. DOI:10.1093/molbev/mst010 |
| [24] |
LEFORT V, LONGUEVILLE J E, GASCUEL O. SMS: Smart model selection in PhyML[J]. Molecular Biology and Evolution, 2017, 34(9): 2422-2424. DOI:10.1093/molbev/msx149 |
| [25] |
GUINDON S, DUFAYARD J F, LEFORT V, et al. New algorithms and methods to estimate maximum-likelihood phylogenies: assessing the performance of PhyML 3.0[J]. Systematic Biology, 2010, 59(3): 307-321. DOI:10.1093/sysbio/syq010 |
| [26] |
RONQUIST F R, HUELSENBECK J P. Mrbayes 3: bayesian phylogenetic inference under mixed models[J]. Bioinformatics, 2003, 19(12): 1572-1574. DOI:10.1093/bioinformatics/btg180 |
| [27] |
RAMBAUT A. FigTree v1. 3.1[EB/OL]. (2009-12-21) [2022-01-25]. http://tree.bio.ed.ac.uk/software/figtree.
|
| [28] |
HILLIS D M, BULL J J. An empirical test of bootstrapping as a method for assessing confidence in phylogenetic analysis[J]. Systematic Biology, 1993, 42(2): 182-192. DOI:10.1093/sysbio/42.2.182 |
| [29] |
ALFARO M E, ZOLLER S, LUTZONI F. Bayes or Bootstrap? A simulation study comparing the performance of Bayesian Markov chain Monte Carlo sampling and bootstrapping in assessing phylogenetic confidence[J]. Molecular Biology and Evolution, 2003, 20(2): 255-266. DOI:10.1093/molbev/msg028 |
| [30] |
NUTTING C C. Descriptions of the Alcyonaria collected by the U.S. Fisheries steamer "Albatross", mainly in Japanese waters, during 1906[M]. New York: Natural Museum, 1912: 81-83.
|
| [31] |
AURIVILLIUS M. The Gorgonarians from Dr. Sixten Bock's Expedition to Japan and Bonin Islands in 1914[M]. Stockholm: The Royal Swedish Academy of Sciences, 1931.
|
| [32] |
THOMSON J A, DEAN L M. The Alcyonacea of the Siboga- Expedition: with an addendum to the Gorgonacea[M]. Leiden: Naturalis Biodiversity Center, 1931.
|
| [33] |
GRASSHOFF M, BARGIBANT G. Coral reef gorgonians of New Caledonia[M]. Paris: Research Institute for Development, 2001: 155-220.
|
| [34] |
BAYER F M. Key to the genera of Octocorallia exclusive of Pennatulacea (Coelenterata: Anthozoa), with diagnosis of new taxa[J]. Proceedings of the Biological Society of Washington, 1981, 94(3): 902-947. |
 2022, Vol. 46
2022, Vol. 46


