文章信息
- 张晨曦, 孙景春, 林承刚. 2022.
- ZHANG Chen-xi, SUN Jing-chun, LIN Cheng-gang. 2022.
- 海洋微塑料对重金属的吸附行为及其复合毒性研究进展
- Research progress on the adsorption behavior of heavy metals on microplastics in the ocean and their combined toxicity
- 海洋科学, 46(8): 155-170
- Marine Sciences, 46(8): 155-170.
- http://dx.doi.org/10.11759/hykx20211209001
-
文章历史
- 收稿日期:2021-12-09
- 修回日期:2022-01-08
2. 中国科学院海洋生态与环境科学重点实验室, 山东 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
4. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
5. 中国科学院海洋牧场工程实验室, 山东 青岛 266071;
6. 山东省实验海洋生物学重点实验室, 山东 青岛 266071
2. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. CAS Engineering Laboratory for Marine Ranching, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
6. Shandong Province Key Laboratory of Experimental Marine Biology, Qingdao 266071, China
塑料制品可塑性强、价格低廉, 已经遍布人类生活的各种场所。据估计, 1950年至2019年塑料产量达到100亿吨, 其中约产生76亿吨塑料废物。据模型估算, 每年至少有800万吨塑料垃圾被排放到海洋中, 预计到2050年, 海洋中含有的塑料重量将超过鱼类的重量[1]。塑料垃圾在海洋环境中容易随风和洋流等外力迁移, 甚至遥远的极地都不能免受塑料垃圾的污染[2], 海洋中的塑料污染已经成为全球性问题。海洋中的塑料废弃物经过长期的风吹、海浪拍打、太阳辐射等物理化学作用会分解成直径小于5 mm的微塑料, 与大尺寸塑料废弃物相比, 微塑料体积小、比表面积大、吸附污染物能力强, 已经成为造成海洋污染的重要负荷之一。微塑料会被不同营养级的海洋生物吞食, 可能会沿着食物链和食物网传递最终进入人体, 对人体造成损害[3]。重金属污染与环境中其他有机污染物有很大的不同, 大部分有机污染物可以通过物理、化学或生物作用来减少或消除其危害。相比之下, 重金属更容易在生物体内积累, 难以降解。食物链中有毒金属的生物积累会对生物体造成严重伤害[4]。近年来, 微塑料和重金属的相互作用引起了学界的广泛关注, 许多学者对微塑料的来源、分析方法和生态风险进行了研究, 但微塑料和重金属的联合作用仍然需要进一步研究总结。为了更好的探明微塑料和重金属对海洋生态环境的影响, 本文对微塑料的来源、分布、对重金属的吸附行为及其对海洋生物的毒性效应进行总结, 为微塑料和重金属污染防止提供参考。
1 微塑料来源根据产生过程不同, 环境中的微塑料可以分为初生微塑料和次生微塑料。初生微塑料是指直接以某种方式设计和生产的微塑料, 如个人护理和清洁产品中添加的塑料微珠、纤维和粉末等[5]。次生微塑料是指经过物理、化学和生物过程使大型塑料破碎而形成的。海洋和近岸环境中的塑料废弃物会经历各种老化过程, 根据不同的降解过程, 常分为紫外线辐射导致的光降解、热辐射导致的热降解、化学反应导致的降解以及机械力等非生物降解效应和生物降解效应。这些效应导致大型塑料废弃物碎片化, 将次生微塑料引入环境[6]。
海洋环境中微塑料种类主要包括聚乙烯(Polyethylene, PE)、聚丙烯(Polypropylene, PP)、聚苯乙烯(Polystyrene, PS)、聚氯乙烯(Polyvinyl chloride, PVC)、聚酰胺(Nylon, PA)和聚对苯二甲酸乙二醇酯(Polyethylene glycol terephthalate, PET)等[7]。人类活动产生的微塑料是海洋微塑料污染的重要来源, 通过对六大洲海岸沉积物中的微塑料调查发现, 这些微塑料成分与服装中使用的PET纤维和丙烯酸酯(acrylic)纤维的比例相似。一件衣服每次洗涤可以产生超过1 900个微塑料纤维, 在海洋环境中发现的大部分微塑料纤维可能来自于洗衣服的废水[8]。含微塑料的废水通过下水道排水系统排入市政污水处理系统后, 虽然污水处理系统对微塑料有一定的拦截效果, 但没有被有效拦截的微塑料仍然会造成重大污染[9]。海水养殖也会造成微塑料的积累, 养殖过程中随意丢弃的塑料废弃物、船舶倾倒垃圾、水产养殖饲料、渔网等工具设备的使用也会导致水生环境中微塑料含量的增加[10]。
2 微塑料的丰度与分布现状 2.1 海水中的微塑料微塑料在自然环境(水、土壤和空气)中不会被“隔离”, 它们可以在不同的环境介质之间移动。普遍认为, 海洋是微塑料的聚集场所, 陆地是海洋微塑料的主要来源之一, 淡水环境被认为是陆地和海洋中微塑料迁移之间的桥梁。陆地上的微塑料通过表面径流流入河流, 然后进入海洋环境[11]。在中国胶州湾海域, 海湾内的微塑料类型与河口内的微塑料类型匹配度很高, 在有水流和泥沙输送趋势的地区, 微塑料的丰度相对较高, 河流输入是海洋微塑料重要的来源[12]。海水中的微塑料很难被去除, 由于洋流作用, 微塑料在海洋中的分布十分广泛。许多调查发现, 在全球各种海洋生态系统中都存在不同程度的微塑料污染, 包括北极、南极、太平洋、印度洋、大西洋等(见表 1)。
| 地点 | 样品类型 | 聚合物丰度/ (个·m–3) | 聚合物类型 | 参考文献 |
| 中国胶州湾 | 表层海水 | 20~120 | PET、PP、PE、PA、聚乙酸乙烯酯(polyvinyl acetate, PVAC)等 | [12] |
| 北极斯瓦尔巴特群岛 | 表、底层海水 | 表层: 0.34±0.31; 底层: 2.68±2.95 | PET、PA、PE、丙烯酸酯(acrylate)、PVC、纤维素(cellulose)等 | [13] |
| 南极洲罗斯海 | 地下海水 | 0.17±0.34 | PE、PP、聚醚砜(Polyethersulfone, PES)、聚四氟乙烯(Poly tetra fluoroethylene, PTFE)、聚甲基丙烯酸甲酯(polymethyl methacrylate, PMMA)、PA | [14] |
| 东北大西洋 | 表层海水 | 2.46±2.43 | ‒ | [15] |
| 西太平洋 | 表层海水 | 0.02~0.10 | PP、PE、PES、PMMA、苯氧树脂(phenoxy resin, PR) | [16] |
| 东印度洋 | 表层海水 | 0.27±0.19 | PP、PET、PE、PTFE、聚丙烯腈(polyacrylonitrile, PAN)等 | [17] |
| 西南太平洋岛国瓦努阿图 | 表层海水 | 0.28 | PS、PE、PP、PEVA等 | [20] |
| 中国南海海口湾 | 表层海水 | 0.26~0.84 | PE、PP、PET、PS等 | [21] |
| 中国东海 | 表层海水 | 112.8±51.1 | PE、PP、PA、PET、PS、PU等 | [22] |
| 注: “‒”表示文章中未具体指出。 | ||||
Lusher等[13]首次对北极地区水体微塑料污染情况进行调查, 由于北极地区并没有密集的城市, 调查海域的微塑料可能不是来自城市人类活动。北极水域的生产力非常高, 捕鱼船只密集, 因此推测海域中大部分的微塑料是由捕鱼活动而形成。在南极罗斯海近岸和海岸附近的地下水中也发现了微塑料污染, 微塑料丰度从0.003 2到1.18个/m3, 形状包括碎片, 纤维等[14]。在东北大西洋94%的样品中发现了微塑料, 共鉴定出2 315个颗粒, 89%的颗粒为长度小于5 mm的微塑料, 平均塑料丰度为2.46个/m3[15]。Liu等[16]对来自西太平洋和中国南海的表层水进行了现场测定, 西太平洋表面水体微塑料丰度(0.02~0.10个/m3)低于中国南海海域(0.05~0.26个/m3), 成分以PP、PE为主。同样的, Li等[17]提供了太平洋和印度洋跨尺度的微塑料污染基线数据, 从沿海地区(2.53±1.83个/m3)到远洋(0.27±0.19个/m3)的微塑料分布存在梯度下降以及较大的空间差异性。形成这种差异的主要原因是微塑料从陆源输入造成的, 因此, 应采取有效的治理措施, 减少陆地塑料废弃物的输入。虽然微塑料在海洋中普遍存在, 但它们的空间分布极其不均匀。工业污染源附近海域以及容易形成环流污染区的封闭或半封闭的海域(如地中海)很容易造成严重微塑料污染[18]。如此广泛的分布会造成不同地区、不同营养级的消费者, 如各种鸟类和鱼类等海洋生物会通过不同途径摄食微塑料, 摄入这些颗粒会对全球的生态系统构成严重威胁, 也进一步揭示了海洋环境对人类生存的重要性[19]。
2.2 沉积物中的微塑料大部分微塑料最终都会沉积在海洋沉积物中, 海底是许多污染物最终的汇[23]。据估计, 悬浮在全球海水中的微塑料颗粒约为9.3至23.6万吨。这些数字仅占一年内从陆地进入海洋的塑料废物的1%~3%[24]。因此, 大多数的微塑料可能已经沉入到海底沉积物中。密度高于海水(密度: 1.02 g/cm3)的塑料聚合物, 如PA(密度: 1.13 g/cm3)会自然下沉。低密度微塑料, 如PE(密度: 0.91 g/cm3), 最终也会由于生物膜的形成而下沉。一旦进入海底, 微塑料就会通过底栖生物的生物扰动埋在更深的沉积物中[25]。
塑料已经侵入了大多数海洋栖息地(见表 2), Adams等[26]首次对加拿大北极范围内的海洋沉积物中的人工颗粒进行分析, 沉积物中的人工颗粒丰度为0.6~4.7个/g, 其中包括微塑料纤维(82%)和微塑料颗粒(15%)。该丰度超过了附近塑料污染源城市地区的记录, 加拿大北极地区可能已经形成微塑料的汇集地。南极不同深度的沉积物样本中也发现了大量的微塑料, 尤其在海岸线上丰度较高。对南半球微塑料丰度的研究表明, 一旦微塑料被运送到南极环极洋流和极地前沿, 微塑料很可能会被困在南极周围[27], 对南极生态环境造成严重的影响。
| 地点 | 样品类型 | 聚合物丰度 | 聚合物类型 | 参考文献 |
| 西南太平洋岛国瓦努阿图 | 沉积物 | 333±115~ 33 300±7 300个/kg |
‒ | [20] |
| 北极加拿大北极地区 | 沉积物 | 0.6~4.7个/g | PVC、聚丙烯酰胺(Polyacrylamide, PAM)、PS、聚氨酯(polyurethane, PU)、PE | [26] |
| 南极罗斯海特拉诺瓦湾 | 沉积物 | 5~1 705个/m2 | PE、PP、PA、PS、PVC、PU、聚乙烯醇(polyvinyl alcohol, PVA)、乙丙橡胶(Ethylene propylene rubber, RPR) | [27] |
| 中国渤海、黄海 | 沉积物 | 171.8个/kg、123.6个/kg、72.0个/kg | 纤维素、PE、PET | [28] |
| 中国香港 | 沉积物 | 49~279个/kg | PP、低密度PE、高密度PE、和苯乙烯-丙烯腈(Styrene-acrylonitrile copolymer, SAN) | [29] |
| 欧洲海滩 | 沉积物 | 72±24 ~ 1 512±187个/kg |
PET、PP、PE | [31] |
| 注: “‒”表示文章中未具体指出。 | ||||
由于人类活动的增加, 西南太平洋岛国上采集的微塑料丰度从2017年的19 167±5 085个/kg, 在2018年增长到了33 300±7 300个/kg, 这与当地土地利用的增加密切相关, 人口更密集的地区, 更接近道路基础设施的酒店和度假村等地方沉积物的微塑料污染情况越严重[20]。中国的渤海、黄海北部和南黄海地区的微塑料平均丰度分别达到了171.8、123.6和72.0个/kg[28]。气候变化对微塑料的污染也有一定的影响, 我国香港地区沿海水域的微塑料丰度在旱季末(2016年3月)最高, 在旱季初(2015年11月)最低。这表明微塑料的丰度和分布可能受季节影响较大[29]。与海洋中存在的微塑料相比, 海滩上微塑料的碎裂在很大程度上取决于环境条件。例如, 夏季强烈的紫外线照射和高温会导致沙滩上塑料大量破碎成更小的碎片, 因此微塑料的数量比冬季更高。这解释了为什么海洋和海滩中微塑料丰度的季节性变化存在差异。值得注意的是, 海滩上微塑料丰度增加的原因包括但不限于洋流、季风和洪水等因素[30]。
2.3 海洋生物中的微塑料微塑料生物降解性差, 可被不同摄食方式和不同营养级的海洋生物摄食(见表 3), 容易在生物体内积累。以沉积物和碎屑为食的多毛类和片脚类动物[32]; 滤食类和悬浮食料的藤壶、桡足类和贝类[33]; 棘皮动物(海参、海胆)[34]、浮游动物和浮游植物等[35], 体内都有微塑料的存在。浮游动物是地球上最丰富和最广泛的生物, 它们通常在微塑料尺寸大小范围内进食。在马来西亚特伦加努河口和近海水域浮游动物中, 每个个体平均摄入了0.104个微塑料纤维或碎片[36]。浮游动物是两个营养级之间的重要联系, 微塑料可以通过浮游动物的摄食进入海洋生物食物链, 并通过食物网对其他海洋生物造成不利影响[37]。与海洋鱼类相关的微塑料调查较多, Wang等[38]从渤海采集了29种不同摄食习性和营养水平的商业鱼类进行微塑料分析。约85.4%的鱼类体内含有微塑料, 平均丰度为2.14个/个体。与其他研究相比, 渤海鱼类的微塑料污染程度相对较轻。在中国渤海湾调查中发现鱼类体内最丰富的是由玻璃纸和PET聚合物组成的微塑料纤维。海胆是底栖生物生态系统的重要生态位, 同时也具有重要的经济价值。Feng等[39]取样的海胆中的微塑料检出率达到89.52%, 所有地点海胆微塑料丰度从2.20±1.5个/个体到10.04±8.46个/个体不等。
| 生物体 | 地点 | 丰度/(个·个体-1) | 形状 | 参考文献 | |
| 浮游生物 | 浮游动物 | 马来西亚特伦加努河口 | 0.104 | 纤维、碎片 | [36] |
| 鱼类 | 银鲳(Pampus argenteus) | 渤海湾 | 0.89±0.77 | 纤维(93.3%)、碎片(3.6%)、颗粒(2.0%)、薄膜(1.1%) | [38] |
| 斑鰶(Konosirus punctatus) | 3.71±3.39 | ||||
| 鲐鱼(Pneumatophorus japonicus) | 1.15±1.49 | ||||
| 鲬(Platycephalus indicus) | 1.80±1.19 | ||||
| 矛尾复鰕虎鱼(Synechogobius hasta) | 2.01±1.67 | ||||
| 白姑鱼(Argyrosomus argentatus) | 2.11±2.36 | ||||
| 方氏云鳚(Enedrias fangi) | 1.14±1.23 | ||||
| 中颌棱鳀(Thryssa mystax) | 1.65±1.39 | ||||
| 高眼鲽(Cleisthenes herzensteini) | 0.32±0.39 | ||||
| 海洋哺乳类 | 白鲸(Delphinapterus leucas) | 亨德里克森岛 | 18~147 | 纤维、碎片 | [40] |
| 灰海豹(Halichoerus grypus) | 爱尔兰南部海岸 | 27.92 | 纤维(85%)、碎片(14%)、薄膜(1%) | [41] | |
| 节肢动物 | 印度白虾(Fenneropenaeus indicus) | 印度喀拉拉邦 | 0.39±0.6 | 纤维(83%)、其他(17%) | [42] |
| 方沙蟹(Ocypode quadrata) | 巴西东南部的Grussai海滩 | 1~158 | 纤维(93%)、碎片(4.4%)、泡沫(1.7%) | [43] | |
| 无脊椎动物 | 海参(Echinodermata: Holothuroidea) | 佛罗里达群岛 | > 1 | 纤维、碎片 | [44] |
| 海胆(Echinoidea) | 中国北方 | 2.20±1.50~10.04±8.46 | 纤维(92.91%)、碎片(4.96%)、薄片(2.13%) | [39] | |
近年来有关海洋哺乳动物对微塑料吸收和暴露的研究有所增加, Moore等[40]在他们取样的所有白鲸体内都发现了微塑料的存在。Hernandez-Milian等[41]对爱尔兰南部海岸的13只灰海豹肠道内的微塑料含量进行研究, 虽然没有发现大的塑料碎片, 但鉴定出363个微塑料制品(85%为纤维, 14%碎片, 1%薄膜)。海洋生物体内检测到的微塑料大部分形状为纤维, 原因可能是由于纤维较容易在显微镜下发现。部分小尺寸颗粒状微塑料难以被发现, 需要更加精密的仪器和技术手段来进行检测。这些顶级捕食者每年可能摄入大量微塑料, 但其中大多数将在消化后被排出, 微塑料颗粒将被重新释放回海洋环境中。这些微塑料颗粒在较低浓度下可能毒性较弱, 但低浓度微塑料长期暴露的潜在危害仍然需要进一步探讨[42]。
3 微塑料吸附的重金属重金属可以通过自然或人为活动进入环境, 经过物理、化学和生物作用不断在自然界和生物体内积累。过量的重金属会破坏土壤和水生生态系统, 影响生物体的生长和活动[45]。微塑料具有较高的比表面积, 导致其成为自然环境中重金属和其他污染物的潜在载体(见表 4)。微塑料上重金属的来源主要有两个方面, 其一是在生产期间重金属及其化合物被添加到塑料中来提高塑料的性能, 如镉、锌作为稳定剂和颜料, 在塑料中的含量分别高达1%和10%[46]。生产过程中添加的重金属相对稳定, 几乎没有迁移倾向, 因为大多数金属化合物是以液相添加到塑料中, 很难释放出来。然而, 当它们由于各种作用被破碎, 变成小尺寸状态时, 重金属有可能沿着浓度梯度不断迁移到微塑料表面[47]。其二是微塑料会从周围的环境中吸附一定浓度的重金属, 在自然环境中, 微塑料已被证实对水相中的重金属具有较高的亲和力, 它们可以迅速吸附周围环境中的重金属[48]。在Carbery等[49]的研究中发现, 微塑料颜色与其吸附重金属含量之间没有关联, 表明微塑料颜色并不是导致金属浓度显著差异的原因。微塑料上的金属水平升高可能是由于密集的工业活动导致地区重金属含量增加造成。土地利用划分似乎是微塑料积累金属的一个重要因素, 与居住用地相比, 从工业地点收集的微塑料上的Se、Cd、Cu、Ba、Zn和Mn水平显著升高, 表明微塑料上的金属负荷显著地反映了当地土地利用的历史情况。同样, 在中国香港地区的调查中发现, 西部地区微塑料上的Ni、Fe、Mn和Cu浓度明显高于东部地区, 说明靠近工业区的珠江很可能是微塑料上重金属的主要来源[50]。在金属浓度较高的地区, 特别是在重工业活动的地区, 微塑料对金属的吸附有所增强。
| 位置 | 样品类型 | 微塑料种类 | 形状 | 吸附重金属种类及浓度 | 参考文献 |
| 澳大利亚北弗里曼特尔海滩 | 沉积物 | PE(64.29%)、PP(28.57%)、PS(7.14%) | 碎片(39.29%)、颗粒(46.43%)、泡沫(10.71%)、其他(3.57%) | Se(12.74 μg/kg)、As(89.58 μg/kg)、Cd(94.73 μg/kg)、Cr(165.38 μg/kg)、Cu(1.16 mg/kg)、Ba(22.35 mg/kg)、Pb(0.24 mg/kg)、Zn(15.12 mg/kg)、Mn(1.25 mg/kg) | [49] |
| 澳大利亚红头海滩 | 沉积物 | PE(56.72%)、PP(31.34%)、PS(4.48%)、未知(7.46%) | 碎片(76.12%)、颗粒(11.94%)、泡沫(4.48%)、纤维(1.49%)、其他(5.97%) | Se(6.14 μg/kg)、As(204.85 μg/kg)、Cd(24.33 μg/kg)、Cr(208.27 μg/kg)、Cu(0.28 mg/kg)、Ba(5.23 mg/kg)、Pb(0.57 mg/kg)、Zn(2.27 mg/kg)、Mn(0.54 mg/kg) | [49] |
| 中国香港 | 沉积物 | PE(42.2%)、PP(23.3%)、PS(19.5%)、PET纤维(6.1%)、PVC(3.3%)、PA(1.1%)、其他(4.5%) | 碎片、纤维、泡沫、薄膜、颗粒 | Cu(0.89±0.89 mg/kg)、Fe(302±224 mg/kg)、Mn(18.6±12.7 mg/kg)、Ni(0.15±0.13 mg/kg)、Zn(19.6±11.4 mg/kg) | [50] |
| 克罗地亚亚得里亚海 | 沉积物 | ‒ | 颗粒 | Cd(2.90 ng/g)、Cr(0.21 μg/g)、Cu(0.21 μg/g)、Fe(40.3 μg/g)、Mn(1.78 μg/g)、Ni(0.14 μg/g)、Pb(0.26 μg/g)、Zn(2.08 μg/g) | [51] |
| 伊朗阿巴斯班达 | 沉积物 | PE、PA、PET | 碎片、薄膜、颗粒、纤维、泡沫 | Al(144.80±5.10 μg/g)、As(220.69±10.95 ng/g)、Cd(5.71±0.41 ng/g)、Co(159.11±6.98 ng/g)、Cr(0.73± 0.15 μg/g)、Cu(0.17±0.01 μg/g)、Fe(133.82±7.03 μg/g)、Hg(97.54±139.77 ng/g)、Mn(6.92±0.32 μg/g)、Ni(0.40±0.01 μg/g)、Pb(178.11±11.01 ng/g)、Ti(3.37±0.36 μg/g)、Zn(0.23±0.03 μg/g) | [52] |
| 英格兰 | 沉积物 | PE、PP、PS、PVC | 颗粒、碎片 | Cd、Pb | [53] |
| 注: “‒”表示文章中未具体指出。 | |||||
研究表明, 微塑料在海洋系统中可以作为重金属的载体对重金属进行富集[51-52], 海洋生物对微塑料的摄入可能会释放并将重金属化合物从生物体转移到食物链上, 获得生物积累[53], 并可以在不同的营养水平上进行生物转化[54], 可能对环境和生物群构成潜在威胁。因此, 对微塑料污染的评估应建立在对微塑料和其它污染物的相互作用及其转运情况的研究基础上进行。
4 微塑料对重金属的吸附行为微塑料上重金属吸附模型研究较多(见表 5), 具体吸附过程可分为3个步骤, 金属在微塑料周围薄膜中的扩散; 微塑料孔隙内重金属的扩散; 重金属在活性位点上的吸附。吸附模型的参数具有明确的物理意义, 可以描述整体的吸附步骤。对于大多数研究, 吸附等温线和动力学模型被用来模拟实验数据和研究吸附过程中的机制。重金属吸附研究中最常用和最适用的等温线模型是Langmuir模型和Freundlich模型, 它们是通过R2系数的比较进行确定。前者描述了分子在吸附部位的单层吸附过程, 吸附剂表面的吸附性能均匀。后者用于表示非线性吸附现象。在大多数情况下, Langmuir模型和Freundlich模型很好地拟合了重金属在微塑料上的吸附[55]。
| 微塑料类型 | 重金属种类 | 微塑料尺寸 | 吸附环境 | 动力学模型 | 等温线模型 | 参考文献 |
| 原始、老化PET碎片 | Zn2+、Cu2+ | 1×1 mm | 超纯水 | ‒ | Langmuir模型 | [63] |
| 老化PS颗粒 | Cd2+ | 400 nm | 超纯水 | 准二级动力学模型 | Henry模型 | [64] |
| 原始PS颗粒、老化PVC碎片 | Zn、Cu | 0.7~0.9 mm、1.6×0.8 mm | 海水 | 准一级动力学模型 | ‒ | [54] |
| PS、PVC、PA、PET颗粒 | Cu2+、Cd2+ | 150~550 μm | 超纯水 | 准二级动力学模型; Elovich模型 | Freundlich模型 | [55] |
| PS | As3+ | 0.1~1 μm、1~10 μm、10~100 μm | 超纯水 | 准二级动力学模型 | Langmuir模型、Freundlich模型 | [59] |
| PVC、PE、PS | Pb | 75~106 μm | 淡水 | 准二级动力学模型 | Langmuir、Freundlich模型(PVC)、BET模型(PS、PE) | [65] |
| PS | As(Ⅲ) | 0.1~1、1~10、10~100 μm | 超纯水 | 准二级动力学模型 | Langmuir、Freundlich模型 | [66] |
| 注: “‒”表示文章中未具体指出。 | ||||||
吸附动力学被广泛应用于获得吸附速率, 估计吸附剂的性能, 分析传质机理。最普遍的动力学方程是准一级(pseudo-first-order, PFO)模型、准二级(pseudo-second-order, PSO)模型。前者经常用于描述非平衡条件下的动力学过程, 它代表了吸附剂初始浓度高和吸附初始阶段的条件, 吸附剂材料中很少存在活性位点。后者代表了吸附剂初始浓度较低和吸附最后阶段的条件, 以及吸附剂具有丰富的活性位点。微塑料通常使用PFO模型、PSO模型和Elovich模型来描述水溶液中重金属的吸附行为。微塑料在水体中对重金属的吸附涉及多种机制(见图 1), 包括物理吸附、络合作用、静电吸附、阳离子-π键相互作用等。对重金属的主要吸附机制随微塑料性质的不同而不同[56]。
 |
| 图 1 微塑料吸附重金属机制 Fig. 1 Mechanism of microplastic adsorption of heavy metals |
微塑料对重金属的吸附特性受多种因素的影响, 微塑料种类、大小和老化程度等特征的不同造成重金属吸附机制也存在差异[57]。不同种类的微塑料表面结构和极性不同, 因此对相同重金属具有不同的吸附亲和力[58]。一般来说, 微塑料粒径越小, 比表面积就越大, 其吸附位点数和可吸附污染物量就越多[59]。但是, 前期研究表明, 小尺寸微塑料比大尺寸微塑料更不稳定, 70 nm的PS颗粒6周后可以在淡水中聚集成199±176 nm的聚合物, 在海水中聚集成361±465 nm聚合物[60]。因此, 粒径对微塑料吸附能力的影响是由粒径和团聚的共同效应所决定。老化微塑料的氧碳比和碳键含量增加, 含氧基团增加了微塑料的表面极性、亲水性和电荷, 导致比表面积和结晶度的变化, 它们都直接或间接地影响了微塑料对重金属的吸附性能[61-62]。
5 微塑料与重金属暴露对海洋生物毒性效应 5.1 微塑料单独暴露对生物的影响微塑料作为新兴的海洋污染物, 在世界各地的海洋生态系统中普遍存在。由于它们体积小, 易被生物吞食, 部分甚至会通过胃肠道膜转移到组织和器官中。最近关于微塑料毒性作用机制的报道表明(见表 6), 微塑料和纳米塑料会诱导生物体产生氧化应激、免疫反应、基因组表达失调、内分泌系统破坏、神经毒性、生殖异常、胚胎毒性和跨代毒性[67]。微塑料对海洋生物的毒性效应受各种因素的影响, 寸尺、浓度和类型都会在一定程度上影响微塑料在生物体内的积累和分布, 进而对生物体产生不同的毒性效应[68]。Phothakwanpracha等[69]利用含有不同尺寸和浓度的PS、PP和聚丁烯(Polybutylene, PB)微塑料水体饲养翡翠贻贝(Perna viridis), 贻贝死亡率伴随着3种微塑料积累的增加而增加, 大型(300~1 000 μm)PS、PP和PB比小型(< 30 μm)和中型(30~300 μm)尺寸导致更高的贻贝死亡率。在相同小型尺寸下, PP颗粒会导致比PS和PB更高的死亡率。在中型和大型尺寸下, PS导致了更高的死亡率。
| 受试生物 | 微塑料种类 | 尺寸 | 暴露剂量 | 暴露途径 | 暴露时间 | 毒性效应 | 参考文献 |
| 凡纳滨对虾(Litopenaeus Vannamei) | 荧光微球 | 1~5 μm | 1.3 g/mL | 腹窦注射 | 2 h | 促进凡纳滨对虾应激和免疫反应, 造成潜在心肌功能障碍 | [70] |
| 仿刺参(Apostichopus japonicus) | 微塑料纤维 | ‒ | 0.6、1.2、10 MFs/g | 饮食暴露 | 60 d | 激活仿刺参免疫反应, 引起氧化应激, 对仿刺参生长无有害影响 | [71] |
| 紫贻贝(Mytilus galloprovinciallis) | 微塑料纤维 | ‒ | 56、100、180 mg/L | 水体暴露 | 7 d | 造成贻贝鳃肥大脱落, 消化腺萎缩和坏死的异常程度增加, DNA损伤增加 | [72] |
| 斑马鱼(Danio rerio) | 微塑料微球 | 1~4 μm | 0、10、100、1 000 mg/L | 水体暴露 | 7 d | 斑马鱼肠道微生物菌群、生理生化参数、糖脂代谢相关基因和代谢产物的转录均受到明显影响, 可能影响斑马鱼的胚胎发育 | [73] |
| 大西洋鲷(Sparus aurata L.) | PVC微粒 | 40~ 150 μm | 100、500 mg/kg | 饮食暴露 | 30 d | 在大西洋鲷肝脏中, hsp90和ucp1基因的表达分别降低和增加 | [74] |
| 青鳉鱼(Oryzias melastigma) | PS颗粒 | 10 μm | 2、20、200 μg/L | 水体暴露 | 60 d | 微塑料在青鳉鱼鳃、肠道和肝脏积累, 导致氧化应激和组织学变化, 延缓了性腺的成熟, 降低了雌鱼的繁殖力 | [75] |
| 注: “‒”表示文章中未具体指出。 | |||||||
暴露于微塑料可诱导凡纳滨对虾(Litopenaeus Vannamei)的心肌功能障碍, 并促进应激和免疫反应[70]。Mohsen等[71]将仿刺参(Apostichopus japonicus)暴露在含微塑料纤维的食物中, 与对照组比较, 酶活性的显著差异仅出现在微塑料纤维的最高浓度处理组。在幼体海参和成体海参中, 酸性磷酸酶(ACP)的活性有显著的波动。幼体和成体海参中的总抗氧化能力(T-AOC)和丙二醛(MDA)水平出现紊乱。这些影响的确切原因尚不清楚, 但可能来自纤维材料本身以及微塑料纤维中的添加剂造成[72]。暴露于聚乙烯微塑料的斑马鱼(Danio rerio)肠道微生物菌群发生了显著变化, 糖脂代谢相关基因的转录水平呈下降趋势; 在1 000 mg/L微塑料处理的幼鱼中, 共有59种磷脂相关物质表现出显著变化, 磷脂代谢相关基因的mRNA水平也有明显变化[73]。饮食暴露微塑料显著增加了大西洋鲷(Sparus aurata L.)血清中天冬氨酸转氨酶、肌酸激酶、白蛋白和球蛋白, 血清中葡萄糖显著降低[74]。青鳉(Oryzias melastigma)暴露于环境相关浓度的聚苯乙烯微塑料中60 d导致微塑料在鳃、肠道和肝脏积累, 还导致氧化应激和组织学变化, 延缓了性腺成熟, 降低了雌鱼繁殖力。在雌性中, 参与类固醇生成途径的基因转录也被下调, 导致雌性血浆中雌二醇和睾酮的浓度降低。在亲代暴露过程中, 推迟了孵化时间, 并降低了后代孵化率、心率和体长[75]。
5.2 微塑料与重金属协同暴露对水生生物的影响微塑料已经扩散到水生环境中, 并作为附着重金属的载体。除了微塑料对水生生物的直接影响外, 有证据表明, 微塑料与重金属之间的相互作用对生物体的影响比单独的微塑料更大。微塑料中添加剂和吸附的重金属可从微塑料中释放, 引起一系列毒性, 并最终通过食物链对人类健康造成有害影响[76]。微塑料与重金属之间的相互作用可能会极大地影响重金属的生物积累和毒性(见表 7)[77]。微塑料可以通过抑制铜离子转运同时增强氧化应激来加重铜在斑马鱼肝脏和肠道的毒性, 造成丙二醛(MDA)和金属硫蛋白(MT)水平升高, 超氧化物歧化酶(SOD)水平降低[78]。Yan等[79]发现微塑料的存在会降低青鳉鱼肠道菌群的多样性和丰度, 而微塑料和重金属(Cd、Pb和Zn)联合处理对增加青鳉鱼肠道的污染负荷增加, 并引发雄性鱼肠道特定细菌种类和肠道功能的显著变化。在性腺发育过程中, 联合暴露会导致青鳉鱼卵泡空位和卵泡闭锁, 并改变与下丘脑-垂体-性腺(HPG)轴相关的基因表达水平, 微塑料上吸附或添加剂中的重金属可能会对生物造成生殖毒性。微塑料和重金属的联合作用通过抑制乙酰胆碱酯酶活性引起斑马鱼幼鱼的神经毒性, 同时造成幼鱼的氧化应激和脂质损伤, 也导致抗氧化系统和解毒机制的激活[80]。微塑料促进重金属生物积累的原因可解释为: 微塑料作为重金属的载体, 增加了重金属的吸收和肠道停留时间; 微塑料破坏了生物体解毒过程, 限制污染物代谢或排泄; 微塑料诱导或加剧组织病理学损伤, 促进污染物进入机体组织(见图 2)[81]。
| 受试生物 | 微塑料种类 | 尺寸 | 重金属种类 | 暴露剂量 | 暴露途径 | 暴露时间 | 毒性效应 | 参考文献 |
| 欧洲舌齿鲈(Dicentrarchus labrax)幼鱼 | - | - | Hg | MPs(0.26、0.69 mg/l)、Hg(0.010、0.016 mg/L) | 水体暴露 | 96h | 微塑料存在加重了鳃及肝脏中的Hg生物积累。引起幼鱼鳃和肝脏的氧化应激, 最高浓度的微塑料引起鳃中的脂质氧化损伤 | [77] |
| 斑马鱼(Danio rerio) | PS | 0.1 μm、20 μm | Cu | Cu(50 μg/L)、MPs(200 μg/L) | 水体暴露 | 14d | 加重肝脏和肠道的铜毒性, 造成丙二醛(MDA)和金属硫蛋白(MT)水平升高,超氧化物歧化酶(SOD)水平降低 | [78] |
| 青鳉鱼(Oryzias melastigma) | PS | 2.5μm | Cd、Pd、Zn | MPs(100 μg/L)、Cd(10 μg/L)、Pb(50 μg/L)、Zn(100 μg/L) | 水体暴露 | 30d | 联合处理组青鱼肠道的污染负荷增加,引发了雄性体内特定细菌种类和肠道功能的显著变化 | [79] |
| 斑马鱼(Danio rerio)胚胎 | - | 1~5 μm | Cu | MPs(2 mg/L)、Cu(60 μg/L、125 μg/L) | 水体暴露 | 14d | 微塑料和Cu单个或联合处理通过抑制乙酰胆碱酯酶活性引起幼鱼的神经毒性 | [80] |
| 斑马鱼(Danio rerio)胚胎 | PET | 150 μm颗粒、20 μm纤维 | Cd | MPs(20 mg/L)、Cd(1 mg/L) | 水体暴露 | 72h | 绒毛膜可以阻隔PET纤维和颗粒,联合暴露造成胚胎中的Cd积累显著降低 | [82] |
| 海洋轮虫(Brachionus plicatilis) | PS | 50 nm、6 μm | As | MPs(1、2.5 μg/mL)、As(1 mg/L) | 水体暴露 | 7d | As与NPs联合暴露导致As更高毒性,可能与MXR抑制有关,而MPs减轻了As的毒性 | [83] |
| 斑马鱼(Danio rerio)幼体 | PS | 100 nm、175 μm | Cd | MPs(20 mg/L)、Cd(1 mg/L) | 水体暴露 | 120h | 纳米PS诱导了幼鱼的高氧化应激, 促进了纳米PS+Cd处理组中牛磺酸代谢和不饱和脂肪的生物合成, 纳米PS还促进了Cd处理的幼鱼的分解代谢过程、氨基酸代谢、嘌呤代谢和类固醇激素生物合成的代谢途径 | [84] |
| 斑马鱼(Danio rerio)胚胎 | PS | 10μm | Cd | MPs(O、0.05、0.1、1、5、10 mg/L)、Cd(0.01 mg/L) | 水体暴露 | 1h | 低浓度微塑料降低了Cd对斑马鱼胚胎的致死和亚致死作用; 高浓度微塑料和Cd联合暴露时,对胚胎的发育毒性表现出协同作用,致死毒性表现出拮抗作用 | [86] |
| 黄海马(Hippocampus kuda) | HDPE | 15~80 μm | C2+、Cd2+、P52+ | MPs(0.033 g/L)、Cu2+(0.05 mg/L)、cd2+(0.01 mg/L)、Pb2+(0.05 mg/L) | 水体暴露 | 45d | 联合处理组海马体长、体重、肥满度、特定生长率、生存率均低于其他组。HDPE微塑料对海马没有明显的不良影响,海马生长影响主要是由于重金属积累造成 | [88] |
| 斑马鱼(Danio rerio) | PE | 10~106 μm | Ag | MPs(10、100、1 000 MPBs/L)、Ag(1 μg/L) | 水体暴露 | 24h | 微塑料和Ag的共同暴露并没有改变斑马鱼中Ag的摄取和定位 | [90] |
| 紫贻贝(Mytilus galloprovincialis) | HDPE | 10~15 μm | Hg | MPs(2 mg/L)、Hg(2.5 μg/L) | 水体暴露 | 240min | Hg积累在贻贝的消化腺和鳃中,微塑料促进了贻贝中Hg的进入,同时也促进了汞的消除 | [91] |
| 注: “‒”表示文章中未具体指出。 | ||||||||
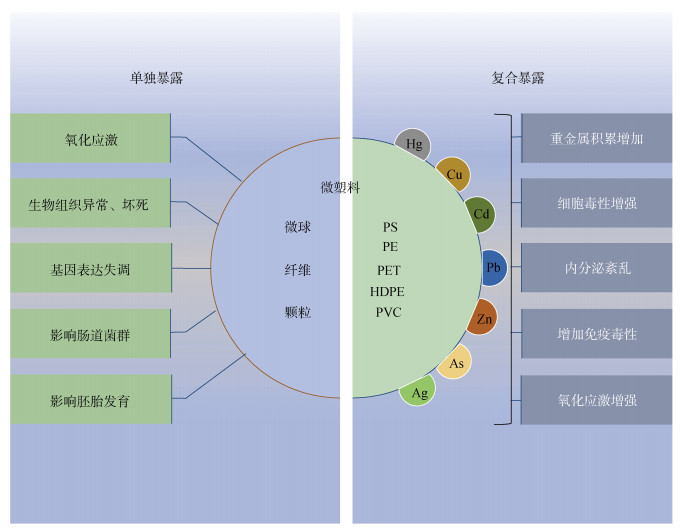 |
| 图 2 微塑料单独和与重金属复合暴露毒性效应 Fig. 2 Toxic effects of microplastics and the combined toxicity of microplastics with heavy metals |
微塑料对水生生物的毒性可能与其形状和尺寸有很大关系。Cheng等[82]的研究表明微塑料纤维的存在加速了斑马鱼胚胎的血流速度和心率, 抑制了胚胎绒毛膜通道的屏障作用。微塑料颗粒在绒毛膜上的吸附, 间接增加了绒毛膜中的Cd含量。相比之下, 微塑料纤维在培养基中解离, 绒毛膜中Cd含量较低。鉴于绒毛膜可以有效阻断颗粒和纤维状微塑料, 造成Cd的生物利用度降低, 胚胎膜内Cd积累显著降低, 微塑料引起的毒性可能与形状有直接关系。纳/微米微塑料和As联合暴露对轮虫(Brachionus plicatilis)的影响与尺寸有着密切关系, 与单独暴露的As和纳/微米微塑料组相比, 联合暴露于As和纳米微塑料组的毒性增强, 暴露于微米级微塑料和As的组则减轻了对轮虫的毒性, 塑料颗粒大小已被证明是决定联合暴露生物效应的一个关键因素[83-84]。在分子水平上, 与微米微塑料相比, 纳米微塑料更容易诱导其对具有多种生物抗性(multixenobiotic resistance, MXR)的ATP-结合盒蛋白的抑制作用[85]。微塑料剂量是影响其毒性的另一个重要因素, Zhang等[86]发现在一系列浓度的微塑料和环境水平Cd的暴露对斑马鱼胚胎生存率和心率(HR)有负面影响。联合暴露下微塑料浓度与致死和亚致死毒性呈正相关。2种污染物的混合物对低浓度微塑料(0.05、0.1 mg/L)对斑马鱼胚胎具有拮抗毒性, 而对高浓度微塑料(1、5、10 mg/L)具有协同亚致死毒性。
另一方面, 有研究证明微塑料的存在对于重金属的影响并不会产生较大影响[87]。HDPE微塑料的存在对黄海马(Hippocampus kuda)的有害影响很少或没有影响, 虽然会引起超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的增加, 但很快恢复到对照水平。这种可能与HDPE微塑料进入海马体内造成物理损伤有关, 因此可以迅速修复, 海马的生长影响主要是由于重金属的积累造成[88]。另有一些研究表明, 微塑料和镍(Ni)同时暴露相比单独重金属镍暴露, 对水蚤(Daphnia magna)的毒性更低。微塑料和重金属同时存在时, 对生物体的毒性会发生改变, 甚至同一物质的毒性趋势可能由于微塑料的官能团和其他特征而有所不同[89]。微塑料的存在一定程度上降低了重金属的生物利用度。Khan等[90]人发现与单独Ag暴露相比, 无论微塑料的剂量如何改变, 原始微塑料和Ag的共同暴露并没有改变斑马鱼中Ag的摄取和定位。与此类似, 微塑料可以促进汞进入贻贝(Mytilus galloprovincialis)体内, 同时也促进了汞的消除。微塑料的存在有助于通过粪便消除汞, 降低了微塑料上汞吸附的毒理学风险[91]。Oliveira等[92]发现暴露于微塑料、汞或混合物的双壳类生物显著降低了暴露后过滤率(FR)和脂质过氧化(LPO)水平, 微塑料与汞对FR、ChE活性、GST活性和LPO水平均表现出拮抗作用。微塑料对重金属的生物利用度影响程度取决于尺寸、浓度、类型、添加剂、重金属浓度和类型等。需要更加深入研究, 客观评估微塑料和重金属共同暴露造成的生态风险。
6 总结与展望与其它污染物相比, 微塑料在环境中很难降解, 并持续在水体和沉积物中作为载体积累重金属等化学污染物。本文主要综述了海洋中微塑料的来源及海水、沉积物和生物体内微塑料的污染现状, 总结了部分海域微塑料上的重金属富集特征, 并介绍了部分微塑料对重金属的吸附模型, 最后总结分析了微塑料单独和与重金属协同作用对海洋生物的毒性效应。近年来, 与微塑料相关的研究日益增多, 但大部分的调查分析缺少统一标准, 无法做到完全客观地评价微塑料污染现状。实验室条件下的毒理研究大多无法同真实环境密切结合, 也无法客观评价微塑料对生物体的影响。微塑料与其它污染物的协同毒性效应也亟待进一步揭示。
1) 微塑料污染调查纳入常规监测
微塑料是广泛存在的污染物, 几乎存在于所有的环境介质中。然而, 由于目前使用的分析程序复杂且不统一, 关于其来源、时间和空间上变化的认知仍然有限[93]。例如, 没有标准过滤尺寸, 导致在水体研究中取样不同, 造成的微塑料尺寸和类型产生差异。大多数结果的代表性和可重复性存在不确定性。因此, 迫切需要一种经过验证、快速和统一的检测方法, 以及一种全面的微塑料污染评价方法, 将微塑料污染纳入常规监测项目, 对未来微塑料污染管控具有重要意义。
2) 真实还原环境中微塑料状态
尽管目前的实验室研究证据表明, 微塑料暴露可能对海洋生物群的健康产生一系列负面影响, 但是大多数暴露研究都测试了与环境浓度无关的高剂量, 并使用了与环境相关性较低的微塑料类型, 这使得微塑料对环境相关风险的外推具有挑战性[94]。可以考虑在实地调查的基础上进行实验设计, 例如, 实验室暴露中使用的微塑料接近环境中真实存在的类型和尺寸等。另一方面, 自然老化微塑料对重金属吸附能力的影响有待进一步研究。与人工老化相比, 微塑料在实际环境中的老化受到许多因素的影响。因此, 在实验室研究中可以采用多种老化方法结合, 以实现与环境老化微塑料的一致性和可控性。在老化过程中, 微塑料表面会形成生物膜, 生物膜与老化微塑料之间的相互作用以及生物膜生长与重金属吸附的关系值得进一步研究。
3) 微塑料和重金属复合毒性
微塑料和重金属难以降解和转化, 它们共同暴露于生态系统中对人类的威胁不能被忽视。微塑料和重金属相互作用对生物体的毒性效应可能是相加、拮抗或协同。由于很难评估微塑料和其他污染物共同接触对人类的实际风险, 因此它们对人类的影响尚不确定。鉴于以往的研究主要集中在单个微塑料和重金属对某些生物体的影响上, 微塑料和相关污染物的联合毒性可能具有化学特异性和物种特异性。到目前为止, 微塑料的哪些特性(大小、形状或类型)增强或减轻了重金属或其它污染物对测试生物体的影响尚不清楚。拮抗或协同效应发生的关键条件及其潜在机制有待进一步研究[95]。
| [1] |
MAGNIER L, MUGGE R, SCHOORMANS J. Turning ocean garbage into products – Consumers' evaluations of products made of recycled ocean plastic[J]. Journal of Cleaner Production, 2019, 215: 84-98. DOI:10.1016/j.jclepro.2018.12.246 |
| [2] |
KANHAI D K, GARDFELDT K, LYASHEVSKA O, et al. Microplastics in sub-surface waters of the Arctic Central Basin[J]. Marine Pollution Bulletin, 2018, 130: 8-18. DOI:10.1016/j.marpolbul.2018.03.011 |
| [3] |
HIPFNER J M, GALBRAITH M, TUCKER S, et al. Two forage fishes as potential conduits for the vertical transfer of microfibres in Northeastern Pacific Ocean food webs[J]. Environmental Pollution, 2018, 239: 215-222. DOI:10.1016/j.envpol.2018.04.009 |
| [4] |
O'CONNOR D, HOU D Y, OK Y S, et al. The effects of iniquitous lead exposure on health[J]. Nature Sustaina bi lity, 2020, 3(2): 77-79. DOI:10.1038/s41893-020-0475-z |
| [5] |
GREGORY M R. Plastic 'scrubbers' in hand cleansers: a further (and minor) source for marine pollution identified[J]. Marine Pollution Bulletin, 1996, 32(12): 867-871. DOI:10.1016/S0025-326X(96)00047-1 |
| [6] |
ZHANG K, HAMIDIAN A H, TUBIC A, et al. Understanding plastic degradation and microplastic formation in the environment: A review[J]. Environmental Pollution, 2021, 274: 116554. DOI:10.1016/j.envpol.2021.116554 |
| [7] |
HIDALGO-RUZ V, GUTOW L, THOMPSON R C, et al. Microplastics in the marine environment: a review of the methods used for identification and quantifycation[J]. Environmental Science & Technology, 2012, 46(6): 3060-3075. |
| [8] |
BROWNE M A, CRUMP P, NIVEN S J, et al. Accumulation of microplastic on shorelines woldwide: sources and sinks[J]. Environmental Science & Technology, 2011, 45(21): 9175-9179. |
| [9] |
CARR S A, LIU J, TESORO A G. Transport and fate of microplastic particles in wastewater treatment plants[J]. Water Research, 2016, 91: 174-182. DOI:10.1016/j.watres.2016.01.002 |
| [10] |
MA J L, NIU X J, ZHANG D Q, et al. High levels of microplastic pollution in aquaculture water of fish ponds in the Pearl River Estuary of Guangzhou, China[J]. Science of the Total Environment, 2020, 744: 140679. DOI:10.1016/j.scitotenv.2020.140679 |
| [11] |
GALLOWAY T S, COLE M, LEWIS C. Interactions of microplastic debris throughout the marine ecosystem[J]. Nature Ecology & Evolution, 2017, 1(5): 0116. |
| [12] |
ZHENG Y F, LI J X, CAO W, et al. Distribution characteristics of microplastics in the seawater and sediment: A case study in Jiaozhou Bay, China[J]. Science of the Total Environment, 2019, 674: 27-35. DOI:10.1016/j.scitotenv.2019.04.008 |
| [13] |
LUSHER A L, TIRELLI V, O'CONNOR I, et al. Microplastics in Arctic polar waters: the first reported values of particles in surface and sub-surface samples[J]. Scien tific Reports, 2015, 5: 14947. DOI:10.1038/srep14947 |
| [14] |
CINCINELLI A, SCOPETANI C, CHELAZZI D, et al. Microplastic in the surface waters of the Ross Sea (Antarctica): Occurrence, distribution and characterization by FTIR[J]. Chemosphere, 2017, 175: 391-400. DOI:10.1016/j.chemosphere.2017.02.024 |
| [15] |
LUSHER A L, BURKE A, O'CONNOR I, et al. Microplastic pollution in the Northeast Atlantic Ocean: validated and opportunistic sampling[J]. Marine Pollu tion Bulletin, 2014, 88(1/2): 325-333. |
| [16] |
LIU M, DING Y, HUANG P, et al. Microplastics in the Western Pacific and South China Sea: Spatial variations reveal the impact of Kuroshio intrusion[J]. Environ mental Pollution, 2021, 288: 117745. DOI:10.1016/j.envpol.2021.117745 |
| [17] |
LI C J, ZHU L X, WANG X H, et al. Cross-oceanic distribution and origin of microplastics in the subsurface water of the South China Sea and Eastern Indian Ocean[J]. Science of the Total Environment, 2021, 805: 150243. |
| [18] |
GONG J, XIE P. Research progress in sources, analytical methods, eco-environmental effects, and control measures of microplastics[J]. Chemosphere, 2020, 254: 126790. DOI:10.1016/j.chemosphere.2020.126790 |
| [19] |
MISHRA A K, SINGH J, MISHRA P P. Microplastics in polar regions: An early warning to the world's pristine ecosystem[J]. Science of the Total Environ ment, 2021, 784: 147149. |
| [20] |
BAKIR A, DESENDER M, WILKINSON T, et al. Occurrence and abundance of meso and microplastics in sediment, surface waters, and marine biota from the South Pacific region[J]. Marine Pollution Bulletin, 2020, 160: 111572. DOI:10.1016/j.marpolbul.2020.111572 |
| [21] |
QI H Y, FU D D, WANG Z Z, et al. Microplastics occurrence and spatial distribution in seawater and sediment of Haikou Bay in the northern South China Sea[J]. Estuarine, Coastal and Shelf Science, 2020, 239: 106757. DOI:10.1016/j.ecss.2020.106757 |
| [22] |
ZHAO S Y, WANG T, ZHU L X, et al. Analysis of suspended microplastics in the Changjiang Estuary: Implications for riverine plastic load to the ocean[J]. Water Research, 2019, 161: 560-569. DOI:10.1016/j.watres.2019.06.019 |
| [23] |
WOODALL L C, SANCHEZ-VIDAL A, CANALS M, et al. The deep sea is a major sink for microplastic debris[J]. Royal Society Open Science, 2014, 1(4): 140317. DOI:10.1098/rsos.140317 |
| [24] |
JAMBECK JENNA R, GEYER R, WILCOX C, et al. Plastic waste inputs from land into the ocean[J]. Scien ce, 2015, 347(6223): 768-771. |
| [25] |
NäKKI P, SETäLä O, LEHTINIEMI M. Bioturbation transports secondary microplastics to deeper layers in soft marine sediments of the northern Baltic Sea[J]. Marine Pollution Bulletin, 2017, 119(1): 255-261. DOI:10.1016/j.marpolbul.2017.03.065 |
| [26] |
ADAMS J K, DEAN B Y, ATHEY S N, et al. Anthropogenic particles (including microfibers and microplastics) in marine sediments of the Canadian Arctic[J]. Science of the Total Environment, 2021, 784: 147155. |
| [27] |
MUNARI C, INFANTINI V, SCOPONI M, et al. Microplastics in the sediments of Terra Nova Bay (Ross Sea, Antarctica)[J]. Marine Pollution Bulletin, 2017, 122(1/2): 161-165. |
| [28] |
ZHAO J M, RAN W, TENG J, et al. Microplastic pollution in sediments from the Bohai Sea and the Yellow Sea, China[J]. Science of the Total Environ ment, 2018, 640: 637-645. |
| [29] |
TSANG Y Y, MAK C W, LIEBICH C, et al. Microplastic pollution in the marine waters and sediments of Hong Kong[J]. Marine Pollution Bulletin, 2017, 115(1/2): 20-28. |
| [30] |
VEERASINGAM S, MUGILARASAN M, VENKATA CHALAPATHY R, et al. Influence of 2015 flood on the distribution and occurrence of microplastic pellets along the Chennai coast, India[J]. Marine Pollution Bulletin, 2016, 109(1): 196-204. DOI:10.1016/j.marpolbul.2016.05.082 |
| [31] |
LOTS F A E, BEHRENS P, VIJVER M G, et al. A large- scale investigation of microplastic contamination: Abundance and characteristics of microplastics in European beach sediment[J]. Marine Pollution Bulletin, 2017, 123(1/2): 219-226. |
| [32] |
SETäLä O, NORKKO J, LEHTINIEMI M. Feeding type affects microplastic ingestion in a coastal invertebrate community[J]. Marine Pollution Bulletin, 2016, 102(1): 95-101. DOI:10.1016/j.marpolbul.2015.11.053 |
| [33] |
DING J F, LI J X, SUN C J, et al. An examination of the occurrence and potential risks of microplastics across various shellfish[J]. Science of The Total Environ ment, 2020, 739: 139887. DOI:10.1016/j.scitotenv.2020.139887 |
| [34] |
MOHSEN M, ZHANG L B, SUN L N, et al. A deposit- feeder sea cucumber also ingests suspended particles through the mouth[J]. Journal of Experimental Biology, 2020, 223(24): jeb230508. |
| [35] |
MD AMIN R, SOHAIMI E S, ANUAR S T, et al. Microplastic ingestion by zooplankton in Terengganu coastal waters, southern South China Sea[J]. Marine Pollution Bulletin, 2020, 150: 110616. DOI:10.1016/j.marpolbul.2019.110616 |
| [36] |
TAHA Z D, MD AMIN R, ANUAR S T, et al. Microplastics in seawater and zooplankton: A case study from Terengganu estuary and offshore waters, Malaysia[J]. Science of The Total Environment, 2021, 786: 147466. DOI:10.1016/j.scitotenv.2021.147466 |
| [37] |
COLE M, COPPOCK R, LINDEQUE P K, et al. Effects of nylon microplastic on feeding, lipid accumulation, and moulting in a coldwater copepod[J]. Environmental Science & Technology, 2019, 53(12): 7075-7082. |
| [38] |
WANG Q, ZHU X P, HOU C W, et al. Microplastic uptake in commercial fishes from the Bohai Sea, China[J]. Che mosphere, 2021, 263: 127962. |
| [39] |
FENG Z H, WANG R, ZHANG T, et al. Microplastics in specific tissues of wild sea urchins along the coastal areas of northern China[J]. Science of The Total Envi ronment, 2020, 728: 138660. DOI:10.1016/j.scitotenv.2020.138660 |
| [40] |
MOORE R C, LOSETO L, NOEL M, et al. Microplastics in beluga whales (Delphinapterus leucas) from the Eastern Beaufort Sea[J]. Marine Pollution Bulletin, 2020, 150: 110723. DOI:10.1016/j.marpolbul.2019.110723 |
| [41] |
HERNANDEZ-MILIAN G, LUSHER A, MACGABBAN S, et al. Microplastics in grey seal (Halichoerus grypus) intestines: Are they associated with parasite aggregations?[J]. Marine Pollution Bulletin, 2019, 146: 349-354. DOI:10.1016/j.marpolbul.2019.06.014 |
| [42] |
DANIEL D B, ASHRAF P M, THOMAS S N. Abundance, characteristics and seasonal variation of microplastics in Indian white shrimps (Fenneropenaeus indicus) from coastal waters off Cochin, Kerala, India[J]. Science of The Total Environment, 2020, 737: 139839. DOI:10.1016/j.scitotenv.2020.139839 |
| [43] |
COSTA L L, ARUEIRA V F, DA COSTA M F, et al. Can the Atlantic ghost crab be a potential biomonitor of microplastic pollution of sandy beaches sediment?[J]. Marine Pollution Bulletin, 2019, 145: 5-13. DOI:10.1016/j.marpolbul.2019.05.019 |
| [44] |
PLEE T A, POMORY C M. Microplastics in sandy environments in the Florida Keys and the panhandle of Florida, and the ingestion by sea cucumbers (Echinodermata: Holothuroidea) and sand dollars (Echinodermata: Echinoidea)[J]. Marine Pollution Bulletin, 2020, 158: 111437. DOI:10.1016/j.marpolbul.2020.111437 |
| [45] |
YU B J, WANG X L, DONG K F, et al. Heavy metal concentrations in aquatic organisms (fishes, shrimp and crabs) and health risk assessment in China[J]. Marine Pollution Bulletin, 2020, 159: 111505. DOI:10.1016/j.marpolbul.2020.111505 |
| [46] |
TOWN R M, VAN LEEUWEN H P, BLUST R. Biochemodynamic features of metal ions bound by micro- and nano-plastics in aquatic media[J]. Frontiers in Chemistry, 2018, 6: 627. DOI:10.3389/fchem.2018.00627 |
| [47] |
BROWNE M A, NIVEN S J, GALLOWAY T S, et al. Microplastic moves pollutants and additives to worms, reducing functions linked to health and biodiversity[J]. Current Biology, 2013, 23(23): 2388-2392. DOI:10.1016/j.cub.2013.10.012 |
| [48] |
HOLMES L A, TURNER A, THOMPSON R C. Adsorption of trace metals to plastic resin pellets in the marine environment[J]. Environmental Pollution, 2012, 160(1): 42-48. DOI:10.3969/j.issn.1001-3865.2012.01.011 |
| [49] |
CARBERY M, MACFARLANE G R, O'CONNOR W, et al. Baseline analysis of metal(loid)s on microplastics collected from the Australian shoreline using citizen science[J]. Marine Pollution Bulletin, 2020, 152: 110914. DOI:10.1016/j.marpolbul.2020.110914 |
| [50] |
LI W J, LO H S, WONG H M, et al. Heavy metals contamination of sedimentary microplastics in Hong Kong[J]. Marine Pollution Bulletin, 2020, 153: 110977. DOI:10.1016/j.marpolbul.2020.110977 |
| [51] |
MARSIC-LUCIC J, LUSIC J, TUTMAN P, et al. Levels of trace metals on microplastic particles in beach sediments of the island of Vis, Adriatic Sea, Croatia[J]. Marine Pollution Bulletin, 2018, 137: 231-236. DOI:10.1016/j.marpolbul.2018.10.027 |
| [52] |
YAZDANI FOSHTOMI M, ORYAN S, TAHERI M, et al. Composition and abundance of microplastics in surface sediments and their interaction with sedimentary heavy metals, PAHs and TPH (total petroleum hydrocarbons)[J]. Marine Pollution Bulletin, 2019, 149: 110655. DOI:10.1016/j.marpolbul.2019.110655 |
| [53] |
MASSOS A, TURNER A. Cadmium, lead and bromine in beached microplastics[J]. Environmental Pollution, 2017, 227: 139-145. DOI:10.1016/j.envpol.2017.04.034 |
| [54] |
BRENNECKE D, DUARTE B, PAIVA F, et al. Microplastics as vector for heavy metal contamination from the marine environment[J]. Estuarine, Coastal and Shelf Science, 2016, 178: 189-195. DOI:10.1016/j.ecss.2015.12.003 |
| [55] |
GAO L, FU D D, ZHAO J J, et al. Microplastics aged in various environmental media exhibited strong sorption to heavy metals in seawater[J]. Marine Pollution Bulletin, 2021, 169: 112480. DOI:10.1016/j.marpolbul.2021.112480 |
| [56] |
GAO X, HASSAN I, PENG Y T, et al. Behaviors and influencing factors of the heavy metals adsorption onto microplastics: A review[J]. Journal of Cleaner Produ ction, 2021, 319: 128777. DOI:10.1016/j.jclepro.2021.128777 |
| [57] |
TORRES F G, DIOSES-SALINAS D C, PIZARRO- ORTEGA C I, et al. Sorption of chemical contaminants on degradable and non-degradable microplastics: Recent progress and research trends[J]. Science of The Total Environment, 2021, 757: 143875. DOI:10.1016/j.scitotenv.2020.143875 |
| [58] |
WANG F, SHIH K M, LI X Y. The partition behavior of perfluorooctanesulfonate (PFOS) and perfluorooctanesulfonamide (FOSA) on microplastics[J]. Chemosphere, 2015, 119: 841-847. DOI:10.1016/j.chemosphere.2014.08.047 |
| [59] |
HAN Xiaoxin, WANG Shiyu, YU Xue, et al. Kinetics and size effects on adsorption of Cu(II), Cr(III), and Pb(II) onto polyethylene, polypropylene, and polyethylene terephthalate microplastic particles[J]. Frontiers in Marine Science, 2021, 8: 785146. DOI:10.3389/fmars.2021.785146 |
| [60] |
VELZEBOER I, KWADIJK C, KOELMANS A A. Strong sorption of PCBs to nanoplastics, microplastics, carbon nanotubes, and fullerenes[J]. Environmental Science & Technology, 2014, 48(9): 4869-4876. |
| [61] |
LUO H W, LIU C Y, HE D Q, et al. Environmental behaviors of microplastics in aquatic systems: A systematic review on degradation, adsorption, toxicity and biofilm under aging conditions[J]. Journal of Hazardous Materials, 2022, 423(Pt A): 126915. |
| [62] |
FU L N, LI J, WANG G Y, et al. Adsorption behavior of organic pollutants on microplastics[J]. Ecotoxicology & Environmental Safety, 2021, 217: 112207. |
| [63] |
WANG Q J, ZHANG Y, WANGJIN X X, et al. The adsorption behavior of metals in aqueous solution by microplastics effected by UV radiation[J]. Journal of Environmental Sciences, 2020, 87: 272-280. DOI:10.1016/j.jes.2019.07.006 |
| [64] |
LANG M F, YU X Q, LIU J H, et al. Fenton aging significantly affects the heavy metal adsorption capacity of polystyrene microplastics[J]. Science of The Total Environment, 2020, 722: 137762. DOI:10.1016/j.scitotenv.2020.137762 |
| [65] |
LIN Z K L, HU Y W, YUAN Y J, et al. Comparative analysis of kinetics and mechanisms for Pb(II) sorption onto three kinds of microplastics[J]. Ecotoxicology and Environmental Safety, 2021, 208: 111451. DOI:10.1016/j.ecoenv.2020.111451 |
| [66] |
DONG Y M, GAO M L, SONG Z G, et al. As(III) adsorption onto different-sized polystyrene microplastic particles and its mechanism[J]. Chemosphere, 2020, 239: 124792. DOI:10.1016/j.chemosphere.2019.124792 |
| [67] |
ALIMBA C G, FAGGIO C. Microplastics in the marine environment: Current trends in environmental pollution and mechanisms of toxicological profile[J]. Environ mental Toxicology & Pharmacology, 2019, 68: 61-74. |
| [68] |
KIM J H, YU Y B, CHOI J H. Toxic effects on bioaccumulation, hematological parameters, oxidative stress, immune responses and neurotoxicity in fish exposed to microplastics: A review[J]. Journal of Hazardous Materials, 2021, 413: 125423. DOI:10.1016/j.jhazmat.2021.125423 |
| [69] |
PHOTHAKWANPRACHA J, LIRDWITAYAPRASIT T, PAIROHAKUL S. Effects of sizes and concentrations of different types of microplastics on bioaccumulation and lethality rate in the green mussel, Perna viridis[J]. Marine Pollution Bulletin, 2021, 173: 112954. DOI:10.1016/j.marpolbul.2021.112954 |
| [70] |
HAN J E, CHOI S-K, JEON H J, et al. Transcriptional response in the whiteleg shrimp (Penaeus vannamei) to short-term microplastic exposure[J]. Aquaculture Reports, 2021, 20: 100713. DOI:10.1016/j.aqrep.2021.100713 |
| [71] |
MOHSEN M, ZHANG L B, SUN L N, et al. Effect of chronic exposure to microplastic fibre ingestion in the sea cucumber Apostichopus japonicus[J]. Ecotoxicolo gy & Environmental Safety, 2021, 209: 111794. |
| [72] |
ALNAJAR N, JHA A N, TURNER A. Impacts of microplastic fibres on the marine mussel, Mytilus galloprovinciallis[J]. Chemosphere, 2021, 262: 128290. DOI:10.1016/j.chemosphere.2020.128290 |
| [73] |
ZHAO Y, QIN Z, HUANG Z Z, et al. Effects of polyethylene microplastics on the microbiome and metabolism in larval zebrafish[J]. Environmental Pollution, 2021, 282: 117039. DOI:10.1016/j.envpol.2021.117039 |
| [74] |
ESPINOSA C, CUESTA A, ESTEBAN M A. Effects of dietary polyvinylchloride microparticles on general health, immune status and expression of several genes related to stress in gilthead seabream (Sparus aurata L.)[J]. Fish Shellfish Immunology, 2017, 68: 251-259. DOI:10.1016/j.fsi.2017.07.006 |
| [75] |
WANG J, LI Y J, LU L, et al. Polystyrene microplastics cause tissue damages, sex-specific reproductive disruption and transgenerational effects in marine medaka (Oryzias melastigma)[J]. Environmental Pollution, 2019, 254(Pt B): 113024. |
| [76] |
KHALID N, AQEEL M, NOMAN A, et al. Interactions and effects of microplastics with heavy metals in aquatic and terrestrial environments[J]. Environmental Pol lu tion, 2021, 290: 118104. |
| [77] |
BARBOZA L G A, VIEIRA L R, BRANCO V, et al. Microplastics increase mercury bioconcentration in gills and bioaccumulation in the liver, and cause oxidative stress and damage in Dicentrarchus labrax juveniles[J]. Scientific Reports, 2018, 8(1): 15655. DOI:10.1038/s41598-018-34125-z |
| [78] |
QIAO R X, LU K, DENG Y F, et al. Combined effects of polystyrene microplastics and natural organic matter on the accumulation and toxicity of copper in zebrafish[J]. Science of The Total Environment, 2019, 682: 128-137. DOI:10.1016/j.scitotenv.2019.05.163 |
| [79] |
YAN W, HAMID N, DENG S, et al. Individual and combined toxicogenetic effects of microplastics and heavy metals (Cd, Pb, and Zn) perturb gut microbiota homeostasis and gonadal development in marine medaka (Oryzias melastigma)[J]. Journal of Hazardous Mate rials, 2020, 397: 122795. |
| [80] |
SANTOS D, FELIX L, LUZIO A, et al. Single and combined acute and subchronic toxic effects of microplastics and copper in zebrafish (Danio rerio) early life stages[J]. Chemosphere, 2021, 277: 130262. DOI:10.1016/j.chemosphere.2021.130262 |
| [81] |
SUN T, WANG S, JI C L, et al. Microplastics aggravate the bioaccumulation and toxicity of coexisting contaminants in aquatic organisms: A synergistic health hazard[J]. Journal of Hazardous Materials, 2022, 424: 127533. DOI:10.1016/j.jhazmat.2021.127533 |
| [82] |
CHENG H, FENG Y, DUAN Z, et al. Toxicities of microplastic fibers and granules on the development of zebrafish embryos and their combined effects with cadmium[J]. Chemosphere, 2021, 269: 128677. DOI:10.1016/j.chemosphere.2020.128677 |
| [83] |
KANG H M, BYEON E, JEONG H, et al. Arsenic exposure combined with nano- or microplastic induces different effects in the marine rotifer Brachionus plicatilis[J]. Aquatic Toxicology, 2021, 233: 105772. DOI:10.1016/j.aquatox.2021.105772 |
| [84] |
QIN L, DUAN Z H, CHENG H D, et al. Size- dependent impact of polystyrene microplastics on the toxicity of cadmium through altering neutrophil expression and metabolic regulation in zebrafish larvae[J]. Environ mental Pollution, 2021, 291: 118169. DOI:10.1016/j.envpol.2021.118169 |
| [85] |
WU B, WU X M, LIU S, et al. Size-dependent effects of polystyrene microplastics on cytotoxicity and efflux pump inhibition in human Caco-2 cells[J]. Chemosphere, 2019, 221: 333-341. DOI:10.1016/j.chemosphere.2019.01.056 |
| [86] |
ZHANG R, WANG M, CHEN X P, et al. Combined toxicity of microplastics and cadmium on the zebrafish embryos (Danio rerio)[J]. Science of The Total Environment, 2020, 743: 140638. DOI:10.1016/j.scitotenv.2020.140638 |
| [87] |
DAVARPANAH E, GUILHERMINO L. Single and combined effects of microplastics and copper on the population growth of the marine microalgae Tetraselmis chuii[J]. Estuarine, Coastal and Shelf Science, 2015, 167: 269-275. DOI:10.1016/j.ecss.2015.07.023 |
| [88] |
SUN J H, XIA S D, NING Y, et al. Effects of microplastics and attached heavy metals on growth, immunity, and heavy metal accumulation in the yellow seahorse, Hippocampus kuda Bleeker[J]. Marine Pollution Bulletin, 2019, 149: 110510. DOI:10.1016/j.marpolbul.2019.110510 |
| [89] |
KIM D, CHAE Y, AN Y J. Mixture toxicity of nickel and microplastics with different functional groups on Daphnia magna[J]. Environmental Science & Tech no logy, 2017, 51(21): 12852-12858. |
| [90] |
KHAN F R, SYBERG K, SHASHOUA Y, et al. Influence of polyethylene microplastic beads on the uptake and localization of silver in zebrafish (Danio rerio)[J]. Environmental Pollution, 2015, 206: 73-79. DOI:10.1016/j.envpol.2015.06.009 |
| [91] |
FERNANDEZ B, SANTOS-ECHEANDIA J, RIVERA- HERNANDEZ J R, et al. Mercury interactions with algal and plastic microparticles: Comparative role as vectors of metals for the mussel, Mytilus galloprovincialis[J]. Journal of Hazardous Materials, 2020, 396: 122739. |
| [92] |
OLIVEIRA P, BARBOZA L G A, BRANCO V, et al. Effects of microplastics and mercury in the freshwater bivalve Corbicula fluminea (Muller, 1774): Filtration rate, biochemical biomarkers and mercury bioconcentration[J]. Ecotoxicology & Environmental Safety, 2018, 164: 155-163. |
| [93] |
PRATA J C, DA COSTA J P, DUARTE A C, et al. Methods for sampling and detection of microplastics in water and sediment: A critical review[J]. TrAC Trends in Analytical Chemistry, 2019, 110: 150-159. DOI:10.1016/j.trac.2018.10.029 |
| [94] |
LI J N, LUSHER A L, ROTCHELL J M, et al. Using mussel as a global bioindicator of coastal microplastic pollution[J]. Environmental Pollution, 2019, 244: 522-533. DOI:10.1016/j.envpol.2018.10.032 |
| [95] |
CAO Y X, ZHAO M J, MA X Y, et al. A critical review on the interactions of microplastics with heavy metals: Mechanism and their combined effect on organisms and humans[J]. Science of The Total Environment, 2021, 788: 147620. DOI:10.1016/j.scitotenv.2021.147620 |
 2022, Vol. 46
2022, Vol. 46


