文章信息
- 高风正, 秦松, 葛保胜. 2022.
- GAO Feng-zheng, QIN Song, GE Bao-sheng. 2022.
- 中国与欧洲微藻产业概况及生物质精准应用
- Microalgal industry and biomass application in China and Europe: a review
- 海洋科学, 46(9): 146-158
- Marine Sciences, 46(9): 146-158.
- http://dx.doi.org/10.11759/hykx20200904002
-
文章历史
- 收稿日期:2020-09-04
- 修回日期:2020-10-15
2. 荷兰瓦赫宁根大学生物工程藻类生产与研究中心, 荷兰 瓦赫宁根 6700AA;
3. 中国科学院烟台海岸带研究所, 山东 烟台 264003
2. Wageningen University, Bioprocess Engineering, AlgaePARC, Wageningen 6700AA, Netherlands;
3. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China
微藻是一类在陆地和海洋分布广泛, 体积微小, 需要借助显微镜才能分辨其形态的藻类群体。微藻可以利用光照、二氧化碳和水进行光合作用, 高效生产蛋白质、多糖、油脂、色素等多种功能活性物质。目前, 螺旋藻(Spirulina)、小球藻(Chlorella)、雨生红球藻(Haematococcus pluvialis)等多个微藻品种已实现了大规模产业化生产。经过几十年的发展, 中国已成为世界上最大的微藻生产国, 微藻生产规模超过美国和欧洲[1-2]。微藻生物质产能的迅速提升与市场需求不足的矛盾促使人们开始思考微藻产业发展的定位和未来方向。随着人们生活水平的提高, 追求营养健康成为首要需求, 中国也提出了“健康中国2030”的发展目标, 这给微藻产业发展提供了良好契机。微藻具有多种生物学功能, 可用于开发功能食品、特医食品等, 从而对接营养健康产业。此外, 微藻具有高蛋白、油脂含量丰富等优点, 也是水产养殖和畜牧养殖产业中重要的饵料和饲料。近年来, 微藻及提取物作为生物肥料、植物刺激素等在农业中的应用也越来越受到重视。如何充分发挥微藻多元化的应用形式, 将生物质产能优势转化为精准应用, 扩大微藻产品应用市场, 是今后微藻产业发展的重点方向。
1 中国与欧洲微藻产业概况中国和欧洲是世界上两大主要的微藻生产区域(表 1)。从产量上看, 中国的微藻年产量超过10 000 t干重, 产值约为20亿美元, 占世界微藻生物质总产量的一半以上, 其中螺旋藻产量约占到世界螺旋藻总产量的七八成[1]。欧洲微藻年产量约为500~2 500 t干重, 为中国的1/20~1/4。从生产区域看, 中国几乎所有的省份都有微藻产业分布, 其中内蒙古、云南、广东、江苏、山东、广西、海南等地是微藻生产大省。欧洲大多数国家拥有微藻产业, 其中葡萄牙、德国、法国、西班牙、意大利、荷兰等国家是主要的微藻生产国。在企业数量上, 中国拥有超过150家微藻企业, 而欧洲拥有约480家, 其中170家欧洲微藻企业的员工数量少于5人。中国微藻企业的生产规模远超欧洲, 中国多家企业的微藻年产量都在1 000 t以上; 而欧洲微藻企业的生产规模都较小, 单家企业最大年产量不足300 t。中国和欧洲微藻产业发展的相似点是, 近年来微藻企业的数量和产量均呈现增长趋势, 同时中国和欧洲均拥有从微藻生产到加工利用的完整产业链。
| 中国 | 欧洲 | |
| 微藻生物质产量(t, 干质量) | >10 000 | 500~2 500 |
| 产值(亿美元) | ~20 | ~7 |
| 企业数量 | >150, 多家年产1 000 t以上大型企业 | ~480, 多为中小企业 |
| 主要生产区域 | 内蒙古、云南、广东、江苏、海南等 | 葡萄牙、德国、法国、西班牙等 |
| 生产方式 | 开放跑道池>发酵罐>封闭光生物反应器 | 封闭光生物反应器>开放跑道池>发酵罐 |
| 允许在食品工业使用的品种 | 螺旋藻、小球藻、雨生红球藻、盐生杜氏藻、裸藻、葛仙米、拟微球藻、莱茵衣藻 | 螺旋藻、小球藻、水华束丝藻、盐生杜氏藻、金色奥杜藻等 |
| 行业协会 | 中国藻业协会微藻分会、中国海洋湖沼学会藻类学分会、青岛微藻产业学会等 | 欧洲藻类生物质协会(EABA)、葡萄牙藻类协会(PROALGA)等 |
微藻的生产系统主要分为封闭式光生物反应器、发酵罐和开放式跑道池等三大类。中国主要采用开放式跑道池进行微藻生产, 实现了螺旋藻、小球藻和盐生杜氏藻(Dunaliella salina)的大规模开放式养殖, 其次是利用发酵罐对小球藻、裸藻(Euglena gracilis)等进行异养发酵, 利用封闭式光生物反应器生产的比例低, 主要应用于雨生红球藻生产。而欧洲微藻企业主要使用封闭光生物反应器进行微藻生产, 比例接近75%, 其次部分企业也采用开放系统进行微藻培养, 使用发酵罐生产微藻的企业占比较低(欧盟委员会生物经济知识中心数据)。跑道池等开放系统的投资和运营成本较低, 但生产效率不高, 品质控制相对封闭式光生物反应器难度较大。中国和欧洲微藻产业生产系统的差异主要与其气候、经济发展等有关。中国幅员辽阔, 适合开放跑道池生产的区域多, 劳动力相对廉价, 开放式跑道池系统满足了低成本、高回报的企业需求, 而欧洲人力资源成本高, 开放跑道池的生产运营成本与光生物反应器相差不多[3]。此外, 欧盟高纬度地区, 如挪威和瑞典等, 气温较低, 无法使用开放跑道池进行户外微藻生产。
微藻是重要的食品或新资源食品资源。目前已有多个微藻品种或提取物被中国或欧洲认可为食品、新资源食品或原料、添加剂等(表 1)。有8个微藻品种被中国政府批准可以在食品工业中直接使用, 分别是螺旋藻(2004年)、盐生杜氏藻(2009年)、雨生红球藻(2010年)、小球藻(2012年)、裸藻(2013年)、葛仙米(Nostoc sphaeroids, 2018年)、拟微球藻(Nannochloropsis gaditana, 2021年)和莱茵衣藻(Chlamydomonas reinhardtii, 2022年)。其中, 螺旋藻已被批准认可为普通食品。除可直接食用的微藻品种外, 微藻来源[裂壶藻(Schizochytrium sp.)、吾肯氏壶藻(Ulkenia amoeboida)、寇氏隐甲藻(Crypthecodinium cohnii)]的DHA(二十二碳六烯酸)藻油也被中国批准为新资源食品(2010年)。欧洲允许在食品工业中直接使用的微藻品种相对较少, 螺旋藻、小球藻和水华束丝藻(Aphanizomenon flos-aquae)已被欧盟批准为新资源食品(novel food), 盐生杜氏藻、金色奥杜藻(Odontella aurita)和雨生红球藻虾青素等被批准可以作为食品添加剂使用。相较欧洲而言, 中国拥有开发微藻功能食品更有利的政策支持和市场需求。
藻类行业协会在微藻产业发展进步中发挥了重要作用。国家级行业协会如中国藻业协会、中国海洋湖沼学会均设有相应的微藻分会。欧洲微藻行业间交流合作主要由欧洲藻类生物质协会组织进行。随着微藻产业的不断发展壮大, 一些地方级协会也相继成立, 例如国内的青岛微藻产业学会及欧洲的葡萄牙藻类协会等。
2 微藻精准应用微藻是食品、饲料、药品、化妆品、生物能源等的重要原料。随着微藻产能的不断提升, 实现生物质的精准应用成为微藻产业的重要发展目标。目前, 绝大部分微藻被用作食品、功能食品、水产饵料或饲料等, 少部分被开发为化妆品、药品等高价值终端产品。
2.1 微藻在健康产业中的应用 2.1.1 微藻与营养健康健康是全人类的共同追求。2016年, 中共中央国务院印发了《“健康中国2030”规划纲要》, 健康产业迎来新的发展契机。2020年, 新型冠状病毒(COVID-19)的全球流行增强了人们对健康的重视。2020年8月, 《人民日报》刊文: 全民健康托起全面小康——习近平总书记关心推动健康中国建设纪实。国家和人民对健康的重视程度日益增加, 健康产业的作用越来越重要。
微藻富含蛋白质、功能性色素、脂肪酸、矿物质等营养元素, 具有多种生物学功能, 包括抗病毒活性。例如, Nagle等[4]分析了紫球藻(Porphyridium sp.)中的多糖用于抗COVID-19的可行性, 并列举了法国利用管道、平板和跑道池培养紫球藻的案例。微藻作为重要的健康资源, 过去几十年, 许多临床功效被证实(表 2)。例如, 螺旋藻具有降血脂、控制血糖、提高免疫力等功效[5-8]; 小球藻可以维持血脂平衡、改善肝功、预防贫血等[9-12]; 雨生红球藻虾青素可以提高人的认知能力, 缓解抑郁和疲劳[13-14]; 盐生杜氏藻β-胡萝卜素具有皮肤保护作用[15]; 裸藻可以显著提高机体抵抗力[16]。除以上可直接食用的微藻外, 一些潜在的微藻及提取物, 如紫球藻硫酸多糖、拟微球藻二十碳五烯酸(EPA)、栅藻(Scenedesmus acutus)等也被证实具有一定的健康功效[17-19]。
| 微藻种类 | 作用形式 | 实验对象 | 效果 | 文献 |
| 螺旋藻 | 片剂 | 25名2型糖尿病患者 | 控制血糖、降低血脂 | [5] |
| 螺旋藻 | 胶囊 | 23名2~13岁肾病综合征儿童 | 降低血脂 | [6] |
| 螺旋藻 | 胶囊 | 51名年龄大于60岁患高胆固醇血症女性 | 降低血脂、改善免疫 | [7] |
| 螺旋藻 | 片剂 | 78名年龄大于60岁的健康受试者 | 控制血脂, 提高免疫力等 | [8] |
| 小球藻 | 片剂 | 17名高危糖尿病或高脂血症受试者 | 调控血糖水平 | [9] |
| 小球藻 | 片剂 | 34名血清胆固醇水平低于5.18 mmol/L的受试者 | 维持血脂水平 | [10] |
| 小球藻 | 片剂 | 70名18~38岁的初产妇 | 降低妊娠相关贫血、蛋白尿等风险 | [11] |
| 小球藻 | 片剂 | 70名20~50岁非酒精性脂肪肝患者 | 改善肝功 | [12] |
| 雨生红球藻 | 虾青素胶囊 | 24名26~63岁健康受试者 | 缓解抑郁和疲劳 | [13] |
| 雨生红球藻 | 虾青素胶囊 | 21名50~79岁有轻度认知障碍的患者 | 改善认知功能 | [14] |
| 盐生杜氏藻 | β-胡萝卜素胶囊 | 20名20~57岁健康受试者 | 防紫外线, 保护皮肤 | [15] |
| 裸藻 | 含微藻餐食 | 13名30~70岁健康不吸烟男性 | 提高免疫力 | [16] |
| 紫球藻 | 硫酸多糖提取物 | 21~55岁有皮肤过敏史的女性 | 抗炎症 | [17] |
| 拟微球藻 | 二十碳五烯酸(EPA)胶囊 | 18~45岁、不吸烟、身体健康的男性 | 提高血浆EPA | [18] |
| 栅藻 | 含微藻餐食 | 40名18~20岁学生 | 12~14 g栅藻不改变尿酸水平 | [19] |
微藻及其活性物质的临床研究主要集中在日韩等国家, 中国和欧洲主要利用动物或细胞模型进行体内或体外功能实验。中国科研人员利用动物或细胞模型对微藻功能做了大量研究(表 3)。例如, 螺旋藻藻蓝蛋白对便秘及肺部纤维化具有显著改善作用[20-26]。小球藻热水提取物具有促进组织修复的功效[27-28]。Zhang等[29]用富含虾青素的雨生红球藻饲喂小鼠, 发现中剂量(1.3 mg/kg体重)虾青素显著提高了小鼠的记忆力。盐生杜氏藻β-胡萝卜素的视力改善作用[30], 葛仙米多糖[31]及裸藻膳食纤维[32]在免疫调节中的作用同样被陆续证实。欧洲的研究人员同样利用动物或细胞实验对微藻及活性物质功能做了相关研究: 螺旋藻藻蓝蛋白对2型糖尿病有改善作用[33]; 裸藻膳食纤维[34]和小球藻多糖[35]具有免疫调节作用; 雨生红球藻虾青素具有强抗氧化活性[36]; 盐生杜氏藻β-胡萝卜素具有防紫外线损伤的功能[37]。
临床及动物或细胞实验均证明, 微藻及其提取物具有改善人类健康的多种功效。这些功效值得进一步验证和推广。值得注意的是, 企业在宣传推介微藻时, 往往罗列多种相关功效, 缺乏具体研究和案例分析, 难以获得消费者的认同和消费热情。因此, 如何进一步明确微藻营养, 并对微藻功能进行精准化, 是获得消费认可及扩宽市场的关键步骤。健康产业是“健康中国2030”发展计划中的重点支持对象, 微藻产业应抓住契机, 加大研究, 明确功能, 积极推广宣传, 主动融入大健康产业。
2.1.2 蛋白质补充与食品添加微藻富含蛋白质, 是重要的蛋白质资源。16世纪起, 螺旋藻就被作为食物被人类食用。西班牙人发现阿兹特克人食用一种蓝绿色薄饼, 其原材料就是螺旋藻[38]。20世纪六七十年代, 小球藻因高蛋白、营养丰富的特点被重视。在1959—1961年, 国家重视发展小球藻养殖, 作为粮食替代资源, 为全民补充蛋白质。生产微藻蛋白相比动物蛋白具有耕地占用面积少的优势, 生产1 kg微藻蛋白所需的耕地面积小于2.5 m2, 而生产等量蛋白质的猪肉、鸡肉、牛肉分别需要47~ 64 m2、42~52 m2和144~258 m2[39]。此外, 根据WHO/FAO等的建议, 微藻蛋白质含有多种人体所必需的氨基酸, 是高品质蛋白资源[40]。据预测, 到21世纪中期, 藻类有望占据18%的蛋白质市场[41]。
目前, 中国对微藻蛋白质的消费相对欧洲较低。欧美人群中的素食主义者比例高, 因此对植物蛋白的需求较大。在绿色消费日益得到重视的今天, 摄食植物蛋白质将成为一种趋势。2020年5月, 欧盟委员会公布的“从农场到餐桌”(Farm to Fork)战略指出, 到2030年欧盟将通过减少50%的农药使用, 减少50%的抗生素使用, 完成25%的有机农业占比等手段, 实现人与自然、粮食系统和生物多样性之间的平衡。植物蛋白替代动物蛋白是该战略中的重要组成部分。2021—2027年, 欧盟将提供至少100亿欧元用于支持蛋白质的绿色替代。微藻蛋白有望在植物蛋白替代动物蛋白中占有一席之地。
微藻不仅可以作为代餐食品被直接食用, 也可用作食品添加剂, 达到增加食品营养价值, 改善产品品质等效果(表 4)。例如, 添加螺旋藻, 可以提高挂面的营养[42]。添加1%的螺旋藻可以提高面包的品质, 达到营养强化的效果[43]。添加0.1%~0.75%的螺旋藻可提高素食中的ω-3多不饱和脂肪酸含量[44]。在饼干中添加1%~3%螺旋藻可以起到增色目的[45]。添加1%~5%的小球藻可以改变面包的流变特性[46]。素食凝胶中添加0.75%的雨生红球藻可达到营养强化和增色等目的[47]。在普通食品中添加微藻成分是提高食品营养价值, 实现微藻广泛利用的一种形式, 但微藻作为食品或食品添加剂使用需严格遵守相关标准规范。中国和欧盟对微藻及相关制品均有严格的管理条例和标准规范(表 5)。目前, 中国螺旋藻、雨生红球藻藻粉的国家标准已经建立并发布实施, 藻蓝蛋白的食品安全国家标准、雨生红球藻虾青素和β-胡萝卜素等微藻提取物的相关检测、添加等标准也相继制定并实施(表 5)。2022年, 鲜食螺旋藻的团体标准由青岛微藻产业学会发布, 为拓展鲜食微藻市场提供了标准依据。在欧盟, 微藻及提取物作为新资源食品及添加剂的审批和使用需按照新资源食品审批管理条例(EU)2015/2283和新资源食品监管条例(EU)2018/102进行审批和监管。虽然中国和欧盟都有针对微藻及其制品的相关标准规范, 但标准体系并不完善, 这在一定程度上制约了微藻及其制品的使用和发展。中国和欧洲关于其他几种藻种的质量标准(小球藻、盐生杜氏藻、裸藻、葛仙米等)、食品安全标准、生产技术规范标准等仍有待建立和完善。建立健全微藻标准体系是科研和企业人员的共同目标, 也是确保产业健康发展的重要保障。目前, 中国各种可食用微藻及其制品的相关国家、地方和企业标准及技术规范都在制定中。
| 微藻品种 | 产品类别 | 中国 | 欧洲 | |
| 螺旋藻 | 藻粉 | 食用螺旋藻粉质量通则GB/T 16919—2022 | 258/97/EC | 新资源食品审批管理条例(EU)2015/2283、新资源食品监管条例(EU)2018/102 |
| 鲜食螺旋藻 | 团体标准鲜食螺旋藻T/QMIS 002—2022 | — | ||
| 藻蓝蛋白 | 进出口检测SN/T 1113—2002 | — | ||
| 食品安全国家标准GB 1886.309—2020 | ||||
| 小球藻 | 藻粉 | — | 258/97/EC | |
| 雨生红球藻 | 藻粉 | GB/T 30893—2014 | (EU) 2017/2470 | |
| 虾青素 | 检测标准GB/T 31520 | |||
| 盐生杜氏藻 | β-胡萝卜素 | 食品添加剂GB 8821—2011、GB 31624—2014 | 231/2012/EC | |
| 葛仙米 | 鲜藻 | 地理标志产品DB42/T 1156—2016 | — | |
| 注: 数据来源于国家质量监督检验检疫总局等官方公告[48-55]及欧盟委员会官方网站 | ||||
微藻富含蛋白质、脂肪酸、色素等, 可提供动物(包括水产养殖动物和家禽家畜)所需要的营养, 是动物饲料或添加剂的重要来源(表 6)。除螺旋藻、小球藻等产业化经济微藻外, 拟微球藻(Nannochloropsis sp.)、三角褐指藻(Phaeodactylum tricornutum)、角毛藻(Chaetoceros calcitrans)、球等鞭金藻(Isochrysis galbana)等微藻品种也是重要的饵料或饲料。据估计, 全球用于饲料或饵料的微藻约占生物质总量的三成[56], 达到3 000 t以上, 且比例将持续升高。
| 类别 | 微藻种类 | 国家 | 应用形式 | 功能 | 文献 |
| 水产养殖 | 拟微球藻 | 中国 | 藻粉 | 促进牙鲆生长, 提高鱼肉品质 | [57] |
| 螺旋藻 | 中国 | 藻粉 | 提高扇贝繁殖能力 | [58] | |
| 雨生红球藻 | 中国 | 藻粉 | 改善七彩神仙鱼体色 | [59] | |
| 雨生红球藻 | 中国 | 藻粉 | 提高红白锦鲤的生长性能, 改善体色, 增强机体的抗氧化能力 | [60] | |
| 卵囊藻 | 中国 | 活细胞 | 提高对虾抗病能力 | [61] | |
| 小球藻、三角褐指藻 | 中国 | 活细胞 | 提高泥蚶体内镉的排除速率 | [62] | |
| 角毛藻、球等鞭金藻等 | 中国 | 活细胞 | 改善缢蛏稚贝肉质风味 | [63] | |
| 角毛藻、螺旋藻 | 中国 | 活细胞 | 提高对虾出苗率, 增加体质量 | [64] | |
| 裸藻 | 丹麦 | β-葡聚糖 | 提高虹鳟鱼免疫力 | [65] | |
| 三角褐指藻 | 挪威 | 藻粉 | 饲喂大西洋鲑鱼, 替代鱼粉 | [66] | |
| 扁藻等 | 荷兰 | 藻粉 | 饲喂大西洋鲑鱼、鲤鱼和白对虾, 提供蛋白质 | [67] | |
| 螺旋藻、小球藻、雨生红球藻 | 葡萄牙 | 藻粉 | 改善观赏鱼体色 | [68] | |
| 巴夫藻、角毛藻、球等鞭金藻等 | 法国 | 活细胞 | 促进牡蛎生长, 提高牡蛎繁殖能力 | [69] | |
| 畜牧业 | 小球藻 | 中国 | 藻粉 | 改善肉鸡健康 | [70] |
| 拟微球藻 | 瑞典 | 藻粉 | 饲喂母鸡, 提高鸡蛋长链脂肪酸含量 | [71] | |
| 雨生红球藻 | 瑞典 | 虾青素 | 提高鸡肉虾青素含量 | [72] | |
| 螺旋藻 | 波兰 | 藻粉 | 饲喂猪, 降低肝脏胆固醇含量 | [73] | |
| 螺旋藻、小球藻 | 芬兰 | 藻粉 | 饲喂奶牛, 替代大豆蛋白 | [74] | |
| 未提及 | 比利时 | 长链脂肪酸DHA | 改善山羊肠道菌群 | [75] |
中国是全球水产养殖第一大国, 据《2019中国渔业统计年鉴》数据, 2018年中国水产养殖总量接近50 000 000 t, 约占水产总量的77%。中国水产饲料年需求量超过20 000 000 t, 微藻在水产养殖中的应用十分重要。例如, Qiao等研究发现拟微球藻可促进牙鲆生长, 提高鱼肉品质[57]。Zhou等利用螺旋藻饲喂扇贝, 可以提高扇贝的繁殖能力[58]。饲喂雨生红球藻藻粉可以改善七彩神仙鱼和红白锦鲤的体色[56-60]。除藻粉外, 微藻活细胞在水产养殖中同样具有广泛应用。例如, 利用卵囊藻(Oocystis borgei)调节对虾养殖水质, 水体溶氧量提高13.0%, 氨氮含量降低51.7%, 对虾养殖的成活率、养成率和产量均得到显著改善[61]。小球藻、三角褐指藻、球等鞭金藻、角毛藻等微藻活细胞可显著改善虾或贝类的成活率和产量[62-64]。2015年, 欧洲水产养殖总量约为3 000 000 t, 占水产总量的17.5%。虽然欧洲水产养殖总量仅为中国的6%, 但微藻在欧洲水产养殖中的应用更广泛, 如虹鳟鱼、对虾等养殖中均使用微藻饵料[65-69]。欧洲有多家企业专门从事微藻水产饵料生产和商业化研发。除作为水产饵料、饲料外, 微藻在水产养殖的水质调节中同样发挥重要作用。建立和维持养殖水体中特定微藻种群的过程称为调水色。利用微藻进行水质调节, 可显著提高养殖水产品的品质和生产效率。微藻调水可显著改善水产动物健康, 产生经济效益。总之, 微藻在水产饵料、饲料及水质调节中有着巨大的市场需求和利润空间。但目前中国水产养殖所用微藻饵料多采用自家简易池塘养殖, 生产效率低, 使用方法欠科学, 效果往往大打折扣。这方面可借鉴欧洲模式, 支持专业化微藻饵料、调水剂公司发展, 开发商业化产品, 以便更好地对接和服务水产养殖需求。
微藻还可提供或补充畜牧业家禽家畜所需要的营养, 提高相关畜牧制品品质(表 6)。研究表明, 将微藻作为饲料或饲料添加剂投喂鸡、牛、猪、山羊等家禽家畜, 可提供丰富的蛋白质和长链脂肪酸, 从而提高肉类品质[70-75]。相对欧洲, 中国对微藻作为饲料提供畜牧业动物营养的研究较少, 而中国对肉制品的需求量较大, 因此利用微藻改善动物营养, 生产高品质肉制品应得到更多关注。目前, 微藻应用于水产养殖和畜牧业养殖在中国面临的主要问题仍是成本偏高。随着生产成本的不断降低, 微藻有望在水产和畜牧养殖领域发挥更多更大的作用。
2.3 微藻在植物种植中的应用微藻在植物种植中的应用同样值得关注。微藻或提取物可作为生物肥料、生物刺激素及种子涂层等应用于植物种植(表 7)。减少化肥、农药使用量是全球农业发展共同努力的方向。过去几十年, 中国农业生产依靠大量的农药和化肥, 造成严重的土壤污染。此外, 过度种植也造成土壤肥力严重下降。因此, 发展生物肥料和有机农药等成为中国农业发展的必经之路和大势所趋。20世纪80年代, 中科院水生所就尝试利用蓝藻提高水稻产量[76]。近年来, 微藻在种植业中的应用得到较大关注。例如, Lv等研究发现鱼腥藻(Anabeana)、栅藻藻液可提高黄瓜根部菌群丰度, 促进黄瓜生长[77]。欧洲的植物种植业发达, 研究人员对微藻及提取物在促进植物种子萌发及生长等方面做了大量研究。结果发现, 微藻及提取物在促进大麦、小麦等种子萌发, 提高西红柿品质, 促进甜菜根和矮牵牛花生长中的作用显著[78-83]。中国微藻应用于种植业尚处于实验阶段, 面临的主要挑战依然是成本偏高。相对欧洲, 中国农产品的价格较低, 现阶段大量使用微藻肥料难以获得较高收益。微藻应用于种植业可从生物激素、种子涂层等较高价值的产品出发, 逐步向大农业拓展。
除作为健康食品、饲料等主要的利用形式外, 微藻还有多种利用途径(图 1)。例如, 微藻具有显著的固碳效率, 可用于进行生物固碳, 缓解碳排放[84]。拟微球藻等微藻品种含有丰富的甘油三酯, 可用于生产生物能源[85]。小球藻、栅藻等微藻具有良好的氮磷清除效率, 可用于污水处理[86]。此外, 微藻所含有的色素、多糖等活性成分可进一步被开发成为化妆品、药品等高价值产品[87]。目前, 微藻在收益相对较低的领域如食品、饲料领域的应用度较高, 但在需要精深加工的领域如化妆品、药品等应用度较低。因此, 进一步明确微藻功能, 提高精深加工程度, 实现精准应用, 是扩大市场需求, 推动微藻产业发展的重要途径。
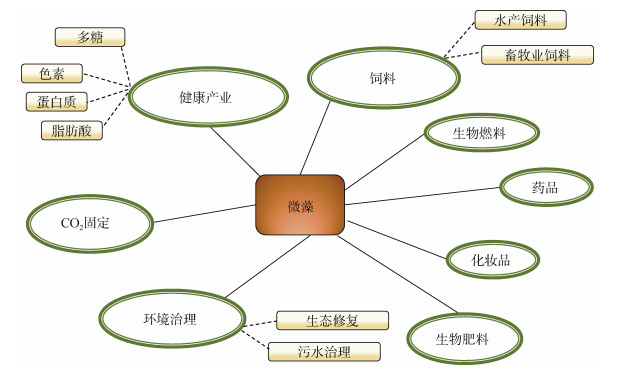 |
| 图 1 微藻经济利用途径 Fig. 1 Possible applications of microalgal biomass |
目前微藻的生产成本仍较高, 即使生产成本最低的螺旋藻, 其价格仍趋近或高于20 000元/t, 约是鱼粉价格的3倍。因此, 进一步降低微藻生产成本, 是拓宽微藻应用范围, 发展形成微藻经济的前提[88]。定向改良藻种、创新培养模式是降低成本的重要途径。例如, 通过改良雨生红球藻藻株, 虾青素的含量和产量均可提高一倍以上[89-91]。通过创新培养方式, 利用异养-稀释-光诱导的复合培养模式, 小球藻的密度高达40~100 g/L[92-93]。这些有助于降低成本的生物技术值得大力发展。
3.2 产学研助推微藻产业转型升级中国和欧洲均拥有较为完整的微藻产业链, 但也存在显著差异。欧洲微藻生产企业除进行生物质生产外, 拥有较强的科研能力, 员工中拥有博士学位的比例较高。例如, 2014年, 欧盟公布的欧盟地平线2020计划, 批准7年共计800亿欧元用于科学研究, 近100项微藻相关研究项目(如MAGNIFICENT、ALGAE4A-B、MIRACLES、SABANA、ProFuture等)获得重点资助(资助金额共约1.8亿欧元)[94], 多家欧洲微藻企业(如Necton、Allmicroalgae等)直接参与其中, 通过产学研合作, 科研成果可直接转化为经济成果。目前, 中国科研院所的研究能力较强, 微藻生物技术研究已达到或接近世界先进水平, 但中国微藻相关企业的研发能力较弱。企业应加强高层次人才引进力度, 增强研发能力, 进一步加强与科研院所的产学研合作, 促进产业科学健康发展。
对微藻进行科学的宣传推广是全球微藻产业面临的共同挑战, 促进微藻消费的前提是人们认识微藻, 认可微藻。高校应针对微藻知识和技术, 设立专门的教育、培训课程, 培养专业化微藻人才, 同时加强微藻科普宣传, 明确微藻功能, 以实现微藻的精准化应用。中国具有全球最大的微藻产业, 拥有生产微藻得天独厚的条件和巨大的消费市场。中国微藻产业通过产学研通力合作, 共同发展, 一定可以实现转型升级, 赢得更广阔的发展空间。
| [1] |
CHEN J, WANG Y, BENEMANN J R, et al. Microalgal industry in China: challenges and prospects[J]. Journal of Applied Phycology, 2016, 28(2): 715-725. DOI:10.1007/s10811-015-0720-4 |
| [2] |
刘建国. 红球藻虾青素资源开发历程与趋势展望[J]. 海洋科学, 2020, 44(8): 130-146. LIU Jianguo. Development history and future prospects of culturing Haematococcus pluvialis for natural astaxanthin[J]. Marine Sciences, 2020, 44(8): 130-146. |
| [3] |
RUIZ J, OLIVIERI G, DE VREE J, et al. Towards industrial products from microalgae[J]. Energy & Environmental Science, 2016, 9(10): 3036-3043. |
| [4] |
NAGLE V, GAIKWAD M, PAWAR Y, et al. Marine red alga Porphyridium sp. as a source of sulfated polysaccharides (SPs) for combating against COVID-19[J]. Preprints, 2020, 2020040168. |
| [5] |
PARIKH P, MANI U, IYER U. Role of Spirulina in the control of glycemia and lipidemia in type 2 diabetes mellitus[J]. Journal of Medicinal Food, 2001, 4(4): 193-199. DOI:10.1089/10966200152744463 |
| [6] |
SAMUELS R, MANI U V, IYER U M, et al. Hypocholesterolemic effect of Spirulina in patients with hyperlipidemic nephrotic syndrome[J]. Journal of Medicinal Food, 2002, 5(2): 91-96. DOI:10.1089/109662002760178177 |
| [7] |
KIM W Y, KIM M H. The change of lipid metabolism and immune function caused by antioxidant material in the hypercholesterolemic elderly women in Korea[J]. Journal of Nutrition and Health, 2005, 38(1): 67-75. |
| [8] |
PARK H J, LEE Y J, RYU H K, et al. A randomized double-blind, placebo-controlled study to establish the effects of Spirulina in elderly Koreans[J]. Annals of Nutrition and Metabolism, 2008, 52(4): 322-328. DOI:10.1159/000151486 |
| [9] |
MIZOGUCHI T, TAKEHARA I, MASUZAWA T, et al. Nutrigenomic studies of effects of Chlorella on subjects with high-risk factors for lifestyle-related disease[J]. Journal of Medicinal Food, 2008, 11(3): 395-404. DOI:10.1089/jmf.2006.0180 |
| [10] |
KIM S, KIM J, LIM Y, et al. A dietary cholesterol challenge study to assess Chlorella supplementation in maintaining healthy lipid levels in adults: a double-blinded, randomized, placebo-controlled study[J]. Nutrition Journal, 2015, 15(1): 54. DOI:10.1186/s12937-016-0174-9 |
| [11] |
NAKANO S, TAKEKOSHI H, NAKANO M. Chlorella pyrenoidosa supplementation reduces the risk of anemia, proteinuria and edema in pregnant women[J]. Plant Foods for Human Nutrition, 2010, 65(1): 25-30. DOI:10.1007/s11130-009-0145-9 |
| [12] |
EBRAHIMI-MAMEGHANI M, SADEGHI Z, FARHANGI M A, et al. Glucose homeostasis, insulin resistance and inflammatory biomarkers in patients with non-alcoholic fatty liver disease: Beneficial effects of supplementation with microalgae Chlorella vulgaris: A double-blind placebo-controlled randomized clinical trial[J]. Clinical Nutrition, 2017, 36(4): 1001-1006. DOI:10.1016/j.clnu.2016.07.004 |
| [13] |
TALBOTT S, HANTLA D, CAPELLI B, et al. Astaxanthin supplementation reduces depression and fatigue in healthy subjects[J]. EC Nutrition, 2019, 14(3): 239-246. |
| [14] |
ITO N, SAITO H, SEKI S, et al. Effects of composite supplement containing astaxanthin and sesamin on cognitive functions in people with mild cognitive impairment: a randomized, double-blind, placebo-controlled trial[J]. Journal of Alzheimer's Disease, 2018, 62(4): 1767-1775. DOI:10.3233/JAD-170969 |
| [15] |
STAHL W, HEINRICH U, JUNGMANN H, et al. Carotenoids and carotenoids plus vitamin E protect against ultraviolet light–induced erythema in humans[J]. The American Journal of Clinical Nutrition, 2000, 71(3): 795-798. DOI:10.1093/ajcn/71.3.795 |
| [16] |
ISHIBASHI K, NISHIOKA M, ONAKA N, et al. Effects of Euglena gracilis EOD-1 ingestion on Salivary IgA reactivity and health-related quality of life in humans[J]. Nutrients, 2019, 11(5): 1144. DOI:10.3390/nu11051144 |
| [17] |
MATSUI M S, MUIZZUDDIN N, ARAD S, et al. Sulfated polysaccharides from red microalgae have antiinflammatory properties in vitro and in vivo[J]. Applied Biochemistry and Biotechnology, 2003, 104(1): 13-22. DOI:10.1385/ABAB:104:1:13 |
| [18] |
KAGAN M L, WEST A L, ZANTE C, et al. Acute appearance of fatty acids in human plasma–a comparative study between polar-lipid rich oil from the microalgae Nannochloropsis oculata and krill oil in healthy young males[J]. Lipids in Health and Disease, 2013, 12(1): 1-10. DOI:10.1186/1476-511X-12-1 |
| [19] |
FELDHEIM W, PAYER H D, SAOVAKONTHA S, et al. The uric acid level in human plasma during a nutrition test with microalgae in Thailand[J]. The Southeast Asian Journal of Tropical Medicine and Public Health, 1973, 4(3): 413-416. |
| [20] |
XIE Y Y, LI W J, LU C Y, et al. The effects of phycocyanin on bleomycin-induced pulmonary fibrosis and the intestinal microbiota in C57BL/6 mice[J]. Applied Microbiology and Biotechnology, 2019, 103(20): 8559-8569. DOI:10.1007/s00253-019-10018-7 |
| [21] |
XIE Y Y, LI W J, ZHU L M, et al. Effects of phycocyanin in modulating the intestinal microbiota of mice[J]. MicrobiologyOpen, 2019, 8(9): e00825. |
| [22] |
LI C C, YU Y, LI W J, et al. Phycocyanin attenuates pulmonary fibrosis via the TLR2-MyD88-NF-κB signaling pathway[J]. Scientific Reports, 2017, 7(1): 1-12. DOI:10.1038/s41598-016-0028-x |
| [23] |
LIU Q, LI W J, LU L N, et al. Phycocyanin attenuates X-ray-induced pulmonary inflammation via the TLR2-MyD88-NF-κB signaling pathway[J]. Journal of Oceanology and Limnology, 2019, 37(5): 1678-1685. DOI:10.1007/s00343-019-8196-8 |
| [24] |
LU L N, LI W J, SUN C, et al. Phycocyanin ameliorates radiation‐induced acute intestinal toxicity by regulating the effect of the gut microbiota on the TLR4/Myd88/NF‐κB pathway[J]. Journal of Parenteral and Enteral Nutrition, 2020, 44(7): 1308-1317. DOI:10.1002/jpen.1744 |
| [25] |
SUN Y X, ZHANG J, YAN Y J, et al. The protective effect of C-phycocyanin on paraquat-induced acute lung injury in rats[J]. Environmental Toxicology and Pharmacology, 2011, 32(2): 168-174. |
| [26] |
MA H T, XIONG H Y, ZHU X L, et al. Polysaccharide from Spirulina platensis ameliorates diphenoxylate-induced constipation symptoms in mice[J]. International Journal of Biological Macromolecules, 2019, 133: 1090-1101. DOI:10.1016/j.ijbiomac.2019.04.209 |
| [27] |
ZHUANG X Y, ZHANG D J, QIN W, et al. A comparison on the preparation of hot water extracts from Chlorella pyrenoidosa (CPEs) and radical scavenging and macrophage activation effects of CPEs[J]. Food & Function, 2014, 5(12): 3252-3260. |
| [28] |
庄秀园, 黄英明, 张道敬, 等. 小球藻高附加值生物活性物质"小球藻热水提取物"的研究现状与展望[J]. 生物工程学报, 2015, 31(1): 24-42. ZHUANG Xiuyuan, HUANG Yingming, ZHANG Daojing, et al. Research status and prospect on hot water extract of Chlorella: the high value-added bioactive substance from Chlorella[J]. Chinese Journal of Biotechnology, 2015, 31(1): 24-42. |
| [29] |
ZHANG X L, PAN L S, WEI X L, et al. Impact of astaxanthin-enriched algal powder of Haematococcus pluvialis on memory improvement in BALB/c mice[J]. Environmental Geochemistry and Health, 2007, 29(6): 483-489. DOI:10.1007/s10653-007-9117-x |
| [30] |
TSAI C F, LU F J, HSU Y W. Protective effects of Dunaliella salina–a carotenoids-rich alga–against ultraviolet B-induced corneal oxidative damage in mice[J]. Molecular Vision, 2012, 18: 1540. |
| [31] |
方倩. 葛仙米对小鼠生长和免疫功能的影响[D]. 新乡: 河南师范大学, 2015. FANG Qian. Study on the effects of Nostoc sphaeroides on the growth and immune function of mouse[D]. Xinxiang: Henan Normal University, 2015. |
| [32] |
GUO Q Q, BI D C, WU M C. et al. Immune activation of murine RAW264.7 macrophages by sonicated and alkalized paramylon from Euglena gracilis[J]. BMC Microbiology, 2020, 20(1): 171. DOI:10.1186/s12866-020-01782-y |
| [33] |
LI Y C, AIELLO G, BOLLATI C, et al. Phycobiliproteins from Arthrospira Platensis (Spirulina): A new source of peptides with dipeptidyl peptidase-Ⅳ inhibitory activity[J]. Nutrients, 2020, 12(3): 794. DOI:10.3390/nu12030794 |
| [34] |
RUSSO R, BARSANTI L, EVANGELISTA V, et al. Euglena gracilis paramylon activates human lymphocytes by upregulating pro-inflammatory factors[J]. Food Science & Nutrition, 2017, 5(2): 205-214. |
| [35] |
GUZMAN S, GATO A, LAMELA M, et al. Anti-inflammatory and immunomodulatory activities of polysaccharide from Chlorella stigmatophora and Phaeodactylum tricornutum[J]. Phytotherapy Research, 2003, 17(6): 665-670. DOI:10.1002/ptr.1227 |
| [36] |
RÉGNIER P, BASTIAS J, RODRIGUEZ-RUIZ V, et al. Astaxanthin from Haematococcus pluvialis prevents oxidative stress on human endothelial cells without toxicity[J]. Marine Drugs, 2015, 13(5): 2857-2874. DOI:10.3390/md13052857 |
| [37] |
RUPEREZ F J, GARCIA-MARTINEZ D, BAENA B, et al. Dunaliella salina extract effect on diabetic rats: metabolic fingerprinting and target metabolite analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009, 49(3): 786-792. DOI:10.1016/j.jpba.2008.12.041 |
| [38] |
ALI S K, SALEH A M. Spirulina-an overview[J]. International Journal of Pharmacy and Pharmaceutical Sciences, 2012, 4(3): 9-15. |
| [39] |
DE VRIES M, DE BOER I J M. Comparing environmental impacts for livestock products: A review of life cycle assessments[J]. Livestock Science, 2010, 128(1/3): 1-11. |
| [40] |
BECKER E W. Micro-algae as a source of protein[J]. Biotechnology Advances, 2007, 25(2): 207-210. DOI:10.1016/j.biotechadv.2006.11.002 |
| [41] |
CAPORGNO M P, MATHYS A. Trends in microalgae incorporation into innovative food products with potential health benefits[J]. Frontiers in Nutrition, 2018, 5: 58. DOI:10.3389/fnut.2018.00058 |
| [42] |
杨生辉. 螺旋藻仙人掌强化营养挂面制作工艺研究[J]. 食品科技, 2009, 34(4): 146-149. YANG Shenghui. Study on the production process for the strengthening nutrition vermicelli of Spirulina and cactus[J]. Food Science and Technology, 2009, 34(4): 146-149. DOI:10.13684/j.cnki.spkj.2009.04.034 |
| [43] |
王宝贝, 邱颖辉, 陈玟璇, 等. 小球藻对青稞面包品质的影响及其抗氧化特性[J]. 食品与发酵工业, 2019, 45(23): 157-162. WANG Baobei, QIU Yinghui, CHEN Wenxuan, et al. Effects of Chlorella on the quality of highland barley bread and its antioxidant properties[J]. Food and Fermentation Industries, 2019, 45(23): 157-162. DOI:10.13995/j.cnki.11-1802/ts.021449 |
| [44] |
BLADES M, GOUVEIA L, BATISTA A P, et al. Spirulina maxima and Diacronema vlkianum microalgae in vegetable gelled desserts[J]. Nutrition & Food Science, 2008, 38: 492-501. |
| [45] |
ONACIK-GÜR S, ŻBIKOWSKA A, MAJEWSKA B. Effect of Spirulina (Spirulina platensis) addition on textural and quality properties of cookies[J]. Italian Journal of Food Science, 2018, 30: 1-12. |
| [46] |
GRAÇA C, FRADINHO P, SOUSA I, et al. Impact of Chlorella vulgaris on the rheology of wheat flour dough and bread texture[J]. LWT-Food Science and Technology, 2018, 89: 466-474. DOI:10.1016/j.lwt.2017.11.024 |
| [47] |
BATISTA A P, NUNES M C, FRADINHO P, et al. Novel foods with microalgal ingredients–Effect of gel setting conditions on the linear viscoelasticity of Spirulina and Haematococcus gels[J]. Journal of Food Engineering, 2012, 110(2): 182-189. DOI:10.1016/j.jfoodeng.2011.05.044 |
| [48] |
中国国家标准化管理委员会. 食用螺旋藻粉质量通则: GB/T 16919—2022[S]. 北京: 中国标准出版社, 2022. Standardization Administration of the People's Republic of China. General quality standard of edible Spirulina powder: GB/T 16919—2022[S]. Beijing: Standards Press of China, 2022. |
| [49] |
中华人民共和国国家质量监督检验检疫总局. 进出口螺旋藻粉中藻蓝蛋白、叶绿素含量的测定方法: SN/T 1113—2002[S]. 北京: 中国标准出版社, 2002. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Determination method of phycocyanin and chlorophyll contents in Spirulina powder: SN/T 1113—2002[S]. Beijing: Standards Press of China, 2002. |
| [50] |
中华人民共和国国家卫生健康委员会. 食品添加剂藻蓝: GB 1886.309—2020[S]. 北京: 中国标准出版社, 2020. National Health Commission of the People's Republic of China. Food additive Phycocyanin: GB 1886.309—2020[S]. Beijing: Standards Press of China, 2020. |
| [51] |
中华人民共和国国家质量监督检验检疫总局. 雨生红球藻粉: GB/T 30893—2014[S]. 北京: 中国标准出版社, 2015. General Administration of Quality Supervision. Inspection and Quarantine of the People's Republic of China. Haematococcus pluvialis powder: GB/T 30893—2014[S]. Beijing: Standards Press of China, 2015. |
| [52] |
中华人民共和国国家质量监督检验检疫总局. 红球藻中虾青素的测定液相色谱法: GB/T 31520—2015[S]. 北京: 中国标准出版社, 2015. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Determination of astaxanthin in Haematococcus pluvialis Liquid Chromatography: GB/T 31520—2015[S]. Beijing: Standards Press of China, 2015. |
| [53] |
中华人民共和国卫生部. 食品安全国家标准食品添加剂β-胡萝卜素: GB 8821—2011[S]. 北京: 中国标准出版社, 2011. Ministry of Health of the People's Republic of China. Food Additive β-carotene: GB 8821—2011[S]. Beijing: Standards Press of China, 2011. |
| [54] |
国家卫生和计划生育委员会. 食品安全国家标准食品添加剂天然胡萝卜素: GB 31624—2014[S]. 北京: 中国标准出版社, 2015. National Health and Family Planning Commission of the People's Republic of China. Food Additive natural carotene: GB 31624—2014[S]. Beijing: Standards Press of China, 2015. |
| [55] |
湖北省质量技术监督局. 地理标志产品鹤峰葛仙米: DB42/T 1156—2016[S]. 武汉: 湖北省质量技术监督局, 2016. Quality and Technical Supervision of Hubei province. Product of geographical indication—Hefeng Gexianmi: DB42/T 1156—2016[S]. Wuhan: Quality and Technical Supervision of Hubei province, 2016. |
| [56] |
LUM K K, KIM J, LEI X G. Dual potential of microalgae as a sustainable biofuel feedstock and animal feed[J]. Journal of Animal Science and Biotechnology, 2013, 4(1): 1-7. DOI:10.1186/2049-1891-4-1 |
| [57] |
QIAO H, WANG H, SONG Z, et al. Effects of dietary fish oil replacement by microalgae raw materials on growth performance, body composition and fatty acid profile of juvenile olive flounder, P aralichthys olivaceus[J]. Aquaculture Nutrition, 2014, 20(6): 646-653. DOI:10.1111/anu.12127 |
| [58] |
ZHOU B C, LIU W C, QU W Y, et al. Application of Spirulina mixed feed in the breeding of bay scallop[J]. Bioresource Technology, 1991, 38(2/3): 229-232. |
| [59] |
王磊, 陈再忠, 冷向军, 等. 饲料中添加雨生红球藻对七彩神仙鱼生长、体色及抗氧化力的影响[J]. 淡水渔业, 2016, 46(6): 92-97. WANG Lei, CHEN Zaizhong, LENG Xiangjun, et al. Effect of Haematococcus pluvialis on growth, body color and antioxidation capacity of discus fish Symphysodon haraldi[J]. Freshwater Fisheries, 2016, 46(6): 92-97. DOI:10.3969/j.issn.1000-6907.2016.06.016 |
| [60] |
赵子续, 张宝龙, 曲木, 等. 饲料中添加雨生红球藻对红白锦鲤生长、体色及抗氧化能力的影响[J]. 生物化工, 2019, 5(1): 119-123, 131. ZHAO Zixu, ZHANG Baolong, QU Mu, et al. Effect of Haematococcus pluvialis on growth, body color and antioxidation capacity of discus fish Cyprinus carpio haematopterus[J]. Biological Chemical Engineering, 2019, 5(1): 119-123, 131. |
| [61] |
黄翔鹄, 李长玲, 刘楚吾, 等. 两种微藻改善虾池环境增强凡纳对虾抗病力的研究[J]. 水生生物学报, 2002, 26(4): 342-347. HUANG Xianghu, LI Changling, LIU Chuwu, et al. Studies on two microalgae improving environment of shrimp pond and strengthening anti-disease ability of Penaeus vannamei[J]. Acta Hydrobiologica Sinica, 2002, 26(4): 342-347. DOI:10.3321/j.issn:1000-3207.2002.04.005 |
| [62] |
许家辉, 陈世雄, 俞兴发, 等. 投喂海水小球藻和三角褐指藻对泥蚶成贝镉排出的影响[J]. 海洋与湖沼, 2018, 49(3): 624-629. XU Jiahui, CHEN Shixiong, YU Xingfa, et al. effects of feeding Chlorella salina and Phaeodactylum tricornutum on cadmium depuration from adult clam Tegillarca granosa[J]. Oceanologia et Limnologia Sinica, 2018, 49(3): 624-629. |
| [63] |
周率, 冉照收, 徐继林, 等. 不同微藻对缢蛏稚贝肉质风味的影响[J]. 食品科学, 2017, 38(6): 173-178. ZHOU Lv, RAN Zhaoshou, XU Jilin, et al. Effects of different dietary micoalgae on flavor compounds of Juvenile Sinonovacula constricia[J]. Food Science, 2017, 38(6): 173-178. |
| [64] |
陈倩伶, 赵永贞, 张瑞杰, 等. 不同微藻饵料对生物絮团育苗系统水质和凡纳滨对虾虾苗生长的影响[J]. 水产科技情报, 2018, 45(2): 108-113. CHEN Qianling, ZHAO Yongzhen, ZHANG Ruijie, et al. Effects of different microalgae bait on water quality of biofloc culture system and young shrimps of Litopenaeus vannamei[J]. Fisheries Science & Technology Information, 2018, 45(2): 108-113. DOI:10.16446/j.cnki.1001-1994.2018.02.011 |
| [65] |
SKOV J, KANIA P W, HOLTEN-ANDERSEN L, et al. Immunomodulatory effects of dietary β-1, 3-glucan from Euglena gracilis in rainbow trout (Oncorhynchus mykiss) immersion vaccinated against Yersinia ruckeri[J]. Fish & Shellfish Immunology, 2012, 33(1): 111-120. |
| [66] |
GONG Y, GUTERRES H A D S, HUNTLEY M, et al. Digestibility of the defatted microalgae N annochloropsis sp. and D esmodesmus sp. when fed to A tlantic salmon, S almo salar[J]. Aquaculture Nutrition, 2018, 24(1): 56-64. DOI:10.1111/anu.12533 |
| [67] |
KIRON V, PHROMKUNTHONG W, HUNTLEY M, et al. Marine microalgae from biorefinery as a potential feed protein source for Atlantic salmon, common carp and whiteleg shrimp[J]. Aquaculture Nutrition, 2012, 18(5): 521-531. DOI:10.1111/j.1365-2095.2011.00923.x |
| [68] |
GOUVEIA L, REMA P, PEREIRA O, et al. Colouring ornamental fish (Cyprinus carpio and Carassius auratus) with microalgal biomass[J]. Aquaculture Nutrition, 2003, 9(2): 123-129. DOI:10.1046/j.1365-2095.2003.00233.x |
| [69] |
MCCAUSLAND M A, BROWN M R, BARRETT S M, et al. Evaluation of live microalgae and microalgal pastes as supplementary food for juvenile Pacific oysters (Crassostrea gigas)[J]. Aquaculture, 1999, 174(3/4): 323-342. |
| [70] |
FAN C M, WU J H, XU L, et al. A mutated rabbit defensin NP-1 produced by Chlorella ellipsoidea can improve the growth performance of broiler chickens[J]. Scientific Reports, 2019, 9(1): 1-9. DOI:10.1038/s41598-018-37186-2 |
| [71] |
FREDRIKSSON S, ELWINGER K, PICKOVA J. Fatty acid and carotenoid composition of egg yolk as an effect of microalgae addition to feed formula for laying hens[J]. Food Chemistry, 2006, 99(3): 530-537. DOI:10.1016/j.foodchem.2005.08.018 |
| [72] |
WALDENSTEDT L, INBORR J, HANSSON I, et al. Effects of astaxanthin-rich algal meal (Haematococcus pluvalis) on growth performance, caecal campylobacter and clostridial counts and tissue astaxanthin concentration of broiler chickens[J]. Animal Feed Science and Technology, 2003, 108(1/4): 119-132. |
| [73] |
SAEID A, CHOJNACKA K, KORCZYŃSKI M, et al. Effect on supplementation of Spirulina maxima enriched with Cu on production performance, metabolical and physiological parameters in fattening pigs[J]. Journal of Applied Phycology, 2003, 25(5): 1607-1617. |
| [74] |
LAMMINEN M, HALMEMIES-BEAUCHET-FILLEAU A, KOKKONEN T, et al. Different microalgae species as a substitutive protein feed for soya bean meal in grass silage based dairy cow diets[J]. Animal Feed Science and Technology, 2019, 247: 112-126. DOI:10.1016/j.anifeedsci.2018.11.005 |
| [75] |
DEWANCKELE L, VLAEMINCK B, HERNANDEZ-SANABRIA E, et al. Rumen biohydrogenation and microbial community changes upon early life supplementation of 22: 6n-3 enriched microalgae to goats[J]. Frontiers in Microbiology, 2018, 9: 573. DOI:10.3389/fmicb.2018.00573 |
| [76] |
LIU Y D, LI S H. Species composition and vertical distribution of blue-green algae in rice field soils, Hubei, China[J]. Nova Hedwigia, 1989, 48(1/2): 55-67. |
| [77] |
LV J P, LIU S F, FENG J, et al. Effects of microalgal biomass as biofertilizer on the growth of cucumber and microbial communities in the cucumber rhizosphere[J]. Turkish Journal of Botany, 2020, 44(2): 167-177. |
| [78] |
RONGA D, BIAZZI E, PARATI K, et al. Microalgal biostimulants and biofertilisers in crop productions[J]. Agronomy, 2019, 9(4): 192. DOI:10.3390/agronomy9040192 |
| [79] |
PAINTER T J. Carbohydrate polymers in desert reclamation: the potential of microalgal biofertilizers[J]. Carbohydrate Polymers, 1993, 20(2): 77-86. DOI:10.1016/0144-8617(93)90081-E |
| [80] |
FERREIRA A, RIBEIRO B, FERREIRA A F, et al. Scenedesmus obliquus microalga-based biorefinery-from brewery effluent to bioactive compounds, biofuels and biofertilizers–aiming at a circular bioeconomy[J]. Biofuels, Bioproducts and Biorefining, 2019, 13(5): 1169-1186. DOI:10.1002/bbb.2032 |
| [81] |
COPPENS J, GRUNERT O, VAN DEN HENDE S, et al. The use of microalgae as a high-value organic slow-release fertilizer results in tomatoes with increased carotenoid and sugar levels[J]. Journal of Applied Phycology, 2016, 28(4): 2367-2377. DOI:10.1007/s10811-015-0775-2 |
| [82] |
BARONE V, BAGLIERI A, STEVANATO P, et al. Root morphological and molecular responses induced by microalgae extracts in sugar beet (Beta vulgaris L.)[J]. Journal of Applied Phycology, 2018, 30(2): 1061-1071. DOI:10.1007/s10811-017-1283-3 |
| [83] |
PLAZA B M, GÓMEZ-SERRANO C, ACIÉN- FERNÁNDEZ F G, et al. Effect of microalgae hydrolysate foliar application (Arthrospira platensis and Scenedesmus sp.) on Petunia x hybrida growth[J]. Journal of Applied Phycology, 2018, 30(4): 2359-2365. DOI:10.1007/s10811-018-1427-0 |
| [84] |
ZHOU W G, WANG J H, CHEN P, et al. Bio-mitigation of carbon dioxide using microalgal systems: advances and perspectives[J]. Renewable and Sustainable Energy Reviews, 2017, 76: 1163-1175. DOI:10.1016/j.rser.2017.03.065 |
| [85] |
WIJFFELS R H, BARBOSA M J. An outlook on microalgal biofuels[J]. Science, 2010, 329(5993): 796-799. DOI:10.1126/science.1189003 |
| [86] |
LI K, LIU Q, FANG F, et al. Microalgae-based wastewater treatment for nutrients recovery: A review[J]. Bioresource Technology, 2019, 291: 121934. DOI:10.1016/j.biortech.2019.121934 |
| [87] |
BHALAMURUGAN G L, VALERIE O, MARK L, et al. Valuable bioproducts obtained from microalgal biomass and their commercial applications: A review[J]. Environmental Engineering Research, 2018, 23(3): 229-241. DOI:10.4491/eer.2017.220 |
| [88] |
高风正, 葛保胜, 向文洲, 等. 生物技术研究引领中国微藻产业发展的六十年: 回顾与展望[J]. 中国科学: 生命科学, 2021, 51(1): 26-39. GAO Fengzheng, GE Baoheng, XIANG Wenzhou, et al. Development of microalgal industries in the past 60 years due to biotechnological research in China: a review[J]. Scientia Sinica Vitae, 2021, 51(1): 26-39. |
| [89] |
SUN Y H, LIU J G, ZHANG X L, et al. Strain H2-419-4 of Haematococcus pluvialis induced by ethyl methanesulphonate and ultraviolet radiation[J]. Chinese Journal of Oceanology and Limnology, 2008, 26(2): 152-156. DOI:10.1007/s00343-008-0152-y |
| [90] |
CHEN Y, LI D F, LU W Q, et al. Screening and characterization of astaxanthin-hyperproducing mutants of Haematococcus pluvialis[J]. Biotechnology Letter, 2003, 25(7): 527-529. DOI:10.1023/A:1022877703008 |
| [91] |
LIU J H, CHEN J, CHEN Z, et al. Isolation and characterization of astaxanthin-hyperproducing mutants of Haematococcus pluvialis (Chlorophyceae) produced by dielectric barrier discharge plasma[J]. Phycologia, 2016, 55(6): 650-658. DOI:10.2216/16-14.1 |
| [92] |
FAN J H, HUANG J K, LI Y G, et al. Sequential heterotrophy-dilution-photoinduction cultivation for efficient microalgal biomass and lipid production[J]. Bioresource Technology, 2012, 112: 206-211. DOI:10.1016/j.biortech.2012.02.046 |
| [93] |
HAN F F, HUANG J K, LI Y G, et al. Enhancement of microalgal biomass and lipid productivities by a model of photoautotrophic culture with heterotrophic cells as seed[J]. Bioresource Technology, 2012, 118: 431-437. DOI:10.1016/j.biortech.2012.05.066 |
| [94] |
MENDES M C, NAVALHO S, FERREIRA A, et al. Algae as food in Europe: an overview of species diversity and their application[J]. Foods, 2022, 11(13): 1871. DOI:10.3390/foods11131871 |
 2022, Vol. 46
2022, Vol. 46


