文章信息
- 石璞, 宋浩, 杨美洁, 胡志, 周骢, 李海州, 张涛. 2023.
- SHI Pu, SONG Hao, YANG Mei-jie, HU Zhi, ZHOU Cong, LI Hai-zhou, ZHANG Tao. 2023.
- 脉红螺Rapana venosa变态过程中自噬与凋亡研究
- Autophagy and apoptosis during metamorphosis in Rapana venosa
- 海洋科学, 47(1): 25-33
- Marine Sciences, 47(1): 25-33.
- http://dx.doi.org/10.11759/hykx20220423003
-
文章历史
- 收稿日期:2022-04-23
- 修回日期:2022-05-09
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
4. 中国科学院海洋牧场工程实验室, 山东 青岛 266071;
5. 中国科学院大学, 北京 100049;
6. 山东省实验海洋生物学重点实验室, 山东 青岛 266071;
7. 山东富瀚海洋科技有限公司, 山东 烟台 265100
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. CAS Engineering Laboratory for Marine Ranching, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
5. University of Chinese Academy of Sciences, Beijing 100049, China;
6. Shandong Province Key Laboratory of Experimental Marine Biology, Qingdao 266071, China;
7. Fuhan Ocean Technology Co., Ltd, Yantai 265100, China
脉红螺Rapana venosa, 隶属于软体动物门(Mo llusca)、腹足纲(Gastropoda)、前鳃亚纲(Prosobranchia)、新腹足目(Neogastropoda)、骨螺科(Muricidae)、红螺属(Rapana), 自然分布于我国的渤海、黄海、东海和日本、俄罗斯沿海等地区, 是我国的重要经济贝类。脉红螺变态涉及巨大的形态改变, 如面盘的退化、次生壳的生成等, 而面盘退化是脉红螺变态完成的重要标志。同时, 在变态阶段中的脉红螺幼虫表现出了高敏感性, 常常会出现大量死亡的现象, 这可能与变态过程受阻有关, 尤其是与面盘的不完全退化有关。以往的研究发现, 在脉红螺幼虫变态过程中自噬与凋亡相关通路显著富集[1]。自噬与凋亡在以往的研究中被认为与器官的退化显著相关, 因此脉红螺的面盘退化可能与自噬与凋亡相关。
自噬在生物形态发生、细胞分化与变态中具有重要的作用。到目前为止, 已经有很多有关生物变态中自噬作用的研究, 如林蛙Rana chensinensis变态时期尾部的退化需要有自噬参与[2], 抑制自噬关键基因ATG7会抑制家蚕变态[3]等。然而, 对于软体动物来说, 变态中自噬相关研究极为稀少, 相关机制尚不明确。
凋亡是一个细胞自发性死亡的生理过程, 主要负责清除生物多余或异常的细胞。凋亡在软体动物变态中已经有了部分研究, 如敲降凋亡关键基因Caspase 3-4基因的表达会使厚壳贻贝Mytilus coruscus幼虫变态率下降[4]; 福建牡蛎Crassostrea angulata变态过程中凋亡关键基因Caspase-2、Caspase-3的表达显著上升[5]; 长牡蛎Crassostrea gigas变态过程中Caspase-1、Caspase-3的表达显著上升[6]等。但凋亡在软体动物中大部分研究还是集中在免疫应答方面, 如椎实螺Lymnaea stagnalis通过激活血细胞凋亡程序和增强活性氧(ROS)的产生来应对除草剂、杀虫剂和药物等环境污染物[7], 血细胞凋亡可以帮助长牡蛎Crassostrea gigas克服寄生虫感染[8]等。但凋亡在腹足纲动物变态中的作用研究仍不明确。
变态是制约脉红螺人工繁育的主要因素, 而这一过程可能与自噬与凋亡显著相关。因此, 本探究了自噬与凋亡在脉红螺幼虫变态中的表达特征以及自噬与凋亡对脉红螺幼虫面盘退化及变态的作用, 以期为脉红螺幼虫变态的诱导物选择提供理论支持。
1 材料与方法 1.1 幼虫培育与样品采集脉红螺亲螺于2021年6月采自山东省威海市自然海域, 并按照Yang等[9]和山东省地方标准“脉红螺苗种繁育技术规范”(标准编号: DB37/T 2773— 2016)[10]的方法于山东省长渔水产有限公司的育苗车间进行亲螺的培育、交配、产卵。亲螺所产的卵放于4 m×4 m×1.2 m的水泥池中孵化, 所孵化的幼虫放于相同规格水泥池中培育, 培育密度为0.05~0.1只/mL, 培育水温21~26 ℃, 培育饵料主要为金藻(Isochrysis galbana)和小球藻(Chlorella vulgaris)。
待显微镜观察到80%以上的脉红螺幼虫发育到四螺层中后期(壳高1 250~1 500 μm)后进行脉红螺幼虫的收集。收集到的脉红螺幼虫放入提前加入曝气24 h干净海水的20 L培养箱中, 每个培养箱放入幼虫100只左右。共设置一个对照组和四个实验组, 分别是自噬诱导组, 自噬抑制组, 凋亡诱导组和凋亡抑制组, 每个组设置10个重复。其中, 自噬诱导组添加卡马西平3.55 mg/L, 自噬抑制组添加氯化铵10.6 mg/L, 凋亡诱导组添加地塞米松13 mg/L, 凋亡抑制组添加Z-VAD-FMK 0.12 mg/L。对培养箱投入过量附有牡蛎稚贝的扇贝壳进行附着变态的诱导, 待附着变态后2 h(M2), 附着变态后4 h(M4)、附着变态后8 h(M8)后, 分别取样, 以四螺层幼虫(L)作为对照。对诱导前后幼虫进行取样时首先对幼虫进行充分麻醉, 以保证面盘充分伸出。麻醉方法为: 将所取的幼虫放入干净海水中, 分批次缓缓加入饱和氯化镁(国化, 上海)溶液, 最终使得幼虫处于20%浓度的氯化镁溶液中。随后取麻痹后的幼虫使用无菌PBS(索莱宝, 北京)冲洗2~3次, 之后置入冻存管中, 部分加入4%多聚甲醛(索莱宝, 北京), 部分加入2.5%戊二醛(索莱宝, 北京), 常温固定12~24 h后置于4 ℃冰箱中保存。用于RNA提取的幼虫样品则对各变态阶段的对照组脉红螺幼虫进行采集, 每个变态阶段样品包括4个生物学重复, 每个样品样品量 > 100 mg, 幼虫使用PBS冲洗1~3次后置于冻存管中, 液氮保存备用。
1.2 组织学观察取4%多聚甲醛固定的各阶段幼虫, 分别使用70%、80%、90%、95%及100%酒精梯度脱水, 后使用50%酒精与50%二甲苯(国化, 上海)混合液, 100%二甲苯Ⅰ, 100%二甲苯Ⅱ进行透明, 随后将组织依次浸入石蜡Ⅰ, 石蜡Ⅱ进行包埋。横切纵切成6 μm切片, 进行HE染色后上镜观察。
1.3 免疫组化标记为检测变态时期各时期自噬与凋亡对脉红螺变态的作用, 本实验使用自噬相关抗体ATG5、LC3(赛维尔, 武汉)与凋亡相关抗体CASP3、CASP8(赛维尔, 武汉)对1.2中所得切片进行免疫组化处理。
1.4 透射电镜观察取2.5%戊二醛(索莱宝, 北京)固定样本, 经过1%锇酸固定(Ted Pella Inc, USA)及丙酮(国化, 上海)与812包埋剂(Sigma-aldrich, USA)处理后使用150目铜网进行捞片, 分别使用2%醋酸铀饱和酒精溶液、2.6%枸橼酸铅溶液(索莱宝, 北京)进行染色。随后进行透射电镜观察。
1.5 免疫荧光标记取1.2中石蜡包埋样本, 将组织去石蜡、复水后使用3% H2O2(国化, 上海)孵育、3% BSA(国化, 上海)封闭, 随后使用兔ATG5多克隆抗体(赛维尔, 武汉)作为一抗, 羊抗兔Ig G(赛维尔, 武汉)作为二抗, 与TUNEL(赛维尔, 武汉)、DAPI(赛维尔, 武汉)分别进行免疫荧光染色, 随后进行封片及镜检。
1.6 RT-PCR分析使用TRIzol试剂盒(Invitrogen, USA)提取各时期样本RNA, 操作方法严格按照试剂盒使用说明, 通过琼脂糖凝胶电泳和Nanodrop1000(Thermo Scientific, USA)检测RNA样品的质量。使用PrimeScript TM RT reagent Kit with gDNA Eraser试剂盒(Takara, Japan)对获得的RNA进行反转录, 具体操作方法参照试剂盒说明书, 获得的cDNA作为后续Real time PCR反应模版。Real time PCR实验根据SYBR® Premix Ex Taq™(Takara, Japan)试剂盒说明书进行, 60S ribosomal subunit基因(RL28)用作内参基因[11], 选择自噬关键基因ATG5、LC3与凋亡关键基因CASP3、CASP7作为目的基因, 其序列根据NCBI入藏号为PRJNA818842的转录组获取。引物设计使用Primer premier 5.0软件, 引物序列见表 1。
| Gene name | Primer sequences |
| ATG5 | F: TTTTGCGTGAGGTATGGGATG |
| R: GGAAAGTAGCTCTGACGTGGC | |
| LC3 | F: AAGGGACGAGATTCCATAC |
| R: AATTCACCGACCAGCATA | |
| CASP3 | F: GCTTGAAGTATCTCGGCAGTA |
| R: CCATTGTGGGTTGGCTCT | |
| CASP7 | F: GGGAAGCCTCGTCTGTTT R: TCCTCAAGTTCTCCAGCATAG |
| RL28 | F: CGTGCGTAACATCACCAAGA R: CACCACAGCTACCACACATT |
对RT-PCR数据使用SPSS v.19.0软件(SPSS Inc., Chicago, IL)进行单因素方差分析(One-way ANOVA), 差异显著性水平为P=0.05。数据表示方式为平均数±标准差(mean±SD)。
2 结果与分析 2.1 脉红螺幼虫变态前后面盘形态变化特征以脉红螺四螺层幼虫(L)、附着变态2 h后(M2)、附着变态4 h后(M4)以及附着变态8 h后(M8)幼虫面盘进行HE染色观察, 结果如图 1所示: 相较于L时期面盘, M2时期面盘形态完好; M4时期纤毛细胞少部分空泡化, 细胞核无明显固缩现象; M8时期纤毛细胞空泡化严重, 细胞核发生了明显的固缩, 面盘中心肌肉细胞也有一定收缩及空泡化。说明在变态开始后8 h, 脉红螺幼虫面盘上已经发生了显著的凋亡现象, 并且面盘纤毛细胞已经开始退化。
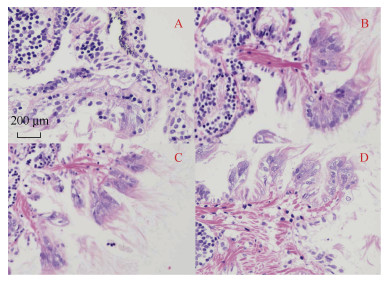 |
| 图 1 脉红螺幼虫变态前后面盘的形态特征变化 Fig. 1 Morphological changes in the velum before and after metamorphosis 注: 使用苏木精-伊红染色, 红色为细胞质, 蓝色为细胞核。A: L时期幼虫面盘; B: M2时期幼虫面盘; C: M4时期幼虫面盘; D: M8时期幼虫面盘 |
对脉红螺L、M2、M4、M8时期幼虫面盘进行透射电镜观察, 结果如图 2所示: L时期面盘上观察不到自噬体、凋亡体等自噬凋亡现象; 在M2时期的面盘上则已经出现了自噬体溶酶体, 线粒体开始肿胀, 部分嵴开始消失, 细胞核异染色质开始边集, 核周隙增宽, 说明此时自噬已经发生, 凋亡有发生的趋势; 在M4时期的面盘上自噬溶酶体大量发生, 线粒体肿胀现象加重, 并且细胞核内的异染色质明显边集, 核开始固缩, 说明在这个阶段的面盘上自噬进一步发生, 同时凋亡也开始发生。在M8时期的面盘上自噬溶酶体已经处于最后降解阶段, 线粒体形态异常, 细胞核固缩, 粗面内质网空泡化严重, 说明整个细胞已经凋亡。
 |
| 图 2 脉红螺变态前后面盘的亚细胞结构变化 Fig. 2 Subcellular structural changes in the velum before and after metamorphosis 注: 红色箭头代表自噬现象, 绿色箭头代表凋亡现象。A: 脉红螺幼虫L时期面盘; B: 脉红螺幼虫M2时期面盘; C: 脉红螺幼虫M4时期面盘; D: 脉红螺幼虫M8时期面盘; ASS: 自噬溶酶体; M: 线粒体; N: 细胞核; RER: 粗面内质网 |
为探究自噬与凋亡关键基因表达的空间特征, 本研究对M4时期面盘自噬关键蛋白Atg5、LC3和凋亡关键蛋白CASP3、CASP8的表达进行了定位(图 3)。结果表明: Atg5、LC3、CASP3和CASP8的阳性信号都分布于面盘的纤毛细胞中。说明自噬与凋亡关键基因在M4时期首先表达于在纤毛细胞中, 这可能由于脉红螺面盘退化过程中纤毛细胞首先退化。为确定自噬与凋亡蛋白表达的时间特征, 本研究对上述4个基因进行了表达水平测定, 结果如图 4所示: 自噬关键基因Atg5在M2时期的表达水平显著高于L时期(P < 0.05)其表达水平在整个变态过程中呈上升趋势; LC3在变态开始后表达水平便显著提高(P < 0.05), 但在M8时期的表达水平有一定下降; 凋亡关键基因CASP3的表达水平在M2、M4时期便显著高于L时期(P < 0.05), 在M8时期的表达水平则有一个极显著的提升(P < 0.05); CASP8的表达水平则只是在M8时期显著升高(P < 0.05)。这说明脉红螺变态中自噬首先发生, 随变态时间的延长凋亡才开始发生。
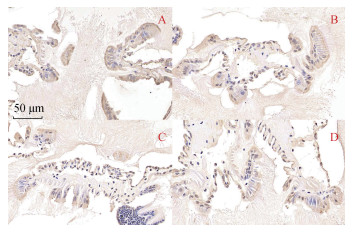 |
| 图 3 脉红螺幼虫面盘的自噬与凋亡相关基因免疫组化定位 Fig. 3 Localization of the autophagic and apoptotic genes in the R. venosa velum by IHC 注: 棕色为阳性信号。A: Atg5抗体免疫组化结果; B: LC3抗体免疫组化结果; C: CASP3抗体免疫组化结果; D: CASP8抗体免疫组化结果 |
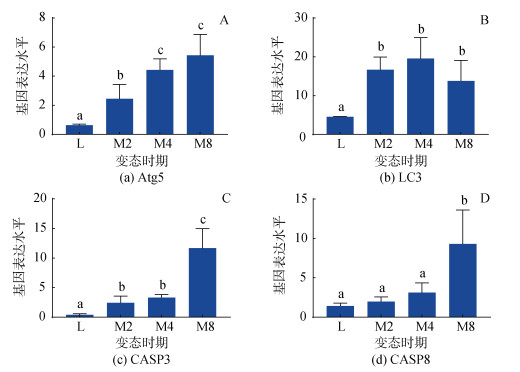 |
| 图 4 自噬与凋亡关键基因在脉红螺幼虫不同发育阶段的表达水平 Fig. 4 Expression levels of the autophagic and apoptotic genes during the metamorphic stages of R. venosa 注: 选用RL28为内参基因, 数值以均值±标准误表示, n=3, 不同字母表示各个阶段之间存在显著性差异, P < 0.05 |
自噬与凋亡诱导与抑制实验结果显示(图 5), 诱导自噬与凋亡显著提高了脉红螺幼虫的变态率; 抑制自噬与凋亡使变态率显著降低。自噬诱导组脉红螺幼虫最终变态率相比对照组提高41.73%, 凋亡诱导组最终变态率提高了79.17%, 而自噬抑制组与凋亡抑制组的最终变态率分别下降了37.14%和65.71%。
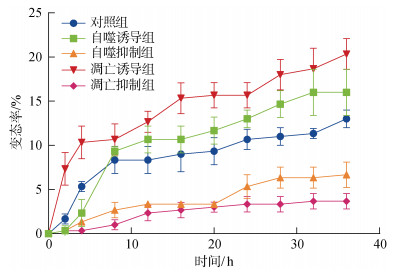 |
| 图 5 自噬与凋亡的诱导与抑制对脉红螺变态率的影响 Fig. 5 Effects of inducing and inhibiting autophagy and apoptosis on R. venosa metamorphosis |
对M4时期幼虫面盘进行Atg5、TUNEL、DAPI荧光染色以示踪自噬与凋亡的变化规律, 结果如图 6所示: 在对照组中, 可见较强的Atg5阳性信号广泛分布于细胞质中, 而TUNEL信号十分微弱, 说明脉红螺变态后4 h面盘已发生较高的自噬水平, 而凋亡尚未发生; 通过卡马西平诱导自噬后, 同样可见较强的Atg5阳性信号, 同时TUNEL信号强度发生显著提高, 说明诱导自噬可同时诱导凋亡的发生; 氯化铵抑制自噬后, Atg5与TUNEL信号强度显著升高, 这是因为氯化铵可以阻止自噬溶酶体的降解, 使得自噬溶酶体在细胞中积累导致自噬信号强度升高, 而积累的自噬溶酶体则诱导了凋亡的发生; 通过地塞米松诱导凋亡后, 可见TUNEL阳性信号明显增多, 同时自噬信号显著降低, 说明诱导凋亡可抑制自噬的发生; 而Z-VAD-FMK抑制凋亡后面盘自噬与凋亡信号与对照组没有明显差异, 说明M4时期凋亡原本便被抑制。综上所述, 在脉红螺变态时期的面盘上, 自噬先于凋亡发生, 并且高水平的自噬可以诱导凋亡的发生, 高度激活的凋亡反而抑制了自噬的发生。
 |
| 图 6 脉红螺幼虫面盘上自噬与凋亡在不同条件下的表达情况 Fig. 6 Expression of autophagy and apoptosis in the R. venosa velum under different conditions |
通过对正常变态的脉红螺幼虫面盘进行形态学观察发现, 脉红螺幼虫面盘随变态时间的延长会逐渐出现空泡化、纤毛脱落、核固缩等迹象; 亚细胞显微结构观察发现, 自噬溶酶体首先发生, 并且发生水平随着变态时间增长而增加, 随后核固缩、内质网空泡化等凋亡事件开始发生, 致使面盘细胞大规模凋亡性死亡; 而免疫组化的结果显示, 自噬与凋亡首先在面盘纤毛中发生。对自噬与凋亡关键基因的表达水平测定发现, 自噬关键基因的表达在变态开始后显著升高, 而凋亡关键基因的表达则在M8时期才有极显著的升高。本研究与以往的研究相匹配, 如家蚕Bombyx mori变态时后丝腺中自噬发生后48~72 h凋亡才被激活, 这是因为家蚕后丝腺的退化需要通过自噬降解糖原储备以产生维持腺细胞正常运作和茧形成所需的能量, 当高水平的自噬充分利用后丝腺后, 则会诱导细胞凋亡使后丝腺细胞发生凋亡性死亡[12]; 对人细胞系的研究发现, 自噬会在轻微的饥饿胁迫下高度表达以应对胁迫, 当饥饿胁迫时间延长, 自噬则会通过分子开关向凋亡进行转化[13]。相关研究表明, 自噬向凋亡的转化的关键分子开关包括Atg5、p53、Bcl-2等基因[14], Atg5蛋白可以被钙蛋白酶切割产生tAtg5-N, 从而激活凋亡诱导因子Bax, 以诱导细胞凋亡[15]。在家蚕细胞系中也有类似的研究, 对家蚕细胞系进行自噬诱导后, 钙蛋白酶会切割BmAtg5和BmAtg6激活凋亡的发生[16], BmAtg5也介导了家蚕幼虫变态时期的器官中自噬向凋亡的转化[17-18]。在本研究中, Atg5在凋亡相关基因高表达的M8时期表达水平相较于M4时期有所提升, 而另一个自噬关键基因LC3的表达水平则有所下降, 这说明在脉红螺变态过程中, Atg5可能是介导自噬向凋亡转化的一个关键分子开关。综上, 脉红螺幼虫变态过程中自噬与凋亡的发生有严格的时序性关系, 变态开始后自噬才会首先发生, 而高水平的自噬会通过关键的分子开关如Atg5诱导凋亡发生。
3.2 自噬与凋亡对脉红螺幼虫变态的作用在自噬与凋亡诱导与抑制实验中, 对自噬与凋亡进行诱导都可以最终提高脉红螺幼虫变态率, 而对自噬与凋亡进行抑制则使最终变态率降低。其中凋亡诱导组所有时间节点的变态率都高于对照组, 这可能是因为凋亡介导了脉红螺幼虫面盘的退化, 凋亡已被证实是生物变态时器官退化的执行者[16, 19], 如Cacaspase-2和Cacaspase-3基因在福建牡蛎C. angulata[5]幼虫面盘的退化中起着关键作用; 织纹螺Ilyanassa obsoleta顶端神经节(apical ganglion)在变态中通过细胞凋亡进行退化, 从而完成整体变态[20]; 凋亡可能是文蛤Meretrix meretrix幼虫面盘退化的主要机制[21]等。然而自噬诱导组M4时期的变态率显著低于对照组, 这可能是由于自噬与凋亡在轻微胁迫下呈拮抗关系[22], 只有在长时间的胁迫下, 高水平的自噬才会向凋亡进行转化。而在脉红螺变态开始阶段, 自噬的诱导会抑制凋亡的发生导致脉红螺变态率降低, 这也与抑制凋亡组中Atg5、TUNEL信号强度与对照组没有显著差异的结果相匹配。以往的研究发现自噬在生物体中则多作为保护或能量供给手段, 如在鳞翅目幼虫变态过程中, 自噬会于幼虫脂肪体中显著激活以应对变态的能量需求[23]。敲除Atg3[24]、Atg5[25]和Atg7[26]的小鼠会在出生后立即死亡, 其体内组织和血浆中的氨基酸水平显著降低; 因没有外界能量供给, 哺乳动物受精卵在着床阶段会提高自噬表达水平以维持胚胎正常生命活动[27]等。包括脉红螺在内的大部分软体动物在变态开始阶段所需的能量依赖内源性能量供给[28-29], 因此在脉红螺变态中, 自噬可能作为一种能量供给手段对即将退化的面盘进行利用, 从而为脉红螺变态提供能量。所以自噬在变态初期会抑制凋亡的表达从而防止面盘过早退化以对面盘进行充分的利用。自噬抑制实验也证明了我们的结果, 虽然高水平的自噬诱导了凋亡, 但氯化铵的添加使得自噬功能丧失, 不再利用面盘提供能量, 从而导致了脉红螺变态率下降。而自噬诱导组的免疫荧光结果中观察到了凋亡的发生则说明, 当自噬大量发生并对面盘进行充分利用后则会诱导凋亡产生以促使面盘退化完成变态, 这也可能是M8时期自噬诱导组变态率高于对照组的原因。综上所述, 在脉红螺面盘退化这一过程中, 自噬作为一个能量供给通路首先对面盘细胞进行充分利用来给脉红螺幼虫变态供给能量, 待自噬充分利用面盘细胞过后, 自噬则会诱导凋亡产生, 最终凋亡作为执行者使面盘细胞死亡。自噬与凋亡二者协同作用使脉红螺幼虫面盘退化, 完成变态(图 7)。
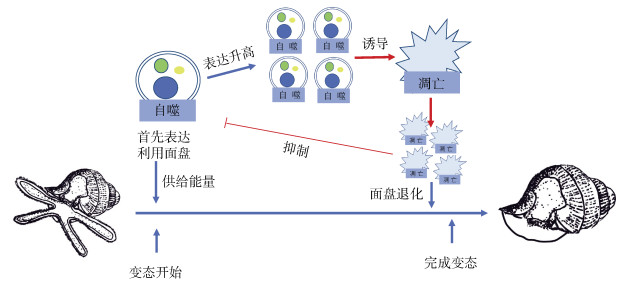 |
| 图 7 脉红螺幼虫变态中自噬与凋亡过程示意图 Fig. 7 Model of autophagy and apoptosis during R. venosa metamorphosis. |
脉红螺幼虫变态时期面盘中自噬与凋亡的发生是一个严格的时序性过程。自噬首先发生, 以对脉红螺幼虫面盘进行充分利用以供给脉红螺幼虫变态所需能量, 随后高水平的自噬会诱导凋亡发生, 凋亡则会使面盘细胞发生凋亡性死亡, 最终使面盘退化。
| [1] |
SONG H, YU Z L, SUN L N, et al. Transcriptomic analysis of differentially expressed genes during larval development of Rapana venosa by digital gene expression profiling[J]. G3 Genes| Genomes| Genetics, 2016, 6(7): 2181-2193. |
| [2] |
WANG H M, LIU Y T, CHAI L H, et al. Morphology and molecular mechanisms of tail resorption during metamorphosis in Rana chensinensis tadpole (Anura: Ranidae)[J]. Comparative Biochemistry and Physiology Part D Genomics Proteomics, 2022, 41: 100945. DOI:10.1016/j.cbd.2021.100945 |
| [3] |
YE W T, BIAN D D, MAO T T, et al. Cloning and functional analysis of autophagy-related gene 7 in Bombyx mori, silkworm[J]. Archives of Insect Biochemistry and Physiology, 2021, 107(4): e21827. |
| [4] |
刘志显, 李嘉政, 梁邻利, 等. 厚壳贻贝(Mytilus coruscus) McCaspase 3-4基因的克隆及其在幼虫变态中的作用[J]. 水生生物学报, 2022, 46(8): 1168-1176. LIU Zhixian, LI Jiazheng, LIANG Linli, et al. Molecular cloning of McCaspase 3-4 and its functions in Mytilus coruscus larval metamorphosis[J]. Acta Hydrobiologica Sinica, 2022, 46(8): 1168-1176. |
| [5] |
YANG B Y, LI L L, PU F, et al. Molecular cloning of two molluscan caspases and gene functional analysis during Crassostrea angulata (Fujian oyster) larval metamorphosis[J]. Molecular Biology Reports, 2015, 42(5): 963-975. DOI:10.1007/s11033-014-3833-y |
| [6] |
QU T, HUANG B Y, ZHANG L L, et al. Identification and functional characterization of two executioner caspases in Crassostrea gigas[J]. PLoS ONE, 2014, 9(2): e89040. DOI:10.1371/journal.pone.0089040 |
| [7] |
RUSSO J, MADEC L. Haemocyte apoptosis as a general cellular immune response of the snail, Lymnaea stagnalis, to a toxicant[J]. Cell and Tissue Research, 2007, 328(2): 431-441. DOI:10.1007/s00441-006-0353-7 |
| [8] |
GOEDKEN M, MORSEY B, SUNILA I, et al. The effects of temperature and salinity on apoptosis of Crassostrea virginica hemocytes and Perkinsus marinus[J]. Journal of Shellfish Research, 2005, 24(1): 177-183. DOI:10.2983/0730-8000(2005)24[177:TEOTAS]2.0.CO;2 |
| [9] |
YANG D Z, ZHOU Y B, GUAN Z C, et al. Technique for industrial breeding in Rapana venosa valenciennes[J]. Fisheries Science, 2007, 26(4): 237-239. DOI:10.3969/j.issn.1003-1111.2007.04.013 |
| [10] |
山东省质量技术监督局. 脉红螺苗种繁育技术规范DB37/T 2773—2016 [S]. 烟台: 山东省质量技术监督局, 2016. Shandong Provincial Bureau of Quality and Technical Supervision. Technical Specification for Seed Breeding of Ranapa venosa. NO. DB37/T 2773—2016[S]. Yantai: Shandong Provincial Bureau of Quality and Technical Supervision, 2016. |
| [11] |
SONG H, DANG X, HE Y Q, et al. Selection of house keeping genes as internal controls for quantitative RT-PCR analysis of the veined rapa whelk (Rapana venosa)[J]. PeerJ, 2017, 5: e3398. DOI:10.7717/peerj.3398 |
| [12] |
MONTALI A, ROMANELLI D, CAPPELLOZZA S, et al. Timing of autophagy and apoptosis during posterior silk gland degeneration in Bombyx mori[J]. Arthropod Structure & Development, 2017, 46(4): 518-528. |
| [13] |
WEI Y J, SINHA S, LEVINE B. Dual role of JNK1-mediated phosphorylation of Bcl-2 in autophagy and apoptosis regulation[J]. Autophagy, 2008, 4(7): 949-951. DOI:10.4161/auto.6788 |
| [14] |
MARIÑO G, NISO-SANTANO M, BAEHRECKE E H, et al. Self-consumption: the interplay of autophagy and apoptosis[J]. Nature Reviews Molecular Cell Biology, 2014, 15(2): 81-94. DOI:10.1038/nrm3735 |
| [15] |
YOUSEFI S, PEROZZO R, SCHMID I, et al. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J]. Nature Cell Biology, 2006, 8(10): 1124-1132. DOI:10.1038/ncb1482 |
| [16] |
TIAN L, LIU S M, LIU H H, et al. 20-hydroxyecdysone upregulates apoptotic genes and induces apoptosis in the bombyx fat body[J]. Archives of Insect Biochemistry and Physiology, 2012, 79(4/5): 207-219. |
| [17] |
YI H Y, YANG W Y, WU W M, et al. BmCalpains are involved in autophagy and apoptosis during metamorphosis and after starvation in Bombyx mori[J]. Insect Science, 2018, 25(3): 379-388. DOI:10.1111/1744-7917.12417 |
| [18] |
XIE K, TIAN L, GUO X Y, et al. BmATG5 and BmAT-G6 mediate apoptosis following autophagy induced by 20-hydroxyecdysone or starvation[J]. Autophagy, 2016, 12(2): 381-396. DOI:10.1080/15548627.2015.1134079 |
| [19] |
KANEKO Y, YASANGA T, SUZUKI M, et al. Larval fat body cells die during the early pupal stage in the frame of metamorphosis remodelation in Bombyx mori[J]. Journal of Insect Physiology, 2011, 57(12): 1715-1722. DOI:10.1016/j.jinsphys.2011.09.013 |
| [20] |
GIFONDORWA D J, LEISE E M. Programmed cell death in the apical ganglion during larval metamorphosis of the marine mollusc Ilyanassa obsoleta[J]. The Biological Bulletin, 2006, 210(2): 109-20. DOI:10.2307/4134600 |
| [21] |
王晓梅, 刘保忠, 相建海. 文蛤(Meretrix meretrix)幼虫发育过程中细胞凋亡和Caspase功能分析[J]. 海洋与湖沼, 2009, 40(2): 181-186. WANG Xiaomei, LIU Baozhong, XIANG Jianhai. Apoptosis and role of caspase in development of Meretrix meretrix larvae[J]. Oceanologia et Limnologia Sinica, 2009, 40(2): 181-186. |
| [22] |
TETTAMANTI G, CASARTELLI M. Cell death during complete metamorphosis[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2019, 374: 20190065. DOI:10.1098/rstb.2019.0065 |
| [23] |
TIAN L, MA L, GUO E E, et al. 20-hydroxyecdysone upregulates Atg genes to induce autophagy in the Bombyx fat body[J]. Autophagy, 2013, 9(8): 1172-1187. DOI:10.4161/auto.24731 |
| [24] |
SOU Y S, WAGURI S, IWATA J, et al. The Atg8 conjugation system is indispensable for proper development of autophagic isolation membranes in mice[J]. Molecular Biology of the Cell, 2008, 19(11): 4762-4775. DOI:10.1091/mbc.e08-03-0309 |
| [25] |
KUMA A, HATANO M, MATSUI M, et al. The role of autophagy during the early neonatal starvation period[J]. Nature, 2004, 432(7020): 1032-1036. DOI:10.1038/nature03029 |
| [26] |
KOMATSU M, WAGURI S, UENO T, et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice[J]. Journal of Cell Biology, 2005, 169(3): 425-434. DOI:10.1083/jcb.200412022 |
| [27] |
TSUKAMOTO S, KUMA A, MURAKAMI M, et al. Autophagy is essential for preimplantation development of mouse embryos[J]. Science, 2008, 321(5885): 117-120. DOI:10.1126/science.1154822 |
| [28] |
ZHAO J, SHI B, JIANG Q R, et al. Changes in gutassociated flora and bacterial digestive enzymes during the development stages of abalone (Haliotis diversicolor)[J]. Aquaculture, 2012, 338-341: 147-153. DOI:10.1016/j.aquaculture.2012.01.016 |
| [29] |
OYARZUN F X, STRATHMANN R R. Plasticity of hatching and the duration of planktonic development in marine invertebrates[J]. Integrative and Comparative Biology, 2011, 51(1): 81-90. DOI:10.1093/icb/icr009 |
 2023, Vol. 47
2023, Vol. 47


