文章信息
- 吕湘琳, 齐红莉. 2023.
- LV Xiang-lin, QI Hong-li. 2023.
- 不同盐度、饵料和光照条件培养下拟伍氏游仆虫的种群动力学响应
- Effects of salinity, food, and light conditions on the population dynamics of Euplotes parawoodruffi
- 海洋科学, 47(1): 66-72
- Marine Sciences, 47(1): 66-72.
- http://dx.doi.org/10.11759/hykx20220514002
-
文章历史
- 收稿日期:2022-05-14
- 修回日期:2022-06-29
原生动物纤毛虫是构成水生生态系统中微型生物食物环的重要组成部分, 它们以藻类、细菌等为食, 同时又被桡足类等大型浮游生物摄食, 有助于将物质和能量转移到更高的营养水平, 在水生生态系统的物质循环和能量流动中发挥了重要作用[1-2]。原生动物由于生长周期短, 对环境变化的敏感等优点, 使其对环境压力的反应较快, 因此被用作水生生态系统水质的有利生物指标[3-4]。近年来, 海洋盐度变化成为世界范围内面对的环境问题[5], 这是由于全球气候变暖导致海平面上升的结果[6], 此外气候灾害同样会导致沿海生态系统的盐度快速变化, 对沿海海洋生态系统造成破坏[7]。大量学者探究了原生动物群落结构与环境因子的相关性发现, 盐度、溶解氧、水温等均为影响原生动物群落组成、时空分布和种群丰度的主要环境因子[8-10]。
拟伍氏游仆虫(Euplotes parawoodruffi)隶属于纤毛门(Ciliophora), 游仆目(Hypotrichia), 由于具有独特的T形大核或Y形大核易于识别, 并且其分布广泛[11-13], 被应用于原生动物学的研究中[14]。该种由Song等[15]首次报道, Dai等[16]发现拟伍氏游仆虫在淡水与海水中均可存活繁殖, 而拟伍氏游仆虫的广盐性特性使得其有监测海洋盐度变化的潜力, 但目前对拟伍氏游仆虫基础生态学的研究较少。本实验以拟伍氏游仆虫为研究对象, 探究了不同盐度、饵料和光照条件培养下拟伍氏游仆虫的种群动力学变化, 为采用原生动物监测海水盐度变化提供相关的基础生态学数据。
1 实验材料与方法 1.1 拟伍氏游仆虫的培养实验所用拟伍氏游仆虫于2019年4月在天津滩涂贝类保护区采集, 在27±1℃下使用孔径0.22 μm的纤维滤膜抽滤的灭菌人工海水进行纯培养, pH 8±0.1。分别以商业干酵母(Saccharomyces cerevisiae, 安琪酵母股份有限公司)和杜氏盐藻(Dunaliella slina, 中盐制盐研究院)投喂, 拟伍氏游仆虫的种群处于指数生长期时开展实验。
1.2 实验方法 1.2.1 不同饵料条件下盐度胁迫对拟伍氏游仆虫种群生长的研究实验在玻璃锥形瓶中进行, 加入50 mL培养液后, 挑取拟伍氏游仆虫于玻璃锥形瓶中, 接种密度为4 ind./mL, 光照强度为2 000 lx、光照周期为L∶D = 14∶10(即白昼与黑夜分别为14 h和10 h)。每天8时, 分别投喂商业干酵母(0.014 mg/mL)和杜氏盐藻(4×106个/mL)。实验共设置5个盐度处理组, 盐度分别为5、10、15、20、25, 每个盐度处理组均设置3个平行。实验持续12 d, 每隔24 h测定一次拟伍氏游仆虫的种群密度, 使用终浓度为2%的戊二醛固定液对细胞进行固定后用1 mL的浮游动物计数框进行计数, 每次计数重复2次, 误差不超过15%[17-18]。
1.2.2 不同饵料条件下光照条件对拟伍氏游仆虫种群生长的研究根据盐度胁迫实验结果在最适生长盐度下, 以酵母菌和杜氏盐藻分别投喂, 实验方法与饵料和盐度胁迫对拟伍氏游仆虫种群生长实验的条件相同, 光照条件分别设置为∶光照(14 L∶10 D)和全黑暗。
1.3 数据处理与分析使用Origin 2018做图, 使用SPSS12.0进行单因素方差分析以及独立样本T检验。拟伍氏游仆虫在不同条件下的种群生长模型使用Logistic模型(式1)建立, 并在Origin 2018中实现, 参数由式(1)确定, 世代时间和种群内禀增长率的关系由式(2)确定:
| $ {N_t} = \frac{k}{{1 + b{e^{ - rt}}}}, $ | (1) |
| $ G = \frac{{\ln 2}}{r}, $ | (2) |
式中Nt (ind./mL)为特定时间的种群数量, K (ind./mL)为环境容纳量, t(d)为培养时间, r (d–1)为种群内禀增长率, b为参数, 以上值均由logistic曲线拟合得到, G (d)为世代时间, 由内禀增长率r计算得到。
2 结果 2.1 不同饵料条件下盐度胁迫对拟伍氏游仆虫种群生长的影响杜氏盐藻喂养组在不同盐度下, 拟伍氏游仆虫的种群生长曲线均符合Logistic生长曲线, 即各盐度处理组中的拟伍氏游仆虫的种群生长均存在停滞期、指数生长期和稳定期(图 1a)。盐度变化明显影响了拟伍氏游仆虫的种群生长, 随着盐度变化拟伍氏游仆虫的环境容纳量呈先上升后下降的趋势, 在15盐度处理组达到峰值103.264 ind./mL, 显著高于其他盐度处理组(P < 0.05, 图 1b)。种群内禀增长率呈先上升后下降的趋势, 世代时间呈先下降后上升的趋势, 20盐度处理组拟伍氏游仆虫的内禀增长率达到峰值(0.590±0.008)d–1, 世代时间达到最低值(1.176± 0.016) d(P < 0.05, 表 1)。随着盐度增高, 25盐度处理组中拟伍氏游仆虫的环境容纳量和种群内禀增长率显著低于其他盐度处理组(P < 0.05)。
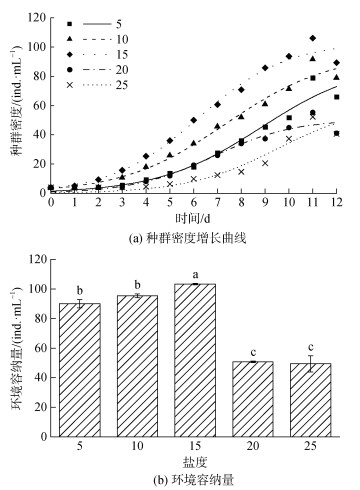 |
| 图 1 不同盐度下拟伍氏游仆虫摄食杜氏盐藻的种群密度增长曲线和环境容纳量。 Fig. 1 Regression curves of the population density growth and carrying capacity in E. parawoodruffi fed with D. salina at different salinity gradients. 注: 标有不同小写字母者表示差异显著(P < 0.05), 标有相同小写字母表示无显著性差异(P > 0.05) |
| 盐度 | 内禀生长率r/(d–1) | 世代时间G/(d) |
| 5 | 0.462±0.021c | 1.503±0.069b |
| 10 | 0.459±0.007c | 1.512±0.024b |
| 15 | 0.538±0.003b | 1.287±0.008c |
| 20 | 0.590±0.008a | 1.176±0.016c |
| 25 | 0.376±0.027d | 1.851±0.130a |
| 注: 同列数据不同小写字母表示差异显著(P < 0.05), 相同小写字母表示差异不显著(P > 0.05) | ||
酵母喂养组在不同盐度下, 酵母喂养的拟伍氏游仆虫的种群生长曲线也符合logistic生长曲线(图 2a)。相较于杜氏盐藻处理组, 酵母组的拟伍氏游仆虫的停滞期较长, 环境容纳量较高。酵母组拟伍氏游仆虫的环境容纳量随盐度变化也呈先上升后下降的趋势, 峰值156.797 ind./mL出现在15盐度处理组, 最低值53.389 ind./mL出现在25盐度处理组(图 2b)。内禀增长率随着盐度变化呈现先下降后上升的趋势, 峰值出现在25盐度处理组(0.691± 0.025)d–1, 世代时间达到最低值(1.005±0.035)d, 最低值出现在15盐度组(0.407±0.006)d–1, 世代时间达到峰值(1.704±0.026) d (P < 0.05, 表 2)。
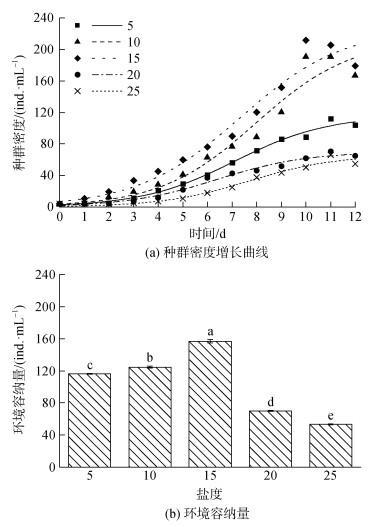 |
| 图 2 不同盐度下拟伍氏游仆虫摄食酵母的种群密度增长曲线和环境容纳量。 Fig. 2 Regression curves of the population density growth and carrying capacity in E. parawoodruffi fed with S. cerevisiae at different salinity gradients. 注: 标有不同小写字母者表示差异显著(P < 0.05), 标有相同小写字母表示无显著性差异(P > 0.05) |
| 盐度 | 内禀生长率r/(d–1) | 世代时间G/(d) |
| 5 | 0.529±0.007b | 1.310±0.018b |
| 10 | 0.545±0.009b | 1.273±0.021b |
| 15 | 0.407±0.006c | 1.704±0.026a |
| 20 | 0.552±0.013b | 1.256±0.029b |
| 25 | 0.691±0.025a | 1.005±0.035c |
| 注: 同列数据不同小写字母表示差异显著(P < 0.05), 相同小写字母表示差异不显著(P > 0.05) | ||
光照和全黑暗条件下两种饵料喂养的拟伍氏游仆虫的种群生长曲线均符合Logistic种群生长曲线(图 3a)。酵母喂养下拟伍氏游仆虫的环境容纳量高于杜氏盐藻喂养组, 光照条件下则显著高于全黑暗处理组(P < 0.05, 图 3b), 光照条件下杜氏盐藻喂养组环境容纳量升高了36.456%, 酵母喂养组环境容纳量升高了38.175%。然而酵母组拟伍氏游仆虫的种群内禀增长率低于杜氏盐藻组, 全黑暗条件下则高于光照处理组, 全黑暗条件下杜氏盐藻喂养组种群内禀增长率升高了22.185%, 酵母喂养组种群内禀增长率升高了24.535%(表 3)。
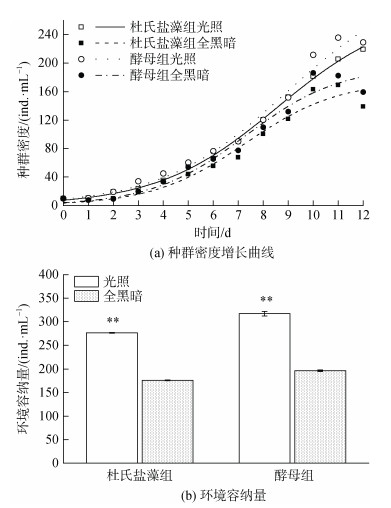 |
| 图 3 不同光照条件和食物下拟伍氏游仆虫的种群密度增长曲线和环境容纳量。 Fig. 3 Regression curves of the population density growth and carrying capacity in E. parawoodruffi exposed to different light and food conditions. 注: 图中标注**表示其间存在极显著性差异(P < 0.01) |
| 盐度 | 杜氏盐藻组 | 酵母组 | |||
| r/(d–1) | G/(d) | r/(d–1) | G/(d) | ||
| 光照 | 0.417 ± 0.001b | 1.663 ± 0.003a | 0.399 ± 0.006b | 1.739 ± 0.026a | |
| 全黑暗 | 0.536 ± 0.011a | 1.295 ± 0.028b | 0.528 ± 0.001a | 1.312 ± 0.003b | |
| 注: 同列数据不同小写字母表示差异显著(P < 0.05), 相同小写字母表示差异不显著(P > 0.05) | |||||
盐度作为水环境中一种重要的非生物因子, 对水生生物的生长发育具有重要作用[19-20]。一方面溶解水生生物的营养物质, 如亚硝酸盐等, 另一方面, 在稳定环境下生物体内都保持着一定的渗透压, 而盐度变化时生物体需要调节本身的离子浓度和渗透压水平以维持渗透压平衡[21]。本实验中, 拟伍氏游仆虫在广泛的盐度范围内均可生存(5~25), 在2种食物喂养下拟伍氏游仆虫的环境容纳量随盐度变化的趋势相似, 在15盐度处理组达到峰值, 在盐度升高和降低时, 拟伍氏游仆虫的环境容纳量均有所下降, 较高盐度下(20~25)拟伍氏游仆虫的生长状态最差。Dai等[16]发现拟伍氏游仆虫在5、10、15盐度培养下可达到较高密度, 在20盐度下可存活, 但生长状态差, 这与本实验结果相似, 高于15盐度下拟伍氏游仆虫生长状态变差, 推测是由于拟伍氏游仆虫属微咸水种, 在20~25盐度下拟伍氏游仆虫为了适应高渗条件会产生高能量消耗有关[22]。Annunciação等[23]发现, 游仆虫(Euplotes sp.)随着盐度变化最大种群密度也呈现先上升后下降的趋势, 在盐度为25达到峰值, 这与本研究中纤毛虫种群生长的变化趋势基本一致, 然而本实验中拟伍氏游仆虫达到峰值的盐度与游仆虫达到峰值的盐度有所不同, 推测是由于物种生活环境不同导致的。并且本实验中随着盐度变化, 2种食物喂养下拟伍氏游仆虫的种群内禀增长率的变化趋势不同, 酵母喂养下拟伍氏游仆虫倾向于通过提高种群内禀增长率的策略来应对高渗条件。
饵料是影响纤毛虫生长的主要因素, 目前对于原生动物纤毛虫的次级生产力的估算也多基于饵料浓度及饵料颗粒大小这两个因素, 但对饵料的品质、适口性等因素影响的关注较少, 纤毛虫对不同饵料的摄食强度不同这意味着饵料对纤毛虫的繁殖发育能产生不同的效应, 有学者发现投喂不同藻类的叶状口突虫(Condylostma spatiosum)的种群生长率差异显著[24], 以球等鞭金藻(Isochrysis galbana)和天然细菌投喂海洋纤毛虫口帆虫(Pleuronema sp.)和盐蚕豆虫(Fabrea salina)时, 会造成纤毛虫体内脂质组成不同[25]。以上研究结果说明, 纤毛虫不仅能够摄取细菌, 还能摄取其他类型的食物, 而且食物营养及适口性等因素会对纤毛虫造成影响。本实验发现, 拟伍氏游仆虫为杂食性生物, 可同时以藻类和菌类为食, 其中酵母喂养的拟伍氏游仆虫的环境容纳量较高, 而杜氏盐藻组喂养的拟伍氏游仆虫的内禀增长率较高, 因此酵母喂养可实现拟伍氏游仆虫的高密度培养, 而杜氏盐藻喂养可实现拟伍氏游仆虫的快速培养。Côrtes等[26]的报道也证实了使用酵母投喂可使纤毛虫游仆虫达到高种群密度, 与藻类相比, 使用酵母来培养拟伍氏游仆虫可减少培养藻类的成本。然而Guermazi等人[27]以杜氏盐藻和酵母作为饵料喂养盐蚕豆虫时发现, 用酵母喂食的盐蚕豆虫的种群密度最小。这与本实验结果不一致, 推测是由于纤毛虫的食物选择性与其体积相关, 拟伍氏游仆虫的体积小于盐蚕豆虫, 因此更倾向于摄食较小的酵母菌。Kamiyama等[28]的研究也证实了饵料的粒径对纤毛虫的摄食率和食物选择存在影响。
光照是水生生态系统中的重要非生物因子, 对水生生物具有双重影响, 既能促进生物个体繁殖发育, 又能抑制生物体的生长, 因此光照对水生生态的能量流动及物质循环具有重要影响[29]。研究表明光照不仅可以直接影响纤毛虫的种群生长, 还可以通过影响细菌群落的生长和组成, 从而影响纤毛虫[30-31]。本实验中, 拟伍氏游仆虫在光照条件下的(14L∶10D)的种群生长状况较好, 环境容纳量高于全黑暗条件下, 这与尾草履虫(Paramecium caudatum)在光照条件下的种群密度高于黑暗条件下的研究结果基本符合[32], 推测光照可以促进拟伍氏游仆虫的生长。然而, 本实验中拟伍氏游仆虫在全黑暗条件下的种群增长率高于光照条件下, 尽管光照条件下拟伍氏游仆虫的环境容纳量较高, 但其没有获得生长率的优势, Chen等[33]在对海洋纤毛虫罗曼虫(Lohmanniella sp.)的摄食率研究时发现, 黑暗条件下纤毛虫的摄食率高于光照条件下, 推测本实验中拟伍氏游仆虫的种群生长率随着光照条件的变化与其摄食率的变化相关。
4 结论本实验发现盐度胁迫和培养条件对拟伍氏游仆虫的种群动力有很大的影响。拟伍氏游仆虫生长的最适盐度为15, 高盐度胁迫下拟伍氏游仆虫的环境容纳量明显下降, 酵母菌投喂可实现拟伍氏游仆虫的高密度培养, 杜氏盐藻投喂可实现拟伍氏游仆虫的快速培养, 并且光照条件下拟伍氏游仆虫的环境容纳量高于黑暗条件下。因此, 实现拟伍氏游仆虫的大规模培养的最适生长条件应为光照条件(14L∶10D)下, 盐度为15, 使用酵母喂养。
| [1] |
WILLIAMS P J L B, DUCKLOW H W. The microbial loop concept: A history, 1930-1974[J]. Journal of Marine Research, 2019, 77(2): 23-81. DOI:10.1357/002224019828474359 |
| [2] |
MIECZAN T, GRZEŚKIEWICZ M. The impact of climate warming on the diurnal dynamics of the microbial loop: Ice cover vs. lack of ice cover on dystrophic lakes[J]. Saudi Journal of Biological Sciences, 2021, 28(9): 5175-5186. DOI:10.1016/j.sjbs.2021.05.047 |
| [3] |
陆夏铭, 杨青. 原生动物在环境监测与城镇污水处理中的应用[J]. 广西城镇建设, 2021(7): 36-38. LU Xiaming, YANG Qing. Application of protozoa in environmental monitoring and urban sewage treatment[J]. Cities and Towns Construction in Guangxi, 2021(7): 36-38. |
| [4] |
KAZMI S S U H, UROOSA, WARREN A, et al. Use of functional units of periphytic protozoa for monitoring water quality in marine ecosystems: bioindicator redundancy[J]. Environmental Science and Pollution Research, 2022, 29(15): 22139-22150. DOI:10.1007/s11356-021-17447-w |
| [5] |
华莉娟, 俞永强. 海洋环流的长期变化和预估[J]. 气候变化研究进展, 2022, 18(1): 19-30. HUA Lijuan, YU Yongqiang. Long term variation and projection of ocean circulation[J]. Climate Change Research, 2022, 18(1): 19-30. |
| [6] |
PAN X L, LI B F, WATANABE Y W. Intense ocean freshening from melting glacier around the Antarctica during early twenty-first century[J]. Scientific Reports, 2022, 12(1): 383-393. DOI:10.1038/s41598-021-04231-6 |
| [7] |
于博, 葛勇, 任殿军, 等. 黄海对台风"利奇马"响应的观测研究[J]. 海洋科学, 2022, 46(1): 34-43. YU Bo, GE Yong, REN Dianjun, et al. Observation of the Yellow Sea response to Typhoon Lekima[J]. Marine Sciences, 2022, 46(1): 34-43. |
| [8] |
张鹏, 刘洋, 安瑞志, 等. 西藏拉萨河中下游原生动物优势种时空生态位[J]. 林业科学, 2022, 58(1): 78-88. ZHANG Peng, LIU Yang, AN Ruizhi, et al. Spatio-temporal niche of dominant protozoa species in the midstream and downstream of Lhasa River, Tibet, China[J]. Scientia Silvae Sinicae, 2022, 58(1): 78-88. |
| [9] |
梅建西. 雅鲁藏布江周丛原生动物群落结构特征及其与环境因子的关系[D]. 重庆: 西南大学, 2020. MEI Jianxi. Protozoan community structure of the Yarlung Zangbo River and its relationship with environmental factors[D]. Chongqing: Southwest University, 2020. |
| [10] |
ALZANY A, AZIA N E A, EL-GHOBASHY A E, et al. Distribution, composition, and abundance of protozoa in Burullus Lake, Egypt, and relationships with environmental variables[J]. Regional Studies in Marine Science, 2021, 48: 102076. DOI:10.1016/j.rsma.2021.102076 |
| [11] |
CHEN X M, XU K D. Morphological studies of six free-living spirotrichean ciliates (Protozoa: Ciliophora) with three new records from the coastal South China Sea[J]. Acta Oceanologica Sinica, 2018, 37(10): 86-90. DOI:10.1007/s13131-018-1304-3 |
| [12] |
王云峰. 烟台近海半咸水沙隙纤毛虫物种多样性研究[D]. 烟台: 烟台大学, 2019. WANG Yunfeng. Species diversity of interstitial ciliates in brackish water off the coast of Yantai[D]. Yantai: Yantai University, 2019. |
| [13] |
AL-RASHEID K A S. New records of interstitial ciliates (Protozoa Ciliophora) from the Saudi coasts of the Red Sea[J]. Tropical Zoology, 2001, 14(1): 133-156. DOI:10.1080/03946975.2001.10531148 |
| [14] |
CHEN W B, ZUO C L, Wang C D, et al. The hidden genomic diversity of ciliated protists revealed by single-cell genome sequencing[J]. BMC Biology, 2021, 19(1): 264-277. DOI:10.1186/s12915-021-01202-1 |
| [15] |
SONG W B, BRADBURY P C. Comparative studies on a new brackish water Euplotes, E. parawoodruffi n. sp., and a redescription of Euplotes woodruffi gaw, (Ciliophora; Hypotrichida)[J]. Archiv Für Protistenkunde, 1997, 148(4): 399-412. DOI:10.1016/S0003-9365(97)80019-X |
| [16] |
DAI R H, XU K D, HE Y Y. Morphological, physiological, and molecular evidences suggest that Euplotes parawoodruffi is a junior synonym of Euplotes woodruffi (Ciliophora, Euplotida)[J]. Journal of Eukaryotic Microbiology, 2013, 60(1): 70-78. DOI:10.1111/jeu.12007 |
| [17] |
类彦立, 徐奎栋. 海洋底栖原生动物生态学研究方法学综述[J]. 海洋科学, 2007, 31(5): 49-55. LEI Yanli, XU Kuidong. Methods for ecological studies of marine benthic protozoa[J]. Marine Sciences, 2007, 31(5): 49-55. |
| [18] |
XU H L, SONG W B, ZHU M Z, et al. Ecological functions of ciliated protozoa in marine ecosystem: effects on accumulation of ambient ammonia[J]. High Technology Letters (English Edition), 2005, 11(1): 101-106. |
| [19] |
HARIS N, MANAN H, JUSOH M, et al. Effect of different salinity on the growth performance and proximate composition of isolated indigenous microalgae species[J]. Aquaculture Reports, 2022, 22: 100925. DOI:10.1016/j.aqrep.2021.100925 |
| [20] |
王婷, 郑佳慧, 胡梦红等. 海洋酸化对贝类的生理生态学影响研究进展[J]. 海洋科学, 2022, 46(1): 192-202. WANG Ting, ZHENG Jiahui, HU Menghong, et al. Advances in studies on the physiological and ecological effects of ocean acidification on shellfish[J]. Marine Sciences, 2022, 46(1): 192-202. |
| [21] |
宫钰莹. 盐生杜氏藻对盐度变化和渗透胁迫下的细胞反应及其中性脂肪的积累[D]. 沈阳: 沈阳农业大学, 2017. GONG Yuying. Cellular responses of Dunaliella salina to the osmotic stress and changes of salinity besides accumulation of lipid[D]. Shenyang: Shenyang Agricultural University, 2017. |
| [22] |
WEINISCH L, KÜHNER S, ROTH R, et al. Identification of osmoadaptive strategies in the halophile, heterotrophic ciliate Schmidingerothrix salinarum[J]. PLoS Biology, 2018, 16(1): e2003892. |
| [23] |
ANNUNCIAÇÃO W F D, OHS C L, TSUZUKI M Y. Influence of food concentration and abiotic parameters on population density growth of the ciliated marine protozoan Euplotes sp. under controlled conditions[J]. Aquaculture Research, 2020, 51(2): 523-534. |
| [24] |
李承春, 徐奎栋, 类彦立. 食物和温度对海洋底栖纤毛虫——叶状突口虫种群增长的影响[J]. 应用与环境生物学报, 2010, 16(4): 545-549. LI Chengchun, XU Kuidong, LEI Yanli. Effects of temperature and food supply on population growth of marine benthic ciliate, Condylostoma spatiosum[J]. Chinese Journal Applied and Environmental Biology, 2010, 16(4): 545-549. |
| [25] |
HARVEY H R, EDERINGTON M C, MCMANUS G B. Lipid composition of the marine ciliates Pleuronema sp. and Fabrea salina: shifts in response to changes in diet[J]. Journal of Eukaryotic Microbiology, 2010, 44(3): 189-193. |
| [26] |
CÔRTES G T, TSUZUKI M Y, MELO E M C. Monoculture of the ciliate protozoan Euplotes sp. (Ciliophora; Hypotrichia) fed with different diets[J]. Acta Scientiarum. Biological Sciences, 2013, 35(1): 5-19. |
| [27] |
GUERMAZI A, ELLOUMI J, AYADI H, et al. Rearing of Fabrea salina Henneguy (Ciliophora, Heterotrichida) with three unicellular feeds[J]. Comptes Rendus Biologies, 2008, 331(1): 56-63. |
| [28] |
KAMIYAMA T, ARIMA S. Feeding characteristics of two tintinnid ciliate species on phytoplankton including harmful species: effects of prey size on ingestion rates and selectivity[J]. Journal of Experimental Marine Biology and Ecology, 2001, 257(2): 281-296. |
| [29] |
MOELLER H V, JOHNSON M D, FALKOWSKI P G. Photoacclimation in the phototrophic marine ciliate Mesodinium rubrum (Ciliophora)[J]. Journal of Phycology, 2011, 47(2): 324-332. |
| [30] |
CADOTTE M W, JANTZ S, MAI D V. Photo-dependent population dynamics of Stentor coeruleus and its consumption of Colpidium striatum[J]. Canadian Journal of Zoology, 2007, 85(5): 674-677. |
| [31] |
LEE C S, LEE S A, KO S R, et al. Effects of photoperiod on nutrient removal, biomass production, and algal-bacterial population dynamics in lab-scale photobioreactors treating municipal wastewater[J]. Water Research, 2015, 68(1): 680-691. |
| [32] |
王海博. 光照对纤毛虫原生动物种群增长的影响[D]. 威海: 山东大学(威海), 2015. WANG Haibo. The effect of light on the population growth of ciliated protozoa[D]. Weihai: Shandong University (Weihai), 2015. |
| [33] |
CHEN K M, CHANG J. Influence of light intensity on the ingestion rate of a marine ciliate, Lohmanniella sp.[J]. Journal of Plankton Research, 1999, 21(9): 1791-1798. |
 2023, Vol. 47
2023, Vol. 47


