文章信息
- 侯蕴轩, 李文娜, 杨晓萱, 雷丽桐, 张代云, 马畅蔚, 王浩. 2023.
- HOU Yun-xuan, LI Wen-na, YANG Xiao-xuan, LEI Li-tong, ZHANG Dai-yun, MA Chang-wei, WANG Hao. 2023.
- 日本七鳃鳗转化生长因子β I型受体基因(L-Tgfbr1)的克隆与表达分析
- Cloning and expression analysis of transforming growth factor β type I receptor gene (L-Tgfbr1) of Lampetra japonica
- 海洋科学, 47(1): 88-98
- Marine Sciences, 47(1): 88-98.
- http://dx.doi.org/10.11759/hykx20201228004
-
文章历史
- 收稿日期:2020-12-28
- 修回日期:2021-02-26
2. 辽宁师范大学 七鳃鳗研究中心, 辽宁 大连 116081;
3. 大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心, 辽宁 大连 116081
2. Lamprey Research Center, Liaoning Normal University, Dalian 116081, China;
3. Collaborative Innovation Center of Seafood Deep Processing, Dalian Polytechnic University, Dalian 116081, China
于3.6亿年前出现的日本七鳃鳗(Lampetra japonica)是洄游性海洋生物, 隶属于圆口纲(Cyclostomata)、七鳃鳗目(Petromyzontiformes)、七鳃鳗科(Petromyzontidae)、七鳃鳗属(Lampetra), 是迄今所知最原始的无颌类脊椎动物。作为脊椎动物最直接的祖先, 七鳃鳗是关联无脊椎与脊椎动物的重要阶元, 从而成为比较免疫学[1]及比较生理学[2]研究的关键物种。尤其是近年来, 七鳃鳗独特的免疫应答机制获得了广泛关注, 其适应性免疫系统的抗原识别机制是以可变淋巴细胞受体(variable lymphocyte receptors, VLRs)为基础, 而非有颌类脊椎动物的T细胞受体(T cell receptor, TCR)和B细胞受体(B cell receptor, BCR)[3]。随后陆续发现了3种VLRs (VLRA、VLRB、VLRC), 其中VLRA/VLRC阳性和VLRB阳性的类淋巴细胞在若干方面分别与有颌脊椎动物的T和B淋巴细胞非常相似[4]。胚系细胞VLRs基因通过随机插入亮氨酸富集重复单元(Leucine-rich repeat, LRR), 产生多种成熟的VLR受体以识别外界各种抗原。因此, 以七鳃鳗为代表的无颌类脊椎动物被认为处于适应性免疫系统开始形成的阶段, 这对揭示适应性免疫系统的起源和进化无疑具有重要的意义[5]。
转化生长因子β Ⅰ型受体(TGF-beta receptor type-2, Tgfbr1)是介导转化生长因子β(transforming growth factor beta, TGF-β)信号通路的关键受体之一。除了Ⅰ型受体, TGF-β信号通路中还存在II型受体(Tgfbr2), 两者结构类似且均属于丝/苏氨酸激酶偶联的受体家族[6]。在该信号通路中, TGF-β作为配体, 首先与Tgfbr2结合, 随后Tgfbr1和Tgfbr2组装成异源四聚体, 触发磷酸化级联反应, 即Tgfbr2介导Tgfbr1活化, Tgfbr1进而招募并磷酸化其下游的受体型Smads蛋白(Smads 2/3), 活化后的受体型Smads与通用型Smads(Smad 4)结合并转位入核, 与其他辅助转录因子共同调控一系列靶基因的转录[6-7]。
TGF-β作为多功能细胞因子, 能够调控细胞增殖、分化、黏附、迁移及凋亡等行为, 在胚胎发育过程和成体组织稳态维持中发挥重要的作用[8]。其中, TGF-β通过调节先天性免疫细胞类群的募集、激活、分化和功能等[9-10], 发挥控制炎症强度和维持免疫稳态的重要作用[11-12]。例如, 经鼻给予TGF-β后能够明显减少癫痫持续状态下大鼠海马中的炎性因子TNF-α及IL-1β的表达, 进而抑制小胶质细胞的活化功能, 从而减轻大鼠海马内的炎症现象, 并可能具有保护脑和抗癫痫的作用[13]。同时, TGF-β在低等脊椎动物中也能够抑制炎症反应[14-15]。例如草鱼(Ctenopharyngodon idella)TGF-β能够抑制植物血凝素(PHA)或脂多糖(LPS)激活的淋巴细胞增殖[16]。而在更古老的头索动物文昌鱼(Branchiostoma japonicum)中, TGF-β能促进静息的巨噬细胞系RAW264.7的迁移, 但抑制激活的RAW264.7迁移[17]。这表明TGF-β信号通路的免疫调控功能在进化上具有保守性。对TGF-β信号通路中配体、受体以及信号转导因子Smads的进化途径进行追踪发现, 该通路起源于后口动物(Deuterostomia)。在无颌脊椎动物进化为有颌脊椎动物后, TGF-β家族成员开始迅速的多样化, 在高等脊椎动物中已发现5种TGF-β分子(TGF-β 1~5)[18]。无颌类脊椎动物是TGF-β信号通路进化中的关键一环, 因此, 对TGF-β信号通路中的各种配体、受体以及Smads在七鳃鳗中的同源基因进行系统的鉴定和进化分析具有重要意义, 但迄今未见相关报道。
本文对日本七鳃鳗TGF-βⅠ型受体基因(L-Tgfbr1)的编码序列进行克隆, 进一步探究了七鳃鳗Tgfbr1中各结构域的保守性及其与其他物种中Tgfbr1的亲缘关系, 并比较了L-Tgfbr1在脂多糖诱导的炎症反应中的表达水平变化。这一研究将为进一步阐明TGF-β信号通路在日本七鳃鳗免疫调节中的功能以及脊椎动物中TGF-β受体分子的起源和进化奠定基础。
1 材料与方法 1.1 实验材料健康的成体日本七鳃鳗饲养于10 ℃的循环水饲养系统中。
1.2 实验方法 1.2.1 七鳃鳗各组织总RNA提取及cDNA的合成利用MiniBEST Universal RNA Extraction Kit试剂盒(TaKaRa)分别提取日本七鳃鳗各组织的总RNA, 使用分光光度计测定RNA浓度, 并用1%的琼脂糖凝胶电泳检验RNA的提取质量。将七鳃鳗白细胞的1 μg总RNA通过PrimeScriptTM II 1st Strand cDNA Synthesis Kit试剂盒(TaKaRa)反转录合成cDNA作为模板, 用于L-Tgfbr1基因的克隆。分别将七鳃鳗各组织的1 μg总RNA通过PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)试剂盒反转录合成cDNA, 用于实时定量PCR检测。
1.2.2 L-Tgfbr1基因的克隆根据实验室已获得的日本七鳃鳗转录组数据设计L-Tgfbr1基因ORF区的PCR扩增引物(表 1)。利用PrimeSTAR HS DNA Polymerase(TaKaRa)扩增目的片段。反应体系: 正向引物Tgfbr1-F 0.5 μL、反向引物Tgfbr1-R 0.5 μL、5× PrimeSTAR Buffer (Mg2+ Plus) 5 μL、dNTP Mixture 2 μL、cDNA模板5 μL、DNA Polymerase 0.25 μL、灭菌水11.75 μL。反应条件: 94 ℃变性10 s, 60 ℃退火5 s, 72 ℃延伸150 s, 共30个循环。
| 引物 | 序列(5′-3′) |
| Tgfbr1-F | CCACGCGGCATGGCCAA |
| Tgfbr1-R | TTTTCGACATCTGCGACTGCT |
| Tgfbr1-qF | CCGAGATCTACCAGACAGTCATGCT |
| Tgfbr1-qR | TCCATGTCCCGTTGTCCTTG |
| GAPDH-qF | AACCAACTGCCTGGCTCCT |
| GAPDH-qR | GTCTTCTGCGTTGCCGTGT |
利用1%琼脂糖凝胶电泳检验扩增结果。随后将大小与预期一致的条带利用DNA胶回收试剂盒(上海生工)进行回收。将胶回收DNA与pEASY-Blunt克隆载体(全式金)进行连接, 并转化感受态大肠杆菌(trans 5α)。经过菌落PCR检测, 将重组质粒送上海生工公司进行测序。
1.2.3 生物信息学分析利用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)分析克隆得到的L-Tgfbr1基因的开放阅读框并获得其编码蛋白质的氨基酸序列; 利用ProtPparam在线预测蛋白的理化性质(https://web.expasy.org/protparam/); 利用TMHMM在线预测跨膜结构域(http://www.cbs.dtu.dk/services/TMHMM/); 利用NetOGlyc在线预测糖基化位点(http://www.cbs.dtu.dk/services/NetOGlyc/); 利用SMART在线预测蛋白功能结构域(http://smart.embl-heidelberg.de/smart/); 利用ClustalW进行多重序列比对分析(https://www.genome.jp/tools-bin/clustalw); 利用SWISS-MODEL (https://swissmodel.expasy.org/)进行同源性建模以预测蛋白的三级结构。
1.2.4 系统发育树的构建利用BLAST程序在NCBI数据库和UniProt数据库中搜索L-Tgfbr1同源基因, 选取了脊索动物中具有代表性的23个物种的Tgfbr1蛋白序列, 利用MEGA X软件中的邻接法(Neighbor-Joining)构建系统进化树, 设置的bootstrap值为1 000, 模型为Jones-Taylor-Thornton(JTT)model。
1.2.5 脂多糖免疫日本七鳃鳗将成体健康的日本七鳃鳗随机分为免疫组与对照组, 免疫组向七鳃鳗腹腔内注射100 μg的LPS, 分别在注射12 h和24 h后麻醉解剖取样。对照组七鳃鳗腹腔注射生理盐水。
1.2.6 实时定量PCR根据L-Tgfbr1基因及L-GAPDH基因ORF区的序列设计QPCR扩增引物(表 1)。将步骤1.2.1中制备的免疫组和对照组中七鳃鳗的各组织cDNA模板, 利用TB Green Premix Ex Taq II试剂盒(TaKaRa)进行实时定量PCR检测。反应体系: 正向引物1 μL、反向引物1 μL、2×TB Green Premix Ex Taq II 12.5 μL、cDNA模板2.5 μL、灭菌水8 μL。反应条件: 94 ℃预变性30 s, 94 ℃变性5 s, 60 ℃退火和延伸34 s, 共40个循环。将髓小体cDNA模板按照1︰3的比例进行梯度稀释, 利用实时定量PCR检测不同梯度下的CT值, 以此绘制L-Tgfbr1和GAPDH基因相对表达量的标准曲线。在测得扩增效率并确定标准曲线符合要求后, 进一步运用“扩增效率–ΔΔCT”法计算相对表达量。
1.2.7 Western blot检测将免疫组及对照组日本七鳃鳗麻醉后取血, 使用Ficoll-Histopaque分离液(Sigma-Aldrich)通过密度梯度法分离白细胞, 使用RIPA裂解液提取白细胞总蛋白, 使用BCA法进行蛋白定量。蛋白样品经SDS-PAGE电泳分离后, 通过湿法电转至PVDF膜。5%脱脂牛奶封闭后, 与经过验证的Tgfbr1特异性兔多克隆抗体(1︰1 000稀释)4 ℃孵育过夜, 随后与辣根过氧化物酶(HRP)偶联的山羊抗兔二抗孵育1 h, 最后使用增强型化学发光(ECL)试剂盒(美仑)进行显色。利用Gel-Pro 4.0软件对条带灰度值进行半定量。
1.2.8 免疫荧光检测将包被多聚赖氨酸的盖玻片放置于24孔板中, 加入七鳃鳗白细胞与髓细胞, 于18 ℃细胞培养箱过夜培养, 培养密度不低于2×106个/孔。用含吐温-20的磷酸盐缓冲液(PBST)清洗细胞后加入4%的多聚甲醛固定液, 室温下固定20 min。加入0.5% 皂素(saponin)室温下通透细胞10 min, 随后加入1% BSA室温封闭30 min。实验组加入Tgfbr1兔多克隆抗体(1︰1 000稀释), 对照组加入小鼠IgG, 室温孵育6 h。随后加入Dylight 594, 山羊抗小鼠IgG荧光二抗, 避光孵育1 h, 清洗后加入Hoechst 33342复染并封片。最后使用激光扫描共聚焦显微镜观察(Carl Zeiss LSM 710)。
1.2.9 统计分析定量数据均利用独立样本重复3次, 数据输入GraphPad Prism 8软件进行分析和作图, 采用student’s t检验进行统计分析。
2 结果与分析 2.1 日本七鳃鳗L-TGF-β I型受体基因的克隆通过搜索本实验室的日本七鳃鳗转录组数据库, 获取了七鳃鳗Tgfbr1同源基因的全长编码序列。进一步根据该候选序列设计特异性引物, 以七鳃鳗白细胞的cDNA作为模板, 利用高保真PCR酶进行目的片段的扩增, 获得了单一且明亮的条带, 连接到T载体后进行测序(图 1a)。利用ORF Finder程序分析L-Tgfbr1 cDNA序列的开放阅读框, 结果表明克隆到的序列全长为1 554 bp, 其中ORF区为1 335 bp, 编码氨基酸残基个数为444(图 1b)。
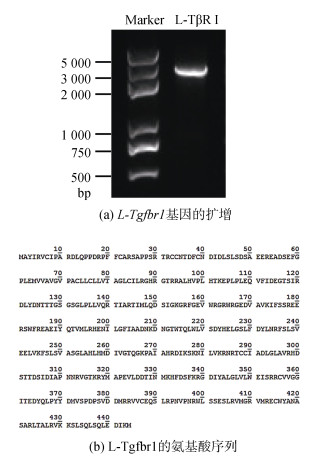 |
| 图 1 L-Tgfbr1基因的扩增与测序 Fig. 1 Amplification of L-Tgfbr1 gene and sequencing of PCR products |
我们进一步对L-Tgfbr1蛋白进行了一系列的生物信息学分析, 包括预测蛋白质的理化性质、跨膜结构域、糖基化位点、功能结构域以及三级结构等。这为接下来进一步探究其生物学功能提供了有力的基础。
利用ProtParam程序分析L-Tgfbr1的理化性质。结果表明, 该蛋白质的理论等电点pI值为6.80, 分子量为50 171.52 u。带负电荷的残基总数(Asp+Glu): 57, 带正电荷的残基总数(Arg+Lys): 56。分子公式为: C2 204H3 514N636O653S25。原子总数: 7 032。预测的半衰期于哺乳动物体外网织红细胞内为30 h, 于酵母内大于20 h, 于大肠杆菌内大于10 h。计算得出的不稳定性指数为53.48, 表明其蛋白稳定性较弱。
利用TMHMM 2.0程序预测L-Tgfbr1是否具有跨膜结构域。结果发现(图 2a), 在L-Tgfbr1蛋白中存在1个单次跨膜结构域, 跨膜结构域的位置在第64~86氨基酸残基之间, 而1~63位氨基酸位于细胞膜表面, 87~444位氨基酸位于细胞内。接下来利用NetNGLyc 1.0程序来分析L-Tgfbr1蛋白糖基化修饰情况(图 2b)。糖基化修饰是重要的蛋白质翻译后修饰之一, 有助于机体蛋白质抵御消化酶的作用, 保证蛋白质的高效能的信号传导功能。以可信度分值大于0.5为阈值, 预测结果发现L-Tgfbr1蛋白不存在O型糖基化位点, 但存在2个N型糖基化位点, 分别位于第125位(分值0.628 8)和211位(分值0.637 9)。其余两个位点疑似存在N型糖基化, 包括第285位(分值0.477 4)和419位(分值0.422 9)。
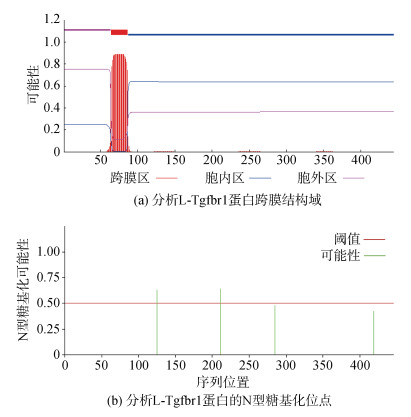 |
| 图 2 分析L-Tgfbr1蛋白跨膜结构域及糖基化位点 Fig. 2 The analysis of the transmembrane domain and the N-type glycosylation sites of L-Tgfbr1 protein |
利用SMART程序预测L-Tgfbr1的功能结构域。结果显示(图 3a), L-Tgfbr1蛋白于第1至43氨基酸残基有一个富含亲水半胱氨酸的配体结合域(Activin_recp domain), 该结构域存在于两种类型的TGF-β受体(Ⅰ型和Ⅱ型)中, 且Ⅰ型受体在半胱氨酸之前还具有7个细胞外残基[19]。L-Tgfbr1于第117至146氨基酸残基存在一个富含甘氨酸/丝氨酸的GS结构域(GS domain), 于第146至433氨基酸残基含有一个丝/苏氨酸蛋白激酶催化结构域(S_TKc domain)。由此可见, L-Tgfbr1分子包含了已知的TGF-β Ⅰ型受体分子的主要功能结构域。此外利用SWISS-MODEL程序预测L-Tgfbr1蛋白的三维构象图(图 3b), 发现模拟的L-Tgfbr1三维结构的骨架与人类Tgfbr1十分相似[20], 进一步提示七鳃鳗L-Tgfbr1分子具有与高等脊椎动物Tgfbr1类似的功能。
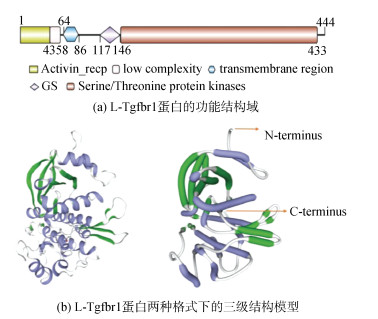 |
| 图 3 分析L-Tgfbr1蛋白的功能结构域和三级结构 Fig. 3 The analysis of the functional domain and tertiary structure of L-Tgfbr1 protein 注: 图b中蓝色为α螺旋, 绿色为延伸链, 链拐角处的银色为β转角, 箭头指示蛋白的N端和C端 |
我们首先于NCBI数据库中选取了脊索动物中5个代表性物种的Tgfbr1氨基酸序列, 分别为哺乳类中的小鼠(Mus musculus)、鸟类中的原鸡(Gallus gallus)、硬骨鱼中的斑马鱼(Danio rerio)、软骨鱼中的鲸鲨(Rhincodon typus)以及头索动物中的文昌鱼(Branchiostoma floridae)。然后利用ClustalW程序将日本七鳃鳗与其他5个物种的Tgfbr1氨基酸序列进行多重序列比对分析。结果显示(图 4), L-Tgfbr1蛋白氨基酸序列与脊椎动物的四个代表物种的同源性为70%左右, 而与头索动物中的文昌鱼的同源性为60%。特别是L-Tgfbr1的C端保守性很高, 该区域主要包括了胞内的丝/苏氨酸激酶催化结构域。
 |
| 图 4 L-Tgfbr1的氨基酸序列与不同物种间的多序列比对 Fig. 4 Multiple sequences alignment of L-Tgfbr1 proteins between lampreys and other species 注: 左侧物种名称及相应的Tgfbr1蛋白登录号依次为Lampetra japonica: 日本七鳃鳗; Mus musculus: 小鼠(NP_033396.1); Gallus gallus: 原鸡(NP_989577.1); Danio rerio: 斑马鱼(NP_001032772.2); Rhincodon typus: 鲸鲨(XP_020377141.1); Branchiostoma floridae: 佛罗里达文昌鱼(XP_035661061.1)。比对序列中的黑色背景表示完全一致的氨基酸残基; 方框表示同源性较高的氨基酸残基 |
为了进一步分析不同物种Tgfbr1之间的进化情况, 选取了包括七鳃鳗在内的23种脊索动物的同源蛋白, 利用MEGA X中的邻接法对不同物种Tgfbr1构建系统进化树。结果显示(图 5), 文昌鱼作为头索动物的代表, 其Tgfbr1位于进化树的根部。而日本七鳃鳗及海七鳃鳗(Petromyzon marinus) Tgfbr1处于脊椎动物Tgfbr1蛋白的底端进化枝上, 表明七鳃鳗Tgfbr1在进化史上具有原始性地位, 这也与作为无颌类脊椎动物的七鳃鳗在脊椎动物进化中的地位一致。
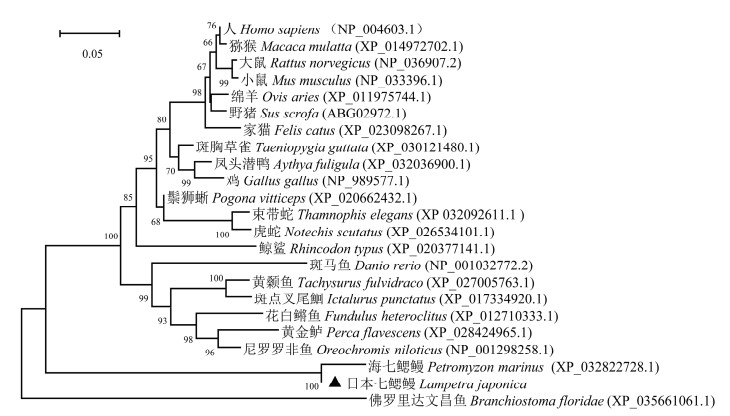 |
| 图 5 利用邻接法构建多物种Tgfbr1蛋白的进化树 Fig. 5 The phylogenetic tree (neighbor-Joinning method) of Tgfbr1 proteins from multiple species 注: 分支上数值代表bootstrap值为1 000时的置信度; 比例尺代表遗传距离为0.05; 图中标注了建树所用各物种的中文名、拉丁学名及Tgfbr1蛋白登录号 |
我们利用实时定量PCR检测了L-Tgfbr1基因在日本七鳃鳗各组织中的转录表达谱。结果发现(图 6), 七鳃鳗肾脏中L-Tgfbr1的相对表达量最低, 而在心脏中的转录水平最高, 约是肾脏表达量的56倍, 性腺中L-Tgfbr1的表达量约为肾脏的36倍, 口腔腺的表达量约为肾脏的21倍, 另外, 在白细胞和肝脏中L-Tgfbr1的转录水平分别约为肾脏的18倍及13倍, 髓小体、肠、鳃组织中L-Tgfbr1表达量约是肾脏的6倍。
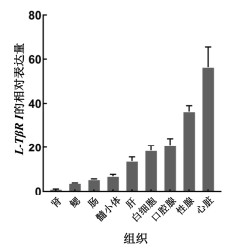 |
| 图 6 L-Tgfbr1基因在日本七鳃鳗各组织中的转录水平分析 Fig. 6 Analysis of transcript levels of L-Tgfbr1 in various tissues of Japanese lamprey 注: 图示L-Tgfbr1基因在各组织和白细胞中的相对表达量, 其中在肾脏中的表达量设为1。实验均重复3次 |
我们首先利用实时定量PCR检测L-Tgfbr1在脂多糖免疫前后的七鳃鳗多个组织中的转录水平变化情况。结果发现同未免疫的对照组相比(图 7), 免疫12 h后的肾脏、鳃、髓小体、肝脏、白细胞、口腔腺组织中L-Tgfbr1的表达水平显著上调(P < 0.01); 在肠和心脏中L-Tgfbr1的表达水平虽有上升趋势, 但是差异不显著(P > 0.05); 但在性腺中与对照相比其表达显著下调。其次, 与对照组相比, 免疫24 h后的肾脏、白细胞中L-Tgfbr1的表达水平显著性上调(P < 0.05), 在鳃组织中L-Tgfbr1的表达水平有所上升, 差异并不明显; 但是在髓小体、肝脏、口腔腺、肠、心脏、性腺等组织中L-Tgfbr1的表达水平同对照组相比显著下调。
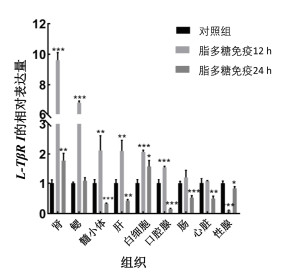 |
| 图 7 L-Tgfbr1基因在LPS免疫前后七鳃鳗中的转录水平变化 Fig. 7 Changes in the transcript levels of L-Tgfbr1 in Japanese lamprey before and after immunization with LPS 注: 图示L-Tgfbr1基因在LPS免疫前后七鳃鳗的各组织和白细胞中的相对表达量, 其中在对照组中的表达量设为1。实验均重复3次。t检验进行统计学分析, *: P < 0.05, **: P < 0.01, ***: P < 0.001 |
我们进一步利用免疫印迹法比较L-Tgfbr1在免疫前后日本七鳃鳗白细胞中的蛋白表达情况。结果发现在LPS免疫七鳃鳗12 h及24 h后, 白细胞中L-Tgfbr1的蛋白表达水平逐渐上调(图 8a)。对条带灰度值进行相对定量后发现, 与对照组相比, LPS注射24 h后白细胞中L-Tgfbr1的蛋白水平显著上调(P < 0.05)(图 8b)。
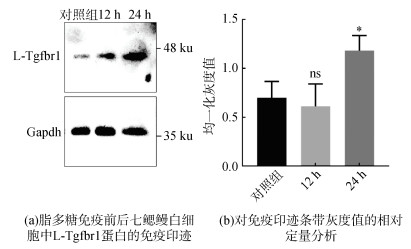 |
| 图 8 L-Tgfbr1在LPS免疫前后七鳃鳗白细胞中的蛋白水平变化 Fig. 8 Changes in the protein levels of L-Tgfbr1 in the leukocytes of Japanese lamprey before and after immunization with LPS 注: 实验均重复3次, t检验进行统计学分析, *: P < 0.05, ns: P > 0.05 |
为了明确L-Tgfbr1在七鳃鳗白细胞及神经轴上髓小体细胞中的亚细胞定位, 我们利用验证过的L-Tgfbr1特异性抗体进行了细胞免疫荧光实验。如图 9所示, 将小鼠同型IgG作为阴性对照, 在白细胞以及髓细胞中能够观察到明显的荧光信号, 表明L-Tgfbr1蛋白主要分布于七鳃鳗白细胞和神经轴上髓小体细胞的细胞质中, 这与已报道的哺乳动物如人的L-Tgfbr1分子的亚细胞定位一致。
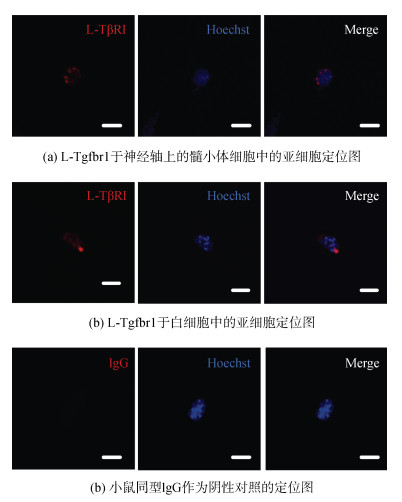 |
| 图 9 L-Tgfbr1在原代培养的七鳃鳗白细胞及髓细胞中的亚细胞定位 Fig. 9 Subcellular localization of L-Tgfbr1 in primary leukocytes and SMB cells of lampreys 注: 蓝色荧光(405 nm): Hoechst 33342荧光染料标记的细胞核; 红色荧光(594 nm): 使用L-Tgfbr1抗体标记的TGF-β I型受体; 比例尺: 50 µm |
为了探索脊椎动物中TGF-β Ⅰ型受体分子的起源和进化, 本研究克隆了日本七鳃鳗L-Tgfbr1基因的编码序列。多序列比对表明, L-Tgfbr1的氨基酸序列与哺乳类、鸟类、硬骨鱼和软骨鱼的代表物种相比相似性较高, 而与头索动物文昌鱼相比则略低。结合结构域分析进一步发现, L-Tgfbr1蛋白中的GS结构域和胞内激酶结构域均具有显著的保守性, 这是两个位于胞内区域的参与受体信号传递的关键结构域。其中, GS结构域是TGF-β Ⅰ型受体所特有的一个富含甘氨酸/丝氨酸的结构域, 是控制Ⅰ型受体激酶催化活性及其与Smads底物相互作用的关键调控元件[21-24]。而胞内激酶结构域属于丝氨酸/苏氨酸特异性激酶亚家族, Ⅰ型受体被Ⅱ型受体磷酸化激活后, 该结构域进一步磷酸化其下游的R-Smads蛋白, 在TGF-β信号通路中起着关键作用[25]。与胞内端结构域的高保守性相反, L-Tgfbr1蛋白位于胞外一端的序列与其他物种之间的相似程度较低, 且长度更短。这一区域包括富含亲水半胱氨酸的配体结合域和一个低复杂度区域。Tgfbr1胞外端序列之间的差异大于胞内端序列之间的差异, 这可能是由于受体的两端在TGF-β通路中具有完全不同的环境和作用, 分别执行配体结合与激酶介导的信号传导功能。在进化过程中, 相对于配体结合侧的受体序列, 信号传导侧的序列发生改变可能要受到更多的约束。
在包括23个脊索动物Tgfbr1全长序列的进化树中, 最原始的头索动物文昌鱼位于树根位置, 3种爬行动物、3种鸟类、7种哺乳动物在各自聚为一支的基础上, 组成一个大的分支, 软骨鱼位于该分支底部。而6种硬骨鱼组成了另一个大的分支。日本七鳃鳗L-Tgfbr1与海七鳃鳗同在一个分支, 位于所有脊椎动物分支的底端位置, 且与硬骨鱼的亲缘关系比较密切, 同人类和小鼠等高等脊椎动物的亲缘关系比较疏远。七鳃鳗作为最原始的脊椎动物, L-Tgfbr1在进化树中的位置和物种的进化位置具有一致性, 进一步探讨其功能对于揭示TGF-β Ⅰ型受体分子的进化过程具有重要意义。
本研究通过实时定量PCR在转录水平上探究了L-Tgfbr1基因的表达谱, 发现该基因在七鳃鳗多组织及白细胞中均有表达, 尤其在心脏、性腺、口腔腺、白细胞及肝脏中的表达量较高, 在肠、肾、鳃、髓小体中检测到低表达。有研究发现在哺乳动物中, TGF-β及其受体在肝脏中高表达[26-27]。在罗非鱼(Oreochromis niloticus)肝脏中, Tgfbr1和Tgfbr2均高表达[28]。然而, 在虹鳟鱼(Oncorhynchus mykiss)中, Tgfbr1和Tgfbr2分别在大脑和肌肉中高表达, 而在肝脏中低表达[29]。这表明不同物种之间Tgfbr1基因在各组织中的表达水平存在差异。
TGF-β信号通路在维持免疫应答的稳态平衡中发挥重要作用。TGF-β通路的激活需要TGF-β Ⅰ型与Ⅱ型受体形成功能性受体复合物[30]。而在先天性免疫应答过程中TGF-β Ⅰ型和Ⅱ型受体的平衡在决定巨噬细胞对TGF-β的反应是激活还是失活方面起着重要作用, 这种平衡在一定程度上是由细胞分化决定的[31]。因此, 在TGF-β信号调控免疫应答的过程中, Tgfbr1表达水平的变化至关重要。脂多糖(LPS)被广泛用于制作模拟细菌感染的动物模型[32]。本研究利用LPS注入七鳃鳗模拟细菌侵染过程, 进而激活其先天性免疫应答, 并从转录与蛋白水平上对Tgfbr1分子的表达变化进行了检测。经过LPS免疫后的两个时段, 七鳃鳗的肾脏、鳃、髓小体、肝脏、白细胞、口腔腺等组织中L-Tgfbr1转录水平在免疫12 h后迅速上调, 而在免疫24 h后基本回落至基底水平。我们还进一步发现了免疫24 h后L-Tgfbr1在白细胞中的蛋白表达水平显著上调, 尽管与转录水平的变化相比在时间上有所滞后, 但表达上调的趋势是完全一致的。与此类似, 罗非鱼接受LPS免疫1 h和6 h后, 其脾脏白细胞和头肾白细胞内Tgfbr1的转录水平均出现显著上调[28]。另外利用LPS体外刺激虹鳟鱼的鳃细胞系RTgill 8 h后, Tgfbr1的转录水平显著上调[29]。因此, 在先天性免疫应答过程中, Tgfbr1的表达变化趋势都呈现一过式的迅速上调, 这表明L-Tgfbr1分子及其介导的TGF-β信号通路在日本七鳃鳗的先天性免疫调控过程中可能发挥了重要的作用, 其具体机制值得进一步深入研究。
4 结论综上所述, 本研究首次克隆得到了TGF-β Ⅰ型受体在日本七鳃鳗中的同源基因, 继而对该蛋白质序列进行了生物信息学分析, 分析了七鳃鳗Tgfbr1同源蛋白中各结构域的保守性及其与其他物种中Tgfbr1分子的亲缘关系, 并阐明了其在脂多糖免疫前后的七鳃鳗各组织中转录水平的变化以及在白细胞中蛋白水平的变化, 明确了L-Tgfbr1在包括白细胞以及髓细胞在内的免疫细胞中的亚细胞定位。本研究为阐明脊椎动物中TGF-β受体分子的起源和进化提供了有价值的线索, 并提示了TGF-β信号通路在七鳃鳗免疫调节中可能发挥重要功能。
| [1] |
COOPER M D, ALDER M N. The evolution of adaptive immune systems[J]. Cell, 2006, 124(4): 815-822. DOI:10.1016/j.cell.2006.02.001 |
| [2] |
BAKER M E, FUNDER J W, KATTOULA S R. Evolution of hormone selectivity in glucocorticoid and mineralocorticoid receptors[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2013, 137: 57-70. DOI:10.1016/j.jsbmb.2013.07.009 |
| [3] |
BOEHM T, MCCURLEY N, SUTOH Y, et al. VLR-based adaptive immunity[J]. Annual Review of Immunology, 2012, 30(1): 203-220. DOI:10.1146/annurev-immunol-020711-075038 |
| [4] |
KASAMATSU J, SUTOH Y, FUGO K, et al. Identification of a third variable lymphocyte receptor in the lamprey[J]. Proceedings of the National Academy of Sciences, 2010, 107(32): 14304-14308. DOI:10.1073/pnas.1001910107 |
| [5] |
BOEHM T, HIRANO M, HOLLAND S, et al. Evolution of alternative adaptive immune systems in vertebrates[J]. Annual Review of Immunology, 2018, 36: 19-42. DOI:10.1146/annurev-immunol-042617-053028 |
| [6] |
SURIYAMURTHY S, BAKER D, tEN DIJKE P, et al. Epigenetic reprogramming of TGF-beta signaling in breast cancer[J]. Cancers (Basel), 2019, 11(5): E726. DOI:10.3390/cancers11050726 |
| [7] |
ZHANG W, JIANG Y, WANG Q, et al. Single-molecule imaging reveals transforming growth factor-β-induced type II receptor dimerization[J]. Proceedings of the National Academy of Sciences, 2009, 106(37): 15679-15683. DOI:10.1073/pnas.0908279106 |
| [8] |
TANG B, VU M, BOOKER T, et al. TGF-β switches from tumor suppressor to prometastatic factor in a model of breast cancer progression[J]. The Journal of Clinical Investigation, 2003, 112(7): 1116-1124. DOI:10.1172/JCI200318899 |
| [9] |
FLAVELL R A, SANJABI S, WRZESINSKI S H, et al. The polarization of immune cells in the tumour environment by TGFβ[J]. Nature Reviews Immunology, 2010, 10(8): 554-567. DOI:10.1038/nri2808 |
| [10] |
GIGANTE M, GESUALDO L, RANIERI E. TGF-Beta: a master switch in tumor immunity[J]. Current Pharmaceutical Design, 2012, 18(27): 4126-4134. DOI:10.2174/138161212802430378 |
| [11] |
MAKWANA M, JONES L L, CUTHILL D, et al. Endogenous transforming growth factor β1 suppresses inflammation and promotes survival in adult CNS[J]. Journal of Neuroscience, 2007, 27(42): 11201-11213. DOI:10.1523/JNEUROSCI.2255-07.2007 |
| [12] |
QIAN L, WEI S J, ZHANG D, et al. Potent anti-inflammatory and neuroprotective effects of TGF-beta1 are mediated through the inhibition of ERK and p47phox-Ser345 phosphorylation and translocation in microglia[J]. Journal of Immunology, 2008, 181(1): 660-668. DOI:10.4049/jimmunol.181.1.660 |
| [13] |
刘益民, 韩远远, 张慧敏, 等. 经鼻给予TGF-β1对匹罗卡品诱导的癫痫持续状态大鼠海马内炎症反应的影响[J]. 中风与神经疾病杂志, 2012, 29(11): 1019-1022. LIU Yimin, HAN Yuanyuan, ZHANG Huimin, et al. Effects of Intranasal administration of TGF-β1 on hippocampus inflammation after pilocarpine induced status epilepticus[J]. Journal of Apoplexy and Nervous Diseases, 2012, 29(11): 1019-1022. DOI:10.19845/j.cnki.zfysjjbzz.2012.11.015 |
| [14] |
MAEHR T, COSTA M M, GONZáLEZ VECINO J L, et al. Transforming growth factor-β1b: A second TGF-β1 paralogue in the rainbow trout (Oncorhynchus mykiss) that has a lower constitutive expression but is more responsive to immune stimulation[J]. Fish & Shellfish Immunology, 2013, 34(2): 420-432. |
| [15] |
LILLEENG E, PENN M H, HAUGLAND Ø, et al. Decreased expression of TGF-β, GILT and T-cell markers in the early stages of soybean enteropathy in Atlantic salmon (Salmo salar L.)[J]. Fish & Shellfish Immunology, 2009, 27(1): 65-72. |
| [16] |
YANG M, ZHOU H. Grass carp transforming growth factor-beta 1 (TGF-beta 1): molecular cloning, tissue distribution and immunobiological activity in teleost peripheral blood lymphocytes[J]. Molecular Immunology, 2008, 45(6): 1792-1798. DOI:10.1016/j.molimm.2007.09.027 |
| [17] |
WANG S, LI F, HU L, et al. Structural and functional characterization of a TGFβ molecule from amphioxus reveals an ancient origin of both immune-enhancing and-inhibitory functions[J]. Developmental & Comparative Immunology, 2014, 45(2): 219-226. |
| [18] |
ZHENG S, LONG J, LIU Z, et al. Identification and evolution of TGF-beta signaling pathway members in twenty-four animal species and expression in tilapia[J]. International Journal of Molecular Sciences, 2018, 19(4): 1154-1174. DOI:10.3390/ijms19041154 |
| [19] |
DIJKE P, ICHIJO H, FRANZéN P, et al. Activin receptor-like kinases: A novel subclass of cell-surface receptors with predicted serine/threonine kinase activity[J]. Oncogene, 1993, 8: 2879-2887. |
| [20] |
HUSE M, MUIR T W, XU L, et al. The TGF beta receptor activation process: an inhibitor- to substrate-binding switch[J]. Molecular cell, 2001, 8(3): 671-682. DOI:10.1016/S1097-2765(01)00332-X |
| [21] |
FRANZEN P, HELDIN C H, MIYAZONO K. The GS Domain of the transforming growth factor-β type-I receptor is important in signal transduction[J]. Biochemical and Biophysical Research Communications, 1995, 207(2): 682-689. DOI:10.1006/bbrc.1995.1241 |
| [22] |
WIESER R, WRANA J L, MASSAGUé J. GS domain mutations that constitutively activate T beta R-I, the downstream signaling component in the TGF-beta receptor complex[J]. The EMBO Journal, 1995, 14(10): 2199-2208. DOI:10.1002/j.1460-2075.1995.tb07214.x |
| [23] |
WRANA J L, ATTISANO L, WIESER R, et al. Mechanism of activation of the TGF-β receptor[J]. Nature, 1994, 370(6488): 341-347. DOI:10.1038/370341a0 |
| [24] |
SOUCHELNYTSKYI S, tEN DIJKE P, MIYAZONO K, et al. Phosphorylation of Ser165 in TGF-beta type I receptor modulates TGF-beta1-induced cellular responses[J]. The EMBO Journal, 1996, 15(22): 6231-6240. DOI:10.1002/j.1460-2075.1996.tb01013.x |
| [25] |
LUGINI L, CECCHETTI S, HUBER V, et al. Immune surveillance properties of human NK cell-derived exosomes[J]. Journal of Immunology, 2012, 189(6): 2833-2842. DOI:10.4049/jimmunol.1101988 |
| [26] |
BEDOSSA P, PELTIER E, TERRIS B, et al. Transforming growth factor-beta 1 (TGF-beta 1) and TGF-beta 1 receptors in normal, cirrhotic, and neoplastic human livers[J]. Hepatology (Baltimore, Md.), 1995, 21(3): 760-766. |
| [27] |
GAO C, GRESSNER G, ZOREMBA M, et al. Transforming growth factor β (TGF-β) expression in isolated and cultured rat hepatocytes[J]. Journal of Cellular Physiology, 1996, 167(3): 394-405. DOI:10.1002/(SICI)1097-4652(199606)167:3<394::AID-JCP3>3.0.CO;2-K |
| [28] |
ZHAN X L, MA T Y, WU J Y, et al. Cloning and primary immunological study of TGF-β1 and its receptors TβR I/TβR II in tilapia(Oreochromis niloticus)[J]. Developmental & Comparative Immunology, 2015, 51(1): 134-140. |
| [29] |
MAEHR T, WANG T, GONZÁLEZ VECINO J L, et al. Cloning and expression analysis of the transforming growth factor-beta receptors type 1 and 2 in the rainbow trout Oncorhynchus mykiss[J]. Developmental & Comparative Immunology, 2012, 37(1): 115-126. |
| [30] |
DERYNCK R, FENG X H. TGF-β receptor signaling[J]. Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 1997, 1333(2): F105-F150. DOI:10.1016/S0304-419X(97)00017-6 |
| [31] |
ASHCROFT G S. Bidirectional regulation of macrophage function by TGF-β[J]. Microbes and Infection, 1999, 1(15): 1275-1282. DOI:10.1016/S1286-4579(99)00257-9 |
| [32] |
GUHA M, MACKMAN N. LPS induction of gene expression in human monocytes[J]. Cellular Signalling, 2001, 13(2): 85-94. DOI:10.1016/S0898-6568(00)00149-2 |
 2023, Vol. 47
2023, Vol. 47


