文章信息
- 王宗月, 袁华茂, 宋金明, 贺志鹏, 段丽琴, 李学刚. 2023.
- WANG Zong-yue, YUAN Hua-mao, SONG Jin-ming, HE Zhi-peng, DUAN Li-qin, LI Xue-gang. 2023.
- 长江口及邻近海域沉积物中四醚脂类的来源及其对底层溶解氧指示作用探究
- Source of tetraether lipids in sediments of the Changjiang River Estuary and adjacent sea: Indication of bottom water dissolved oxygen
- 海洋科学, 47(11): 24-34
- Marine Sciences, 47(11): 24-34.
- http://dx.doi.org/10.11759/hykx20230327001
-
文章历史
- 收稿日期:2023-03-27
- 修回日期:2023-04-26
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049;
4. 中国科学院海洋大科学中心, 山东 青岛 266071;
5. 山东省淡水渔业研究院, 山东 济南 250117
2. Marine Ecology and Environmental Science Laboratory, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. Shandong Freshwater Fisheries Research Institute, Jinan 250117, China
微生物可通过改变细胞膜脂化合物的组成以调节细胞膜的流动性、渗透性和稳定性来适应环境变化, 基于此机制所建立的有机分子指标可用于重建古环境的变化。甘油二烷基甘油四醚(glycerol dialkyl glycerol tetraethers, GDGTs)是一种重要的微生物膜脂化合物, 主要包含带有0~4个环戊烷分子的GDGTs (GDGT 0-4), 以及泉古菌醇(Cren, 带有4个环戊烷分子和1个环己烷分子)及其异构体(Cren‘)[1-2]。基于GDGTs不同组分的相对丰度, Schouten等[3]提出了TEX86(TetraEther indeX of tetraethers consisting of 86 carbons)指标, 并被广泛用于海洋古温度重建[4-7]。然而, 许多研究表明TEX86反演的古温度偏离实际温度, 表明GDGTs的组成变化并不完全取决于温度[8-10]。
溶解氧(DO)作为支撑微生物生命活动的重要环境因子, 对古菌膜脂的组成也存在影响[11-13]。通过实验室恒温培养不同氨氧化古菌(AOA)菌株, 发现GDGT-2和GDGT-3的相对丰度随DO浓度的降低而增加, GDGT-1的相对丰度逐渐减小, 导致TEX86估算的温度显著高于实际培养温度[14]。
长江口及其邻近海域的季节性低氧问题一直备受关注。研究发现长江口及邻近海域夏季低氧区的面积不断扩大, 持续时间增长, 缺氧水平不断加剧[16-17]。由于观测资料的缺乏, 导致对近海低氧长时间变化规律的认识仍不清楚。因此, 探究沉积物中GDGTs的组成对底层DO的响应, 建立不同溶解氧条件与GDGTs组成的定量关系, 可为探寻GDGTs作为指示长江口邻近海域低氧演变历程的代用指标提供新的视角。
1 材料与方法 1.1 采样站位与样品预处理于2022年7月搭乘“中渔科211”科考船在长江口及其邻近海域采集不同深度(0 m、5 m、10 m、25 m和30 m)的颗粒物和表层沉积物(0~2 cm)样品, 采样站位如图 1所示。水样用船载NISKIN采水器(12 L) 采集后立即用0.7 μm GF/F玻璃纤维滤膜(经马弗炉灼烧, 450 ℃, 5 h)过滤。每层过滤水样6 L, 过滤结束后将滤膜对折并包裹在灼烧过的铝箔内, 标记好于−20 ℃冰箱中冷冻保存。海水采集过程中利用船载CTD同步获取原位温度、盐度参数, 并于现场测定海水溶解氧和pH等参数。表层沉积物经箱式沉积物采集器采集, 采集0~2 cm样品, 之后置于−20 ℃冷冻保存, 带回实验室经冷冻干燥并研磨后待用。
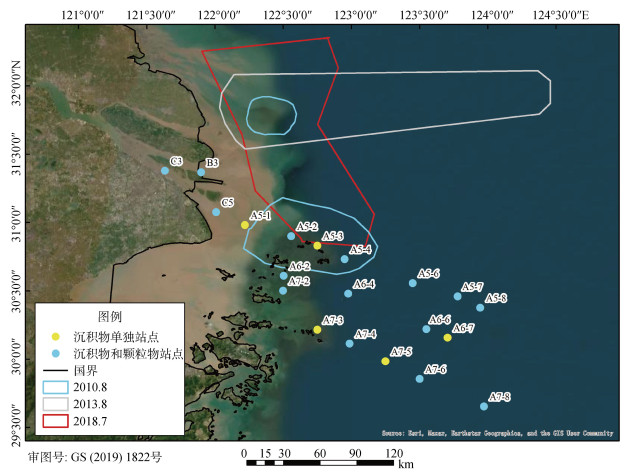 |
| 图 1 长江口及其邻近海域采样站位图 Fig. 1 Map of sampling stations in the sea area adjacent to the Changjiang River Estuary 注: 蓝色圆点代表沉积物和颗粒物采样站位; 黄色圆点代沉积物采样站位; 封闭区域为不同年份低氧区位置 |
取适量经冷冻干燥并研磨后的表层沉积物约5 g (或经过滤后的GF/F滤膜), 加入10 mL甲醇/二氯甲烷(1/3, v/v)混合均匀, 并加入50 μL 0.925 mg·L–1内标(C46 GTGTs)振荡使其混合均匀后, 超声15 min。超声结束后利用离心机(3 000 r/min, 3 min)离心得到上清液, 重复萃取4次。将上清液合并后用柔和氮气吹干, 并加入5 mL 6% KOH甲醇溶液(质量比)并超声3次, 每次10 min, 每次间隔30 min, 之后于通风橱中放置过夜。第二天, 碱水解完毕的样品中加入4 mL正己烷萃取4次, 收集上清液并用硅胶柱以正己烷和甲醇/二氯甲烷(5/95, v/v)洗脱得到非极性和极性组分。极性组分吹干后, 用0.22 μm PTFE膜过滤, 洗脱液经氮气吹干后以正己烷/异丙醇(99/1, v/v)定容, 最后利用液相色谱-质谱进行测定。
1.2.2 GDGTs的测试使用1290 II型高效液相色谱配备6470系列三重四极杆质谱仪(Agilent Technologies, Wilmington, DE, USA)进行高效液相色谱-大气压化学电离-质谱分析(HPLC-APCI-MS)。在40 ℃下配备了HILIC Plus色谱柱(3.0 mm×100 mm, 1.8 μm, Agilent Technologies, USA)以分离不同的GDGTs。流动相A相和B相分别为正己烷和正己烷/异丙醇(9/1, v/v), 流速为0.4 mL·min–1。梯度洗脱程序如下: 0~5 min为100%的A, 5~5.5 min时流动相B的比例增加到5%, 5.5~ 10 min流动相B的比例增加到10%, 10~20 min流动相B的比例增加到15%, 20~35 min流动相B的比例增加到30%, 并保持10 min, 45~55 min B的比例增加到50%并保持5 min。质谱仪器参数为: APCI正模式, 雾化器压力60 psi, 蒸发器温度350 ℃, 干燥气(N2)流量5.0 L·min–1, 温度350 ℃, 毛细管电压4 000 V, 电晕放电电流4 000 nA。在选择离子监测模式(m/z 1 302、1 300、1 298、1 296、1 292、744)下进行各种GDGTs的检测。
2 结果和讨论 2.1 长江口及其邻近海域GDGTs的组成和分布特征在长江口邻近海域表层沉积物和悬浮颗粒物中, 共检测了6种核心GDGTs的化合物, 包括GDGT-0、GDGT-1、GDGT-2、GDGT-3、Cren及Cren的异构体(Cren‘)。其中, GDGT-0和Cren作为GDGTs种类最多的组分, 其占到总GDGTs的80%以上(图 2, 表 1)。
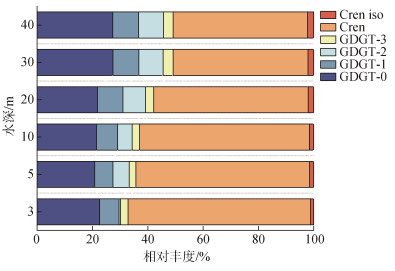 |
| 图 2 长江口及其邻近海域悬浮颗粒物GDGTs相对丰度随深度的变化 Fig. 2 Variation in the relative abundance of GDGTs in suspended particulate matter with water depth in the sea area adjacent to Changjiang River Estuary |
| 站位 | %GDGT-0 | %GDGT-1 | %GDGT-2 | %GDGT-3 | %Cren | %Cren‘ |
| A5-1 | 30.87 | 8.18 | 5.79 | 2.12 | 51.86 | 1.18 |
| A5-2 | 28.51 | 7.69 | 5.09 | 2.02 | 55.55 | 1.14 |
| A5-3 | 30.60 | 8.25 | 5.55 | 2.20 | 52.31 | 1.10 |
| A5-4 | 29.30 | 8.66 | 6.00 | 2.45 | 52.04 | 1.56 |
| A5-6 | 29.49 | 9.39 | 6.94 | 2.69 | 49.91 | 1.58 |
| A5-7 | 29.04 | 9.24 | 6.58 | 2.60 | 50.99 | 1.56 |
| A5-8 | 29.54 | 8.81 | 6.82 | 2.71 | 50.48 | 1.63 |
| A6-2 | 30.24 | 8.10 | 5.82 | 2.19 | 52.55 | 1.10 |
| A6-4 | 29.79 | 8.87 | 6.37 | 2.54 | 50.96 | 1.47 |
| A6-6 | 28.98 | 9.29 | 6.86 | 2.67 | 50.49 | 1.71 |
| A6-8 | 29.88 | 9.24 | 6.88 | 2.70 | 49.67 | 1.63 |
| A7-3 | 32.91 | 8.67 | 5.82 | 2.29 | 49.14 | 1.17 |
| A7-2 | 30.94 | 8.32 | 5.58 | 2.21 | 51.67 | 1.28 |
| A7-4 | 30.12 | 8.18 | 5.47 | 2.14 | 52.85 | 1.25 |
| A7-5 | 30.72 | 9.50 | 6.73 | 2.70 | 48.73 | 1.63 |
| A7-6 | 30.59 | 9.25 | 6.90 | 2.69 | 48.93 | 1.63 |
| A7-8 | 30.29 | 9.28 | 7.15 | 2.82 | 48.69 | 1.75 |
| B3 | 30.23 | 8.60 | 6.80 | 2.02 | 51.46 | 0.90 |
| C3 | 44.35 | 14.17 | 10.38 | 2.81 | 27.83 | 0.46 |
| C5 | 29.85 | 7.74 | 6.15 | 1.94 | 53.35 | 0.96 |
悬浮颗粒物总GDGTs的含量变化范围为0.56~ 33.24 ng·L–1, 整体上呈现由表层到底层升高的分布趋势, 最高值出现在长江口外的A6-4站位的底层(图 3)。这种垂直分布趋势与水柱中奇古菌的分布相关, 对长江口及内陆架区域水体中氨单加氧酶基因(amoA)定量分析的研究表明, 该海域底层水中附着于颗粒物上的奇古菌丰度明显高于表层[18]。本研究结果与古菌功能基因丰度的垂直分布一致, 即底层GDGTs的丰度更高, 表明奇古菌更倾向于在较深水层生长繁衍。表层奇古菌的丰度低可能是由于以下原因造成的: (1)奇古菌与浮游植物竞争NH4+-N[19]; (2)强光抑制了奇古菌的生长[20]。作为GDGTs的主要生产者, 表层奇古菌的数量少, 导致GDGTs的丰度低。作为奇古菌的标志物, Cren是沉积物中含量最高的GDGT组分, 含量在0.32~16.07 ng·L–1之间, 占总GDGTs的平均比例为55.00%。其次是GDGT-0, 含量在0.11~ 10.34 ng·L–1之间, 占总GDGTs的平均比例为25.62% (图 3)。整体而言, 随着水深的增加, GDGT-0的相对丰度逐渐增加, 而Cren的相对丰度逐渐降低(图 3)。
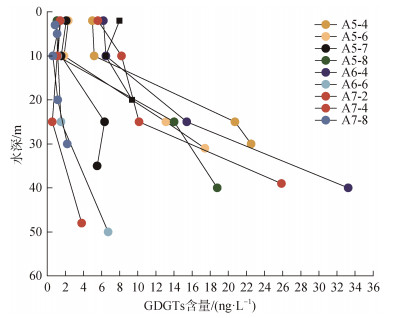 |
| 图 3 长江口及其邻近海域悬浮颗粒物GDGTs含量随深度的分布 Fig. 3 Distribution of GDGTs content in suspended particulate matter with depth in the sea area adjacent to the Changjiang River Estuary |
长江口及其邻近海域表层沉积物中总GDGTs的含量范围为6.20~452.82 ng·g–1, 平均值为252.38 ng·g–1。整体上总GDGTs呈现出由长江口内向外海增加的趋势(图 4a), 最低值出现在长江口内C3站位, 最高值位于采样站位的外侧(A6-6)。在沉积物中, 奇古菌来源的Cren占比最高(除C3外), 含量在1.72~228 ng·g–1之间, 占总GDGTs的平均比例为50%。其次是GDGT-0, 含量在2.74~ 103.96 ng·g–1之间, 占总GDGTs的平均比例为31%。对于C3站位, GDGT-0的相对丰度大于Cren, 这可能是由于在河口位置其他古菌(如产甲烷古菌)的贡献导致的。
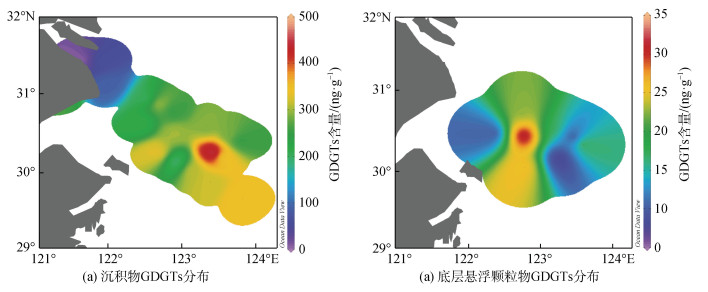 |
| 图 4 长江口及其邻近海域GDGTs的含量空间分布特征 Fig. 4 Spatial distribution characteristics of GDGT content in sediment and suspended particulate matter GDGTs of the bottom layer in the sea area adjacent to the Changjiang River Estuary |
已有的研究表明, 开阔大洋表层沉积物的GDGTs主要来源于表层或次表层水体浮游奇古菌产生的GDGTs的沉降, 可以提供过去表层或次表层环境变化的信息[3, 21-22]。而对于中国边缘海的研究表明, 沉积物中的GDGTs主要来源于底层颗粒物的沉降[7, 23], 并可用于反演底层温度的变化[6-7]。为了研究长江口及其邻近海域沉积物中GDGTs的来源, 本研究对比了沉积物和颗粒物中GDGTs的组成。GDGT-0/Cren已被提出用于评估产甲烷古菌产生的GDGT-0的贡献, 一般认为GDGT-0/Cren > 2反映了产甲烷古菌对GDGTs的贡献[24]。对于大洋的研究发现, GDGT-2/GDGT-3随深度的增加而增加[21, 25]。Hernández-Sánchez等[21]通过对比沉积物和颗粒物中GDGT-2/GDGT-3的比值, 验证沉积物中GDGTs主要来源于次表层悬浮颗粒物的沉降。本研究悬浮颗粒物的GDGT-2/GDGT-3随水深的增加呈现降低的趋势(图 5a)。而GDGT-0/Cren随水深的增加而增加(图 5b), 这与GDGT-0随水深的增加而增加, Cren随水深的增加而降低是一致的(图 3)。对比颗粒物和沉积物中GDGTs的GDGT-2/GDGT-3和GDGT-0/Cren指标, 发现沉积物中的GDGT-2/GDGT-3和GDGT-0/Cren比值均与底层颗粒物相近(图 5), 表明沉积物中的GDGTs主要来源于底层悬浮颗粒物的沉降, 与前期研究发现的东海沉积物中GDGTs主要来源于底层古菌的贡献, 进而证明表层沉积物TEX86指标能够重建底层水体温度的结果相一致[6-7, 23]。由图 4可知沉积物和底层悬浮颗粒物GDGTs浓度最低值均出现于近岸站位。此外, 与表层和次表层水相比, 底层GDGTs的浓度(图 2)较高, 且沉积物GDGTs浓度低于底层悬浮颗粒物GDGTs浓度(图 6), 表明沉积物再悬浮的影响可忽略, 这都为底层古菌GDGTs对表层沉积物的贡献提供了证据。因此, 本文的研究结果进一步证实了东海表层沉积物中GDGTs主要来源于底层颗粒物的输入而非沉积物的原位生产。
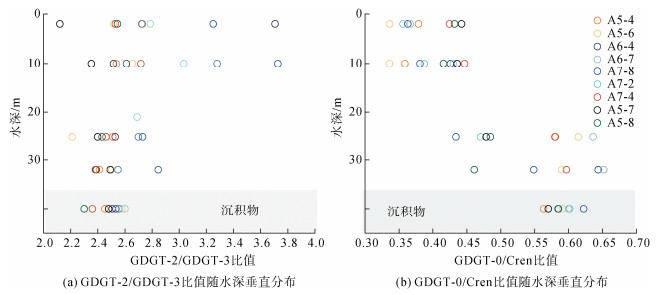 |
| 图 5 长江口及其邻近海域悬浮颗粒物和沉积物GDGTs的组成比较 Fig. 5 Comparison of the GDGT composition in suspended particulate matter and sediment in the sea area adjacent to the Changjiang River Estuary 注: 灰色阴影代表沉积物 |
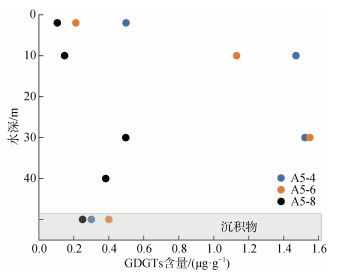 |
| 图 6 长江口及其邻近海域悬浮颗粒物和沉积物GDGTs浓度垂直分布(μg·g–1) Fig. 6 Vertical distribution of suspended particulate matter and sediment GDGT concentrations (μg·g–1) in the sea area adjacent to the Changjiang River Estuary |
GDGTs已被报道能够有效指示海洋生态环境的变化, 广泛用于海洋古环境的重建[6, 26-27]。近年来古菌的纯培养研究发现, DO可显著影响GDGTs组分相对丰度的变化[14], 显示了其指示DO变化的潜力。但是在外海环境条件下, 还缺乏GDGTs对于DO变化响应的报道, 无法建立其有效指标来指示近海DO的长期变化。本文分析发现底层悬浮颗粒物%GDGT-0、%Cren和GDGT-0/Cren与底层DO无显著相关性(R=−0.77, P > 0.05; R=−0.12, P > 0.05; R=0.3, P > 0.05)。每个站位现场测量的DO是瞬时信号, 故理论上其应与代表活体古菌的完整极性GDGTs(IPL-GDGTs)具有显著相关性, 而与代表化石残体古菌的核心GDGTs间相关性较弱。对表层沉积物研究结果显示, 长江口及其邻近海域表层沉积物中%GDGT-0、%Cren和GDGT-0/Cren与DO的关系并不明显(图 7a, c, e), 可能是由于在外海环境下GDGTs的影响因素较为复杂, 如温度、pH值和NH4+-N浓度等均会影响GDGTs的组成[2, 28-31]。古菌培养实验表明, pH也控制着GDGTs的分布, 环化率(Ring Index, RI)随着pH的降低而增加[28, 32-33]。当pH < 4时, GDGTs主要以GDGT-6(含6个环戊烷的GDGT)为主, 而在pH > 4时, 则以GDGT-5(含5个环戊烷的GDGT)及环戊烷数更少的GDGT为主[28], 且%GDGT-0随着温度的升高和pH值的降低而降低[14]。NH4+-N对GDGTs的丰度和组成也有影响。Evans等[31]研究发现, 低浓度NH4+-N条件下, 古菌优先合成Cren, 而高浓度NH4+-N条件下GDGT-0和GDGT-1的相对丰度高。因此, 在海洋环境中, GDGTs的组成和分布受多种因素的共同影响, 可能会削弱GDGTs与DO间的相关性。
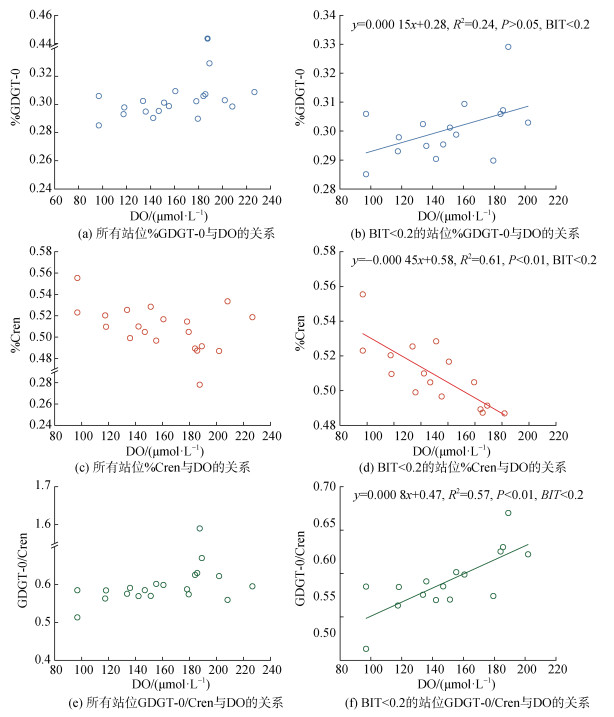 |
| 图 7 长江口及其邻近海域沉积物GDGT代用指标与底层DO的关系 Fig. 7 Relation between sedimentary GDGT indicators and bottom DO in the sea area adjacent to Changjiang River Estuary |
长江口及其邻近海域是典型的以河流输入为主导的边缘海, 其受陆源输入的影响较大。基于支链GDGTs(brGDGTs)和Cren相对丰度的BIT(Branched and Isoprenoid Tetraether)指数[34]用来评估陆源有机质的输入。一般而言, 开放大洋BIT接近于0, 在土壤环境中则接近于1。在边缘海中由于海陆物质的混合, BIT值介于0~1之间。BIT值越高, 表明陆源输入对近海有机质的贡献越大; 反之, 说明受陆源输入的影响越小。对沉积物GDGTs与底层DO相关性的进一步分析发现, 当剔除受陆源输入影响较大的长江口内和近河口的部分站位后(即BIT > 0.2的站位), 随着DO降低, %GDGT-0降低, %Cren升高, GDGT-0/Cren降低(图 7 b, d, f)。%GDGT-0与DO的相关性较弱(R2=0.24, P > 0.05)(图 7 b), 而%Cren与DO具有显著的负相关性(R2=0.61, P < 0.01), GDGT-0/Cren与DO呈显著正相关(R2=0.57, P < 0.01)(图 7d, f)。说明在受陆源输入影响较小的海域(BIT < 0.2), 沉积物中%Cren与GDGT-0/Cren具有指示底层DO变化的潜力。
对GDGT相关指标和环境因子间的相关性分析发现, 温度与GDGT指标间无显著相关性, %Cren与pH和盐度呈负相关关系(表 2), 表明除DO外, pH和盐度也会影响%Cren这一指标; GDGT-0/Cren与pH呈正相关关系, 表明pH对GDGT-0/Cren指标有影响。DO与pH具有强正相关关系(R2=0.70), 在缺氧形成过程中, 呼吸作用向水体释放CO2, 使得pH降低[35], 说明pH对GDGT具有间接影响, 直接影响是由于DO的变化造成的。对海洋奇古菌分离株N. maritimus的培养发现, pH在7.3~7.9范围内GDGTs组成和环化率均具有微小变化[32]。在本研究中pH变化范围介于7.79~7.98间, 其变化很小, 故pH对GDGT-0/Cren和%Cren的影响可忽略。因此, 在本文的研究中, %Cren受盐度和DO的共同影响, 而GDGT-0/Cren主要受控于DO。由于%Cren受盐度和DO的共同影响, 而GDGT-0/Cren主要受控于DO, 且GDGT-0/Cren的比值反映了%GDGT-0和%Cren的共同变化, 因此GDGT-0/Cren比值可以作为指示DO的潜在代用指标。在自然水体中沉积物GDGTs受到表层颗粒物的沉降以及温度、NH4+-N和pH等化学参数的影响, 可能会削弱代用指标在自然水体与DO的相关性。未来的研究应聚焦于更多沉积物样品、更广泛的海域的沉积物GDGTs与DO关系的探究, 验证GDGTs作为氧化还原代用指标的准确性和普适性。
| %GDGT-0 | %Cren | GDGT-0/Cren | |
| pH | 0.26 | 0.41* | 0.44** |
| 盐度 | 0.01 | 0.51** | 0.22 |
| 温度 | 0.19 | 0.01 | 0.01 |
| 注: *表示P < 0.05, 显著相关; **表示P < 0.01, 极显著相关 | |||
沉积物GDGTs对DO的响应可能是由以下某个原因或几个原因共同作用的结果: (1)有氧条件下GDGTs的降解; (2)GDGTs合成途径变化; (3)古菌群落变化。
2.4.1 有氧条件下GDGTs的降解GDGTs具有稳定的化学结构和对环境变化的敏感性, 经常被用于古气候重建[36-37], 且重建时间尺度可达数百万年[24, 38-39]。然而, 研究发现无论是在自然条件下, 还是在实验室单因素变量控制条件下, GDGTs在氧化降解因素的影响下其含量、分布和组成会发生改变[2, 11, 40-41]。研究表明, 在有氧条件下Cren降解速率高于GDGT-0[41], 这可能是导致GDGT-0/Cren随DO浓度的降低而降低的原因。在低氧条件下, GDGTs的降解速率降低, 有利于GDGTs的保存[11, 42]。然而, 海洋沉积物中GDGTs的降解研究结果表明, 自然状态下不同氧化条件对TEX86值的影响较小[43], 这可能与黏土矿物对GDGTs的保护有关。因此, 自然海域中有氧条件下GDGTs降解的影响可忽略。
2.4.2 GDGTs合成途径变化在低氧条件下, 氨氧化古菌因溶解氧的限制而产生电子受体的限制, 进而产生能量限制, 造成GDGTs的合成途径发生改变[44-45]。在低氧条件即能量限制时, 古菌合成GDGTs的前体化合物双香叶基香叶基甘油磷酸(digeranylgeranylglyceryl phosphate, DGGGP)中包含的双键倾向于形成环戊烷以节省2个电子, 使得古菌产生高环化度GDGTs[30], 从而增加GDGTs的环化率, 增加细胞膜的致密性, 以降低能量消耗[30, 46]。
2.4.3 古菌群落变化不同的环境条件也会引起古菌群落结构发生变化。奇古菌主要存在于有氧环境中, 然而在O2不充足的环境中, 更适应低氧环境的古菌类群如深海古菌Group D(MBG-D)、深古菌(MCG)等占主导地位, 从而对GDGTs的总量和组成产生影响[47-49]。DO浓度降低时, 好氧奇古菌的活动受到抑制, 而厌氧古菌(如超级门古菌DPANN)则变得活跃, 古菌群落也会由以奇古菌为主转变为以DPANN超级门为主[15, 50]。研究发现与从头合成相比, 厌氧古菌可能倾向于优先回收利用CL-GDGTs(如GDGT-0)来合成IPL-GDGTs[15], 这可能是低氧条件下GDGT-0相对丰度降低的原因, 但这一解释仍需要对低氧条件下IPL-GDGTs和古菌群落的研究来证实。综上所述, 沉积物中GDGTs对DO变化的响应可能是由古菌群落变化和古菌自身适应共同作用的综合结果。
3 结论本文探讨了长江口及其邻近海域表层沉积物中GDGTs组成对底层溶解氧的响应, 并探究了潜在的影响机制。结果显示, 随着深度的增加, 颗粒物GDGT-0相对丰度增加, Cren相对丰度降低, 使得GDGT-0/Cren随水深的增加而增加。通过对比沉积物和颗粒物GDGT-0/Cren和GDGT-2/GDGT-3指标, 发现沉积物中GDGTs主要来源于底层颗粒物的沉降。通过对沉积物中不同GDGTs组分的相对丰度与底层DO浓度的相关性分析, 发现当剔除陆源输入较为明显的站位后, 底层DO浓度与GDGT-0/Cren具有较强的正相关性(R2=0.57, P < 0.01), 表明在受陆源输入影响较小的海域(BIT < 0.2), GDGT-0/Cren具有指示长江口及邻近海域夏季底层DO变化的潜力。古菌群落结构的转变、古菌通过调整膜脂GDGTs的组成来适应低氧环境是GDGT-0/Cren指标指示底层DO变化的潜在机制, 但这一指标的应用仍需要扩展到更多海域, 以进一步验证指标的可靠性。
致谢: 本研究的数据及样品采集得到国家自然科学基金委员会共享航次计划项目(批准号: 42149903)的资助, 该航次(编号: NORC2022-03)由“中渔科211”号科考船实施, 在此一并致谢。
| [1] |
SCHOUTEN S, HOPMANS E C, PANCOST R D, et al. Widespread occurrence of structurally diverse tetraether membrane lipids: evidence for the ubiquitous presence of low-temperature relatives of Hyperthermophiles[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97: 14421-14426. |
| [2] |
SINNINGHE DAMSTÉ J S, SCHOUTEN S, HOPMANS E C, et al. Crenarchaeol: the characteristic core glycerol dibiphytanyl glycerol tetraether membrane lipid of cosmopolitan pelagic crenarchaeota[J]. Journal of Lipid Research, 2002, 43: 1641-1651. DOI:10.1194/jlr.M200148-JLR200 |
| [3] |
SCHOUTEN S, HOPMANS E C, SCHEFUSS E, et al. Distributional variations in marine crenarchaeotal membrane lipids: a new tool for reconstructing ancient sea water temperatures?[J]. Earth and Planetary Science Letters, 2002, 204: 265-274. DOI:10.1016/S0012-821X(02)00979-2 |
| [4] |
KIM J H, VAN DER MEER J, SCHOUTEN S, et al. New indices and calibrations derived from the distribution of crenarchaeal isoprenoid tetraether lipids: Implications for past sea surface temperature reconstructions[J]. Geochi mica et Cosmochimica Acta, 2010, 74: 4639-4654. DOI:10.1016/j.gca.2010.05.027 |
| [5] |
PEARSON A AND INGALLS A E. Assessing the use of archaeal lipids as marine environmental proxies[J]. Annual Review of Earth and Planetary Sciences, 2013, 41: 359-384. DOI:10.1146/annurev-earth-050212-123947 |
| [6] |
XING L, SACHS J P, GAO W X, et al. TEX86 paleothermometer as an indication of bottom water temperature in the Yellow Sea[J]. Organic Geochemistry, 2015, 86: 19-31. DOI:10.1016/j.orggeochem.2015.05.007 |
| [7] |
WANG Y Y, LI D W, SACHS J P, et al. Vertical distribution of isoprenoid GDGTs in suspended particles from the East China Sea shelf and implications for sedimentary TEX86H records[J]. Organic Geochemistry, 2019, 136: 103895. DOI:10.1016/j.orggeochem.2019.07.004 |
| [8] |
SCHOUTEN S, PITCHER A, HOPMANS E C, et al. Intact polar and core glycerol dibiphytanyl glycerol tetraether lipids in the Arabian Sea oxygen minimum zone: Ⅰ. selective preservation and degradation in the water column and consequences for the TEX86[J]. Geochimica et Cosmochimica Acta, 2012, 98: 228-243. DOI:10.1016/j.gca.2012.05.002 |
| [9] |
BASSE A, ZHU C, VERSTEEGH G J M, et al. Distribution of intact and core tetraether lipids in water column profiles of suspended particulate matter off Cape Blanc, NW Africa[J]. Organic Geochemistry, 2014, 72: 1-13. DOI:10.1016/j.orggeochem.2014.04.007 |
| [10] |
KIM J H, SCHOUTEN S, RODRIGO-GÁMIZ M, et al. Influence of deep-water derived isoprenoid tetraether lipids on the TEX86H paleothermometer in the Mediterranean Sea[J]. Geochimica et Cosmochimica Acta, 2015, 150: 125-141. DOI:10.1016/j.gca.2014.11.017 |
| [11] |
HUGUET C, KIM J H, DE LANGE G J, et al. Effects of long term oxic degradation on the U37K', TEX86 and BIT organic proxies[J]. Organic Geochemistry, 2009, 40: 1188-1194. DOI:10.1016/j.orggeochem.2009.09.003 |
| [12] |
XIE S T, LIU X L, SCHUBOTZ F, et al. Distribution of glycerol ether lipids in the oxygen minimum zone of the Eastern Tropical North Pacific Ocean[J]. Organic Geochemistry, 2014, 71: 60-71. DOI:10.1016/j.orggeochem.2014.04.006 |
| [13] |
QIAN S, YANG H, DONG C H, et al. Rapid response of fossil tetraether lipids in lake sediments to seasonal environmental variables in a shallow lake in central China: implications for the use of tetraether-based proxies[J]. Organic Geochemistry, 2019, 128: 108-121. DOI:10.1016/j.orggeochem.2018.12.007 |
| [14] |
QIN W, CARLSON L T, ARMBRUST E V, et al. Confounding effects of oxygen and temperature on the TEX86 signature of marine Thaumarchaeota[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112: 10979-10984. |
| [15] |
LIPSEWERS Y A, HOPMANS E C, DAMSTE J S S, et al. Potential recycling of thaumarchaeotal lipids by DPANN Archaea in seasonally hypoxic surface marine sediments[J]. Organic Geochemistry, 2018, 119: 101-109. DOI:10.1016/j.orggeochem.2017.12.007 |
| [16] |
刘贲, 张霄宇, 曾江宁等. 长江口低氧区的成因及过程[J]. 海洋地质与第四纪地质, 2018, 38(1): 187-194. LIU Ben, ZHANG Xiaoyu, ZENG Jiangning et al. The origin and processof hypoxia in the Yangtze River Estuary[J]. Marine Geology & Quaternary Geology, 2018, 38(1): 187-194. |
| [17] |
王寇, 李博, 卢军炯等. 长江口邻近海域夏季低氧区变化及温盐特征[J]. 厦门大学学报(自然科学版), 2020, 59(S1): 32-38. WANG Kou, LI Bo, LU Junjiong, et al. Temperature and salinity characteristics of summer hypoxia area in the Yangtze River Estuary adjacent sea area[J]. Journal of Xiamen University (Natural Science), 2020, 59(S1): 32-38. |
| [18] |
ZHANG Y, XIE X, JIAO N Z, et al. Diversity and distribution of amoA-type nitrifying and nirS-type denitrifying microbial communities in the Yangtze River estuary[J]. Biogeosciences, 2014, 11: 2131-2145. DOI:10.5194/bg-11-2131-2014 |
| [19] |
GALAND P E, GUTIÉRREZ-PROVECHO C, MASSANA R, et al. Inter-annual recurrence of archaeal assemblages in the coastal NW Mediterranean Sea (Blanes Bay Microbial Observatory)[J]. Limnology and Oceanography, 2010, 55: 2117-2125. DOI:10.4319/lo.2010.55.5.2117 |
| [20] |
MERBT S N, STAHL D A, CASAMAYOR E O, et al. Differential photoinhibition of bacterial and archaeal ammonia oxidation[J]. FEMS Microbiology Letters, 2012, 327: 41-46. DOI:10.1111/j.1574-6968.2011.02457.x |
| [21] |
HERNÁNDEZ-SÁNCHEZ M T, WOODWARD E M S, TAYLOR K W R, et al. Variations in GDGT distributions through the water column in the South East Atlantic Ocean[J]. Geochimica et Cosmochimica Acta, 2014, 132: 337-348. DOI:10.1016/j.gca.2014.02.009 |
| [22] |
JAESCHKE A, WENGLER M, HEFTER J, et al. A biomarker perspective on dust, productivity, and sea surface temperature in the Pacific sector of the Southern Ocean[J]. Geochimica et Cosmochimica Acta, 2017, 204: 120-139. DOI:10.1016/j.gca.2017.01.045 |
| [23] |
GUO J Q, YUAN H M, SONG J M, et al. Variation of isoprenoid GDGTs in the stratified marine water column: Implications for GDGT-based TEX86 paleothermometry[J]. Frontiers in Marine Science, 2021, 8715708. |
| [24] |
BLAGA C I, REICHART G -J, VISSERS E W, et al. Seasonal changes in glycerol dialkyl glycerol tetraether concentrations and fluxes in a perialpine lake: Implications for the use of the TEX86 and BIT proxies[J]. Geochimica et Cosmochimica Acta, 2011, 75: 6416-6428. DOI:10.1016/j.gca.2011.08.016 |
| [25] |
TAYLOR K W R, HUBER M, HOLLIS C J, et al. Re-evaluating modern and Palaeogene GDGT distributions: implications for SST reconstructions[J]. Global and Planetary Change, 2013, 108: 158-174. DOI:10.1016/j.gloplacha.2013.06.011 |
| [26] |
ZHANG J, JIA G D, GUO W, et al. Isoprenoid tetraether lipids in suspended particulate matter from the East China Sea and implication for sedimentary records[J]. Organic Geochemistry, 2017, 114: 81-90. DOI:10.1016/j.orggeochem.2017.09.006 |
| [27] |
LU X X, CHEN J L, HAN T W, et al. Origin of hydroxyl GDGTs and regular isoprenoid GDGTs in suspended particulate matter of Yangtze River Estuary[J]. Organic Geochemistry, 2019, 128: 78-85. DOI:10.1016/j.orggeochem.2018.12.010 |
| [28] |
BOYD E S, PEARSON A, PI Y, et al. Temperature and pH controls on glycerol dibiphytanyl glycerol tetraether lipid composition in the hyperthermophilic crenarchaeon Acidilobus sulfurireducens[J]. Extremophiles, 2011, 15(1): 59-65. DOI:10.1007/s00792-010-0339-y |
| [29] |
COBBAN A, ZHANG Y J, ZHOU A, et al. Multiple environmental parameters impact lipid cyclization in Sulfolobus acidocaldarius[J]. Environment Microbiology, 2020, 22(9): 4046-4056. DOI:10.1111/1462-2920.15194 |
| [30] |
HURLEY S J, ELLING F J, KOENNEKE M, et al. Influence of ammonia oxidation rate on thaumarchaeal lipid composition and the TEX86 temperature proxy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113: 7762-7767. |
| [31] |
EVANS T W, KOENNEKE M, LIPP J S, et al. Lipid biosynthesis of Nitrosopumilus maritimus dissected by lipid specific radioisotope probing (lipid-RIP) under contrasting ammonium supply[J]. Geochimica et Cos mochimica Acta, 2018, 242: 51-63. DOI:10.1016/j.gca.2018.09.001 |
| [32] |
ELLING F J, KÖNNEKE M, MUßMANN M, et al. Influence of temperature, pH, and salinity on membrane lipid composition and TEX86 of marine planktonic thaumarchaeal isolates[J]. Geochimica et Cosmochimica Acta, 2015, 171: 238-255. DOI:10.1016/j.gca.2015.09.004 |
| [33] |
FEYHL-BUSKA J, CHEN Y, JIA C, et al. Influence of growth phase, pH, and temperature on the abundance and composition of tetraether lipids in the thermoacidophile picrophilus torridus[J]. Frontiers in Microbiology, 2016, 7: 1323. |
| [34] |
HOPMANS E C, WEIJERS J W H, SCHEFUß E, et al. A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids[J]. Earth and Planetary Science Letters, 2004, 224: 107-116. DOI:10.1016/j.epsl.2004.05.012 |
| [35] |
刘进文. 近海环境中的呼吸作用及其与海洋酸化的耦合关系探讨[D]. 厦门: 厦门大学, 2014. LIU Jinwen. On the respiration and ocean acidification in the coastal ocean[D]. Xiamen: Xiamen University, 2014. |
| [36] |
KUYPERS M M M, BLOKKER P, ERBACHER J, et al. Massive expansion of marine archaea during a mid Cretaceous oceanic anoxic event[J]. Science, 2001, 293: 92-94. DOI:10.1126/science.1058424 |
| [37] |
SCHOUTEN S, HOPMANS E C, FORSTER A, et al. Extremely high sea-surface temperatures at low latitudes during the middle cretaceous as revealed by archaeal membrane lipids[J]. Geology, 2003, 31: 1069-1072. |
| [38] |
WANG H Y, LIU W G, ZHANG C L, et al. Branched and isoprenoid tetraether (BIT) index traces water content along two marsh-soil transects surrounding Lake Qinghai: Implications for paleo-humidity variation[J]. Organic Geochemistry, 2013, 59: 75-81. DOI:10.1016/j.orggeochem.2013.03.011 |
| [39] |
NAAFS B D A, INGLIS G N, ZHENG Y, et al. Introducing global peat-specific temperature and pH calibrations based on brGDGT bacterial lipids[J]. Geochimica et Cosmochimica Acta, 2017, 208: 285-301. DOI:10.1016/j.gca.2017.01.038 |
| [40] |
HUGUET C, DE LANGE G J, GUSTAFSSON O, et al. Selective preservation of soil organic matter in oxidized marine sediments (Madeira Abyssal Plain)[J]. Geochimica et Cosmochimica Acta, 2008, 72: 6061-6068. DOI:10.1016/j.gca.2008.09.021 |
| [41] |
张佳皓, 裴宏业, 赵世锦, 等. 样品保存过程中降解对GDGTs环境代用指标的影响[J]. 地球科学, 2020, 45(1): 317-329. ZHANG Jiahao, PEI Hongye, ZHAO Shijin et al. The impact of degradation on the tetraether-based proxies during the sample atorage[J]. Earth Science, 2020, 45(1): 317-329. |
| [42] |
HARVEY H R, FALLON R D, PATTON J S. The effect of organic matter and oxygen on the degradation of bacterial membrane lipids in marine sediments[J]. Geochimica et Cosmochimica Acta, 1986, 50: 795-804. DOI:10.1016/0016-7037(86)90355-8 |
| [43] |
SCHOUTEN S, HOPMANS E C, SINNINGHE DAMSTÉ J S. The effect of maturity and depositional redox conditions on archaeal tetraether lipid palaeother‐mometry[J]. Organic Geochemistry, 2004, 35(5): 567-571. DOI:10.1016/j.orggeochem.2004.01.012 |
| [44] |
NISHIMURA Y, EGUCHI T. Biosynthesis of archaeal membrane lipids: Digeranylgeranylglycerophospholipid reductase of the thermoacidophilic Archaeon Thermoplasma acidophilum[J]. Journal of Biochemistry, 2006, 139: 1073-1081. DOI:10.1093/jb/mvj118 |
| [45] |
KOGA Y, MORII H. Biosynthesis of ether-type polar lipids in archaea and evolutionary considerations[J]. Microbiology and Molecular Biology Reviews, 2007, 71: 97-120. DOI:10.1128/MMBR.00033-06 |
| [46] |
ELLING F J, KOENNEKE M, LIPP J S, et al. Effects of growth phase on the membrane lipid composition of the thaumarchaeon Nitrosopumilus maritimus and their implications for archaeal lipid distributions in the marine environment[J]. Geochimica et Cosmochimica Acta, 2014, 471: 579-597. |
| [47] |
KUBO K, LLOYD K G, BIDDLE J F, et al. Archaea of the Miscellaneous Crenarchaeotal Group are abundant, diverse and widespread in marine sediments[J]. Isme Journal, 2012, 6(10): 1949-1965. DOI:10.1038/ismej.2012.37 |
| [48] |
KONNEKE M, BERNHARD A E, DE LA TORRE J R, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature, 2005, 437(7058): 543-546. DOI:10.1038/nature03911 |
| [49] |
LLOYD K G, SCHREIBER L, PETERSEN D G, et al. Predominant archaea in marine sediments degrade detrital proteins[J]. Nature, 2013, 496(7444): 215-218. DOI:10.1038/nature12033 |
| [50] |
BESSELING M A, HOPMANS E C, BOSCHMAN R C, et al. Benthic archaea as potential sources of tetraether membrane lipids in sediments across an oxygen minimum zone[J]. Biogeosciences, 2018, 15: 4047-4064. DOI:10.5194/bg-15-4047-2018 |
 2023, Vol. 47
2023, Vol. 47


