
文章信息
- 张卓, 杨波, 崔洲平, 林子燚, 谢子强, 郑惠娜, 廖宝林, 肖宝华, 朱春华. 2023.
- ZHANG Zhuo, YANG Bo, CUI Zhou-ping, LIN Zi-yi, XIE Zi-qiang, ZHENG Hui-na, LIAO Bao-lin, XIAO Bao-hua, ZHU Chun-hua. 2023.
- 亚热带珊瑚礁海域枯水季pCO2的分布特征及CO2汇源转换机制——以深圳杨梅坑海域为例
- Distribution characteristics of pCO2 and source-sink conversion mechanism of CO2 in a subtropical coral reef water during the dry season: A case study of the Yangmeikeng Sea area in Shenzhen, China
- 海洋科学, 47(11): 45-56
- Marine Sciences, 47(11): 45-56.
- http://dx.doi.org/10.11759/hykx20230426001
-
文章历史
- 收稿日期:2023-04-26
- 修回日期:2023-05-31
2. 广东海洋大学深圳研究院, 广东 深圳 518108;
3. 清华大学深圳国际研究生院, 广东 深圳 518055;
4. 广东海洋大学食品科技学院, 广东 湛江 524088
2. Shenzhen Institute of Guangdong Ocean University, Shenzhen 518108, China;
3. Shenzhen International Graduate School, Tsinghua University, Shenzhen 518055, China;
4. College of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524088, China
随着大气二氧化碳(CO2)浓度的升高, 全球变暖形势日益严峻。遏制全球变暖、保护地球生态环境迫在眉睫。中国是全球最大的CO2排放国, 但作为发展中国家发展永远是硬道理。中国不能以影响国民经济命脉为代价来进行硬性减排。因此, 增加碳汇(即CO2的吸收), 尤其是海洋碳汇, 有助于实现“不减产的减排”目标, 是助力中国实现碳达峰与碳中和目标的重要路径。
珊瑚礁生态系统作为“海洋中的热带雨林”具有强大的“碳捕获”能力, 是快速吸收大气CO2的天然反应池, 被称为海洋碳“增汇”的潜在场所[1-2]。然而, 由于珊瑚存在高效的碳代谢过程(珊瑚钙化和呼吸), 珊瑚礁海域CO2的汇/源属性仍存有争议。以往研究表明, 珊瑚礁海域通常作为大气CO2的源, 每年可释放0.005~0.08 Gt C的CO2, 平均为1.51 mol C/(m2·d)[3-4]。但需要强调的是, 上述CO2通量是基于少数珊瑚礁生态系统的调查结果获得。除此之外, 浮游植物的光合作用、微生物呼吸和礁栖生物碳代谢过程均会显著影响水体中总碱度(TA)和溶解性无机碳(DIC)的浓度, 从而改变整个珊瑚礁区CO2的源汇属性[5-6]。在不同季节不同珊瑚礁区, 上述过程均存在显著差异, 最终CO2的源汇属性也可能显著不同。
南海拥有数百个热带和亚热带珊瑚礁, 是近海碳循环的活跃区域。以往部分研究表明, 南海珊瑚礁是大气CO2的源[5-6], 但上述主要基于热带珊瑚礁的调查结果获得, 目前对亚热带珊瑚礁海域CO2的汇源特征及季节变化知之甚少。深圳地处珠江入海口东岸、毗邻香港, 其近岸海域受人类干扰剧烈。位于深圳东部的杨梅坑海域是典型的亚热带海域, 其沿岸分布众多珊瑚群落[7-8]。近些年, 受到沿岸人类活动与全球暖化的双重影响, 杨梅坑海域珊瑚种类及覆盖率急剧下降。本研究组前期调查结果显示, 调查海域珊瑚覆盖率由2010年的56%下降至2019年的36.5%。最新学术观点认为, 健康的珊瑚礁生态系统是大气CO2的汇, 而退化时则变成大气CO2的源[2]。因此, 杨梅坑海域珊瑚礁生态系统的健康状况及生物群落的代谢过程(光合作用、微生物呼吸和珊瑚代谢)可能是支配该海域CO2汇源属性的关键因素。受温度、盐度、光照等因素的影响, 杨梅坑海域生物群落的代谢特征存在显著的季节性差异[9-10], 可能导致CO2汇源属性的转变, 但目前未见相关的报道。因此, 本研究基于2022年11月(秋季)和2023年2月(冬季)对杨梅坑海域的碳酸盐体系进行了调查, 其目的是探究枯水季节典型亚热带珊瑚礁海水pCO2的分布特征及主要控制机制。
1 材料与方法 1.1 研究区域及样品采集杨梅坑海域位于大鹏半岛沿岸(图 1), 是深圳东部重要的珊瑚礁区域, 该海域礁区面积约93公顷, 造礁石珊瑚42种, 优势种为霜鹿角珊瑚(Acropora pruinosa)、澄黄滨珊瑚(Porites lutea)、指形鹿角珊瑚(Acropora digitifera)、黄癣蜂巢珊瑚(Favia favus)、肉质扁脑珊瑚(Platygyra carnosus)等[11]。研究海域海水深度为10~15 m, 周边无大河输入, 仅有一条季节性小河(杨梅河), 该海域海水全年处于一类水质标准, 适宜珊瑚生长[12]。
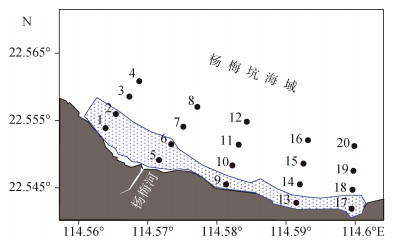 |
| 图 1 杨梅坑海域调查站位图 Fig. 1 Survey station map of Yangmeikeng sea area 注: 蓝色边框代表珊瑚礁区域 |
于2022年11月(秋季)和2023年2月(冬季), 对杨梅坑海域进行2个航次的调查, 每个航次均布设20个站位(图 1), 其中站位1、2、5、6、9、13和17位于珊瑚礁区域。调查项目包括温度、盐度、叶绿素a(Chl a)、溶解氧(DO)、pH和总碱度(TA)。用Niskin采水器采集表层和底层海水样品, 具体方法参考《Guide to Best Practices for Ocean CO2 measurements》[13]标准操作规范进行, 水样的采集顺序依次为: DO、pH和TA。pH样品盛装在50 mL硼硅酸盐玻璃瓶中(预先在马弗炉500 ℃灼烧6 h), 样品采集后在甲板上现场测定(采集后10 min以内测完)。TA样品盛装在100 mL高密度聚乙烯瓶(预先在5%HCl溶液中浸泡48 h, 用超纯水清洗3~5遍), 添加0.1%体积的饱和HgCl2固定并密封, 放置在阴凉处, 带回实验室分析。
1.2 分析方法采用多参数水质分析仪(美国YSI EXO2)确定水深, 并现场测定温度、盐度、DO和Chla, 4种参数的精确度分别为±0.05 ℃(温度)、±0.01(盐度)、±0.5 μmol/L(DO)和0.01 μg/L。调查期间采用滴定法和荧光分光光度法校正获得的DO和Chl a数据[14]。此外, 根据Weiss方程[15], 结合温度、盐度和DO数据计算海水表观耗氧量(AOU)。同时, 根据CADÉE等[16]提出的方法计算不同季节杨梅坑海域的初级生产力。
海水pH使用配备Orion®8107BNRoss组合电极的精密pH计现场测定, pH标度为总氢离子标度(pHT), 测量电极经由三羟甲基氨基甲烷(Tris)(25 ℃时, pH=8.093 6)和2-氨基吡啶(25 ℃时, pH=6.787)标准溶液进行校准, 精密度为±0.001 pH单位。海水TA测试前, 将待测样品静置(使悬浮颗粒物充分沉淀)并恒温至25 ℃(±0.1 ℃)。TA通过Gran滴定法测定, 每个样品平行测定3次, 平行样品间的相对偏差 < 0.1%。此外, 样品测试过程, 采用A. G. Dickson实验室提供的标准海水(Batch 190, 标称值: 2 218.31 μmol/L)进行质控分析[17], 标准海水TA的测定结果与标称值偏差 < 0.1%。
海水的DIC和CO2分压(pCO2)通过pHT、TA、水温和盐度, 利用二氧化碳信息分析中心提供的CO2SYS软件(CDIAC, http://cdiac.ornl.gov)计算获得[18]。计算中采用了LUEKER等[19]报道的碳酸的解离常数(K1和K2), DICKSON[20]报道的硼酸的第一表观离解常数(KB)和LEE等[21]报道的总硼酸浓度(BT)。此外, 在后续的生物过程讨论时(3.1.2章节), 为了消除混合作用和热力学效应对pCO2的干扰, 对pCO2进行温度和盐度的归一化处理, 其中pCO2@21.52℃表示温度(秋季和冬季的平均温度)归一化结果, 而npCO2@21.52℃表示温度(平均温度)和盐度(平均盐度)归一化处理后结果[22]。
1.3 室内培养实验 1.3.1 海水微生物呼吸实验为确定秋季和冬季海水微生物呼吸对pCO2的影响, 选取4个代表性站位(站位5、6、7和8)进行海水培养实验[22]。具体而言, 将GF/F滤膜过滤后海水移至培养瓶中, 其中一瓶加入1 mL饱和氯化汞溶液作为对照组, 另一瓶不做任何处理。实验在黑暗条件进行48 h, 每组设置3个平行, 温度为调查期间海水的平均温度(秋季: 23.5±0.5 ℃和冬季: 19.5±0.5 ℃)。分别在实验的第0、12、24、48 h测定培养系统中海水的DIC和TA浓度。微生物呼吸对海水DIC和TA的影响(RDIC和RTA)可以根据如下公式获得:
式中k0和k分别是对照组和样品组中DIC或TA(μmol/kg)对时间(h)的线性回归斜率。
1.3.2 珊瑚代谢实验与1.3.1方法类似, 通过分析珊瑚培养期间海水pHT和TA浓度的变化, 探究珊瑚代谢对海水pCO2的影响。实验珊瑚为杨梅坑海域前5优势种珊瑚(霜鹿角珊瑚、澄黄滨珊瑚、指形鹿角珊瑚、黄癣蜂巢珊瑚、肉质扁脑珊瑚)。分别在秋季和冬季调查期间采集上述珊瑚于培养箱中(培养箱装满现场海水), 并在2 h内运回实验室。同时, 采集80 L海水, 经GF/F滤膜过滤后带回实验室用于后续珊瑚培养实验。
到达实验室后, 将不同种类的珊瑚迅速转移到装有5 L过滤海水的密封玻璃缸中培养48 h(12 h光照/12 h黑暗)。另外, 选取仅加过滤海水的玻璃缸作为对照组。实验温度和光照条件设为调查期间的平均温度(秋季: 23.5±0.5 ℃和冬季: 19.5±0.5 ℃)和平均光照强度(秋季: 130 μmol/(m2·s)和冬季: 115 μmol/(m2·s))。珊瑚代谢对海水DIC和TA的影响(CpH和CTA)可以根据如下公式获得:
式中: DIC0(TA0)和DIC1(TA1)分别为实验初始和最终DIC(TA)测试值, 其中, DIC浓度是根据pHT、TA、水温和盐度, 利用二氧化碳信息分析中心提供的CO2SYS软件计算获得, V为培养海水的体积(L), ρ(kg/m3)为海水密度, t为实验时间(h), S为珊瑚块的表面积(cm2), 采用锡箔纸方法获得[11]。
1.4 数据处理 1.4.1 海-气界面CO2通量计算海-气界面CO2通量是研究碳循环最直接最重要的参数之一, 其计算公式如下:
其中K0是CO2的溶解度常数[23], k(单位: cm/h)是CO2的海气传输系数。在这项研究中, k是通过SWEENEY等[24-25]的Wanninkhof(1992)修订方程计算获得:
其中: Sc是海水中的Schmidt常数, 根据WANNINKHOF[25]报道的方程计算得出。u10是海面以上10 m的风速。本研究u10是从国家地球系统科学数据中心(http://ocean.geodata.cn)[26]获得。
1.4.2 秋、冬季pCO2控制的一维计算模型利用XUE等[27-28]提出的一维质量收支模型计算温度、海-气交换、混合过程和生物过程(光合作用、呼吸作用和珊瑚代谢)对海水pCO2季节变化的贡献。具体而言, 首先设定初始时间为t1, 此时海水温度(T)、盐度(S)和TA、DIC和pCO2分别为T1、S1、TA1、DIC1和pCO2-1。当时间增加到t2时, 这些参数变为T2、S2、TA1、DIC1和pCO2-2。从t1到t2过程中, TA、DIC和pCO2的变化可表示为:
式中: “温度”、“混合”、“海气”和“生物”分别表示温度变化、混合过程、海气交换、生物过程的影响。当计算温度对pCO2的影响时, 保持DIC和TA恒定, 仅改变CO2SYS软件系统中温度的大小, 计算pCO2的变化:
因此, 这里的温度效应指热力学效应(物理过程)。由于该过程对温度影响进行了量化, 因此接下来计算海气交换、混合作用和生物过程的影响时, 需在等温条件下进行处理。例如, 对于混合过程:
CO2海气交换过程能够改变海水中DIC的浓度, 对TA不产生影响, 该过程对pCO2的贡献可通过如下公式获得:
式中: ρ为海水密度, H是海水混合层深度。最后剩余的过程可假设为生物过程影响, 其主要包括光合作用、呼吸作用和珊瑚代谢过程。生物过程对pCO2的影响可通过以下公式获得:
调查期间, 海水温度、盐度、Chla和DO值的范围分别为18.7~25.1 ℃、31.0~33.2、0.11~7.05 μg/L和203.4~ 237.8 μmol/L。如图 2所示, 秋、冬季海水温度和盐度随着深度的增加变化较小, 而秋季海水DO含量随着深度的增加显著降低(图 2)。空间分布来看, 表、底层海水温度在秋季呈现近岸高、远岸低的分布趋势; 而冬季表层海水呈现东高、西低的分布特征, 底层温度未见明显的空间差异(图 3a~3d)。对于海水盐度, 其分布较为均匀, 整体位于32~33, 仅在秋季杨梅河口处发现一个极小值(31.0), 表明陆源输入影响较小。
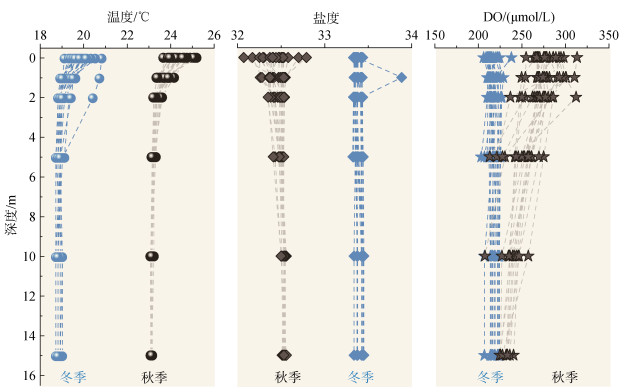 |
| 图 2 海水温度、盐度和DO的浓度特征 Fig. 2 Concentration characteristics of temperature, salinity and DO intheseawater |
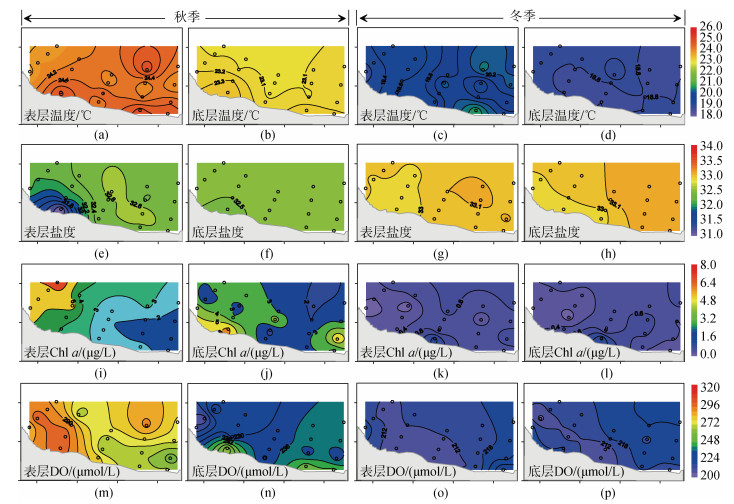 |
| 图 3 表、底层海水温度(a)、盐度(b)、Chla(c)和DO(d)的水平分布 Fig. 3 The horizontal distribution characteristics of temperature (a), salinity (b), Chl a (c) and DO (d) in surface and bottom seawater |
如图 3i~3p所示, 在不同季节, 表、底层海水Chla和DO的含量及分布呈现明显的差异。其中, 秋季海水Chla的含量(表层: 3.28±1.70 μg/L, 底层: 3.20±1.30 μg/L)显著高于冬季(0.45±0.22和0.46±0.23 μg/L)。空间分布来看, 秋季Chla整体呈现西部高于东部的分布特征, 而冬季Chla未呈现明显的空间变化。
与Chla变化类似, 秋季海水DO含量显著高于冬季。空间上, 秋季表层海水DO呈现西高、东低的分布特征, 而底层呈现近岸高于远岸的分布趋势。相比较而言, 冬季海水DO的空间差异不显著(图 3m~3p)。
2.2 主要无机碳参数 2.2.1 TA、DIC和pHT秋季表、底层海水TA的变化范围为1 976.7~ 2 221.6 µmol/kg, 平均值为2 167.3±49.6 µmol/kg(表层)和2 181.3±12.5 µmol/kg(底层)。相比较, 冬季海水TA的变化较小, 其浓度范围为2 190.7~2 233.1 µmol/kg, 表、底层平均值为2 214.0±8.4和2 220.4±9.7 µmol/kg。水平分布来看, 秋季表、底层海水和冬季底层海水TA整体呈现近岸低、远岸高的分布特征, 这与冬季表层海水呈相反的分布趋势(图 4a~4d)。
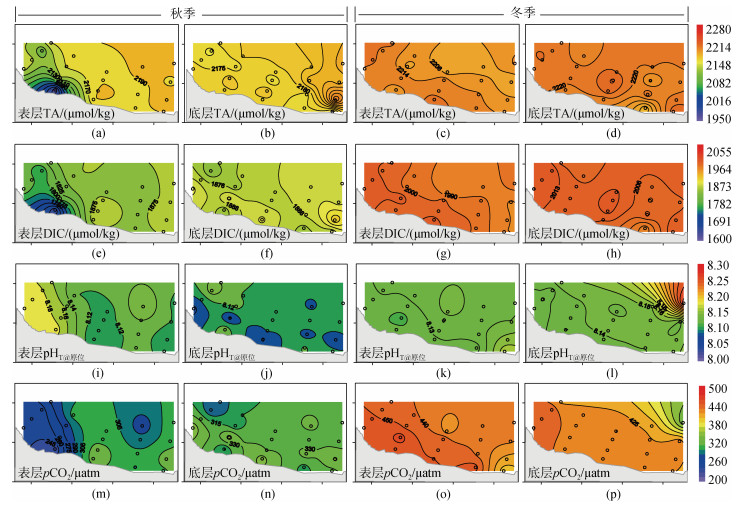 |
| 图 4 表、底层海水TA(a~d)、DIC(e~h)和pHT(i~l)的水平分布特征 Fig. 4 The horizontal distribution characteristics of TA (a~d), DIC (e~h) and pHT in surface and bottom seawater |
海水DIC浓度变化范围为1 655.3~2 020.2 µmol/kg, 秋、冬季表层(底层)DIC的平均值分别为1 847.9±55.4 (1 887.2±18.4)和1 999.1±12.4(2 008.1±9.6)µmol/kg。与TA的分布相似, 秋季表、底层海水和冬季底层海水DIC整体呈现近岸低、远岸高的分布特征。
调查海域海水pHT的变化范围为8.074~8.200。秋季表层海水pHT呈现西部向东部递减的分布趋势, 这与DO的分布相一致(图 3m和图 4i), 而在其他季节海水pHT的空间变化不明显(图 4f~4h)。
2.2.2 pCO2和FCO2当海水中pCO2的值高于大气值时(2022年约417.06 ppm/μatm, ftp://aftp.cmdl.noaa.gov/products/trends/co2/co2_annmean_gl.txt), 海水向大气释放CO2。本研究秋季海水pCO2值的变化范围为233.6~355.6 µatm, 平均为294.2±30.1 µatm(表层)和323.3± 20.0 µatm(底层)。因此, 在该季节, 调查海域整体表现为大气CO2的汇, 其FCO2值为–2.52~–1.17 mmol C/(m2·d)(平均: –1.66± 0.40 mmol C/(m2·d))。从空间分布来看, 表层pCO2与FCO2整体呈现西部向东部递增的分布趋势, 这与pHT的分布趋势相反(图 4e和图 5a和5e)。
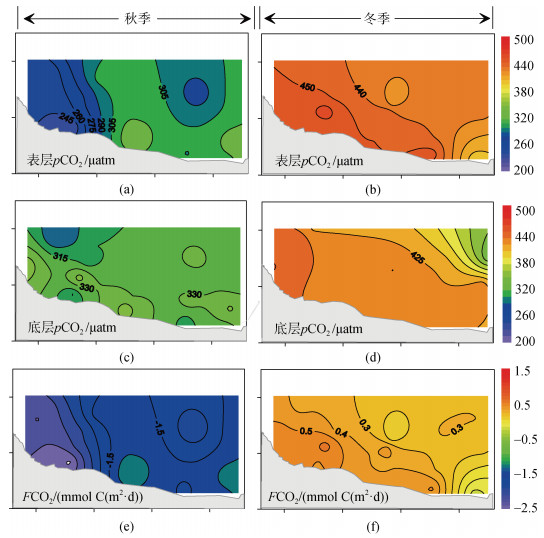 |
| 图 5 表、底层pCO2(a~d)含量和FCO2(e, f)的水平分布特征 Fig. 5 The horizontal distribution characteristics of surface and bottom pCO2 (a~d) and FCO2 (e, f) in seawater |
到了冬季, 海水pCO2显著升高, 其范围为404.2~465.3 µatm, 平均为442.6±13.4 µatm(表层)和433.4±10.3 µatm(底层)。与秋季相反, 冬季杨梅坑海域整体表现为大气CO2的弱源(站位17除外), 其FCO2值为–0.14~0.65 mmol C/(m2·d)(平均: 0.36± 0.17 mmol C/(m2·d))。从空间分布来看, 表层pCO2与FCO2呈现近岸向远岸递减的分布特征(图 4e和图 5b和5f)。
2.3 室内培养实验结果通过分析培养实验期间海水TA和DIC浓度的变化, 探究微生物呼吸和珊瑚代谢过程(光合、呼吸和钙化)对海水pCO2的贡献, 具体结果如图 6所示。其中, 秋季和冬季海水微生物呼吸每天可降低海水TA的浓度为0.66±0.16和0.73±0.21 µmol/kg; 提高海水DIC的浓度为4.09±1.02和4.34±3.27 µmol/kg。
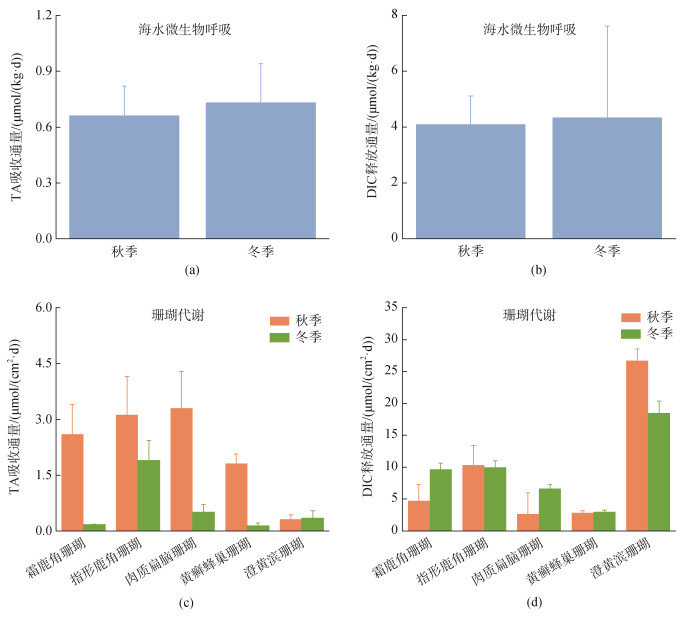 |
| 图 6 秋季和冬季微生物和珊瑚代谢对TA(a和c)/DIC(b和d)的吸收/释放通量 Fig. 6 The uptake/release fluxes of TA (a and c) / DIC (b and d) by microorganisms and coral metabolism in autumn and winter |
此外, 秋季(冬季)霜鹿角珊瑚、指形鹿角珊瑚、肉质扁脑珊瑚、黄癣蜂巢珊瑚和澄黄滨珊瑚的代谢过程对TA的吸收通量为2.60±0.80(0.17±0.01)、3.12±1.03(1.90±0.54)、3.30±0.98(0.50±0.21)、1.81±0.26 (0.14±0.07)和0.31±0.12(0.35±0.20)µmol/(cm2/d), DIC的释放通量为4.73±2.60(9.68±0.97)、10.31±3.12(10.01±1.00)、2.67± 3.30(6.67±0.67)、2.86±0.32(2.99±0.30)和26.71±1.81 (18.51±1.85)L/(cm2/d)。
3 讨论 3.1 秋、冬季海水pCO2变化的影响因素分析近岸珊瑚礁海水pCO2通常受到温度、盐度(咸淡水混合)、生物活动等多因素的共同影响[22, 29]。由于这些因素之间也存在着相互作用, 因此不同海域和季节海水pCO2的主要影响因素可能有所不同。
3.1.1 温度和盐度温度是海水碳酸盐体系最主要的影响因素之一。通常温度对海水pCO2具有双重影响: 一方面, 温度的变化会影响海水CO2的溶解度和碳酸盐的解离平衡, 即温度升高、CO2溶解度降低, 引起pCO2增高; 另一方面, 温度能够影响海水中生物的代谢活动(微生物呼吸、光合作用、珊瑚代谢等), 进而调节pCO2变化[22, 30-31]。
如图 7a所示, 调查期间pCO2与温度呈现显著性负相关(P < 0.001, n=80)。很显然, 热力学效应(物理溶解)不能解释pCO2的季节变化趋势(呈相反趋势)。这说明温度影响下的生物过程(例如光合作用和呼吸作用)可能是驱动pCO2季节变化的主要因素。在秋季, 调查海域海水温度适中(约24 ℃), 适宜浮游植物的繁殖, 该阶段具有较高的初级生产(Chl a: 3.24±1.29 μg/L), 能够大量吸收海水中的CO2。相比较, 冬季温度较低(约19℃), 初级生产较低(Chl a: 0.46±0.22μg/μg/L)(图 3), 吸收CO2的能力较弱。此外, 室内模拟实验结果表明, 秋季和冬季微生物呼吸对海水pCO2的影响并未呈现明显的差异(图 6)。尽管珊瑚代谢对TA和DIC的吸收/释放有显著差异, 但该过程对杨梅坑海域TA和DIC的影响较小(具体见3.1.3小节)。因此, 综合来看, 秋、冬季温度影响下的初级生产的差异可能是导致pCO2变化的主要因素。
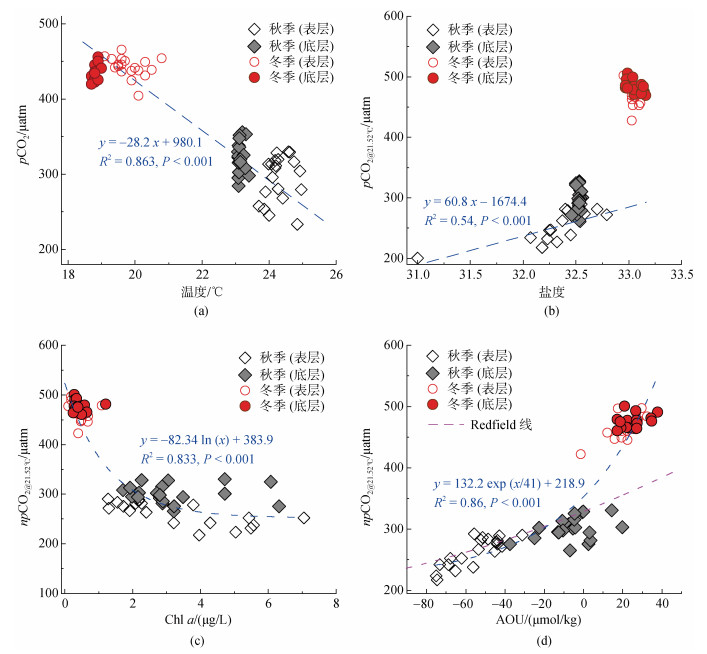 |
| 图 7 表、底层pCO2和温度(a)、盐度(b)、Chla(c)和AOU(d)的关系 Fig. 7 The relationship between pCO2 and temperature (a), salinity (b), Chla (c) and AOU (d) in surface and bottom seawater |
此外, 在近岸海域, 陆源淡水输入通常能够改变海水TA和DIC的浓度, 进而影响海水pCO2的分布, 而盐度能够有效指示淡盐水混合过程[32]。本研究秋季表层海水pCO2与盐度呈现显著的线性关系(y=60.8 x–1 674.4, P < 0.01, n=20; 图 7b), 表明陆源输入对pCO2空间分布具有重要影响。然而, 我们发现冬季海水pCO2值远远高于咸淡水混合线(y=60.8 x–1 674.4)趋势(图 7b), 说明存在其他因素的显著影响[22]。
3.1.2 光合作用和微生物呼吸藻类的光合作用可用以下公式来描述: 106CO2+ 122H2O+16HNO3+H3PO4→(CH2O)106(NH3)16H3PO4+138O2。光合作用可降和提高海水中DIC和TA的浓度, 进而调节海水的pCO2[29]。本研究总体来看, Chl a与npCO2@21.52℃呈现显著性负相关(P < 0.001, n=80; 图 7c), 指示浮游植物光合作用的显著影响[22]。此外, 微生物呼吸过程与光合作用相反, 即(CH2O)106(NH3)16H3PO4+ 138O2→106CO2+122H2O+16HNO3+H3PO4, 该过程能够增加海水中的DIC浓度, 降低TA浓度, 进而提升海水的pCO2[29]。
AOU通常是指示生物活动(光合作用和呼吸作用)的关键指标, 当AOU < 0时, 海洋系统中有机质的生物地球化学以光合作用为主, 而如果AOU > 0, 则以呼吸为主[33]。杨梅坑海域秋季和冬季海水AOU的结果分别为–30.52±27.72和23.45±7.00 μmol/kg, 表明秋季以光合作用为主, 而冬季以呼吸作用为主。此外, 如图 7d所示, AOU与npCO2@21.52℃呈现显著性正相关(P < 0.001, n=80), 说明生物过程(光合作用和呼吸作用)是控制pCO2季节变化的主要因素。其中, 秋季npCO2@21.52℃-AOU之间的分布模式遵循REDFIELD[34]线的变化趋势(图 7d), 指示浮游植物光合作用/海源有机质分解的主导作用[35]。而有趣的是, 冬季npCO2@21.52℃-AOU之间的分布模式明显偏离REDFIELD线的变化趋势, 这可能受到其他因素的影响, 例如海气交换和珊瑚及其他礁栖生物的代谢过程。此外, 调查区域与外海水平交换过程也可能是影响pCO2变化及分布的重要原因[36], 但遗憾的是, 本次调查未获得该过程的有效数据。
此外, 根据秋、冬季杨梅坑海域的初级生产力和微生物呼吸结果初步量化了不同季节生物过程对TA、DIC和pCO2的贡献[22]。结果表明, 秋季(11月)杨梅坑海域浮游植物光合作用每天可降低海水DIC浓度为5.14 μmol/kg, 并增加TA浓度为0.82 μmol/kg; 而微生物呼吸可增加DIC浓度为4.09 μmol/kg, 降低TA浓度为0.66 μmol/kg。综合来看, 生物过程(光合作用和呼吸作用)每天能够降低海水DIC浓度为1.05 μmol/kg, 增加TA浓度为0.16 μmol/kg。因此, 秋季生物过程每天可导致杨梅坑海域pCO2降低1.63μatm。
相比较, 冬季调查海域的初级生产力明显低于秋季, 该季节浮游植物光合作用每天仅降低海水DIC浓度为1.37 μmol/kg, 增加TA的浓度为0.22 μmol/kg; 而冬季微生物呼吸结果与秋季相当, 即每天增加DIC浓度为4.34 μmol/kg, 降低TA浓度为0.73 μmol/kg。因此, 冬季生物过程每天能够升高海水DIC浓度为2.97 μmol/kg, 降低TA浓度为0.51μmol/kg, 最终导致pCO2每天升高9.35 μatm。因此, 正如3.1.1章节所述, 秋、冬季杨梅坑海域初级生产力的季节差异可能是导致pCO2显著变化的主要因素。
3.1.3 珊瑚代谢对海水中pCO2的影响与微生物呼吸类似, 珊瑚代谢(光合、呼吸和钙化)过程能够降低和增加礁区海水TA和DIC浓度进而调节海水pCO2[5, 6, 37]。根据室内培养结果结合杨梅坑海域珊瑚分布状况初步估算珊瑚代谢对调查海域海水TA和DIC的贡献。整体来看, 珊瑚代谢过程对杨梅坑海域TA和DIC的影响较小; 其中, 秋季珊瑚代谢过程每天仅降低和升高TA和DIC浓度为0.06和0.43 μmol/kg, 而冬季珊瑚代谢过程每天仅降低和升高TA和DIC浓度为0.03和0.41 μmol/kg。因此, 从整个调查海域来看, 珊瑚代谢过程对海水TA和DIC的影响较小, 仅占微生物呼吸的4%~10%。
然而, 由图 5b可看出, 珊瑚礁区内的pCO2显著高于礁区外部, 这说明珊瑚代谢过程对礁区pCO2作用更为显著。假设珊瑚的代谢仅对礁区内部的pCO2产生影响(忽略礁区内、外海水交换过程)。在此情况, 秋季珊瑚代谢过程每天可降低和升高TA和DIC浓度为0.14和1.82 μmol/kg, 而冬季珊瑚代谢过程每天可降低和升高TA和DIC浓度为0.41和1.90 μmol/kg, 占微生物呼吸的21%~56%。因此, 局部海域珊瑚代谢作用可能对pCO2产生重要影响, 不能忽视。
3.2 一维模型揭示秋、冬季CO2源汇转变的控制机制如图 8a所示, 杨梅坑海域冬季海水pCO2显著高于秋季。此外, FCO2结果表明, 该海域秋季表现为大气CO2的汇, 其吸收通量为1.66±0.41 mmol C/(m2·d); 而冬季表现为大气CO2的弱源, 其释放通量为0.65± 0.14 mmol C/(m2·d)(图 8a)。物理过程(温度和盐度)和生物过程(光合作用、微生物呼吸和珊瑚代谢)共同影响pCO2的变化, 控制研究海域CO2的源汇属性。为了进一步阐明上述各个过程的贡献, 本研究利用一维质量收支模型, 计算了温度、海-气交换、盐度(混合作用)和生物活动(光合作用、微生物呼吸和珊瑚代谢)对表、底层海水pCO2季节变化(秋、冬季)的贡献。
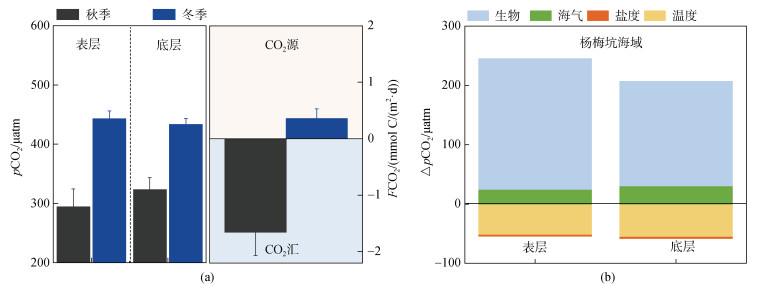 |
| 图 8 秋、冬季表、底层海水pCO2和FCO2值(a)以及不同过程(生物过程、珊瑚代谢、海气交换、盐度以及温度变化)对pCO2变化的贡献(b) Fig. 8 The pCO2 and FCO2 values of surface and bottom seawater in autumn and winter (a), and the contribution of different processes (biological processes, coral metabolism, air-sea exchange, salinity and temperature changes) to pCO2 changes (b) |
由图 8b结果看出, 生物过程(光合作用、呼吸作用和珊瑚代谢)是导致杨梅坑海域pCO2增加的主要因素, 其贡献了pCO2总变化量的73.6%(表层)和66.5%(底层), 而CO2海气交换过程占总变化量的8.3%和11.6%。如前所述, 冬季初级生产力降低是诱导杨梅坑海域CO2源-汇转变的关键驱动因素。这可能是由于该季节温度较低所导致。相反, 冬季温度的降低(约4℃)导致表、底层海水pCO2下降52.5和56.1 μatm, 占pCO2总变化量的17.5%和21.2%, 而盐度(混合作用)对海水pCO2变化的贡献甚微(< 1%)。因此, 综合来看, 杨梅坑海域生物过程, 尤其是浮游植物光合作用的季节变化是导致秋、冬季CO2源-汇转变的主控因素。
4 结论秋季和冬季(枯水季节)杨梅坑海域pCO2的变化较大, 范围为233.3~465.3 μatm。秋季表现为大气CO2的汇, 其吸收通量为1.66±0.41 mmol C/(m2·d); 冬季表现为大气CO2的弱源, 其释放通量为0.36± 0.17 mmol C/(m2·d)。
季节性温度影响下的生物活动变化(尤其是光合作用)是导致海水CO2源汇转变的主要成因。在秋季, 海水温度适中(约24 ℃), 浮游植物繁殖旺盛, 初级生产较高, 能够大量吸收大气中的CO2; 相比较, 冬季温度较低(约19 ℃), 初级生产较低, 该过程吸收大气CO2的能力相对较弱。
珊瑚的代谢活动对礁区pCO2产生一定影响, 占微生物呼吸的21%~56%。
| [1] |
KUWAE T, HORI M. Blue carbon in shallow coastal ecosystems[M]. Singapore: Springer, 2019: 273-293.
|
| [2] |
石拓, 郑新庆, 张涵, 等. 珊瑚礁: 减缓气候变化的潜在蓝色碳汇[J]. 中国科学院院刊, 2021, 36(3): 270-278. SHI Tuo, ZHENG Xinqing, ZHANG Han, et al. Coral reefs: potential blue carbon sinks for climate change mitigation[J]. Bulletin of Chinese Academy of Sciences (Chinese Version), 2021, 36(3): 270-278. |
| [3] |
SUZUKI A, KAWAHATA H. Carbon budget of coral reef systems: An overview of observations in fringing reefs, barrier reefs and atolls in the Indo-Pacific regions[J]. Tellus B: Chemical and Physical Meteorology, 2003, 55(2): 428-444. DOI:10.3402/tellusb.v55i2.16761 |
| [4] |
BORGES A V, DELILLE B, FRANKIGNOULLE M. Budgeting sinks and sources of CO2 in the coastal ocean: Diversity of ecosystems counts[J]. Geophysical Research Letters, 2005, 32(14): 1-4. |
| [5] |
YAN H, YU K, SHI Q, et al. Seasonal variations of seawater pCO2 and sea-air CO2 fluxes in a fringing coral reef, northern South China Sea[J]. Journal of Geophysical Research: Oceans, 2016, 121(1): 998-1008. DOI:10.1002/2015JC011484 |
| [6] |
YAN H Q, YU K F, SHI Q, et al. Coral reef ecosystems in the South China Sea as a source of atmospheric CO2 in summer[J]. Chinese Science Bulletin, 2011, 56: 676-684. DOI:10.1007/s11434-011-4372-8 |
| [7] |
XU M, WANG X, XI R, et al. Characteristics of nutrients and eutrophication assessment of shenzhen offshore waters[C]//IOP Conference Series: Earth and Environmental Science. IOP Publishing, 2018, 153(6): 062038.
|
| [8] |
ZHAO Y, LAW Y S, ZHAI X, et al. Urban coral communities and water quality parameters along the coasts of Guangdong Province, China[J]. Marine Pollution Bulletin, 2022, 180: 113821. DOI:10.1016/j.marpolbul.2022.113821 |
| [9] |
张崧, 孙现领, 王为, 等. 广东深圳大鹏半岛海岸地貌特征[J]. 热带地理, 2013, 33(6): 647-658. ZHANG Song, SUN Xianling, WANG Wei, et al. Features of coastal landforms in Dapeng Peninsula of Shenzhen, China[J]. Trop Geogr, 2013, 33(6): 647-658. |
| [10] |
韩婷婷, 齐占会, 吴风霞, 等. 大亚湾不同海洋功能区表层海水无机碳体系的比较研究[J]. 热带海洋学报, 2016, 35(2): 57-65. HAN Tingting, QI Zhanhui, WU Fengxia, et al. Comparative study of dissolved inorganic carbon systems of surface waters in various oceanic functional areas of Daya Bay[J]. Journal of Tropical Oceanography, 2016, 35(2): 57-65. |
| [11] |
YANG B, ZHANG Z, CUI Z, et al. Multiple factors driving carbonate system in subtropical coral community environments along Dapeng Peninsula, South China Sea[J]. Atmosphere, 2023, 14(4): 688. DOI:10.3390/atmos14040688 |
| [12] |
郭峰, 肖家光, 田鹏等. 大亚湾及大鹏半岛沿岸造礁石珊瑚现状与生态脆弱性评价[J]. 应用海洋学学报, 2022, 41(4): 568-582. GUO Feng, XIAO Jiaguang, TIAN Peng, et al. Status of scleractinian corals in Daya Bay and along the coast of Dapeng Bay[J]. Journal of Applied Oceanography, 2022, 41(4): 568-582. DOI:10.3969/J.ISSN.2095-4972.2022.04.002 |
| [13] |
DICKSON A G, SABINE C L, CHRISTIAN J R. Guide to best practices for ocean CO2 measurements[M]. Seattle: North Pacific Marine Science Organization, 2007.
|
| [14] |
GRASSHOFF K, KREMLING K, EHRHARDT M. Methods of seawater analysis[M]. Wiley‐VCH Verlag GmbH: John Wiley & Sons, 2009.
|
| [15] |
WEISS R F. The solubility of nitrogen, oxygen and argon in water and seawater[J]. Deep Sea Research A, 1970, 17(4): 721-735. |
| [16] |
CADEE G C, HEGEMAN J. Primary production of phytoplankton in the Dutch Wadden Sea[J]. Netherlands Journal of Sea Research, 1974(2/3): 240-255. |
| [17] |
CAI W J, DAI M, WANG Y, et al. The biogeochemistry of inorganic carbon and nutrients in the Pearl River estuary and the adjacent Northern South China Sea[J]. Continental Shelf Research, 2004, 24(12): 1301-1319. DOI:10.1016/j.csr.2004.04.005 |
| [18] |
PELLETIER G J, LEWIS E, WALLACE D. A calculator for the CO2 system in seawater for Microsoft Excel/VBA[Z]. Olympia: Washington State Department of Ecology, 2005.
|
| [19] |
LUEKER T J, DICKSON A G, KEELING C D. Ocean pCO2 calculated from dissolved inorganic carbon, alkalinity, and equations for K1 and K2: validation based on laboratory measurements of CO2 in gas and seawater at equilibrium[J]. Marine Chemistry, 2000, 70(1/3): 105-119. |
| [20] |
DICKSON A G. Standard potential of the (AgCl(s)+ 1/2H2 (g)=Ag(s)+ HCl(aq)) cell and the dissociation constant of bisulfate ion in synthetic sea water from 273.15 to 318.15 K[J]. Journal of Chemical Thermo dynamics, 1990, 22: 113-127. DOI:10.1016/0021-9614(90)90074-Z |
| [21] |
LEE K, KIM T W, BYRNE R H, et al. The universal ratio of boron to chlorinity for the North Pacific and North Atlantic oceans[J]. Geochimica et Cosmochimica Acta, 2010, 74(6): 1801-1811. DOI:10.1016/j.gca.2009.12.027 |
| [22] |
YANG B, GAO X, ZHAO J, et al. Massive shellfish farming might accelerate coastal acidification: A case study on carbonate system dynamics in a bay scallop (Argopectenirradians) farming area, North Yellow Sea[J]. Science of the Total Environment, 2021, 798: 149214. DOI:10.1016/j.scitotenv.2021.149214 |
| [23] |
WEISS R F. Carbon dioxide in water and seawater: the solubility of a non-ideal gas[J]. Marine Chemistry, 1974, 2(3): 203-215. DOI:10.1016/0304-4203(74)90015-2 |
| [24] |
SWEENEY C, GLOOR E, JACOBSON A R, et al. Constraining global air-sea gas exchange for CO2 with recent bomb 14C measurements[J]. Global Biogeochemical Cycles, 2008, 21(2): 1-10. |
| [25] |
WANNINKHOF R. Relationship between wind speed and gas exchange over the ocean[J]. Journal of Geophysical Research: Oceans, 1992, 97(C5): 7373-7382. DOI:10.1029/92JC00188 |
| [26] |
国家地球系统科学数据中心. 珠江口水文气象桩基平台气象观测数据集[EB/OL]. 2022[2023.3.15]. http://ocean.geodata.cn. South China Sea and Adjacent Seas Data Center, Meteorological observation data set observed by hydrometeorological platform in Pearl River Estuary [EB/OL]. 2022 [2023.3.15]. http://ocean.geodata.cn. |
| [27] |
XUE L, CAI W J, HU X, et al. Sea surface carbon dioxide at the Georgia time series site (2006–2007): Air–sea flux and controlling processes[J]. Progress in Oceanography, 2016, 140: 14-26. DOI:10.1016/j.pocean.2015.09.008 |
| [28] |
XUE L, CAI W J, SUTTON A J, et al. Sea surface aragonite saturation state variations and control mechanisms at the Gray's Reef time-series site off Georgia, USA (2006–2007)[J]. Marine Chemistry, 2017, 195: 27-40. DOI:10.1016/j.marchem.2017.05.009 |
| [29] |
CAI W J, HU X, HUANG W J, et al. Acidification of subsurface coastal waters enhanced by eutrophication[J]. Nature Geoscience, 2011, 4(11): 766-770. DOI:10.1038/ngeo1297 |
| [30] |
TAKAHASHI T, SUTHERLAND S C, SWEENEY C, et al. Global sea–air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2002, 49(9-10): 1601-1622. DOI:10.1016/S0967-0645(02)00003-6 |
| [31] |
PIPKO I I, PUGACH S P, LUCHIN V A, et al. Surface CO2 system dynamics in the Gulf of Anadyr during the open water season[J]. Continental Shelf Research, 2021, 217: 104371. DOI:10.1016/j.csr.2021.104371 |
| [32] |
ZHAI W D, CHEN J F, JIN H Y, et al. Spring carbonate chemistry dynamics of surface waters in the northern East China Sea: Water mixing, biological uptake of CO2, and chemical buffering capacity[J]. Journal of Geophysical Research: Oceans, 2014, 119(9): 5638-5653. DOI:10.1002/2014JC009856 |
| [33] |
BENSON B B, KRAUSE Jr D. The concentration and isotopic fractionation of oxygen dissolved in freshwater and seawater in equilibrium with the atmosphere[J]. Limnology and Oceanography, 1984, 29(3): 620-632. DOI:10.4319/lo.1984.29.3.0620 |
| [34] |
REDFIELD A C. The biological control of chemical factors in the environment[J]. American Scientist, 1958, 46(3): 230A-221. |
| [35] |
ANDERSON L A, SARMIENTO J L. Redfield ratios of remineralization determined by nutrient data analysis[J]. Global Biogeochemical Cycles, 1994, 8(1): 65-80. DOI:10.1029/93GB03318 |
| [36] |
CHOI Y, KIM D, NOH J H, et al. Contribution of Changjiang River discharge to CO2 uptake capacity of the Northern East China Sea in August 2016[J]. Continental Shelf Research, 2021, 215: 104336. DOI:10.1016/j.csr.2020.104336 |
| [37] |
SUZUKI A, KAWAHATA H. Partial pressure of carbon dioxide in coral reef lagoon waters: comparative study of atolls and barrier reefs in the Indo-Pacific Oceans[J]. Journal of Oceanography, 1999, 55: 731-745. DOI:10.1023/A:1007872314591 |
 2023, Vol. 47
2023, Vol. 47


