文章信息
- 石凤, 周玉婷, 李佳霖, 高会旺, 秦松. 2023.
- SHI Feng, ZHOU Yu-ting, LI Jia-lin, GAO Hui-wang, QIN Song. 2023.
- 海洋聚球藻对不同硝酸盐浓度的响应特征
- Response characteristics of marine Synechococcus under different nitrate concentrations
- 海洋科学, 47(11): 110-120
- Marine Sciences, 47(11): 110-120.
- http://dx.doi.org/10.11759/hykx20220706001
-
文章历史
- 收稿日期:2022-07-06
- 修回日期:2022-10-18
2. 中国科学院烟台海岸带研究所 海岸带生物学与生物资源保护重点实验室, 山东 烟台 264003;
3. 烟台大学 生命科学学院, 山东 烟台 264005
2. Key Lab of Coastal Biology and Biological Resource Conservation, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China;
3. College of Life Sciences, Yantai University, Yantai 264005, China
20世纪80年代以来, 由于人类活动以及全球气候变化的影响, 中国近海尤其是渤海湾、长江口、珠江口等多个海域出现富营养化现象, 浮游生态系统有害藻华频发。近十年来, 中国在发展经济的同时, 注重环境治理, 近海营养盐浓度有所降低, 部分海域监测到寡营养化现象的发生, 近海营养盐水平波动明显[1]。氮是营养盐中限制浮游植物生长的主要因子, 氮源浓度的变化可以导致浮游植物的生物量及群落结构发生改变[2-3]。由于氮源的不断输入, 长江口浮游植物以叶绿素a表征的年平均生物量在20世纪80年代初约为1.5 μg·L–1, 至2016年已增加到3.0 μg·L–1左右[4]。同时长江口浮游植物的种群组成也发生了变化, 硅藻的相对丰度逐渐降低, 而鞭毛藻的相对丰度呈现逐渐增加的趋势[5]。硝酸盐是海水中的主要氮源, 在近海海水中的浓度约为铵态氮的4倍, 已有研究表明其浓度变化对浮游藻类具有显著影响。在较高硝酸盐浓度下进行培养, 东海原甲藻和三角褐指藻的生物量和生长周期表现出明显差异, 释放挥发性卤代烃碘甲烷的能力受到抑制[6]。微小亚历山大藻在高氮磷比条件下能够快速进入指数生长期, 较高的硝酸盐浓度可以促进藻毒素在胞内和胞外的累积, 使赤潮产生的环境危害增大[7]。目前关于硝酸盐对浮游植物影响的研究大多关注真核生物, 硝酸盐对微微型原核藻类的影响尚不明确。
聚球藻(Synechococcus)是一种典型的微微型原核蓝藻, 在全球海洋内分布广泛且丰度较高, 年生物量达(7.0±0.3)×1026 cells。聚球藻是海洋中重要的初级生产者, 对海洋微食物网具有关键支撑作用, 根据每小时固碳率进行估计, 其年净初级生产力贡献约为8×109 t·C, 占海洋净初级生产力的16.7%[8]。聚球藻周转迅速, 受水平基因转移影响, 其对环境变化的适应能力强, 表现出明显的适应性响应特征。通过生态模型的预测发现, 当温度升高至30 ℃时, 聚球藻生物量将增加13.9%[8]。随着CO2浓度升高, 不同生长期聚球藻的生理响应特征存在差异, 指数生长期的聚球藻光合作用能力增强, 而稳定期的聚球藻光合作用能力减弱[9]。聚球藻在近海海域的生物地理分布是适应性响应的重要表征, 在多个海域的研究发现硝酸盐浓度是影响其分布的重要环境因子[10-11]。
在中国近海海域, 聚球藻是浮游植物的主要种群, 丰度范围为102~105 cells·mL–1。作为近海微型浮游动物的主要食物来源, 聚球藻在黄海中部的被捕食率高达44.4%~72.4%, 其种群变化能够改变底层食物网的生态承载力进而影响生态系统[12]。渤海和黄海地处中国东部陆架海, 是西太平洋典型的半封闭大陆边缘海, 其营养盐浓度受人类活动的影响较大。为探究硝酸盐浓度变化对聚球藻的影响, 本研究从渤黄海采集原位聚球藻进行富集培养, 通过硝酸盐浓度控制的室内模拟培养实验, 探究不同硝酸盐浓度下聚球藻的生长、光合生理参数和碳氮含量等的变化, 旨在阐明不同硝酸盐浓度下聚球藻种群的响应特征, 为进一步探讨聚球藻的环境指示作用及生态反馈效应提供科学依据。
1 材料与方法 1.1 样品采集与富集培养原位聚球藻于2020年8月在渤海B12(38.87°N, 119.67°E)和黄海H19(33.00°N, 124.01°E)站位采集。利用CTD采样器(Sea-Bird 911Plus, Sea-Bird, 美国)采集2~5 m水深的海水100 mL, 经48 μm筛绢预过滤后用3 μm针管过滤器过滤至含放线菌酮(0.05 mg·mL–1)的50 mL SNAX培养基中进行富集培养。富集培养条件为: 温度25 ℃, 光照强度50 μmol·m–2·s–1, 光照周期12D: 12L。
1.2 培养实验方法在无菌条件下, 分别将100 mL的富集培养藻液B12和H19于7 386 r/min、4 ℃条件下离心20 min, 接种于无氮组分海盐(Aquavitro, 美国海化)配制的1 L改良的SNAX培养基中(硝酸盐浓度为实验组浓度, 铵盐浓度为1.0 μmol·L–1, 其余成分浓度不变)。参照实际海域营养盐状况[13], 实验设置4个硝酸盐浓度组, 分别为0.1、1.0、10.0、100.0 μmol·L–1, 每个实验组设置3个平行。实验从第6 d开始采取半连续培养方式, 每间隔24 h从培养瓶中取出250 mL培养基并补充250 mL新鲜培养基。实验持续15 d, 期间每24 h测定藻细胞密度, 至实验结束测定聚球藻的色素含量、光合作用参数以及体系中的碳氮含量。
1.3 分析测定方法 1.3.1 聚球藻富集样品的鉴定取富集样品1.40 mL, 加入多聚甲醛(终浓度为0.5%)固定后, 采用流式细胞仪(BD FACS Jazz, 美国)根据前向散射光(FSC)、侧向散射光(SSC)、叶绿素a(FL-1, 488 nm)、藻红蛋白(FL-2, 585 nm)和藻蓝蛋白(FL-3, 640 nm)荧光信号鉴定聚球藻及其色素类型。另取500 mL富集样品过滤至0.22 μm聚碳酸酯滤膜(Millipore Co., 美国), 采用高通量测序分析聚球藻的系统发育分类。具体方法为使用DNA快速提取试剂盒(Fast DNAspin kit, MP BIO, 美国)抽提DNA, 以聚球藻特异性引物rpoC1-39F/rpoC1-462R扩增RNA聚合酶γ亚单位编码基因[14]。PCR反应条件为: 95 ℃预变性3 min; 35个循环(95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 45 s); 72 ℃延伸10 min, 4℃保存。扩增产物在Majorbio有限公司(上海, 中国)使用PE300 Illumina MiSeq测序平台进行测序。序列经fastp v0.20.0质控, FLASH v1.2.7拼接后, 使用UPARSE v7.1剔除嵌合体, 与NCBI数据库中的相似序列比对并以原绿球藻的PCC9511为外群, 采用最大似然法用MEGA X构建系统进化树。原始数据保存至NCBI SRA数据库(序列号: SAMN26533762-SAMN26533769)。
1.3.2 藻细胞密度测定采用流式细胞术测定聚球藻细胞密度, 方法同1.3.1。参照文献方法计算聚球藻细胞的比生长速率和最大比生长速率[15]。
1.3.3 叶绿素a和藻胆蛋白含量测定取藻液40 mL, 参照文献方法[16], 用甲醇法提取叶绿素a(Chl a)后, 用分光光度计(Lambda 25, PerkinElmer, 美国)根据665 nm和652 nm处的吸光值计算叶绿素a浓度。另取藻液40 mL, 参照文献方法[17], 用超声破碎法提取藻胆蛋白, 以PBS缓冲液为空白, 测定565 nm、620 nm和650 nm处的吸光值, 按照公式(1-3)计算分别藻蓝蛋白(PC)、别藻蓝蛋白(APC)和藻红蛋白(PE)的浓度。
| $ c_{\mathrm{PC}}=\left(A_{620}-0.7 \times A_{650}\right) / 7.38. $ | (1) |
| $ c_{\mathrm{APC}}=\left(A_{650}-0.7 \times A_{620}\right) / 5.65 . $ | (2) |
| $ c_{\mathrm{PE}}=\left[A_{565}-2.8 \times\left(c_{\mathrm{PC}}-2.34 \times c_{\mathrm{APC}}\right)\right] / 12.7.$ | (3) |
式中, A620、A650和A565分别表示620、650和565 nm处的吸光值, cPC、cAPC和cPE分别表示PC、APC和PE的浓度(mg·mL–1)。
1.3.4 光合生理参数测定取藻液3 mL, 暗适应15 min后使用Aqua Pen手持式藻类叶绿素荧光仪(WALZ, 德国)测量量子产率(Qy)和最大光化学效率(Fv/Fm)值。测量光、饱和脉冲光及光化光分别设置为0.018、1 800和600 μmol·m–2·s–1。
1.3.5 营养盐及碳、氮含量测定取藻液10 mL, 经0.45 μm滤膜过滤至10 mL离心管中, 利用连续流动分析仪(AA3, Seal Analytical, 德国)测定铵盐(NH4+), 硝酸盐(NO3–), 亚硝酸盐(NO2–)和磷酸盐(PO43–)的浓度[18]。另取藻液10 mL, 经0.45 μm滤膜过滤至酸洗棕色玻璃瓶中, 利用全自动总有机碳分析仪(TOC-VCPH, Shimadzu, 日本)测定总有机碳(TOC)、总无机碳(TIC)和总氮(TN)的含量。
1.4 数据分析使用FlowJo 10.6.2软件分析流式细胞仪获得的数据, 使用Origin 2018进行绘图, 使用SPSS 26.0软件对数据进行单因素方差分析(ANOVA)和t检验, 设置显著性水平为P < 0.05。
2 结果与讨论 2.1 富集聚球藻的主要类群流式细胞分析结果显示, 富集样品主要为富含PC的聚球藻(图 1)。高通量测序共测得269 977条序列, 在97%的相似度下, 共获得295个OTUs, 其中OTU183为优势度最高的类群。系统进化分析结果表明, 富集聚球藻以5.1亚类的clade Ⅷ型为主, 相似序列均分离自近海海域的浮游生物样本[19]。
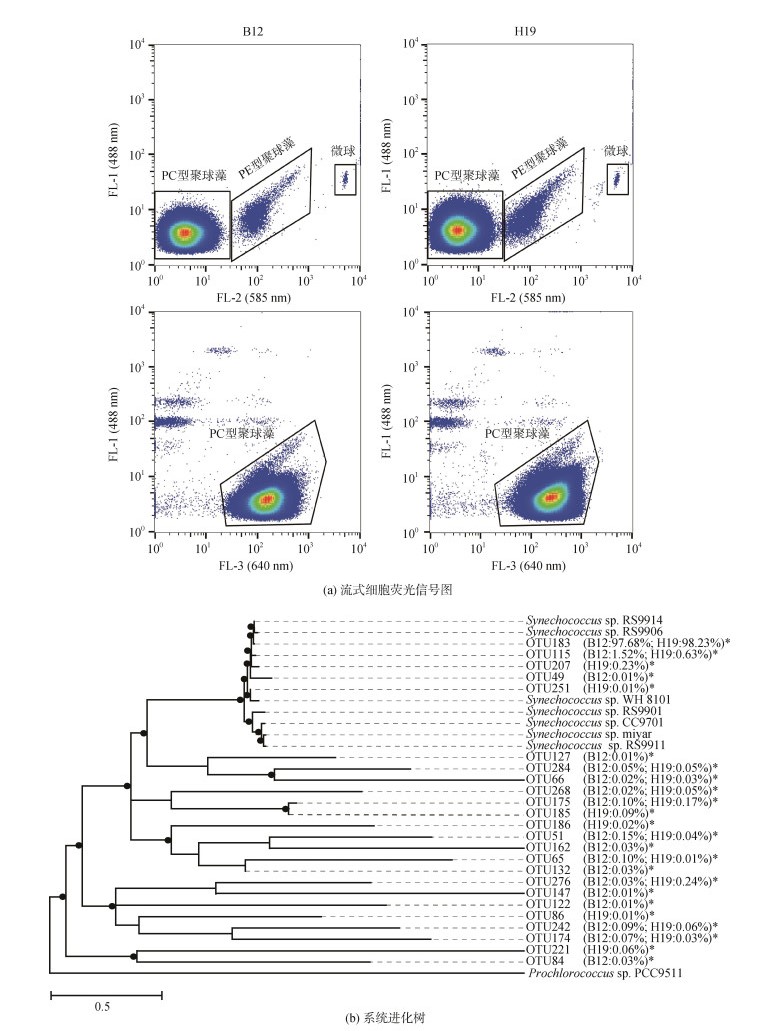 |
| 图 1 富集样本B12和H19的流式细胞荧光信号图以及系统进化树 Fig. 1 Flow cytometric fluorescence signals and phylogenetic tree of enriched samples B12 and H19 注: *表示该OTU在样品中的相对丰度。B12和H19分别为采集于2020年8月渤海B12(38.87°N, 119.67°E)和黄海H19(33.00°N, 124.01°E)站位的聚球藻富集样本 |
聚球藻作为中国近海浮游植物的主要类群, 种群多样性丰富, 按系统发育组成可分为Subcluster 5.1、5.2和5.3三个大的亚类, 包含至少20多个分支, 按捕光色素蛋白组成可分为富含PC型和富含PE型的聚球藻[20-21]。结果显示, 聚球藻富集样本B12和H19样品间种群结构差异不明显, 原位聚球藻经富集培养后种群趋于单一化。富含PE的聚球藻在硝酸盐浓度较高的环境中处于竞争劣势[22], 因此在培养过程中其相对丰度降低, PC型聚球藻成为主要类群。聚球藻系统进化分析归类的clade Ⅷ型是隶属于Subcluster 5.1的一类富含PC的聚球藻[19], 对盐度和营养盐变化有较高的适应性, 在河口区域的相对丰度远高于外海[23-24]。
2.2 不同硝酸盐浓度对聚球藻生长的影响富集培养的聚球藻接种至改良的SNAX培养基中, 聚球藻无适应期, 快速进入对数生长期, 且比生长速率迅速达到最大值(图 2)。对数生长期时, 不同硝酸盐浓度实验组间的聚球藻细胞生物量差异不大; 对数生长期后, 聚球藻细胞密度随硝酸盐浓度的增高而逐渐增高。当硝酸盐浓度为0.1、1.0、10.0 μmol·L–1时, 聚球藻培养体系所能支持的生物量较小且差异不显著。聚球藻细胞在对数生长期达到一定丰度后, 细胞丰度不再增长, 最高细胞密度为4.49×106 cells·mL–1。当硝酸盐浓度为100.0 μmol·L–1时, 聚球藻培养体系可支持的生物量更大, 聚球藻细胞可持续增长直至稳定, 最高细胞密度为1.35×107 cells·mL–1。不同硝酸盐浓度下, B12和H19聚球藻的生长特性存在差异, B12的对数生长期持续时间均少于H19。
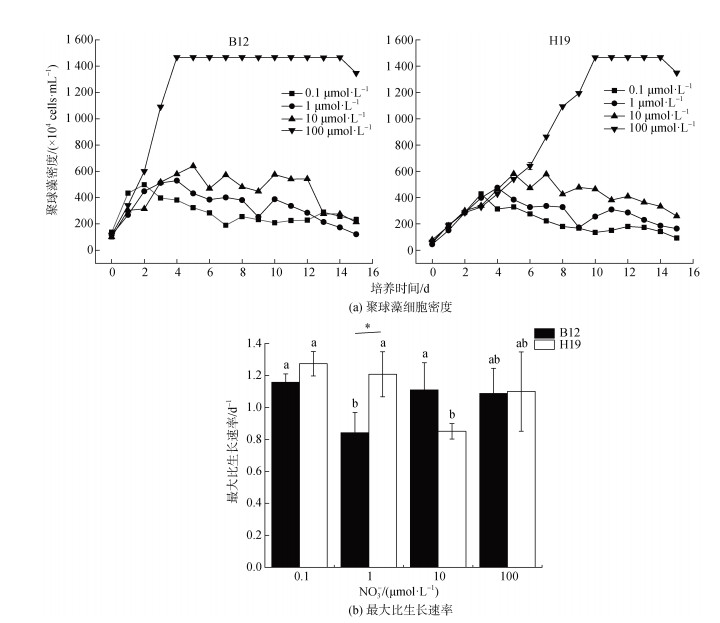 |
| 图 2 不同硝酸盐浓度下聚球藻细胞密度以及最大比生长速率 Fig. 2 Cell abundance and maximum specific rates for the growth of Synechococcus under different nitrate concentrations 注: B12和H19分别为采集于2020年8月渤海B12(38.87°N, 119.67°E)和黄海H19(33.00°N, 124.01°E)站位的聚球藻富集样本。标有不同小写字母者表示组间有显著性差异, 标有相同小写字母者表示组间无显著性差异 |
高硝酸盐浓度可以支持的聚球藻生物量更大。在藻类生长初期, 硝酸盐并不会成为藻类生长的限制因子; 随着聚球藻的生长, 硝酸盐浓度为0.1、1.0、10.0 μmol·L–1的实验组氮源不足, 藻细胞通过内源呼吸维持自身代谢和光合作用, 藻细胞生长受到限制; 而100.0 μmol·L–1硝酸盐可提供给聚球藻细胞更多的营养, 从而细胞不断增殖, 达到稳定[25-26]。实验采用了半连续培养方式, 聚球藻细胞未呈现明显的衰亡期。聚球藻对不同硝酸盐浓度具有较强的适应性, 但不同硝酸盐浓度组间生长状况存在较大差异, 这主要是由其对硝酸盐吸收能力的不同引起。已有研究结果也发现, 聚球藻在较高硝酸盐浓度下, 生长会出现延迟效应, 硝酸盐浓度由5 μmol·L–1升高至156 μmol·L–1时, 其半饱和常数由较低水平(0.1~ 8 μmol·L–1)提高至较高水平(1~156 μmol·L–1)[27]。聚球藻对硝酸盐浓度变化的迅速适应, 可促使其在硝酸盐浓度波动较大的近海环境中细胞稳定增殖, 获得相较于原绿球藻的竞争优势[23]。
2.3 不同硝酸盐浓度对聚球藻色素含量的影响随着硝酸盐浓度的增高, 聚球藻的Chl a浓度逐渐增高, 藻胆蛋白含量无明显变化(图 3)。以第15 d聚球藻藻细胞数计算单位细胞内的Chl a和藻胆蛋白含量, 发现硝酸盐浓度升高对单位藻细胞内的Chl a累积无明显影响, 但藻胆蛋白含量降低。当硝酸盐浓度为100.0 μmol·L–1时, 单位细胞内PC、PE和APC的含量最低, 分别为0.779 pg·cell–1、1.002 pg·cell–1、0.726 pg·cell–1。同一硝酸盐浓度下, H19的Chl a含量显著高于B12(P < 0.05)。在1.0 μmol·L–1硝酸盐浓度下, B12样本的藻胆蛋白含量低于检出限。
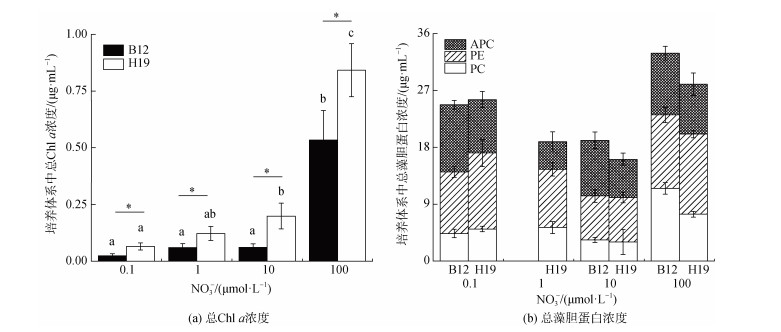 |
| 图 3 不同硝酸盐浓度下聚球藻总叶绿素a、藻胆蛋白的浓度 Fig. 3 Concentrations of total chlorophyll a and phycobiliprotein in Synechococcus under different nitrate concentrations 注: B12和H19分别为采集于2020年8月渤海B12(38.87°N, 119.67°E)和黄海H19(33.00°N, 124.01°E)站位的聚球藻富集样本。标有不同小写字母者表示组间有显著性差异, 标有相同小写字母者表示组间无显著性差异 |
Chl a作为一种光合色素, 在光合作用中起到捕获光能的作用, 能有效吸收、传递和转化光能, 驱动有机碳转化为无机碳, 是光能转化效率的重要表征参数[28]。硝酸盐主要是利用光合作用中的H2O氧化形成O2的过程中释放的ATP进入细胞。随着硝酸盐浓度的增加, 光能转化效率逐渐提高, 光合作用增强, 从而产生更多的ATP, 促使更多的硝酸盐主动输入细胞, 形成一种正反馈机制, 有助于聚球藻将更多的光能转化为自身化学能, 从而提高其初级生产力[29-30]。除了Chl a, 聚球藻还可利用藻胆体捕获和传递光能[31]。氮是聚球藻藻胆蛋白的重要组成元素, 直接影响藻胆体的合成[32]。有研究表明, 微藻主要通过调配用于氮固定和色素合成的能量, 平衡氮缺乏的不利影响[33-34]。高硝酸盐浓度下, 聚球藻细胞密度较大, 用于氮固定的能量较多, 而用于藻胆蛋白合成的能量较少。这也是不同硝酸盐浓度下藻胆蛋白含量差异不大的主要原因。另外高硝酸盐浓度下, 聚球藻细胞密度变大的同时, 细胞间的遮光效应增强, 单位细胞的捕光能力受到一定抑制。
2.4 不同硝酸盐浓度对聚球藻光合生理参数的影响不同硝酸盐浓度对B12和H19的Fv/Fm的影响不同。B12各组间的Fv/Fm无显著差异(P > 0.05), 而H19的Fv/Fm随硝酸盐浓度的增大而逐渐减小(P < 0.05) (图 4)。当硝酸盐浓度为100.0 μmol·L–1时, H19的Fv/Fm值与浓度为0.1 μmol·L–1时相比, 减少了43.27%, 表明在高硝酸盐浓度的环境中, 聚球藻H19所捕获的光能超过自身可利用的能力, 光合作用受到的胁迫增大。不同浓度的硝酸盐对两种聚球藻富集样本的Qy影响不显著。
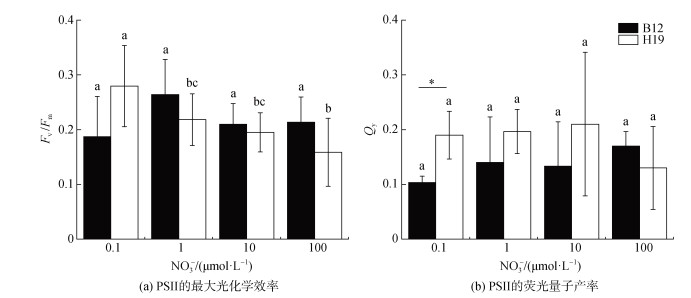 |
| 图 4 不同硝酸盐浓度下聚球藻的光合生理参数 Fig. 4 Photosynthetic physiological parameters of Synechococcus under different nitrate concentrations 注: B12和H19分别为采集于2020年8月渤海B12(38.87°N, 119.67°E)和黄海H19(33.00°N, 124.01°E)站位的聚球藻富集样本。标有不同小写字母者表示组间有显著性差异, 标有相同小写字母者表示组间无显著性差异 |
Fv/Fm和Qy分别表示PSII的最大光化学效率和荧光量子产率, 能够反映环境条件对藻细胞光合作用的胁迫[35]。一般认为, 硝酸盐可以通过其中间产物亚硝酸盐抑制植物光合作用。高浓度硝酸盐下, 细胞膜内的质子通透性通常高于细胞膜两侧的质子梯度, 从而导致光合作用所受到的胁迫增大[36]。Sahay等[37]和Chen等[38]发现高亚硝酸盐浓度可抑制光合作用中心的电子传递速率和叶绿体产氧速率, 使藻细胞的Fv/Fm值降低。
2.5 不同硝酸盐浓度下培养体系中的营养盐及碳氮含量的变化随着培养条件中硝酸盐浓度的增高, 培养结束后H19的NO3-和PO43-的浓度逐渐降低(图 5)。同时, 当硝酸盐浓度为100.0 μmol·L–1时, 培养体系内的TIC和TOC的浓度较低, 分别为9.96 mg·L–1和7.08 mg·L–1, TN的浓度无显著差异(P > 0.05) (图 6)。以第15 d培养体系中聚球藻藻细胞数计算单位细胞释放的TIC、TOC和TN含量, 分别为0.68 mg·cell–1、0.48 mg·cell–1和1.55 mg·cell–1。结果表明随着硝酸盐浓度的增高, 藻体利用氮和磷的生理反应会加快, 对氮和磷的同化率会略有升高, 导致其培养体系中测得的氮和磷营养盐浓度较低。虽然高硝酸盐浓度能够促进聚球藻对氮和磷的转化速率, 但是培养体系中的总有机碳含量并没有显著提高, 聚球藻生物量的增加主要提高了食物链的底层供给, 对于溶解有机碳的输出影响较小。在实际海域, 固碳并不等于储碳, 有机物的过量可能导致大量细菌滋生, 从而将浮游植物固定的有机碳再次释放入大气中, 同时消耗大量氧气, 使生态系统进入恶性循环[39]。因此, 适当的营养盐浓度将有助于避免富营养化并促进浮游植物生长, 提高生物泵效率从而保持较高的储碳能力。
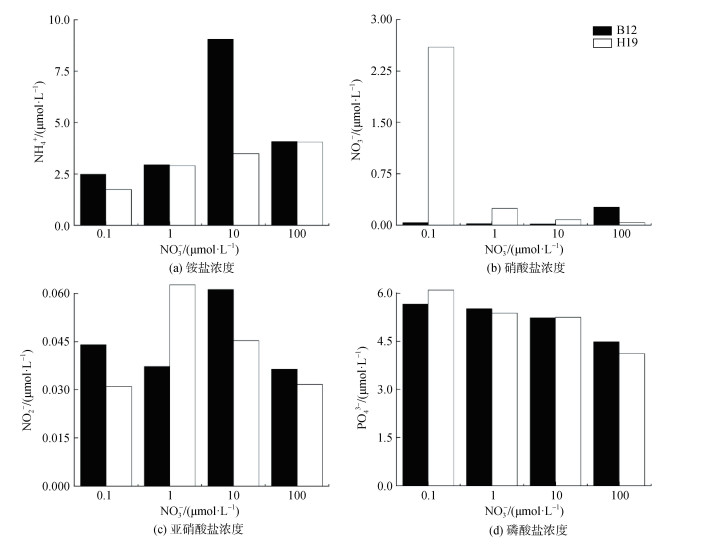 |
| 图 5 不同硝酸盐浓度下聚球藻培养体系中NH4+、NO3–、NO2–和PO43–浓度 Fig. 5 Concentrations of ammonium, nitrate, nitrite, and phosphate in the culture system of Synechococcus under different nitrate concentrations 注: B12和H19分别为采集于2020年8月渤海B12(38.87°N, 119.67°E)和黄海H19(33.00°N, 124.01°E)站位的聚球藻富集样本。标有不同小写字母者表示组间有显著性差异, 标有相同小写字母者表示组间无显著性差异 |
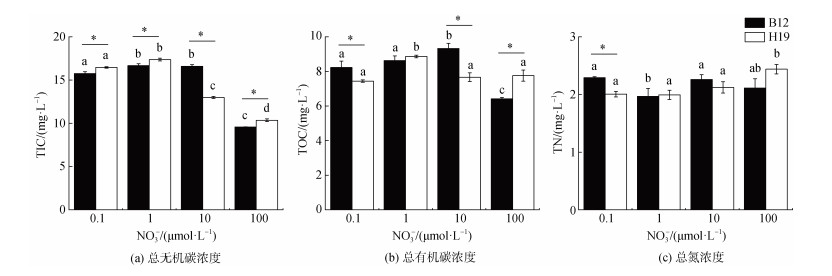 |
| 图 6 不同硝酸盐浓度下聚球藻培养体系中的TIC、TOC和TN浓度 Fig. 6 Concentrations of total inorganic carbon, total organic carbon, and total nitrogen in the culture system of Synechococcus under different nitrate concentrations 注: B12和H19分别为采集于2020年8月渤海B12(38.87°N, 119.67°E)和黄海H19(33.00°N, 124.01°E)站位的聚球藻富集样本。标有不同小写字母者表示组间有显著性差异, 标有相同小写字母者表示组间无显著性差异 |
氮是影响微藻生长的重要因素。过低的氮浓度会影响微藻细胞的三羧酸循环及叶绿素合成, 降低其光合效率[40], 而过高的氮浓度会导致微藻细胞中毒, 生长受到抑制[41]。已有研究表明, 氮添加可促进浮游植物净生长率的增加, 但PSII光合作用参数Fv/Fm和σPSII与氮添加并无直接关系[42]; 氮缺乏条件下微藻生理水平上的响应与光照过量相似, 会发生光合色素降解光合能力下降的现象[43], 而代谢水平上合成胞外聚合物的能力会增强进而影响藻际环境微生物的丰度[44]。硝酸盐的同化主要依靠活性的硝酸盐转运蛋白(NRT), 硝酸还原酶(NR)和亚硝酸盐还原酶(NiR)。其中, NRT主要负责将硝酸盐输送入细胞, NR和NiR促进硝酸盐还原为铵。当硝酸盐浓度较高时, NRT、NR和NiR基因的表达量较高, 从而促进硝酸盐的同化[45]。聚球藻在全球海洋中数量巨大、分布广泛且周转迅速(相当于海洋中浮游植物的五倍), 是海洋异养生物的主要食物来源之一[46], 同时也为异养细菌提供了重要碳源和营养源。高浓度的硝酸盐可促进海洋中的聚球藻增殖, 提升氮磷同化速率, 提高底营养级的供给。但本研究也存在一定的局限性。富集样品的聚球藻种群趋于同质化, 与实际海域原位聚球藻有差异, 主要原因是富集培养条件过于单一, 培养基中的营养盐浓度较高, 导致聚球藻中的机会类群迅速适应成为绝对优势种。B12和H19以rpoC1为标记的种群组成差异不大, 优势种均为OTU183, 但实验结果中两者对硝酸盐的响应在生长特性、光合参数方面存在较大的差异, 主要由聚球藻在原海域生态位中水平转移造成的适应性基因的转入引起[47]。另外培养实验的“瓶颈效应”也会影响浮游植物响应特征。在30 mL至4 L的容积范围内, 培养瓶容积对浮游植物生长有显著影响[48]。采用围隔开展原位培养实验将有助于进一步探究不同硝酸盐浓度对聚球藻种群的影响。
3 结论通过研究不同硝酸盐浓度下聚球藻的生长趋势、光合色素含量、光合生理参数以及培养体系中碳氮含量的变化, 发现聚球藻对硝酸盐浓度具有较高的适应能力。聚球藻在不同硝酸盐浓度下均能实现生长, 当硝酸盐浓度较高时, 聚球藻培养体系可支持的生物量显著提高, 且对光能的转化效率更高, 光合作用更强。光合作用产生的能量促进了聚球藻对硝酸盐以及碳、磷等营养物质的吸收, 但其捕获的光能超过自身可利用的能力, 导致其光合效率降低。研究结果证实高硝酸盐浓度能够促进聚球藻将更多的光能固定为自身化学能, 提高氮、磷在海洋食物链的吸收转化, 然而其产生增量的效率较低, 对浮游生态系统的储碳促进作用相对较小。
| [1] |
郑立文. 解析渤黄海开阔海域的海源氮[D]. 青岛: 山东大学, 2019. ZHENG Liwen. Resolving the contribution of oceanic nutrient inputs coastal eutrophication: Bohai and Yellow seas[D]. Qingdao: Shandong University, 2019. |
| [2] |
GLIBERT P M, WILKERSON F P, DUGDALE R C, et al. Pluses and minuses of ammonium and nitrate uptake and assimilation by phytoplankton and implications for productivity and community composition, with emphasis on nitrogen-enriched conditions[J]. Limnology and Oceanography, 2016, 61(1): 165-197. DOI:10.1002/lno.10203 |
| [3] |
赖俊翔, 俞志明, 宋秀贤, 等. 利用特征色素研究长江口海域浮游植物对营养盐加富的响应[J]. 海洋科学, 2012, 36(5): 42-52. LAI Junxiang, YU Zhiming, SONG Xiuxian, et al. Pigment-based assessment of the response of phytoplankton to nutrient addition at the Changjiang Estuary[J]. Marine Sciences, 2012, 36(5): 42-52. |
| [4] |
WANG B D, XIN M, WEI Q S, et al. A historical overview of coastal eutrophication in the China Seas[J]. Marine Pollution Bulletin, 2018, 136: 394-400. DOI:10.1016/j.marpolbul.2018.09.044 |
| [5] |
JIANG Z B, LIU J J, CHEN J F, et al. Responses of summer phytoplankton community to drastic environmental changes in the Changjiang (Yangtze River) estuary during the past 50 years[J]. Water Research, 2014, 54(5): 1-11. |
| [6] |
倪洁, 刘珊珊, 陈妍, 等. 光照和硝酸盐浓度对东海原甲藻和三角褐指藻释放挥发性卤代烃的影响[J]. 海洋学报, 2020, 42(12): 119-128. NI Jie, LIU Shanshan, CHEN Yan, et al. Influences of nitrate concentration and light intensity on the production of volatile halocarbons by Prorocentrum donghaiense and Phaeodactylum tricornutum[J]. Haiyang Xuebao, 2020, 42(12): 119-128. |
| [7] |
郝爽, 刘丽君, 陈军辉, 等. 高氮磷比与酸化共同作用对微小亚历山大藻生长和产毒的影响[J]. 海洋科学, 2021, 45(2): 1-10. HAO Shuang, LIU Lijun, CHEN Junhui, et al. Effects of acidification and high N/P ratios on toxin production in Alexandrium minutum[J]. Marine Sciences, 2021, 45(2): 1-10. |
| [8] |
FLOMBAUM P, GALLEGOS J L, GORDILLO R A, et al. Present and future global distributions of the marine cyanobacteria Prochlorococcus and Synechococcus[J]. Proceedings of the National Academy of Sciences, 2013, 110(24): 9824-9829. DOI:10.1073/pnas.1307701110 |
| [9] |
牟善莉, 李刚, 李鸿妹, 等. 近海聚球藻Synechococcus PCC7002在不同生长期对环境CO2浓度升高的生理响应[J]. 中国科学地球科学, 2018, 48(12): 1620-1628. MOU Shanli, LI Gang, LI Hongmei, et al. Differential physiological responses of the coastal cyanobacterium Synechococcus sp. PCC7002 to elevated pCO2 at lag, exponential, and stationary growth phases[J]. Science China Earth Sciences, 2018, 48(12): 1620-1628. |
| [10] |
SOHM J A, AHLGREN N A, THOMSON Z J, et al. Co-occurring Synechococcus ecotypes occupy four major oceanic regimes defined by temperature, macronutrients and iron[J]. The ISME Journal, 2016, 10(2): 333-345. DOI:10.1038/ismej.2015.115 |
| [11] |
XIA X M, PARTENSKY F, GARCZAREK L, et al. Phylogeography and pigment type diversity of Synechococcus cyanobacteria in surface waters of the northwestern Pacific Ocean[J]. Environmental Microbiology, 2017, 19(1): 142-158. DOI:10.1111/1462-2920.13541 |
| [12] |
ZHAO Y, DONG Y, LI H B, et al. Grazing by microzooplankton and copepods on the microbial food web in spring in the southern Yellow Sea, China[J]. Marine Life Science and Technology, 2020, 2: 442-455. DOI:10.1007/s42995-020-00047-x |
| [13] |
梁翠, 线薇薇, 沈志良. 近十几年间长江口春季无机氮和磷含量分布变化特征及影响因素分析[J]. 中国海洋大学学报, 2016, 46(3): 82-90. LIANG Cui, XIAN Weiwei, SHEN Zhiliang. Analysis of trends and influencing factors of nitrogen and phosphate in the Yangtze River Estuary in spring over the last few years[J]. Periodical of Ocean University of China, 2016, 46(3): 82-90. |
| [14] |
MÜHLING M, FULLER N J, SOMERFIELD P J, et al. High resolution genetic diversity studies of marine Synechococcus isolates using rpoC1-based restriction fragment length polymorphism[J]. Aquatic Microbial Ecology, 2006, 45(3): 263-275. |
| [15] |
娄孝飞, 杜延生, 张海平. 基于细胞尺度的光照对四尾栅藻生长的影响[J]. 中国环境科学, 2020, 40(11): 5020-5026. LOU Xiaofei DU Yansheng, ZHANG Haiping. Effect of light intensity on the growth of Scenedesmus quadricauda at cell scale[J]. China Environmental Science, 2020, 40(11): 5020-5026. DOI:10.3969/j.issn.1000-6923.2020.11.044 |
| [16] |
LICHTENTHALER H, BUSCHMANN C. Current Protocols in Food Analytical Chemistry[M]. New York: John Wiley and Sons, 2001: F4.3. 1-F4.3. 8.
|
| [17] |
MITTAL R, TAYANANDI H A, MANTRI V A, et al. Ultrasound assisted methods for enhanced extraction of phycobiliproteins from marine macro-algae, Gelidium pusillum (Rhodophyta)[J]. Ultrasonics Sonochemistry, 2017, 38: 92-103. DOI:10.1016/j.ultsonch.2017.02.030 |
| [18] |
SCIENCE A, GRASSHOFF K, KREMLING K, et al. Methods of Seawater Analysis (3rd Edition)[M]. HobokenL: John Wiley and Sons, 1999.
|
| [19] |
FULLER N J, MARIE D, PARTENSKY F, et al. Clade-specific 16S ribosomal DNA oligonucleotides reveal the predominance of a single marine Synechococcus clade throughout a stratified water column in the Red Sea[J]. Applied and Environmental Microbiology, 2003, 69(5): 2430-2443. DOI:10.1128/AEM.69.5.2430-2443.2003 |
| [20] |
侯庆华, 毛铁墙, 陈清香. 海洋聚球藻多样性及时空分布特征研究进展[J]. 广东海洋大学学报, 2018, 38(6): 96-104. HOU Qinghua, MAO Tieqiang, CHEN Qingxiang. Advances in diversity and spatial-temporal distribution characteristics of marine Synechococcus[J]. Journal of Guangdong Ocean University, 2018, 38(6): 96-104. |
| [21] |
乐凤凤, 刘诚刚, 郝锵, 等. 2006年秋季长江口及邻近海域微微型浮游生物的分布特征及环境影响因素[J]. 海洋学研究, 2011, 29(3): 1-10. YUE Fengfeng, LIU Chenggang, HAO Qiang, et al. Distribution and environmental impact factors of picoplankton in Changjiang River Estuary and its adjacent sea areas in autumn of 2006[J]. Journal of Marine Sciences, 2011, 29(3): 1-10. DOI:10.3969/j.issn.1001-909X.2011.03.002 |
| [22] |
ERNST A, DEICHER M, HERMAN P M J, et al. Nitrate and phosphate affect cultivability of cyanobacteria from environments with low nutrient levels[J]. Applied and environmental microbiology, 2005, 71(6): 3379-3383. DOI:10.1128/AEM.71.6.3379-3383.2005 |
| [23] |
XIA X M, GUO W, TAN S J, et al. Synechococcus assemblages across the salinity gradient in a salt wedge estuary[J]. Frontiers in Microbiology, 2017, 8: 1254. DOI:10.3389/fmicb.2017.01254 |
| [24] |
STOMP M, HUISMAN J, VÖRÖS L, et al. Colourful coexistence of red and green picocyanobacteria in lakes and seas[J]. Ecology Letters, 2007, 10(4): 290-298. DOI:10.1111/j.1461-0248.2007.01026.x |
| [25] |
王艳, 唐海溶, 蒋磊, 等. 硝酸盐对球形棕囊藻生长和硝酸还原酶活性的影响[J]. 植物学通报, 2006, 23(2): 138-144. WANG Yan, TANG Hairong, JIANG Lei, et al. Effects of nitrate on the growth and nitrate reductase activity in Phaeocystis globosa[J]. Chinese Bulletin of Botany, 2006, 23(2): 138-144. |
| [26] |
邓开开, 李奕璇, 方芳, 等. 营养盐对藻类生长影响的原位实验研究[J]. 土木与环境工程学报, 2016, 43(4): 162-175. DENG Kaikai, LI Yixuan, FANG Fang, et al. Influence of nutrients on the in situ growth of algae[J]. Journal of Civil and Environmental Engineering, 2016, 43(4): 162-175. |
| [27] |
COLLOS Y, VAQUER A, SOUCHU P. Acclimation of nitrate uptake by phytoplankton to high substrate levels 1[J]. Journal of Phycology, 2005, 41(3): 466-478. DOI:10.1111/j.1529-8817.2005.00067.x |
| [28] |
SUOMIVUORI C M, WINTER N O C, HÄTTIG C, et al. Exploring the light-capturing properties of photosynthetic chlorophyll clusters using large-scale correlated calculations[J]. Journal of Chemical Theory and Computation, 2016, 12(6): 2644-2651. |
| [29] |
MATORIN D N, ANTAL T K, OSTROWSKA M, et al. Chlorophyll fluorimetry as a method for studying light absorption by photosynthetic pigments in marine algae[J]. Oceanologia, 2004, 46(4): 519-531. |
| [30] |
FALKOWSKI P G and STONE D P. Nitrate uptake in marine phytoplankton: energy sources and the interaction with carbon fixation[J]. Marine Biology, 1975, 32(1): 77-84. |
| [31] |
GAN F, BRYANT D A. Adaptive and acclimative responses of cyanobacteria to far‐red light[J]. Environmental Microbiology, 2015, 17(10): 3450-3465. |
| [32] |
MURTON J, NAGARAJAN A, NGUYEN A Y, et al. Population-level coordination of pigment response in individual cyanobacterial cells under altered nitrogen levels[J]. Photosynthesis Research, 2017, 134: 165-174. |
| [33] |
BERGES J A, CHARLEBOIS D O, MAUZERALL D C, et al. Differential effects of nitrogen limitation on photosynthetic efficiency of photosystems Ⅰ and Ⅱ in microalgae[J]. Plant Physiology, 1996, 110(2): 689-696. |
| [34] |
WANG J Y, WAGNER N D, FULTON J M, et al. Diazotrophs modulate phycobiliproteins and nitrogen stoichiometry differently than other cyanobacteria in response to light and nitrogen availability[J]. Limnology and Oceanography, 2021, 66(6): 2333-2345. |
| [35] |
史胜青, 袁玉欣, 杨敏生, 等. 水分胁迫对4种苗木叶绿素荧光的光化学淬灭和非光化学淬灭的影响[J]. 林业科学, 2004, 40(1): 168-173. SHI Shengqing, YUAN Yuxin, YANG Meisheng, et al. Effects of water stress on photochemical quenching and non-photochemical quenching of chlorophyll a fluorescence in four tree seedlings[J]. Scientia Silvae Sinicae, 2004, 40(1): 168-173. |
| [36] |
ALMEIDA J S, JÚLIO S M, REIS M A M, et al. Nitrite inhibition of denitrification by Pseudomonas fluorescens[J]. Biotechnology and Bioengineering, 2010, 46(3): 194-201. |
| [37] |
SAHAY A, JAJOO A, SINGH P, et al. Nitrite regulates distribution of excitation energy between the two photosystems by causing state transition[J]. Plant Physiology and Biochemistry, 2006, 44(1): 7-12. |
| [38] |
CHEN W M, TONG H B, LIU H. Effects of nitrate on nitrite toxicity to Microcystis aeruginosa[J]. Marine pollution bulletin, 2012, 64(6): 1106-1111. |
| [39] |
焦念志. 海洋固碳与储碳——并论微型生物在其中的重要作用[J]. 中国科学: 地球科学, 2012, 42(10): 1473-1486. JIAO Nianzhi. Carbon fixation and sequestration in the ocean with special refernce to the microbial carbon pump[J]. Science China Earth Sciences, 2012, 42(10): 1473-1486. |
| [40] |
王珂. 不同光强和氮源条件下类波氏真眼点藻的生长、油脂积累和尿素代谢规律研究[D]. 广州: 暨南大学, 2014. WANG Ke. The pattern of growth, lipids accumulation andurea metabolism in Eustigmatos cf. polyphem under the different light and nitrogen regimes[D]. Guangzhou: Jinan University, 2014. |
| [41] |
DAI G Z, QIU B S, FORCHHAMMER K. Ammonium tolerance in the cyanobacterium Synechocystis sp. strain PCC 6803 and the role of the psbA multigene family[J]. Plant Cell and Environment, 2014, 37(4): 840-851. |
| [42] |
KULK G, POLL W, BUMA A. Photophysiology of nitrate limited phytoplankton communities in Kongsfjorden, Spitsbergen[J]. Limnology and Oceanography, 2018, 63(6): 2606-2617. |
| [43] |
王鑫, 唐学玺, 赵一蓉, 等. 假微型海链藻对不同氮培养条件的响应[J]. 海洋环境科学, 2021, 40(5): 717-723. WANG Xin, TANG Xuexi, ZHAO Yirong, et al. Responses of Thalassiosira Pseudonana to different nitrogen conditions[J]. Marine Environmental Science, 2021, 40(5): 717-723. |
| [44] |
魏晓雪, 石峰, 陈子熙, 等. 三角褐指藻及其藻际环境对不同无机氮源的响应[J]. 海洋科学, 2022, 46(1): 10-21. WEI Xiaoxue, SHI Feng, CHEN Zixi, et al. Responses of Phaeodactylum tricornutum and its bacteria in the phycosphere to different inorganic nitrogen sources[J]. Marine Sciences, 2022, 46(1): 10-21. |
| [45] |
OHASHI Y, SHI W, TAKATANI N, et al. Regulation of nitrate assimilation in cyanobacteria[J]. Journal of experimental Botany, 2011, 62(4): 1411-1424. |
| [46] |
CHRISTAKI U, VÁZQUEZ-DÍOMÍNGUEZ E, COURTUES C, et al. Grazing impact of different heterotrophic nanoflagellates on eukaryotic (Ostreococcus tauri) and prokaryotic picoautotrophs (Prochlorococcus and Synechococcus)[J]. Environmental Microbiology, 2010, 7(8): 1200-1210. |
| [47] |
NOGUEIRA P, DOMINGUES R B, BARBOSA A B. Are microcosm volume and sample pre-filtration relevant to evaluate phytoplankton growth?[J]. Journal of Experimental Marine Biology and Ecology, 2014, 461: 323-330. |
| [48] |
POLZ M F, ALM E J, HANAGE W P. Horizontal gene transfer and the evolution of bacterial and archaeal population structure[J]. Trends in Genetics, 2013, 29(3): 170-175. |
 2023, Vol. 47
2023, Vol. 47


