文章信息
- 张健, 李训猛, 程晓鹏, 黄宏, 王凯, 章守宇. 2023.
- ZHANG Jian, LI Xun-meng, CHENG Xiao-peng, HUANG Hong, WANG Kai, ZHANG Shou-yu. 2023.
- 天然海藻场沿岸表层沉积物有机质的分布特征与来源
- Distribution characteristics and sources of organic matter in surface sediments along the coast of natural seaweed bed
- 海洋科学, 47(12): 21-29
- Marine Sciences, 47(12): 21-29.
- http://dx.doi.org/10.11759/hykx20210531003
-
文章历史
- 收稿日期:2021-05-31
- 修回日期:2021-06-30
沿海湿地是陆地生态系统和海洋生态系统之间的过度区域, 这里是陆地和海洋之间碳氮交换和储存的重要场所[1]。尽管沿海湿地仅占海洋的面积的10%, 但有大约80%的有机碳埋藏在大陆边缘的沿海生态系统中, 因此对沿海沉积物有机质来源解析和控制分布因素的理解对于了解生物地球化学碳和氮循环埋藏至关重要[2-6]。
海藻场是一类以大型底栖海藻为背景生物的典型沿海湿地生态系统[7], 广泛分布于全球潮间带和浅潮下带的岩礁区域, 约占全球岩礁海岸线的四分之一[8-9]。海藻场中有超过80%的生产力会进入碎屑通道, 随水体从近岸浅水区域向深潮下带迁移, 并为底栖生物提供物质和能量来源[10-12], 因此沉积物有机质含量和来源是决定海藻场沿岸生物多样性的重要物质基础之一。由于海藻场处于海陆交界地带, 耦合了陆地与海洋有机碳循环过程, 沉积物有机质来源极为复杂[13-14]。一方面, 海藻场自身的大型海藻碎屑和浮游植物会沉降进入海藻场沿岸沉积物; 另一方面, 陆地径流的输入、人类水产养殖的饵料投放、生活污水和生产废水的排放等也会向海藻场沿岸沉积物输入大量有机质[3, 14]。为了阐明沉积物有机质的来源, 碳氮比值(C/N)和碳氮稳定同位素(δ13C、δ15N)技术已经被广泛应用于河流、河口、湖泊、水库、海湾等水生生态系统的沉积物有机质来源辨析[6, 15-17]。通常, 不同有机质来源具有不同的C/N、δ13C和δ15N特征值, 因此可以利用不同端元生物的特征值差异来对沉积物有机质来源进行定性和定量分析[18]。例如海洋有机质和陆地有机质的C/N比值范围分别为5~9和>20[19-20]; 陆生C3植物和海洋浮游植物的δ13C范围分别为−28‰~ −26‰和−21.9‰~−19‰[21-22]; 陆源有机质的和海源有机质的δ15N平均值分别为2‰和6‰[6, 23]。
由于海藻场主要分布在潮间带和浅潮下带的岩礁区域, 这种特殊的底质类型使得常用沉积物采集设备(如抓斗采泥器、柱状采泥器等)无法采集海藻场的沉积物, 这可能是有关海藻场沉积物研究相对较少的原因[14]。为解决沉积物采样的相关困难, 本研究使用沉积物收集装置和抓斗采泥器分别收集海藻场沿岸岩礁区域和外围非岩礁区域的沉积物, 并分析了沉积物的粒度组成、总有机碳(TOC)、总氮(TN)、C/N比值和碳氮稳定同位素(δ13C和δ15N)。运用贝叶斯碳稳定同位素混合模型计算了潜在来源生物对沉积物有机质的贡献率, 并评估了进入沉积物中的海藻碎屑占海藻碎屑总产生量的占比, 以期为评估海藻场碎屑的产生规模、沉积物有机质分布与来源特征和渔业资源养护功能提供数据支撑。
1 材料与方法 1.1 研究区域嵊山岛(122°48′0.79″~122°50′5.23″E, 30°42′3.50″~ 30°44′6.62″N)位于长江口的东南部、舟山群岛东北部海域, 是舟山渔场的中心位置。该岛海岸线长19.3 km, 陆地面积7.1 km2, 呈西北-东南走向, 地势东高西低。2018—2020年, 使用Biosonics MX回声探测器对嵊山岛进行连续三年的环岛测扫, 结合现场水肺潜水观察和采样调查结果, 嵊山岛海岸主要为岩礁岸线, 天然海藻场主要分布在水深0~6 m的岩石区域, 海藻场宽幅小于10 m。海藻场以马尾藻属生物为优势物种, 主要包括鼠尾藻(Sargassum thunbergii)、羊栖菜(Sargassum fusiforme)、瓦氏马尾藻(Sargassum vachellianum)、铜藻(Sargassum horneri), 伴生物种有孔石莼(Ulva pertusa)、网地藻(Dictyota dichotoma)等。考虑到波浪、海流、海藻生活史以及经济生产活动可能对沉积有机质分布造成影响, 选取嵊山岛北部无人村海域为研究区域, 该区域海藻场覆盖度高、生物量大, 且没有陆地径流和生活污水输入。在无人村海藻场我们在离岸方向上选取了三种不同类型的底质作为研究对象, 分别为R1, R2, R3区域, 并在每个区域设置三个采样站点, 站点详细信息见表 1。
| 区域 | 底质类型 | 水深/m | 离岸距离/m | 站点 |
| R1 | 海藻场-岩礁区 | 3~5 | 5~10 | 1, 2和3 |
| R2 | 非海藻场-岩礁区 | 8~12 | 25~35 | 4, 5和6 |
| R3 | 非岩礁泥质区 | 20~23 | 500 | 7, 8和9 |
岩礁区沉积物采集: 沉积物收集装置通过水肺潜水方式固定在海藻场内部和外部的礁石上, 沉积10~14 d后(沉积时间受天气影响), 将固定在沉积物收集装置上沉积物收集管取回。采集的沉积物先经100目筛网过滤去除石块和贝类尸体, 然后在阴凉处静置12 h以上, 使沉积物充分沉淀并去除上清液。最后将沉积物转移到干净聚乙烯自封袋中在低温下储存, 直到进一步实验分析。
非岩礁泥质区沉积物采集: 使用不锈钢抓斗采泥器收集泥质海区的表层沉积物, 取表层0.5 cm以内沉积物样品, 装入干净的聚乙烯自封袋中低温保存, 直到进一步实验分析。
大型藻类组: 通过水肺潜水在研究区域随机采集3个样方的大型藻类样品, 样方面积为25 cm×25 cm。将大型海藻按生物量比例混合组合成大型海藻组样品, 用去离子水洗涤大型海藻表面以去除附着在藻体上的有机颗粒和杂质。然后将大型藻类样品收集到干净聚乙烯自封袋中在低温下储存, 直到进一步实验分析。
悬浮颗粒有机物(suspended particulate organic matter, POM): 使用采水器采集15 L表层0.2~0.5 m海水。去除水体中的杂质后将水样过滤到GF/F膜上, 该膜预先在马弗炉中550 ℃燃烧6 h以去除有机物。然后将POM样本装入聚乙烯自封袋中在低温下储存, 直到进一步实验分析。
浮游植物: 用浅水Ⅲ型浮游植物网水平拖网15 min, 采集表层0.2~1 m的浮游植物。浮游植物样品通过250 µm和160 µm两个网筛过滤, 去除浮游动物和杂质。然后将浮游植物样品过滤到预先在550 ℃马弗炉中灼烧过的GF/F膜上, 并将浮游植物样品装入到干净聚乙烯自封袋中在低温下储存, 直到进一步实验分析。
1.3 实验方法沉积物粒度分析的预处理程序参照中国国家标准(GB/T12763.8—2007)。使用激光粒度分析仪(Mastersizer 2000, Malvern Instruments Ltd., UK)分析沉积物样品的粒度, 每个样品重复测量3次取平均值。在分析之前, 使用超声波振动使含有沉积物样品的溶液均匀化1 min, 沉积物粒度分为3类: 黏土(<4 μm)、粉砂(4~63 μm)和砂(>63 μm)。
首先, 用1 mol·L–1的盐酸溶液酸化样品, 并在摇床上振荡24 h, 每6 h更换一次盐酸溶液, 以确保完全去除样品中的无机碳。随后用去离子水反复冲洗酸化的沉积物和端元生物样品至上清液呈中性。然后将样品冷冻干燥, 研细, 过筛, 并保存在干燥器中待分析。
TOC、TN浓度和同位素比值(δ13C和δ15N)分别用元素分析仪(德国Elementar公司Vario-ELⅢ)和同位素比值质谱仪(德国IRMS公司Isoprime)测定。稳定同位素组成计算公式如下:
式中, X表示13C或15N, R代表13C/12C或15N/14N, δ(13C)和δ(15N)是相对于标准品的丰度。其中, 碳的参考标准为Vienna PeeDee belemnite(VPDB), 氮的参考标准为大气N2。以国际标准品USGS40(δ13CVPDB= –26.39‰, δ15NAir= –4.52‰)和小麦粉标准品(δ13CVPDB= –27.21‰, δ15NAir=2.85‰)为对照品。对所有样品的分析结果表明, TOC和TN的测定精度≤0.06%, δ13C的测定精度≤0.07‰, δ15N的测定精度≤0.13‰。
1.4 海藻场碎屑产生量和有机碳沉积量海藻场碎屑产生量和有机碳沉积量分别用(1)和(2)估算:
| $ F=B×(1–M)×S_{1}×T_{1}, $ | (1) |
| $ C=A×S_{2}×T_{2}×t, $ | (2) |
其中, F为研究区域海藻碎屑产生量, 单位: g; B为单位面积海藻生物量, 单位: g·m-2; M为海藻含水率; S1和S2分别是研究区域海藻场和海湾面积, 单位: m2; T1和T2分别是海藻和沉积物总有机碳含量; C为研究区域有机碳沉积量, 单位: g; A为单位面积沉积速度, 单位: g·m-2·d-1; t为沉积时间, 单位: d。
1.5 数据分析C化学性质相对保守, 其同位素组成广泛应用于水生生态系统沉积物有机质来源研究。本研究使用贝叶斯碳同位素混合模型估算不同潜在来源生物对沉积物有机质的贡献率, 该模型在基于先验信息的前提下, 考虑了端元值的不确定性, 并增加了随机效应分类变量和残差+过程误差等模块提升了对混合物来源及其贡献比例定量计算的准确性, 模型使用R中的MixSIAR包, R版本为4.0.3。沉积物和端元生物的δ13C被用作输入参数, 蒙特卡洛-马尔科夫链(MCMC)设置为“非常长”, 并使用Gelman-Rubin和Geweke诊断测试来检测输出结果是否合理。错误结构和指定先验设置为“剩余误差”和“无信息先验”, 对不同端元生物贡献的平均值进行统计分析。数据单因素方差分析和相关性分析均使用SPSS 25和Origin 2018进行, 差异显著性水平P<0.05。
2 结果 2.1 表层沉积物粒度组成特征无人村海藻场及其附近海域的表层沉积物中的黏土、粉砂和砂占比分别为32.15%~38.76%、49.50%~ 66.75%、0.77%~13.45%, 中值粒度为6.04~6.95 μm, 三种底质类型区域的沉积物均为黏土质粉砂(图 1)。在空间分布上, 沉积物中砂和黏土的占比随离岸距离增加而下降, 粉砂占比随离岸距离增加而增加。单因素方差分析结果显示, 不同离岸距离的沉积物中黏土和中值粒度差异不显著(P>0.05), 不同离岸距离的沉积物中粉砂、砂占比差异显著(P<0.05), 不同月份的沉积物中黏土、粉砂、砂和中值粒度差异均不显著(P>0.05)。
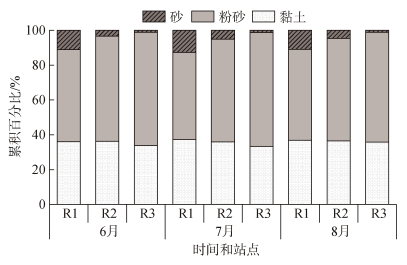 |
| 图 1 沉积物粒径组成 Fig. 1 Grain-size composition of sediment |
无人村海藻场及附近海域沉积物总有机碳(TOC)、总氮(TN)、碳氮比值(C/N)范围分别为0.70%~2.41%、0.11%~0.41%、5.53~6.48, 三个研究区域的TOC、TN和C/N比值见图 2。沉积物TOC和TN的时空分布表现为R1>R2>R3, 7月>8月>6月。单因素方差分析表明, 不同离岸距离的沉积物TOC和TN差异显著(P<0.05), C/N差异不显著(P>0.05); 不同月份的沉积物TOC、TN和C/N比值差异不显著(P>0.05)。线性回归分析表明, TOC与TN相关性显著(图 3); 沉积物TOC和TN含量与砂占比相关性显著(图 4)。
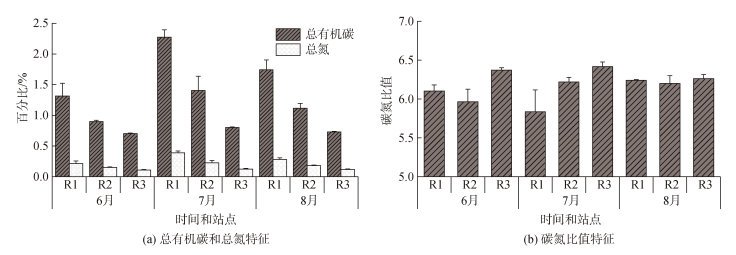 |
| 图 2 沉积物总有机碳、总氮、碳氮比值特征 Fig. 2 The characters of TOC, TN, and C/N ratios in sediment |
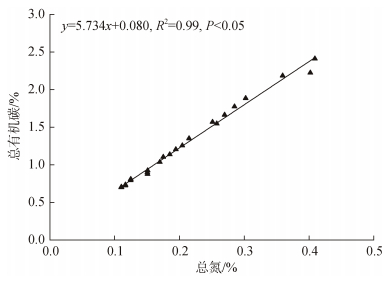 |
| 图 3 沉积物总有机碳与总氮的线性关系 Fig. 3 The linear relationship between TOC and TN in sediment |
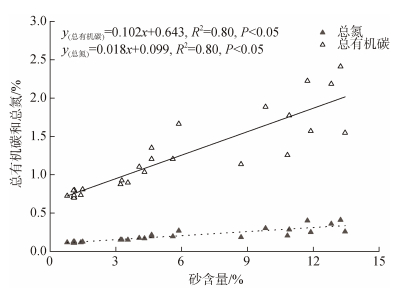 |
| 图 4 沉积物砂占比与总有机碳和总氮的线性关系 Fig. 4 Linear relationship among sands with TOC and TN in sediment |
无人村海藻场及附近海域沉积物δ13C在–21.79‰~ –19.60‰之间, 均值为–21.22‰±0.37‰, δ15N在1.56‰~ 4.26‰之间, 均值为3.01‰±0.93‰。R1区域的δ13C和δ15N均值分别为–20.48‰±0.18‰和2.63‰±0.59‰; R2区域δ13C和δ15N均值分别为–20.48‰±0.03‰和2.34‰± 0.48‰; R3区域δ13C和δ15N均值分别为–20.48‰±0.01‰和4.05‰±0.06‰(图 5)。单因素方差分析显示, 不同月份的沉积物δ13C和δ15N差异不显著(P>0.05); 不同离岸距离的沉积物δ13C差异显著(P<0.05), 不同离岸距离的沉积物δ15N不显著(P>0.05)。线性回归分析表明, δ13C和δ15N相关性不显著(R2=0.10, P>0.05)。
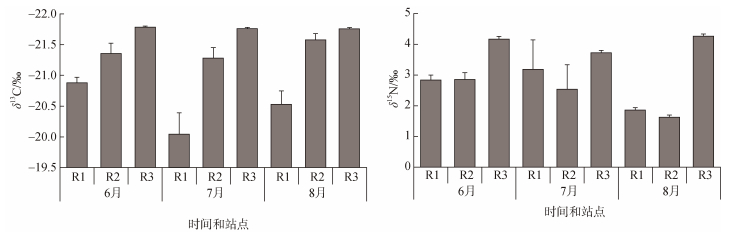 |
| 图 5 沉积物δ13C和δ15N特征 Fig. 5 The characters of δ13C and δ15N in sediment |
大型海藻的δ13C范围在–20.28‰~–14.71‰之间, δ15N范围在0.43‰~5.15‰, C/N比值在10.85~19.28之间; POM的δ13C在–21.35‰~–17.94‰之间, δ15N在1.35‰~4.88‰, C/N比值在5.25~8.39之间; 浮游植物的δ13C在–23.14‰~–20.99‰之间, δ15N在1.49‰~ 4.68‰, C/N比值在4.46~6.55之间, 平均值见表 2。表层沉积物的δ13C、δ15N、C/N值均包含在潜在来源生物值域的范围内, 这表明大型海藻、POM和浮游植物均是沉积物有机质的潜在来源生物(图 6)。单因素方差分析表明, 不同端元生物的δ13C差异显著(P<0.05), δ15N差异不显著(P>0.05), 浮游植物和POM的C/N比差异不显著(P>0.05)。由于POM的δ13C、δ15N和C/N比值的范围均与浮游植物和大型海藻有重叠, 且其δ13C和C/N比值的均值介于大型藻类和浮游植物之间, 因此将POM视为大型藻类和浮游植物的混合物。
| 样品 | δ13C/‰ | δ15N/‰ | C/N |
| 浮游植物 | −21.79±0.71 | 3.23±1.28 | 5.51±0.73 |
| 悬浮颗粒有机物 | −19.80±0.84 | 2.99±1.20 | 7.02±0.88 |
| 大型海藻 | −17.50±1.43 | 3.40±1.11 | 14.85±2.54 |
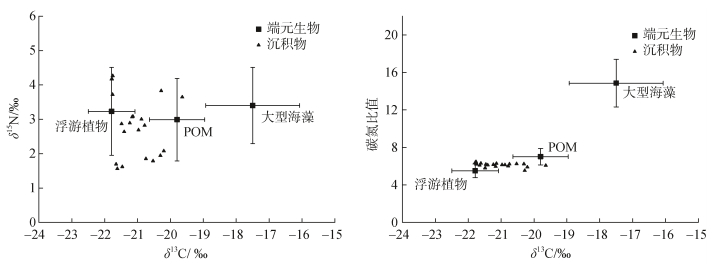 |
| 图 6 沉积物δ13C和δ15N、C/N的关系 Fig. 6 Relationship between δ13C and δ15N, C/N in sediment |
贝叶斯碳稳定同位素混合模型结果显示, 6月大型海藻对R1、R2、R3区域沉积物有机质的贡献率分别为19.10%~27.40%、6.30%~7.40%和2.30%~2.40%, 7月分别为34.30%~45.60%、12.80%~15.00%和4.80%~ 5.00%, 8月分别为24.00%~33.60%、8.20%~9.60%和3.00%~3.10%(图 7)。大型海藻对沉积物有机质的贡献率时空分布特征为: 7月>8月>6月, R1>R2>R3。单因素方差分析表明, 不同离岸距离区域大型海藻对沉积物有机质的贡献率差异显著(P<0.05); 不同月份大型海藻对沉积物有机质的贡献率差异不显著(P>0.05)。
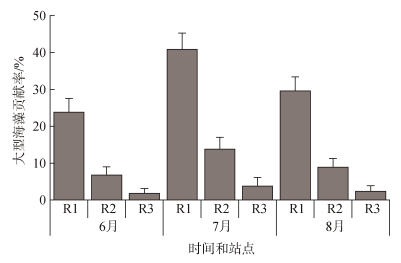 |
| 图 7 浮游植物和大型海藻对沉积物有机质的贡献率 Fig. 7 Contribution rate of phytoplankton and macroalgae to sediment organic matter |
6、7、8月海藻场生物量分别为7 011 g/m2、7 313 g/m2、1 004 g/m2, 藻类含水率约为90%, TOC含量约40%, 海藻覆盖度约40%, 平均日沉积量为17.10 g·m–2·d–1, R1、R2和R3区域面积分别为25 000 m2、80 000 m2和600 000 m2。根据海藻场固碳量公式(1)估算可得, 研究区域海藻场6、7、8月的海藻固碳量分别为2.80 t, 2.93 t和0.40 t。7月到8月的过程中, 海藻生物量迅速下降, 约有2.53 t碳在这一时期从大型海藻体内转移至环境中, 因此选择7月评估海藻场沉积有机碳量。根据公式(2)计算7月研究区域的碳沉积量, R1、R2和R3区域的分别为0.30 t、0.38 t和2.12 t。根据2.4中海藻在不同区域对沉积物有机碳的贡献率, 海藻在R1、R2和R3区域分别沉积了0.12 t、0.08 t和0.10 t, 共有约0.30 t海藻有机碳进入沉积物中, 约占海藻碎屑总量11.98%。
3 讨论 3.1 海藻场沉积物有机质的来源粒度作为沉积物的基本属性之一, 其能在一定程度上反应沉积物的来源[24]。有研究表明, 藻类碎屑和浮游植物遗体主要埋藏在粒径大于66 μm的沉积物中[25]。在本研究中, 沉积中的砂(>63 μm)占比与沉积有机质含量显著正相关, 这说明海藻场沉积物中的有机质主要保存在粒径大于63 μm的沉积物中, 因此认为海藻场沉积物有机质主要是来源于藻类碎屑和浮游植物。C/N比值、δ13C和δ15N广泛用于区分水生生态系统中的沉积有机物来源[1, 17, 26-27]。研究表明, 陆地C3植物和有机废水的δ13C值范围分别为–28‰~–26‰[6]和–28.1‰~–25.5‰[28], 海源有机质δ13C范围在–21‰~–18‰[29], 本研究中的端元生物和沉积物有机质的δ13C值与海源有机质的δ13C范围接近, 而远离陆源有机质δ13C范围, 且不发生重叠, 因此可以排除陆源有机质对本研究的影响。陆地维管植物体相较海洋藻类内含有大量纤维素, 其C/N比值通常大于20, 而海源有机质体内富含蛋白质, 其C/N比在5~9之间[20]。在水生生态系统研究中, 认为沉积物C/N比值小于8为典型的海源性来源, 大于12为典型的陆源型来源[30], 在本研究中, 无人村海藻场表层沉积物有机质C/N比值的范围为5.53~6.53, 因此, 该区域沉积物是典型的海源型来源, 与δ13C的判定结果一致。无人村海藻场沉积物有机质来源主要包括大型海藻、POM和浮游植物, 本研究分析结果表明POM是大型藻类和浮游植物的混合物, 因此无人村海藻场沉积物有机质来源为大型海藻和浮游植物混合贡献, 这与吴程宏等对枸杞岛的研究结果一致[14]。
3.2 影响沉积有机质的时空分布的因素6月中旬海藻场优势种羊栖菜、鼠尾藻等处于茂盛期, 并于7月初达到生物量最大值, 随后, 底栖藻类在7月迅速老化衰退, 8月上旬生物量达到最小值, 这说明7月到8月上旬之间会有大量海藻碎屑产生进入环境[31-34]。本研究中各月份沉积物有机质含量和大型海藻对沉积物有机质的贡献率有一定差异, 沉积物有机质含量和大型海藻对沉积物有机质的贡献率均表现为7月>8月>6月, 这主要是由海藻凋落量差异导致的。7月大型海藻生物迅速下降, 生物体结构快速解体, 碎屑产生量最大; 6月是优势藻种的凋落早期, 海藻结构解体速度较慢, 海藻碎屑产生量较小; 8月是藻体分解末期, 此时海藻分解虽然很快, 但此时生物量相较7月时已经减少很多, 总体上产生碎屑量较小, 因此6月和8月大型海藻对沉积物有机质的贡献率低于7月。此外, 研究区域是中国赤潮发生次数最多和累计面积最大区域, 赤潮主要集中发生在5~9月, 这也会在一定程度上影响海藻场沉积物有机质的分布与来源[1]。
对河口、海湾和养殖区域等水生系统的研究表明, 随研究区域与潜在来源生物距离的增加, 沉积物有机质含量和潜在来源生物对沉积物有机质的贡献率均呈下降趋势[1, 13, 26]。本研究对海藻场三个研究区域沉积物有机质含量和大型海藻对沉积物有机质的贡献率均表现为R1>R2>R3, 即随着研究区域与海藻生长区域的距离增加, 沉积物有机质含量和大型海藻对沉积有机质的贡献率均著下降, 这表明研究区域与潜在来源生物的距离是影响海藻场沿岸沉积有机质含量和来源的重要因素, 这与河口、海湾等水生生态系统中关于物源距离对沉积物有机质影响的研究结果一致[1, 13, 26]。
3.3 海藻场碎屑的去向海藻场作为生产力最高的近海生态系统之一, 海藻每年受波浪和生活史周期限制会产生大量有机碎屑[35]。据估计, 海藻生产力的82%进入了碎屑通道, 这些被释放的海藻碎屑会随水体离开海藻场进入邻近海区[36], 这与本研究对水体POM来源于大型海藻和浮游植物混合贡献的判断一致。水体中的海藻碎屑在迁移输运的过程中会不断向海底沉积, 进入深潮下带和更深的峡湾区域的沉积物中, 并为低生产力的深海区域底栖生物提供食物来源[37]。本研究评估结果显示, 海藻迅速凋落期7月, 海藻碎屑产生量和沉积在海藻场沿岸沉积物中的海藻碎屑量分别为2.53 t和0.30 t, 进入沉积物中的海藻约占海藻碎屑总产生量的11.98%, 有超过85%的海藻固碳量会被各种生物分解利用, 或随潮汐、海流向外输送。这表明海藻场对生物资源的养护功能不仅仅局限于海藻场生态系统本身, 而会在更大空间尺度产生影响邻近海区[37-38]。由于7月海藻场处于一个生活史交替时期, 一方面, 上一个生活史周期中海藻未完全衰退, 其藻体剩余的生殖托、叶片、气囊、枝干等结构进一步分解; 另一方面, 下一生活史周期的藻类已经进入幼苗期, 此时藻体具有初生叶片。这种海藻的生活史的交叉重叠现象可能导致海藻碎屑产生量会造成评估结果偏低, 因此会有更大比例的海藻碎屑被输送到邻近海区。
4 结论根据对沉积物的粒度组成、C/N比值和稳定同位素组成的分析, 嵊山岛海藻场沿岸沉积物有机质主要来源于大型海藻和浮游植物的混合贡献。通过贝叶斯稳定同位素混合模型分析, 结果显示大型海藻对沉积物有机质的贡献率为2.30%~45.60%, 这主要受海藻生活史周期和物源距离影响。在空间分布上, 随离岸距离增加大型海藻对沉积物有机质的贡献率显著下降; 在时间分布上, 在海藻迅速凋落期, 大型海藻对沉积物有机质的贡献率最高, 而凋落早期和凋落末期大型海藻贡献率较低。在海藻迅速凋落期7月, 进入沉积物中海藻约占海藻碎屑总产生量的11.98%, 超过85%的海藻碎屑被生物分解利用, 或随潮汐、海流向外输送。本研究初步探讨了海藻场沉积物有机质来源和分布, 以及海藻碎屑的去向, 这对于阐释海藻场的生物资源养护功能与管理具有重要意义。
| [1] |
GU Y G, OUYANG J, NING J J, et al. Distribution and sources of organic carbon, nitrogen and their isotopes in surface sediments from the largest mariculture zone of the eastern Guangdong coast, South China[J]. Marine Pollution Bulletin, 2017, 120(1/2): 286-291. |
| [2] |
KUBO A, KANDA J. Seasonal variations and sources of sedimentary organic carbon in Tokyo Bay[J]. Marine Pollution Bulletin, 2017, 114(2): 637-643. DOI:10.1016/j.marpolbul.2016.10.030 |
| [3] |
HEDGES J I, KEIL R G. Sedimentary organic matter preservation: an assessment and speculative synthesis[J]. Marine Chemistry, 1995, 49(2/3): 81-115. |
| [4] |
HEDGES J I, KEIL R G, BENNER R. What happens to terrestrial organic matter in the ocean?[J]. Organic Geochemistry, 1997, 27(5/6): 195-212. |
| [5] |
LIU D, LI X, EMEIS K C, et al. Distribution and sources of organic matter in surface sediments of Bohai Sea near the Yellow River Estuary, China[J]. Estuarine, Coastal and Shelf Science, 2015, 165: 128-136. DOI:10.1016/j.ecss.2015.09.007 |
| [6] |
HU J, PENG P A, JIA G, et al. Distribution and sources of organic carbon, nitrogen and their isotopes in sediments of the subtropical Pearl River estuary and adjacent shelf, Southern China[J]. Marine Chemistry, 2006, 98(2/4): 274-285. |
| [7] |
MOTTET M G. Enhancement of the marine environment for fisheries and aquaculture in Japan[M]. Boca Raton: CRC Press, 2018: 13-112.
|
| [8] |
STENECK R S, GRAHAM M H, BOURQUE B J, et al. Kelp forest ecosystems: biodiversity, stability, resilience and future[J]. Environmental Conservation, 2002, 29(4): 436-459. DOI:10.1017/S0376892902000322 |
| [9] |
Luning K. Seaweeds: Their environment, biogeography and ecophysiology[J]. Journal of Ecology, 1991, 79(2): 1066. |
| [10] |
GRAHAM M H. Effects of local deforestation on the diversity and structure of Southern California Giant Kelp Forest Food Webs[J]. Ecosystems, 2004, 7(4): 341-357. |
| [11] |
MILLER R J, LAFFERTY K D, LAMY T, et al. Giant kelp, macrocystis pyrifera, increases faunal diversity through physical engineering[J]. Proceedings of the Royal Society B Biological Sciences, 2018, 285(1874): 2017-2571. |
| [12] |
FILBEE-DEXTER K, SCHEIBLING R E. Sea urchin barrens as alternative stable states of collapsed kelp ecosystems[J]. Marine Ecology Progress Series, 2014, 495: 1-25. DOI:10.3354/meps10573 |
| [13] |
于广磊, 李斌, 李凡, 等. 黄河口附近海域沉积物中碳氮元素地球化学特征及有机质来源研究[J]. 海洋环境科学, 2019, 38(6): 862-867. YU Guanglei, LI Bin, LI Fan, et al. Carbon, nitrogen geochemical character and organic matter source study in the coastal sediment of Yellow River Estuary[J]. Marine Environmental Science, 2019, 38(6): 862-867. |
| [14] |
吴程宏, 章守宇, 周曦杰, 等. 岛礁海藻场沉积有机物来源辨析[J]. 水产学报, 2017, 41(8): 1246-1255. WU Chenghong, ZHANG Shouyu, ZHOU Xijie, et al. Identifying sources of sedimentary organic matter in the rocky reef seaweed bed[J]. Journal of Fisheries of China, 2017, 41(8): 1246-1255. |
| [15] |
HU L, GUO Z, FENG J, et al. Distributions and sources of bulk organic matter and aliphatic hydrocarbons in surface sediments of the Bohai Sea, China[J]. Marine Chemistry, 2009, 113(3/4): 197-211. |
| [16] |
KRISHNA M S, NAIDU S A, SUBBAIAH C V, et al. Distribution and sources of organic matter in surface sediments of the eastern continental margin of India[J]. Journal of Geophysical Research: Biogeosciences, 2013, 118(4): 1484-1494. DOI:10.1002/2013JG002424 |
| [17] |
VILHENA M P S P, COSTA M L, BERREDO J F, et al. The sources and accumulation of sedimentary organic matter in two estuaries in the Brazilian Northern coast[J]. Regional Studies in Marine Science, 2018, 18: 188-196. DOI:10.1016/j.rsma.2017.10.007 |
| [18] |
OGAWA Y, OKAMOTO Y, SADABA R B, et al. Sediment organic matter source estimation and ecological classification in the semi-enclosed Batan Bay Estuary, Philippines[J]. International Journal of Sediment Research, 2021, 36(1): 110-119. DOI:10.1016/j.ijsrc.2020.05.007 |
| [19] |
MIDDELBURG J J, HERMAN P M J. Organic matter processing in tidal estuaries[J]. Marine Chemistry, 2007, 106(1/2): 127-147. |
| [20] |
张凌, 陈繁荣, 殷克东, 等. 珠江口及近海表层沉积有机质的特征和来源[J]. 热带海洋学报, 2010, 29(1): 98-103. ZHANG Ling, CHEN Fanrong, YIN Kedong, et al. The characteristics and sources of surface sediments in the Pearl River Estuary and its adjacent shelves[J]. Journal of Tropical Oceanography, 2010, 29(1): 98-103. |
| [21] |
FRY B, SHERR E. δ13C measurements as indicators of carbon flow in marine and freshwater ecosystems[M]. New York: Springer New York, 1989: 196-229.
|
| [22] |
MEYERS P A. Organic geochemical proxies of paleoceanographic, paleolimnologic, and paleoclimatic processes[J]. Organic Geochemistry, 1997, 27(5/6): 213-250. |
| [23] |
GEARING J N. The use of stable isotope ratios for tracing the nearshore-offshore exchange of organic matter[M]. Berlin: Springer, 1988: 69-101.
|
| [24] |
袁杰, 曹广超, 鄂崇毅, 等. 环青海湖表层土壤沉积物粒度分布特征及其指示意[J]. 水土保持研究, 2015, 22(3): 150-154. YUAN Jie, CAO Guangchao, E Chongyi, et al. Grain size distributions of the surface soil deposit around qinghai lake and its implications[J]. Research of Soil and Water Conservation, 2015, 22(3): 150-154. |
| [25] |
冯晓萍, 蔡进功. 沉积物的颗粒大小与所含有机质关系的研究进展[J]. 海洋地质与第四纪地质, 2010, 30(6): 141-148. FENG Xiaoping, CAI Jingong. Relationship between sediment partcle size and organic matter: recent progress[J]. Marine Geology & Quaternary Geology, 2010, 30(6): 141-148. |
| [26] |
GIREESHKUMAR T R, DEEPULAL P M, CHANDRAMOHANAKUMAR N. Distribution and sources of sedimentary organic matter in a tropical estuary, south west coast of India (Cochin estuary): a baseline study[J]. Marine Pollution Bulletin, 2013, 66(1/2): 239-245. |
| [27] |
LIAO W S, HU J F, ZHOU H D, et al. Sources and distribution of sedimentary organic matter in the Beibu Gulf, China: Application of multiple proxies[J]. Marine Chemistry, 2018, 206: 74-83. DOI:10.1016/j.marchem.2018.09.006 |
| [28] |
郑新庆, 黄凌风, 杜建国, 等. 筼筜湖绿潮期间颗粒有机物及沉积有机物的来源研究[J]. 海洋学报, 2013, 35(5): 102-111. ZHENG Xinqing, HUANG Lingfeng, DU Jianguo, et al. The source of particulate organic matter and sedimentation organic matter during macroalgae bloom in Yundang Lagoon[J]. Acta Oceanologica Sinica, 2013, 35(5): 102-111. |
| [29] |
GOÑI M A, RUTTENBERG K C, EGLINTON T I. Sources and contribution of terrigenous organic carbon to surface sediments in the Gulf of Mexico[J]. Nature, 1997, 389(6648): 275-278. DOI:10.1038/38477 |
| [30] |
赖建平. 鄱阳湖区悬浮颗粒物和表层沉积物有机质碳, 氮同位素研究[D]. 南昌: 南昌大学, 2012. LAI Jianping. Carbon and nitrogen isotopes of suspended particulate matter and surface sediments in Poyang Lake Region[D]. Nanchang: Nanchang University, 2012. |
| [31] |
陈亮然, 章守宇, 陈彦, 等. 枸杞岛马尾藻场铜藻的生命史与形态特征[J]. 水产学报, 2015, 39(8): 1218-1229. CHEN Liangran, ZHANG Shouyu, CHEN Yan, et al. Life history and morphology of Sargassum horneri from the Sargassum seaweed bed of Gouqi Island[J]. Journal of Fisheries of China, 2015, 39(8): 1218-1229. |
| [32] |
詹冬梅, 吕芳, 栾青, 等. 山东省荣成海区潮间带鼠尾藻生长及其化学组分的季节性变化[J]. 大连海洋大学学报, 2018, 33(3): 295-299. ZHAN Dongmei, LV Fang, LUAN Qing, et al. Growth and seasonal constituent variations in brown alga Sargassum thunbergii at different tidal zones in coastal Rongcheng, Shandong Province[J]. Journal of Dalian Ocean University, 2018, 33(3): 295-299. |
| [33] |
韩军军, 白凯强, 赵明林, 等. 瓦氏马尾藻有性繁殖和幼孢子体发育的形态学观察[J]. 水生生物学报, 2016, 40(6): 1215-1220. HAN Junjun, BAI Kaiqiang, ZHAO Minglin, et al. Morphological observation of sargassum vachellianum sexual reproduction and juvenile sporophyte development[J]. Acta Hydrobiologica Sinica, 2016, 40(6): 1215-1220. |
| [34] |
孙建璋, 方家仲, 朱植丰, 等. 羊栖菜Sargassum fusiforme (Have) Setch繁殖生物学的初步研究[J]. 浙江水产学报, 1996, 15(4): 243-249. SUN Jianzhang, FANG Jiazhong, ZHU Zhifeng, et al. A preliminary study on the reproductive biology of Sargassum fursiforme[J]. Journal of Zhejiang College of Fisheries, 1996, 15(4): 243-249. |
| [35] |
FEEHAN C J, GRAUMAN-BOSS B C, STRATHMANN R R, et al. Kelp detritus provides high-quality food for sea urchin larvae[J]. Limnology and Oceanography, 2018, 63(1): 299-306. |
| [36] |
KRUMHANSL K A, SCHEIBLING R E. Production and fate of kelp detritus[J]. Marine Ecology Progress Series, 2012, 467: 281-302. |
| [37] |
FILBEE-DEXTER K, WERNBERG T, NORDERHAUG K M, et al. Movement of pulsed resource subsidies from kelp forests to deep fjords[J]. Oecologia, 2018, 187(1): 291-304. |
| [38] |
CLASEN J L, SHURIN J B. Kelp forest size alters microbial community structure and function on Vancouver Island, Canada[J]. Ecology, 2016, 96(3): 862-872. |
 2023, Vol. 47
2023, Vol. 47


