文章信息
- 刘峰, 吴乐乐, 王雨浓, 齐婷, 徐世宏, 李军, 李贤. 2023.
- LIU Feng, WU Le-le, WANG Yu-nong, QI Ting, XU Shi-hong, LI Jun, LI Xian. 2023.
- 大菱鲆幼鱼视网膜结构及不同光谱下视蛋白基因表达特征的研究
- Development of retinal structures and opsin gene expression under different spectra in juvenile turbot
- 海洋科学, 47(12): 30-39
- Marine Sciences, 47(12): 30-39.
- http://dx.doi.org/10.11759/hykx20230319001
-
文章历史
- 收稿日期:2023-03-19
- 修回日期:2023-04-27
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266237;
3. 中国科学院 海洋大科学研究中心, 山东 青岛 266071;
4. 中国科学院大学, 北京 100049;
5. 中国海洋大学 水产学院, 山东 青岛 266003
2. Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao Laboratory for Marine Biology and Biotechnology, Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China;
5. Fisheries College, Ocean University of China, Qingdao 266003, China
由于自然水体中光环境的差异, 鱼类在长期的进化过程中对光谱环境产生了适应, 以实现个体生存利益的最大化[1]。感光系统、生理反应和行为偏好表现出对光谱环境的适应性特征, 表现为不同发育阶段或环境诱导的物种特异性和可塑性。何大仁等[2]研究比较黄鳍鲷(Spaus latus)、金色小沙丁鱼(Sardinella aurita)、赤点石斑鱼(Epinephelus akaara)、蓝圆鲹(Decapterus maruadsi)和鲻(Mugil cephalus)等海水鱼的视网膜结构, 发现具有视觉高敏感型视网膜的鱼类对光环境的变化有较强的适应性。大多数卵生鱼类的初孵仔鱼视网膜尚未发育完全, 在孵化后约2~3 d逐渐出现感光细胞层[3-5]。在后期发育过程中, 视网膜的结构不断发生变化, 这是对生态环境异质性的适应。在一些底栖鱼类中, 为了适应水底的弱光环境, 双锥细胞和三锥细胞的数量逐渐增加, 以获得更高的光敏性。如半滑舌鳎(Cynoglossus semilaevis)幼鱼早期主要为高密度的单锥细胞, 适合上层水域生活, 而变态发育完成后栖息于水体底层, 以夜间活动为主, 双锥细胞明显增多[6]。在对不同光环境的长期适应过程中, 视网膜的结构, 包括各层的细胞类型、数量以及厚度, 在不同物种之间可能会出现巨大的差异[7]。为了适应明亮的环境, 上层水域的鱼类其内核层具有分化程度更高的细胞[8]。而底层弱光环境下的鱼类, 如半滑舌鳎、牙鲆(Paralichthys)等, 内核层细胞较少, 甚至没有明显的分化[6]。与浅水层昼行性物种相比, 为适应弱光环境, 提高光敏性, 生活在珊瑚礁上的夜行性物种灯颊鲷(Anomalops katoptron)发育出以杆状细胞为主的视网膜结构, 外核层与内核层的厚度增加[8]。此外, 同一物种的视网膜结构通常随着对不同光环境的适应而变化。例如, 在黑暗适应后, 三棱石斑鱼(Epinephelus heniochus)的感光细胞外段变短, 感光细胞层厚度明显减少, 色素指数下降。当光强增加到10 lx以上时, 色素颗粒开始包裹感光细胞层, 色素指数显著增加[9]。章厚泉等[10]也报道, 为了平衡蓝光环境下的颜色感知, 中长波长敏感锥细胞的外段长度显著增加, 而短波长敏感锥细胞的数量减少了65%。
除了视网膜结构外, 不同物种视蛋白的表达水平也存在光谱环境的适应性变化。光被视网膜或松果体等光敏器官接收后, 会传输到下丘脑-垂体系统, 在调节生长、繁殖和代谢等生理活动中发挥重要作用[11]。由于视蛋白表达的差异, 大多数物种对其原始栖息地的特定光谱更敏感[12, 13]。例如, sws1、rh2和lws在拟沙丁鱼(Sardinops melanosticus)中表达, 而sws2在丁香鱼(Engraulis japonicus)、鲫(Crucian carp)、斑马鱼(Danio rerio)和蓝鳍金枪鱼(Thunnus orentalis)中表达[14, 15]。鱼类的不同生命周期阶段视蛋白的组成可能不同。例如, 黄盖鲽(Pseudopleuronectes yokohamae)在不同的发育阶段通过调节视蛋白的表达量来适应光谱环境的变化[16]。在黑鲷(Acanthopagrus schlegelii)幼鱼中, 视紫红质rh1占总视蛋白表达量的60%, 而在成鱼中, 这一比例上升到90%。在这一过程中, 随着幼鱼从内湾浅水区向深水区迁移, 幼鱼增加了rh1的表达, 以提高光敏性, 适应光环境的变化[17]。
大菱鲆(Scophthalmus maximus)是中国重要的经济海水养殖鱼类, 其在生长发育过程中会经历变态发育, 生活习性由浮游生活转为底栖生活, 栖息水域由浅海游向深海[18]。这个过程伴随着光环境的改变, 视觉器官结构和视觉功能也表现出适应性变化。本研究以大菱鲆幼鱼为对象, 研究不同发育阶段大菱鲆幼鱼视网膜结构、视蛋白基因的表达特征及不同光谱处理下视蛋白表达的变化趋势, 以期在理论上深入理解鱼类视觉发育规律、感光功能可塑性及其对光环境的适应机制, 为探究大菱鲆对光环境的适应机制及工厂化养殖光照调控技术的建立提供理论参考。
1 材料与方法 1.1 实验用鱼本研究中实验鱼均取自威海圣航水产科技有限公司, 分别为生产条件下养殖的2月龄(1.53±0.27 g)、3月龄(3.43±0.29 g)、9月龄(34.92±2.33 g)幼鱼, 和在红光、黄光、蓝光、绿光和全光5种不同光谱环境中饲养2.5个月的7月龄(20.4±1.7 g)幼鱼, 光环境及养殖条件参照Wu等[19]。工厂化正常养殖大菱鲆幼鱼各阶段分别20尾, 其中10尾用于组织学观察, 10尾用于视蛋白基因表达检测; 取不同光谱下饲养的幼鱼各10尾用于视蛋白基因表达差异检测。样本采集前用质量浓度为300 mg/L的间氨基苯甲酸乙酯甲磺酸盐(MS 222)进行麻醉, 随后立即解剖取出眼睛分别置于4% PFA固定液和液氮中保存, 以用于组织石蜡切片、视蛋白基因表达qPCR分析。
1.2 石蜡切片眼组织固定24 h后, 置于70%酒精保存。眼组织经过梯度乙醇溶液脱水、二甲苯透明、浸蜡、石蜡包埋后, 进行横向的连续切片, 石蜡块的切片厚度为5 μm。经HE染色后, 在Nikon(Ni-U, Nikon, 日本)显微镜下观察并拍照。统计大菱鲆视网膜上色素层、视锥视杆层、外核层、内核层和神经节细胞层与整个视网膜厚度的比值, 具体方法参考车景青等[20, 21]。
1.3 视蛋白的表达特征对液氮中保存的眼组织进行RNA的提取并进行电泳检测和浓度检测, 所有浓度归一后进行逆转录合成cDNA, 实时荧光定量(qPCR)检测视蛋白基因的相对表达量。引物序列以及具体步骤参考王雨浓等[21]。
2 结果 2.1 大菱鲆不同发育时期视网膜的结构变化如图 1所示, 2月龄大菱鲆幼鱼视网膜呈现脊椎动物经典10层结构, 由脉络膜至晶体方向依次为: (1)色素上皮层(Pigment epithelium layer, PEL); (2)视锥视杆层(Layer of rods and cones, RCL); (3)外界膜(Outer limiting membrane, OLM); (4)外核层(Outer nuclear layer, ONL); (5)外网层(Outer reticular layer, ORL); (6)内核层(Inner nuclear layer, INL); (7)内网层(Inner reticular layer, IRL); (8)神经节细胞层(Layer of gangion cells, GCL); (9)神经纤维层(Nerve fiber layer, NFL); (10)内界膜(Inner limiting membrane, ILM)。2月龄大菱鲆神经节细胞层紧密排列, 且细胞数量较多; 9月龄时, 神经节细胞数量有所下降, 神经节细胞排列变得稀疏。各时期各层的厚度与视网膜整体厚度的比值如图 2所示。2月龄与3月龄之间的色素上皮层厚度与视网膜整体厚度的比值存在显著的差异; 2月龄、3月龄以及9月龄视锥视杆层厚度与视网膜整体厚度比值之间差异不显著; 9月龄的外核层厚度与视网膜整体厚度比值显著高于2月龄和3月龄; 2月龄时内核层的厚度与总厚度的比值显著大于3月龄与9月龄(P<0.05); 随着大菱鲆幼鱼的生长发育视网膜的内核层与神经节层视网膜整体厚度的比值下降、外核层厚度与视网膜整体厚度的比值升高; 而视锥视杆层的厚度与视网膜整体厚度的比值没有显著的变化。
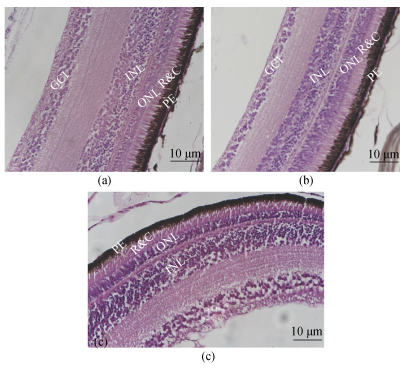 |
| 图 1 大菱鲆各发育阶段视网膜结构HE染色 Fig. 1 Hematoxylin and eosin staining of turbot retinal structures at different developmental stages a. 2月龄; b. 3月龄; c. 9月龄; PE.色素上皮层; R&C.视锥视杆层; ONL.外核层; INL.内核层; GCL.神经节细胞层 |
 |
| 图 2 视网膜各层厚度与视网膜整体厚度的比值 Fig. 2 Ratio of the thickness of each retina layer to the thickness of the retina 注: 不同字母“a”“b”“c”表示显著差异。显著水平为P<0.05 |
2月龄时大菱鲆幼鱼具有5类视蛋白基因的表达, 分别为视杆细胞中的视紫红质基因rh1、视锥细胞中的紫外视蛋白基因sws1、红视蛋白基因lws、蓝视蛋白基因sws2以及绿视蛋白基因rh2家族(rh2a1、rh2a2、rh2b1、rh2b2、rh2c)。2月龄时眼组织中各视蛋白基因的表达量由高到低依次是rh1、rh2家族、lws、sws1、sws2; 3月龄为rh1、rh2家族、lws、sws2、sws1; 9月龄时则为rh1、rh2家族、sws1、sws2、lws。随着幼鱼的生长发育, 各类视蛋白基因的表达也发生了改变。其中绿视蛋白5个亚家族基因中(rh2a1、rh2a2、rh2b1)的表达趋势一致, 均表现为2月龄的表达量显著高于3月龄和9月龄, 3月龄与9月龄之间差异不显著(P<0.05)。绿视蛋白基因家族中的rh2c、rh2b2和视杆细胞中的视紫红质基因rh1以及其他3种视锥细胞中的紫外视蛋白基因sws1、蓝视蛋白基因sws2、红视蛋白基因lws的表达量均表现出随着月龄的增加而逐渐降低的趋势(图 3)。大菱鲆幼鱼视杆细胞中的视紫红质基因rh1在3个时期都是表达比例最高的, 在3个阶段均超过总量的50.00%, 且随着幼鱼的生长发育所占比例逐渐上升, 由2月龄的57.35%上升到9月龄77.19%。视锥蛋白的表达比例随着月龄的增加逐渐下降, 其中绿视蛋白基因rh2家族是所有视锥蛋白中表达比例最高的, 2月龄时表达比例为32.77%, 9月龄时减小到20.72%。红视蛋白基因lws由2月龄时的4.49%下降至9月龄时的0.13%。蓝视蛋白基因sws2的表达比例平稳下降。紫外视蛋白基因sws1的表达比例呈现先下降后上升的趋势(图 4)。
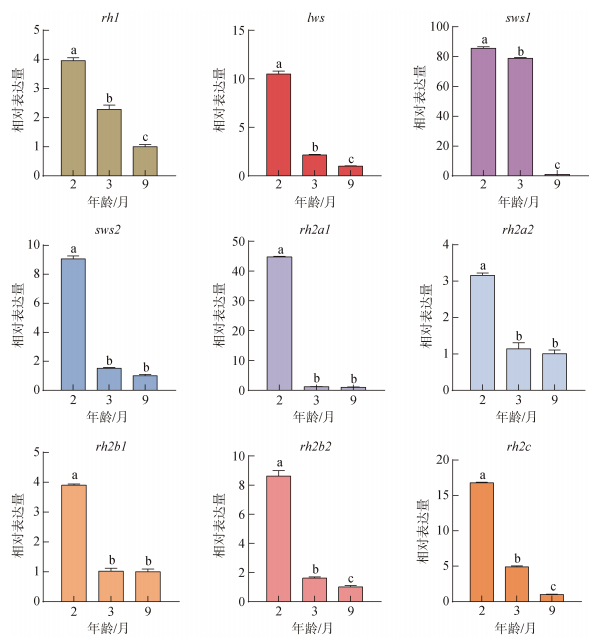 |
| 图 3 不同发育阶段大菱鲆幼鱼视蛋白各基因相对表达 Fig. 3 Relative expression of opsin genes in juvenile turbot at different developmental stages 注: 不同字母“a”“b”“c”表示显著差异。显著水平为P<0.05 |
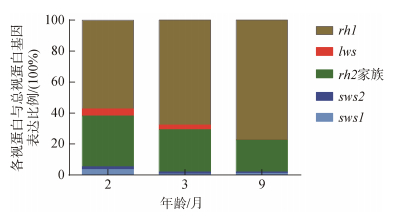 |
| 图 4 不同发育阶段大菱鲆幼鱼各视蛋白基因与总视蛋白基因表达量的比例 Fig. 4 The ratio of the expression of each opsin gene to the expression of all opsin genes in juvenile turbot at different developmental stages |
不同光谱处理下, 大菱鲆幼鱼的9种视蛋白基因中lws、rh1、rh2a1、rh2a2、rh2b2、rh2c在5种光谱下的表达水平没有显著的变化。rh2b1、sws1和sws的相对表达量存在差异。与全光谱相比, rh2b1、sws2、sws1在红、黄光下的表达量显著下降(P<0.05), 而rh2b1在蓝、绿光下表达显著上升、sws2在绿光下表达显著上升, 其他则变化不显著(图 5)对不同光谱处理下的5类视蛋白基因占视蛋白基因总表达量的比例统计分析结果如图 6所示。黄、绿、蓝以及全光谱下基因rh2家族与视蛋白基因总表达量的比例最高, 分别为69.57%、66.84%、72.87%、61.57%; 而红光下基因rh1的表达量占比最高达到74.10%。红光下幼鱼rh1与视蛋白基因总表达的比例达到74.1%显著高于其他光谱环境, rh2基因家族与视蛋白基因总表达的比例只有18.71%显著低于其他光谱(P<0.05)。蓝光下rh1与视蛋白基因总表达的比例为19.77%显著低于其他光谱, 但比例为2.10%的sws2和72.87%的rh2基因家族却显著高于其他光谱组(P<0.05)。与全光谱相比, 红光下rh1的表达比例升高, rh2基因家族的表达比例下降; 蓝光下rh1的表达比例下降, sws2和rh2家族的表达比例升高(图 6)。
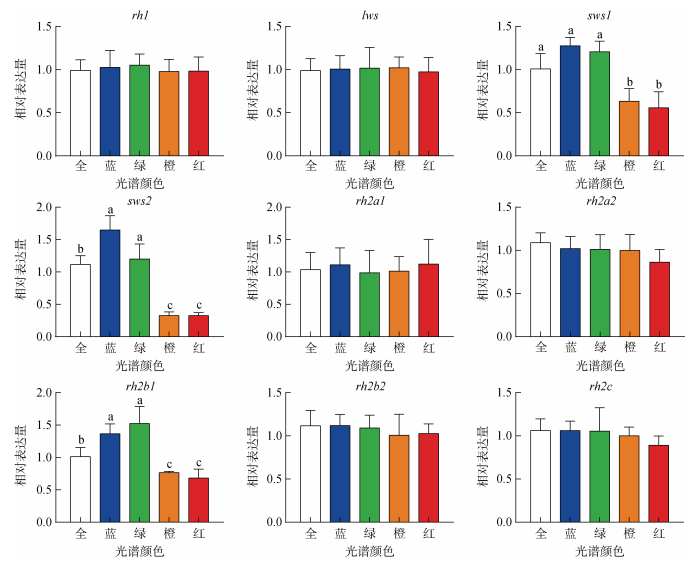 |
| 图 5 不同光谱下大菱鲆幼鱼视蛋白基因的表达特征 Fig. 5 Expression characteristics of opsin genes in juvenile turbot under different spectra 注: 不同字母“a”“b”“c”表示显著差异。显著水平为P<0.05 |
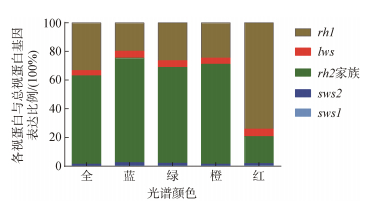 |
| 图 6 不同光谱下各视蛋白基因与总视蛋白基因表达的比例 Fig. 6 Proportion of opsin gene expression to total opsin gene expression under different spectra |
视觉作为动物获取外界信息的重要途径之一, 在觅食、求偶及躲避敌害等方面具有重要作用[22]。当水生生物栖息的光环境发生改变时, 鱼类视网膜上的视觉光感受器通常会进行调整, 以确保最佳的适应能力[23]。鱼类视网膜在视觉信号转导的过程中起着重要的作用, 视网膜各层的厚度与细胞数量共同影响鱼类的光敏感性与视觉精确度[24]。视网膜结构的变化与鱼类的生活习性、捕食行为, 与栖息环境有很强的相关性[25-27]。随着鳜(Siniperca chuatsi)的生长发育, 其视网膜中视锥细胞和神经节细胞的密度降低, 视杆细胞的密度增加, 外核层以及神经节细胞层与视网膜整体厚度的比值增大[28]。在半滑舌鳎中有研究发现, 随其生长发育视锥细胞和神经节细胞密度降低而视杆细胞密度增加, 1月龄以后视杆细胞数量显著增加; 同时外核层细胞核与神经节细胞的比值增大[29, 30]。本研究获得了类似的结果, 大菱鲆幼鱼视网膜神经节细胞层中的神经节细胞在2月龄时排列较为紧密, 且数量较多; 到了9月龄时排列变得稀疏, 且数量有所下降。随着大菱鲆幼鱼的生长, 视网膜中外核层的厚度逐渐增加, 神经节细胞层的厚度逐渐减小, 导致其光敏感性进一步增强。车景青等[20]对大菱鲆鱼苗视网膜的结构特征研究发现其变态前后视网膜上外核层细胞核的数量显著增多, 外核层厚度显著增大; 内核层的厚度先增大后减小。大菱鲆幼鱼视网膜的变化可能与大菱鲆变态发育之后的底栖生活有关。经过水层的吸收与散射, 底层的光环境减弱, 可能为了适应这种光环境的变化, 大菱鲆的视网膜结构进行了调整以便更好的适应底栖的弱光环境。上述研究结果暗示, 大菱鲆幼鱼在变态后其视网膜可能仍需一段较长的发育过程以适应水体底层的光环境变化。
3.2 大菱鲆生长发育过程中视蛋白基因表达比例特征变化鱼类在不同发育时期对光的敏感性不同, 处于不同发育阶段的鱼类, 视蛋白基因表达的差异性, 是其适应各发育阶段生活水层中光环境差异的机制之一[31]。如黄盖鲽在生长发育中, rh1基因和lws基因表达量逐渐上升, sws1等短波敏感视蛋白基因则逐渐下降[16]。本研究中发现随着大菱鲆的生长发育, rh1的表达比例逐渐增加, 从2月龄的57.35%增加到9月龄的77.19%。在其他鱼类中也观察到相似的变化过程, 如鲑(Oncorhynchus kisutch)[32, 33]、鳗(Anguilla japonica)、鳟(Oncorhynchus mykiss)[13]和黑鲷[34]。红鳍笛鲷(Lutjanus erythropterus)有着与大菱鲆相似的生活史, 在早期仔鱼阶段营浮游生活, lws主要感受长波的红色光(λmax约560 nm), 底栖生活时后在视网膜中rh1基因表达占据绝对优势, 而视锥蛋白的作用相对减弱, 视紫红质在对鱼类适应弱光环境、摄食及躲避敌害等方面发挥重要作用[35]。随着大菱鲆幼鱼的生长发育rh1的表达比例上升以及lws表达比例的下降表明大菱鲆rh1和lws基因表达与其生活光环境的变化密切相关, 在早期适应上层水域的浮游生活, 以及底栖生活适应弱光环境等方面发挥重要作用。黄盖鲽rh1基因表达量随生长发育而逐渐上升, sws1等短波敏感视蛋白基因则逐渐下降[16], 表征其与大菱鲆相似的栖息地光环境特征和视蛋白表达特征。
3.3 不同光谱对大菱鲆幼鱼视蛋白基因表达的影响视蛋白是G蛋白偶联受体超家族, 由350~400个氨基酸组成。视色素接收光信号后, 11-顺式视黄醛构象改变, 形成全反式视黄醛, 从而启动光信号转导过程[36]。鱼类对不同光环境刺激的响应中视蛋白表达可塑性具有物种特异性, 丽鱼(Metriaclima mbenji)在幼鱼期和成鱼期都存在视蛋白表达的可塑性变化[37]。然而, 大西洋鳕鱼(Gadus morhua)在仔鱼期经过不同光谱的刺激后, 视蛋白的表达并未出现变化[38]。不同物种间的差异可能与遗传或生态视觉的需求有关[39]。与绿光相比, 橙光处理下的孔雀鱼(Poecilia reticulata)显示出更高的lws表达水平, 并且其lws表达变化与对长波长光谱的行为敏感性密切相关[40]。类似地, 对于蓝鳍卢氏鳉(Lucania goodie), 在清水中饲养的个体表现出较高的sws2b2和sws1表达水平, 而在紫外/蓝光成分弱的浑浊水体中生长的个体表现出较高的lws和rh2表达水平[41]。慈鲷(Cichlidae)成鱼也表现出由光谱差异引起的视蛋白表达的可塑性变化[42]。大多数动物都拥有发育良好的光感受器和神经网络, 通过对光的感知来调控生理活动, 对环境变化做出反应并产生适应性[43]。本研究中大菱鲆幼鱼表现出不同发育阶段及不同光谱环境下视蛋白基因表达的可塑性, 其中rh1与总视蛋白基因的表达比例随着大菱鲆幼鱼的生长发育比值上升, 由2月龄的57.35%上升到9月龄77.19%。不同光谱下, rh2b1、sws2、sws1均表现出显著的表达差异和变化趋势, 红光下rh1的表达比例也显著高于其它光谱(P<0.05)。鱼类眼睛的结构特征以及视蛋白基因在光谱环境下的表达模式变化, 体现了其适应不同光环境下的强大调节机制[44]。研究视蛋白基因的表达特征有利于我们更好地了解鱼类视觉适应光谱环境的机制。然而, 在视蛋白基因的表达可塑性机制中, 是由光环境变化或遗传因素的主导地位仍有待进一步的研究。
4 结论2、3、9月龄时大菱鲆幼鱼视网膜呈现清晰的经典10层结构, 且外核层的厚度与视网膜整体厚度的比值随着年龄的增长逐渐上升。5类视蛋白基因在2月龄时均有表达, 其中视锥细胞中的紫外视蛋白基因sws1、蓝视蛋白基因sws2、红视蛋白基因lws的表达量都是随着月龄的增加而逐渐降低; 视紫红质基因rh1的表达比例上升, 由2月龄的57.35%上升到9月龄77.19%; 视锥蛋白基因的表达比例下降; 其中红视蛋白基因lws由2月龄时的4.49%到9月龄时的0.13%。当大菱鲆幼鱼视蛋白基因的表达呈现出光谱环境的可塑性变化, 红光下rh1的表达比例升高, rh2基因家族的表达比例下降; 蓝光下rh1的表达比例下降, sws2和rh2基因家族的表达比例升高。大菱鲆幼鱼视网膜结构特征的变化与视蛋白表达的变化可能是其适应生活环境变化的一种策略。
| [1] |
KUSMIC C, GUALTIERI P J. Morphology and spectral sensitivities of retinal and extraretinal photoreceptors in freshwater teleosts[J]. Semanticscholar, 2000, 31(2): 183-200. |
| [2] |
何大仁, 徐永淦. 五种海水鱼视网膜结构的比较[J]. 应用海洋学学报, 1993, 12(4): 342-350. HE Daren, XU Yonggan. Comparison on retinal structure of five specles of marine fishes[J]. Journal of Applied Oceanography, 1993, 12(4): 342-350. |
| [3] |
严太明, 杨世勇, 杨淞, 等. 重口裂腹鱼眼早期形态发生研究[J]. 四川动物, 2014, 2(2): 239-243. YAN Taiming, YANG Shiyong, YANG Song, et al. Early eye morphogenesis of Schizothorax davidi[J]. Sichuan Journal of Zoology, 2014, 2(2): 239-243. |
| [4] |
CHE J, CHEN J, HU M F. Histological structure of retina and visual characteristics of turbot fry[J]. Progress in Fishery Sciences, 2016, 37(3): 25-32. |
| [5] |
HAN M M, LI X, WU L L, et al. The plasticity of vision and body development of turbot Scophthalmus maximus larvae under different light spectra[J]. Aquaculture Research, 2020, 51(8): 3347-3357. DOI:10.1111/are.14670 |
| [6] |
马爱军, 王新安, 庄志猛, 等. 半滑舌鳎与摄食行为相关的特定感觉器官研究[J]. 海洋与湖沼, 2007, 38(3): 240-245. MA Aijun, WANG Xinan, ZHUANG Zhimeng, et al. Study on relationship of the special sense organ and feeding behaviour of cynoglossus semilaevis gunter[J]. Oceanologia et Limnologia Sinica, 2007, 38(3): 240-245. DOI:10.3321/j.issn:0029-814X.2007.03.009 |
| [7] |
张瑞祺, 赵岩, 唐首杰, 等. 鳜视网膜, 侧线结构及视觉与侧线在捕食行为中相互作用机制的行为学分析[J]. 水产学报, 2018, 11(4): 215-223. ZHANG Ruiqi, ZHAO Yan, TANG Shoujie, et al. Retina, lateral line structure of mandarinfish (Siniperca chuatsi) along with behavioral analysis of interaction mechanism between vision and lateral line in predatory behavior[J]. Journal of Fisheries of China, 2018, 11(4): 215-223. |
| [8] |
MARK M D, DONNER M, EICKELBECK D, et al. Visual tuning in the flashlight fish Anomalops katoptron to detect blue, bioluminescent light[J]. PLOS ONE, 2018, 13(7): 198-765. |
| [9] |
BEJARANO‐ESCOBAR R, BLASCO M, DEGRIP W J, et al. Eye development and retinal differentiation in an altricial fish species, the senegalese sole (Solea senegalensis, Kaup 1858[J]. Fish Diseases, 2010, 314(7): 580-295. |
| [10] |
章厚泉, 何大仁. 鲑点石斑鱼, 大弹涂鱼在不同光照强度下网膜运动反应的比较[J]. 厦门大学学报, 1989, 28(6): 647-665. ZHANG Houquan, HE Daren. The comparison of zhe retinomotor responses of epinephhis fario boleopfthalmas petiairostris under various light intensities[J]. Journal of Xiamen University(Natural Science), 1989, 28(6): 647-665. |
| [11] |
WAGNER H J, KRöGER R H J P I R, RESEARCH E. Adaptive plasticity during the development of colour vision[J]. Progress in Retinal and Eye Researc, 2005, 24(4): 521-536. DOI:10.1016/j.preteyeres.2005.01.002 |
| [12] |
FALCON J, MIGAUD H, MUNOZ-CUETO J A, et al. Current knowledge on the melatonin system in teleost fish[J]. Journal of Fish Biology, 2010, 165(3): 469-482. |
| [13] |
CHRISTIANA L C, NOVALES I F. Chromatic organization of cone photoreceptors in the retina of rainbow trout: single cones irreversibly switch from UV (SWS1) to blue (SWS2) light sensitive opsin during natural development[J]. Experimental Biology, 2007, 210(23): 4123-4135. DOI:10.1242/jeb.009217 |
| [14] |
MIYAZAKI T, KONDRASHEV S L, TSUCHIYA C B, et al. Visual pigment genes and absorbance spectra in the Japanese sardine Sardinops melanostictus (Teleostei: Clupeiformes)[J]. Comparative Biochemistry and Phy siology, 2018, 218(5): 54-63. |
| [15] |
KAWAMURA S, KASAGI S, KASAI D, et al. Spectral sensitivity of guppy visual pigments reconstituted in vitro to resolve association of opsins with cone cell types[J]. Vision Research, 2016, 127(3): 67-73. |
| [16] |
SATO I, KASAGI S, TAKAHASHI A, et al. Expression dynamics of visual opsin genes in marbled sole Pseudopleuronectes yokohamae during metamorphosis from the larval to the juvenile stage[J]. Gene, 2021, 787(6): 545-562. DOI:10.3760/cma.j.cn511374-20200410-00249 |
| [17] |
SHAND J, DAVIES W L, THOMAS N, et al. The influence of ontogeny and light environment on the expression of visual pigment opsins in the retina of the black bream, Acanthopagrus butcheri[J]. Experimental Biology, 2008, 211(9): 495-503. |
| [18] |
雷霁霖. 海水养殖新品种介绍─大菱鲆[J]. 中国水产, 2000, 4(2): 38-39. LEI Qilin. Introduction of new varieties in mariculture- turbot[J]. China Fisheries, 2000, 4(2): 38-39. DOI:10.3969/j.issn.1002-6681.2000.02.018 |
| [19] |
WU L, WANG Y, HAN M, et al. Growth, stress and non-specific immune responses of turbot larvae exposed to different light spectra[J]. Aquaculture, 2020, 520(C): 734-750. |
| [20] |
车景青, 陈京华, 胡苗峰. 大菱鲆鱼苗视网膜组织结构与视觉特性[J]. 渔业科学进展, 2016, 37(2): 25-32. CHE Jingqing, CHEN Jinghua, HU Miaofeng. Histological structure of retina and visual characteristics of turbot Scophthalmus maximus fry[J]. Progress in Fishery Sciences, 2016, 37(2): 25-32. |
| [21] |
王雨浓, 李贤, 吴乐乐, 等. 大菱鲆(Scophthalmus maximus) 不同发育阶段视蛋白基因表达特征研究[J]. 海洋与湖沼, 2020, 51(1): 186-192. WANG Yunong, LI Xian, WU Lele, et al. Expression characteristics of opsin genes in different developmental stages of scophthalmus maximus[J]. Oceanologia et Lim nologia Sinica, 2020, 51(1): 186-192. |
| [22] |
LIANG L, CHINFEI C. Organization, function, and development of the mouse retinogeniculate synapse[J]. Annual Review of Vision Science, 2020, 6(2): 45-52. |
| [23] |
FRAU S, PAULLADA-SALMERóN J A, PARADISO I, et al. From embryo to adult life: differential expression of visual opsins in the flatfish Solea senegalensis under different light spectra and photoperiods[J]. Frontiers, 2022, 9(3): 507-516. |
| [24] |
SUSANNE K, HILMAR M, ERIK M, et al. Analyses of signal transduction cascades reveal an essential role of calcium ions for regulation of melatonin biosynthesis in the light-sensitive pineal organ of the rainbow trout[J]. Journal of Neurochemistry, 2000, 74(6): 2478-2489. |
| [25] |
GARZA-GISHOLT E, HART N S, COLLIN S P J B, et al. Retinal morphology and visual specializations in three species of chimaeras, the deep-sea R. pacifica and C. lignaria, and the vertical migrator C. milii (Holocephali)[J]. Brain Behavior and Evolution, 2018, 92(1): 57-62. |
| [26] |
BROWMAN H I, GORDON W C, EVANS B I, et al. Correlation between histological and behavioral measures of visual acuity in a zooplanktivorous fish, the white crappie[J]. Case Reports in Neurology, 1990, 35(2): 85-97. |
| [27] |
SHAND J, CHIN S M, HARMAN A M, et al. The relationship between the position of the retinal area centralis and feeding behaviour in juvenile black bream Acanthopagrus butcheri (Sparidae: Teleostei)[J]. Royal Society, 2000, 355(4): 1183-1186. |
| [28] |
魏开建, 张海明. 鳜鱼视网膜发育的组织学研究[J]. 华中农业大学学报, 1996, 15(3): 263-269. WEI Kaijian, ZHANG Haiming. Hstologicl study on the development of retina of mandarin fish[J]. Journal of Huazhong Agricultural University, 1996, 15(3): 263-269. |
| [29] |
王新安, 马爱军, 庄志猛, 等. 半滑舌鳎(Cynoglossus semilaevis)摄食行为感觉作用的研究[J]. 海洋与湖沼, 2006, 6(2): 555-560. WANG Xinan, MA Aijun, ZHUANG Zhimeng, et al. Feeding behvior of Cynoglossus semilaevis with different senses[J]. Oceanologia et Limnologia Sinica, 2006, 6(2): 555-560. |
| [30] |
马爱军, 王新安, 庄志猛, 等. 半滑舌鳎仔、稚鱼视网膜结构与视觉特性[J]. 动物学报, 2007, 2(6): 354-363. MA Aijun, WANG Xinan, ZHUANG Zhimeng, et al. Structure of retina and visual characteristics of the half- smooth tongue-sole Cynoglossus semilaevis Günter[J]. Current Zoology, 2007, 2(6): 354-363. |
| [31] |
KAREN C, TYRONE S, TODD S J, et al. Visual sensitivities tuned by heterochronic shifts in opsin gene expression[J]. BMC Biology, 2008, 6(1): 1741-1756. |
| [32] |
TEMPLE S E, VELDHOEN K M, PHELAN J T, et al. Ontogenetic changes in photoreceptor opsin gene expression in coho salmon (Oncorhynchus kisutch, Walbaum)[J]. The Journal of Experimental Biology, 2008, 211(Pt 24): 3879-3888. |
| [33] |
TEMPLE S E, SAMUEL D R, THEODORE J H, et al. Effects of exogenous thyroid hormones on visual pigment composition in coho salmon (Oncorhynchus kisutch)[J]. The Journal of Experimental Biology, 2008, 211(Pt 13): 2134-2143. |
| [34] |
JULIA S, HART N S, NICOLE T, et al. Developmental changes in the cone visual pigments of black bream Acanthopagrus butcheri[J]. The Journal of Experimental Biology, 2002, 205(Pt 23): 3661-3667. |
| [35] |
NIK L, FABIO C, MARKO F, et al. Visual gene expression reveals a cone to rod developmental progression in deep-sea fishes[J]. Molecular Biology and Evolution, 2021, 38(12): 5664-5677. |
| [36] |
PALCZEWSKI K, KUMASAKA T, HORI T, et al. Crystal structure of rhodopsin: A G protein-coupled receptor science[J]. Science, 2000, 289(5): 739-745. |
| [37] |
蔡燕雯. 基因调控丽鱼色觉[J]. 海洋世界, 2005, 15(11): 33-34. CAI Yanwen. Genes regulate color vision in cichlids[J]. Ocean World, 2005, 15(11): 33-34. |
| [38] |
SIERRA-FLORES R, DAVIE A, GRANT B, et al. Effects of light spectrum and tank background colour on Atlantic cod and Turbot larvae performances[J]. Aquaculture, 2016, 450(4): 6-13. |
| [39] |
MARTIN L, SARA M S, KAREN L C, et al. Short-term colour vision plasticity on the reef: changes in opsin expression under varying light conditions differ between ecologically distinct fish species[J]. The Journal of Experimental Biology, 2018, 221(Pt 22): 175-186. |
| [40] |
白桂芬, 林垚. LED单色光和双色光对孔雀鱼成鱼的初步试验[J]. 赤峰学院学报(自然科学版), 2018, 34(11): 36-40. BAI Guifen, LIN Yao. Preliminary experiments of LED monochromatic and bicolor light on adult guppies[J]. Journal of Chifeng University(Natural Science Edition), 2018, 34(11): 36-40. |
| [41] |
FULLER R C, CARLETON K L, FADOOL J M, et al. Population variation in opsin expression in the bluefin killifish, Lucania goodei: a real-time PCR study[J]. Journal of Comparative Physiology, A, Neuroethology, Sensory, Neural, and Behavioral Physiology, 2004, 190(2): 147-154. |
| [42] |
SRI P N, MIRANDA R Y, KAREN L C. Adult plasticity in African cichlids: Rapid changes in opsin expression in response to environmental light differences[J]. Molecular Ecology, 2017, 26(21): 6036-6052. |
| [43] |
DALTON B E, LU J, LEIPS J. Variable light environments induce plastic spectral tuning by regional opsin coexpression in the African cichlid fish, Metriaclima zebra[J]. Ecology Environment & Conservation, 2015, 24(16): 24-35. |
| [44] |
OLE S, YOHEY T, ISABEL S, et al. Speciation through sensory drive in cichlid fish[J]. Nature, 2008, 455(13): 620-626. |
 2023, Vol. 47
2023, Vol. 47


