文章信息
- 毕正浩, 杨芳, 潘渊博, 杨玲, 林忠州, 罗冬莲, 周成旭. 2023.
- BI Zheng-hao, YANG Fang, PAN Yuan-bo, YANG Ling, LIN Zhong-zhou, LUO Dong-lian, ZHOU Cheng-xu. 2023.
- 越冬前后海马齿脂肪酸和挥发性有机物组成和变化特征
- Composition and changes in fatty acids and volatile organic compounds in Sesuvium portulacastrum during overwintering
- 海洋科学, 47(12): 40-54
- Marine Sciences, 47(12): 40-54.
- http://dx.doi.org/10.11759/hykx20230404001
-
文章历史
- 收稿日期:2023-04-04
- 修回日期:2023-04-24
2. 福建省水产研究所 福建省海洋生物增养殖与高值化利用重点实验室, 福建 厦门 361013;
3. 宁波大学海洋学院, 浙江 宁波 315211
2. Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province, Fisheries Research Institute of Fujian, Xiamen 361013, China;
3. Ocean College of Ningbo University, Ningbo 315211, China
海马齿(Sesuvium portulacastrum)是一种番杏科、海马齿属肉质多年生草本盐生植物。在我国, 主要生长于福建、广东和海南等南方近海地区[1]。全淡水和全海水的生长条件均适应, 对旱涝、盐碱、高温和重金属污染等都有很强的耐受性[2], 且扦插、扩培等都易于操作、成活率高、扩繁可控, 可用来防风固沙, 吸收导致水体富营养化的营养盐等物质[3], 因此, 在消除富营养化生态修复中具有重要潜力。张志英等[4]在厦门筼筜湖浮床上种植海马齿净化水质, 发现海马齿的根能有效吸附水中悬浮物, 并将水中的氮、磷元素富集于叶茎内, 有效地降低湖水的富营养化程度。李色东等[5]发现, 种植海马齿可以很好地净化养殖废水。此外, 海马齿叶、茎和根的提取物可有效抑制典型赤潮藻中肋骨条藻(Skeletonema costatum)的生长, 延缓其生长期[6]。
海马齿还可作为食用植物、饲料或民族药用[7-8], 常吃有助于清除体内毒素, 软化心血管和促进消化。海马齿中含有的次生代谢产物可以在香料、食品、化妆品和制药工业中作为合成原料的替代品[9]。可见, 种植海马齿, 既能有效利用其生长过程进行生态修复, 又能生产具有高附加值的次生物质, 因此, 是一种值得推广的可持续发展方式。
生物体特有的热生理极限部分与细胞膜的组成有关, 特别是与脂类和脂肪酸的合成有关[10]。不饱和脂肪酸是生物膜的重要组成部分, 作为细胞中一些信号分子的前体物质, 可以调节细胞的生物学功能[11]。不饱和脂肪酸可增加细胞膜的流动性, 在植物膜脂中, 不饱和脂肪酸含量越高, 膜脂的低温抗性就越强[12]。植物细胞膜不饱和脂肪酸的程度高低决定膜的流动性, 影响植物对非生物胁迫的抗性, 因此, 不饱和脂肪酸具有防止植物遭受低温胁迫损伤的作用[13]。脂肪酸的合成是评估盐生植物生理状态的工具[14]。同时, 脂肪酸也是膳食脂质营养的主要成分, 在人体代谢、健康和疾病中起到重要的作用。膳食来源的不同特征性的脂肪酸组成, 对人体的健康会造成不同的影响[15-16]。挥发性物质主要是由脂类的氧化分解、蛋白质与糖类等的降解产生[17], 其组成、含量及变化特征, 与生物的生化代谢过程密切相关。通过测量挥发性有机物, 可以确定研究对象的生理状态[18], 进行香气成分和品质判断[19-20]。同样的, 挥发性有机物质也是评价食品品质变化的有效信息[21-22]。
海马齿在我国主要生长于福建、广东、海南、台湾中南部等地区[23], 相对于这些地区, 浙江宁波处于较北的地理位置, 也是目前海马齿处于最高纬度的位置。相对于南方沿海, 宁波沿海冬季可能出现短期冰冻低温天气, 因此, 对北移种植的海马齿生态修复体系是一个主要考验。本研究在宁波梅山湾海马齿生态修复浮床上采集海马齿样品, 通过解析脂肪酸和挥发性有机物在植株不同部位中的组成和变化特征, 重点关注越冬前后以及低温损伤严重植株的变化特征, 探讨海马齿北移种植时, 面临越冬低温和冻伤所造成的影响; 同时, 基于脂质营养指数, 探讨北移越冬对海马齿食物营养上的影响。
1 材料与方法 1.1 样品采集和环境水质根据气象记录, 2020—2021年越冬期间的气温情况: 10月平均气温20 ℃左右; 11、12月平均气温约10 ℃、2021年1月达到最低0 ℃、2—3月气温回升, 平均气温约10 ℃。于2020年10月和2021年3月, 分两批采样。采样地点为浙江省宁波市北仑区梅山湾的海马齿养殖浮床(北纬29°45′23″, 东经121°55′6″)。在一字排列的7组生态浮床上, 间隔1组共选取3组进行采样。
采样方法和样品分组: 共2次采样3个分组。
10月组: 选择茎叶翠绿无枯萎、生长状态良好的海马齿整株采摘;
3月未冻伤组: 同样选择茎叶翠绿无枯萎、生长状态良好的海马齿整株采摘;
3月冻伤组: 选择植株茎叶颜色偏深紫、现斑点、有叶片败坏等冻伤现象明显的海马齿整株采摘, 其中枯萎败坏的叶片不作为样品处理, 即冻伤组叶样品仍然选择植株上完好叶做分析。采集的海马齿植株分别放入密封袋, 迅速带回实验室, 马上进行样品分解处置。野外采样同时, 用YSI水质仪测定温度、盐度、溶解氧和pH等水质参数。
1.2 样品处理与制备将带回实验室的海马齿用蒸馏水清洗后, 分成花、叶、茎和根4部分, 用小密封袋保存放入−20 ℃冰箱预冷24 h, 真空冷冻干燥机干燥48 h, 制备冻干样品, 以均质仪破碎制冻干粉样, −80 ℃冰箱保存。两批次采集完成并制冻干样后, 进行脂肪酸和挥发性有机物分析。
1.3 脂肪酸分析取100 mg粉末状样品, 每组样品3平行。参考文献方法[24], 经过提取总脂、脂肪酸皂化和脂肪酸甲酯化后, 加入0.1 mL的双(三甲基硅烷基)三氟乙酰胺(BSTFA), 60 ℃水浴2 h, 氮气吹干。向上述加入1 mL的正己烷(色谱纯), 再用注射器过滤膜到2 mL进样瓶中, 上GC-MS检测。
仪器为7890B-7000C气相色谱-质谱联用仪, 美国安捷伦科技有限公司。
色谱柱: CD2560, 100 m×0.25 mm×0.20 μm, 德国CNW公司。GC条件, 进样采用不分流模式, 柱温箱起始温度140 ℃, 保持5 min, 以4 ℃·min–1, 升温至240 ℃, 保持30 min。载气为高纯氦气, 流速为2.25 mL·min–1; 进样口温度250 ℃。MS条件EI离子源: 电子能量70 eV; 灯丝发射电流为200 μA, 离子源温度为230 ℃; 扫描质量范围, 40~600 m/z。
将测得的各脂肪酸谱图与计算机谱库(NIST/ Wiley)中的标准脂肪酸谱图进行对比, 并结合脂肪酸标准品的保留时间进行定性分析。按面积归一化法进行分析, 求得各脂肪酸的相对百分含量。
1.4 挥发性有机物质(VOCs)分析取海马齿叶和茎样品各15 g (因花、根样品不足, 仅使用叶、茎样品分析VOCs), 每组样品3平行, 置于50 mL的离心管中, 1: 1加入饱和氯化钠溶液, 发生盐析反应, 降低有机化合物的溶解度。使用高速分散机进行匀浆处理, 取5 mL匀浆样品倒入20 mL顶空进样瓶中, 上机进行测定。
顶空固相微萃取条件: 利用全自动固相微萃取进样系统(德国Gerstel公司)。样品首先在60 ℃下振荡平衡15 min, 再将预先老化30 min的50或30 μm DVB/CAR/PDMS萃取头(美国Supelco公司)深入到样品顶空处吸附20 min。此过程中, 温度仍为60 ℃并持续振荡。吸附完成后, 将萃取头插入到GC进样口, 在210 ℃温度下解吸7 min。
色谱条件: 利用7890B-7000C气相色谱-质谱联用仪(美国安捷伦科技有限公司), 使用VOCOL毛细管柱(60 m×0.32 mm×1.8 mm, 德国CNW公司)进行分析。进样采用不分流模式, 柱温箱起始温度35 ℃, 保持2 min, 以15 ℃/min, 升温至125 ℃, 保持1 min, 再以2 ℃/min升温至200 ℃, 保持12 min。载气为高纯氦气, 流速为1.6 mL/min; 进样口温度210 ℃。
质谱条件: EI离子源; 电子能量70 eV; 灯丝发射电流为200 μA, 离子源温度为230 ℃; 扫描质量范围, 50~500 m/z。
将测得的各化合物谱图与计算机谱库(NIST/Wiley)中的标准物质谱图进行对比, 辅以人工图谱解析, 并结合正构烷烃标准品的保留时间进行定性分析。按面积归一化法进行分析, 求得各化合物的相对百分含量。
1.5 脂质营养指数的计算利用解析出的脂肪酸百分含量数据, 进一步计算出以下脂质质量指数[25]: 多不饱和脂肪酸/饱和脂肪酸比值(PUFA/SFA)、不饱和脂肪酸n-6/n-3比值(n-6/n-3)、致动脉粥样硬化指数(AI)、血栓形成指数(TI)和低胆甾醇血症/高胆甾醇血症比率(HH)。其中:
| $\mathrm{AI}=(\mathrm{C} 12: 0+4 \times \mathrm{C} 14: 0+\mathrm{C} 16: 0) /\left(\sum \mathrm{MUFA}+\mathrm{PUFA}_{\mathrm{n}-6}+\mathrm{PUFA}_{\mathrm{n}-3}\right), $ | (1) |
| $\mathrm{TI}=(\mathrm{C} 14: 0+\mathrm{C} 16: 0+\mathrm{C} 18: 0) /\left(0.5 \times \sum \mathrm{MUFA}+0.5 \times \mathrm{PUFA}_{\mathrm{n}-6}+3\right.\times \left.\mathrm{PUFA}_{\mathrm{n}-3}+\mathrm{PUFA}_{\mathrm{n}-3} / \mathrm{PUFA}_{\mathrm{n}-6}\right), $ | (2) |
| $\begin{aligned} & \mathrm{HH}=[\mathrm{C} 18: 1(\mathrm{n}-9)+\mathrm{C} 18: 2(\mathrm{n}-6)+\mathrm{C} 20: 4(\mathrm{n}-6)+\mathrm{C} 18: 3(\mathrm{n}-3)+\mathrm{C} 20: \\ & 5(\mathrm{n}-3)+\mathrm{C} 22: 5(\mathrm{n}-3)+\mathrm{C} 22: 6(\mathrm{n}-3)] /(\mathrm{C} 14: 0+\mathrm{C} 16: 0) .\end{aligned}$ | (3) |
其中∑MUFA为单不饱和脂肪酸总和, PUFAn-6为n-6多不饱和脂肪酸, PUFAn-3为n-3多不饱和脂肪酸。
1.6 数据分析采用偏最小二乘判别方法(PLS-DA)进行主成分分析, 由MetaboAnalyst 5.0(https://www.MetaboAnalyst.ca)绘图; 用Excel绘制百分比堆积图; 数据与统计分析经SPSS 26处理, 采用单因素方差分析(One-way ANOVA), 显著性水平P<0.05。利用InteractiVenn绘制韦恩图。
2 结果 2.1 海马齿生态浮床水域的水质参数两批次采样时, 海马齿养殖区水质参数如表 1所示。
| 水质参数 | 2020年10月 | 2021年3月 |
| 温度/℃ | 23.91±0.00 | 12.79±0.01 |
| pH | 8.70±0.01 | 7.92±0.01 |
| 溶解氧/(mg·L−1) | 10.45±0.00 | 9.27±0.00 |
| 总悬浮物/ (g·L−1) | 20.17±0.05 | 21.27±0.05 |
| 氧化还原电位/mV | 212.67±0.47 | 338.67±0.47 |
| 盐度 | 20.55±0.01 | 21.65±0.00 |
| 电导率/(ms·cm−1) | 32.87±0.05 | 34.87±0.05 |
| 密度(kg·m−3) | 12.90±0.08 | 16.17±0.05 |
| 浊度/NTU | 7.33±0.47 | 0.00±0.00 |
由水质测定结果可知, 梅山湾越冬温度变化显著(P<0.05), 10月份为23.91 ℃, 3月份为12.79 ℃。pH有所降低, 10月份为8.70, 3月份为7.92。10月溶解氧为10.45 mg/L, 3月为9.27 mg/L。10月时浊度为7.33NTU, 而3月采样时, 降低到0.00NTU。从其他水质指标来看, 越冬前后为相对增加的状态, 如总悬浮物, 由20.17 g/L到21.27 g/L; 氧化还原电位由212.67 mV到338.67 mV; 盐度由20.55到21.65; 电导率由32.87 ms/cm到34.87 ms/cm。
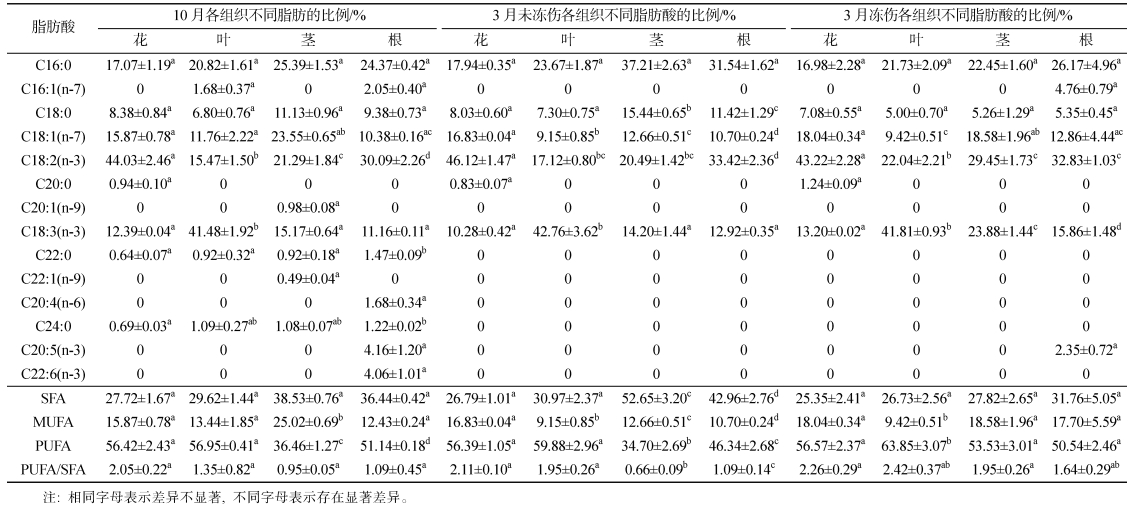
2.2 脂肪酸的组成和变化特征如表 2所示, 在10月、3月未冻伤和3月冻伤三组样品中, 共检出14种脂肪酸。其中包括5种饱和脂肪酸(SFA), 4种单不饱和脂肪酸(MUFA), 5种多不饱和脂肪酸(PUFA)。10月组中, 植株各部位样品检出了全部14种脂肪酸; 3月样品中, 22碳以上的脂肪酸均未检出(除根中检出的C20:5(n-3)外), 同时, 仅在冻伤组的根样品中, 检出了C16:1(n-7)。总体而言, 根样品中检出的脂肪酸种类最多。
从脂肪酸组成和变化可以看出(图 1, 表 2), SFA中, 优势脂肪酸为C16:0, 其含量在茎和根部位大于花和叶部位, 其中, 3月未冻伤组茎和根中达最大值, 分别为37.21%和31.54%; C20:0仅在花部位样品中检测出, 且相对含量低(平均约1.00 %); C22:0和C24:0在10月各部位样品中均有检出, 平均含量分别为0.99%和1.02%, 但3月样本中均未检出。MUFA中, 优势脂肪酸为C18:1(n-7), 各组样品中均有检出, 在花和茎部位的相对含量(平均分别为16.91%和18.26%)均大于叶和根部位(平均分别为10.11%和11.31%)。PUFA中, 优势脂肪酸为C18:2(n-3)和C18:3(n-3), 在各组样品中均有检出; C18:2(n-3)在花部位的含量最高(43.22%~46.12%), 其中3月未冻伤组含量最高, 冻伤组含量最低(P>0.05); 该脂肪酸在叶部位的含量最低(15.47%~22.04%), 其中10月组为其最小值, 3月冻伤组为其最大值; C18:3(n-3)在叶部位的含量最高, 平均为42.02%, 三组样本间无显著差异(P>0.05), 在花、茎和根中的平均含量分别为11.96%、17.75%和13.31%。C20以上的PUFA [C20:4(n-6)、C20:5(n-3)和C22:6(n-3)]在未越冬前的10月根样品中检出, 含量分别为1.68%、4.16%和4.06%。3月冻伤组的根中, 检出含量为2.35%的C20:5(n-3)。
 |
| 图 1 三组海马齿植株不同部位中脂肪酸组成变化 Fig. 1 The variation of fatty acid compositionin different parts of S. portulacastrum in three groups |
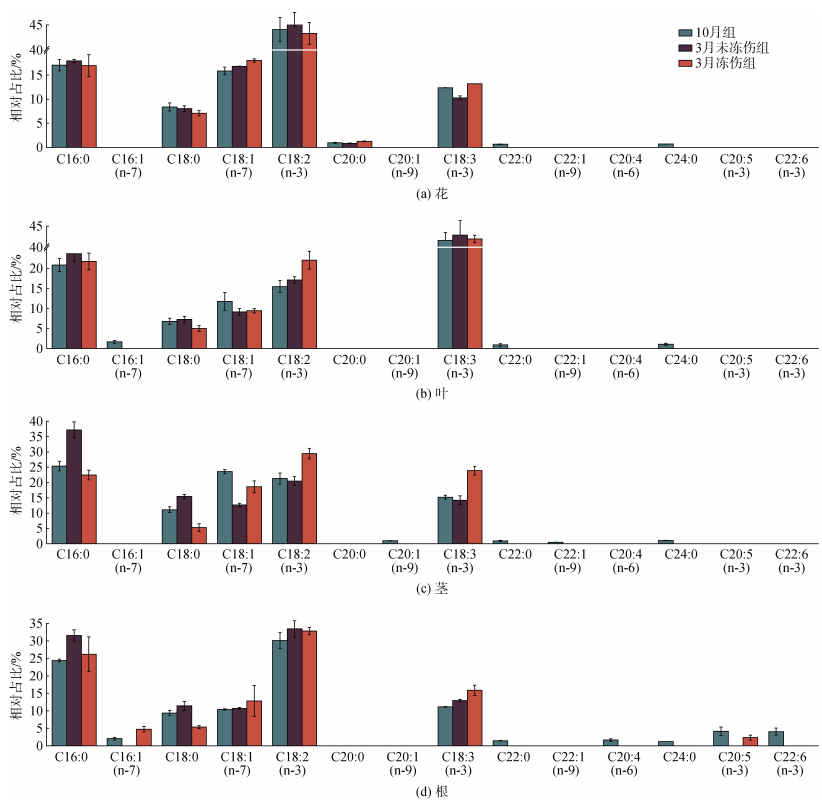
从三组海马齿各部位的PUFA、MUFA和SFA的百分比堆积图可以看出(图 2), 花部位中(图 2a), 相对含量最高的为PUFA, 占比达56.39%~56.57%; 其次是SFA, 占比为25.35%~27.72%; 含量最少的是MUFA (15.87%~18.04%); 三类脂肪酸在三组样品中差异显著(P<0.05)。叶部位中(图 2b), PUFA含量最高(56.95%~63.85%, P<0.05), 且呈现10月组至3月未冻伤组至3月冻伤组递增的特征; SFA的含量为26.73%~30.97%, 3月冻伤组含量最低; 含量最少的是MUFA(9.15%~13.44%), 3月两组占比无显著差异, 均小于10月组。茎部位(图 2c), PUFA含量在10月组和3月未冻伤组中分别为36.46%和34.70%, 无显著差异(P>0.05), 但3月冻伤组中, PUFA含量显著增加(P<0.05), 占比达53.53%。3月未冻伤组的SFA含量达52.65%, 相对于10月组和3月冻伤组差异显著(P<0.05), 后两者分别为38.53%和27.82%, 无显著差异(P>0.05)。根部位中(图 2d), 三类脂肪酸在三组样本中的变化趋势与茎中相同, 其中, PUFA含量为46.34%~51.14%, 在10月组中最高; SFA含量为31.76%~42.96%, 3月未冻伤组最高, 3月冻伤组最低。
 |
| 图 2 三组海马齿植株不同部位脂肪酸的百分比堆积图 Fig. 2 Percentage accumulation of fatty acids in different parts of S. portulacastrum in three groups |
各样品的PLS-DA分析结果显示(图 3): 花样品中, 主成分1、2分别占总方差的39.4%和24.9%; 叶样品中, 分别占61.1%和33.4%; 茎样品中, 分别占54.2%和42.6%; 根样品中, 分别占61.1%和33.4%。其中, 花(图 3a)、茎(图 3c)和根(图 3d)的脂肪酸组成在10月、3月冻伤、未冻伤三组组间显著区分; 而叶部位样品的脂肪酸组成仅在10月与3月的样品间分离, 3月的冻伤与未冻伤样品无显著差异(图 3b)。
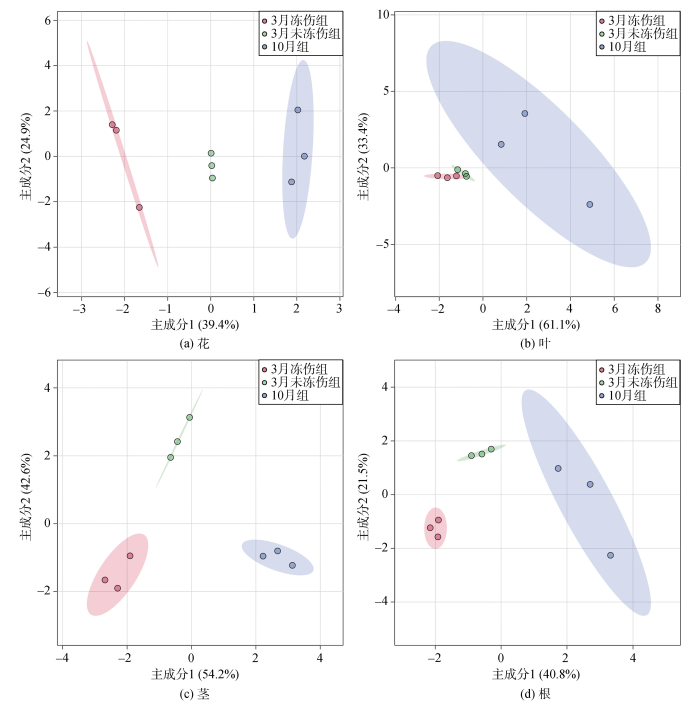 |
| 图 3 三组海马齿植株不同部位的脂肪酸PLS-DA分析 Fig. 3 PLS-DA analysis of fatty acids collected from different parts of S. portulacastrum in three groups |
通过PLS-DA分析得出VIP(变量重要性投影)>1的脂肪酸结果显示(图 4), 分别有5~6种脂肪酸在海马齿越冬前后脂肪酸组成差异中有重要贡献。
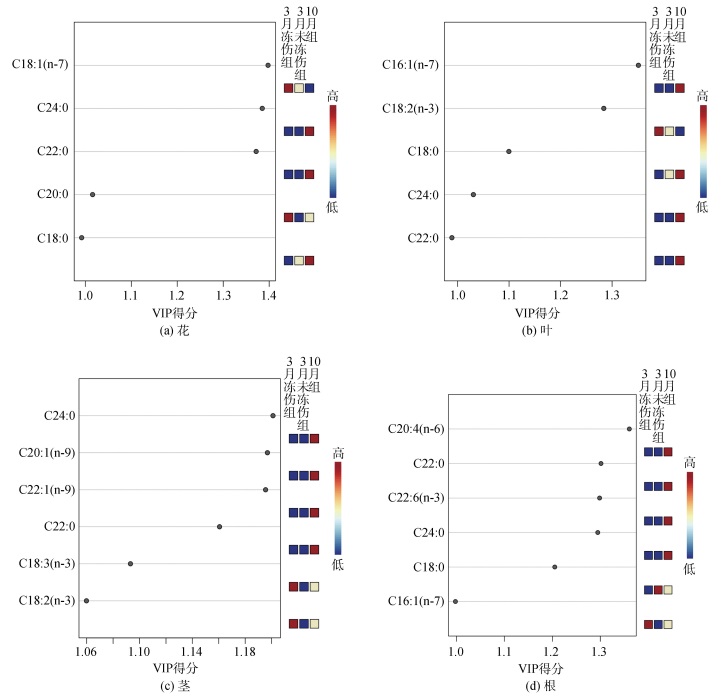 |
| 图 4 PLS-DA中脂肪酸的VIP分数和不同部位中重要脂肪酸(VIP>1) Fig. 4 VIP scores of fatty acids in PLS-DA and important fatty acids in different parts of S. portulacastrum |
从重要脂肪酸在各组中的变化可以看出(图 5), C20:0仅在花样品中为重要脂肪酸, 表现为3月冻伤组显著大于其他两组, 而在植株不同部位检出的C20以上饱和脂肪酸, 均仅在10月组中检出, 3月两组均未检出; C18∶0在花、叶和根样品中的变化, 均表现为3月冻伤组显著低于10月组和3月未冻伤组(图 5a, b, d), 后两组间无显著差异; 花样品中的C18:1(n-7) (图 5a)、叶和茎样品中的C18:2(n-3) (图 5b, c)以及茎样品中的C18:3(n-3) (图 5c), 则均呈现为3月冻伤组显著高于10月组和未冻伤组, 后两组间无显著差异。
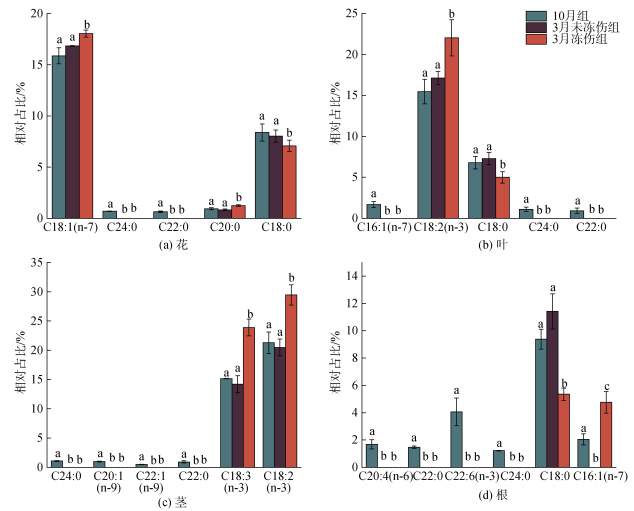 |
| 图 5 VIP脂肪酸在三组海马齿植株不同部位的相对含量 Fig. 5 Relative content of VIP fatty acids in different parts of S. portulacastrum in three groups |
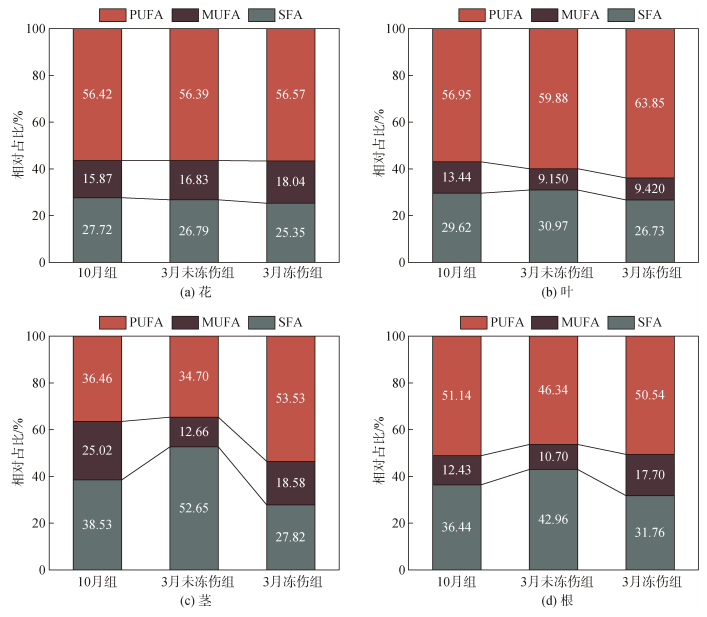
PUFA/SFA是评价膳食食物营养价值最常用的指标, 也可作为评估饮食对心血管健康影响的指数, 这个比率越高, 效果越好。由图 6可以看出, PUFA/ SFA在花样品中具有最高值, 越冬前后三组样品的变化不大, 平均为2.14(图 6a); 在叶、茎和根样品中, 均显示3月冻伤组PUFA/SFA显著增加(图 6b、c、d); 叶样品中的比值呈现10月组至3月未冻伤组至3月冻伤组递增的趋势(图 6b)。
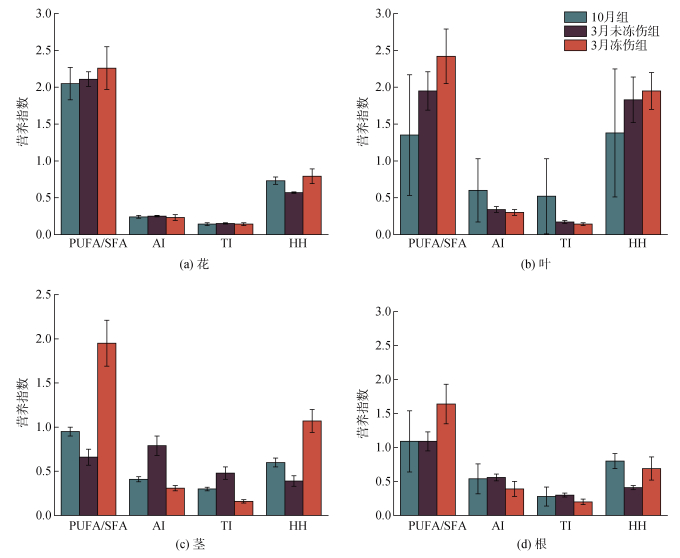 |
| 图 6 三组海马齿植株不同部位的脂质营养指数 Fig. 6 Lipid nutrition indices of different parts of S. portulacastrum in three groups |
不饱和脂肪酸具有抗动脉粥样硬化功能, 可以降低磷脂、胆固醇和酯化脂肪酸的水平。因此, 食用AI含量较低的食物或产品可以降低人体血浆中总胆固醇的水平。总体而言, 各组海马齿的花样品中, AI值最低(图 6a), 且三组样品无显著差异(P<0.05); AI值在叶、茎和根样品中, 均体现与采样月份或受冻伤程度相关的特征: 3月冻伤组相对最低(叶和根样本中无统计显著性)、茎样品中变化幅度大, 且有显著性差异(P<0.05)。
血栓形成指数(TI)表征了脂肪酸的血栓形成潜力, 表明在血管中形成凝块的趋势, 因此TI值越小越好。TI值在三组海马齿各部位的特征和变化类似AI值, 在花样品中, TI值最低, 在3月冻伤组中呈现下降趋势, 茎样品的TI值在三组样品中有显著性差异(P<0.05)。
HH描述了低胆固醇脂肪酸和高胆固醇脂肪酸之间的关系, 比率相对较高, 有助于降低冠心病的发病率。HH的值在叶部位样品中最高, 跟10月相比, 3月未冻伤组和冻伤组HH的值呈增加趋势(图 5b)。
2.4 挥发性有机物(VOCs)的组成及其变化特征海马齿叶和茎样品的VOCs分析结果显示, 所有样品中, 共检测出86种VOCs, 其中包括21种醇类, 16种脂类, 7种酮类, 15种含氮化合物, 2种芳香烃, 1种呋喃, 1种含硫化合物, 7种烷烃, 16种其他化合物。在所有样品中, 蘑菇醇(1-Octen-3-ol)所占比例最高, 10月组、3月未冻伤组和3月冻伤组中, 叶和茎样品蘑菇醇的平均含量分别为57.84%±7.56%和17.03%±8.43%、75.75%±1.55%和18.78%±4.71%、40.31%±25.3%和21.99%±2.89%, 可以看出, 叶中的蘑菇醇含量远远高于茎; 2-乙基噻吩-5.5-二氧化物也在三组样品的叶和茎中共同检出, 3月两组样品跟10月相比, 其所占比例大幅度降低; 在所有样品中都检出的正庚醚, 在叶中的含量(7.92%~11.01%)均大于茎中含量(0.77%~3.08%); 2-环己烯-1-醇在10月组叶、茎样品中均未检出, 越冬后的3月组中均检出, 且在茎中含量(平均16.94%)高于叶中含量(平均4.67%)。
韦恩图分析结果显示(图 7): 茎样品中, 10月组检测出39种, 独有种类25种; 3月未冻伤组检出27种, 独有种类2种; 3月冻伤组检出28种, 独有种5种; 3组共有种类10种。叶样品中, 10月组检出21种, 独有种类17种; 3月未冻伤组检出9种, 无独有种类; 3月冻伤组检出14种, 独有种类6种; 3组共有种类3种; 3月两组化合物种类减少, 且未冻伤组减少尤盛。
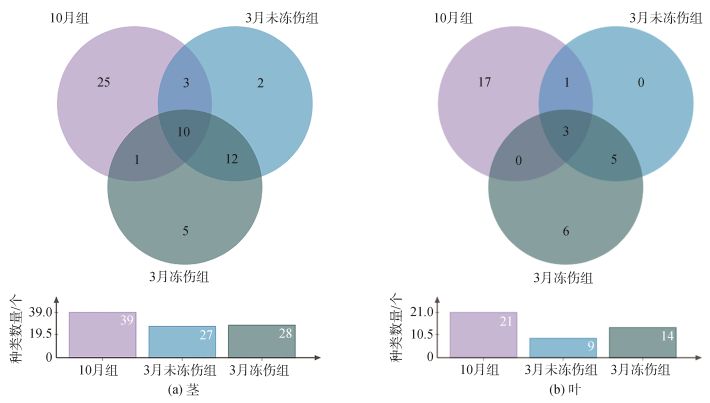 |
| 图 7 三组海马齿叶和茎中挥发性有机物质种类数量韦恩图 Fig. 7 Venn diagram of the VOCs numbers in dentate leaf and stem of S. portulacastrum in three groups |
如图 8a所示, 茎样品中, 属于优势占比的有醇类、酯类、含氮和含硫4类化合物, 醇类相对含量在3组样品中始终处于最高水平, 且在3月2组样品中, 其相对含量显著增加(P<0.05), 10月份为35.81%±13.48%, 3月份未冻伤和冻伤分别为73.05%±1.33%和68.46%±1.1%; 与10月组相比, 醇类是3月2组茎样品中相对含量唯一提高的优势物质, 其余优势物质都有所降低(图 8a)。叶样品中(图 8b), 除其他类型外, 属于相对优势占比的有醇类、酯类和含硫3类化合物, 醇类相对含量始终处于最高水平, 10月组为66.11%±8.16%, 3月未冻伤和冻伤组分别为77.93%±2.52%和72.04%±3.68%; 与10月相比, 3月两组叶样品中, 醇类和脂类是相对含量提高的优势物质, 而含硫物质是降低的(图 8b)。
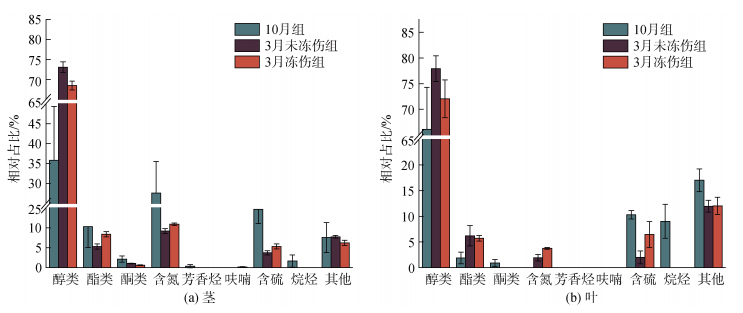 |
| 图 8 三组海马齿叶和茎中各类挥发性有机物质相对含量 Fig. 8 Relative contents of various volatile substances in dentate leaf and stem of S. portulacastrum in three groups |
偏最小二乘判别分析(PLS-DA)是一种使用多元回归技术的监督方法。可以很好地缩减并提取出与Y(本文指三个海马齿分组)表现出最大的相关性[26], 更全面、更直观地观察大量变量在不同组间的变化。因此采用PLS-DA分析三组海马齿样品花、叶、茎和根中脂肪酸的变化。海马齿植株花、叶、茎和根4个部位的脂肪酸组成存在时间差异, 显示越冬过程的综合影响, 同时, 也显示受冻程度差异, 造成脂肪酸组成变化不同。海马齿植株各部位中, 花、茎和根在3组样本间脂肪酸均显著差异, 而叶样品的脂肪酸组成在3月的2组样品中无显著差异。虽然3月冻伤组植株有显著的枯萎和坏死叶, 但用于样品分析的叶部位均是健康的, 因此, 可能造成了三月的2组叶样品无显著差异, 同时, 也可能说明了耐受低温后健康叶的脂肪酸组成结构相对稳定的特点。
从脂肪酸的角度来看, 三烯脂肪酸如C18:3(n-3)是最丰富的脂肪酸, 通常是在植物膜脂中检测到的主要脂肪酸。本研究的3组海马齿样品叶中, C18:3(n-3)的含量占比为40%左右, 是相对比例较高的不饱和脂肪酸。该脂肪酸含量随环境条件[27]、物种差异[28]而变化。该脂肪酸在茎样品中, 是构成组间差异的重要脂肪酸之一。海马齿越冬后, 冻伤组植株茎部位深紫色, 直观上与未冻伤组和越冬前(10月组)有较大差异。一般来说, 海草和陆生植物的特征都是合成短链脂肪酸(小于C18), 相比之下, 其他水产初级生产者, 如微型和大型藻类, 以合成长链脂肪酸(大于C20)的能力为特征[29-30], 测定结果显示, 海马齿中含有的脂肪酸多数为C数小于20的脂肪酸, 极少数为C数20以上的脂肪酸。对重要脂肪酸因子分析结果显示, C18脂肪酸的显著变化是造成越冬前后以及植株不同部位间脂肪酸组成变化的重要因素。相对于越冬前(10月组)以及未冻伤组, 冻伤组的花、叶和根样品中, C18饱和脂肪酸显著降低; 而几个C18不饱和脂肪酸, 包括花中的C18:1(n-7)、叶中的C18:2(n-3)、茎中的C18:3(n-3)和C18:2(n-3), 都呈现3月冻伤组相对于10月组和3月未冻伤组显著增加的特征。低温胁迫诱导生物体脂肪酸代谢趋向去饱和, 不饱和脂肪酸含量增加[31]。C18脂肪酸代谢可能在海马齿抵抗越冬低温胁迫发挥重要作用, 对脂肪酸去饱和酶基因的改造, 可能对耐寒植株创制有重要意义。
在冬季, 年最低气温和辐照度(日照长度)减少的综合效应可能会刺激诸如不饱和脂肪酸(n-3)的合成。低温和低辐射增加了陆生植物、微型和大型微藻类叶中类囊体膜脂的不饱和度, 这被认为是在寒冷季节维持类囊体膜最佳流动性的生理条件[32-33], 这一现象在海马齿冻伤组叶和茎中有所体现, 叶和茎暴露在空气中, 冬季温度变化大, 而根在海水里, 温度变化相对较小, 因此不饱和脂肪酸占比增加, 以维持类囊体膜的正常流动。
异常高的(n-3)PUFA占比可能是在极冷水中生存的生理机制, 实际上, 在南极和适应寒冷的植物中, 高水平的(n-3)PUFA已经被确定有利于最佳的代谢反应、膜流动性和光合组织的冷冻保护[31], 以支持其在寒冷环境中的适应和生存[34-35]。本研究显示, 冬季过后, 样品中(n-3)PUFA的占比有所提升, 尤其是冻伤组, 可能是为了更好地适应环境而改变。
综上所述, 我们认为, 海马齿抗冻应激的脂肪酸类物质是(n-3)PUFA, 其中C18:3(n-3)是关键物质, 其变化规律与抗冻关系值得深入研究。脂肪酸在疾病预防和治疗中起着积极或者消极的作用, 例如, 饱和脂肪酸可能会提高发展性硬化症以及疾病进展的风险, 而多不饱和脂肪酸可能会缓解多发性硬化症[19]。作为另外一个例子, 一些必须的脂肪酸代谢物可以发挥保健作用, 例如抗炎和神经保护作用, 但是它们也可以产生负面作用, 例如炎症、坏死促进剂和动脉弱硬化。一般来说, 脂肪酸是从各种膳食来源获得的, 这些膳食来源具有特征性的脂肪酸组成, 因此影响健康结果。目前人们越来越重视健康, 发掘和食用绿色食品, 海马齿作为富营养化生态修复物种, 要移除水中富营养盐, 其下游开发利用是一个重要途径。分析海马齿植株不同部位脂质营养指数的变化发现, 花部位各种脂质营养指数较为稳定。叶部位较特殊, 与10月相比, 3月两组各种脂质营养指数变化明显, 且都是往好的方面变化。说明越冬后春季海马齿叶部位营养价值较高。海马齿的可食用部位是叶和茎, 叶和茎比较, 可以发现叶的营养价值要强于茎的。本研究显示, 经历冬季低温胁迫存活的海马齿, 其脂质营养指数有所提升, 从而进一步显示北移种植海马齿构建生态修复系统的潜在价值。
冬季低温使海马齿新陈代谢降低, 导致挥发性物质种类减少。多不饱和脂肪酸和氨基酸的降解会生成酮类物质[36], 10月温度相对高, 海马齿的生长代谢处于相对活跃状态, 其酮类物质含量相对高于3月组。蘑菇醇在3组海马齿样品中均有检出, 且所占比例最高, 叶中含量明显高于茎。该物质具有蘑菇味、青草味、熟土豆味, 可以赋予特殊的清香和菌菇类气味[37-38], 通常是由于12-脂氧合酶对花生四烯酸的作用[39-41]。海马齿在处理的过程中, 能闻到淡淡的清香。上述的抗冻应激效应关键脂肪酸C18:3(n-3)也可以通过脂肪酸氧合酶代谢成为蘑菇醇, 因此, C18:3(n-3)代谢产生蘑菇醇可能是海马齿抗冻应激的标志性生化代谢过程。蘑菇醇可能是海马齿抗冻应激的主要代谢产物, 值得关注。
4 结论温度变化对北移种植的海马齿挥发性物质和脂肪酸组成及脂质营养指标均造成了显著影响。植株的不同部位响应越冬温度变化的影响也不同。低温使海马齿叶和茎中挥发性物质的种类明显减少。C18脂肪酸代谢在北移种植海马齿越冬过程中耐受低温胁迫中可能有重要意义。C18:3(n-3)和蘑菇醇分别是脂肪酸与挥发性物质中最为重要的两个代谢产物, C18:3(n-3)代谢产生蘑菇醇可能是海马齿抗冻应激的标志性生化代谢过程。
| [1] |
LONARD R I, JUDD F W. The biological flora of coastal dunes and wetlands Sesuvium portulacastrum (L.) L[J]. Journal of Coastal Research, 1997, 13(1): 96-104. |
| [2] |
杨芳, 杨妙峰, 郑盛华, 等. 东山湾海马齿生态浮床原位修复效果研究[J]. 福建水产, 2019, 41(3): 225-233. YANG Fang, YANG Miaofeng, ZHENG Shenghua, et al. Study on the in-situ remediation effects of Sesuvium portulacastrum ecological floating beds in Dongshan Bay[J]. Journal of Fisheries Research in Fujian, 2019, 41(3): 225-233. |
| [3] |
窦碧霞, 黄建荣, 李连春, 等. 海马齿对海水养殖系统中氮、磷的移除效果研究[J]. 水生态学杂志, 2011, 32(5): 94-99. DOU Bixia, HUANG Jianrong, LI Lianchun, et al. Research on effects of nutrient and phosphate removal from marine aquaculture system by Sesuvium portulacastrum[J]. Journal of Hydroecology, 2011, 32(5): 94-99. |
| [4] |
张志英, 黄凌风, 姜丹, 等. 浮床种植海马齿对富营养化海水氮、磷移除能力的初步研究[C]//中国环境科学学会2009年学术年会论文集, 中国环境科学学会, 2009, 50-55. ZHANG Zhiying, HUANG Linfeng, JIANG Dan, et al. The primary studies on the abilities of the Sesuvium portulacastrum ecological floating beds in removing N and P in eutrophicated seawaters[C]//Proceedings of the 2009 Academic Annual Conference of the Chinese Society of Environmental Sciences, the Chinese Society of Environmental Sciences, 2009, 50-55. |
| [5] |
李色东, 曹煜成, 李卓佳, 等. 湛江海区海马齿(Sesuvium portulacastrum)根、茎生长特性的初步研究[J]. 湛江海洋大学学报, 2006, 26(6): 21-25. LI Sedong, CAO Yucheng, LI Zhuojia, et al. Preliminary study on growth of root and caudex of Sesuvium portulacastrum[J]. Journal of Zhanjiang Ocean Uni versity, 2006, 26(6): 21-25. DOI:10.3969/j.issn.1673-9159.2006.06.006 |
| [6] |
李银心. 海马齿及其提取物的新用途[P]. 中国专利, 2009, 881056073: 4-9. LI Yinxin. The new applications of Sesuvium portulacastrum and its extracts[P]. Chinese Patent, 2009, 881056073: 4-9. |
| [7] |
范伟, 李文静, 付桂, 等. 一种兼具研究与应用开发价值的盐生植物——海马齿[J]. 热带亚热带植物学报, 2010, 18(6): 689-695. FAN Wei, LI Wenjing, FU Gui, et al. Sesuvium portulacastrum, A promising halophyte in research and application[J]. Journal of Tropical and Subtropical Botany, 2010, 18(6): 689-695. DOI:10.3969/j.issn.1005-3395.2010.06.017 |
| [8] |
ROJAS A, HERNANDEZ L, PEREDA-MIRANDA R, et al. Screening for antimicrobial activity of crude drug extracts and pure natural products from Mexican medicinal plants[J]. Journal of Ethnopharmacology, 1992, 35(3): 275-283. DOI:10.1016/0378-8741(92)90025-M |
| [9] |
LIS-BALCHIN M, DEANS S G. Bioactivity of selected plant essential oils against Listeria monocytogenes[J]. Journal of Applied Microbiology, 1997, 82(6): 759-762. DOI:10.1046/j.1365-2672.1997.00153.x |
| [10] |
MURAKAMI Y, TSUYAMA M, KOBAYASHI Y, et al. Trienoic fatty acids and plant tolerance of high temperature[J]. Science, 2000, 287(5452): 476-479. DOI:10.1126/science.287.5452.476 |
| [11] |
BOLTON M D. Primary metabolism and plant defense-fuel for the fire[J]. Molecular Plant-Microbe Interactions, 2009, 22(5): 487-497. DOI:10.1094/MPMI-22-5-0487 |
| [12] |
戴晓峰, 肖玲, 武玉花, 等. 植物脂肪酸去饱和酶及其编码基因研究进展[J]. 植物学通报, 2007, 24(1): 105-113. DAI Xiaofeng, XIAO Ling, WU Yuhua, et al. An overview of plant fatty acid desaturases and the coding genes[J]. Chinese Bulletin of Botany, 2007, 24(1): 105-113. DOI:10.3969/j.issn.1674-3466.2007.01.010 |
| [13] |
王利民, 符真珠, 高杰, 等. 植物不饱和脂肪酸的生物合成及调控[J]. 基因组学与应用生物学, 2020, 39(1): 254-258. WANG Limin, FU Zhenzhu, GAO Jie, et al. Molecular mechanism of unsaturated fatty acids synthesis and regulation in plant[J]. Genomics and Applied Biology, 2020, 39(1): 254-258. |
| [14] |
DUARTE B, CARREIRAS J, PEREZ-ROMERO J A, et al. Halophyte fatty acids as biomarkers of anthropogenic- driven contamination in Mediterranean marshes: sentinel species survey and development of an integrated biomarker response (IBR) index[J]. Ecological Indicators Integrating Monitoring Assessment & Management, 2018, 87: 86-96. |
| [15] |
LANGLEY M R, TRIPLET E M, SCARISBRICK I A. Dietary influence on central nervous system myelin production, injury, and regeneration[J]. Biochimica et Biophysica Acta-molecular Basis of Disease, 2020, 1866(7): 165779-165802. DOI:10.1016/j.bbadis.2020.165779 |
| [16] |
WU H, XU L, BALLANTYNE C M. Dietary and pharmacological fatty acids and cardiovascular health[J]. Journal of Clinical Endocrinology & Metabolism, 2020, 105: 1030-1045. |
| [17] |
郭雅. 不同腌制工艺对风干鳊鱼品质影响研究[D]. 南京: 南京师范大学, 2016: 30-42. GUO Ya. The effect of different curing technology on quality of air-drying Parabaramis pekinensis[D]. Nanjing: Nanjing Normal University, 2016: 30-42. |
| [18] |
王娜, 王颉, 孙剑锋, 等. 即食菲律宾蛤仔贮存过程中的香气成分分析[J]. 食品工业, 2012, 33(8): 131-134. WANG Na, WANG Jie, SUN Jianfeng, et al. Analysis of the flavor components during the processing of instant clam storage[J]. The Food Industry, 2012, 33(8): 131-134. |
| [19] |
王晓, 尹鹏, 郭桂义, 等. 信阳毛尖茶芳香成分研究进展[J]. 茶叶, 2018, 44(2): 77-80. WANG Xiao, YIN Peng, GUO Guiyi, et al. Research progress on aromatic ingredients of Xinyang maojian tea[J]. Journal of Tea, 2018, 44(2): 77-80. |
| [20] |
李娜, 张富县, 李妙清, 等. 鲜山楂不同部位挥发性成分分析[J]. 中国食品添加剂, 2019, 30(6): 121-127. LI Na, ZHANG Fuxian, LI Miaoqing, et al. Analysis of volatile components in different parts of fresh hawthorn[J]. China Food Additives, 2019, 30(6): 121-127. |
| [21] |
ZHANG Z M, LI G K, LUO L, et al. Study on seafood volatile profile characteristics during storage and its potential use for freshness evaluation by headspace solid phase microextraction coupled with gas chromatography–mass spectrometry[J]. Analytica Chimica Acta, 2010, 659(1): 151-158. |
| [22] |
IGLESIAS J, MEDINA I, BIANCHI F, et al. Study of the volatile compounds useful for the characterization of fresh and frozen-thawed cultured gilthead sea bream fish by solid-phase microextraction gas chromatography–mass spectrometry[J]. Food Chemistry, 2009, 115(4): 1473-1478. DOI:10.1016/j.foodchem.2009.01.076 |
| [23] |
刘炜, 熊怡然, 郜晓峰, 等. 海马齿生态适应能力与修复应用研究[J]. 热带作物学报, 2023, 44(2): 438-445. LIU Wei, XIONG Yiran, HAO Xiaofeng, et al. Study on the ecological adaptation and restoration application of Sesuvium portulacastrum L.[J]. Chinese Journal of Tropical Crops, 2023, 44(2): 438-445. |
| [24] |
BECA-CARRETERO P, GUIHENEUF F, KRAUSE- JENSEN D, et al. Seagrass fatty acid profiles as a sensitive indicator of climate settings across seasons and latitudes[J]. Marine Environmental Research, 2020, 161: 105075. |
| [25] |
PLEADIN J, KVRGIC K, ZRNCIC S, et al. Variations in nutritive composition of three shellfish species[J]. Italian Journal of Food Science, 2019, 31(4): 716-730. |
| [26] |
RUTH S, VILLEGAS B, AKKERMANS W, et al. Prediction of the identity of fats and oils by their fatty acid, triacylglycerol and volatile compositions using PLS-DA[J]. Food Chemistry, 2010, 118(4): 948-955. |
| [27] |
UPCHURCH R G. Fatty acid unsaturation, mobilization, and regulation in the response of plants to stress[J]. Biotechnology Letters, 2008, 30(6): 967-977. |
| [28] |
NISHIDA I, MURATA N. Chilling sensitivity in plants and cyanobacteria: the crucial contribution of membrane lipids[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1996, 47(1): 541-568. |
| [29] |
SCHMID M, GUIHENEUF F, STENGEL D B. Fatty acid contents and profiles of 16 macroalgae collected from the Irish coast at two seasons[J]. Journal of Applied Phycology, 2014, 26: 451-463. |
| [30] |
SCHMID M, GUIHÉNEUF F, STENGEL D B. Plasticity and remodelling of lipids support acclimation potential in two species of low-intertidal macroalgae, Fucus serratus (Phaeophyceae) and Palmaria palmata[J]. Algal Research-Biomass Biofuels and Bioproducts, 2017, 26: 104-114. |
| [31] |
TIAN J Y, TIAN L, CHEN M, et al. Low temperature affects fatty acids profiling and key synthesis genes expression patterns in Zanthoxylum bungeanum maxim[J]. International Journal of Molecular Sciences, 2022, 23(4): 2319. |
| [32] |
ALBERDI M, BRAVO L A, GUTIERREZ A, et al. Ecophysiology of antarctic vascular plants[J]. Physiologia Plantarum, 2002, 115: 479-486. |
| [33] |
TEOH M L, CHU W L, MARCHANT H, et al. Influence of culture temperature on the growth, biochemical composition and fatty acid profiles of six Antarctic microalgae[J]. Journal of Applied Phycology, 2004, 16(6): 421-430. |
| [34] |
MURATA N, SATO N, TAKAHASHI N, et al. Compositions and positional distributions of fatty acids in phospholipids from leaves of chilling-sensitive and chilling-resistant plants[J]. Plant and Cell Physiology, 1982, 23: 1071-1079. |
| [35] |
ROUTABOUL J M, FISCHER S, BROWSE J. Trienoic fatty acids are required to maintain chloroplast function at low temperature[J]. Plant Physiology, 2000, 124(4): 1697-1705. |
| [36] |
袁华根, 高峰, 徐骏, 等. 鸡肉挥发性风味化合物分析[J]. 江西农业学报, 2006, 18(5): 139-141. YUAN Huagen, GAO Feng, XU Jun, et al. Identification of volatile flavour compounds of chicken meat[J]. Acta Agriculturae Jiangxi, 2006, 18(5): 139-141. |
| [37] |
MOHAMED H N, MAN Y C, MUSTAFA S, et al. Tentative identification of volatile flavor compounds in commercial Budu, a malaysian fish sauce, using GC-MS[J]. Molecules, 2012, 17(5): 5062-5080. |
| [38] |
PENNARUN A L, PROST C, DEMAIMAY M. Identification and origin of the character-impact compounds of raw oyster Crassostrea gigas[J]. Journal of the Science of Food and Agriculture, 2002, 82(14): 1652-1660. |
| [39] |
HSIEH R J, GERMAN J B, KINSELLA J E. Lipoxygenase in fish tissue: some properties of the 12-lipoxygenase from trout gill[J]. Journal of Agricultural & Food Chemistry, 1988, 36(4): 680-685. |
| [40] |
GERMAN J B, CREVELING R K. Identification and characterization of a 15-lipoxygenase from fish gills[J]. Journal of Agricultural and Food Chemistry, 1990, 38(12): 2144-2147. |
| [41] |
GRN I U, BARBEAU W E. Lipoxygenase activity in menhaden gill tissue and its effect on odor of n-3 fatty acid ester concentrates[J]. Journal of Food Biochemistry, 1994, 18(3): 199-212. |
 2023, Vol. 47
2023, Vol. 47