文章信息
- 孟良, 李华煜, 王元宁, 李金泽, 李永仁, 郭永军, 张涛. 2023.
- MENG Liang, LI Hua-yu, WANG Yuan-ning, LI Jin-ze, LI Yong-ren, GUO Yong-jun, ZHANG Tao. 2023.
- 复合益生菌和底质深度对硬壳蛤育苗效果的影响
- Effect of compound probiotics and substrate depth on the breeding of hard clam (Mercenaria mercenaria)
- 海洋科学, 47(12): 55-62
- Marine Sciences, 47(12): 55-62.
- http://dx.doi.org/10.11759/hykx20230405001
-
文章历史
- 收稿日期:2023-04-05
- 修回日期:2023-04-19
2. 中国科学院海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071
2. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
硬壳蛤(Mercenaria mercenaria), 又称美洲帘蛤, 自然栖息于大西洋沿岸, 是主要的浅海和滩涂经济双壳贝类之一, 具有肉质鲜美、生长快、抗逆性强等特点[1]。中国科学院海洋研究所于1997年首次引进该种, 经几年试养后发现, 硬壳蛤适合我国大部分沿海滩涂和虾池养殖[2]。我国硬壳蛤苗种的市场供应主要依赖于人工育苗。近几年, 硬壳蛤苗种繁育过程中, 出现了幼虫成活率下降、人工育苗成功率偏低等现象, 导致苗种供不应求, 严重制约了养殖产业健康持续发展。因此, 探究适宜硬壳蛤生长和存活的环境条件, 能够为硬壳蛤的大规模室内人工育苗供理论基础。
益生菌可通过改善水质环境或机体肠道菌群等方式, 增强了养殖动物机体的免疫力和抗病力等[3]。目前, 益生菌在水产养殖中的应用已引起国内外学者的广泛关注[4]。相关研究主要集中在病原体的竞争性排除、免疫调节、抗菌、促进消化酶活性和生长存活等方面[5-7]。研究表明, 筛选自凡纳滨对虾(Litopenaeus vannamei)的几种乳酸杆菌对多种致病弧菌的生长具有显著抑制作用[8]。益生菌显著提高了凡纳滨对虾的生长率、存活率和免疫活性, 其体内的碱性磷酸酶、酸性磷酸酶和溶菌酶等免疫相关酶的活性显著增强[9]。投喂添加丁酸梭菌代谢物的饲料后, 凡纳滨对虾生长率和存活率都显著高于对照组[10]。此外, 益生菌还会促进细菌素、噬铁素和溶菌酶等抗菌物质的产生, 增强多种鱼类对病毒、细菌、真菌和寄生虫感染的抵抗力[11]。
与甲壳动物、鱼类相比, 关于益生菌对贝类生长和存活影响的研究较少, 仅有的少数研究主要聚焦于牡蛎和鲍[12-13]。已有研究表明, 益生菌具有增强贝类消化酶活性的功能, 能够提高贝类饵料利用率和生长速度[5]。例如, 交替单胞菌显著提高了长牡蛎(Crassostrea gigas)幼虫的生长率和存活率[14]。投喂添加弧菌(Abn1.2和alg3.1)耐利福平突变株益生菌的饲料显著提高了驴耳鲍(Haliotis asinine)的肠道琼脂酶活性以及生长速度[15]。在贝类苗种培育中, 益生菌大多单独投喂, 但投喂复合益生菌能提供对机体的整体保护, 可能更有利于贝类幼虫的存活和生长[16]。例如, 从成年牡蛎肠道筛选到的复合益生菌能够显著提高长牡蛎和熊本牡蛎(C. sikamea)的存活率和变态率[17]。施用乳酸杆菌复合益生菌后, 珠母贝(Pinctada mazatlanica)的存活率显著提升[18]。
变态是海洋双壳贝类发育过程中的重要发育事件, 贝类变态是外界诱导因子和内部调控因子协同作用的结果, 受基因调控和环境因素的共同影响, 如食物、底质、金属离子和微生物分泌物等[19-20]。与其他海洋双壳类物种类似, 硬壳蛤生活史可分为3个阶段, 包括浮游期、匍匐期和埋栖阶段。硬壳蛤浮游幼虫期使用面盘来运动, 当幼虫发育出足, 面盘开始退化, 便可以进行附着变态, 壳顶后期幼虫附着在合适的底质上便开始变态[21]。然而, 如果幼虫在感受到诱导信号后没有合适的条件进行附着, 会出现延迟变态现象[22]。并且, 在附着变态阶段, 幼虫对外部环境因子变化更为敏感。对于硬壳蛤等埋栖型贝类来讲, 底质起着提供活动场所、增加附着点、建立隐蔽场所以及充当营养物质等作用[23]。在自然条件下, 由于硬壳蛤生活在潮间带的泥滩地区, 需要在泥沙底质才能完成变态和生长[24]。因此, 本实验研究了复合益生菌和沙质底质对硬壳蛤幼虫和稚贝生长和存活的影响, 以期筛选促进硬壳蛤生长发育、提高成活率的复合益生菌, 确定适宜其生长发育的最佳底质深度, 进一步优化人工育苗技术, 为硬壳蛤大规模人工育苗工作的开展提供技术支撑。
1 材料与方法 1.1 实验材料硬壳蛤种贝取自于天津恒仟水产有限公司池塘(38.8°N, 117.5°E)和福建省莆田市中灵农业有限公司池塘(25.3°N, 119.0°E)。经过虾塘水培养15 d后, 使用阴干或者变温刺激的方法在广东省湛江雷州市育苗基地的育苗车间进行产卵。
从威海市博益农业科技有限公司获得2种复合益生菌, 有效活菌数≥8.0×108/mL, S1为复合型多菌株菌群(酵母菌、乳酸菌、光照菌、放线菌、枯草芽孢杆菌等), 经过耐盐性驯化, 适应力强。S2为乳酸菌类的复合菌群, 另外添加丁酸梭菌的代谢物。在幼虫培育期间中, 益生菌原液置于4 ℃冰箱中保存。实验用沙经40目网筛筛滤并使用高锰酸钾消毒后晒干备用。
1.2 幼虫培育受精卵按照10个/mL受精卵置于250 L塑料实验桶中, 每个250 L塑料实验桶上标有产卵日期和初始饲养密度。幼虫培养在遮光、充气条件下进行, 每天换水2次, 每次1/2体积, 维持水温和盐度恒定。实验开始后, 每个实验桶3~4 d进行1次全量换水, 在换水过程中, 使用260目筛绢来转移幼虫, 并及时去除桶底死亡个体、粪便和杂质。换水时, 培养容器需使用10%的碘溶液和自来水擦洗。若培养容器出现粉红色斑点, 则用1%的次氯酸溶液擦洗培养容器。在擦洗完毕后, 使用20%硫代硫酸钠溶液中和次氯酸, 随后使用海水彻底冲洗。
在担轮幼虫和D型幼虫期间不投喂饵料[25]。幼虫培育以等鞭金藻(Isochrysis galbana)为主。幼虫孵化24 h后开始投饵, 投饵量为5 000~20 000 cells·mL−1·d−1。在壳顶幼虫后期, 投饵量为30 000~50 000 cells·mL−1·d−1。每隔2 h检查1次水体中饵料密度并及时调整投饵量, 及时换水并测量幼虫大小。养殖8~10 d, 当幼虫达到面盘幼虫后期(壳长170~230 μm)时, 足开始发育, 面盘开始退化, 活动减弱, 将附着变态。此时, 将幼虫全部转移到新的实验桶中。每天取30个幼虫进行显微镜镜检, 并使用image view软件测量壳长。通过计算每2 mL中幼虫的数量来计算每个实验桶中幼虫的数量及成活率。当幼虫达到稚贝阶段, 日全量换水1次, 试验结束时统计桶底变态稚贝数量, 测定变态率。每日换水并观察存活状态, 移除死亡个体。死亡标志: 壳面暗淡, 内部器官模糊不清, 足不伸出, 体内原生动物繁生, 鳃纤毛不动。
1.3 实验设计实验1: 探究在20 ℃条件下培养30 d后, 不同益生菌对硬壳蛤幼虫存活、生长和变态的影响。实验组硬壳蛤幼虫在投喂的藻类饵料中添加体积比2×10–6益生菌, 对照组硬壳蛤幼虫仅投喂藻类。
实验2: 探究在不同温度(20 ℃和25 ℃)下培养8 d后, 益生菌对不同地区种贝所产幼虫生长的影响。实验组硬壳蛤幼虫添加体积比2×10–6 S2益生菌, 对照组硬壳蛤幼虫仅投喂藻类。
实验3: 探究在不同沙底质深度对幼虫的附着率、变态率、存活率和生长率的影响。按照沙底质深度分为T1(0 mm, 对照组)、T2(1 mm)、T3(3 mm)和T4(5 mm), 对照组为普通的塑料底质。本实验共进行20 d。
实验4: 探究不同规格硬壳蛤稚贝潜沙能力的差异。根据稚贝壳长挑选150粒稚贝, 按照每组50粒稚贝分为A1(0.7 mm<A1<1 mm)、A2(1 mm<A2<2 mm)和A3(2 mm<A3<3 mm)3个规格组。在2 L烧杯底部铺设厚约2 cm细沙(粒径<0.70 mm)。本实验共进行24 h。
在所有实验中, 根据处理方式分为2~4组, 每个处理组设置3个生物学重复。
1.4 数据收集和分析在实验1、2中, 在每次实验开始(0 d)时, 使用图像分析仪(Image View)随机测量30个幼虫的壳长。在实验进行8~10 d, 幼虫发育到壳顶幼虫后期时, 测定幼虫存活率(%), 幼虫存活率为实验结束时幼虫密度与初始密度的比例。并随机选取30个幼虫, 测定其壳长, 并计算幼虫的特定生长率(SGR, %/d), 是衡量生长状况的一个常用指标。第30 d时, 计算每组稚贝的存活率。实验3中, 每3 d取样测量幼虫的出足率、变态率、存活率和生长率。在实验4中, 观察并记录不同规格稚贝的潜沙时间以及潜沙深度。使用偏度系数(g1)计算仅投喂藻类的对照组和添加益生菌的每个处理的实验组幼虫的大小频率分布。计算公式如下:
其中: At为实验第t天时幼虫的幼虫密度(ind./mL); A0为幼虫初始密度(ind./mL)。Lt为试验第t天时幼虫的壳长(μm); L0为幼虫初始壳长(μm); t为试验时间(d)。
使用Excel和GraphPad Prism 8进行数据统计分析和制图, 使用SPSS软件中One-Way ANOVA和Two-Way ANOVA方法进行统计学分析, P<0.05被认为具有显著性差异。数据表示方式为平均数±标准差(mean ± SD)。
2 结果 2.1 益生菌对硬壳蛤幼虫的生长率、存活率和变态率的影响结果显示, 两种益生菌对硬壳蛤幼虫的生长率和变态率均有显著影响(P<0.05)。如图 1和图 2所示, 投喂益生菌后幼虫的生长率和变态率显著提高(P<0.05), 此结果表明, 在幼虫培养过程中, 投喂益生菌有利于提高硬壳蛤幼虫的生长率和变态率。S1、S2两种益生菌对幼虫存活率没有显著差异(P>0.05, 图 3), 投喂S2益生菌后幼虫的生长率和变态率最高(P<0.05), 但S2与S1组间的幼虫变态率无明显差异(P>0.05), 以上结果表明, S2益生菌对硬壳蛤幼虫生长和变态的促进作用优于S1益生菌。
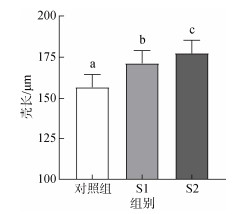 |
| 图 1 20 ℃条件下, 以添加不同益生菌培养10 d后, 硬壳蛤幼虫的生长情况 Fig. 1 Growth of clam larvae cultured with different probiotics at 20 ℃ for 10 days 注: 不同字母代表不同实验组间存在显著差异(P<0.05); S1: 复合型多菌株菌群(酵母菌、乳酸菌、光照菌、放线菌、枯草芽孢杆菌等); S2: 乳酸菌类的复合菌群(添加丁酸梭菌的代谢物) |
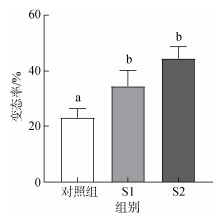 |
| 图 2 20 ℃条件下, 益生菌培养30 d后幼虫变态率 Fig. 2 Larval metamorphosis rate after 30 days of probiotic culture at 20 ℃ 注: 不同字母代表不同实验组间存在显著差异(P<0.05); S1: 复合型多菌株菌群(酵母菌、乳酸菌、光照菌、放线菌、枯草芽孢杆菌等); S2: 乳酸菌类的复合菌群(添加丁酸梭菌的代谢物) |
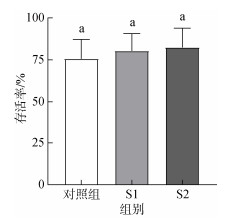 |
| 图 3 20 ℃条件下添加不同益生菌培养10 d后硬壳蛤幼虫的存活率 Fig. 3 Survival rate of clam larvae cultured with different probiotics at 20 ℃ for 10 days 注: 不同字母代表不同实验组间存在显著差异(P<0.05); S1: 复合型多菌株菌群(酵母菌、乳酸菌、光照菌、放线菌、枯草芽孢杆菌等); S2: 乳酸菌类的复合菌群(添加丁酸梭菌的代谢物) |
温度和亲贝产地对硬壳蛤壳幼虫的特定生长率有着极显著性影响(P<0.01)。如图 4和图 5所示, 在不同培养温度下养殖8 d后, S2实验组幼虫的SGRs显著高于对照组(P<0.05); 在20 ℃下, 各组幼虫都具有极显著差异(P<0.01), 且在同一处理下, 福建组幼虫的SGRs极显著高于天津组幼虫(P<0.01)(图 4a); 而在25 ℃下, 福建组幼虫与天津组幼虫之间的SGRs无显著差异(P>0.05)(图 4b)。以上结果表明, 在20 ℃时, 不同产地的幼虫生长率都具有显著差异(P<0.05), 福建组幼虫生长率大于天津组; 在25 ℃时, 在相同处理下不同产地幼虫的生长率无显著差异(P>0.05)。综上所述, S2益生菌对幼虫SGRs的促进效果受到种贝产地和培育温度的影响。
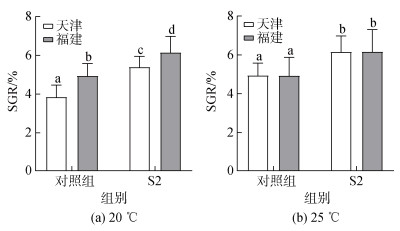 |
| 图 4 不同产地培育的硬壳蛤幼虫的特定生长率 Fig. 4 Specific growth rates of larvae cultured from different habitats 注: 不同字母代表不同实验组间存在显著差异(P<0.05); S1: 复合型多菌株菌群(酵母菌、乳酸菌、光照菌、放线菌、枯草芽孢杆菌等); S2: 乳酸菌类的复合菌群(添加丁酸梭菌的代谢物) |
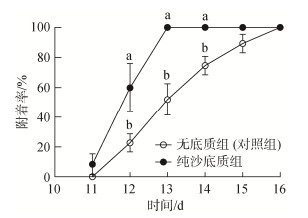 |
| 图 5 沙质底质对硬壳蛤面盘幼虫附着率影响 Fig. 5 Effect of a sandy substrate on the clam larval settlement rate 注: 不同字母代表不同实验组间存在显著差异(P<0.05) |
S2益生菌对硬壳蛤幼虫大小频率分布的影响如表 1所示。幼虫大小频率分布的形状可以用偏度系数(g1)表示。g1计算了仅投喂藻类的对照组和添加益生菌的每个处理的实验组幼虫的大小频率。若数据符合正态分布, 则g1为0。g1为正值表明小个体幼虫占比较大, 而负值表明大个体幼虫占比较大。对照组幼虫的g1系数在0.17至0.69之间, 投喂S2益生菌的幼虫的g1系数在–0.29至0.18之间。在实验处理1和4中, 单独投喂藻类的幼虫群体的显著偏度系数都低于S2组的幼虫群体(P<0.05), 说明在添加S2益生菌的养殖水体中, 小型幼虫的占比较低。
| 实验处理 | 对照组 | S2 | P | ||
| g1 | s.d. | g1 | s.d. | ||
| 1 | 0.211 | 0.319 | –0.298 | 0.150 | 0.016 |
| 2 | 0.690 | 0.633 | 0.188 | 0.125 | 0.249 |
| 3 | 0.173 | 0.651 | –0.073 | 0.279 | 0.581 |
| 4 | 0.866 | 0.564 | –0.178 | 0.230 | 0.040 |
| 注: 实验处理1: 在20 ℃下培养的天津幼虫; 实验处理2: 在25 ℃下培养的天津幼虫; 实验处理3: 在20 ℃下培养的福建幼虫; 实验处理3: 在25 ℃下培养的福建幼虫 | |||||
如图 5所示, 在2 d、3 d和4 d时, 实验组幼虫的附着率显著高于对照组(P<0.05); 在3 d时, 实验组幼虫全部附着, 与对照组幼虫的附着率的比值达到最大(2︰1); 结果表明, 沙质底质对硬壳蛤幼虫附着具有显著促进作用(P<0.05)。在实验进行第3 d时, T3组幼虫的出足率最高, 显著高于T1、T2组(P<0.05); 在第6 d和10 d时, T2、T3和T4组的幼虫出足率无显著性差异(P>0.05)(图 6)。T1组幼虫变态率显著低于实验组(P>0.05), 而实验组间没有显著性差异(图 7)。T1组存活率最低, 显著低于T3和T4组(P<0.05), T3组的幼虫存活率最高, 与T4组无显著差异(P>0.05)(图 8)。实验结果表明, 沙质底质对硬壳蛤幼虫的附着率、变态率和存活率具有积极作用, 3 mm深度沙质底质对硬壳蛤幼虫变态率和存活率的效果最佳。
 |
| 图 6 在不同沙深度条件下硬壳蛤幼虫的出足率 Fig. 6 Foot emergence rate of clam larvae at different sand depths 注: 不同字母代表不同实验组间存在显著差异(P<0.05); T1: (深度0 mm, 对照组); T2(深度1 mm); T3(深度3 mm); T4(深度5 mm) |
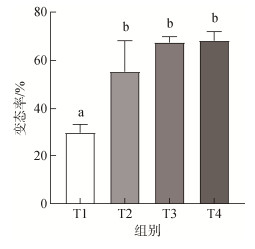 |
| 图 7 不同沙深度条件下硬壳蛤幼虫的变态率 Fig. 7 Metamorphosis rate of clam larvae under different sand depths 注: 不同字母代表不同实验组间存在显著差异(P<0.05); T1: (深度0 mm, 对照组); T2(深度1 mm); T3(深度3 mm); T4(深度5 mm) |
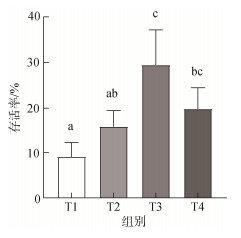 |
| 图 8 不同沙深度条件下硬壳蛤幼虫的存活率 Fig. 8 Survival rate of clam larvae at different sand depths 注: 不同字母代表不同实验组间存在显著差异(P<0.05); T1: (深度0 mm, 对照组); T2(深度1 mm); T3(深度3 mm); T4(深度5 mm) |
沙质底质组稚贝壳长显著高于对照组(P<0.05)。在实验进行10 d时, T3和T4组稚贝的壳长显著高于T1组(P<0.05), 实验进行20 d时, T3组稚贝的壳长最长, 且实验组组间没有显著性差异(P>0.05)。实验结果表明沙质底质组对稚贝的生长也具有促进作用。
2.6 规格对硬壳蛤稚贝潜沙行为的影响如表 2所示, 硬壳蛤稚贝在沙质底质中的潜沙深度与苗种规格无显著差异(P>0.05), 在12 h时, A1、A2和A3组70%~80%稚贝的潜沙深度为0~3 mm, 6%~10%的稚贝潜沙深度为3~6 mm的, 13%~20%的稚贝潜沙深度为6~9 mm。结果表明0.7~3 mm的稚贝适宜的潜沙深度为0~3 mm, 只有不到20%稚贝潜到3~9 mm的深度。
| 12 h潜沙的深度 | A1组 | A2组 | A3组 |
| 0~3 mm | 80.00% ± 4.01% | 73.33% ± 6.71% | 76.67% ± 8.11% |
| 3~6 mm | 6.67% ± 3.50% | 6.67% ± 5.97% | 10.00% ± 5.97% |
| 6~9 mm | 13.33% ± 3.38% | 20.00% ± 8.45% | 13.33% ± 6.80% |
| 注: A1(0.7 mm<稚贝壳长<1 mm); A2(1 mm<稚贝壳长<2 mm); A3(2 mm<稚贝壳长<3 mm) | |||
硬壳蛤为外来物种, 苗种主要来源于不同地区的人工育苗场, 繁育过程易受不同养殖环境的影响。作为滤食性贝类, 硬壳蛤幼虫肠道的微生物菌群在很大程度上取决于海水中的微生物, 因此控制养殖环境中微生物的种类和数量, 对其发育和存活具有重要意义。本研究探究了复合益生菌对硬壳蛤幼虫的生长率、变态率和存活率的影响。结果表明, 在硬壳蛤幼虫培养过程中添加S2益生菌能够显著提高硬壳蛤幼虫的生长率和存活率, 且添加益生菌后的小个体幼虫占比降低。有类似研究表明, LAB复合益生菌加速了斑马鱼(Danio rerio)幼鱼对卵黄营养的吸收和利用, 提高了幼鱼的生长率和存活率[26]。LAB复合益生菌也显著提高了珠母贝(Pinctada mazatlanica)生长率和存活率[18]。丁酸梭菌(Clostridium butyricum)是典型的产丁酸盐细菌, 可以产生氨基酸、维生素和短链脂肪酸来增加肠道的营养物质[27]。在饵料中添加可以产短链脂肪酸的益生菌, 有利于日本大鲍(H.gigantea)的生长[28]。例如, 添加肠球菌(Enterococcus sp.)的复合益生菌后显著增加了新西兰鲍(H.iris)幼虫的生长率和存活率[12]。添加盐酸弧菌(Vibrio halioticoli)复合益生菌显著提高了皱纹盘鲍(H. discus hannai)的生长速度[29]。因此, 硬壳蛤幼虫的生长率增高, 可能是由于益生菌增强了幼虫蛋白酶和脂肪酶等消化酶的活力; 或者是为幼虫提供了额外的营养物质。
此外, 实验2结果表明, 幼虫生长率受到温度和产地的影响。在不同温度下, 不同产地幼虫的生长率具有显著性差异, 可能是温度影响了不同产地幼虫肠道中细菌的丰度, 导致与复合益生菌菌群之间产生拮抗作用, 进而影响了幼虫的生长。有研究表明, 在不同温度下, 鲍鱼肠道微生物菌群丰度具有显著差异, 高温条件下绿盘鲍(H. discus hannai ♀× H.fulgens♂)用于维持正常新陈代谢、保持细胞形态功能的肠道微生物较皱纹盘鲍(H. discus hannai)丰度更高[30]。
底质是影响底栖贝类生长、存活、行为方式以及地理分布的重要环境因素。本研究结果显示, 沙质底质对硬壳蛤的附着率、生长率和变态率具有显著的促进作用, 在有沙质底质条件下, 硬壳蛤幼虫能够较快地附着并完成潜沙。有研究表明, 底质对菲律宾蛤仔(Ruditapes philippinarum)的摄食率、呼吸和排泄产生显著影响[31-32]。有研究表明, 滤食性贝类摄食一定量的沙子, 有助于粉碎胃内颗粒物, 诱导体内消化酶的分泌, 进而提高对营养物质的吸收[33]。在有缓冲沉积物或海草床的底质条件下, 硬壳蛤幼虫以及稚贝的生长率和存活率均显著提升, 且种群密度较高[34-35]。而在室内条件下, 水相对静止, 残饵、水中悬浮物及粪便在沙表面逐渐积累, 无法定期清理, 可引起有害微生物繁殖, 因此, 在养殖过程中, 池塘底部应投放适量沙子并及时清除粪便和残饵, 从而保持贝苗生活环境的相对稳定。在本实验中, T3组(3 mm)深度最适合硬壳蛤幼虫的生长、变态和存活, 且硬壳蛤稚贝在12 h后, 仍然有73%~80%的稚贝埋栖在0~3 mm的深度。因此, 3 mm深度沙质底质对壳长小于3 mm硬壳蛤稚贝培育效果最佳。
4 结论复合益生菌对硬壳蛤幼虫的生长率和变态率具有显著促进作用, 含有丁酸梭菌代谢物的乳酸菌复合益生菌效果最好, 显著提高幼虫的生长率和变态率, 且添加S2益生菌的养殖水体中, 小型幼虫的比例更低; 温度和产地影响着幼虫的生长率, 在20 ℃下时, 在同一处理下, 福建产幼虫的生长率高于天津产幼虫, 而在25 ℃时, 它们无显著差异。沙质底质促进了幼虫的附着变态, 提高了幼虫的附着速度, 3 mm深度沙质底质条件下的幼虫出足率、变态率和存活率最高; 埋栖在3 mm以上的稚贝所占比例最高。筛选了促进硬壳蛤生长发育、提高成活率的复合益生菌, 确定了适宜硬壳蛤生长发育的最佳底质深度, 进一步优化了硬壳蛤人工育苗技术, 对开展大规模硬壳蛤人工育苗工作具有显著的促进意义。
| [1] |
常亚青, 王喜福. 硬壳蛤的人工育苗技术[J]. 水产科学, 2002, 9(1): 43-47. CHANG Yaqing, WANG Xifu. Artificial cultivation of Mercenaria mercenaria[J]. Journal of Fishery Sciences of China, 2002, 9(1): 43-47. |
| [2] |
张涛, 杨红生, 刘保忠, 等. 硬壳蛤(Mercenaria mercenaria)稚贝中间培育模式的初步研究[J]. 海洋与湖沼, 2003, 34(6): 648-655. ZHANG Tao, YANG Hongsheng, LIU Baozhong, et al. Primary study on modes of seed hard clam Mercenaria mercenaria (Linnaeus, 1758) culture in field[J]. Oceanologia et Limnologia Sinica, 2003, 34(6): 648-655. DOI:10.3321/j.issn:0029-814X.2003.06.009 |
| [3] |
WANG A R, RAN C, WANG Y B, et al. Use of probiotics in aquaculture of China—a review of the past decade[J]. Fish & Shellfish Immunology, 2019, 86: 734-755. |
| [4] |
PRADO S, ROMALDE J L, BARJA J L. Review of probiotics for use in bivalve hatcheries[J]. Veterinary Microbiology, 2010, 145(3): 187-197. |
| [5] |
NEWAJ-FYZUL A, AL-HARBI A H, AUSTIN B. Review of probiotics for use control in aquaculture[J]. Aquaculture, 2014, 431: 1-11. DOI:10.1016/j.aquaculture.2013.08.026 |
| [6] |
HILL C, GUARNER F, REID G, et al. The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic[J]. Nature Reviews Gastroenterology & Hepatology, 2014, 11(8): 506-514. |
| [7] |
SUMON T A, HUSSAIN M A, SUMON M A A, et al. Functionality and prophylactic role of probiotics in shellfish aquaculture[J]. Aquaculture reports, 2022, 25: 101220. DOI:10.1016/j.aqrep.2022.101220 |
| [8] |
ADEL M, YEGANEH S, DAWOOD M A O, et al. Effects of Pediococcus pentosaceus supplementation on growth performance, intestinal microflora and disease resistance of white shrimp, Litopenaeus vannamei[J]. Aquaculture Nutrition, 2017, 23(6): 1401-1409. DOI:10.1111/anu.12515 |
| [9] |
LI H D, TIAN X L, DONG S L. Growth performance, non-specific immunity, intestinal histology and disease resistance of Litopenaeus vannamei fed on a diet supplemented with live cells of Clostridium butyricum[J]. Aquaculture, 2019, 498: 470-481. DOI:10.1016/j.aquaculture.2018.09.003 |
| [10] |
LI H D, TIAN X L, ZHAO K, et al. Effect of Clostridium butyricum in different forms on growth performance, disease resistance, expression of genes involved in immune responses and mTOR signaling pathway of Litopenaeus vannamai[J]. Fish & shellfish immunology, 2019, 87: 13-21. |
| [11] |
ASSAN D, KUEBUTORNYE F K A, HLORDZI V, et al. Effects of probiotics on digestive enzymes of fish (finfish and shellfish); status and prospects: a mini review[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2022, 257: 110653. DOI:10.1016/j.cbpb.2021.110653 |
| [12] |
RIQUELME F R S P. Use of macroalgae supplemented with probiotics in the Haliotis rufescens (Swainson, 1822) culture in Northern Chile[J]. Aquaculture Research, 2011, 42(7): 953-961. DOI:10.1111/j.1365-2109.2010.02678.x |
| [13] |
AMIN M, BOLCH C J S, ADAMS M B, et al. Growth enhancement of tropical abalone, Haliotis asinina L, through probiotic supplementation[J]. Aquaculture international, 2020, 28(2): 463-475. DOI:10.1007/s10499-019-00473-4 |
| [14] |
DOUILLET P A, LANGDON C J. Use of a probiotic for the culture of larvae of the Pacific oyster (Crassostrea gigas Thunberg)[J]. Aquaculture, 1994, 119(1): 25-40. DOI:10.1016/0044-8486(94)90441-3 |
| [15] |
FATURRAHMAN, ROHYATI I S, SUKIMAN D. Improved of growth rate of abalone Haliotis Asinine fed pudding probiotic-enriched protein[J]. Procedia Environmental Sciences, 2015, 23: 315-322. DOI:10.1016/j.proenv.2015.01.046 |
| [16] |
CHAPMAN C M C, GIBSON G R, ROWLAND I. Health benefits of probiotics: are mixtures more effective than single strains?[J]. European Journal of Nutrition, 2011, 50(1): 1-17. DOI:10.1007/s00394-010-0166-z |
| [17] |
MADISON D, SCHUBIGER C, LUNDA S, et al. A marine probiotic treatment against the bacterial pathogen Vibrio coralliilyticus to improve the performance of Pacific (Crassostrea gigas) and Kumamoto (C. sikamea) oyster larvae[J]. Aquaculture, 2022, 560: 738611. DOI:10.1016/j.aquaculture.2022.738611 |
| [18] |
AGUILAR-MACÍAS O, OJEDA-RAMÍREZ J, CAMPA-CÓRDOVA A, et al. Evaluation of natural and commercial probiotics for improving growth and survival of the pearl oyster, Pinctada mazatlanica, during late hatchery and early field culturing[J]. Journal of the World Aquaculture Society, 2010, 41(3): 447-454. DOI:10.1111/j.1749-7345.2010.00386.x |
| [19] |
RODRIGUEZ R S, OJEDA P F, INESTROSA C N. Settlement of benthic marine invertebrates[J]. Marine Ecology Progress Series, 1993, 97(2): 193-207. |
| [20] |
CAVALCANTI G S, ALKER A T, DELHERBE N, et al. The influence of bacteria on animal metamorphosis[J]. Annual Review of Microbiology, 2020, 74: 137-158. DOI:10.1146/annurev-micro-011320-012753 |
| [21] |
GOLDBERG R. Biology and culture of the hard clam (Mercenaria mercenaria)[J]. Southern Regional Aqua culture Center, 1989, 263-276. |
| [22] |
ARINI E, JAYA N T S P. The effect of various spat collector materials for spat attachment of pearl of pearl oyster (Pinctada maxima)[J]. Journal of Coastal Development, 2012, 15: 1410-5217. |
| [23] |
沈新强, 夏培艳. 滩涂贝类养殖环境研究现状与展望[J]. 海洋科学进展, 2011, 29(4): 546-553. SHEN Xinqiang, XIA Peiyan. Research status and prospect of shellfish culture environment in tidal flat[J]. Advances in Marine Science, 2011, 29(4): 546-553. DOI:10.3969/j.issn.1671-6647.2011.04.015 |
| [24] |
陈蓉, 刘建勇, 唐连俊, 等. 中国5个海区不同群体毛蚶形态差异分析[J]. 海洋科学, 2009, 33(7): 64-69. CHEN Rong, LIU Jianyong, TANG Lianjun, et al. Morphological variations analysis of five different populations of Scapharca subcrenata in China[J]. Marine Sciences, 2009, 33(7): 64-69. |
| [25] |
GALLAGER S M, MANN R. Growth and survival of larvae of Mercenaria mercenaria (L.) and Crassostrea virginica (Gmelin) relative to broodstock conditioning and lipid content of eggs[J]. Aquaculture, 1986, 56(2): 105-121. DOI:10.1016/0044-8486(86)90021-9 |
| [26] |
PADENIYA U, LARSON E T, SEPTRIANI S, et al. Probiotic treatment enhances pre-feeding larval development and early survival in zebrafish Danio rerio[J]. Journal of aquatic animal health, 2022, 34(1): 3-11. DOI:10.1002/aah.10148 |
| [27] |
DUAN Y F, DONG H B, WANG Y, et al. Effects of the dietary probiotic Clostridium butyricum on intestine digestive and metabolic capacities, SCFA content and body composition in Marsupenaeus japonicus[J]. Journal of Ocean University of China, 2018, 17(3): 690-696. DOI:10.1007/s11802-018-3464-3 |
| [28] |
IEHATA S, INAGAKI T, OKUNISHI S, et al. Improved gut environment of abalone Haliotis gigantea through Pediococcus sp. Ab1 treatment[J]. Aquaculture, 2010, 305(1): 59-65. |
| [29] |
SAWABE T, SETOGUCHI N, INOUE S, et al. Acetic acid production of Vibrio halioticoli from alginate: a possible role for establishment of abalone–V. halioticoli association[J]. Aquaculture, 2003, 219(1): 671-679. |
| [30] |
王星泽. 饵料及温度对四种海洋贝类肠道微生物的影响[D]. 厦门: 厦门大学, 2020. WANG Xinze. Effects of diet and temperature-induced variations on the gut microbiota of four types of marine mollusk[D]. Xiamen: Xiamen University, 2020. |
| [31] |
董波, 薛钦昭, 李军. 环境因子对菲律宾蛤仔摄食生理生态的影响[J]. 海洋与湖沼, 2000, 31(6): 636-642. DONG Bo, XUE Qinzhao, LI Jun. Environmental factors affecting the effding physiological ecology of manila clam, Ruditapes philippinarum (Adams etreeve, 1850)[J]. Oceanologia et Limnologia Sinica, 2000, 31(6): 636-642. DOI:10.3321/j.issn:0029-814X.2000.06.008 |
| [32] |
王芳, 董双林, 王涛, 等. 菲律宾蛤仔呼吸和排泄规律的研究[J]. 海洋科学, 1998, 22(2): 1-3. WANG Fang, DONG Shuanglin, WANG Tao, et al. Study on the regularity of respiration and excretion of manila clam Ruditapes philippinarum[J]. Marine Sciences, 1998, 22(2): 1-3. |
| [33] |
BAYNE B L, HAWKINS A, NAVARRO E. Feeding and digestion by the mussel Mytilus edulis L. (Bivalvia: Mollusca) in mixtures of silt and algal cells at low concentrations[J]. Journal of Experimental Marine Biology & Ecology, 1987, 111(1): 1-22. |
| [34] |
PETERSON C H. Enhancement of Mercenaria mercenaria densities in seagrass beds: is pattern fixed during settlement season or altered by subsequent differential survival?[J]. Limnology & Oceanography, 1986, 31(1): 200-205. |
| [35] |
CURTIN T P, VOLKENBORN N, DWYER I P, et al. Buffering muds with bivalve shell significantly increases the settlement, growth, survival, and burrowing of the early life stages of the Northern quahog, Mercenaria mercenaria, and other calcifying invertebrates[J]. Estuarine, Coastal and Shelf Science, 2022, 264: 107686. DOI:10.1016/j.ecss.2021.107686 |
 2023, Vol. 47
2023, Vol. 47


