
文章信息
- 李金泽, 胡志, 王晓龙, 李永仁, 郭永军, 张涛. 2023.
- LI Jin-ze, HU Zhi, WANG Xiao-long, LI Yong-ren, GUO Yong-jun, ZHANG Tao. 2023.
- 中国蛤蜊Mactra chinensis Philippi稚贝运动行为学初步研究
- Preliminary study on the behavior of Mactra chinensis Philippi
- 海洋科学, 47(12): 63-68
- Marine Sciences, 47(12): 63-68.
- http://dx.doi.org/10.11759/hykx20230406001
-
文章历史
- 收稿日期:2023-04-06
- 修回日期:2023-04-20
2. 中国科学院海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071;
3. 山东省海洋科学研究院, 山东 青岛 266104
2. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Shandong Academy of Marine Sciences, Qingdao 266104, China
中国蛤蜊Mactra chinensis Philippi俗称飞蛤、黄蛤、黄蚬子, 隶属于瓣鳃纲(Lamelibranchia)、帘蛤目(Veneroida)、蛤蜊科(Veneridae)、蛤蜊属(Mactra), 广泛分布于我国黄渤海潮间带中下区的细砂滩至水深60 m的浅海区, 是我国北方重要的经济贝类[1]。中国蛤蜊肉质鲜美, 营养丰富, 具有很高的经济价值, 在浅海滩涂养殖和人工增养殖方面具有极大的发展潜力[2]。
近些年来沈永忱等[3]和闫喜武等[4]先后进行了中国蛤蜊诱导产卵、胚胎发育和人工繁育相关研究; 王海涛等[5]和Zhang等[6]研究了不同底质对中国蛤蜊稚贝生长的影响。目前影响中国蛤蜊滩涂养殖的主要问题在于养殖过程中存在“跑滩”现象, 即大量中国蛤蜊在短时间内由一个区域迁移到较远的另一区域[7]。王海涛等[8]曾采取插网阻拦的方法防止中国蛤蜊跑滩, 但效果并不理想。与其他埋栖型贝类相比, 中国蛤蜊运动能力较强, 因此目前对中国蛤蜊跑滩问题缺乏有效的解决方法。此外, 中国蛤蜊养殖地点一般位于潮间带, 受昼夜潮汐影响, 滩涂底质存在干露现象, 这种环境变化也会对中国蛤蜊行为产生影响。中国蛤蜊跑滩现象的发生原因除了其本身运动能力强外, 还可能与其底质、干露等环境条件有关。因此, 本文探讨了规格、水温、水流、底质、干露对中国蛤蜊稚贝运动行为的影响, 以期从行为学角度查明中国蛤蜊的跑滩现象。
1 材料与方法 1.1 实验材料中国蛤蜊取自通过人工育苗后得到的稚贝, 运输到山东省长渔水产有限公司。量取壳长分别为3 mm、5 mm、10 mm、15 mm的中国蛤蜊各500枚, 分别放置于圆柱形玻璃钢水槽(直径1.0 m, 高0.8 m)中暂养, 暂养期间投喂适量新鲜的金藻和小球藻, 每天投喂3次, 饵料密度为6×104个/mL。筛选粒径分别为0.408±0.127 mm、0.699±0.139 mm和1.571±0.359 mm的海沙, 用海水冲洗干净, 备用。
1.2 实验设计 1.2.1 中国蛤蜊跳跃行为研究在装有25 ℃新鲜海水的有刻度的烧杯中放入壳长分别为3 mm、5 mm、10 mm和15 mm的中国蛤蜊各50枚, 利用手机录像和利用格尺与目视观察统计1 h内各规格中国蛤蜊的跳跃次数和跳跃高度, 每个规格实验重复3次。
设置3个温度梯度, 分别为15 ℃, 20 ℃和25 ℃, 以壳长为10 mm的中国蛤蜊作为实验对象, 利用手机录像和利用格尺与目视观察统计1 h内中国蛤蜊的跳跃次数和跳跃高度, 每个温度梯度设置3个重复实验。
1.2.2 中国蛤蜊潜沙行为研究在养殖水槽(30 cm×40 cm×25 cm)底部分别铺入3种粒径的干净海沙, 粒径分别为细沙0.408±0.127 mm、中沙0.699±0.139 mm和粗沙1.571±0.359 mm。厚度均为3 cm, 注入新鲜海水(25 ℃, 盐度30), 每种规格海沙区域各均匀放入20枚壳长为10 mm的中国蛤蜊。置于静水条件下1 h, 在此期间每隔10 min统计一次中国蛤蜊的潜沙比例, 实验重复3次。
在方形托盘(35 cm×25 cm×3.5 cm)中盛满粒径为0.408±0.127 mm的海沙, 小心放置于跑道式环形水槽中, 每个托盘放入20枚壳长为10 mm的中国蛤蜊, 利用造浪泵施加水流, 流速梯度设置为0 m/s、0.05 m/s、0.10 m/s、0.15 m/s、0.20 m/s和0.25 m/s, 观察中国蛤蜊运动状态并进行数量统计。每个流速梯度设置3个重复实验。
1.2.3 周期性干露对中国蛤蜊行为影响研究在方形托盘(35 cm×25 cm×3.5 cm)中盛入粒径为0.408±0.127 mm的海沙, 厚度3.0 cm, 取20枚壳长为10~15 mm的中国蛤蜊, 放入托盘。移入水中静置放置6 h后, 将托盘轻轻取出, 排去表层海水, 放置于25 ℃空气中进行干露处理, 记录24 h内中国蛤蜊稚贝从沙中钻出的比例, 观察中国蛤蜊潜沙的行为变化, 记录中国蛤蜊从沙中爬出的数量和比例。干露结束后, 重新将托盘放入水中, 设置共5个干露-淹没时间组, 第一组干露5 min, 淹没24 h; 第二组干露6 h, 淹没18 h; 第三组干露12 h, 淹没12 h; 第四组干露18 h, 淹没6 h; 第五组干露24 h, 淹没5 min; 每个组3个重复实验, 记录中国蛤蜊的漂浮比例。
1.2.4 数据分析采用Excel 2010和SPSS 19.0软件进行数据统计分析和作图, 对数据进行正态分布和方差齐次性检验, 然后进行单因素方差分析(ANOVA), 当P<0.05时为差异显著。
2 实验结果 2.1 规格对中国蛤蜊跳跃行为的影响中国蛤蜊的运动能力与其个体大小密切相关。当其壳长为3 mm时, 其运动形式仅为依靠斧状足爬行, 不具备跳跃能力。当中国蛤蜊壳长达到5 mm时, 可以利用斧状足的伸缩和摆动在水中跳跃一段距离。壳长为10 mm的中国蛤蜊个体跳跃频率和跳跃高度均显著高于壳长为5 mm和15 mm的个体(P<0.05)(图 1)。
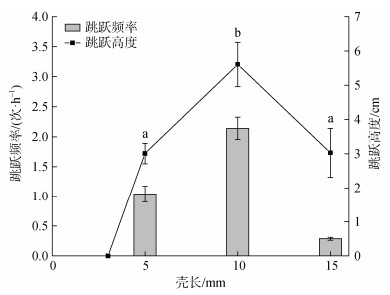 |
| 图 1 不同规格中国蛤蜊的跳跃行为 Fig. 1 Jumping behavior of M. chinensis with different specifications 注: 数值以均值±标准误表示, 不同字母表示各个阶段之间存在显著性差异, P<0.05 |
中国蛤蜊的跳跃行为明显受到水温的影响。在一定温度范围内, 中国蛤蜊的跳跃频率和高度随水温的升高呈上升趋势(图 2)。当水温为25 ℃时, 其跳跃频率和高度均显著高于15 ℃和20 ℃(P<0.05)。而水温为15 ℃和20 ℃时, 中国蛤蜊跳跃高度没有显著差异(P > 0.05)。
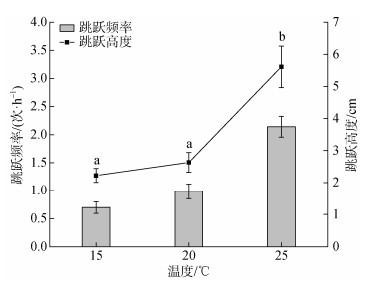 |
| 图 2 温度对中国蛤蜊跳跃行为的影响 Fig. 2 Effect of temperature on the jumping behavior of M. chinensis 注: 数值以均值±标准误表示, 不同字母表示各个阶段之间存在显著性差异, P<0.05 |
静水条件下, 中国蛤蜊在不同粒径的沙质环境中表现出不同的潜沙行为(图 3)。3种粒径的沙质环境中, 中国蛤蜊潜沙比例均随时间推移而逐渐上升, 并于60 min后趋于稳定。各时间节点细沙底质的潜沙比例均最高, 中沙底质次之, 粗砂底质最低。第60 min时, 中国蛤蜊在细沙底质的潜沙比例为67.5%, 显著高于中沙底质的51.22%和粗沙底质的30.05% (P<0.05)。
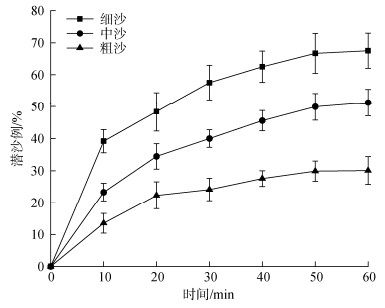 |
| 图 3 静水条件下中国蛤蜊的潜沙比例随时间的变化 Fig. 3 Variation in the submerged sand ratio of M. chinensis with time under static water conditions |
在细沙底质环境中, 施加不同速度的水流5 min后, 中国蛤蜊的潜沙比例存在显著差异(P<0.05)(图 4)。相对于静水条件, 施加微弱水流后, 中国蛤蜊的潜沙速度和比例明显增加。水流流速为0.15 m·s–1时, 潜沙比例达到最大, 96%的中国蛤蜊个体在5 min内潜入沙中。当水流进一步增大时, 部分中国蛤蜊无法在水流中保持稳定而被水流冲走, 潜沙比例随之下降。水流为0.25 m·s–1时, 仅有22.00%的个体留在原处并完成潜沙。
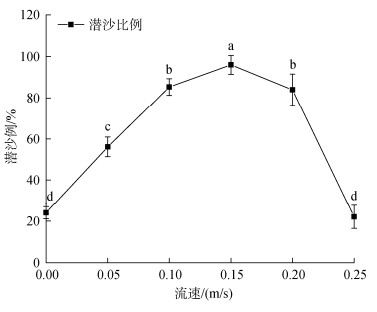 |
| 图 4 不同流速水流对中国蛤蜊潜沙的影响 Fig. 4 Effect of water flow at different velocities on the burrowing of M. chinensis 注: 数值以均值±标准误表示, 不同字母表示各个阶段之间存在显著性差异, P<0.05 |
实验结果表明, 排去上层海水1~2 h后, 已潜入沙中的中国蛤蜊借助斧状足的力量陆续从沙中钻出, 钻出的比例随时间不断增加。干露12~14 h后, 所有中国蛤蜊均从沙中钻出, 暴露在空气中(图 5)。将不同干露时间的中国蛤蜊重新放置于海水中, 部分中国蛤蜊在水面漂浮一段再下落至水底(图 6)。漂浮比例随干露时间的增加而增加, 干露6 h时, 入水后28.75%的个体漂浮于水面, 显著低于干露18 h和24 h的漂浮比例(P<0.05)。
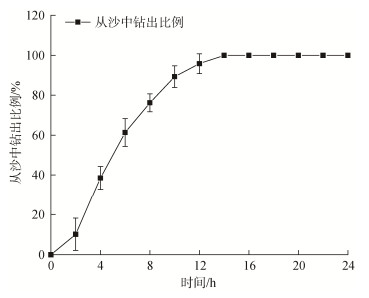 |
| 图 5 已潜沙中国蛤蜊从沙中钻出比例随干露时间的变化 Fig. 5 Variation in the proportion of M. chinensis drilled out of the sand with air exposure time |
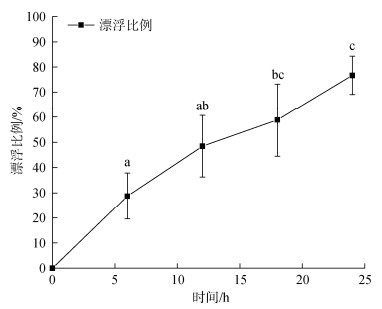 |
| 图 6 不同时间干露后再入水中国蛤蜊漂浮比例变化 Fig. 6 Changes in the floating proportion of M. chinensis re-entering the water after drying at different times 注: 数值以均值±标准误表示, 不同字母表示各个阶段之间存在显著性差异, P<0.05 |
通过实验观察发现, 中国蛤蜊因为其具有较为粗壮有力的足, 运动能力较强。中国蛤蜊稚贝生长3 mm左右时, 其运动方式是依靠足的攀附和伸缩进行爬行。当其壳长达到5 mm以上时, 可以依靠足部的力量弹跳起来, 随后再依靠足的摆动在水中运动一段距离。中国蛤蜊壳长10 mm左右其跳跃频率最高, 然而在到达壳长15 mm左右时, 其跳跃频率大幅度下降, 可能是随着稚贝生长, 其体重不断增加导致其跳跃频率降低。
中国蛤蜊运动能力受温度的影响较为明显。本研究表明, 中国蛤蜊在25 ℃时运动能力最强, 其运动能力随水温降低而降低, 这可能是由于温度影响中国蛤蜊的耗氧量、呼吸率等, 进而影响中国蛤蜊个体的代谢水平和活力[9]。由于贝类属变温动物, 温度对双壳贝类耗氧量和呼吸能量损失有显著影响, 是影响贝类呼吸率和代谢的主要因素之一[10]。双壳贝类代谢率通常随着温度的增加而增加[11], 在超过最大或最佳温度极限时, 代谢率会迅速降低[12]。在13~23 ℃下, 中国蛤蜊耗氧率随温度升高而升高, 当温度升高至28 ℃时, 其代谢率迅速下降[13], 中国蛤蜊的跳跃变化趋势与耗氧量数据变化趋势相同。
长期以来, 中国蛤蜊的“跑滩”特性是阻碍其大规模养殖的关键症结之一。发生这种现象的原因除了其本身存在跳跃现象外, 还可能与其潜沙深度浅、周期性干露以及干露后再入水后漂浮等有关[7]。之前研究结果表明, 中国蛤蜊的潜沙深度和其他双壳贝类一样会受到底质粒径大小和水流速度的影响[14-15], 有的学者认为有些贝类可能形成了对由不同流速带来的掩埋其沙层厚度的改变的行为适应[16-17]。从本研究结果来看, 中国蛤蜊潜沙能力受到底质环境的影响, 底质为细沙的时候潜沙比例最大, 导致这一现象可能是因为中国蛤蜊稚贝斧状足较小, 沙子对中国蛤蜊稚贝潜沙过程产生的阻力大小与其粒径成正相关, 从而产生生物能量学限制[18-20], 因此会出现底质粒径大实验组的中国蛤蜊稚贝潜沙比例低。本研究发现, 适当的水流速度和细沙底质有利于中国蛤蜊稚贝潜沙。中国蛤蜊在细沙和水流速度为0.15 m·s–1时稚贝潜沙比例达到最大, 而当底质粒径较大, 或水流速度过快或者过缓时, 都会影响中国蛤蜊稚贝的潜沙比例。在流速过快时, 中国蛤蜊稚贝容易被水流冲走, 无法完成潜沙。而在中国蛤蜊受到干露影响时, 也会从沙中钻出, 经过干露影响再入水后, 部分稚贝会在水面漂浮一段时间, 在此时间内漂浮的稚贝也容易随水流运动。
综上所述, 中国蛤蜊的“跑滩”行为可能不仅与其自身运动能力强有关, 底质粒径大小、周期性干露后稚贝从底质中爬出以及干露后的稚贝可以在水面上漂浮等因素都可能导致中国蛤蜊跑滩。
| [1] |
张玺, 齐钟彦 . 贝类学纲要[M]. 北京: 科学出版社, 1961. ZHANG Xi, QI Zhongyan. Outline of shellfish science[M]. Beijing: Science Press, 1961. |
| [2] |
齐钟彦, 马绣同, 王祯瑞, 等 . 中国经济软体动物[M]. 北京: 中国农业出版社, 1998. QI Zhongyan, MA Xiutong, WANG Zhenrui, et al. Chinese economic molluscs[M]. Beijing: China Agriculture Press, 1998. |
| [3] |
沈永忱, 郑宝太, 刘吉明, 等. 中国蛤蜊的诱导产卵和胚胎发育观察[J]. 水产科技情报, 2004(6): 265-266. SHEN Yongchen, ZHENG Baotai, LIU Jiming, et al. Observation on induced spawning and embryonic development of Mactra chinensis Philippi[J]. Aquatic Science and Technology Intelligence, 2004(6): 265-266. DOI:10.3969/j.issn.1001-1994.2004.06.008 |
| [4] |
闫喜武, 王琦, 赵越, 等. 中国蛤蜊人工育苗技术的初步研究[J]. 大连水产学院学报, 2010, 25(1): 41-44. YAN Xiwu, WANG Qi, ZHAO Yue, et al. Preliminary study on artificial breeding techniques for Mactra chinensis Philippi[J]. Journal of Dalian Ocean University, 2010, 25(1): 41-44. DOI:10.3969/j.issn.1000-9957.2010.01.008 |
| [5] |
王海涛, 王世党, 童伟, 等. 中国蛤蜊室内人工育苗技术研究[J]. 科学养鱼, 2011(8): 39-40. WANG Haitao, WANG Shidang, TONG Wei, et al. Research on indoor artificial breeding techniques for Mactra chinensis Philippi[J]. Scientific Fish Culture, 2011(8): 39-40. |
| [6] |
ZHANG X K, LI Z, HUO Z M, et al. Effect of substrate component on the growth and survival of juvenile sunray surf clam (Mactra chinensis Philippi)[J]. Journal of Ocean University of China, 2016, 15(4): 676-680. DOI:10.1007/s11802-016-2957-1 |
| [7] |
王子臣, 刘吉明, 朱岸, 等. 鸭绿江口中国蛤蜊生物学初步研究[J]. 水产学报, 1984(1): 33-44. WANG Zichen, LIU Jiming, ZHU An, et al. Preliminary study on the biology of Mactra chinensis Philippi at the Yalu River mouth[J]. Journal of Fisheries, 1984(1): 33-44. |
| [8] |
王海涛, 王世党, 王浩, 等. 中国蛤蜊生态养殖技术[J]. 科学养鱼, 2013(1): 45-46. WANG Haitao, WANG Shidang, WANG Hao, et al. Ecological aquaculture technology for Mactra chinensis Philippi[J]. Scientific Fish Culture, 2013(1): 45-46. |
| [9] |
王尚洪, 欧阳珊, 高建华, 等. 许氏帆蚌耗氧率和排氨率研究[J]. 海洋科学, 2005, 29(8): 39-43. WANG Shanghong, OUYANG Shan, GAO Jianhua, et al. Study on oxygen consumption and ammonia excretion rate of Hyriopsis schlegerii[J]. Marine Sciences, 2005, 29(8): 39-43. |
| [10] |
XIAO B C, LI E C, DU Z Y, et al. Effects of temperature and salinity on metabolic rate of the Asiatic clam Corbicula fluminea (Müller, 1774)[J]. Springer Plus, 2014, 3(1): 455. DOI:10.1186/2193-1801-3-455 |
| [11] |
TAWARE S S, LAGADE V M, MULEY D V. Oxygen consumption rate of the estuarine Psammobiid clam Soletellina diphos (linnaeus) under various environmental conditions[J]. Indian Journal of Marine Sciences, 2012, 41(5): 468-472. |
| [12] |
林小涛, 钟金香, 颉晓勇, 等. 温度对翡翠贻贝能量收支的影响[J]. 海洋科学, 2002, 26(4): 13-16. LIN Xiaotao, ZHONG Jinxiang, JIE Xiaoyong, et al. The effect of temperature on the energy budget of Perna viridis[J]. Marine Sciences, 2002, 26(4): 13-16. |
| [13] |
王雅倩, 赵文, 程芳晋, 等. 体重和温度对中国蛤蜊耗氧率和排氨率的影响[J]. 大连水产学院学报, 2009, 24(6): 544-548. WANG Yaqian, ZHAO Wen, CHENG Fangjin, et al. Effects of body weight and temperature on oxygen consumption and ammonia excretion rate of Mactra chinensis Philippi[J]. Journal of Dalian Ocean University, 2009, 24(6): 544-548. |
| [14] |
HUNT H L. Transport of juvenile clams: effects of species and sediment grain size[J]. Journal of Experimental Marine Biology and Ecology, 2004, 312(2): 271-284. |
| [15] |
ST-ONGE P, MIRON G. Effects of current speed, shell length and type of sediment on the erosion and transport of juvenile softshell clams (Mya arenaria)[J]. Journal of Experimental Marine Biology and Ecology, 2007, 349(1): 12-26. |
| [16] |
高悦勉, 孙洋, 孙培海, 等. 北寄贝的生物学和增养殖[J]. 水产科学, 2006, 25(7): 371-375. GAO Yuemian, SUN Yang, SUN Peihai, et al. Biology and aquaculture of Pseudocardium sachalinense[J]. Aquatic Science, 2006, 25(7): 371-375. |
| [17] |
ROEGNER C, ANDRÉC, LINDEGARTH M, et al. Transport of recently settled soft-shell clams (Mya arenaria L.) in laboratory flume flow[J]. Journal of Experimental Marine Biology and Ecology, 1995, 187(1): 13-26. |
| [18] |
CHECA A G, CADÉE G C. Hydraulic burrowing in the bivalve Mya arenaria Linnaeus (Myoidea) and associated ligamental adaptations[J]. Journal of Molluscan Studies, 1997, 63(2): 157-171. |
| [19] |
DORGAN K M. The biomechanics of burrowing and boring[J]. Journal of Experimental Biology, 2015, 218(2): 176-183. |
| [20] |
ST-ONGE P, MIRON G, MOREAU G. Burrowing behaviour of the softshell clam (Mya arenaria) following erosion and transport[J]. Journal of Experimental Marine Biology and Ecology, 2007, 340(1): 103-111. |
 2023, Vol. 47
2023, Vol. 47


