文章信息
- 顾瑞婷, 徐少春, 岳世栋, 许帅, 张玉, 张晓梅, 周毅. 2023.
- GU Rui-ting, XU Shao-chun, YUE Shi-dong, XU Shuai, ZHANG Yu, ZHANG Xiao-mei, ZHOU Yi. 2023.
- 中国辽宁-浙江沿海地区川蔓草分布现状、生态特征及其主要威胁
- Distribution, ecological features, and threats to Ruppia populations between Liaoning and Zhejiang, China
- 海洋科学, 47(12): 69-79
- Marine Sciences, 47(12): 69-79.
- http://dx.doi.org/10.11759/hykx20220915001
-
文章历史
- 收稿日期:2022-09-15
- 修回日期:2022-11-23
2. 中国科学院海洋研究所, 海洋生态与环境科学重点实验室, 山东 青岛 266071;
3. 青岛海洋国家实验室, 海洋生态与环境科学功能实验室, 山东 青岛 266237;
4. 中国科学院大学, 北京 100049;
5. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
6. 中国科学院海洋牧场工程实验室, 山东 青岛 266071;
7. 山东省实验海洋生物学重点实验室, 山东 青岛 266071
2. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
6. CAS Engineering Laboratory for Marine Ranching, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
7. Shandong Province Key Laboratory of Experimental Marine Biology, Qingdao 266071, China
海草是一种在全球温带和热带沿海地区广泛分布的沉水性维管植物[1]。海草床与红树林、珊瑚礁并称为三大重要近海生态系统[2]。作为重要的栖息地建立者和生态系统“工程师”, 海草床为众多海洋生物提供了食物来源与生存、产卵、孵化和育幼场所[3-6]。海草的地上部分可以减少波浪和潮汐对海岸线的侵蚀作用, 地下部分可以固着底质, 从而能护堤减灾[7]。虽然海草床的分布面积只占海洋面积的约1%, 但其沉积物中封存的碳约占埋藏于海洋中总碳量的10%~18%, 是全球生态系统中重要的碳汇[8-10]。此外, 近岸海草床的生态服务功能还包括降低该生态系统中人类、鱼类和无脊椎动物和病原体的接触风险等[11]。
川蔓草(Ruppia), 曾名川蔓藻, 隶属于单子叶植物纲, 泽泻亚纲(Alismatidae), 川蔓草属(Ruppiaceae)[12-13]。作为高等被子植物, 它具有完整的根茎叶系统, 其叶片呈带状, 细长且柔软, 地下茎水平生长, 茎间生有环状排列的根[14]。与其他海草相比, 川蔓草具更强的环境适应能力, 生长的水深范围为0.5~4.5 m, 盐度范围为0~230[4], 是一种广泛分布于热带和温带滨海、瀉湖、盐沼等浅水水域中的沉水被子植物[15-17]。与其他海草一样, 川蔓草是这些水域生态系统中的重要组成成分和初级生产力[18], 它不仅可以为水禽提供食物[19]、为鱼类提供产卵和孵化栖息地[20], 还能改善生长区域水体和底质环境质量[21-22]。
中国20世纪80年代至2016年川蔓草(藻)的分布资料显示: 中国浙江以北9个省市(含青海、宁夏2个内陆省份)川蔓草分布站点共23个, 包括吉林省长岭县, 辽宁省大连市普兰店区、旅顺口区, 青海省青海湖, 宁夏回族自治区银川市, 天津市塘沽区、滨海新区, 山东省东营市、烟台市、青岛市、滨州市, 江苏省连云港市、盐城市, 上海市崇明岛, 浙江省慈溪市、舟山市、温州市[23-31]。其中青海与宁夏虽有川蔓草分布的文献记录, 但于硕[23]在2009年对该记录进行重访调查时未发现文献中记录站点中川蔓草生长的迹象, 故认为这两处内陆川蔓草分布站点已经退化。通过分析历史文献中川蔓草的分布地点类型, 总结发现中国温带地区川蔓草广泛分布于咸水和半咸水区域, 其中咸水景观河道、咸水池塘、盐场、咸水养殖池中最为常见。
尽管前期已有许多关于中国川蔓草分布现状的调查研究, 但现有研究调查范围较小, 或调查时间较早, 尚缺乏大范围的川蔓草分布现状报道。因此, 我们于2016—2019年对中国辽宁至浙江沿海地区川蔓草分布状态进行了实地调查, 根据调查结果总结了调查区域内川蔓草分布特点, 分析了影响其分布的主要因素。
1 调查方法根据前期文献资料, 本研究于2016年6月—2019年9月期间, 对辽宁、河北、天津、山东、江苏、上海、浙江七个沿海省市有川蔓草分布记录的站点进行重访调查, 了解有历史记录的川蔓草草床的分布现状。在重访过程中, 通过咨询当地人士、生境识别等手段, 对调查区域内适宜川蔓草生长的生境进行实地勘查。最终, 我们记录所调查的川蔓草分布点GPS坐标、生境类型, 估测站点川蔓草分布面积, 并通过arcGIS软件将文献中的川蔓草历史分布站点和本次调查中有川蔓草分布的站点结果进行汇总。
由于前期物种命名不规范以及重复命名, 导致川蔓草分类系统十分混乱, 世界范围内新的川蔓草物种不断被发现[23, 32-35]。Yu和den Hartog[36]对中国境内的川蔓草进行了大范围调查, 通过比对遗传信息和形态学特征, 将中国境内分布的川蔓草进行了重新定种, 分别为短柄川蔓草(R. brevipedunculata)与中国川蔓草(R. sinensis)[13, 36]。中国分布的这两种川蔓草茎、叶形态相似, 但花序轴长度差异明显, 其中R. sinensis的花序轴较长(14~108 mm), 常呈螺旋状, 而R. brevipedunculata的花序轴较短, 为1~7 mm (图 1)[23, 36]。本次调查过程中, 依靠两种川蔓草上述形态学差异进行简单的种类鉴别。
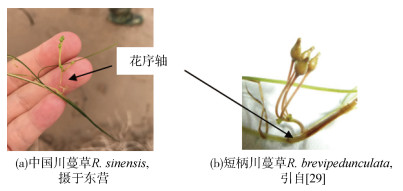 |
| 图 1 中国两种川蔓草形态 Fig. 1 Morphologies of Ruppia distributed in China |
本研究于2016至2019年调查了浙江以北7个沿海省及直辖市, 调查站点32处, 共发现有川蔓草分布的站点22处, 川蔓草退化站点10处。其中江苏省盐城市及连云港临洪河口两处在调查时生境水体干涸, 但由于其沉积物表面发现了大量川蔓草种子, 故认为该处有川蔓草分布。其余20处川蔓草分布点的植株经形态学辨别, 均被鉴定为中国川蔓草(R. sinensis)。本次调查中咸水养殖池、盐场咸水池(排水沟)、景观湿地(河道)、咸水湖泊及海边均有川蔓草分布, 分布面积超过2 100 ha, 其中咸水养殖池是调查区域中川蔓草最常见的生境类型(表 1)。
| 省份 | 市、区 | 具体分布位置 | 经度/E | 纬度/N | 生境类型 | 分布面积/ha |
| 辽宁省 | ||||||
| 营口市 | 盖州市 | 122°17′53.00″ | 40°28′1.00″ | 咸水养殖池 | 100 | |
| 山东省 | ||||||
| 东营市 | 黄河口保护区 | 119°12′53.00″ | 37°43′24.00″ | 咸水湖泊 | 800 | |
| 大汶流 | 118°58′13.03″ | 37°45′55.83″ | 沟渠 | 0.12 | ||
| 刁口乡1 | 118°36′33.00″ | 37°59′52.00″ | 咸水池塘 | 0.5 | ||
| 刁口乡2 | 118°34′3.89″ | 38° 2′31.62″ | 咸水排水池 | 0.3 | ||
| 市郊区 | 117°39′50.00″ | 38°57′47.00″ | 咸水养殖池 | 2 | ||
| 威海市 | 逍遥湾 | 122°19′47.00″ | 37°24′16.00″ | 人工景观湿地 | 2 | |
| 南海新区 | 122°0′0.04″ | 36°59′10.00″ | 沟渠 | — | ||
| 烟台市 | 莱州市 | 119°40′38.00″ | 37°9′15.00″ | 咸水养殖池 | 100 | |
| 龙口市 | 120°19′35.79″ | 37°41′14.43″ | 港口边咸水塘 | 0.05 | ||
| 潍坊市 | 寿光市 | 119°13′51.55″ | 37°10′7.72″ | 潮间带(围堰) | 146 | |
| 寒亭区 | 119°10′58.82″ | 37°9′57.25″ | 咸水养殖池 | — | ||
| 滨州市 | 沾化区 | 118°6′42.91″ | 38°8′20.50″ | 咸水养殖池 | 300 | |
| 河北省 | ||||||
| 唐山市 | 乐亭县 | 118°58′44.25″ | 39°10′53.65″ | 沟渠 | 100 | |
| 秦皇岛 | 119°33′36.00″ | 39°54′18.00″ | 池塘 | 45 | ||
| 天津市 | ||||||
| 大港区 | 117°32′25.00″ | 38°38′41.00″ | 咸水养殖池 | 466 | ||
| 江苏省 | ||||||
| 连云港 | 临洪河口 | 119°12′31.00″ | 34°44′59.00″ | 湿地 | 25 | |
| 台北盐场 | 119°12′49.00″ | 34°41′19.00″ | 废弃盐场 | 0.03 | ||
| 台南盐场 | 119°26′41.00″ | 34°39′31.00″ | 废弃盐场 | 0.02 | ||
| 盐城 | 射阳县 | 120°45′40.00″ | 33°27′0.30″ | 咸水蓄水池 | 25 | |
| 浙江省 | ||||||
| 舟山市 | 朱家尖岛 | 122°20′47.00″ | 29°56′50.00″ | 咸水养殖池 | 10 | |
| 注: “—”代表分布面积数据缺失 | ||||||
咸水养殖池是川蔓草最常见的分布生境, 该类生境中川蔓草分布面积较大, 且大多生长茂密。其中, 位于山东省滨州市沾化县养虾池内发现了面积约300 ha的川蔓草床(盐度40~50); 天津市大港区的对虾养殖区(盐度30)中发现了非常大量的川蔓草生长, 面积约466 ha。通过调研得知, 该地区川蔓草种子约在每年7—8月成熟(图 2a)。
 |
| 图 2 咸水养殖区的川蔓草床 Fig. 2 Ruppia beds in marine culture ponds |
对该类川蔓草分布站点进行重访时发现, 其种群的退化大多与人为活动相关。例如文献中曾记载江苏省盐城市射阳县旺阳水产公司养殖池内有大量川蔓草分布。但本次调查时该公司内大部分海水养殖池已改为淡水养殖池, 而新的养殖池内未发现有川蔓草分布迹象。该公司养殖池外的临海一号水库附近的沉积物中发现有川蔓草种子, 表明这里曾有川蔓草分布。位于浙江省慈溪市的川蔓草分布站点也已由海水养殖池变为了淡水养殖池(盐度约为2), 该生境中曾广泛分布的川蔓草已被适应淡水生长的眼子菜替代。位于浙江省舟山市普陀区朱家尖岛的海水养殖池中虽发现有大量川蔓草生长(盐度为28~32), 但是, 调研过程中当地养殖户表示会于春季至夏初对养殖池中的川蔓草进行打捞清理并施以除草剂杀灭(3—4月), 以此消除池中附生丝状绿藻暴发对养殖对象的潜在危害。此外, 养殖模式的变化也将导致川蔓草种群的退化, 例如位于浙江省舟山桃花岛内的海水养殖池塘由以前的土塘粗养模式发展为高位池精养模式, 新的养殖模式不再适合川蔓草生长, 且养殖户为抑制池塘中植被生长, 也会定期向池内施以除草剂, 以上改变导致了该地原有川蔓草的消失。
2.2.2 盐场川蔓草分布及其消失原因川蔓草大多可发现于废弃盐场中。对于运行中的盐场, 工作人员多通过人为抽调卤水, 或暴晒等方式使盐场中的晒盐池及附近沟壑水体中盐度过高(> 70), 不适宜川蔓草生长, 故在这类盐场中几乎无川蔓草生长迹象。例如位于天津市塘沽的盐场及浙江舟山市朱家尖的盐场(图 3a)。随着产业结构的调整, 一部分有川蔓草分布记录的盐场现已废弃, 其中部分废弃盐场的咸水沟壑能发现川蔓草分布, 如连云港的台南和台北盐场(盐度为1~18, 图 3b和c); 另一部分盐场如浙江省温州市苍南盐场, 废弃后大部分区域已完全干涸成为海产品晾晒场, 且附近咸水沟壑严重污染, 水体浑浊度高, 已无川蔓草生长(图 3d)。
 |
| 图 3 盐场中分布的川蔓草种群 Fig. 3 Ruppia beds in saltpans |
据文献记载, 天津市滨海新区景观河道中曾有大量川蔓草生长, 但本次调查发现该区域受人类活动影响, 川蔓草种群退化严重。例如由于水利、道桥工程建设, 原有川蔓草生长区水体面积大量萎缩、水体盐度大幅降低, 已不再适宜川蔓草生长(图 4a)。据文献中记载, 青岛市城阳区某盐场中有川蔓草分布, 但重访调查发现该盐场区域已改建为城镇居民区, 无川蔓草踪迹, 其附近的盐场旧址已改为湿地公园, 其中的水体为淡水, 只有眼子菜类生长(图 4b)。山东省东营市黄河三角洲保护区中的瀉湖和威海市逍遥湾附近的湿地公园中均发现了大量的川蔓草(图 4c和d)。然而, 该类型生境仍受严重人为干扰, 例如, 逍遥湾湿地公园川蔓草在8月生长达到峰值, 湖中川蔓草植株密度极高, 但因为有大量丝状藻附着生长, 严重影响景观整体美观, 公园管理人员在该时段会对湖中川蔓草进行打捞清除, 以维持公园景观(图 4d)。
 |
| 图 4 景观河道和瀉湖中的川蔓草分布站点 Fig. 4 Ruppia beds in lagoons and lakes |
咸水沟渠区分布的川蔓草往往受人类活动影响较小, 但受环境变化的影响较大。例如东营市大汶流乡的川蔓草分布于一条约120 ha的沟渠中, 当长时间不降雨, 该处生境将完全干涸, 生境中的川蔓草植株因干涸而死, 种群完全退化; 而当环境持续大量降雨时, 生境将重新覆水, 沉积物中川蔓草种子苏醒萌发, 种群得以恢复(图 5)。
 |
| 图 5 山东省东营市大汶流乡附近川蔓草分布的沟渠 Fig. 5 Ruppia beds in a brackish water ditch in Dongying, Shandong Province |
本次调查还在北方地区第一次发现了川蔓草在潮间带分布的案例。在山东省潍坊市的潮间带(围堰)发现了川蔓草与日本鳗草(Zostera japonica)混生海草床。通过调研了解发现, 该海草分布区曾为开放海域, 后当地为发展旅游业, 对该区域进行了人工围填, 形成了约3 000 ha的潮间带围堰海域(与外海连通), 其中现存混生海草床面积约为146 ha, 水体盐度为29~33 (图 6)。
 |
| 图 6 山东省潍坊市寿光市的川蔓草与日本鳗草混生海草床 Fig. 6 Mixed seagrass beds (Ruppia and Zostera japonica) in Shouguang, Weifang, Shandong Province |
川蔓草广泛分布于咸水与半咸水生境中, 属于广义上的海草[24]。本次调查结果显示, 中国辽宁-浙江沿海地区川蔓草分布生境类型包括咸水养殖池塘、咸水沟渠(池塘)、盐场、瀉湖(湖泊)、潮间带(围堰)5类, 其中咸水养殖池(塘)是该区域川蔓草主要生境类型。以上川蔓草分布的生境类型多呈封闭状态, 蓄水能力较弱, 生境中水体盐度常随气象条件(如高温、降雨)发生较大变化。例如位于山东省威海市逍遥湾附近湿地公园中川蔓草生长的湖泊水体盐度范围为1~20, 而整个调查区域内川蔓草分布生境的盐度变化范围可达1~51。结合Yu和den Hartog[36]中的调查结果, 可以认为广泛分布于调查区域的中国川蔓草可以耐受的盐度范围为可达50, 与其他的川蔓草物种如R. megacarpa (可耐受的盐度区间为5~46), R. polycarpa (可耐受的盐度区间为2~66)相似[4, 36]。
同时, 调查区域内的川蔓草的分布呈现范围广、分布站点零散的特点。分布区域生境受人类活动与气候影响极大。例如, 养殖池塘中的川蔓草会因养殖户定期的清理而减少, 沟壑和小型湖泊等生境覆水量随季节和气候变化呈现周期性干涸与丰水, 导致川蔓草种群周期性繁盛与衰退。以上特征导致川蔓草分布点调查与分布面积的评估十分困难。
3.2 中国辽宁-浙江沿海地区川蔓草生活史策略川蔓草具有有性繁殖与无性繁殖两种生殖策略, 以及一年生(annual)和多年生(perennial)两种不同的生活史策略[17, 37-38]。两种生活史策略的川蔓草种群中均包含有性繁殖和无性繁殖过程, 但不同的生活史策略种群的生殖策略的侧重不同。多年生川蔓草种群植株全年存在, 主要依靠无性克隆增殖和营养生长维持种群规模[38]。一年生川蔓草种群的生长周期一般短于一年, 当生长环境及气候条件不利于其生长时, 川蔓草种群退化甚至消失, 待条件适宜后再依靠沉积物种子库恢复种群密度[38]。
本次调查发现, 黄河三角洲是中国辽宁-浙江沿海川蔓草分布最广的地区, 分布面积超过800 ha, 且主要分布物种为R. sinensis(中国川蔓草)[36, 39-40]。现有调查结果显示, 该地区分布的R. sinensis种群具有一年生和多年生两种不同的生活史策略[41]。其中该地区一年生R. sinensis种群生活史与R. maritima生活史相似, 共分为种子期、苗期、营养生长成体期和生殖生长成体期四种生命阶段, 具体表现为: 2月时种子萌发并长至幼苗; 3—4月时R. sinensis幼苗继续营养生长至营养生长成体期, 此时植株密度相对较低, 在此期间R. sinensis植株开始进行无性繁殖, 且叶片上有大量的附生藻附着; 5月时种群内R. sinensis植株密度和生物量开始上升, 分别达到4月植株密度的10倍、生物量的30倍, 且种群中出现花苞和未成熟的种子, 种群开始进行有性繁殖; 6—8月时种群有性繁殖进入高峰期, 在此期间有大量的种子生成[42-43]。
3.3 中国辽宁-浙江沿海地区川蔓草种群补充机制有性繁殖被认为是川蔓草种群在受干扰较大的环境中进行自然种群补充的主要方式, 即通过开花、结种的方式进行种群增殖[17]。该繁殖方式虽然会消耗较多的能量成本, 但能够保证草床中海草具有较高的基因多样性, 对外界干扰具有较强的抵抗力和恢复力[44]。沉积物中的海草种子库大小决定着海草种群应对不利干扰的抗逆力与恢复力。不同川蔓草种群的种子库大小具有一定差异, 如南非Kleinemonde Estuary的R. cirrhosa种子库中种子平均数量为(2 852±327) 颗/m2[38], 美国Everglades-Florida Bay种子库密度为150~25 398颗/m2[45]。调查季节的不同与种群生活史策略的差异都会造成种子库中种子数量的差异。例如, 美国Everglades-Florida Bay繁殖季节R. maritima种子库可以达到25 398颗/m2, 而在非繁殖季节其沉积物中的种子数量可能为150~1 783颗/m2[45]; 一年生R. cirrhosa种群种子库中的种子数量明显多于附近多年生R. cirrhosa种群[46]。
本研究调查区域内的R. sinensis种子成熟过程也与R. maritima相似, 具体表现为: 6月时大量的种子已经生成了坚硬的内果皮和绿色的外果皮, 8月时种群中的种子大多已经褪去外果皮, 露出坚硬的黑色内果皮。10月时种子库中种子数量达到顶峰, 种子密度可达113 470.2 ± 28 015.4颗/m2[17, 43, 47]。每年3—5月为该地区R. sinensis种子的萌发季节, 此时的种子主要富集在次表层沉积物处(5~10 cm); 而过冬种子库(10—12月)中, 65%的中国川蔓草种子主要富集于沉积物10~15 cm处[43]。
3.4 川蔓草种群面临的主要威胁中国辽宁-浙江沿海地区的川蔓草种群面临的主要威胁可以分为人类活动与极端气候影响两类。人类影响是导致中国温带地区川蔓草种群退化最主要的原因, 具体威胁有: 生境水域污染, 人工清除, 城镇建设、围填海、盐场废弃改建、海水养殖区设施化改造等导致的生境破坏。中国北方地区川蔓草植株生长环境中的营养盐往往十分充足, 在其生长旺盛期, 植株生长密度较高, 遮挡水体中光线的同时, 为绿藻提供了附着基础, 促进绿藻大量繁殖, 使得水体变混浊, 不再利于生境中其他生物生长, 且影响环境美观。因此, 大量养殖户或湿地公园管理者会通过打捞或施以除草剂的方式对其进行清理, 导致其生物量迅速降低, 川蔓草床逐渐退化。
虽然季节性生境干涸在一年生川蔓草种群中较为常见, 随着生境上覆水重新出现, 沉积物中的种子开始萌发, 种群新的生命周期开始[43]。R. cirrhosa经历生境干涸后, 恢复的种群在下一个生长周期中生物量和种子产量较有稳定上覆水的种群显著升高[48]。但当生境连续干涸超过3个月, 川蔓草种群将受到显著影响[43]。2017—2018年黄河三角洲经历了极端干燥天气事件使得该地区R. sinensis一年生种群持续5个月处于干涸状态。根据当地天气数据显示2018年入春以来, 该地区虽出现过少量降水, 川蔓草床也曾多次出现短暂积水, 种子库中的种子随之迅速萌发。但新长出的R. sinensis幼苗会因再次的干燥暴露而死。该过程不仅无法恢复R. sinensis种群, 还会消耗该地区种群沉积物中的种子库[43]。但种子库中种子密度 > 3 000颗/m2时, 该种群仍能在环境条件适宜时得到迅速地恢复[45]。
3.5 川蔓草的生态学价值与其他海草一样, 川蔓草具有丰富的生态学价值。海水养殖池是川蔓草在中国辽宁-浙江地区分布的最主要生境之一, 其中的养殖生物包括海参及虾[49-51]。包海岩等[50]对中国北方地区盐田中的南美白对虾养殖系统进行研究后提出: 川蔓草的稳定生长有助于改善养殖水体的富营养状况; 增加水体中硅藻和无脊椎动物生物量, 为虾类提供饵料; 减缓养殖水体因水浅而出现的日夜温度骤变过程; 为体型较小的南美白对虾提供躲避天敌的场所; 并能通过自身光合作用过程增加养殖环境溶氧量, 利于环境中养殖个体生长。川蔓草耐盐的特性以及极强的环境适应能力使得其可以作为理想的景观河道及公园的绿化植物, 改善水质。王卫红等[14]通过室内实验发现在适宜种植密度下, 川蔓草对再生水体中总氮和总磷的去除率分别可达43.01%, 94.06%, 起到减轻水体富营养化的功效。同时, 川蔓草还可以作为指示生物表征生长环境中微量重金属含量变化, 例如黄河三角洲地区R. sinensis生长环境和植物样本中Cu和Cd浓度从高至低分别为沉积物、植物地上组织、植物地下组织、上覆水[52]。通过监测川蔓草地上部分重金属富集程度可以间接评估该地区环境中重金属浓度, 提高监测精度。同时, R. sinensis对必需金属元素Cu和非必须金属Cd具有极强的耐受能力, 其明显的形态毒性效应仅发生在Cu 50 μmol/L和Cd 500 μmol/L浓度时, 这使其也可作为生物修复种对受到污染的生境中重金属进行吸收清除[49]。
3.6 川蔓草床的管理建议本次调查的川蔓草分布现状及调研结果显示, 中国浙江-辽宁沿海地区有数量可观的川蔓草分布。虽然人类活动影响与气候条件改变都会导致川蔓草床退化, 但大部分川蔓草床可以依靠沉积物中的种子库在环境适宜时进行种群恢复。因此, 我们针对不同生境中川蔓草提出差异化的管理建议:
1) 对于海水养殖池中的川蔓草, 建议对川蔓草进行分阶段式管理: 养殖前期, 让川蔓草充分生长, 以降低养殖环境中水体的氮、磷含量; 待川蔓草生长至夏季旺盛期(6—7月), 进行人工割草、捞草, 适度减少川蔓草的数量, 使水体中的营养物质含量维持于适宜状态, 并为养殖生物保留足够的生存空间; 当川蔓草生长进入衰败期(9—10月), 增加对养殖环境中川蔓草的捞除量, 防止由于川蔓草植株腐烂导致的养殖水体质量下降; 保留少量的川蔓草床植株用于生产种子, 成熟后种子落入底泥中, 来年生成新的川蔓草种群。
2) 对于景观河道及湿地公园等区域, 应尽量减少对川蔓草种群的人为干扰, 充分施展川蔓草种群的生态功能。
3) 根据川蔓草种子产量大, 川蔓草植株对水体盐度耐受范围广的特点, 利用种子移植法, 将川蔓草引入富营养水体中进行水体净化修复, 如海水养殖尾水净化工程。
4 结论本研究通过实地调查的方式, 在中国辽宁-浙江沿海地区发现有川蔓草广泛分布。并根据调查结果总结川蔓草的主要分布生境类型包括: 咸水养殖池、咸水沟渠、咸水池塘、瀉湖、潮间带5类。人类活动的干扰是导致其种群退化的最主要原因, 但其强大的有性繁殖能力使得该物种具有强大的种群恢复能力, 因此该物种尚不需要进行保护性修复。目前, 川蔓草不同地理种群的物候差异以及对不同环境因子的耐受能力尚缺乏深入对比研究, 如何实现对川蔓草种群的科学管理, 充分实现川蔓草的生态价值是未来的研究方向。
| [1] |
SHORT F, CARRUTHERS T, DENNISON W, et al. Global seagrass distribution and diversity: A bioregional model[J]. Journal of Experimental Marine Biology and Ecology, 2007, 350(1/2): 3-20. |
| [2] |
NAGELKERKEN I, VAN DER VELDE G, GORISSEN M W, et al. Importance of mangroves, seagrass beds and the shallow coral reef as a nursery for important coral reef fishes, using a visual census technique[J]. Estuarine Coastal and Shelf Science, 2000, 51(1): 31-44. DOI:10.1006/ecss.2000.0617 |
| [3] |
COSTANZA R, DARGE R, DEGROOT R, et al. The value of the world's ecosystem services and natural capital[J]. Nature, 1997, 387: 253-260. DOI:10.1038/387253a0 |
| [4] |
BROCK M A. Biology of the salinity tolerant genus Ruppia L in saline lakes in south Australia: 2 population ecology and reproductive biology[J]. Aquatic Botany, 1982, 13: 249-268. DOI:10.1016/0304-3770(82)90063-8 |
| [5] |
LIU W G, LI X Z, AN Z S, et al. Total organic carbon isotopes: A novel proxy of lake level from Lake Qinghai in the Qinghai-Tibet Plateau, China[J]. Chemical Geology, 2013, 347: 153-160. DOI:10.1016/j.chemgeo.2013.04.009 |
| [6] |
TAYLOR M D, FRY B, BECKER A, et al. Recruitment and connectivity influence the role of seagrass as a penaeid nursery habitat in a wave dominated estuary[J]. Science of the Total Environment, 2017, 584/585: 622-630. DOI:10.1016/j.scitotenv.2017.01.087 |
| [7] |
FONSECA M S, CAHALAN J A. A preliminary evaluation of wave attenuation by four species of seagrass[J]. Estuarine, Coastal and Shelf Science, 1992, 35(6): 565-576. DOI:10.1016/S0272-7714(05)80039-3 |
| [8] |
MCLEOD E, CHMURA G L, BOUILLON S, et al. A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2[J]. Frontiers in Ecology and the Environment, 2011, 9(10): 552-560. DOI:10.1890/110004 |
| [9] |
DUARTE C M, LOSADA I J, HENDRIKS I E, et al. The role of coastal plant communities for climate change mitigation and adaptation[J]. Nature Climate Change, 2013, 3: 961-968. DOI:10.1038/nclimate1970 |
| [10] |
FOURQUREAN J W, DUARTE C M, KENNEDY H, et al. Seagrass ecosystems as a globally significant carbon stock[J]. Nature Geoscience, 2012, 5: 505-509. DOI:10.1038/ngeo1477 |
| [11] |
LAMB J B, WATER J A J M V D, BOURNE D G, et al. Seagrass ecosystems reduce exposure to bacterial pathogens of humans, fishes, and invertebrates[J]. Science, 2017, 355(6326): 731-733. DOI:10.1126/science.aal1956 |
| [12] |
ANDERSON W R. An integrated system of classification of flowering plants[J]. Brittonia, 1982, 34(2): 268-270. DOI:10.2307/2806386 |
| [13] |
黄小平, 江志坚, 张景平, 等. 全球海草的中文命名[J]. 海洋学报, 2018, 40(4): 127-133. HUANG Xiaoping, JIANG Zhijian, ZHANG Jingping, et al. The Chinese nomenclature of the global seagrass[J]. Haiyang Xuebao, 2018, 40(4): 127-133. DOI:10.3969/j.issn.0253-4193.2018.04.012 |
| [14] |
王卫红, 季民. 沉水植物川蔓藻的生态学特征及其对环境变化的响应[J]. 植物学报, 2006, 23(1): 98-107. WANG Weihong, JI Min. Ecological characteristics of submerged macrophyte Ruppia maritima and its response to environmental changes[J]. Chinese Bulletin of Botany, 2006, 23(1): 98-107. |
| [15] |
VERHOEVEN J T A. The ecology of Ruppia-dominated communities in Western-Europe: distribution of Ruppia representatives in relation to their autecology[J]. Aquatic Botany, 1979, 6: 197-268. DOI:10.1016/0304-3770(79)90064-0 |
| [16] |
MANNINO A M, MENENDEZ M, OBRADOR B, et al. The genus Ruppia L. (Ruppiaceae) in the Mediterranean region: An overview[J]. Aquatic Botany, 2015, 124: 1-9. DOI:10.1016/j.aquabot.2015.02.005 |
| [17] |
STRAZISAR T, KOCH M S, FRANKOVICH T A, et al. The importance of recurrent reproductive events for Ruppia maritima seed bank viability in a highly variable estuary[J]. Aquatic Botany, 2016, 134: 103-112. DOI:10.1016/j.aquabot.2016.07.005 |
| [18] |
KANTRUD H A. Wigeongrass (Ruppia maritima L. ): a literature review[R]. Washington: U S Fish and Wildlife Service, 1991.
|
| [19] |
TRIEST L, SIERENS T. Reprint of "Is the genetic structure of Mediterranean Ruppia shaped by bird-mediated dispersal or sea currents?"[J]. Aquatic Botany, 2014, 115: 45-53. DOI:10.1016/j.aquabot.2014.02.004 |
| [20] |
HUMPHRIES P, POTTER I C, LONERAGAN N R. The fish community in the shallows of a temperate Australian estuary-relationships with the aquatic macrophyte Ruppia megacarpa and environmental variables[J]. Estuarine Coastal and Shelf Science, 1992, 34(4): 325-346. DOI:10.1016/S0272-7714(05)80074-5 |
| [21] |
付春平, 唐运平, 张志扬, 等. 沉水植物对景观河道水体氮磷去除的研究[J]. 农业环境科学学报, 2005(S1): 114-117. FU Chunping, TANG Yunping, ZHANG Zhiyang, et al. Nitrogen and phosphorus removal capacity of submerged plant, Ruppia maritime and Potamogeton pecinatus in TEDA landscape river[J]. Journal of Agro-Environment Science, 2005(S1): 114-117. |
| [22] |
PULICH W M. Seasonal Growth Dynamics of Ruppia maritima L Sl and Halodule wrightii aschers in southern Texas and evaluation of sediment fertility status[J]. Aquatic Botany, 1985, 23: 53-66. DOI:10.1016/0304-3770(85)90020-8 |
| [23] |
于硕. 中国沿海川蔓藻(Ruppia)的分布及其影响因素[D]. 上海: 华东师范大学, 2010. YU Shuo. Distribution of Ruppia species along China coastline and the influencing factors[D]. Shanghai: East China Normal University, 2010. |
| [24] |
李敏, 周大庆, 夏欣, 等. 吉林省自然植被就地保护现状及保护空缺分析[J]. 生态与农村环境学报, 2014, 30(3): 289-293. LI Min, ZHOU Daqing, XIA Xin, et al. Status quo of in situ conservation and protection gaps for natural vegetation in Jilin province, China[J]. Journal of Ecology and Rural Environment, 2014, 30(3): 289-293. DOI:10.3969/j.issn.1673-4831.2014.03.003 |
| [25] |
陈耀东. 青海湖眼子菜科植物的研究[J]. 水生生物学报, 1987, 11(3): 228-237. CHEN Yaodong. Studies on the Potamogetonaceae in Qinghai Lake[J]. Acta Hydrobiologica Sinica, 1987, 11(3): 228-237. |
| [26] |
李炳玺, 谢应忠, 赖声渭, 等. 银川平原湿地维管植物区系研究[J]. 农业科学研究, 2005, 26(4): 33-36. LI Bingxi, XIE Yingzhong, LAI Shengwei, et al. Study on flora of wetland vascular plants in Yinchuan Plain[J]. Journal of Agricultural Sciences, 2005, 26(4): 33-36. |
| [27] |
关代宇, 贾海瀛. 天津泰达再生水景观水体构建技术及工程示范[J]. 中国给水排水, 2013, 29(3): 33-37. GUAN Daiyu, JIA Haiying. Construction technology and project demonstration of reclaimed landscape water body in TEDA[J]. China Water & Wastewater, 2013, 29(3): 33-37. DOI:10.3969/j.issn.1000-4602.2013.03.009 |
| [28] |
刘云龙, 张学雷, 曲凌云. 基于matK和ITS基因序列探索山东东营一种海草的系统发育进化地位. "一带一路"战略与海洋科技创新——中国海洋学会2015年学术论文集[C]. 北京: 海洋出版社, 2015. LIU Yunlong, ZHANG Xuelei, QU Lingyun. Investigation on the phylogenetic and evolutionary status of a seagrass species in Dongying, Shandong province based on matK and ITS gene sequences. "The Belt and Road" Strategy and Marine Science and Technology Innovation: Chinese Society for Oceanology[C]. Beijing: China Ocean Press, 2015. |
| [29] |
李峰, 谢永宏, 陈心胜, 等. 黄河三角洲湿地水生植物组成及生态位[J]. 生态学报, 2009, 29(11): 6257-6265. LI Feng, XIE Yonghong, CHEN Xinsheng, et al. Composition of aquatic plants and their niche characteristics in wetlands of the Yellow River Delta[J]. Acta Ecologica Sinica, 2009, 29(11): 6257-6265. DOI:10.3321/j.issn:1000-0933.2009.11.061 |
| [30] |
李玉玺, 段代祥. 滨州市水生园林植物资源调查及其应用现状[J]. 安徽农业科学, 2008, 37(22): 10774-10775. LI Yuxi, DUAN Daixiang. Resources investigation and status of landscape uses of aquatic plant in Binzhou waterscape[J]. Journal of Anhui Agriculture Science, 2008, 37(22): 10774-10775. |
| [31] |
王金旺, 邹颖颖, 魏馨. 温州水生维管束植物分布新纪录[J]. 温州大学学报(自然科学版), 2016, 37(4): 40-45. WANG Jinwang ZOU Yingying, WEI Xin. New records of aquatic vascular plant in Wenzhou[J]. Journal of Wenzhou University (Natural Science), 2016, 37(4): 40-45. |
| [32] |
赵良成, 吴志毅. 川蔓藻属系统分类和演化评述[J]. 植物分类学报, 2008, 46(6): 467-478. ZHAO Liangcheng, WU Zhiyi. A review on the taxonomy and evolution of Ruppia[J]. Journal of Systematics and Evolution, 2008, 46(6): 467-478. |
| [33] |
BICKFORD D, LOHMAN D J, SODHI N S, et al. Cryptic species as a window on diversity and conservation[J]. Trends in Ecology & Evolution, 2007, 22(3): 148-155. |
| [34] |
DEN HARTOG C, VAN TUSSENBROEK B I, WONG J G R, et al. A new Ruppia from Mexico: Ruppia mexicana n. sp[J]. Aquatic Botany, 2016, 131: 38-44. DOI:10.1016/j.aquabot.2016.02.005 |
| [35] |
ITO Y, OHI-TOMA T, TANAKA N, et al. Phylogeny of Ruppia (Ruppiaceae) revisited: molecular and morphological evidence for a new species from western Cape, South Africa[J]. Systematic Botany, 2016, 40(4): 942-949. DOI:10.1600/036364415X689988 |
| [36] |
YU S, DEN HARTOG C. Taxonomy of the genus Ruppia in China[J]. Aquatic Botany, 2014, 119: 66-72. DOI:10.1016/j.aquabot.2014.08.003 |
| [37] |
RIDDIN T, ADAMS J B. The seed banks of two temporarily open/closed estuaries in South Africa[J]. Aquatic Botany, 2009, 90: 328-332. DOI:10.1016/j.aquabot.2008.12.003 |
| [38] |
MALEA P, KEVREKIDIS T, MOGIAS A. Annual versus perennial growth cycle in Ruppia maritima L. : temporal variation in population characteristics in Mediterranean lagoons (Monolimni and Drana Lagoons, Northern Aegean Sea)[J]. Botanica Marina, 2004, 47(5): 357-366. |
| [39] |
韩美, 张晓惠, 刘丽云. 黄河三角洲湿地研究进展[J]. 生态与环境, 2006, 15: 872-875. HAN Mei, ZHANG Xiaohui, LIU Liyun. Research progress on wetland of the Yellow River Delta[J]. Ecology and Environment, 2006, 15: 872-875. |
| [40] |
张晓惠. 黄河三角洲湿地生态服务功能价值评估[D]. 济南: 山东师范大学, 2007. ZHANG Xiaohui. Evaluation on the value of wetland ecosystem services in Yellow River Delta[D]. Jinan: Shandong Normal University, 2007. |
| [41] |
GU R T, SONG X Y, ZHOU Y, et al. Relationships between annual and perennial seagrass (Ruppia sinensis) populations and their sediment geochemical characteristics in the Yellow River Delta[J]. Frontiers in Plant Science, 2021, 12: 634199. |
| [42] |
STRAZISAR T, KOCH M S, MADDEN C J. Seagrass (Ruppia maritima L.) life history transitions in response to salinity dynamics along the Everglades-Florida bay ecotone[J]. Estuaries and Coasts, 2015, 38: 337-352. |
| [43] |
GU R T, SONG X Y, ZHOU Y, et al. In situ investigation of the influence of desiccation on sediment seed banks and population recruitment of the seagrass Ruppia sinensis in the Yellow River Delta, China[J]. Marine Pollution Bulletin, 2019, 149: 1-8. |
| [44] |
EHLERS A, WORM B, REUSCH T B H. Importance of genetic diversity in eelgrass Zostera marina for its resilience to global warming[J]. Marine Ecology Progress Series, 2008, 355: 1-7. |
| [45] |
STRAZISAR T, KOCH M S, DUTRA E, et al. Ruppia maritima L. seed bank viability at the Everglades-Florida Bay ecotone[J]. Aquatic Botany, 2013, 111: 26-34. |
| [46] |
MANNINO A M, GRAZIANO M. Differences in the growth cycle of Ruppia cirrhosa (Petagna) Grande in a Mediterranean shallow system[J]. Plant Biosystems, 2016, 150(1): 54-61. |
| [47] |
GU R T, ZHOU Y, SONG X Y, et al. Tolerance of Ruppia sinensis seeds to desiccation, low temperature, and high salinity with special reference to long-term seed storage[J]. Frontiers in Plant Science, 2018, 9: 1-13. |
| [48] |
VROMANS D C, ADAMS J B, RIDDIN T. The phenology of Ruppia cirrhosa (Petagna) Grande and Chara sp in a small temporarily open/closed estuary, South Africa[J]. Aquatic Botany, 2013, 110: 1-5. |
| [49] |
孙爱丽. 海参养殖池塘中几种大型藻类的危害及其防治措施[J]. 水产养殖, 2014, 35(5): 28-29. SUN Aili. Damage and control measures of several macroalgae in sea cucumber culture pond[J]. Journal of Aquaculture, 2014, 35(5): 28-29. |
| [50] |
包海岩, 邵蓬, 张勤, 等. 北方地区盐田生态养殖技术[J]. 河北渔业, 2012(9): 13-17. BAO Haiyan, SHAO Peng, ZHANG Qin, et al. Ecological aquaculture technology in salt pans in northern China[J]. Hebei Yuye, 2012(9): 13-17. |
| [51] |
朱庆亮, 徐高峰, 田杞承, 等. 移植川蔓藻净化育苗用海水的试验研究[J]. 中国水产, 2002(2): 59-60. ZHU Qingliang, XU Gaofeng, TIAN Qicheng, et al. Research on transplanting Ruppia to clear aqucultural seawater[J]. China Fisheries, 2002(2): 59-60. |
| [52] |
GU R T, LIN H Y, ZHOU Y, et al. Programmed responses of different life-stages of the seagrass Ruppia sinensis to copper and cadmium exposure[J]. Journal of Hazardous Materials, 2021, 403: 1-12. |
 2023, Vol. 47
2023, Vol. 47


