文章信息
- 王静, 臧帆, 秦松. 2023.
- WANG Jing, ZANG Fan, QIN Song. 2023.
- 螺旋藻藻蓝蛋白对酒精性肝损伤大鼠肠道菌群的影响
- Effect of Spirulina phycocyanin on intestinal flora of rats with alcoholic liver injury
- 海洋科学, 47(12): 93-101
- Marine Sciences, 47(12): 93-101.
- http://dx.doi.org/10.11759/hykx20221028001
-
文章历史
- 收稿日期:2022-10-28
- 修回日期:2023-05-05
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003
2. Yantai Institute of Coastal Zone Research Chinese Academy of Scences, Yantai 264003, China
酒精性肝病(alcoholic liver disease, ALD)是由于持续过度性饮酒而导致的疾病, 最终可发展为终末期肝病[1, 2]。酒精性肝损伤是由于酒精对肠-肝轴的间接影响, 以及酒精通过其代谢产物乙醛对肠道的直接影响。这两种作用都通过激活肝巨噬细胞上的Toll样受体(Toll-like receptors, TLR)4, 导致肝细胞和巨噬细胞坏死凋亡, 继而产生氧化应激和活性氧, 最后导致细胞因子的级联反应。肝细胞、巨噬细胞和星状细胞之间的相互作用以及炎症信号引起的肝微循环中一氧化氮的变化导致胶原沉积和门脉高压症肝纤维化[3-6]。据报道, 各种肝脏疾病, 如酒精性肝病(ALD)、非酒精性肝病(non alcoholic liver disease, NAFLD)都与肠道菌群的平衡紊乱有关[7-9]。因此, 肠道菌群的稳态在一定程度上能够影响酒精性肝损伤的进程。
螺旋藻藻蓝蛋白(phycocyanin, PC)是一种天然蛋白质。据报道, 藻蓝蛋白具有多种生物活性, 如抗氧化、抗炎、抗血管生成等[10]。近年来, 已有研究证明PC具有抗肝损伤、保护肝脏的作用[10-12]。Xia等人[13]使用30%乙醇灌胃雌性KM小鼠诱导ALD, 研究了PC的预防作用。模型组血清谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)水平分别比对照组升高113.6%和96.72%。与酒精肝小鼠相比, 不同剂量的PC可以降低ALT和AST水平。PC还可以通过提高机体免疫力来抑制酒精诱导的亚急性肝细胞损伤。与模型相比, PC可以显著提高血清中CD3+T和CD4+T细胞的活性, 并提高T细胞的增殖率。PC干预后, 肝损伤小鼠T细胞增殖及CD3+和CD4+T细胞均有不同程度的增加[14]。此外, PC易提取纯化, 可大量生产[15], 且没有细胞毒性[16]。因此, PC可能是一种改善酒精性肝损伤的潜在物质。
1 材料与方法 1.1 实验材料和动物螺旋藻藻蓝蛋白(Amax/A280=3.0), 购自新大泽螺旋藻有限公司(中国福清)。HE染色试剂盒和Masson三色染色试剂盒, 购自北京索莱宝科技有限公司。水飞蓟素, 购自上海麦克林生化科技有限公司。大鼠饲料, 购自济南朋悦动物繁育中心。
于济南朋悦实验动物繁育中心购进雄性80只8周龄SPF级SD大鼠, 大鼠自由饮食, 适应性培养1周。
1.2 实验方法 1.2.1 动物模型建立将大鼠分为对照组(Con组)、模型(Mo组)、藻蓝蛋白组(PC组)、阳性对照组(Pos组), 每组20只。Mo组以10 mL/kg/d 25%酒精进行灌胃。每周对大鼠称重一次, 以调整酒精剂量。Con组以相等容量的饮用水灌胃。PC组藻蓝蛋白剂量设置为200 mg/kg。Pos组水飞蓟素剂量设置为100 mg/kg。大鼠灌胃PC和水飞蓟素2 h后进行酒精的灌胃。干预3个月结束后, 将大鼠处死, 收集对应的样品。
1.2.2 大鼠肝脏组织的HE和Masson染色使用HE染色和Masson染色试剂盒对大鼠肝脏石蜡切片进行染色。
1.2.3 肠道菌群的高通量测序和序列数据分析在干预的最后一天收集大鼠粪便, 将大鼠抓起, 用无菌的冻存管收集大鼠排出的粪便(粪便量需要大于150 mg), 放入液氮中速冻后, 置于−80 ℃冰箱进行保存。参考翟诗翔等[17]的肠道菌群的高通量测序方法对大鼠粪便进行采集和测序。从大鼠粪便样本中分离细菌基因组DNA, 采用TransStart Fastpfu DNA聚合酶反应体系在V3-V4可变区内使用特异性引物338F和806R进行PCR扩增(ABI GeneAmp® 9700型PCR仪)(表 1)。通过2%的琼脂糖凝胶电泳检测PCR产物并进行回收(AXYGEN公司)。使用DNA样品制备试剂盒(Illumina公司)构建MiSeq文库, 并根据测序流程利用Illumina MiSeq测序平台进行测序。通过美吉生物云平台(https://cloud.majorbio.com)进行生物信息学分析。
| 测序区域 | 引物名称 | 引物序列 |
| V3-V4可变区 | 338F | ACTCCTACGGGAGGCAGCAG |
| 806R | GGACTACHVGGGTWTCTAAT |
对原始序列进行质量过滤, 并使用Qiime平台的默认参数根据其条形码将其分配给样品, 使用Usearch软件平台提取优化序列的非重复序列, 取出不重复的单个序列。在97%的相似性下, 对非重复序列进行OTU聚类。通过Alpha多样性分析, 反应肠道菌群的丰富度和多样性, 包括sobs、shannon统计学分析指数。使用R语言PCoA统计分析和作图软件进行UniFrac PCoA分析, 基于所选距离矩阵进行作图, 分析不同组之间的差异。之后进行组间显著性差异检验, 根据得到的群落丰度数据, 对不同组微生物群落之间的物种进行假设检验, 评估物种丰度差异的显著性水平。
2 实验结果 2.1 大鼠肝脏病理分析HE染色(图 1)和Masson染色(图 2)结果显示, 与Con组相比, Mo组大鼠肝小叶结构模糊, 肝细胞排列紊乱, 细胞肿胀, 出现空泡型变性和炎性细胞浸润。大鼠服用PC后, 肝细胞和肝小叶结构均较完整。但是, 与Mo组相比, 水飞蓟素治疗的Pos组部分肝小叶结构较模糊, 肝细胞排列较紊乱, 中心区域周围肝细胞肿胀, 偶见炎细胞浸润。
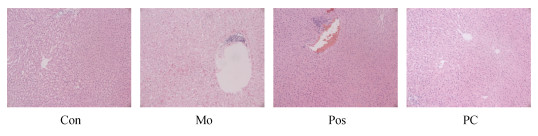 |
| 图 1 各组大鼠肝脏组织HE染色(40×) Fig. 1 HE staining of rat liver tissue in each group (40×) 注: Con, 对照组; Mo, 模型组; Pos, 阳性对照组; PC, 藻蓝蛋白组 |
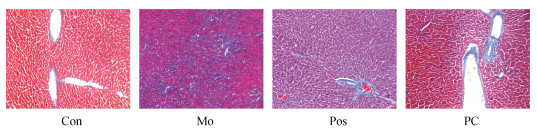 |
| 图 2 各组大鼠肝脏组织Masson染色(100×) Fig. 2 Masson staining of rat liver tissue in each group (100×) 注: Con, 对照组; Mo, 模型组; Pos, 阳性对照组; PC, 藻蓝蛋白组 |
由此可见, PC能够抑制肝损伤程度, 延缓肝纤维化, 推测PC对酒精性肝脏组织具有一定的保护作用。
2.2 肠道菌群基础质控分析本研究共完成77个样本的多样性数据分析, 共获得优化序列4 188 905, 1 739 427 606 bases, 平均序列长度为415 bp。Alpha多样性分析反应了肠道菌群的丰富度和多样性。如图 3所示, 本研究稀释曲线趋近平缓, 大鼠粪便样本菌群数量检测比率接近饱和。大鼠肠道菌群稀释曲线反映了大鼠在灌胃酒精后, 与Con组相比, Mo组肠道菌群丰富度和多样性下降, 而大鼠口服PC后肠道菌群丰富度和多样性增加, 而水飞蓟素治疗的Pos组丰富度和多样性结果较PC组高。
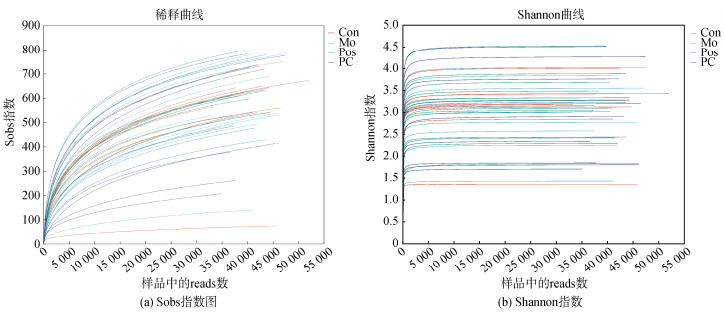 |
| 图 3 藻蓝蛋白干预对肠道菌群组成的影响 Fig. 3 Effect of phycocyanin intervention on gut flora composition |
通过基于weighted-unifrac距离的主坐标分析(principal co-ordinates analysis, PCoA)分析研究各组大鼠肠道菌群的差异。如图 4所示, 各组样本沿主纵坐标轴形成明显的微生物种类聚集, Mo组大鼠粪便中的菌群类型主要分布在Con组的右下侧, 口服PC后, 大鼠肠道菌群差异向Con组和Mo组左侧偏移, 说明酒精和PC干预后都能影响大鼠肠道菌群。PC组肠道菌群分布与Pos组部分重叠, 推测口服PC后, 大鼠肠道菌群分布得到改善。
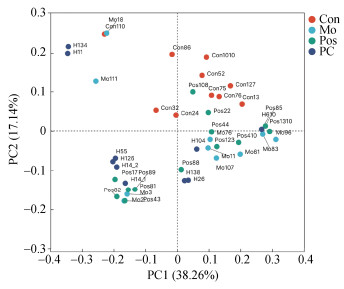 |
| 图 4 非加权unifrac主坐标分析 Fig. 4 Unweighted unifrac principal coordinate analysis 注: 横轴和纵轴表示两个选定的主坐标轴, 百分比表示主坐标轴对样本组成差异的解释度值; 不同颜色或形状的点代表不同分组的样本, 两样本点越接近, 表明两样本物种组成越相似 |
对97%相似度的OUTs进行分类, 如图 5所示, Con组、Mo组、Pos组、PC组共有为1 426个OTU, 其中Con组有1 152个, Mo组有1 229个, Pos组有1 253个, PC组有1 245个, 这些组共有的OTUs有967个。Con组独有18个, Mo组独有8个, Pos组独有3个, PC组独有31个。结果表明, 酒精诱导后大鼠肠道菌群的物种数降低, 在口服PC后其物种数增加。
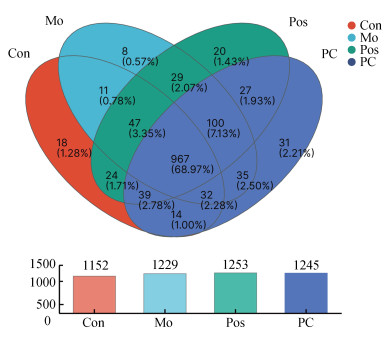 |
| 图 5 大鼠粪便肠道菌群的Veen图 Fig. 5 Veen diagram of fecal intestinal flora in rats 注: Con, 对照组; Mo, 模型组; Pos, 阳性对照组; PC, 藻蓝蛋白组。其中不同的颜色代表不同的分组(或样本), 重叠部分的数字代表多个分组中共有的物种数目, 非重叠部分的数字代表对应分组所特有的物种数目 |
为了研究PC对大鼠肠道菌群结构的影响, 对各组的大鼠肠道菌群进行组间差异显著性检验分析。
在门分类水平上, 如图 6a所示, 根据各组菌门的丰度比例, 优势菌门为拟杆菌门(Firmicutes)和放线菌门(Actinobacteriota)。与Con组相比, Mo组、Pos组和PC组显著增加了Firmicutes的丰度。而与Mo组相比, PC干预后, 降低了Firmicutes的丰度。对于Actinobacteriota, 结果则与Firmicutes截然不同, Mo组、Pos组和PC组降低了该菌群的丰度, PC干预后, 增加了该菌群的丰度(图 6b)。
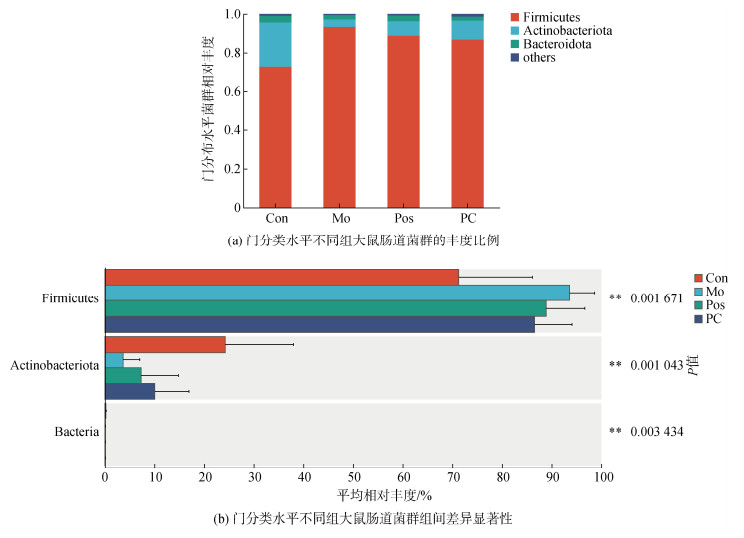 |
| 图 6 藻蓝蛋白干预在门分类水平上对肠道菌群丰度的影响 Fig. 6 Effect of phycocyanin intervention on gut flora abundance at the phylum classification level 注: 纵轴表示某一分类学水平下的物种名, 横轴表示物种不同分组中平均相对丰度, 不同颜色的柱子表示不同分组; 最右边为P值, P≤0.05时具有统计学意义。0.01<*P≤0.05, 0.001<**P≤0.01, *** P≤0.001 |
在科分类水平上, 如图 7a所示, 根据各组菌科的丰度比例, 优势菌科为Lactobacillaceae、消化链球菌科(Peptostreptococcaceae), 丹毒丝菌科(Erysipelotrichaceae), 梭菌科(Clostridiaceae)和Bifidobacteriaceae。Lactobacillaceae和Erysipelotrichaceae的丰度组间无显著性差异。与Con组相比, Mo组、Pos组和PC组增加了Peptostreptococcaceae和Clostridiaceae的丰度, 而PC组与Mo组相比, PC干预后增加了该两种菌科的丰度。与Con组相比, 酒精干预后Bifidobacteriaceae的相对丰度降低, 加入PC后丰度增加(图 7b)。
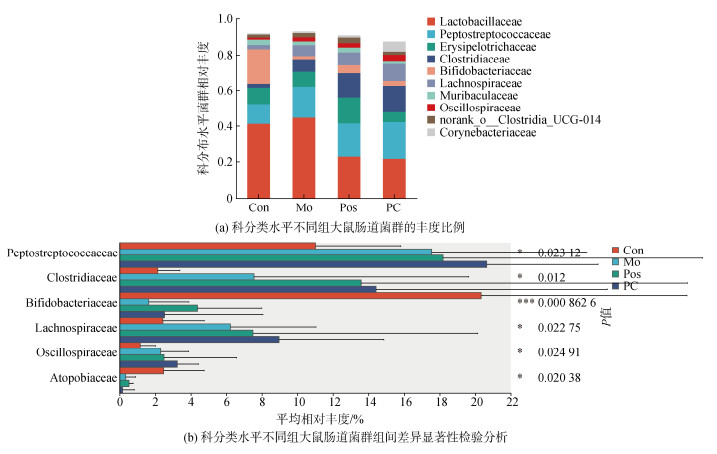 |
| 图 7 藻蓝蛋白干预在科分类水平上对肠道菌群丰度的影响 Fig. 7 Effect of phycocyanin intervention on gut flora abundance at the family classification level 注: 纵轴表示某一分类学水平下的物种名, 横轴表示物种不同分组中平均相对丰度, 不同颜色的柱子表示不同分组; 最右边为P值, P≤0.05时具有统计学意义。0.01<*P≤0.05, 0.001<**P≤0.01, *** P≤0.001 |
在属分类水平上, 如图 8a所示, 根据各组菌属的丰度比例, 优势菌属为乳酸杆菌属(Lactobacillus), 罗姆布茨菌属(Romboutsia), 梭状芽孢杆菌属(Clostridium)和双歧杆菌属(Bifidobacterium), Lactobacillus的丰度各组之间无显著差异性, Mo组与Con组相比, Lactobacillus的丰度略微增加, PC干预后, 其丰度降低。与Con组相比, 酒精诱导后增加了Romboutsia和Clostridium的丰度, 口服PC后, 该两种菌属的丰度明显增加。而Bifidobacterium在酒精干预后丰度显著降低, PC干预后其丰度增加(图 8b)。
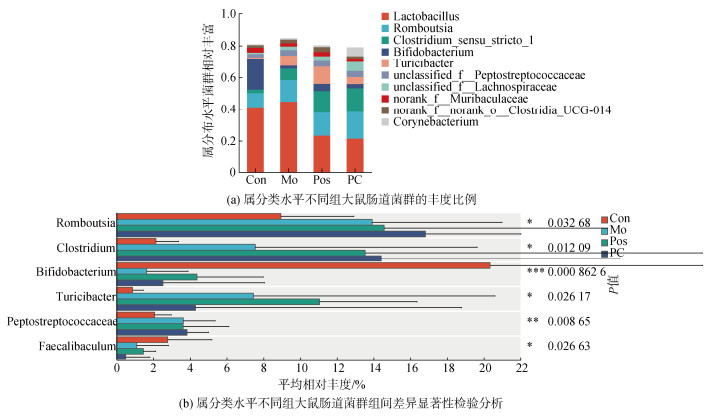 |
| 图 8 藻蓝蛋白干预在属分类水平上对肠道菌群丰度的影响 Fig. 8 Effect of phycocyanin intervention on gut flora abundance at the genus taxonomic level 注: Y轴表示某一分类学水平下的物种名, X轴表示物种不同分组中平均相对丰度, 不同颜色的柱子表示不同分组; 最右边为P值, P≤0.05时具有统计学意义。0.01<*P≤0.05, 0.001<**P≤0.01, *** P≤0.001 |
为了进一步评估PC干预后优势菌群的变化, 对从门到属分类水平的物种进行LEfSe (linear discriminant analysis effect size, 线性判别分析)多级物种差异判别分析。如图 9所示, 线性判别分析得分(LDA阈值为2)的结构总共发现了54个具有统计意义的分类单元, 其中Con组中差异丰富的分类单元的数量是Mo组的4倍, PC组中差异丰富的分类单元的数量是Mo组的5倍。Con组中Actinobacteriota等显著富集, Mo组中Firmicutes等显著富集, PC组中Clostridiaceae等显著富集, 该结果与上述门和属水平上的分析结果基本一致。
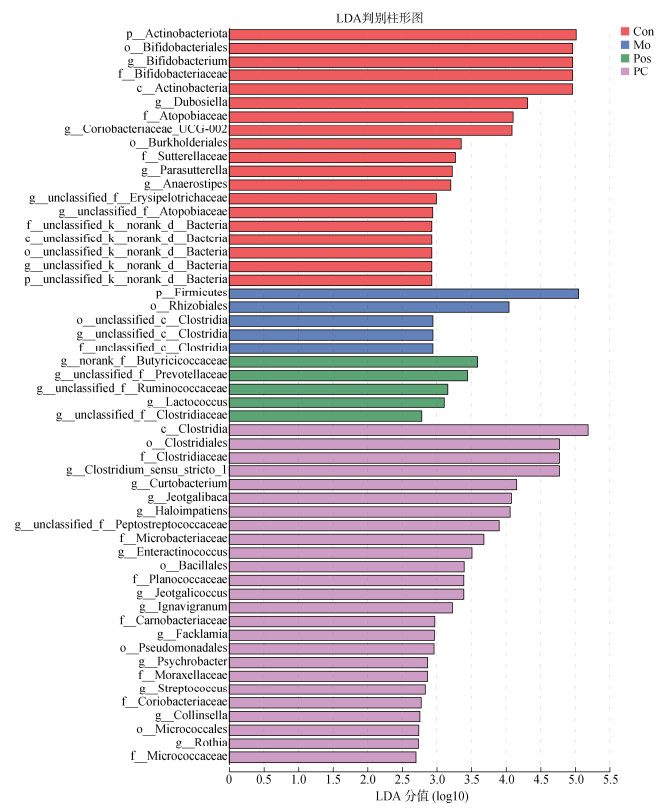 |
| 图 9 LEfSe分析生成的线性判别分析(LDA阈值为2) Fig. 9 Linear discriminant analysis generated by LEfSe analysis (LDA threshold of 2) 注: LDA判别柱形图统计多组中有显著作用的微生物类群, 通过LDA分析(线性回归分析)获得的LDA分值, LDA分值越大, 代表物种丰度对差异效果影响越大 |
螺旋藻藻蓝蛋白是一种具有抗氧化、免疫调节、抗炎等药理活性的天然活性物质[18]。在本研究中, 使用酒精和螺旋藻藻蓝蛋白干预SD大鼠以研究螺旋藻藻蓝蛋白对酒精性肝损伤大鼠肠道菌群的影响。
肠道菌群通过加强肠道屏障, 从而促进健康[19-20]。已有报道证明, 酒精性肝损伤与肠屏障功能障碍有关[21]。许多研究已经确定了与酒精相关肠道菌群区系的变化[22-23], 适度酒精摄入可能会增加肠道菌群区系的Alpha多样性[24]。肠道由近100万亿细菌定植, 其中90%以上属于Bacteroidetes和Firmicutes[8]。Firmicutes/Bacteroidetes (F/B)可以反映肠道菌群的失调情况[25]。本研究在门分类水平上, 酒精干预增加了Firmicutes的丰度, 进而导致F/B值增加, 口服PC后Firmicutes的丰度与Mo组相比降低, 导致F/B值降低。因此, 推测PC能够改善酒精引起的肠道菌群的紊乱。
在微生物群中, 乳酸杆菌能够说明酒精与肠道菌群之间的联系。肠道菌群将酒精转化为乙醛, 乳酸杆菌促进乙醛转化为乙酸。乙醛通过干扰上皮层之间的紧密连接来破坏上皮屏障, 从而导致细菌和脂多糖(又名内毒素)跨膜通透性和渗漏增加[24]。Sawada等[26]曾报道, 肠道细菌产生的脂多糖可以通过激活TLR4而引起肝脏炎症。因此, 乳酸杆菌起到保护肠道的作用。本研究在属水平上, 酒精诱导后Lactobacillus的丰度略微增加, 酒精转化为乙醛增多, 造成肝损伤, 从而导致乳酸杆菌丰度增加。而服用PC后, 促使乳酸杆菌促进乙醛转化为乙酸, 则乳酸杆菌的丰度与Mo组相比降低了。因此, 我们推测PC对酒精引起的肝损伤具有一定程度的影响。
有益菌可以减少肝脏炎症和肝酶, 从而影响非酒精性肝损伤。Faouri等[27]曾在儿童和青少年NAFLD患者中使用了含有Lactobacillus acidophilus、Bifidobacterium和Lactobacillus rhamnosus的益生菌胶囊, 在治疗后, 肝酶改善和肝脏超声正常化。因此, 我们可以推测, Bifidobacterium, Peptostreptococcaceae等有益菌对酒精性肝损伤可能也具有缓解作用。本研究在属水平上, 酒精诱导后显著降低了Bifidobacterium的丰度, PC干预后, Bifidobacterium的丰度增加。而Peptostreptococcaceae在酒精诱导后其丰度增加, 大鼠口服PC后该菌属丰度继续增加, 从而可能缓解肝损伤。同时, 在门水平上, Mo组的Actinobacteriota丰度与Con组相比降低, 口服PC后其丰度则增加。而Bifidobacterium是Actinobacteriota中的一种菌属[28], 可以说明Actinobacteriota是一种有益菌。此外, 我们还发现在大鼠酒精诱导形成肝损伤后继续口服PC, 某些特定菌群的相对丰度发生变化, 这对酒精性肝损伤的肠道菌群的研究提供了新的方向和途径。
4 结论本研究采用酒精灌胃的方式诱导大鼠酒精性肝损伤, 证明了PC对于酒精性肝损伤可能具有一定的保护作用。酒精诱导后, 通过肝脏切片Masson和HE染色的病理分析, 初步判断PC对酒精性肝损伤有一定的缓解作用。之后进行了肠道菌群的高通量测序, 酒精和PC干预后大鼠肠道菌群紊乱, 大鼠肠道菌群的多样性增加, 具有抗炎活性的Bifidobacterium、Actinobacteriota和Peptostreptococcaceae等有益菌的丰度增加, 因此, PC可能是通过增加有益菌的数量来调节大鼠肠道菌群的平衡, 从而减缓酒精性肝损伤。本研究为PC缓解酒精性肝损伤的机制提供了新的线索, 但是体内相互作用关系较为复杂, 具体缓解肝损伤的机理还需要进一步的验证。
| [1] |
SHEN F, WANG Z, LIU W, et al. Ethyl pyruvate can alleviate alcoholic liver disease through inhibiting Nrf2 signaling pathway[J]. Experimental and Therapeutic Medicine, 2018, 15(5): 4223-4228. |
| [2] |
LEE H Y, NAM Y, CHOI W S, et al. The hepato- protective effect of eupatilin on an alcoholic liver disease model of rats[J]. The Korean Journal of Physiology & Pharmacology: Official Journal of the Korean Physiological Society and the Korean Society of Pharmacology, 2020, 24(5): 385-394. |
| [3] |
WONG V W, SINGAL A K. Emerging medical therapies for non-alcoholic fatty liver disease and for alcoholic hepatitis[J]. Translational Gastroenterology and Hepatology, 2019, 4: 53. DOI:10.21037/tgh.2019.06.06 |
| [4] |
CAROTTI S. Starring role of toll-like receptor-4 activation in the gut-liver axis[J]. World Journal of Gastrointestinal Pathophysiology, 2015, 6(4): 99. DOI:10.4291/wjgp.v6.i4.99 |
| [5] |
NISHIMURA N, KAJI K, KITAGAWA K, et al. Intestinal permeability is a mechanical rheostat in the pathogenesis of liver cirrhosis[J]. International Journal of Molecular Sciences, 2021, 22(13): 6921. DOI:10.3390/ijms22136921 |
| [6] |
ZHAO L, MEHMOOD A, YUAN D, et al. Protective Mechanism of edible food plants against alcoholic liver disease with special mention to polyphenolic compounds[J]. Nutrients, 2021, 13(5): 1612. DOI:10.3390/nu13051612 |
| [7] |
YANG Z, XIA Q, LU D, et al. Human mesenchymal stem cells treatment improved hepatic lesions and reversed gut microbiome disorder in non-alcoholic steatohepatitis[J]. Aging, 2020, 12(21): 21660-21673. DOI:10.18632/aging.103962 |
| [8] |
CHOPYK D M, GRAKOUI A. Contribution of the intestinal microbiome and gut barrier to hepatic disorders[J]. Gastroenterology, 2020, 159(3): 849-863. DOI:10.1053/j.gastro.2020.04.077 |
| [9] |
KOCH M. Gut microbiota and the liver: a tale of 2 cities: a narrative view in 2 acts[J]. Journal of Clinical Gastroenterology, 2016, 50(S2): S183-S187. |
| [10] |
SARUMATHI A, SETHUPATHY S, SARAVANAN N. The protective efficacy of spirulina against bacterial endotoxin potentiated alcoholic liver disease[J]. Journal of Functional Foods, 2014, 9: 254-263. DOI:10.1016/j.jff.2014.04.026 |
| [11] |
MCCARTY M F, BARROSO-ARANDA J, CONTRERAS F. Genistein and phycocyanobilin may prevent hepatic fibrosis by suppressing proliferation and activation of hepatic stellate cells[J]. Medical Hypotheses, 2009, 72(3): 330-332. DOI:10.1016/j.mehy.2008.07.045 |
| [12] |
WU L C, HO J A, SHIEH M C, et al. Antioxidant and antiproliferative activities of Spirulina and Chlorella water extracts[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4207-4212. DOI:10.1021/jf0479517 |
| [13] |
XIA D, LIU B, XIN W Y, et al. Protective effects of C-phycocyanin on alcohol-induced subacute liver injury in mice[J]. Journal of Applied Phycology, 2016, 28(2): 765-772. DOI:10.1007/s10811-015-0677-3 |
| [14] |
LIU R, QIN S, LI W. Phycocyanin: Anti-inflammatory effect and mechanism[J]. Biomedicine & Pharmacotherapy, 2022, 153: 113362. |
| [15] |
吴蕾, 庞广昌, 陈庆森. 螺旋藻藻蓝蛋白的规模化提取和色谱纯化技术研究进展[J]. 食品科学, 2008, 29(4): 461-463. WU Lei, PANG Guangchang, CHEN Qingsen. Progress of large-sacle extraction and purification technology of phycocyanin from Spirulina[J]. Food Science, 2008, 29(4): 461-463. DOI:10.3321/j.issn:1002-6630.2008.04.104 |
| [16] |
AL-MALKI A L. In vitro cytotoxicity and pro-apoptotic activity of phycocyanin nanoparticles from Ulva lactuca (Chlorophyta) algae[J]. Saudi Journal of Biological Sciences, 2020, 27(3): 894-898. DOI:10.1016/j.sjbs.2019.12.037 |
| [17] |
翟诗翔, 李文军, 李莉莉, 等. 藻蓝蛋白对四氯化碳诱导的大鼠肝纤维化及肠道微生物的影响[J]. 海洋科学, 2021, 45(7): 103-109. ZHAI Shixiang, LI Wenjun, LI Lili, et al. Effects of phycocyanin on carbon tetrachloride-induced hepatic fibrosis and gut microbiota in rats[J]. Marine Sciences, 2021, 45(7): 103-109. |
| [18] |
WU Q, LIU L, Miron A, et al. The antioxidant, immunomodulatory, and anti-inflammatory activities of Spirulina: an overview[J]. Archives of Toxicology, 2016, 90(8): 1817-1840. DOI:10.1007/s00204-016-1744-5 |
| [19] |
ADAK A, KHAN M R. An insight into gut microbiota and its functionalities[J]. Cellular and Molecular Life Sciences, 2019, 76(3): 473-493. DOI:10.1007/s00018-018-2943-4 |
| [20] |
HIIPPALA K, JOUHTEN H, RONKAINEN A, et al. The potential of gut commensals in reinforcing intestinal barrier function and alleviating inflammation[J]. Nutrients, 2018, 10(8): 988. DOI:10.3390/nu10080988 |
| [21] |
ZHAO M, CHEN C, YUAN Z, et al. Dietary Bacillus subtilis supplementation alleviates alcohol-induced liver injury by maintaining intestinal integrity and gut microbiota homeostasis in mice[J]. Experimental and Therapeutic Medicine, 2021, 22(5): 1312. DOI:10.3892/etm.2021.10747 |
| [22] |
CASSARD A, CIOCAN D. Microbiota, a key player in alcoholic liver disease[J]. Clinical and Molecular Hepatology, 2018, 24(2): 100-107. DOI:10.3350/cmh.2017.0067 |
| [23] |
HARTMANN P, SEEBAUER C T, SCHNABL B. Alcoholic liver disease: the gut microbiome and liver cross talk[J]. Alcoholism, Clinical and Experimental Research, 2015, 39(5): 763-775. DOI:10.1111/acer.12704 |
| [24] |
KOSNICKI K L, PENPRASE J C, CINTORA P, et al. Effects of moderate, voluntary ethanol consumption on the rat and human gut microbiome[J]. Addiction Biology, 2018, 24(4): 617-630. |
| [25] |
QIN N, YANG F, LI A, et al. Alterations of the human gut microbiome in liver cirrhosis[J]. Nature, 2014, 513(7516): 59-64. DOI:10.1038/nature13568 |
| [26] |
SAWADA Y, KAWARATANI H, KUBO T, et al. Combining probiotics and an angiotensin‐Ⅱ type 1 receptor blocker has beneficial effects on hepatic fibrogenesis in a rat model of non‐alcoholic steatohepatitis[J]. Hepatology Research: the Official Journal of the Japan Society of Hepatology, 2018, 49(3): 284-295. |
| [27] |
FAMOURI F, SHARIAT Z, HASHEMIPOUR M, et al. Effects of probiotics on nonalcoholic fatty liver disease in obese children and adolescents[J]. Journal of Pediatric Gastroenterology and Nutrition, 2017, 64(3): 413-417. DOI:10.1097/MPG.0000000000001422 |
| [28] |
SAKANAKA M, GOTOH A, YOSHIDA K, et al. Varied pathways of infant gut-associated Bifidobacterium to assimilate human milk oligosaccharides: prevalence of the gene set and its correlation with Bifidobacteria-rich microbiota formation[J]. Nutrients, 2019, 12(1): 71. DOI:10.3390/nu12010071 |
 2023, Vol. 47
2023, Vol. 47


