
文章信息
- 宋楚儿, 孟振, 张正, 宋小金, 高淳仁. 2023.
- SONG Chu-er, MENG Zhen, ZHANG Zheng, SONG Xiao-jin, GAO Chun-ren. 2023.
- 异养蛋白核小球藻净化对虾池塘养殖尾水的实验
- Experiment on purification of tail water of shrimp pond culture with heterotrophic cultivated Chlorella pyrenoidosa
- 海洋科学, 47(2): 63-70
- Marine Sciences, 47(2): 63-70.
- http://dx.doi.org/10.11759/hykx20220507003
-
文章历史
- 收稿日期:2022-05-07
- 修回日期:2022-06-28
2. 中国水产科学研究院黄海水产研究所 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071;
3. 中国科学院青岛生物能源与过程研究所, 山东 青岛 266101
2. Laboratory for Marine Fisheries Science and Food Production Processes, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Qingdao Institute of Bioenergy and Processes, Chinese Academy of Sciences, Qingdao 266101, China
我国陆基海水养殖趋向高密度和高投入量的集约化、规模化模式发展, 为保护养殖海域水源环境, 国家出台制定了严格的养殖尾水排放标准。氮、磷营养盐超标是养殖尾水的主要问题, 也是尾水处理工艺中较难去除的水质因子。已有研究表明, 在海水鱼类养殖中, 饲料中85%的磷、80%~88%的碳、52%~95%的氮, 会因饲料浪费、生物排泄及呼吸等方式流失到养殖水体中[1]。其中无机氮(NH4+-N、NO3–-N和NO2–-N)和磷(PO43‒)是影响水产养殖生物和水域环境的主要胁迫因子, 氮磷超标一方面可以对养殖动物产生胁迫作用[2], 引发应激反应而导致抗病力降低[3], 另一方面, 可导致周围水域的富营养化[4-6], 引发水华、赤潮等灾害[7-8], 制约了水产养殖业的健康持续发展。近年来, 国内外开展了大量有关微藻培养和废水处理的研究, 发展了藻类处理养殖废水/尾水的技术[9-10]。微藻是一类含有叶绿素a并能进行光合作用的微生物的总称, 能够利用水体中的碳、氮、磷生长并合成自身所需的蛋白质、核酸等细胞成分, 在获得初级生产力的同时可以快速去除水体中的N、P营养盐, 而成为当前养殖尾水处理领域的研究热点[11]。
蛋白核小球藻(Chlorella pyrenoidosa), 属绿藻门(Chlorophyta), 共球藻纲(Trebouxiophyceae), 小球藻目(Chlorellales), 小球藻科(Chlorellaceae), 小球藻属(Chlorella), 是一种球形单细胞藻类, 具有生长繁殖迅速、光合效率高、盐度适应范围广等特点[12-14]。蛋白核小球藻除了可以利用光能和CO2进行正常的光合自养生长外, 还可以利用有机碳源和O2进行异养生长繁殖[15]。异养培养藻细胞增殖速率和养殖产量远高于光自养培养, 且培养条件可控, 单位水体藻细胞生物量大, 有效降低了采收和利用成本[16-17], 因此, 异养微藻具有比自养微藻更高的应用潜能。
国内外学者对光自养蛋白核小球藻在水质净化中的应用开展了大量研究。Lekshmi等[18]证实蛋白核小球藻12 d对生活污水中氨氮、磷酸盐和硝酸盐的最大去除率可达99%、95%、80%; 秦璐等[19]发现中、高浓度蛋白核小球藻添加试验可显著降低罗非鱼养殖水体的氨氮和总磷浓度; 陆洪省等[20]将养殖污水中分离培养的蛋白核小球藻接种至养鸭场污水中, 蛋白核小球藻可在水体中快速生长, 8.5 d对总磷、总氮的去除率达34.7%和23%。而异养培养的蛋白核小球藻作为接种藻液在光自养培养条件下对养殖尾水的脱氮除磷效果研究较少。
本研究以异养发酵培养的蛋白核小球藻作为接种藻液, 以凡纳滨对虾(Penaeus vannamei)海水池塘养殖尾水为对象, 通过对异养培养的蛋白核小球藻进行光自养转换和盐度适应性驯化, 比较不同起始接种密度的藻种在养殖尾水中的生长状况及其对氮、磷营养盐的去除效率, 以此筛选适宜的接种密度并阐明氮磷消耗规律, 为异养微藻在净化海水养殖尾水中的应用提供科学依据。
1 材料与方法 1.1 藻种来源异养蛋白核小球藻由中国科学院青岛生物能源与过程研究所生物能源研究室提供。蛋白核小球藻异养培养方法为: 将100 mL无菌藻种接种至1.2 L灭菌的发酵培养基(葡萄糖30 g/L、酵母提取物25 g/L, 盐度10), 在3 L生物反应器, 于30 ℃发酵培养120 h, 离心、洗涤、保存藻液备用。
1.2 养殖尾水取自山东省威海市某对虾养殖池塘的尾水, 尾水经过滤、灭菌后放置室温备用, 养殖尾水盐度20, pH 7.98。加入BG-11培养基[12]中除NaNO3、KH2PO4以外的营养盐, 用于后续的培养实验。
1.3 实验设计异养藻液经离心、洗涤收集后, 以全价BG11培养基(盐度10)稀释1 000倍进行光自养转换, 稀释后藻细胞密度为3×108个/mL, 光自养转换时间为3~5 d, 光照强度6 600 lx, 光/暗周期16 h∶8 h, 温度25±0.5 ℃。光自养转换期间进行盐度驯化, 发酵藻液盐度为10, 按照每天提升3~5的盐度添加相应重量的NaCl至所需终浓度(尾水盐度)。
蛋白核小球藻接种密度设置为1.0×105个/mL(G1)、5.0×105个/mL(G5)、1.0×106个/mL(G10)3个梯度, 分别接种至总体积为500 mL的培养液中(藻液+尾水), 装入1 L三角烧瓶, 同时以未添加藻细胞的养殖废水为空白对照组(G0), 每个实验组及对照组均设立3个平行样。对照组和实验组三角烧瓶均放置于光照培养箱(GXZ-380, 宁波江南仪器厂)中培养, 培养条件为温度为25 ℃, 光照强度6 600 lx, 光暗周期为16 h∶8 h, 每天摇动3~5次, 避免藻细胞贴壁生长。
1.4 指标检测接种前, 检测养殖废水基础水质条件。在培养周期(21 d)内, 对照组和实验组每个平行样每5 d记录藻细胞密度, 每3 d取样1次测定水质。
藻细胞密度: 采用血球计数板(XB.K.25)在显微镜下记录藻细胞数量, 每个平行样计数3次, 取平均值。
营养盐测定: 每个实验组每个平行样分别取20 mL藻液, 8 000 r/min离心10 min后, 去除藻细胞, 收集上清液。采用众科创谱MI-89便携式水质快速测定仪对PO43‒-P、NH4+-N、NO3‒-N、NO2‒-N进行测定, 取平均值。
酸碱度(pH): 每个实验组的平行样各测定1次, 取平均值, pH计型号为Thermo Orion。
1.5 数据处理与分析藻细胞密度、pH值和营养盐去除率以平均值±标准差(Mean±SD)表示, 采用SPSS 26.0软件进行单因素方差分析(One-way ANOVA), 并采用Tukey’s多重比较分析同一密度不同时间和同一时间不同密度处理组间的差异, P < 0.05为显著性差异。
2 结果 2.1 藻细胞生物量的增长蛋白核小球藻经光自养转换和盐度驯化后, 可以在养殖尾水中快速增殖(图 1)。接种5~10 d后, 不同接种密度的小球藻的细胞数量均呈指数增加, 10~15 d G1组和G5组细胞增殖速度减慢, 而G10组仍持续增加, 15 d时显著高于G1组和G5组(P < 0.05), 20 d时, 藻细胞生物量分别增加39.25、7.98和4.07倍, 不同接种密度的实验组细胞密度无明显差异。
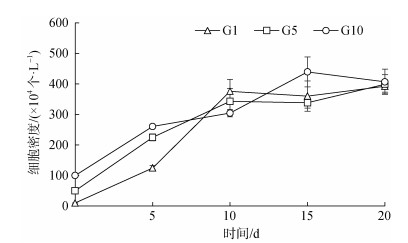 |
| 图 1 不同接种密度的蛋白核小球藻在养殖尾水中生长情况 Fig. 1 Effect of different inoculation densities on the growth of Chlorella pyrenoidosa in mariculture tail water |
蛋白核小球藻的生长过程中, 通过光合作用利用HCO3‒, 释放O2, 会导致养殖尾水pH升高(图 2)。各实验组pH值在培养3 d后即显著高于对照组, 其中G5、G10组水体的pH值第3 d时达到最高, 而后趋于平稳, 第12 d后呈下降趋势; 而G1组水体的pH值在9 d前略低于G5、G10组, 至12 d与两者无显著性差异, 15 d后则显著下降, 实验结束时, 3个实验组无显著性差异。
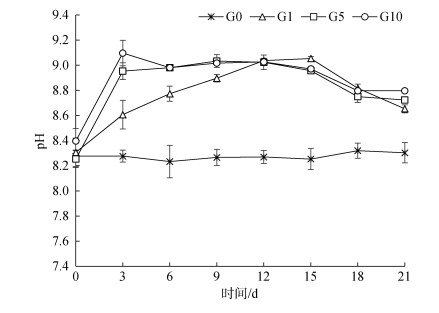 |
| 图 2 不同接种密度下水体的pH值变化 Fig. 2 Effect of different inoculation densities on the pH values of mariculture tail water |
养殖尾水磷酸盐(PO43‒-P)初始质量浓度为4.27 mg/L。各实验组的PO43‒-P去除率随藻细胞生物量的增加均呈持续上升趋势(图 3)。实验周期内, G1组对PO43‒-P的去除效率低于G5、G10组; 15 d前, G5、G10组之间PO43‒-P的去除率无显著差异, 15 d后差异显现, G10组表现出较高的去除效率; 至21 d, 三组蛋白核小球藻对养殖尾水中PO43‒-P的去除率分别为(58.8± 0.72)%、(72.9±1.7)%、(81.4±9.86)%, 磷酸盐的去除效果与蛋白核小球藻接种密度呈正相关, G10组PO43‒-P去除效果优于G1、G5组。
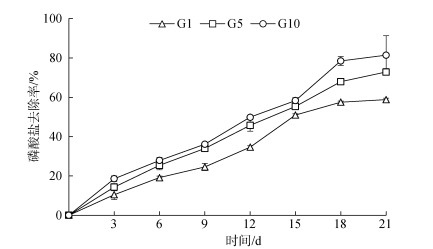 |
| 图 3 不同接种密度的蛋白核小球藻对海水养殖尾水中磷酸盐去除率的影响 Fig. 3 Effect of different inoculation densities of Chlorella pyrenoidosa on the removal rate of PO43‒ in mariculture tail water |
养殖尾水氨氮(NH4+-N)的初始质量浓度为7.02 mg/L。蛋白核小球藻能够快速的去除养殖尾水中的NH4+-N(图 4), 接种小球藻后, 3个实验组养殖水体中的NH4+-N的去除率呈迅速上升趋势, 接种后3 d, 各组间差异显著(P < 0.05), 其处理效果由大到小为: G10 > G5 > G1。至6 d, NH4+-N的去除率分别达到(81.9± 6.0)%, (96.2±1.16)%, (95.4±1.24)%, 至12 d, 各实验组养殖尾水中NH4+-N完全去除。
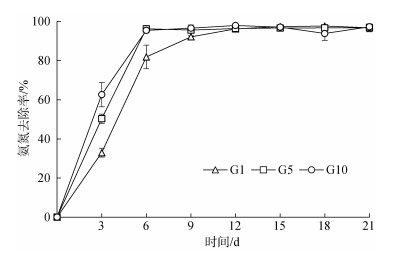 |
| 图 4 不同接种密度的蛋白核小球藻对海水养殖尾水中氨氮去除率的影响 Fig. 4 Effect of different inoculation densities of Chlorella pyrenoidosa on the removal rate of NH4+ in mariculture tail water |
养殖尾水中硝酸盐氮(NO3‒-N)的初始质量浓度为12.77 mg/L。蛋白核小球藻在养殖初期对养殖废水中NO3‒-N的吸收利用率较低(图 5), 其中, G1组和G5组养殖尾水中NO3‒-N去除率在接种后9 d内无显著性变化, 9~12 d去除率快速增加, 此后持续上升; G10组去除率则在接种6 d后即开始增加, 6~15 d上升明显, 15 d后基本保持不变, 具有较高的去除率; 第12 d, 三组蛋白核小球藻对NO3‒-N的去除率分别为(34±3.65)%、(56.5±6.03)%、(70.2±6.09)%, G10组显著优于G1和G5组; 21 d, 三组的去除率分别为(82±1.35)%、(93.3±4.41)%、(91.8±2.77)%。蛋白核小球藻接种浓度为5×105个/mL达到理想的NO3‒-N去除效果。
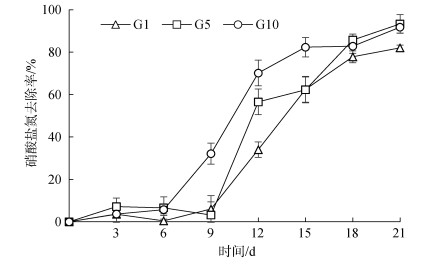 |
| 图 5 不同接种密度的蛋白核小球藻对海水养殖尾水中硝酸盐氮去除率的影响 Fig. 5 Effect of different inoculation densities of Chlorella pyrenoidosa on the removal rate of NO3– in mariculture tail water |
养殖尾水亚硝酸盐氮(NO2‒-N)的初始质量浓度为16.89 mg/L。不同接种密度下, 在实验开始的12 d内, 各实验组养殖尾水中NO2‒-N的去除率无显著性变化(图 6), G1组NO2‒-N去除率在培养12 d后快速上升, G5组在15 d后呈上升趋势, G10组NO2‒-N去除率较低, 无显著性变化; 21 d, 三组蛋白核小球藻对NO2‒-N的去除率分别为(84.3±3.52)%、(23.5± 2.53)%、(3.4±2.16)%。蛋白核小球藻接种密度为1×105个/mL时对NO2‒-N去除效果最佳。
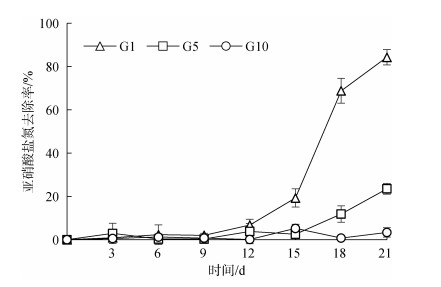 |
| 图 6 不同接种密度的蛋白核小球藻对海水养殖尾水中亚硝酸盐氮去除率的影响 Fig. 6 Effect of different inoculation densities of Chlorella pyrenoidosa on the removal rate of NO2– in mariculture tail water |
氮、磷是微藻生长和代谢过程中重要的营养元素。氮是合成蛋白质、叶绿素的主要成分, 其中, 氨氮、硝酸氮、亚硝酸氮和尿素是微藻代谢的主要氮源[21-22], 氮源的类型及浓度对微藻细胞增殖有着不同的影响[23]。磷是合成核酸、磷脂和蛋白质的主要成分, 无机磷酸盐是微藻优先吸收利用的磷形式[24]。当氮、磷充足时, 微藻能迅速繁殖, 生长速率高; 当氮、磷缺乏时, 生长则受到限制。
在异养培养条件下, 蛋白核小球藻能利用有机碳作为能源进行生长, 消除了因藻细胞互相遮蔽导致光照不足的影响, 具有增殖速度快、培养时间短、生物获得量高等优势, 以此实现高密度、低成本的培养。有研究得出, 当异养小球藻进行光自养转化后, 其叶绿素及光合作用都有一定的增强[25], 具有比自养藻种更高的比生长速率、生物量浓度和生产力。Han等[26]采用异养蛋白核小球藻细胞作为藻种进行光自养培养研究, 发现其生长快速, 藻细胞密度可达到光自养小球藻的1.91倍。本实验中的异养小球藻在经光自养转换和盐度驯化后, 可以快速适应养殖尾水的水质条件, 利用其中C、N、P营养盐实现藻细胞增殖, 在培养初期即进入指数生长期, 与Han等[26]结论一致。
接种密度是影响微藻的生长和增殖的重要条件, Lau等[27]认为初始密度是影响藻类生长的第一个生物因素。本研究中20 d时, 蛋白核小球藻的生物量分别增加39.25(G1)、7.98(G5)和4.07(G10)倍, 低密度组生物量增加最多, 这可能与养殖尾水N、P营养盐浓度比正常生长所需的培养基浓度低, 不能满足高接种密度组的持续生长有关, 也可能与养殖尾水N/P比例有关[28]。李晓伟[29]在研究斜生栅藻(Scenedesmus obliqnus)脱氮除磷影响因素时发现微藻生物量随着藻细胞接种密度的增大而增大。谢志浩等[30]研究表明随着接种密度的增加, 三角褐指藻(Phaeodactylum tricornutum)和等鞭金藻(Isochrysis galbana)对营养盐的消耗增加, 藻细胞的生长速度加快, 进入指数增长期的时间提前, 与本研究中高密度接种组率先达到生长平台期(5 d)的结果一致。
微藻对养殖尾水N、P营养盐的吸收利用取决于微藻生长, 因此, 接种密度同样影响微藻对养殖尾水的N、P去除效率。在一定的范围内, 较高密度的藻细胞可以加速氮、磷的去除, 然而, 当密度过高时可能会导致光合作用效率降低, 从而影响其对N、P的吸收利用[31]。本研究中, 凡纳滨对虾养殖尾水中无机N、P浓度均随微藻生物量的增加持续降低, 在较高的藻细胞起始密度下, 蛋白核小球藻对水体中磷酸盐、氨氮的去除速率更高, 大小依次为1.0×106个/mL > 5.0×105个/mL > 1.0×105个/mL。其中高密度组蛋白核小球藻在培养初期即可快速去除NH4+-N、PO43‒-P, 6 d时NH4+-N去除率可达(95.4±1.24)%, 21 d时PO43‒-P的去除率达(81.4±9.86)%, 高密度组表现出比低起始密度组更有效的氮、磷去除效果, 证明了在一定范围内, 微藻的接种密度越高, 对氮、磷等营养盐的去除率也会越高, 并且可以缩短去除时间[32]。余宗苡[33]在自养培养蛋白核小球藻去除猪场污水NH4+-N的研究中, 发现高浓度的接种密度(5×107 cfu/mL)有助于加快藻细胞对污水中NH4+-N的吸收效率。张桐雨等[34]在采用小球藻(Chlorella sp. HNC11)和双眉藻(Amphora sp. HNY)去除对虾养殖池塘废水N、P营养盐的研究中, 发现藻细胞起始密度能提高单位水体中氮和磷的去除速率。商洪国等[35]在对比钝顶螺旋藻(Spirulina platensis)不同藻种浓度下对氮、磷的去除效能时得出, 总氮、总磷的去除速率随着藻种接种浓度的增加而增快, 与本研究结果一致。
微藻在光自养条件下, 对氮的吸收顺序一般认为: NH4+-N > NO3‒-N > NO2‒-N > 有机氮[36-38]。由于吸收和同化NH4+所需的能量较低, 因此微藻会优先选择氨氮, 而对NO3‒-N、NO2‒-N吸收利用受NH4+-N的抑制, 只有在NH4+-N浓度较低不足以满足微藻生长时才利用后者[39-40]。本研究中, 培养初始的6 d内, 各实验组养殖尾水的NH4+-N浓度即迅速降低, 到第9 d时, 3组去除率均达90%以上; NO3‒-N的消耗则滞后于NH4+-N, 高接种密度组6 d后NO3‒-N浓度开始下降, 低密度和中密度组在9 d后开始下降, 此时NH4+-N浓度下降到极低水平, 不足以满足微藻正常生长所需的N浓度; NO2‒-N的消耗滞后于NO3‒-N, 而高接种密度组在整个实验周期内NO2‒-N吸收利用极低, 21 d去除率仅(3.4±2.16)%, 中、低浓度组在15 d后NO2‒-N浓度显著降低, 对应的培养液中NO3‒-N浓度较低, 此后两组NO2‒-N去除率显著增加。可见, 异养发酵的蛋白核小球藻作为藻种在光自养条件下, 对氮源的利用规律依次为是NH4+-N、NO3‒-N和NO2‒-N, 与之前报道一致。本研究中蛋白核小球藻对NO2‒-N的去除效果可能受到藻细胞生长的影响, 15 d后高接种密度组(G10)培养液由于其他营养盐的快速消耗, 藻细胞增殖停滞, NO2‒-N的吸收利用极低, 而G1、G5组藻细胞仍可维持缓慢增长, 尤其是G1组, 因此, 两者可有效降低养殖尾水中NO2‒-N浓度。值得注意的是, 利用微藻去除NO2‒-N的研究中, 其去除效果与微藻接种密度并非简单的正相关, 张继平等[41]利用小球藻(Chlorella sp.)去除南美白对虾养殖水体中亚硝酸盐氮的研究表明, 当水体中小球藻的接种密度超过2.0×104个/mL时, 亚硝酸盐氮的去除效果无明显提高。总体来说, 本实验中的蛋白核小球藻优先利用氨氮, 其次是硝酸盐氮, 在一定范围内适当地提高小球藻的接种密度, 能提高其对磷酸盐、氨氮、硝酸盐氮的去除率, 而对于亚硝酸盐氮的去除来说, 可探讨其作为异养蛋白核小球藻藻种的单一氮源时, 研究最佳的接种密度和去除效率。
异养发酵的微藻作为藻种进行光自养转化后, 由于具有比自养微藻藻种更高的比生长速率[25], 其在尾水水质净化中可能会同样表现出比光自养微藻更高的净化效率。Lau等[27]采用1×105个/mL、1×106个/mL、5×106个/mL和1×107个/mL接种密度的普通小球藻(Chlorella vulgaris)净化污水, 10 d对NH4+-N的去除率分别为74.1%、97.8%、89.7%、99.9%, 对PO43‒-P的去除率分别为68.8%、92.8%、73.4%、85.6%, 其中1×107个/mL被认为是最适宜的接种密度。李君荣等[42]将初始密度为1×106个/mL的光自养蛋白核小球藻用于处理稀释50%的猪场废水, 结果显示经蛋白核小球藻7 d的处理, TN和TP的去除率达79.69% 和87.14%。Lau等[43]也证实废水驯化的普通小球藻具有比非驯化藻种更高的脱氮除磷作用, 10 d无机氮、磷的去除率可达86%和70%。对比本实验结果, 以异养发酵的蛋白核小球藻作为藻种进行养殖尾水的水质净化, 6 d氨氮去除率即高于80%, 12 d磷酸盐的去除率为(49.9±0.18)%, 表明异养发酵的蛋白核小球藻作为藻种在光自养条件下可能具有更高效的脱氮除磷作用, 且净化能力优于普通小球藻。
综上所述, 本研究中采用异养发酵培养的蛋白核小球藻为藻种进行凡纳滨对虾养殖尾水水质净化实验表明, 蛋白核小球藻具有较好的适应能力, 生长速度快, 对氨氮、磷酸盐和硝酸盐的去除效果较好, 在养殖尾水脱氮除磷的处理过程中, 考虑到小球藻的成本投入和去除效率, 低、中密度组不仅能有效地去除养殖废水中的氮、磷等营养盐, 且生长优, 获得了与高密度接种组相近的处理效果和藻细胞生物量, 因此建议蛋白核小球藻的最佳接种密度为1.0×105~5.0×105个/mL。异养培养方式具有比光自养培养更高的比生长速率、生物量浓度和生产力, 适于在规模化尾水处理中推广应用, 但由于环境的复杂性, 在实际应用中要根据养殖尾水氮/磷营养盐组成、处理周期、光照和温度等因素, 选择和优化适宜的蛋白核小球藻接种密度, 提高处理效果, 实现水质净化。
| [1] |
WU R S S. The environmental impact of marine fish culture: Towards a sustainable future[J]. Marine Pollution Bulletin, 1995, 31(4): 159-166. |
| [2] |
章琼, 蒋高中, 李冰. 水产动物对氨氮胁迫响应的转录组分析研究进展[J]. 江苏农业科学, 2015, 43(3): 227-230. ZHANG Qiong, JIANG Gaozhong, LI Bing. Advances in transcriptome analysis of aquatic animal responses to ammonia nitrogen stress[J]. Jiangsu Agricultural Sciences, 2015, 43(3): 227-230. DOI:10.15889/j.issn.1002-1302.2015.03.074 |
| [3] |
SOUZA-BASTOS L R, VAL A L, WOOD C M. Are amazonian fish more sensitive to ammonia? Toxicity of ammonia to eleven native species[J]. Hydrobiologia, 2017, 789(1): 143-155. DOI:10.1007/s10750-015-2623-4 |
| [4] |
PRIMAVERA J H. Overcoming the impacts of aquaculture on the coastal zone[J]. Ocean & Coastal Management, 2006, 49(9/10): 531-545. |
| [5] |
ZHANG Y, BLEEKER A, LIU J G. Nutrient discharge from China's aquaculture industry and associated environmental impacts[J]. Environmental Research Letters, 2015, 10(4): 045002. DOI:10.1088/1748-9326/10/4/045002 |
| [6] |
MOURA R S T, VALENTI W C, HENRY-SILVA G G, et al. Sustainability of nile tilapia net-cage culture in a reservoir in a semi-arid region[J]. Ecological Indicators, 2016, 66(7): 574-582. |
| [7] |
段学华, 何立红, 李春燕. 水产养殖对水质影响及防治措施[J]. 能源与环境, 2010(4): 95-96. DUAN Xuehua, HE Lihong, LI Chunyan. Effects of aquaculture on water quality and its control measures[J]. Energy and Environment, 2010(4): 95-96. DOI:10.3969/j.issn.1672-9064.2010.04.042 |
| [8] |
ABDEL-RAOUF N, AL-HOMAIDAN A A, IBRAHEEM I B. Microalgae and wastewater treatment[J]. Saudi Jour nal of Biological Sciences, 2012, 19(3): 257-275. DOI:10.1016/j.sjbs.2012.04.005 |
| [9] |
MALLICK N. Biotechnological potential of immobilized algae for wastewater N, P and metal removal: A review[J]. Biometals, 2002, 15(4): 377-390. DOI:10.1023/A:1020238520948 |
| [10] |
胡洪营, 李鑫, 杨佳. 基于微藻细胞培养的水质深度净化与高价值生物质生产耦合技术[J]. 生态环境学报, 2009, 18(3): 1122-1127. HU Hongying, LI Xin, YANG Jia. Coupling of wastewater deep purification and high quality biomass production based on microalgae cultivation[J]. Ecology and Environmental Sciences, 2009, 18(3): 1122-1127. DOI:10.3969/j.issn.1674-5906.2009.03.059 |
| [11] |
孟范平, 宫艳艳, 马冬冬. 基于微藻的水产养殖废水处理技术研究进展[J]. 微生物学报, 2009, 49(6): 691-696. MENG Fanping, GONG Yanyan, MA Dongdong. Recent progress in treatment of aquaculture wastewater based on microalgae-A review[J]. Acta Microbiologica Sinica, 2009, 49(6): 691-696. DOI:10.3321/j.issn:0001-6209.2009.06.002 |
| [12] |
陈明耀. 生物饵料培养(海水养殖专业用)[M]. 北京: 中国农业出版社, 1995. CHEN Mingyao. Cultivation of biological bait (for mariculture)[M]. Beijing: China Agriculture Press, 1995. |
| [13] |
吕福荣, 杨海波, 李英敏. 小球藻净化污水中氮磷能力的研究[J]. 生物学杂志, 2003, 20(2): 25-26, 34. LÜ Furong, YANG Haibo, LI Yingmin. Study on the N, P purification ability of Chlorella[J]. Journal of Biology, 2003, 20(2): 25-26, 34. DOI:10.3969/j.issn.2095-1736.2003.02.009 |
| [14] |
陈春云, 庄源益, 方圣琼. 小球藻对养殖废水中N、P的去除研究[J]. 海洋环境科学, 2009, 28(1): 9-11. CHEN Chunyun, ZHUANG Yuanyi, FANG Shengqiong. Study on N, P removed in culturing wastewater by Chlorella[J]. Marine Environmental Science, 2009, 28(1): 9-11. DOI:10.3969/j.issn.1007-6336.2009.01.003 |
| [15] |
BABAEI A, MEHRNIA M R, SHAYEGAN J, et al. Evaluation of nutrient removal and biomass production through mixotrophic, heterotrophic, and photoautotrophic cultivation of Chlorella in nitrate and ammonium wastewater[J]. International Journal of Environmental Research, 2018, 12(3): 167-178. |
| [16] |
LIANG Y N, SARKANY N, YI C. Biomass and lipid productivities of Chlorella vulgaris under autotrophic, heterotrophic and mixotrophic growth conditions[J]. Biotechnology Letters, 2009, 31(7): 1043-1049. DOI:10.1007/s10529-009-9975-7 |
| [17] |
ZHENG Y B, CHI Z Y, LUCKER B, et al. Two-stage heterotrophic and phototrophic culture strategy for algal biomass and lipid production[J]. Bioresource Technology, 2012, 103(1): 484-488. DOI:10.1016/j.biortech.2011.09.122 |
| [18] |
LEKSHMI B, JOSEPH R S, JOSE A, et al. Studies on reduction of inorganic pollutants from wastewater by Chlorella pyrenoidosa and Scenedesmus abundans[J]. Alexandria Engineering Journal, 2015, 54(4): 1291-1296. DOI:10.1016/j.aej.2015.09.013 |
| [19] |
秦璐, 陈曦, 裘丽萍, 等. 小球藻对罗非鱼养殖水体水质及细菌群落结构的影响[J]. 中国农学通报, 2021, 37(12): 112-120. QIN Lu, CHEN Xi, QIU Liping, et al. Effect of Chlorella on the quality and bacterial community structure of GIFT Tilapia culture water[J]. Chinese Agricultural Science Bulletin, 2021, 37(12): 112-120. |
| [20] |
陆洪省, 刘亚樵, 刘文君, 等. 养殖污水中蛋白核小球藻的分离鉴定及其污水处理效果[J]. 农业工程学报, 2017, 33(4): 273-277. LU Hongsheng, LIU Yaqiao, LIU Wenjun, et al. Isolation, identification of Chlorella pyrenoides from aquaculture wastewater and its purification of wastewater[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(4): 273-277. |
| [21] |
CHEN G Q, FENG C. Growing phototrophic cells without light[J]. Biotechnology Letters, 2006, 28(9): 607-616. DOI:10.1007/s10529-006-0025-4 |
| [22] |
ANITHA S, SHAH A R, ALI B. Modulation of lipid productivity under nitrogen, salinity and temperature stress in microalgae Dunaliella sp.[J]. Journal of Environmental Biology, 2018, 39(5): 625-632. DOI:10.22438/jeb/39/5/MRN-761 |
| [23] |
ARUMUGAM M, AGARWAL A, ARYA M C, et al. Influence of nitrogen sources on biomass productivity of microalgae Scenedesmus bijugatus[J]. Bioresource Technology, 2013, 131: 246-249. DOI:10.1016/j.biortech.2012.12.159 |
| [24] |
SU Y Y. Revisiting carbon, nitrogen, and phosphorus metabolisms in microalgae for wastewater treatment[J]. Science of The Total Environment, 2020, 762(1): 144590. |
| [25] |
LEWITUS A J, CARON D A, MILLER K R. Effects of light and glycerol on the organization of the photosynthetic apparatus in the facultative heterotroph Pyrenomonas salina (cryptophyceae)[J]. Journal of Phycology, 1991, 27(5): 578-587. DOI:10.1111/j.0022-3646.1991.00578.x |
| [26] |
HAN F F, HUANG J K, LI Y G, et al. Enhancement of microalgal biomass and lipid productivities by a model of photoautotrophic culture with heterotrophic cells as seed[J]. Bioresource Technology, 2012, 118: 431-437. DOI:10.1016/j.biortech.2012.05.066 |
| [27] |
LAU P S, TAM N F Y, WONG Y S. Effect of algal density on nutrient removal from primary settled wastewater[J]. Environmental Pollution, 1995, 89(1): 59-66. DOI:10.1016/0269-7491(94)00044-E |
| [28] |
KUMAR S D, SANTHANAM P, LEWIS-OSCAR F, et al. A dual role of marine microalga Chlorella sp. (PSDK01) in aquaculture effluent with emphasis on initial population density[J]. Arabian Journal for Science and Engineering, 2015, 40(1): 29-35. DOI:10.1007/s13369-014-1498-4 |
| [29] |
李晓伟. 斜生栅藻藻类膜脱氮除磷影响因素及其机理研究[D]. 南宁: 广西大学, 2016. LI Xiaowei. Study on influencing factors and mechanism of removal of nitrogen and phosphorus by Scenedesmus obliquus algal biofilm[D]. Nanning: Guangxi University, 2016. |
| [30] |
谢志浩, 俞泓伶, 裘辉. 不同起始密度对等鞭金藻和三角褐指藻种间生长的影响[J]. 宁波大学学报(理工版), 2011, 24(4): 1-4. XIE Zhihao, YU Hongling, QIU Hui. Effects of initial cell density on interspecific growth interaction between Isochrysis galbana and Phaeodactylum tricornutum[J]. Journal of Ningbo University (Natural Science and Engineering Edition), 2011, 24(4): 1-4. DOI:10.3969/j.issn.1001-5132.2011.04.001 |
| [31] |
FOGG G E, THAKE B J. Algal cultures and phytoplankton ecology[M]. Madison USA: University of Wisconsin Press, 1987.
|
| [32] |
HAMEED M. Effect of algal density in bead, bead size and bead concentrations on wastewater nutrient removal[J]. African Journal of Biotechnology, 2010, 6(10): 1185-1191. |
| [33] |
余宗苡. 基于蛋白核小球藻培养的高效处理富铵废水联产生物质研究[D]. 广州: 华南理工大学, 2019. YU Zongyi. High efficiency treatment of ammonium-rich wastewater based on cultivation of Chlorella pyrenoidosa with biomass co-production[D]. Guangzhou: South China University of Technology, 2019. |
| [34] |
张桐雨, 唐选盼, 李洪武, 等. 小球藻和双眉藻对虾塘养殖废水氮、磷的去除效果[J]. 广东农业科学, 2013, 40(18): 169-171, 185. ZHANG Tongyu, TANG Xuanpan, LI Hongwu, et al. Efficiency of nitrogen and phosphorus removal from shrimp breeding wastewater by Chlorella sp. HNC11 and Amphora sp. HNY[J]. Guangdong Agricultural Sciences, 2013, 40(18): 169-171, 185. |
| [35] |
商洪国, 吴楠, 韩飞, 等. 微藻对海水养殖循环水高效碳氮磷一体化去除的研究[J]. 环境科学学报, 2021, 41(9): 3408-3417. SHANG Hongguo, WU Nan, HAN Fei, et al. Efficient simultaneous removal of carbon, nitrogen and phosphorus by microalgae in seawater aquaculture recirculating water[J]. Acta Scientiae Circumstantiae, 2021, 41(9): 3408-3417. |
| [36] |
MCCARTHY J J, TAYLOR W R, TAFT J L. Nitrogenous nutrition of the plankton in the chesapeake bay. 1. Nutrient availability and phytoplankton preferences[J]. Limnology and Oceanography, 1977, 22(6): 996-1011. |
| [37] |
PEREZ-GARCIA O, ESCALANTE F M E, DE-BASHAN L E, et al. Heterotrophic cultures of microalgae: Metabolism and potential products[J]. Water Research, 2011, 45(1): 11-36. |
| [38] |
李亚丽, 赵国强, 武双, 等. 基于废水培养微藻及微藻资源化利用的研究[J]. 现代化工, 2021, 41(4): 48-51. LI Yali, ZHAO Guoqiang, WU Shuang, et al. Cultivation of microalgae based on wastewater and utilization of microalgae[J]. Modern Chemical Industry, 2021, 41(4): 48-51. |
| [39] |
FERNÁNDEZ E, LLAMAS á, GALV NÁA. Chapter3- Nitrogen assimilation and its regulation[M]//FERNÁNDEZ E, LLAMAS Á, GALVÁN A. The chlamydomonas sourcebook (second edition). London: Academic Press. 2009: 69-113.
|
| [40] |
NAGARAJAN D, LEE D J, CHEN C Y, et al. Resource recovery from wastewaters using microalgae-based approaches: A circular bioeconomy perspective[J]. Bioresource Technology, 2020, 302: 122817. |
| [41] |
张继平, 郭照良. 小球藻对降低南美白对虾养殖水体中亚硝酸盐氮含量的研究[J]. 水产科学, 2006(10): 517-519. ZHANG Jiping, GUO Zhaoliang. Reduction of the concentration of nitrite in cultivation water of litopenasus vannamei by Chlorella[J]. Fisheries Science, 2006(10): 517-519. |
| [42] |
李君荣, 申婷, 胡蕾. 蛋白核小球藻处理猪场废水的效果观察[J]. 家畜生态学报, 2012, 33(5): 80-82. LI Junrong, SHEN Ting, HU Lei. Effect of Chlorella pyrenoidosa on treatment of wastewater from pig- farms[J]. Acta Ecologiae Animalis Domastici, 2012, 33(5): 80-82. |
| [43] |
LAU P S, TAM N F Y, WONG Y S. Wastewater nutrients removal by Chlorella vulgaris: Optimization through acclimation[J]. Environmental Technology, 1996, 17(2): 183-189. |
 2023, Vol. 47
2023, Vol. 47


