文章信息
- 田振方, 王滨, 崔爱君, 徐永江, 柳学周, 姜燕, 田云臣. 2023.
- TIAN Zhen-fang, WANG Bin, CUI Ai-jun, XU Yong-jiang, LIU Xue-zhou, JIANG Yan, TIAN Yun-chen. 2023.
- 鱼类spexin系统鉴定及其生理功能研究
- Identification of the spexin system and its physiological functions in fish
- 海洋科学, 47(2): 100-108
- Marine Sciences, 47(2): 100-108.
- http://dx.doi.org/10.11759/hykx20220402002
-
文章历史
- 收稿日期:2022-04-02
- 修回日期:2022-06-30
2. 中国水产科学研究院 黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室, 山东 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室深蓝渔业工程联合实验室, 山东 青岛 266237;
4. 天津农学院 计算机与信息工程学院, 天津 300384
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Joint Laboratory for Deep Blue Fishery Engineering, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
4. College of Computer and Information Engineering, Tianjin Agricultural University, Tianjin 300384, China
Spexin(SPX), 也称作神经肽Q(NPQ), 是一种新型下丘脑神经肽, 最初是通过生物信息学方法在人类蛋白组中发现的[1-2]。随后, 从鱼类到哺乳类均鉴定出了spx的同源基因[3]。SPX的成熟肽是一种十四肽, 其氨基酸序列在不同物种间高度保守, 鱼类和四足类之间仅有1个氨基酸差异[3-4]。spx基因在不同脑区和外周组织中广泛表达, 表明SPX可能发挥了重要的生理功能。前期大量研究结果已证实SPX参与了脊椎动物摄食、生殖、血糖稳态、脂肪酸吸收、胃肠道蠕动等多种生理过程[3-5]。此外, SPX通过和甘丙肽受体GALR2和GALR3结合发挥了其生理功能[6-8]。
基于共线性分析和数据挖掘, 韩国学者在非哺乳类中又发现了一种新型spx基因, 即spx2, 之前所发现的spx基因重新命名为spx1[8]。目前对脊椎动物spx2基因结构、组织分布和生理功能等信息知之甚少, 有关鱼类SPX生理功能研究也主要集中在生殖和摄食调控方面。本文简要总结鱼类SPX及其受体的研究进展, 重点对SPX的基因种类、结构特征、组织分布、生理学功能以及信号转导机制等内容进行概括讨论, 旨在加深对鱼类SPX系统的认识和了解, 为后续深入研究提供参考。
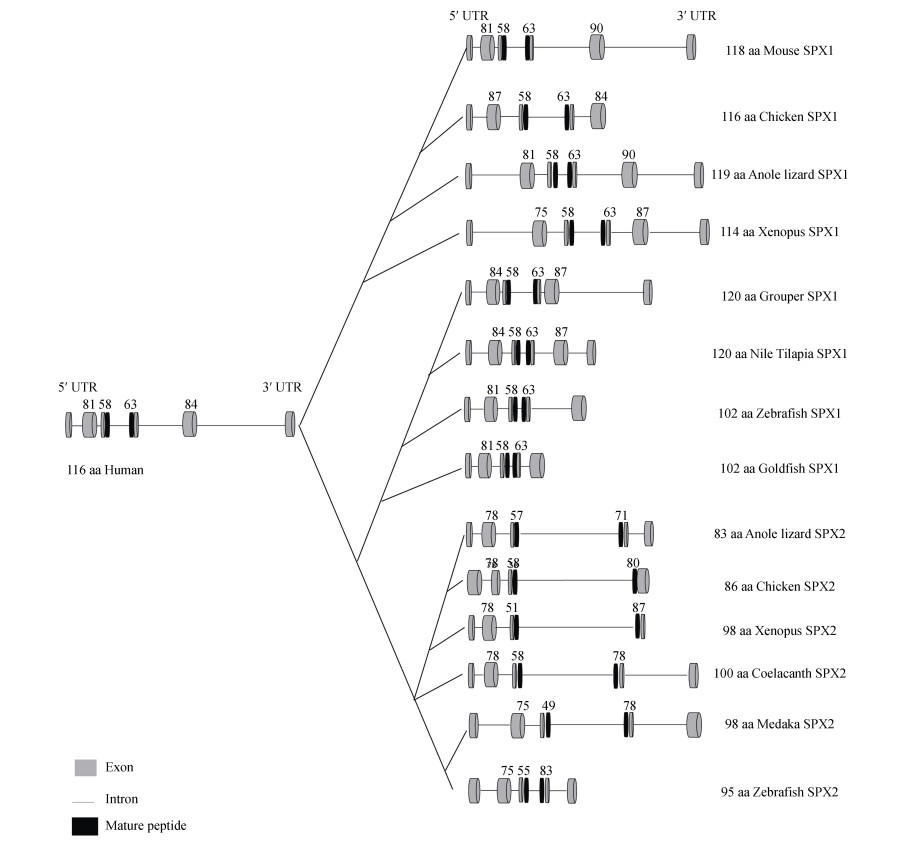
1 鱼类spx基因种类、结构、进化分析及组织表达特征目前, 已在金鱼(Carassius auratus)[9-10]、斑马鱼(Danio rerio)[10]、斜带石斑鱼(Epinephelus coioides)[11]、雅鱼(Schizothorax prenanti)[12]、半滑舌鳎(Cynoglossus semilaevis)[13]、金钱鱼(Scatophagus argus)[14]、西伯利亚鲟鱼(Acipenser baeri)[15]及尼罗罗非鱼(Oreochromis niloticus)[6]中鉴定出了spx1基因。但仅在斑马鱼、青鳉(Oryzias latipes)和半滑舌鳎中鉴定出了spx2基因[8, 16]。人类spx1基因位于第12号染色体上, 也称作c12orf39基因, 该基因由6个外显子和5个内含子组成, 编码116个氨基酸的前体多肽[3]。同样, 斜带石斑鱼spx1基因也是由6个外显子和5个内含子组成, 编码120个氨基酸的前体多肽[11]。然而, 斑马鱼和金鱼spx1基因由5个外显子和4个内含子组成, 编码102个氨基酸的前体多肽[9]。
哺乳类中不存在spx2基因, 其他非哺乳类spx2基因结构与spx1基因结构类似。例如斑马鱼和青鳉spx2基因均由5个外显子和4个内含子组成, 分别编码95和98个氨基酸的前体多肽。图 1总结了不同物种spx1和spx2基因结构特征: 第一和第二外显子编码信号肽, 第三和第四外显子编码成熟肽。另外, 金鱼spx1基因存在内含子选择性剪接现象, 导致产生了3种不同长度的mRNA转录本, 分别包内含子(574 bp)。由于前两种转录本内含子中含有终止密码子导致其不能编码SPX1成熟肽, 只有长度为574 bp的转录本能够编码SPX1成熟肽[9]。spx2基因中是否存在类似现象仍不得而知, 需要进一步深入研究。
脊椎动物SPX1的成熟肽是一种十四肽, 其氨基酸序列高度保守, 目前已知所有鱼类SPX1成熟肽氨基酸序列均为NWTPQAMLYLKGTQ-NH2, 这与四足类SPX1成熟肽氨基酸序列NWTPQAMLYLKGA Q-NH2相比仅有1个氨基酸差异(图 2a)。另一方面, 斑马鱼、非洲爪蟾(Xenopus tropicalis)、变色龙(Anolis carolinensis)、鸡(Gallus gallus)等SPX2成熟肽也是一种十四肽, 但它们成熟肽之间有4个位点存在氨基酸序差异(图 2a)。然而, 青鳉和半滑舌鳎SPX2成熟肽包含17个氨基酸, 其氨基酸序列均为LNIHW GPQSMMYLKGKY-NH2 [8, 16]。有意思的是, 尼罗罗非鱼等慈鲷科(Cichlidae)鱼类中也不存在spx2基因, 但有两种spx1基因, 即spx1a和spx1b。尼罗罗非鱼SPX1a成熟肽氨基酸序列与其他鱼类SPX1序列完全相同, 但SPX1b成熟肽氨基酸序列为NWTSQAIL YLKGAQ-NH2, 与SPX1a之间有3个位点存在氨基酸差异[6]。综上所述, 尽管不同物种SPX1和SPX2成熟肽之间存在个别氨基酸差异, 它们的氨基酸序列还是高度保守的, 这说明SPX1和SPX2在脊椎动物中发挥了重要的生理功能。
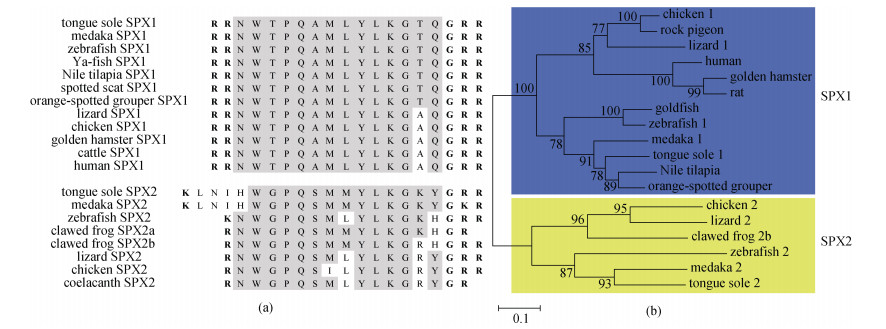 |
| 图 2 脊椎动物SPX成熟肽氨基酸序列比对(a)及进化树分析(b) Fig. 2 Alignment of amino acid sequences for SPX mature peptides (a) and phylogenetic analysis (b) in vertebrates |
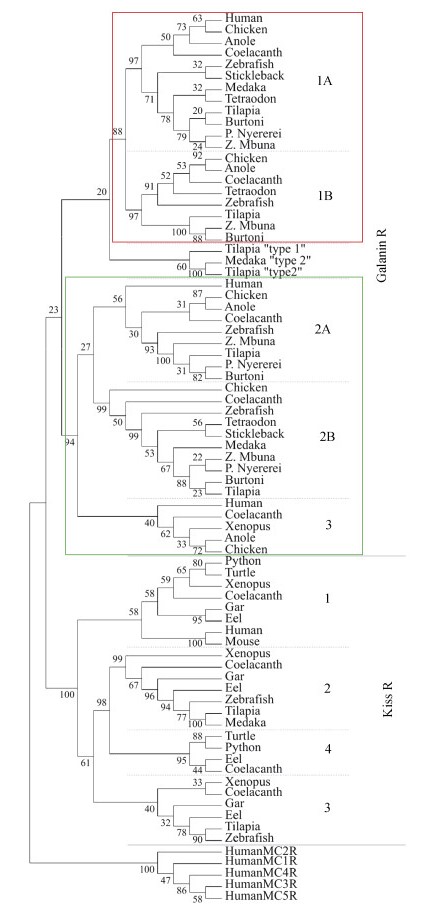
进化树分析结果表明, 脊椎动物SPX序列分为明显的两支, 即SPX1进化支和SPX2进化支(图 2b)。硬骨鱼类SPX1序列之间亲缘关系更近, 聚为一支, 然而四足类SPX1序列聚为另一支。同样, 硬骨鱼类和四足类SPX2序列明显分为两个进化支。基因组共线性分析结果进一步表明, SPX与GAL (galanin, 甘丙肽)、Kiss (kisspeptin, 吻素)基因起源于同一祖先, 这3个基因是在第二轮全基因组复制(2R)之前通过局部复制产生的[8]。如图 3所示, 腔棘鱼(Coelacanth)、变色龙、斑马鱼、河鲀(Tetraodon)等spx1基因与kiss2基因位于同一染色体上, 但人类不存在kiss2基因; 腔棘鱼、变色龙、鸡、非洲爪蟾、斑马鱼、青鳉spx2基因和gal基因也位于同一染色体上; 腔棘鱼和非洲爪蟾的GAL样多肽(galp)基因和kiss3基因相邻。因此, 这3种神经肽构成了SPX/GAL/Kiss家族[17]。
RT-PCR和IHC结果显示spx1基因广泛表达于人和大鼠多种组织, 表明SPX1可能参与了多种生理过程[18-19]。与之类似, spx1也在多种鱼类组织中广泛表达, 但表达模式具有物种特异性。总体而言, spx1在金鱼[9-10]、斑马鱼[10]、斜带石斑鱼[11]、雅鱼[12]、半滑舌鳎[13]和西伯利亚鲟鱼[15]的脑中高表达; spx1在斑马鱼、斜带石斑鱼和金钱鱼卵巢[10, 11, 14]以及斜带石斑鱼肝脏[11]中的表达量也较高。尼罗罗非鱼spx1a主要在中脑和卵巢中高表达, 然而spx1b在垂体、肾脏以及所有脑区中均有表达, 尤其是在前脑中高表达。另外, spx1b的表达水平远远高于spx1a的表达水平[6]。目前, 有关脊椎动物spx2组织分布的信息很少。RT-PCR结果表明spx2在半滑舌鳎不同脑区和外周组织中均有表达, 其中在卵巢中的表达量最高[16]。KIM等[20]通过原位杂交方法详细研究了斑马鱼spx1和spx2的脑区分布特征: spx1在中脑和脑干中表达, 而spx2在下丘脑视前区表达。
2 鱼类SPX受体鉴定、进化分析、组织表达特征及信号转导机制KIM等[8]首次开展了脊椎动物SPX的进化机制研究, 共线性分析结果表明spx、gal和kiss基因紧密地位于同一连锁群中, 并且相对于kiss而言, spx与gal进化关系更近, 暗示这3种神经肽可能起源于同一基因。此外, SPX1序列中第2、3、9、10和12位氨基酸与GAL所对应位置的氨基酸完全相同, 并且GAL第2、3和9位氨基酸对受体结合和活化至关重要。鉴于SPX1和GAL结构相似性, 故推测SPX1可能激活GAL受体(GALR)。斑马鱼SPX、GAL和Kiss成熟肽氨基酸序列比对见图 4。
 |
| 图 4 斑马鱼SPX、GAL和Kiss成熟肽氨基酸序列比对 Fig. 4 Alignment of amino acid sequences for SPX, GAL and Kiss mature peptides in zebrafish |
哺乳类有3种GALR类型, 即GALR1、GALR2和GALR3; 鱼类只有GALR1和GALR2, 不存在GLAR3。但是鱼类每种GALR都有2种旁系同源基因, 即galr1a、galr1b、galr2a和galr2b [21]。最近, 在尼罗罗非鱼中鉴定出了6种GALR类型, 除了上述4种类型外, 还存在另外2种类型, 称作1型galr和2型galr[6]。
GALR属于7次跨膜G蛋白偶联受体家族(GPCR), 该受体N末端包含1~2个潜在的N连接糖基化位点(NXT/S)以及1~3个PKC磷酸化位点(SSR/ SKK/SKR)[6]。脊椎动物GALR和KissR进化树分析表明: GALR和KissR明显分为两个进化支; GALR分支进一步分为GALR1和GALR2/3两个分支; KissR分支也进一步分为KissR1、KissR2、KissR3和KissR4 4个分支; 需要注意的是, 尼罗罗非鱼1型GALR和2型GALR以及青鳉1型GALR属于GALR1姐妹分支(图 5)。
目前有关鱼类galr基因组织分布的研究较少。尼罗罗非鱼galr1a和galr2a表达谱类似, 二者在所有组织中均有表达, 其中在肾脏表达量最高; galr1b在前肠中高表达, 其次为前脑, 但在其他组织中表达量较低; galr2b主要在前脑和中脑表达, 在其他组织中几乎不表达[6]。在欧洲海鲈中也鉴定出了galr1a、galr1b、galr2a和galr2b基因, 这4种基因均在雌雄鲈鱼前脑和中脑高表达, 其次为性腺和嗅上皮组织; 其中galr1a和galr1b表达具有性别二态性, 二者在精巢中表达量高于卵巢[22]。斑马鱼galr1a只在脑和肠中表达, 但galr1b广泛表达于中枢和外周组织[23]。另一方面, 斑马鱼galr2a和galr2b只在胚胎的中枢神经系统表达, 其中galr2a在端脑腹侧区域低表达, 而galr2b则在嗅球、中脑被盖、脊髓等不同脑区均有表达[24]。此外, 在金鱼脑和肠中均可检测到GALR1和GALR2的免疫阳性信号[25]。综上所述, 不同GALR基因的表达模式具有物种和组织特异性, 也可能与生殖周期、营养状况、性别差异等因素有关。
尽管SPX在脊椎动物多种生理过程中发挥了重要作用, 但有关其信号转导机制研究较少。在人、非洲爪蟾和斑马鱼中, 配体和受体互作研究表明SPX1和SPX2均可激活GALR2 (GALR2a和GALR2b)和GALR3, 但不能激活GALR1。此外, 相比较GAL而言, 非洲爪蟾和斑马鱼SPX多肽与GALR2b有更强的结合能力。这些结果表明GALR2和GALR3是SPX的内源性受体[8]。但是, SPX不能激活Kiss受体(KissR)[8]。SPX1和SPX2均显著性增加了转染了人GALR2和GALR3的HEK293细胞中SRE-luc的活性。同样, SPX1和SPX2也增加了转染了非洲爪蟾GALR2b和GALR3的HEK293细胞中SRE-luc的活性。上述结果表明, PKC通路介导了SPX的生理功能[8]。斑马鱼中存在4种GALR类型(GALR1a、GALR1b、GALR2a和GALR2b), 但SPX1和SPX2只能增加转染了斑马鱼GALR2a和GALR2b的HEK293细胞中SRE-luc的活性。然而GAL却能激活这4种受体, 进而增加了SRE-luc的活性。该结果表明SPX1和SPX2主要通过GALR2a和GALR2b发挥其生理功能, 并且PKC通路参与了此过程[8]。尼罗罗非鱼SPX1a和SPX1b只能增加转染了GALR2b的COS-7细胞中SRE-luc和CRE-luc的活性, 表明GALR2b介导了尼罗罗非鱼SPX1的生理功能, 并且PKC和PKA通路参与了此过程[6]。进一步深入研究SPX与GnRH[26]、GnIH[27-28]、Kiss[29-30]等其他神经肽之间的信号互作机制, 将有助于了解这些神经肽如何协同作用于生殖轴进而影响脊椎动物生殖活动。
3 鱼类SPX生理功能及表达调控研究目前, 有关鱼类SPX生理功能的研究主要集中在摄食和生殖两方面。脑室注射SPX1显著性降低了金鱼本底以及神经肽Y (NPY)或者食欲素(orexin)诱导的摄食量和摄食行为。此外, SPX1也降低了脑中摄食促进因子(npy、apelin、agrp)的表达水平, 同时增加了摄食抑制因子(cck、pomc、cart、crh)的表达水平[9]。腹腔注射SPX1也降低了西伯利亚鲟鱼的摄食量; 增加了下丘脑摄食抑制因子(nucb2、cart、ucn3、pyy)的表达水平, 降低了下丘脑摄食促进因子npy的表达水平; 与此同时, SPX1也上调了胃中nucb2和pyy的表达水平, 下调了胃中ucn3、cck以及apelin的表达水平[15]。与野生型斑马鱼相比, 敲除spx1基因的斑马鱼的摄食量显著性增加; 脑室注射SPX1降低了下丘脑agrp的表达水平, 增加了pomc的表达水平[31]。上述结果表明SPX1抑制了鱼类摄食。
腹腔注射SPX1显著性降低了金鱼血清LH含量; SPX1也抑制了金鱼垂体细胞LH分泌[10]。同样, 腹腔注射SPX1a和SPX1b均降低了尼罗罗非鱼血清LH和FSH含量[6]。有意思的是, 基因敲除spx1并不影响斑马鱼正常生殖能力[31]。这可能是由于鱼类中存在生殖补偿机制, 敲除某一神经肽并不能影响鱼类正常生殖, 因为其他神经肽可能发挥了此神经肽的类似功能[32]。在体和离体研究结果显示SPX1降低了斜带石斑鱼垂体gh表达水平, 但不影响fshβ和lhβ表达水平[11]。腹腔注射SPX1促进了半滑舌鳎下丘脑gnih和gnrh3的表达水平, 抑制了垂体gh、gthα和fshβ表达水平, 但对lhβ表达水平没有影响[13]。此外, 在斑马鱼背侧缰核中过表达spx1可以降低其焦虑行为[33]。目前, 尚无有关脊椎动物SPX2生理功能的报道。综上所述, 鱼类SPX发挥了重要的生理功能。然而, 多种因素也可通过影响SPX基因表达, 进而间接调控鱼类摄食和生殖等生理过程。
3.1 营养状况对spx基因表达调控的影响营养状况对鱼类spx基因表达具有重要的影响。在金鱼、雅鱼、西伯利亚鲟鱼和尼罗罗非鱼中, 饥饿导致脑中spx1基因表达量下降[6, 9, 12, 15]。相反, 饥饿上调了斜带石斑鱼、半滑舌鳎和金钱鱼脑中spx1的表达水平[11, 13, 14]。目前, 仅有一篇报道关于营养状况对spx2基因表达调控的影响。饥饿2周显著性上调了半滑舌鳎脑、垂体和卵巢中spx2的表达水平[16]。这些结果表明SPX可能参与了鱼类摄食调控和能量平衡, 并且营养状况对spx基因表达调控具有物种特异性。
MA等[34]以金鱼为实验模型进一步深入研究了营养状况与spx1基因表达之间的功能联系和信号转导机制。摄食增加了金鱼血清中葡萄糖、胰岛素和SPX1的含量, 同时上调了肝脏中胰岛素和spx1的表达水平。皮尔逊相关性分析表明血清中胰岛素和葡萄糖、SPX1和葡萄糖、SPX1和胰岛素之间存在正相关。腹腔注射葡萄糖增加了血清中葡萄糖含量, 上调了肝脏中胰岛素和spx1以及不同脑区中spx1的表达水平。此外, 腹腔注射胰岛素降低了血清中葡萄糖含量, 但增加了血清中SPX1含量, 上调了肝脏以及不同脑区中spx1的表达水平。胰岛素拮抗剂S961阻断了葡萄糖诱导的血清中SPX1含量以及肝脏和不同脑区中葡萄糖诱导的spx1的表达水平。与在体实验结果类似, 葡萄糖增加了金鱼肝脏细胞中胰岛素和spx1的表达水平; 胰岛素也增加了肝脏细胞中spx1的表达水平; 然而S961以及胰岛素受体抑制剂HNMPA均阻断了葡萄糖诱导的spx1的表达水平。胰岛素也上调了金鱼脑细胞中spx1的表达水平, 但HNMPA阻断了胰岛素诱导的spx1的表达水平。另外, 胰岛素处理肝脏细胞和脑细胞后均增加了MEK1/2、ERK1/2、MKK3/6、
在金鱼、斜带石斑鱼和金钱鱼中研究发现, 下丘脑spx1表达水平在卵巢成熟过程中逐渐降低, 暗示性类固醇激素可能调控spx1基因表达[10, 11, 14]。金鱼卵巢切除后下丘脑spx1的表达量显著性上升, 而注射雌二醇(E2)后其表达量又回到了本底水平, 表明E2抑制了金鱼下丘脑spx1的表达[10]。同样, E2也降低了金钱鱼下丘脑spx1的表达水平[14]。迄今为止, 性类固醇激素是否也影响脊椎动物spx2的表达尚未有报道。
3.3 压力对spx基因表达调控的影响尼罗罗非鱼群体具有明显的社会等级, 是研究社会失败压力(social defeat stress)的良好动物模型。它有spx1a和spx1b两种基因, 但不存在spx2基因; spx1a在脑区2(视顶盖、中脑、下丘脑)中表达量最高, 其次为脑区3(小脑、后脑), 在脑区1(端脑、视前区)中表达量最低, 远远低于脑区2和脑区3; 相反, spx1b在脑区1中表达量最高, 其次为脑区3和脑区2[35]。与对照组相比, 长期社会失败压力导致实验鱼血清中皮质醇含量上升; 脑区2中spx1a和spx1b的表达量也显著性增加, 但脑区1和脑区3中spx1a和spx1b的表达量无显著性差异, 此结果说明脑区2对压力应答很敏感。因为长期压力会抑制生殖、生长和摄食, 长期社会失败压力下导致尼罗罗非鱼脑区2中spx1的表达量上升, 说明SPX1可能抑制了这些生理过程, 这与之前SPX1生理功能研究结果是一致的[3-4]。
4 小结与展望SPX是一种氨基酸序列高度保守的新型下丘脑神经肽, 通过GALR2和GALR3介导参与了哺乳类脂质代谢、血糖稳态、胃肠道蠕动、心血管功能等多种生理过程。目前, 仅在几种鱼类中鉴定出了spx1和spx2基因, 以及6种潜在的受体galr基因, 有关其生理功能研究也主要集中在摄食和生殖调控两方面。因此, 进一步深入开展以下方面的研究工作, 将有助于更好地了解SPX参与鱼类摄食和生殖等生理过程的协同作用机制: (1)阐明SPX组织分布特征。由于缺少特异性抗体, 有关鱼类SPX在脑等组织中的精确细胞定位研究较少。通过制备特异性抗体, 阐明SPX以及与其他神经肽之间的组织分布特征, 可为研究SPX生理学功能以及与其他神经肽之间的功能互作提供基本依据。(2)通过基因编辑等手段深入开展鱼类SPX生理学功能研究。哺乳类SPX的生理学功能受到了广泛研究, 然而鱼类SPX生理学功能研究刚刚起步, 尤其是关于SPX2的生理功能尚未见有报道。此外, 进一步开展SPX与其他神经肽(GnRH、GnIH、Kiss等)之间的功能互作, 阐明鱼类生殖内分泌调控网络机制, 为研发鱼类新型生殖调控制剂提供理论依据。(3)解析SPX受体下游信号通路, 完善信号转导网络机制。前期初步研究结果证实SPX能够通过GALR2和GALR3激活PKC和PKA通路, 然而ERK、Ca2+等其他信号通路是否介导了SPX的生理功能仍不得而知。总之, 阐明上述研究内容才能更好地了解SPX参与鱼类摄食和生殖等生理功能的作用机制。
| [1] |
MIRABEAU O, PERLAS E, SEVERINI C, et al. Identification of novel peptide hormones in the human proteome by hidden Markov model screening[J]. Genome Res, 2007, 17(3): 320-327. DOI:10.1101/gr.5755407 |
| [2] |
SONMEZ K, ZAVERI N T, KERMAN I A, et al. Evolutionary sequence modeling for discovery of peptide hormones[J]. PLoS Comput Biol, 2009, 5(1): e1000258. DOI:10.1371/journal.pcbi.1000258 |
| [3] |
LIM C H, LEE M Y M, SOGA T, et al. Evolution of structural and functional diversity of spexin in mammalian and non-mammalian vertebrate species[J]. Front Endocrinol (Lausanne), 2019, 10: 379. DOI:10.3389/fendo.2019.00379 |
| [4] |
MA A N, BAI J, HE M L, et al. Spexin as a neuroendocrine signal with emerging functions[J]. Gen Comp Endocrinol, 2018, 265(1): 90-96. |
| [5] |
LV S Y, ZHOU Y C, ZHANG X M, et al. Emerging roles of NPQ/Spexin in physiology and pathology[J]. Front Pharmacol, 2019, 10: 457. DOI:10.3389/fphar.2019.00457 |
| [6] |
COHEN Y, HAUSKEN K, BONFIL Y, et al. Spexin and a novel cichlid-specific spexin paralog both inhibit FSH and LH through a specific galanin receptor (Galr2b) in tilapia[J]. Front Endocrinol (Lausanne), 2020, 11: 71. DOI:10.3389/fendo.2020.00071 |
| [7] |
LIN C Y, ZHANG M, HUANG T, et al. Spexin enhances bowel movement through activating L-type voltage-dependent calcium channel via galanin receptor 2 in mice[J]. Sci Rep, 2015, 5: 12095. DOI:10.1038/srep12095 |
| [8] |
KIM D K, YUN S, SON G H, et al. Coevolution of the spexin/galanin/kisspeptin family: Spexin activates galanin receptor type II and III[J]. Endocrinology, 2014, 155(5): 1864-1873. DOI:10.1210/en.2013-2106 |
| [9] |
WONG M K, SZE K H, CHEN T, et al. Goldfish spexin: solution structure and novel function as a satiety factor in feeding control[J]. Am J Physiol Endocrinol Metab, 2013, 305(3): E348-366. DOI:10.1152/ajpendo.00141.2013 |
| [10] |
LIU Y, LI S S, QI X, et al. A novel neuropeptide in suppressing luteinizing hormone release in goldfish, Carassius auratus[J]. Mol Cell Endocrinol, 2013, 374(1/2): 65-72. |
| [11] |
LI S S, LIU Q Y, XIAO L, et al. Molecular cloning and functional characterization of spexin in orange-spotted grouper (Epinephelus coioides)[J]. Comp Biochem Physiol B Biochem Mol Biol, 2016, 196/197: 85-91. DOI:10.1016/j.cbpb.2016.02.009 |
| [12] |
WU H W, LIN F J, CHEN H, et al. Ya-fish (Schizothorax prenanti) spexin: identification, tissue distribution and mRNA expression responses to periprandial and fasting[J]. Fish Physiol Biochem, 2016, 42(1): 39-49. DOI:10.1007/s10695-015-0115-0 |
| [13] |
WANG S P, WANG B, CHEN S L. Spexin in the half- smooth tongue sole (Cynoglossus semilaevis): molecular cloning, expression profiles, and physiological effects[J]. Fish Physiol Biochem, 2018, 44(3): 829-839. DOI:10.1007/s10695-018-0472-6 |
| [14] |
DENG S P, CHEN H P, ZHAI Y, et al. Molecular cloning, characterization and expression analysis of spexin in spotted scat (Scatophagus argus)[J]. Gen Comp Endocrinol, 2018, 266: 60-66. DOI:10.1016/j.ygcen.2018.04.018 |
| [15] |
TIAN Z Z, XU S Q, WANG M, et al. , Identification, tissue distribution, periprandial expression, and anorexigenic effect of spexin in Siberian sturgeon, Acipenser baeri[J]. Fish Physiol Biochem, 2020, 46(6): 2073-2084. DOI:10.1007/s10695-020-00856-y |
| [16] |
WANG B, CUI A J, TIAN J, et al. Characterization of a novel spexin gene (spx2) in the half-smooth tongue sole and regulation of its expression by nutritional status[J]. Aquac Rep, 2020, 18: 100544. DOI:10.1016/j.aqrep.2020.100544 |
| [17] |
YUN S, KIM D K, FURLONG M, et al. Does kisspeptin belong to the proposed RF-amide peptide family?[J]. Front Endocrinol (Lausanne), 2014, 5: 134. |
| [18] |
GU L P, MA Y H, GU M Y, et al. Spexin peptide is expressed in human endocrine and epithelial tissues and reduced after glucose load in type 2 diabetes[J]. Peptides, 2015, 71: 232-239. DOI:10.1016/j.peptides.2015.07.018 |
| [19] |
PORZIONATO A, RUCINSKI M, MACCHI V, et al. Spexin expression in normal rat tissues[J]. J Histochem Cytochem, 2010, 58(9): 825-837. DOI:10.1369/jhc.2010.956300 |
| [20] |
KIM E, JEONG I, CHUNG A Y, et al. Distribution and neuronal circuit of spexin 1/2 neurons in the zebrafish CNS[J]. Sci Rep, 2019, 9(1): 5025. DOI:10.1038/s41598-019-41431-7 |
| [21] |
MILLS E G, IZZI-ENGBEAYA C, ABBARA A, et al. Functions of galanin, spexin and kisspeptin in metabolism, mood and behaviour[J]. Nat Rev Endocrinol, 2021, 17(2): 97-113. DOI:10.1038/s41574-020-00438-1 |
| [22] |
MARTINS R S, PINTO P I, GUERREIRO P M, et al. Novel galanin receptors in teleost fish: identification, expression and regulation by sex steroids[J]. Gen Comp Endocrinol, 2014, 205: 109-120. DOI:10.1016/j.ygcen.2014.06.030 |
| [23] |
LI L F, WEI S L, HUANG Q Y, et al. A novel galanin receptor 1a gene in zebrafish: tissue distribution, developmental expression roles in nutrition regulation[J]. Comp Biochem Physiol B Biochem Mol Biol, 2013, 164(3): 159-167. DOI:10.1016/j.cbpb.2012.12.004 |
| [24] |
KIM E, JEONG I, KIM S, et al. Distribution of galanin receptor 2b neurons and interaction with galanin in the zebrafish central nervous system[J]. Neurosci Lett, 2016, 628: 153-160. DOI:10.1016/j.neulet.2016.06.025 |
| [25] |
MENSAH E T, BLANCO A M, DONINI A, et al. Brain and intestinal expression of galanin-like peptide (GALP), galanin receptor R1 and galanin receptor R2, and GALP regulation of food intake in goldfish (Carassius auratus)[J]. Neurosci Lett, 2017, 637: 126-135. DOI:10.1016/j.neulet.2016.11.037 |
| [26] |
MUNOZ-CUETO J A, ZMORA N, PAULLADA-SALMERON J A, et al. The gonadotropin-releasing hormones: Lessons from fish[J]. Gen Comp Endocrinol, 2020, 291: 113422. DOI:10.1016/j.ygcen.2020.113422 |
| [27] |
WANG B, YANG G K, XU Y F, et al. Recent studies of LPXRFa receptor signaling in fish and other vertebrates[J]. Gen Comp Endocrinol, 2019, 277: 3-8. DOI:10.1016/j.ygcen.2018.11.011 |
| [28] |
MUNOZ-CUETO J A, PAULLADA-SALMERON J A, ALIAGA-GUERRERO M, et al. A journey through the gonadotropin-inhibitory hormone system of fish[J]. Front Endocrinol (Lausanne), 2017, 8: 285. DOI:10.3389/fendo.2017.00285 |
| [29] |
WANG B, MECHALY A S, SOMOZA G M. Overview and new insights into the diversity, evolution, role, and regulation of kisspeptins and their receptors in teleost fish[J]. Front Endocrinol (Lausanne), 2022, 13: 862614. DOI:10.3389/fendo.2022.862614 |
| [30] |
OHGA H, SELVARAJ S, MATSUYAMA M. The roles of kisspeptin system in the reproductive physiology of fish with special reference to chub mackerel studies as main axis[J]. Front Endocrinol (Lausanne), 2018, 9: 147. DOI:10.3389/fendo.2018.00147 |
| [31] |
ZHENG B B, LI S S, LIU Y, et al. Spexin suppress food intake in zebrafish: Evidence from gene knockout study[J]. Sci Rep, 2017, 7: 14643. DOI:10.1038/s41598-017-15138-6 |
| [32] |
TRUDEAU V L. Facing the Challenges of neuropeptide gene knockouts: Why do they not inhibit reproduction in adult teleost fish?[J]. Front Neurosci, 2018, 12: 302. DOI:10.3389/fnins.2018.00302 |
| [33] |
JEONG I, KIM E, SEONG J Y, et al. Overexpression of spexin 1 in the dorsal habenula reduces anxiety in zebrafish[J]. Front Neural Circuits, 2019, 13: 53. DOI:10.3389/fncir.2019.00053 |
| [34] |
MA A N, HE M L, BAI J, et al. Dual role of insulin in spexin regulation: Functional link between food intake and spexin expression in a fish model[J]. Endocrinology, 2017, 158(3): 560-577. |
| [35] |
LIM C H, SOGA T, LEVAVI-SIVAN B, et al. Chronic social defeat stress up-regulates spexin in the brain of nile tilapia (Oreochromis niloticus)[J]. Sci Rep, 2020, 10: 7666. DOI:10.1038/s41598-020-64639-4 |
 2023, Vol. 47
2023, Vol. 47