文章信息
- 孙洪潇, 唐文娇, 刘超, 耿慧霞, 林卓如, 张清春, 于仁成. 2023.
- SUN Hong-xiao, TANG Wen-jiao, LIU Chao, GENG Hui-xia, LIN Zhuo-ru, ZHANG Qing-chun, YU Ren-cheng. 2023.
- 秦皇岛近岸海域脂溶性藻毒素污染状况与来源分析
- Contamination status and origins of lipophilic marine toxins in Qinhuangdao coastal waters
- 海洋科学, 47(3): 41-48
- Marine Sciences, 47(3): 41-48.
- http://dx.doi.org/10.11759/hykx20220222002
-
文章历史
- 收稿日期:2022-02-22
- 修回日期:2022-05-06
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049;
4. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
5. 中国海洋大学海洋生命学院, 山东 青岛 266590
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. College of Marine Life Sciences, Ocean University of China, Qingdao 266590, China
海洋中的部分微藻可以产生高活性的藻毒素, 能够在双壳类等软体动物体内累积, 危害人类健康。目前已发现的赤潮藻毒素及其衍生物约有200多种[1], 根据其化学结构, 可以将常见藻毒素分为大田软海绵酸毒素(okadaic acid, OA)、扇贝毒素(pectenotoxin, PTX)、虾夷扇贝毒素(yessotoxin, YTX)、环亚胺类毒素(cyclicimine, CI)、氮杂螺环酸类(azaspiracid, AZA)、短裸甲藻毒素(brevetoxin, BTX)、软骨藻酸毒素(domoic acid, DA)和石房蛤毒素(saxitoxin, STX)等8类[2]。其中, 除DA和STX类毒素易溶于水外, 其他藻毒素因极性低, 更易溶于有机溶剂, 因此统称为脂溶性藻毒素(lipophilic marine toxins, LMTs)。因脂溶性藻毒素导致的中毒事件在全球许多沿海国家都有报道[3]。
近年来, 我国近海多次出现赤潮藻毒素导致的食用海产品中毒事件。2016年5月, 河北省秦皇岛海域发生了一起食用紫贻贝引起的中毒事件[4], 造成多人中毒, 类似中毒事件之后也有发生。对贝类和浮游植物的分析表明, 中毒事件是由麻痹性贝类毒素造成, 毒素主要来源于一种产毒的链状亚历山大藻(Alexandrium catenella)[5]。与我国近海其他海域相比, 秦皇岛近岸海域的链状亚历山大藻只产生高毒性的氨甲酰基类毒素, 导致中毒事件的风险较高。但是, 对于该海域脂溶性藻毒素污染状况缺少认识, 该海域是否存在脂溶性藻毒素导致中毒的风险不清, 有必要进行系统研究。
脂溶性藻毒素结构复杂, 种类繁多, 如何高效分析各类藻毒素是一个巨大的挑战。近年来, 随着液相色谱-质谱联用技术的快速发展, 液-质联用技术在脂溶性藻毒素分析中得到广泛应用[6]。由于各类脂溶性藻毒素的化学性质相近, 可以利用液相色谱对毒素进行初步分离, 结合质谱检测器强大的定性分析能力, 从而实现对各类藻毒素的同步检测。自2003年以来, 相关学者先后研发了多种脂溶性藻毒素的同步分析方法[7-9], 显著提高了对近海藻毒素污染状况的认识。应用液-质联用分析手段, 在我国近海采集的贝类、浮游植物、海水和沉积物等样品中检测到了OA、PTX、YTX、CI、AZA等大部分已知的脂溶性藻毒素[10-21], 为针对性地开展脂溶性藻毒素检测和监测奠定了基础。但是, 已有工作大多为短时间内完成的大面调查, 缺少对特定海域的长时间精细调查。在秦皇岛近岸海域, 长时间序列的精细调查也存在欠缺。
目前海洋中已知的脂溶性藻毒素主要由甲藻产生, 如鳍藻属(Dinophysis)、亚历山大藻属(Alexandrium)、裸甲藻属(Gymnodinium)、原甲藻属(Prorocentrum)、原多甲藻属(Protoperidinum)及凯伦藻属(Karenia)中的部分藻种等[2, 22]。在以往工作中, 对于调查海域脂溶性藻毒素的来源缺少针对性分析, 多数工作只能依据检测到的藻毒素组分, 结合对培养甲藻产毒状况的分析结果进行推测。近年来, 随着高通量测序技术的快速发展, 宏条码技术开始逐渐应用于浮游植物群落组成分析中[23], 在有害藻华研究中也得到了很好的应用。高通量测序方法可通过提供浮游植物组成的详细信息, 揭示我国近海有毒有害藻种的多样性, 也为染毒藻种的筛查提供了一种新的技术手段[16, 24-25]。
针对秦皇岛近岸海域潜在的藻毒素污染问题, 本研究选择多个采样点, 进行了为期一年的连续观测, 应用液-质联用方法分析了浓缩浮游植物和贝类样品中的藻毒素污染状况, 并通过宏条形码手段分析了鳍藻属藻种情况, 初步探讨了该海域脂溶性藻毒素的污染风险及其毒素来源。
1 材料与方法 1.1 样品采集与处理在渤海秦皇岛近岸海域设置四个采样点SHG-1 (119.74°N, 39.94°E)、SHG-2(119.80°N, 39.89°E)、SHG-3 (119.63°N, 39.90°E)和SHG-4(119.69°N, 39.84°E) (图 1), 进行样品采集。于2020年8月—2021年7月期间进行样品采集, 根据每次采样分析结果所反映出的藻华发生情况和贝类中毒素污染状况, 适当调整采样时间, 期间共采样15次。
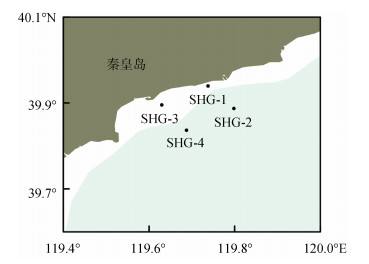 |
| 图 1 渤海秦皇岛近岸海域毒素样品采集站位示意图 Fig. 1 Sampling sites along the coast of Qinhuangdao in the Bohai Sea |
在每一站点泵采表层海水1 000 L, 先用孔径200 µm的筛绢过滤除去浮游动物后, 再用20 µm的筛绢浓缩, 并以过滤海水调整总体积至850 mL, 混匀后取200 mL浓缩液过滤到玻璃纤维滤膜(Whatman, GF/C, 英国)上, 置于–20 ℃冷冻保存, 用于脂溶性藻毒素分析; 另取50 mL藻液, 加入2~3 mL鲁格试剂固定, 常温下保存, 用于浮游植物形态鉴定。采集表层海水2 L, 以200 μm筛绢去除浮游动物后, 以聚碳酸酯滤膜(Millipore, HTTP04700, 美国)过滤, 控制抽滤泵压力 < 50 kPa, 滤膜放入冻存管后, 于液氮中保存, 用于浮游植物宏条形码分析。贝类样品采自SHG-1站位附近养殖区, 共采集贻贝样品13次, 在2021年4—5月的7次调查中还采集了扇贝和牡蛎样品。每次采集约1 kg新鲜贝类, 解剖取出软组织, 置于–20 ℃冷冻保存, 用于毒素分析。
1.2 脂溶性藻毒素分析脂溶性藻毒素提取参照实验室以往建立的方法[13-14], 简述如下: 取冷冻保存的滤膜, 以甲醇提取并定容至10 mL。取1 g贝类匀浆组织, 以甲醇提取并定容至10 mL。毒素粗提液采用Strata™-X固相萃取小柱进行净化, 将藻类提取液(5 mL)或贝类提取液(1 mL)以超纯水稀释成约30%(体积分数)的甲醇提取液上柱, 以1 mL 20%的甲醇溶液淋洗后, 抽干, 加入1.2 mL含0.3%氨水的甲醇洗脱, 洗脱液经0.22 μm有机相滤膜过滤后进行液-质联用分析。
脂溶性藻毒素分析参照Gerssen等建立的多类藻毒素同步分析方法[8], 并略作调整[13-14]。液-质联用系统包括超高效液相色谱仪(Thermo Fisher UltiMate3000, 美国)和三重四极杆线性离子阱质谱仪(AB Sciex, Qtrap®-4500, 美国)。色谱柱为C18反相色谱柱(Waters, X-bridge C18, 3.5 μm, 3 mm× 150 mm, 美国), 采用二元梯度洗脱, 流动相A为10%乙腈水溶液(6.7 mmol/L NH4OH, pH=11); 流动相B为90%乙腈水溶液(6.7 mmol/L NH4OH, pH=11), 具体分析过程参见Liu等[13]。质谱检测器先以标准毒素进行调谐, 设置质谱检测参数并对其优化。采用正负离子快速转换的扫描方式, 通过多反应模式(multiple reaction monitoring, MRM)对毒素进行检测, 其中在0~7.5 min采用负离子扫描模式, 分析检测OA、DTX1、YTX; 7.5~10 min采用正离子扫描模式, 分析检测AZA1; 10~14 min采用正离子扫描模式分析检测SPX1、GYM、PTX2, 具体检测参数Liu等[13]。
分析中采用的甲醇、乙腈均为色谱级(MERCK, 美国), 氨水色谱级, 含量为28%(Sigma, GER)。有证脂溶性标准藻毒素OA、DTX1、YTX、AZA1、PTX2、SPX1、GYM等购自加拿大国家研究院海洋生物科学研究所。
1.3 浮游植物宏条码分析浮游植物宏条码分析过程参照Chen等的方法[26], 简述如下: 以CTAB法提取浮游植物样品中的DNA, 采用真核生物V4区引物(正向引物D514 5′-TCCAGCTCCAATAGCGTA-3′, 反向引物B706R 5′-AATCCRAGAATTTCACCTCT-3′)进行PCR扩增, 扩增反应条件和过程参照Chen等[26]。扩增反应产物用1%琼脂糖凝胶电泳进行检测, 应用Illumina HiSeq2500平台对PCR产物进行测序, 测序工作由北京百迈客生物科技有限公司完成。原始数据经数据拆分、拼接、裁截、过滤和清洗后, 获得高质量序列, 使用Uparse软件(http://drive5.com/uparse/)将相似性≥97%以上的序列聚类成OTU, 以Silva 18S rDNA真核数据库(Release 119, https://www.arb-silva.de/documentation/release-119/)以及NCBI核酸数据库(https://blast.ncbi.nlm.nih.gov/)对获得的OTUs进行物种注释。从NCBI数据库中下载现有鳍藻属的18S rDNA V4区序列, 结合测序获得的OTU序列使用Mega软件(Version 7.0)构建OTU代表序列进化树(maximum likelihood, ML), 重复次数1 000。
1.4 浮游植物样品的显微镜观察采集的浮游植物样品参照Utermöhl (1958)方法沉降后, 在显微镜下观察。
1.5 数据统计分析采用SPSS 26.0进行统计学分析。通过Pearson相关系数进行相关性检验。P≤0.05时, 存在显著线性相关关系。
2 结果与讨论本次调查中, 在秦皇岛近岸海域采集的浓缩浮游植物样品和贝类样品中仅检出了PTX2毒素(图 2), 这与以往对渤海西部海域脂溶性藻毒素污染状况的认识基本一致。对四个采样点采集的浓缩浮游植物样品的检测结果表明, 浮游植物样品均可检出PTX2毒素(图 3)。其中SHG-3站位采集的样品中毒素含量明显高于SHG-1站位, 两个站位PTX2毒素含量的变化特征基本一致, 春季毒素含量最高, 在2021年4—5月份达到峰值, 最高含量分别达到350和1.00 ng/L; 秋季毒素含量也略有上升, 2020年10—11月毒素含量相对较高。以往调查中也发现, 渤海海域春夏季浮游植物样品中脂溶性藻毒素含量较高, 其中PTX2毒素含量最高可达1.11 ng/L, 与本研究在SHG-3站位的分析结果(1.14 ng/L)大致相当[13]。与浓缩浮游植物样品中毒素含量变化相似, 在本研究采集的贝类样品中, 也仅在2021年4月18—26日期间采集的样品中检测到PTX2毒素(图 4)。其中, 4月18日仅在牡蛎样品中检测到了PTX2毒素, 含量为0.77 μg/kg。在26日采集的贝类样品中, 贻贝、扇贝和牡蛎等三种贝类中均检测到了毒素, 其中牡蛎体内毒素含量最高, 达到1.10 μg/kg, 明显高于18日牡蛎样品中的毒素含量。扇贝和贻贝样品中的PTX2含量分别为0.62 μg/kg和0.50 μg/kg。这表明渤海海域PTX2毒素在春季最容易造成贝类染毒。与之相比, 北黄海海域双壳类中PTX2毒素含量在夏季最高[18], 而南海大亚湾采集的贝类样品中PTX2毒素含量在春、秋季最高, 这种区域差异可能与海域中产毒藻种丰度的季节变化有关[27]。
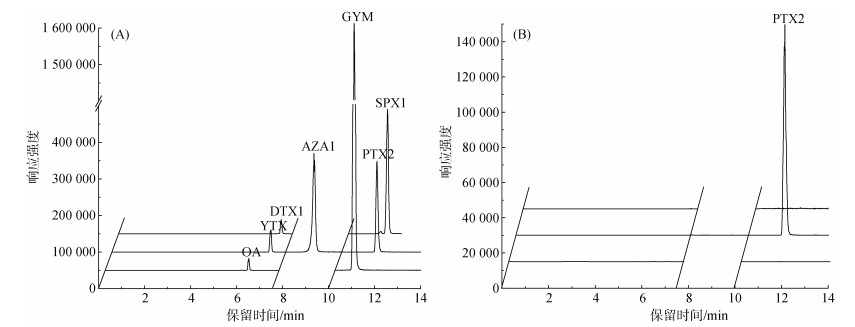 |
| 图 2 脂溶性藻毒素标准品(A)和2021年4月26日SHG-3站位浮游植物样品(B)的液-质联用分析谱图 Fig. 2 Liquid chromatography–tandem mass spectrometry chromatograms of the lipophilic toxin standards (A) and a net-concentrated phytoplankton sample (B) collected on April 26, 2021 |
 |
| 图 3 2020年9月—2021年7月秦皇岛近岸海域浓缩浮游植物样品中PTX2含量的变化情况 Fig. 3 Variation in pectenotoxin-2 content in net-concentrated phytoplankton samples collected from the coastal waters of Qinhuangdao from September 2020 to July 2021 |
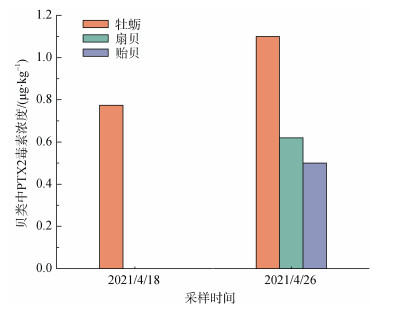 |
| 图 4 2021年4月秦皇岛近岸海域牡蛎、贻贝和扇贝体内PTX2含量情况 Fig. 4 Pectenotoxin-2 content in oysters, mussels, and scallops collected along the coast of Qinhuangdao in April 2021 |
刘仁沿等在对渤海贝类中脂溶性藻毒素的调查中, 在贝类样品中就只检测到了PTX2毒素, 且含量较低[28]。2014年, 柳阳等对渤海周边5处海域的浮游植物和贝类样品中的脂溶性藻毒素污染状况进行了调查, 发现PTX2、OA和DTX1等毒素含量较高, 此外还检测到了环亚胺类毒素SPX1和微量的GYM等毒素成分[14]。根据渤海脂溶性藻毒素的调查结果, 在渤海西部秦皇岛、汉沽和葫芦岛海域贝类中, PTX2是最为常见的脂溶性藻毒素成分, 在葫芦岛中的贝类中检测率高达83%, 秦皇岛样品中阳性检出率也有67%, 葫芦岛样品阳性率超过50%。除渤海外, 在我国近海其他海域采集的贝类样品中, PTX2毒素也是一种常见的毒素组分, 在北黄海、东海和南海的贝类样品中都有检出[18, 27]。其中, 北黄海和大亚湾的个别贝类样品中, PTX2毒素含量超过欧盟食品安全标准, 最高甚至超过1 000 μg/kg[18, 29]。与之相比, 渤海海域贝类样品中PTX2的阳性检出率较高, 但毒素含量很低, PTX2毒素含量均低于4.28 µg/kg, 与本研究中检测的最高毒素含量1.10 µg/kg处于同一量级。扇贝毒素属于大环内酯类毒素, 以往研究中常和腹泻性贝毒联系在一起, 但通常不会导致严重的腹泻症状。研究发现, PTX类毒素会对肝脏造成损伤, 因此又被称为肝损伤性贝毒(hepatotoxic shellfish poisoning, HSP)[22]。欧洲食品安全管理局建议PTX2在贝类中不能超过120 μg/kg, 欧盟设定的贝类食用安全控制标准为160 μg/kg。参照上述标准, 秦皇岛近岸贝类中的PTX2毒素不会导致中毒问题。
海洋中的PTX类毒素主要由鳍藻属中的倒卵形鳍藻(D. fortii), 尖锐鳍藻(D. acuta), 渐尖鳍藻(D. acuminata), 具尾鳍藻(D. caudata)、挪威鳍藻(D. norvegica)、三角鳍藻(D. tripos)、圆形鳍藻(D. rotundata)等产生[30-31]。在我国近海, 产毒鳍藻广泛分布[31-32]。PTX2是鳍藻中最为常见的毒素组分[33-34], 进入贝类后可被快速水解产生PTX2sa [33, 35]。对2021年4月各站位浮游植物样品中的鳍藻进行形态学鉴定发现, 海水中主要存在渐尖鳍藻、倒卵形鳍藻等鳍藻藻种。以往对两种鳍藻单细胞产毒特征的分析发现, 两种鳍藻均可以产生PTX2毒素[32], 推测秦皇岛近海浮游植物与贝类中的PTX2毒素可能来自倒卵形鳍藻和渐尖鳍藻。以往研究发现, 在烟台近海有较高密度的渐尖鳍藻和倒卵形鳍藻(200~600 cells/L), 在同一海域也检测到有高含量的OA、DTX1和PTX2, 总量可达2.0~9.0 ng/L[36]。北黄海和大亚湾海域中贝类毒素的变化也与渐尖鳍藻丰度的变化密切相关[27, 37]。
本研究选择高通量扩增的V4靶区, 对部分鳍藻藻种进行了种系进化关系分析, 结果表明, 鳍藻属藻种V4区序列差异很小, 多种产毒的光合自养型鳍藻聚成一簇(图 5), 无法对不同藻种进行甄别。但是, 该簇藻种主要由产毒鳍藻藻种构成, 具有产生PTX2等毒素的报道[19, 31, 38], 因此, 该OTU有可能代表产毒鳍藻。对采集浮游植物样品中表征该簇产毒鳍藻的OTU进行分析可以看出, 样品该OTU序列数与PTX毒素含量具有显著的正相关关系(P < 0.05, 图 6), 在一定程度上反映了PTX2毒素源自产毒鳍藻。值得说明的是, DNA提取及目标序列扩增偏好性对高通量测序结果影响很大, 如果采用更具特异性的qPCR方法, 可能会得到更加可靠的结果。因此, 基于V4丰度对PTX毒素乃至OA类毒素的指示意义值得进一步关注。
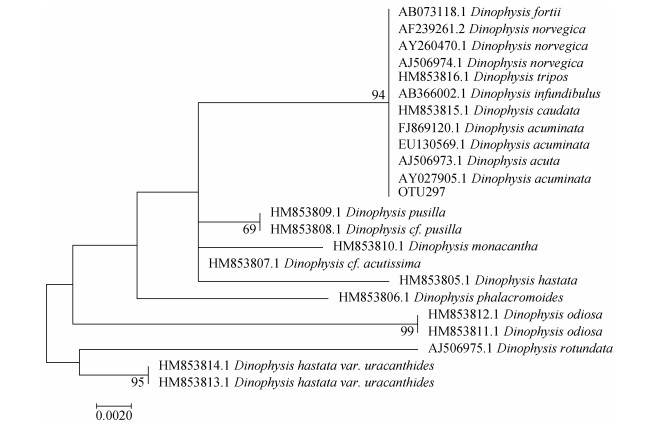 |
| 图 5 基于18S rRNA基因V4区序列分析的常见鳍藻藻种系统进化树(最大似然法) Fig. 5 Phylogenetic tree established for Dinophysis species based on the V4 region sequences of the 18S rRNA gene |
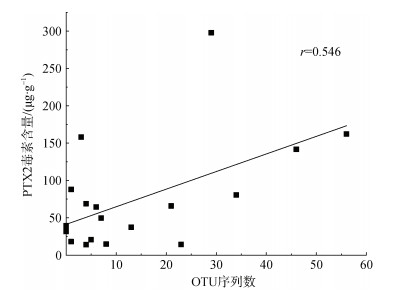 |
| 图 6 2020年8月~2021年7月秦皇岛浮游植物样品中有毒鳍藻OTU数与PTX2含量的相关关系 Fig. 6 Correlation between the operational taxonomic unit number representing toxic Dinophysis spp. and pectenotoxin-2 content in net-concentrated phytoplankton samples collected in the coastal waters of Qinhuangdao from August 2020 to July 2021 |
本文应用高效液相色谱-质谱联用和高通量测序等手段, 对秦皇岛近岸海域2020—2021年采集的浮游植物和贝类样品进行了分析, 发现秦皇岛近海浮游植物和贝类样品中均可检出PTX2毒素, 毒素含量在春季(4—5月)达到最高, 但贝类样品中的PTX2毒素含量很低, 因此秦皇岛海域脂溶性藻毒素引发中毒事件的风险不大。高通量测序和形态学观察结果表明, 样品中的PTX2毒素主要来自渐尖鳍藻和倒卵形鳍藻等有毒藻种, 选择V4区序列有可能指示浮游植物中PTX毒素含量的变化。
| [1] |
GERSSEN A, MULDER P P, DE BOER J. Screening of lipophilic marine toxins in shellfish and algae: development of a library using liquid chromatography coupled to orbitrap mass spectrometry[J]. Analytica Chimica Acta, 2011, 685(2): 176-185. DOI:10.1016/j.aca.2010.11.036 |
| [2] |
FAO. Marine biotoxins food and nutrition paper. Rome: food and agriculture organizaition of the United Nations[EB/OL]. 2004.
|
| [3] |
LASSUS P, CHORMERAT N, HESS P, et al. Toxic and Harmful Microalgae of the World Ocean[M]. Denmark: International Society for the Study of Harmful Algae/ Intergovernmental Oceanographic Commission of UNESCO, 2016: 68.
|
| [4] |
DING L, QIU J B, LI A F. Proposed biotransformation pathways for new metabolites of paralytic shellfish toxins based on field and experimental mussel samples[J]. Journal of Agricultural and Food Chemistry, 2017, 65: 5494-5502. DOI:10.1021/acs.jafc.7b02101 |
| [5] |
YU R C, ZHANG Q C, LIU Y, et al. The dinoflagellate Alexandrium catenella producing only carbamate toxins may account for the seafood poisonings in Qinhuangdao, China[J]. Harmful Algae, 2021, 102: 101980. |
| [6] |
QUILLIAM M A. The role of chromatography in the hunt for red tide toxins[J]. Journal of Chromatography A, 2003, 1000(1/2): 527-548. |
| [7] |
STOBO L A, LACAZE J, SCOTT A, et al. Liquid chromatography with mass spectrometry-Detection of lipophilic shellfish toxins[J]. Journal of Aoac International, 2005, 88(5): 1371-1382. DOI:10.1093/jaoac/88.5.1371 |
| [8] |
GERSSEN A, MULDER P P J, MCELHINNEY M A, et al. Liquid chromatography-tandem mass spectrometry method for the detection of marine lipophilic toxins under alkaline conditions[J]. Journal of Chromatography A, 2009, 1216(9): 1421-1430. DOI:10.1016/j.chroma.2008.12.099 |
| [9] |
THESE A, SCHOLZ J, PREISS-WEIGERT A. Sensitive method for the determination of lipophilic marine biotoxins in extracts of mussels and processed shellfish by high-performance liquid chromatography-tandem mass spectrometry based on enrichment by solid-phase extraction[J]. Journal of Chromatography A, 2009, 1216(21): 4529-4538. DOI:10.1016/j.chroma.2009.03.062 |
| [10] |
刘仁沿, 高春蕾, 梁玉波, 等. Gymnodimine, 首次在我国北海缘齿牡蛎中发现的一种腹泻性贝毒组分[J]. 海洋学报, 2008, 30(6): 171-176. LIU Renyan, GAO Chunlei, LIANG Yubo, et al. First evidence of Gymnodimine in Dendostrea crenulifrea collected from the coast of Beihai, China[J]. Acta Oceanologica Sinica, 2008, 30(6): 171-176. DOI:10.3321/j.issn:0253-4193.2008.06.021 |
| [11] |
高春蕾, 刘仁沿, 梁玉波, 等. 虾夷扇贝毒yessotoxins (YTXs), 中国沿海贝类中首次发现的一组贝类生物毒素[J]. 海洋学报, 2010, 32(3): 129-137. GAO Chunlei, LIU Renyan, LIANG Yubo, et al. First report of the presence of yessotoxins (YTXs) in shellfish from China's coastal areas[J]. Acta Oceanologica Sinica, 2010, 32(3): 129-137. |
| [12] |
LIU R Y, LIANG Y B, WU X L, et al. First report on the detection of pectenotoxin groups in Chinese shellfish by LC-MS/MS[J]. Toxicon, 2011, 57(7/8): 1000-1007. |
| [13] |
LIU Y, YU R C, KONG F Z, et al. Lipophilic marine toxins discovered in the Bohai Sea using high performance liquid chromatography coupled with tandem mass spectrometry[J]. Chemosphere, 2017, 183: 380-388. DOI:10.1016/j.chemosphere.2017.05.073 |
| [14] |
LIU Y, YU R C, KONG F Z, et al. Contamination status of lipophilic marine toxins in shellfish samples from the Bohai Sea, China[J]. Environmental Pollution, 2019, 249: 171-180. DOI:10.1016/j.envpol.2019.02.050 |
| [15] |
LIU Y, ZHANG P, DU S, et al. Sediment as a potential pool for lipophilic marine phycotoxins with the case study of Daya Bay of China[J]. Marine Drugs, 2019, 17(11): 1-13. |
| [16] |
CHEN J H, LI X, WANG S, et al. Screening of lipophilic marine toxins in marine aquaculture environment using liquid chromatography-mass spectrometry[J]. Chemosphere, 2017, 168: 32-40. DOI:10.1016/j.chemosphere.2016.10.052 |
| [17] |
HE X P, CHEN J H, WU D N, et al. Distribution characteristics and environmental control factors of lipophilic marine algal toxins in Changjiang estuary and the adjacent East China Sea[J]. Toxins, 2019, 11(10): 596. DOI:10.3390/toxins11100596 |
| [18] |
WU H Y, LUAN Q S, GUO M M, et al. Phycotoxins in scallops (Patinopecten yessoensis) in relation to source, composition and temporal variation of phytoplankton and cysts in North Yellow Sea, China[J]. Marine Pollution Bulletin, 2018, 135: 1198-1204. DOI:10.1016/j.marpolbul.2018.08.045 |
| [19] |
LI A F, SUN G, QIU J B, et al. Lipophilic shellfish toxins in Dinophysis caudata picked cells and in shellfish from the East China Sea[J]. Environmental Science and Pollution Research, 2015, 22: 3116-3126. DOI:10.1007/s11356-014-3595-z |
| [20] |
LI M H, SUN G, QIU J B, et al. Occurrence and variation of lipophilic shellfish toxins in phytoplankton, shellfish and seawater samples from the aquaculture zone in the Yellow Sea, China[J]. Toxicon, 2017, 127: 1-10. DOI:10.1016/j.toxicon.2016.12.009 |
| [21] |
WANG Y L, CHEN J H, LI Z Y, et al. Determination of typical lipophilic marine toxins in marine sediments from three coastal bays of China using liquid chromatography tandem mass spectrometry after accelerated solvent extraction[J]. Marine Pollution Bulletin, 2015, 101: 954-960. DOI:10.1016/j.marpolbul.2015.10.038 |
| [22] |
DARANAS A H. Toxic marine microalgae[J]. Toxicon, 2001, 39: 1101-1132. DOI:10.1016/S0041-0101(00)00255-5 |
| [23] |
陈楠生. 有害藻华的宏条形码分析: 机会与挑战[J]. 海洋科学, 2020, 44(7): 116-134. CHEN Nansheng. Metabarcoding analysis of harmful algal blooms: Opportunities and challenges[J]. Marine Sciences, 2020, 44(7): 116-134. |
| [24] |
LIU S Y, Gibson K, CUI Z M, et al. Metabarcoding analysis of harmful algal species in Jiaozhou Bay[J]. Harmful Algae, 2020, 92: 101772. DOI:10.1016/j.hal.2020.101772 |
| [25] |
CHEN Y, XU Q, Gibson K, et al. Metabarcoding dissection of harmful algal bloom species in the East China Sea off Southern Zhejiang Province in late spring[J]. Marine Pollution Bulletin, 2021, 169: 112586. DOI:10.1016/j.marpolbul.2021.112586 |
| [26] |
CHEN Z F, ZHANG Q C, KONG F Z, et al. Resolving phytoplankton taxa based on high-throughput sequencing during brown tides in the Bohai Sea, China[J]. Harmful Algae, 2019, 84: 127-138. DOI:10.1016/j.hal.2019.03.011 |
| [27] |
JIANG T, LIU L, LI Y, et al. Occurrence of marine algal toxins in oyster and phytoplankton samples in Daya Bay, South China Sea[J]. Chemosphere, 2017, 183: 80-88. DOI:10.1016/j.chemosphere.2017.05.067 |
| [28] |
刘仁沿, 梁玉波, 刘磊, 等. 液相色谱结合串联质谱方法研究中国沿海贝类中脂溶性藻毒素的种类结构和分布规律[J]. 生态环境学报, 2014, 23(8): 1320-1326. LIU Renyan, LIANG Yubo, LIU Lei, et al. The lipophilic phycotoxins profile and distribution in bivalve shellfish of Chinese coasts by high performance liquid chromatography coupled with mass spectrometry[J]. Ecology and Environmental Sciences, 2014, 23(8): 1320-1326. |
| [29] |
张秀尧, 蔡欣欣. 东海染毒紫贻贝中贝类毒素的分离和鉴定[J]. 卫生研究, 2012, 41(5): 819-823. ZHANG Xiuyao, CAI Xinxin. Isolation and identification of shellfish toxins from contaminated blue mussel (Mytilus edulis) from the East China Sea[J]. Journal of Hygiene Research, 2012, 41(5): 819-823. |
| [30] |
KAMIYAMA T, SUZUKI T. Production of dinophysistoxin-1 and pectenotoxin-2 by a culture of Dinophysis acuminata (Dinophyceae)[J]. Harmful Algae, 2009, 8(2): 312-317. DOI:10.1016/j.hal.2008.07.003 |
| [31] |
LI Z X, GUO M X, YANG S G, et al. Investigation of pectenotoxin profiles in the Yellow Sea (China) using a passive sampling technique[J]. Marine Drugs, 2010, 8(4): 1263-1272. DOI:10.3390/md8041263 |
| [32] |
罗璇. 青岛近海鳍藻种群动态与产毒特征研究[D]. 北京: 中国科学院大学, 2011. LUO Xuan. Population dynamics and toxin production of Dinophysis species in the coastal waters of Qingdao[D]. Beijing: University of Chinese Academy of Sciences, 2011. |
| [33] |
SUZUKI T, BEUZENBERG V, MACKENZIE L, et al. Liquid chromatography-mass spectrometry of spiroketal stereoisomers of pectenotoxins and the analysis of novel pectenotoxin isomers in the toxic dinoflagellate Dinophysis acuta from New Zealand[J]. Journal of Chromatography A, 2003, 992(1/2): 141-150. |
| [34] |
MACKENZIE L, BEUZENBERG V, HOLLAND P, et al. Pectenotoxin and okadaic acid-based toxin profiles in Dinophysis acuta and Dinophysis acuminata from New Zealand[J]. Harmful Algae, 2005, 4(1): 75-85. DOI:10.1016/j.hal.2003.12.001 |
| [35] |
MILES C O, WILKINS A L, SAMDAL I A, et al. A novel pectenotoxin, PTX-12, in Dinophysis spp. and shellfish from Norway[J]. Chemical Research in Toxicology, 2004, 17: 1423-1433. DOI:10.1021/tx049870a |
| [36] |
陈建华, 于仁成, 孔凡洲, 等. 北黄海海域虾夷扇贝体内脂溶性藻毒素分析[J]. 海洋与湖沼, 2014, 45(4): 855-863. CHEN Jianhua, YU Rencheng, KONG Fanzhou, et al. Detection of lipophilic phycotoxin in Patinopecten Yessoensis in the northern Yellow Sea[J]. Oceanologia et Limnologia Sinica, 2014, 45(4): 855-863. |
| [37] |
宫长宝, 冯志权, 王丽, 等. 獐子岛海域浮游甲藻及有毒微藻的年际变化研究[J]. 海洋与湖沼, 2019, 50(3): 672-683. GONG Changbao, FENG Zhiquan, WANG Li, et al. Study on the interannual variation of planktonic dinoflagellates and toxic microalgae in the sea area around the Zhangzi Island, NE China[J]. Oceanologia et Limnologia Sinica, 2019, 50(3): 672-683. |
| [38] |
SUZUKI T, MIYAZONO A, BABA K, et al. LC-MS/MS analysis of okadaic acid analogues and other lipophilic toxins in single-cell isolates of several Dinophysis species collected in Hokkaido, Japan[J]. Harmful Algae, 2009, 8: 233-238. |
 2023, Vol. 47
2023, Vol. 47


