文章信息
- 卫茂生, 王清池, 耿丽华, 岳洋, 孙超岷, 张全斌. 2023.
- WEI Mao-sheng, WANG Qing-chi, GENG Li-hua, YUE Yang, SUN Chao-min, ZHANG Quan-bin. 2023.
- 南海细菌胞外多聚物的神经保护活性筛选
- Screening of bacterial extracellular polymeric substances with neuroprotective activity from the South China Sea
- 海洋科学, 47(3): 79-88
- Marine Sciences, 47(3): 79-88.
- http://dx.doi.org/10.11759/hykx20210301001
-
文章历史
- 收稿日期:2021-03-01
- 修回日期:2021-05-04
2. 海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
海洋蕴含丰富的生物资源[1-2], 是探索海洋生物多样性、发现活性天然产物的巨大资源宝库[3]。生命在海洋中孕育发展, 经过35亿年的漫长演化, 海洋生物已经适应了环境中敌对介质的胁迫, 进化出多种方式应对环境压力[4]。广阔复杂的海洋生物圈生存着具有独特代谢功能的细菌[5-7], 据估计, 海洋中91%的微生物资源未被有效发掘利用[8]。海洋细菌能够适应复杂的海洋环境条件, 甚至在深海、极地等极端环境下也能生存, 而且独特的海洋环境使海洋细菌的代谢方式也区别于陆源细菌, 包括活跃的次级代谢过程[9-10]。以陆源细菌为工程菌提取活性产物的研究已开展多年[11], 从中发现结构和活性新颖的先导化合物的限制变大, 所以着眼于海洋细菌, 尤其是源于极端生境细菌的活性分子的发现和分离已成为研究天然产物的新热点[12-15]。
细菌在海洋中扮演着至关重要的角色, 包括驱动生物地化循环以及作为分解者广泛参与能量循环和物质传递等过程[16-17]。细菌能遍布地球各处与其表观可塑性密不可分[18-19], 其自身产生的胞外聚合物(extracellular polymeric substance, EPS)发挥着很大的作用[20-21]。EPS使得细菌可以粘附在物质表面[22], 能够保护单个细胞免受环境压力[23]。尤其是在极端环境中, EPS有助于协助细菌摄取营养物质和释放代谢废物, 缓冲pH值和渗透压的波动来维持细菌外部微环境的稳态[24], 为群体感应提供介质以及促进遗传信息交流或者避免捕食[25-26]。可以说, 合成EPS是海洋细菌生存不可或缺的能力[21]。
从已有报道来看, 细菌EPS由多糖、蛋白质以及脂类组成, 还含有少量核酸、磷酸盐或硫酸盐[20]。EPS中的多糖成分大多由3~4种单糖组成的杂多糖构成[25], 其电荷来源于糖醛酸、氨基糖或者取代基团, 如硫酸基团或者磷酸基团。多糖复杂多样的结构特点拓展了EPS的应用范围[27]。天然来源的多糖通常具有多种生物活性, 而且安全性较高, 受到越来越多的关注[28-30]。EPS作为天然多糖宝库中初露头角的资源[31], 有着巨大的开发潜力, 尤其是来源于深海细菌种群的EPS。
1 材料与方法 1.1 样本来源细菌菌株由中国科学院海洋研究所孙超岷课题组惠赠, 样品采自中国南海北部。采样地理信息详情见表 1。
| 时间 | 经度 | 纬度 | 水深/m | x(CO2) / (mg L–1) | p(CO2) /Pa | CH4/ (μmol·L–1) | 盐度 | 温度/℃ |
| 2017年9月17日 | 119°17′04.956″E | 22°06′58.384″N | 1 143 | 812.34 | 82.71 | 13.3 | 34.544 | 3.674 |
| 注: x(CO2): 二氧化碳柱平均干空气混合比, p(CO2): 二氧化碳分压 | ||||||||
将活化两次的细菌接种于100 mL Zobell 2216E培养基(蛋白胨5 g/L, 酵母粉1 g/L, 磷酸高铁0.01 g/L, 过滤后的海水配制), 在28 ℃, 120 r/min条件下培养12 h。将指数期的种子培养基按照10%(v/v)的比例接种到装有300 mL额外添加10%(w/v)蔗糖的2216E培养基的500 mL锥形瓶中, 在相同的培养条件下培养2 d。培养液经4 000 r/min离心15 min后, 收集上清用4倍乙醇沉淀, 在4 ℃下过夜。过滤, 将滤渣重新溶解后经4 000 r/min离心15 min, 再将上清液浓缩并真空干燥后制得EPS。
1.3 细胞培养人神经母细胞瘤SH-SY5Y细胞由青岛大学(中国青岛)惠赠。将细胞保持在DME/F12(Hyclone)中, 该培养基含有5%的胎牛血清(Gibco)和1%的青链霉素(Gibco), 置于37 ℃、5%CO2培养箱中培养。当细胞密度达到约80%时, 将细胞消化后进一步培养。显微镜下观察细胞形态, 当细胞处于对数生长期时为实验最佳状态。
1.4 细胞模型的建立将100 μL对数期SH-SY5Y细胞按5×103个/孔的密度接种于96孔板中培养24 h后, 弃去原培养液, 加入梯度剂量的过氧化氢(H2O2)(剂量分别为25、50、75、100、125、150、175、200 μmol/L)配制的完全培养基100 μL孵育24 h, 按四甲基偶氮唑蓝(methyl thiazolyl tetrazolium, MTT)测定法测定IC50值。
1.5 细胞毒性测定MTT测定法测量EPS对SH-SY5Y细胞的毒性作用。具体方法: 将100 μL对数期SH-SY5Y细胞按5×103个/孔的密度接种于96孔板中培养24 h后, 弃去原培养液, 加入800 μg·mL–1的EPS配制的完全培养基100 μL孵育24 h, 向处理的细胞中加入5 mg·mL–1的MTT10 μL继续孵育4 h, 吸去上清, 加入150 μL DMSO充分溶解, 使用Infinite M1000 PRO酶标仪(TECAN, 瑞士)在490 nm下测量反应产物的光密度值(OD)。
1.6 EPS体外活性的评价将100 μL对数期SH-SY5Y细胞按5×103个/孔的密度接种于96孔板中培养24 h后, 弃去原培养液, 加入800 μg·mL–1的不同EPS配制的完全培养基100 μL孵育2 h后, 加入100 μL两倍IC50剂量浓度的H2O2继续孵育24 h后按上述MTT法测定细胞活力, 评价EPS对H2O2损伤的保护能力。
1.7 一般分析方法采用Bradford蛋白检测试剂盒(碧云天, 中国上海)对蛋白质含量进行分析。采用苯酚硫酸法测定总糖含量。
1.8 EPS分子量测定采用高效凝胶渗透色谱(HPGPC)法分析EPS的分子量, 色谱柱为TSK GEL G3000HXL柱(300 mm× 7.8 mm, 7 μm)(TOSOH, 日本), 流动液为0.05 mol/L Na2SO4, 流速为0.50 mL/min。配制10 mg/mL的EPS溶液, 注射前用0.22 μm膜滤过。以右旋糖酐为标准品(9 750、13 050、36 800、64 650、135 350、300 600 Da), 进样体积为20 μL。
1.9 EPS单糖组成测定配制10 mg·mL–1 EPS溶液, 经4 mol/L三氟乙酸(TFA)在105 ℃下酸水解5 h。恢复至室温, 2 mol/L NaOH中和后, 将100 μL的水解液与0.3 mol/L NaOH (100 μL)和0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(PMP)甲醇溶液(120 μL)在70 ℃水浴条件下混合反应1 h。将衍生化溶液冷却至室温, 用0.3 mol/L HCl中和, 然后用氯仿(0.5 mL)萃取三次, 收集上层水相。经0.22 μm滤膜过滤后, 按20 μL体积进样分析。PMP衍生物的色谱分离采用C18色谱柱(4.6 mm× 250 mm, 5 µm)(Agilent, 美国), 使用0.1 mol/L磷酸盐缓冲液(pH 6.8)和乙腈做流动相, 调节比例为83∶17(v/v, %), 流速为0.8 mL/min。色谱柱温度维持在30 ℃, PDA检测波长为245 nm。11种标准单糖分别为D-甘露糖、D-氨基葡萄糖ž氯化氢、L-鼠李糖、D-葡萄糖醛酸、D-半乳糖醛酸、D-氨基半乳糖ž氯化氢、D-半乳糖、D-木糖、D-阿拉伯糖和L-岩藻糖(Sigma-Aldrich, 美国)。PMP柱前衍生后的标准单糖同样按上述方法测定。
1.10 EPS硫酸基含量测定配制10 mg·mL–1 EPS溶液, 经2 mol/L盐酸在105 ℃下酸水解4 h。恢复至室温, 氨水中和后定容至5 mL, 过0.22 μm膜备用。硫酸钾配制标准品溶液, 明胶氯化钡法测定硫酸基含量。
1.11 活性菌株鉴定及保藏上述在28 ℃培养24 h的活性细菌由北京擎科生物技术有限公司青岛分部进行全16S rDNA基因序列分析, 前后引物分别是7F, 1540R。所得序列上传NCBI数据库并利用BLAST功能进行序列比对。从GenBank数据库中下载相关的菌株序列信息, 使用MEGA、Jmodeltest和PhyML[32]确定最佳算法, 所得拓扑结构由Figtree绘制进化树。纯菌株保藏于–80 ℃甘油冻存液(20%, w/v)中。
2 结果与分析 2.1 深海细菌EPS体外神经保护活性筛选细胞内时时刻刻发生着氧化还原过程, 因而不可避免地产生活性氧, 如超氧阴离子、羟基自由基、过氧化氢等[33]。这些活性氧诱导氧化应激, 导致线粒体、蛋白质、DNA和膜脂功能障碍, 最终破坏细胞功能和完整性。H2O2可诱导多种细胞凋亡, 并作为活性氧的前体。此外, H2O2容易在细胞和组织中扩散。所以, H2O2可以作为损伤剂应用于评价先导化合物的神经保护活性。实验结果表明, 浓度范围在50~200 μmol/L的H2O2可损伤SH-SY5Y细胞, IC50剂量浓度在100 μmol/L~125 μmol/L范围内(图 1a), 为避免过度损伤, 设定100 μmol/L H2O2为模型组剂量。图 1b表明, EPS在800 μg/mL的浓度下, MTT法检测细胞活力均高于70%。据标准ISO10993-5[34]所述, 细胞活力不低于70%, 可视为没有细胞毒性。因此, EPS在0~800 μg·mL–1时无明显细胞毒性。EPS体外孵育2 h后, 给予100 μmol/L H2O2损伤。同对照组相比, 仅给予H2O2作为氧化损伤模型组(Neg), 给予EPS和H2O2作为实验组。我们从南海北部海域共分离培养得到97种菌株, 分别培养发酵获得EPS, 经实验确定, 其中共有16种EPS(编号为4、20、24、31、38、40、52、63、64、68、73、76、78、89、90、92, 表 2)在剂量浓度为800 μg·mL-1时能够使得氧化损伤后的细胞活力大于90%, 表明具有显著的神经保护活性(图 1c)。其中, 编号为24、68、89、90的EPS活性最为显著。
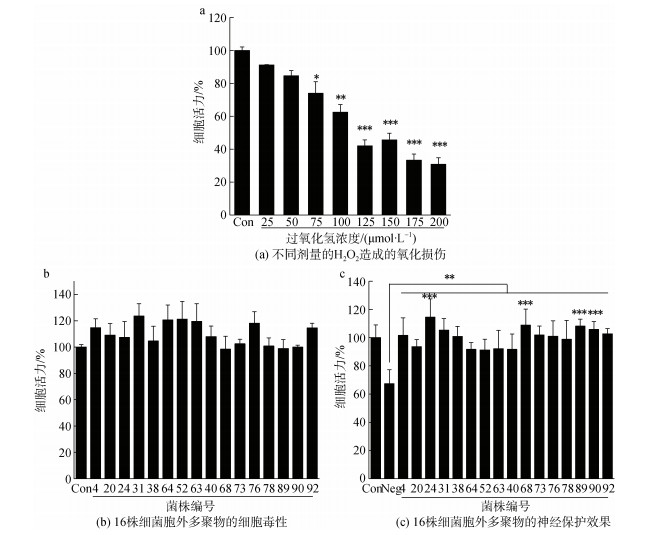 |
| 图 1 胞外多聚物的体外神经保护能力 Fig. 1 Neuroprotective ability of EPS in vitro 注: EPS: 胞外聚合物; Con: 对照组; Neg: 模型组; *P < 0.05, **P < 0.01, ***P < 0.001 |
| 编号 | 总糖含量/% | 蛋白含量/% | SO42–含量/% | 分子量分布/kDa | |||
| > 200 kDa | 10~200 kDa | < 10 kDa | |||||
| 放线菌门 | |||||||
| 63 | 19.71±1.51 | 19.05±2.11 | 10.32±1.06 | 681.2 | 38.0 | 5.1, 2.0 | |
| 厚壁菌门 | |||||||
| 4 | 14.62±1.59 | 16.92±0.87 | 3.91±0.35 | 252.2 | 30.2 | 2.0 | |
| 20 | 14.06±0.20 | 18.50±3.40 | 8.78±0.18 | — | 34.0 | 3.0 | |
| 64 | 14.35±2.93 | 20.62±6.05 | 2.91±0.23 | — | 34.8, 23.8 | 5.3 | |
| 73 | 18.49±1.23 | 26.18±4.42 | 4.46±1.18 | 298.5 | 27.5 | 2.4 | |
| 76 | 21.40±0.67 | 20.42±4.05 | 16.39±2.70 | 254.4 | 35.5 | 1.6 | |
| 68 | 17.35±1.19 | 27.34±2.60 | 22.05±1.84 | 572.4 | 37.2 | 1.9 | |
| 38 | 16.68±0.95 | 21.25±4.50 | 13.22±0.04 | 226.4 | 42.0 | 1.6 | |
| 78 | 18.34±1.70 | 31.05±5.70 | 5.79±0.22 | 321.0 | 37.1 | 1.8 | |
| 40 | 17.29±0.74 | 15.61±1.92 | 7.90±0.26 | 278.4 | 37.2 | 1.6 | |
| 变形菌门 | |||||||
| 89 | 15.38±0.90 | 25.48±7.05 | 26.53±1.20 | — | — | 4.6, 1.1 | |
| 24 | 17.14±3.17 | 20.62±0.03 | 13.09±0.60 | 251.9 | 43.8 | 6.6, 3.0 | |
| 31 | 15.96±2.08 | 10.66±0.32 | 3.84±0.31 | — | 44.8 | 5.1, 1.8 | |
| 90 | 14.58±0.27 | 29.49±2.05 | 13.02±1.78 | — | 36.2 | 2.0 | |
| 92 | 18.46±2.62 | 28.29±4.18 | 18.01±0.19 | — | 40.3 | 4.8, 1.9 | |
| 52 | 15.76±0.52 | 14.15±0.93 | 1.38±0.11 | 285.7 | 17.8 | 2.8, 1.0 | |
对16种EPS分别测定了化学组成, 结果见表 2和表 3, 从总糖含量、蛋白含量及硫酸基含量来看, 传统的醇沉水溶的方式得到的EPS成分复杂, 苯酚硫酸法测定总糖含量在14.06%~21.40%之间, BCA法测定蛋白含量在10.66%~31.05%之间, 明胶氯化钡法测定硫酸基含量在2.91%~26.53%之间。HPGPC分析证明EPS分子量有较大的分布范围(表 2), 呈现三段分布, 采用分子排阻分离的方法可实现有效的分离纯化。16种EPS的单糖组成如表 3所示, 甘露糖、氨基葡萄糖、葡萄糖醛酸、氨基半乳糖、葡萄糖、半乳糖六种单糖的含量较高, 部分EPS中含有岩藻糖和鼠李糖。考虑到发酵培养基中含有酵母粉, 单糖组成主要是甘露糖和半乳糖, 发酵提取过程有少部分培养基残留, 因此EPS中甘露糖和葡萄糖的含量相对偏高, 但稀有单糖如氨基葡萄糖、葡萄糖醛酸、氨基半乳糖、岩藻糖和鼠李糖证明活性菌株存在独特的代谢方式。
| 编号 | 单糖组成(摩尔比) | |||||||
| 甘露糖 | 氨基葡萄糖 | 鼠李糖 | 葡萄糖醛酸 | 氨基半乳糖 | 葡萄糖 | 半乳糖 | 岩藻糖 | |
| 放线菌门 | ||||||||
| 63 | 0.10 | 0.05 | — | 0.05 | 0.03 | 1.00 | 0.05 | — |
| 厚壁菌门 | ||||||||
| 4 | 1.00 | 0.59 | — | 0.26 | 0.12 | 0.84 | 0.70 | — |
| 20 | 0.20 | 0.08 | — | 0.07 | 0.04 | 1.00 | 0.08 | — |
| 64 | 1.00 | 0.25 | — | 0.28 | 0.12 | 0.78 | 0.15 | — |
| 73 | 1.00 | 0.14 | 0.27 | 0.26 | 0.11 | 0.81 | 0.14 | 0.26 |
| 76 | 1.00 | 0.13 | — | 0.34 | — | 0.80 | 0.15 | 0.02 |
| 68 | 0.13 | — | — | 0.04 | — | 1.00 | 0.04 | — |
| 38 | 1.00 | 0.10 | — | 0.07 | 0.06 | 0.36 | 0.11 | — |
| 78 | 1.00 | 0.30 | — | 0.29 | 0.15 | — | 0.21 | 0.12 |
| 40 | 1.00 | 0.20 | 0.26 | 0.21 | — | 0.81 | — | — |
| 变形菌门 | ||||||||
| 89 | 0.22 | 0.08 | — | 0.07 | 0.04 | 1.00 | 0.08 | — |
| 24 | 0.92 | 0.17 | — | 0.20 | 0.10 | 1.00 | 0.44 | 0.31 |
| 31 | 1.00 | 0.33 | — | 0.57 | 0.21 | — | 0.33 | — |
| 90 | 0.20 | 0.10 | — | — | — | 1.00 | — | — |
| 92 | 0.19 | 0.06 | — | 0.06 | 0.03 | 1.00 | 0.05 | — |
| 52 | 1.00 | 0.37 | — | 0.23 | 0.12 | 0.83 | 0.25 | — |
将上述16种EPS对应编号的菌株活化后, 分别以7F, 1540R作前后引物进行16S rDNA全序列分析, 鉴定结果如表 4所示。结果表明, 16株深海细菌归属于3门8科9属16种。三个门类: 放线菌门(Actinobacteria, 1/16), 厚壁菌门(Firmicutes, 9/16)和变形菌门(Proteobacteria, 6/16)。厚壁菌门有两个科类: Bacillaceae(8/9), Planococcaceae(1/9); 变形菌门有五个科类: Halomonadaceae(2/6), Alteromonadaceae(1/6), Phyllobacteriaceae(1/6), Pseudomonadaceae(1/6), Stenotrophomonas(1/6)。在种的分类地位上, 有8株不同的芽孢杆菌和2株不同的盐单胞菌。
| 编号 | 种 | 科 | 属 | NCBI编号 | 一致性/% |
| Actinobacteria Phylum | |||||
| 63 | Dietzia maris | Dietziaceae | Dietzia | MT534560.1 | 100.00 |
| Firmicutes Phylum | |||||
| 4 | Bacillus cereus | Bacillaceae | Bacillus | MG011544.1 | 99.93 |
| 20 | Bacillus subtilis | MT645613.1 | 100.00 | ||
| 64 | Bacillus sp.BA(2014) | KM054693.1 | 99.72 | ||
| 73 | Bacillus sp. YDC2-P | EU781520.1 | 99.66 | ||
| 76 | Bacillus sp.(in: Bacteria) | MG309534.1 | 99.86 | ||
| 68 | Bacillus thuringiensis | KY316407.1 | 99.93 | ||
| 38 | Bacillus toyonensis | MT605503.1 | 100.00 | ||
| 78 | Cytobacillus firmus | Cytobacillus | MF177874.1 | 100.00 | |
| 40 | Jeotgalibacillus alimentarius | Planococcaceae | Jeotgalibacillus | MN865989.1 | 99.72 |
| Proteobacteria Phylum | |||||
| 89 | Halomonas aquamarina | Halomonadaceae | Halomonas | EU440965.1 | 99.86 |
| 24 | Halomonas sp. | LC507431.1 | 100.00 | ||
| 31 | Marinobacter sp. HO54 | Alteromonadaceae | Marinobacter | KJ577049.1 | 99.79 |
| 90 | Mesorhizobium sp. G2DM-29 | Phyllobacteriaceae | Mesorhizobium | DQ416795.1 | 99.49 |
| 92 | Pseudomonas stutzeri | Pseudomonadaceae | Pseudomonas | JX177718.1 | 99.79 |
| 52 | Stenotrophomonas maltophilia | Xanthomonadaceae | Stenotrophomonas | KJ719580.1 | 99.79 |
16株活性深海菌株的系统进化树建立如图 2所示, 厚壁菌门、变形菌门和放线菌门形成距离较远的三个独立分支。厚壁菌门的9株细菌, 除Jeotgalibacillus alimentarius外, 其余8株细菌形成一个独立亚支, 归属于芽孢杆菌科(Bacillaceae)。变形菌门的6株细菌从同一分支出发后分布在不同的次级分支上, 种间差异明显, 两株Halomonas处于同一分支, 其拓扑结构同厚壁菌门相比, 有明显的差异。
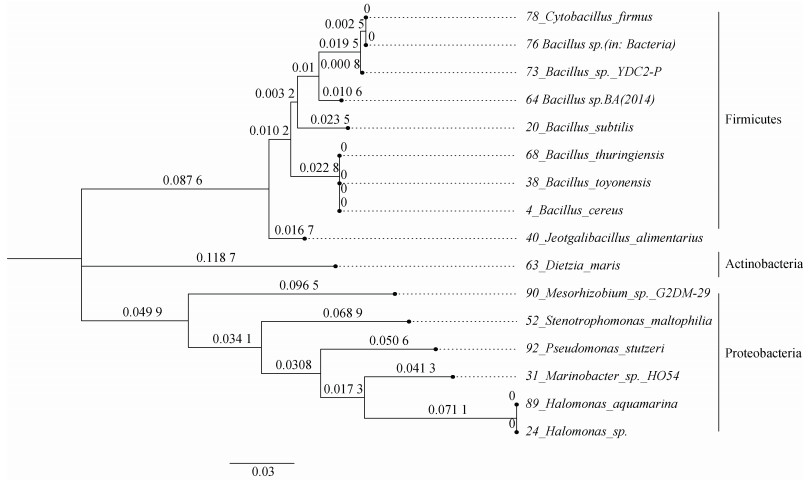 |
| 图 2 16株深海菌株的系统进化树 Fig. 2 Phylogenetic tree of 16 abyssal strains |
目前, 实现海洋微生物实验室条件下的分离培养限制很多[11]。传统方法下, 可培养的主要是厚壁菌门和变形菌门的种群, 放线菌门的微生物很少被发现[7]。所以, 在已报道的EPS鲜有提及放线菌门的细菌, 大多是以芽孢杆菌为代表的厚壁菌门和以盐单胞菌为主的变形菌门[35-36]。本研究提及的样本经鉴定后, 符合这样的种群分布, 16种活性菌株中, 厚壁菌门有9株, 其中有8株鉴定为芽孢杆菌; 另有6株属于变形菌门, 其中2株是盐单胞菌。就进化关系来看, 16株活性菌的进化关系符合16S rDNA测定的种属关系, 主要有三个分支对应三个门的组成。S. maltophilia与Xanthomnas campestris同属于Xanthomonadaceae科, 后者是黄原胶的工程菌。黄原胶作为增稠剂、乳化剂、稳定剂, 已经广泛应用于食品、石油和医疗等多个行业, 是目前世界上市场价值最大的微生物多糖[37]。X. campestris被认为是植物病原菌[38], 与其同科的S. maltophilia可能在基因序列上倾向于陆生菌, 所以在进化树上表现出同其他菌株的显著差异。作为16株深海细菌中唯一的放线菌门的细菌, 以D. maris为实验对象开展了胞外生物表面活性剂的研究, 其EPS能够降解为多种有机物, 在培养优化后产率可观, 有潜力转化为实用的生物表面活性剂[39]。
16种EPS的化学成分中, 总糖, 蛋白及硫酸基成分占比分别分布在14.06%~21.40%, 10.66%~31.05%和2.91%~26.53%范围内, 并且分子量分布呈三段分布, 通过分子排阻原理可以实现分离纯化, 这对追踪EPS中活性成分十分有利。另外, 16种EPS的单糖组成中, 甘露糖和葡萄糖是主要的单糖种类, 是大部分的胞外多糖的共同特征[40]。结合种属鉴定结果, 16株活性菌在同科属上已有关于EPS的研究。黄原胶成品是由1-4连接的β-D-葡萄糖残基组成的纤维状主链, 每一个葡萄糖残基都与一个由葡萄糖醛酸和两个甘露糖残基组成的三糖侧链相连, 结构中甘露糖∶葡萄糖∶葡萄糖醛酸=2∶2∶1[41]。另外市场上的黄原胶成品的分子量在100~1 000 kDa[42]。在S. maltophilia提取的EPS中, 含有黄原胶的3种单糖, 比例接近4∶3∶1, 最大分子量在285.7 kDa, 接近黄原胶成品的性质, 可以作为可能的黄原胶生产菌来研究。本实验中的样本采集环境是温度低、压强高的极端环境, 芽孢杆菌形成芽孢的独特机制能够适应这种环境胁迫, 芽孢中的EPS对于维持生存状态是十分重要的。目前, 已报道的芽孢杆菌合成的胞外多糖主要是由甘露糖, 葡萄糖组成, 偶有半乳糖和岩藻糖, 具备成胶能力[43-44]。就单糖组成而言, 与所得8株活性芽孢杆菌产生的EPS单糖组成一致。另外, 分离自海洋极端环境的Alteromonas[45], Halomonas[46]和Pseudomonas[47]的细菌都发现了能够合成EPS的成员, 稍有不同在于其单糖组成中另包含有木糖和半乳糖醛酸, 许多具有良好的生物活性, 包括抗肿瘤、抗氧化、冷冻保护以及乳化能力等。就已研究细菌EPS来看, EPS的生物活性同其中的多糖成分密切相关, 这意味着本实验中筛选到的16种EPS的神经保护活性也离不开其中多糖成分的作用, 需要对EPS进一步开展分离纯化工作, 探究活性成分, 并结合多糖结构表征方法来发现结构新颖的活性多糖。
| [1] |
王发左, 张偲, 张田, 等. 中国海洋微生物多样性研究生物多样性保护, 2010, 5(6): 651-658. WANG Fazuo, ZHANG Si, ZHANG Tian, et al. The study of diversities of marine microbes in China[J]. Bulletin of Chinese Academy of Sciences, 2010, 5(6): 651-658. |
| [2] |
TUTTLE R N, DEMKO A M, PATINN V. Detection of natural products and their producers in ocean sediments[J]. Applied and Environmental Microbiology, 2019, 85(8): e02830-18. |
| [3] |
徐新亚, 杨宏, 宁小清, 等. 北部湾海洋微生物物种多样性与化学多样性研究进展[J]. 广西科学, 2020, 27(5): 1-19. XU Xinya, YANG Hong, NING Xiaoqing, et al. Research progress of marine microbial diversity and chemical diversity in Beibu Gulf[J]. Guangxi Sciences, 2020, 27(5): 1-19. |
| [4] |
JIMENO J, FAIRCLOTH G, SOUSA-FARO J F, et al. New marine derived anticancer therapeutics ─ a journey from the sea to clinical trials[J]. Marine Drugs, 2004, 2(1): 14-19. DOI:10.3390/md201014 |
| [5] |
PROKSCH P, EDRADA-EBEL R, EBEL R. Drugs from the Sea-Opportunities and Obstacles[J]. Marine Drugs, 2003(1): 5-17. |
| [6] |
STINCONE P, BRANDELLI A. Marine bacteria as source of antimicrobial compounds[J]. Critical Reviews in Biotechnology, 2020, 40(3): 306-319. DOI:10.1080/07388551.2019.1710457 |
| [7] |
GUAN T W, LIN Y J, OU M Y, et al. Isolation and diversity of sediment bacteria in the hypersaline aiding lake, China[J]. PLoS One, 2020, 15(7): e0236006. DOI:10.1371/journal.pone.0236006 |
| [8] |
MORA C, TITTENSOR D P, ADL S, et al. How many species are there on Earth and in the ocean?[J]. PLoS Biology, 2011, 9(8): e1001127. DOI:10.1371/journal.pbio.1001127 |
| [9] |
RAGHUKUMAR S. Marine biotechnology: An approach based on components, levels and players[J]. Indian Journal of Geo Marine Sciences, 2011, 40(5): 609-619. |
| [10] |
LIU T, WU S, ZHANG R, et al. Diversity and antimicrobial potential of Actinobacteria isolated from diverse marine sponges along the Beibu Gulf of the South China Sea[J]. FEMS Microbiology Ecology, 2019, 95(7): fiz089. DOI:10.1093/femsec/fiz089 |
| [11] |
DANIEL R. The soil metagenome-a rich resource for the discovery of novel natural products[J]. Current Opinion in Biotechnology, 2004, 15(3): 199-204. DOI:10.1016/j.copbio.2004.04.005 |
| [12] |
PANNO L, BRUNO M, VOYRON S, et al. Diversity, ecological role and potential biotechnological applications of marine fungi associated to the seagrass Posidonia oceanica[J]. Nature Biotechnology, 2013, 30(6): 685-694. |
| [13] |
KOWALEWSKI M, FINNEGAN S. Theoretical diversity of the marine biosphere[J]. Paleobiology, 2010, 36(1): 1-15. DOI:10.1666/0094-8373-36.1.1 |
| [14] |
ANA CLÁUDIA DANTAS M. Prospecting of bioactive compounds[J]. Current Pharmaceutical Design, 2020, 26(33): 4031. DOI:10.2174/138161282633200820110502 |
| [15] |
LIU Z, LIU H, ZHANG W. Natural polypropionates in 1999-2020: An overview of chemical and biological diversity[J]. Marine Drugs, 2020, 18(11): 569. DOI:10.3390/md18110569 |
| [16] |
BOURNE D G, MORROW K M, WEBSTER N S. Insights into the coral microbiome: Underpinning the health and resilience of reef ecosystems[J]. Annual Review of Microbiology, 2016, 70(1): 317-340. DOI:10.1146/annurev-micro-102215-095440 |
| [17] |
HAWLEY A K, NOBU M K, WRIGHT J J, et al. Diverse Marinimicrobia bacteria may mediate coupled biogeochemical cycles along eco-thermodynamic gradients[J]. Nature Communications, 2017, 8(1): 1507. DOI:10.1038/s41467-017-01376-9 |
| [18] |
LÓPEZ-MAURY L, MARGUERAT S, BÄHLER J. Tuning gene expression to changing environments: from rapid responses to evolutionary adaptation[J]. Nature Reviews Genetics, 2008, 9(8): 583-593. DOI:10.1038/nrg2398 |
| [19] |
FLEMMING H. EPS-Then and Now[J]. Microorganisms, 2016, 4(4): 41. DOI:10.3390/microorganisms4040041 |
| [20] |
FLEMMING H, WINGENDER J. Relevance of microbial extracellular polymeric substances (EPSs) – Part Ⅱ: Technical aspects[J]. Water Science and Technology, 2001, 43(6): 9-16. DOI:10.2166/wst.2001.0328 |
| [21] |
FLEMMING H, WINGENDER J, SZEWZYK U, et al. Biofilms: an emergent form of bacterial life[J]. Nature Reviews Microbiology, 2016, 14(9): 563-575. DOI:10.1038/nrmicro.2016.94 |
| [22] |
DANG H, LOVELL C. Microbial surface colonization and biofilm development in marine environments[J]. Microbiology and Molecular Biology Reviews, 2016, 80(1): 91-138. DOI:10.1128/MMBR.00037-15 |
| [23] |
LO GIUDICE A, POLI A, FINORE I, et al. Peculiarities of extracellular polymeric substances produced by Antarctic bacteria and their possible applications[J]. Applied Microbiology and Biotechnology, 2020, 104(7): 2923-2934. DOI:10.1007/s00253-020-10448-8 |
| [24] |
DE CARVALHO C, FERNANDES P. Production of metabolites as bacterial responses to the marine environment[J]. Marine Drugs, 2010, 8(3): 705-727. DOI:10.3390/md8030705 |
| [25] |
DECHO A, GUTIERREZ T. Microbial extracellular polymeric substances (EPSs) in ocean systems[J]. Frontiers in Microbiology, 2017, 8: 922. DOI:10.3389/fmicb.2017.00922 |
| [26] |
de CARVALHO C. Marine biofilms: A successful microbial strategy with economic implications[J]. Frontiers in Marine Science, 2018, 5: 126. DOI:10.3389/fmars.2018.00126 |
| [27] |
NICHOLS C, GUEZENNEC J, BOWMAN J. Bacterial exopolysaccharides from extreme marine environments with special consideration of the southern ocean, sea ice, and deep-sea hydrothermal vents: a review[J]. Marine Biotechnology, 2005, 7(4): 253-271. DOI:10.1007/s10126-004-5118-2 |
| [28] |
刘城移, 袁源, 郝心怡, 等. 蝉虫草菌丝体胞内和胞外多糖抗肝细胞氧化损伤比较研究[J]. 菌物学报, 2020, 39(2): 421-433. LIU Chengyi, YUAN Yuan, HAO Xinyi, et al. A comparative study of intracellular and extracellular polysaccharides in mycelia of Cordyceps cicadae against oxidative damage of hepatocytes[J]. Mycosystema, 2020, 39(2): 421-433. |
| [29] |
南亚昀, 雍学芳, 王礼星, 等. 枸杞多糖药理学研究进展[J]. 天津中医药, 2014, 31(12): 763-765. NAN Yayun, YONG Xuefang, WANG Lixing, et al. Progress in pharmacological research of Lycium barbarum polysaccharide[J]. Tianjin Journal of Traditional Chinese Medicine, 2014, 31(12): 763-765. |
| [30] |
肖玉焕, 韩丽, 保红坤, 等. 灵芝多糖防治中枢神经系统疾病的研究进展[J]. 中草药, 2020, 51(24): 6391-6395. XIAO Yuhuan, HAN Li, BAO Hongkun, et al. Research progress on Ganoderma lucidum polysaccharide in prevention and treatment of central nervous system diseases[J]. Chinese Traditional and Herbal Drugs, 2020, 51(24): 6391-6395. |
| [31] |
张钊瑞, 张晨, 李大鹏. 微生物多糖的结构与应用研究进展[J]. 食品研究与开发, 2021, 42(1): 182-192. ZHANG Zhaorui, ZHANG Chen, LI Dapeng. Advances in Structure and Application of Microbial Polysaccharides[J]. Food Research and Development, 2021, 42(1): 182-192. |
| [32] |
GUINDON S, DUFAYARD J F, LEFORT V, et al. New algorithms and methods to estimate maximum-likelihood phylogenies: Assessing the performance of PhyML 3.0[J]. Systematic Biology, 2010, 59(3): 307-321. DOI:10.1093/sysbio/syq010 |
| [33] |
HANAFY D M, PRENZLER P D, BURROWS G E, et al. Neuroprotective activity of mentha species on hydrogen peroxide-induced apoptosis in SH-SY5Y cells[J]. Nutrients, 2020, 12(5): 1366. DOI:10.3390/nu12051366 |
| [34] |
Biological evaluation of medical devices—Part 5: Tests for in vitro cytotoxicity: ISO 10993-5: 2009 [S/OL]. [2023-02-04]. https://www.iso.org/standard/36406.html.
|
| [35] |
陈柔雯, 王可欣, 龙丽娟, 等. 一份南海深海沉积物样品中可培养细菌的多样性[J]. 生物资源, 2018, 40(4): 321-333. CHEN Rouwen, WANG Kexin, LONG Lijuan, et al. Diversity of cultured bacteria isolated from a deep see sediment in South China Sea[J]. Biotic Resources, 2018, 40(4): 321-333. |
| [36] |
李涛, 王鹏, 汪品先. 南海西沙海槽表层沉积物微生物多样性[J]. 生态学报, 2008, 28(3): 1166-1173. LI Tao, WANG Peng, WANG Pinxian. Microbial diversity in surface sediments of the Xisha Trough, the South China Sea[J]. Acta Ecologica Sinica, 2008, 28(3): 1166-1173. |
| [37] |
FREITAS F, ALVES V D, REIS M A M. Advances in bacterial exopolysaccharides: from production to biotechnological applications[J]. Trends in Biotechnology, 2011, 29(8): 388-398. |
| [38] |
邱嘉辉, 何亚文. 微生物胞外多糖黄原胶的应用与研究进展[J]. 激光生物学报, 2019, 28(5): 385-409. QIU Jiahui, HE Yawen. Advances in applications and research of Xanthan gum[J]. Acta Laser Biology Sinica, 2019, 28(5): 385-409. |
| [39] |
周翔, 梁剑平, 郝宝成, 等. 12C6+离子辐射下海迪茨氏菌及其表面活性物质研究[J]. 科技导报, 2012, 30(12): 21-25. ZHOU Xiang, LIANG Jianping, HAO Baocheng, et al. Dietzia maris induced by carbon-ion beams and its biodegradation ability[J]. Science & Technology Review, 2012, 30(12): 21-25. |
| [40] |
CASILLO A, LANZETTA R, PARRILLI M, et al. Exopolysaccharides from marine and marine extremophilic bacteria: structures, properties, ecological roles and applications[J]. Marine Drugs, 2018, 16(2): 69. |
| [41] |
YAO J, ZHANG B, GE C, et al. Xanthohumol, a polyphenol chalcone present in hops, activating Nrf2 enzymes to confer protection against oxidative damage in PC12 cells[J]. Journal of Agricultural and Food Chemistry, 2015, 63(5): 1521-1531. |
| [42] |
KREYENSCHULTE D, KRULL R, MARGARITIS A. Recent advances in microbial biopolymer production and purification[J]. Critical Reviews in Biotechnology, 2014, 34(1): 1-15. |
| [43] |
NICOLAUS B, PANICO A, MANCA M C, et al. A halophilic thermotolerant Bacillus isolated from a marine hot spring able to produce a new exopolysaccharide[J]. Biotechnology Letters, 2002, 24: 515-519. |
| [44] |
MAO R, TANG J, SWANSON B. Water holding capacity and microstructure of gellan gels[J]. Carbohydrate Polymers, 2001, 46: 365-371. |
| [45] |
CAMBON-BONAVITA M A, RAGUÉNÈS G, JEAN J, et al. A novel polymer produced by a bacterium isolated from a deep-sea hydrothermal vent polychaete annelid[J]. Journal of Applied Microbiology, 2002, 93: 310-315. |
| [46] |
BÉJAR V, CALVO C, MOLIZ J N, et al. Effect of growth vonditions on the rheological properties and chemical composition of volcaniella eurihalina exopolysaccharide[J]. Applied Biochemistry and Biotechnology, 1996, 59(1): 77-86. |
| [47] |
MATSUDA M, YAMORI T, NAITOH M, et al. Structural revision of sulfated polysaccharide B-1 isolated from a marine Pseudomonas species and its cytotoxic activity against human cancer cell lines[J]. Marine Biotechnology, 2003, 5(1): 13-19. |
 2023, Vol. 47
2023, Vol. 47


