文章信息
- 王君玥, 徐名扬, 张慧敏, 张珍珍, 申欣, 顾海峰, 姬南京. 2023.
- WANG Jun-yue, XU Ming-yang, ZHANG Hui-min, ZHANG Zhen-zhen, SHEN Xin, GU Hai-feng, JI Nan-jing. 2023.
- 夜光藻高效培养方法建立及其有性繁殖发生机制的初步研究
- Establishment of a high-efficiency culture method for Noctiluca scintillans and a preliminary study of its sexual reproduction mechanism
- 海洋科学, 47(3): 89-96
- Marine Sciences, 47(3): 89-96.
- http://dx.doi.org/10.11759/hykx20220429006
-
文章历史
- 收稿日期:2022-04-29
- 修回日期:2022-06-08
2. 江苏海洋大学 江苏省海洋生物产业技术协同创新中心, 江苏 连云港 222005;
3. 自然资源部第三海洋研究所 海洋生物多样性实验室, 福建 厦门 361005;
4. 江苏省海洋资源开发研究院, 江苏 连云港 222005
2. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Jiangsu Ocean University, Lianyungang 222005, China;
3. Third Institute of Oceanography, Ministry of Natural Resources, Xiamen 361005, China;
4. Jiangsu Marine Resources Development Research Institute, Lianyungang 222005, China
赤潮通常是指一些海洋微藻、原生动物或细菌在水体中过度繁殖或聚集造成水体变色的现象[1]。近年来, 随着水体富营养化、全球气候变化、海洋酸化等现象加剧, 赤潮发生的规模和频率总体呈明显增加趋势[2-3]。夜光藻(Noctiluca scintillans)隶属于甲藻门, 作为典型的赤潮生物之一, 在全球多个海域曾形成过大面积赤潮, 对海洋生态系统构成一定威胁[4-5]。根据夜光藻营养型的不同, 可将其划分为红色夜光藻和绿色夜光藻2种类型。绿色夜光藻主要由于细胞内共生了一种绿藻(Pedinomonas noctilucae)而呈现绿色[6], 绿色夜光藻可利用内共生绿藻光合作用产物获取营养, 但摄取食物对其也很重要[7-8]。红色夜光藻为异养型浮游植物, 只能通过摄食硅藻等浮游植物、细菌、桡足卵类等来获取营养供其生长繁殖[4]。除此以外, 夜光藻也因会形成“蓝色荧光海”而备受社会关注。鉴于夜光藻赤潮发生的危害性以及公众的高度关注, 开展其赤潮形成机制等方面的研究尤为重要和迫切。
近年来研究人员对夜光藻的基础生物学和赤潮成因研究已取得较大进展, 如大鹏湾和胶州湾夜光藻种群动态和水文参数调查分析表明, 水温、叶绿素浓度、营养盐等对夜光藻种群密度都有不同程度的影响, 多数研究者认为夜光藻赤潮频发的首要原因可能是水体富营养化引起的浮游植物增殖, 从而为夜光藻供给充足饵料[9-11]。此外, 夜光藻自身的生物学特征如繁殖方式、生长速率等内因在赤潮发生过程中也起着重要作用[12]。夜光藻的繁殖方式包括有性繁殖和无性繁殖两种方式, 通常情况下该物种主要通过营养细胞的二分裂进行无性繁殖, 但在一定条件下部分营养细胞会转化为配子母细胞, 进而释放配子进行有性繁殖[13-14]。1899年Calkins首次报道了夜光藻配子母细胞的存在, 但其配子融合以及合子发育成营养细胞过程却未见完整报道[15], 直到2006年, Fukuda和Endoh才首次全面描述了夜光藻有性繁殖过程[13]。当前, 尽管我们对夜光藻的生活史有一个较为明确的认识, 但该物种有性繁殖发生机制研究却鲜有报道, 且尚未达成一致结论。
本研究主要对我国近海海域的红色夜光藻进行分离, 建立了室内长期培养方法, 并在培养体系中观察到配子母细胞发生过程。在此基础之上, 比较分析了不同生长阶段对夜光藻配子母细胞发生的影响。上述研究的开展将有助于我们深入了解夜光藻有性繁殖的发生机制, 加深对夜光藻生活史的认识, 阐明有性繁殖对该物种赤潮形成的贡献。
1 材料与方法 1.1 样品采集及夜光藻的分离鉴定从江苏连云港连岛近岸海区采集表层海水, 使用大口径吸管吸取夜光藻单细胞, 用灭菌海水清洗藻细胞后, 转移至光照培养箱中培养。培养温度为20 ℃, 光暗周期为14 h∶10 h, 光照强度为100±10 μE·m–2·s–1, 培养所用海水均采自连云港表层海域, 盐度为30±1, 经孔径0.22 μm滤膜过滤和高温高压处理后使用。实验过程以亚心形四爿藻(Tetraselmis subcordiformis)作为饵料。
1.2 温度变化对夜光藻生长的影响实验设定5个温度梯度, 分别为10、15、20、25和30 ℃, 每个温度设置3个生物学重复。实验使用250 mL锥形瓶, 每个处理组的培养体积为100 mL, 夜光藻初始细胞密度为2个/mL, 其他培养条件(光周期和光强)同上。实验期间以亚心形四爿藻(碳含量约100 pg/细胞)为饵料, 饵料细胞浓度为10 000个/mL, 即饵料碳含量为1 μg/mL, 每2 d投喂一次, 保证饵料充足, 且根据培养体系中饵料残留做适当调整[16]。由于夜光藻细胞体积较大, 实验过程中均使用大口径的吸管定量吸取藻液, 转移至无菌的培养皿中使用肉眼观察法, 以实现对夜光藻的准确计数。
1.3 夜光藻室内长期高效培养方法的建立在进行夜光藻的培养过程中, 饵料藻的状态、投喂的多少均会对夜光藻的生长产生一定影响。为了达到夜光藻的长期高效培养的目的, 我们利用实验室现有条件设计了一种饵料投喂装置(图 1)。该培养装置分外围容器和内置嵌套容器两部分组成, 其中内置容器底部以孔径100 μm的筛绢覆盖。在夜光藻正常培养期间, 夜光藻置于装有海水的容器A中, 投喂饵料时, 将内置容器缓慢上移, 转移至有高浓度饵料藻的容器B中1 h后, 再将内置容器缓慢转移至容器A中进行继续培养。
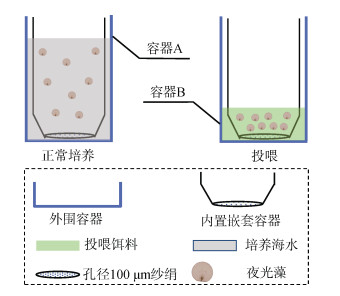 |
| 图 1 夜光藻培养与投饵装置 Fig. 1 Noctiluca scintillans cultivation and feeding device |
为了进一步开展夜光藻有性繁殖发生机制的研究, 我们利用倒置显微镜对培养体系中的夜光藻配子母细胞进行持续观察。首先, 用大口径的吸管将配子母细胞转移至细胞培养板中, 并不间断视频拍摄记录配子母细胞的变化过程。然后, 将释放的配子转移至新的细胞培养板中, 在倒置显微镜下继续观察配子细胞融合和合子发育过程。此外, 我们采用鲁格氏固定试剂对配子细胞进行固定拍照, 为后续环境样品中配子母细胞有效计数提供基础。
1.5 夜光藻不同生长阶段对配子母细胞发生的影响选择指数生长期的夜光藻, 设置细胞初始密度为5个/mL, 培养温度25 ℃, 保证饵料充足, 其他培养条件(光周期和光强)同上。实验设置3个生物学重复。每2~3 d对培养体系中的营养细胞的密度及配子母细胞进行计数, 并计算夜光藻配子母细胞发生率。
1.6 数据统计与分析分别采用SPSS 26.0和GraphPad Prism 5.0软件对各实验数据进行统计分析及绘图。对各参数进行正态分布检验后, 对符合正态分布的数据进行单因素方差分析(P < 0.05)。
根据下列公式计算夜光藻配子母细胞发生率:
| ${\rm{配子母细胞发生率}}=G_{\mathrm{cc}} /\left(T_{\mathrm{cc}}+G_{\mathrm{cc}}\right) \times 100 \%, $ | (1) |
其中Tcc是培养体系中营养细胞(Trophonts)的浓度, Gcc是培养体系中配子母细胞(Gametogenic cell)浓度。
2 结果与分析 2.1 温度变化对夜光藻生长的影响由图 2a可见, 夜光藻在10、15、20、25 ℃培养条件下均能生长, 随着培养时间的延长, 细胞密度呈持续增长趋势。在10~25 ℃温度范围内, 随着培养温度的升高, 夜光藻的生长速率也呈逐渐增加趋势。在25 ℃培养条件下, 经20 d培养, 夜光藻的细胞密度由起始的2个/mL增加至32个/mL, 平均生长率达0.14 d–1, 且在实验结束前细胞密度仍呈持续增加趋势。当培养温度为30 ℃时, 夜光藻细胞密度快速下降, 2 d后在培养体系中观察不到完整的藻细胞(图 2b)。
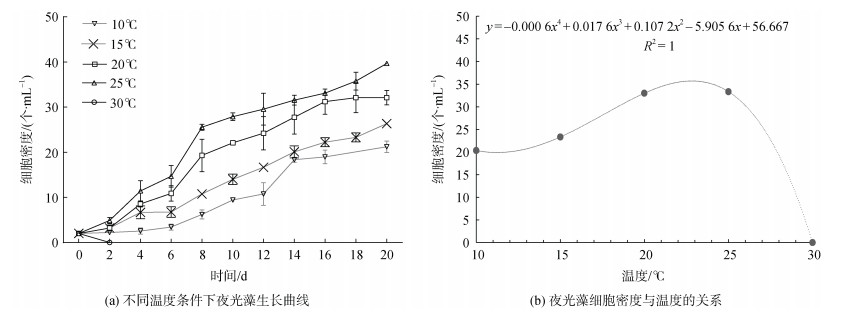 |
| 图 2 温度变化对夜光藻生长的影响 Fig. 2 Effect of temperature on the growth of Noctiluca scintillan |
根据不同温度培养条件下体系中夜光藻的最终细胞密度, 求得温度与细胞密度的回归方程为y= –0.000 6x4+ 0.017 6x2–5.905 6x+56.667(R2=1)(图 2 b), 即在10~30℃范围内, 随着温度升高, 夜光藻细胞密度呈先增加后降低趋势, 其最适生长温度范围为20~25 ℃。
2.2 夜光藻室内长期高效培养方法的建立培养体系中饵料的多少与夜光藻的生长关系密切, 当环境中饵料细胞密度过高时可造成夜光藻大量死亡。在实验室现有条件下, 我们设计了一种夜光藻高效培养装置, 如图 1所示, 通过此装置改善了传统的投喂方式, 可大大减少培养过程对夜光藻和饵料藻细胞密度频繁计数的环节。此外, 该培养装置可有效避免传统投饵过量对夜光藻生长产生影响, 也能保证夜光藻摄取足量的饵料。基于该培养装置, 我们已实现了实验室培养条件下夜光藻的稳定培养和传代。
2.3 夜光藻配子母细胞及配子观察在实验室条件下, 夜光藻主要以二分裂的形式进行无性繁殖(图 3)。然而, 在特定生长时期, 在培养体系中可观察到夜光藻的配子母细胞。为了对夜光藻的配子发生过程实现连续观察, 我们对培养体系中夜光藻的配子母细胞进行分离培养。如图 4所示, 夜光藻配子母细胞的发生, 首先是其营养细胞的形态与结构发生变化, 细胞核逐渐靠近细胞表面后连续进行2次分裂, 形成4个核子, 营养细胞将转变为配子母细胞(图 4a-f), 其后核子继续进行多次分裂, 形成4簇共256~1 024个原配子, 当核子分裂至1 024个配子时停止分裂, 最终集中在细胞表面, 并释放夜光藻配子(图 4e)。夜光藻配子母细胞成熟后, 其配子释放过程较为迅速, 大部分配子在1 h内可释放, 而剩余少量配子释放较为缓慢, 通常在3~6 h可完成全部配子的释放, 而配子母细胞在完成配子释放后逐渐萎缩。夜光藻释放的配子是具有两根鞭毛的成熟配子(游动孢子), 可在培养体系中正常游动(图 5a)。释放的夜光藻配子仅极少部分能形成纺锤形合子(图 5b), 但本研究在培养体系中未观察到合子发育成新的营养细胞过程。为了对环境样品中夜光藻配子进行准确观察, 利用1%的鲁格氏固定液对配子进行固定观察, 如图 5c所示, 配子经鲁格氏固定后, 细胞边缘有部分萎缩, 形态与非固定配子差异较大, 但仍然能清晰地观察到2根鞭毛。
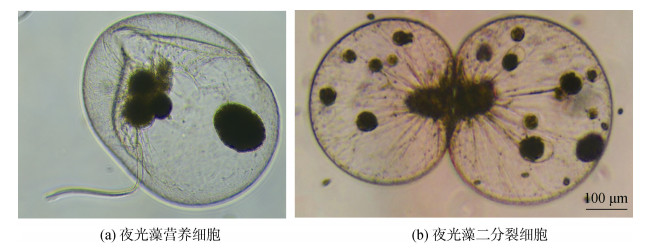 |
| 图 3 夜光藻细胞 Fig. 3 Photographs of Noctiluca scintillans cell (scale bar: 100 μm) 注: b图中标尺也适用于a图。 |
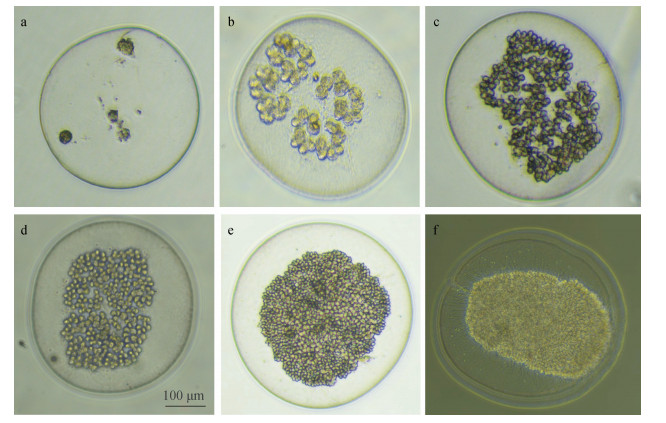 |
| 图 4 夜光藻配子发生过程 Fig. 4 Process of gametogenesis (scale bar: 100 μm) 注: a-f代表含有不同原配子数的配子母细胞, d图中标尺为100 μm, 也适用于a-f的其他图。 |
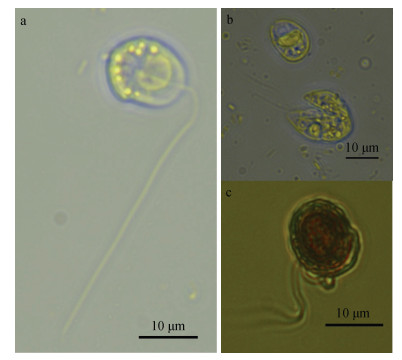 |
| 图 5 夜光藻配子形态观察 Fig. 5 Photographs of Noctiluca scintillans mature gamete 注: (a)释放的配子细胞; (b)形成的合子; (c)鲁格氏固定的配子。 |
在夜光藻长期培养过程中, 我们发现当夜光藻生长到某一阶段时, 培养体系中可观察到配子母细胞。基于此, 本研究对不同生长阶段夜光藻培养体系中配子母细胞的发生率进行了持续观察。如图 6所示。不同生长阶段培养体系中夜光藻配子母细胞密度与营养细胞密度变化趋势基本一致。实验培养前期, 夜光藻营养细胞密度总体呈上升趋势, 体系中未发现其配子母细胞。第10 d, 在培养体系中首次观察到配子母细胞, 经计数得到配子母细胞发生率为1.83 %, 配子母细胞发生的这一过程持续到第12 d, 其配子母细胞发生率为1.82 %, 与此同时培养体系中夜光藻营养细胞密度达到峰值18.8个/mL。第12 d之后, 培养体系夜光藻营养细胞和配子母细胞密度均呈逐渐下降趋势, 直至他们在培养体系中消失。
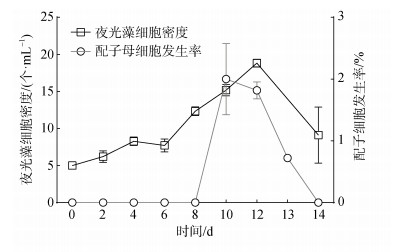 |
| 图 6 不同生长阶段夜光藻配子母细胞发生率 Fig. 6 Incidence of gametocytes in different growth stages |
自然状态下, 夜光藻摄食的范围很广, 对饵料的选择也可能存在一定的偏好性[17-18]。吴玉霖等[19]夜光藻实验室培养实验表明, 相比较于其他3种饵料藻(金藻、三角褐指藻和小球藻), 以扁藻为饵料的夜光藻生长最为迅速。基于此, 本研究以扁藻为饵料藻, 成功实现了夜光藻的传代培养。红色夜光藻作为完全异养的生物, 其生长主要依赖于水体环境中饵料的供应, 充足的饵料对夜光藻的生长繁殖起着重要作用[20]。传统夜光藻培养, 一般采用直接添加饵料培养物的方法。然而, 饵料的添加量、饵料的状态以及培养体系中营养盐水平等不确定因素均会给夜光藻的生长带来诸多影响, 如培养体系中营养盐较为充足时, 则利于饵料藻快速增殖, 从而与夜光藻形成竞争关系, 如通过化感作用抑制夜光藻的生长。本研究设计的夜光藻培养装置巧妙地解决了上述问题, 通过对内外装置的配合使用, 实现了夜光藻与饵料藻的分离培养。投喂时将夜光藻置于高丰度饵料的环境中, 可保证夜光藻摄取充足的饵料, 维持其自身的生长所需, 投喂结束后, 将夜光藻置于正常海水中, 避免了高丰度饵料藻对夜光藻生长的影响, 且培养体系中残留的少量饵料藻并不会对夜光藻的生长产生抑制。
温度是影响浮游植物生长的重要环境因素之一, 且对夜光藻种群动态起着关键性作用。20世纪90年代, Uhlig等[21]对德国湾(German Bight)开展了20年(1968—1988)的长期观测, 结果表明夜光藻生长的适宜温度范围在15~24 ℃之间; 1988年, Qi等[22]对广东近岸海域赤潮进行监测, 结果显示高细胞密度夜光藻集中发生在19~25 ℃范围内, 且30℃是夜光藻的致死温度; 韩国海域Jangmok Bay原位调查发现夜光藻密度随水温波动, 且环境温度大于28℃时种群丰度急剧下降[23]。本实验结果显示, 连云港海域夜光藻在10~25 ℃之间均能正常生长繁殖, 最高密度出现在20~25 ℃, 夜光藻种群丰度在30℃时迅速下降直至全部死亡(图 2), 该结果与已报道研究大致相同, 但也存在稍许差异, 这种差异可能由于观察或分离的夜光藻来自不同海区, 导致夜光藻对温度的适应能力存在差异。此外, 研究表明不同海域夜光藻赤潮发生的温度也存在较大差异, Huang等[10]对大鹏湾夜光藻原位调查表明, 夜光藻赤潮暴发时海水温度在16~28.6 ℃之间, 而黄海海域夜光藻的最高密度常出现在10 ℃左右[24]。田达玮等[11]对胶州湾夜光藻种群动态原位监测表明, 夜光藻种群丰度与水体温度存在显著的负相关性, 种群密度最高出现在全年水温最低的2月份, 远远低于已有报道夜光藻赤潮发生温度。综上, 这些研究结果不仅说明不同地理群体的夜光藻种系存在差异, 也表明夜光藻赤潮的发生是多种环境因素共同作用的结果。因此, 在后续开展夜光赤潮发生机制研究时, 应综合考虑赤潮发生海域环境因素变化情况, 做到全面分析。
Calkins等[15]首次报道了夜光藻配子母细胞的存在, 直到2006年研究者Fukuda和Endoh[13]首次全面描述了夜光藻有性繁殖过程, 完善了该物种的生活史。配子母细胞发生时, 少部分夜光藻营养细胞失去鞭毛及食物泡后逐渐变为圆形, 继而转变为配子母细胞, 配子母细胞经过核分裂后形成256~1 024个配子, 待配子成熟后被释放至水体中[13, 25-26]。夜光藻与大多数甲藻不同, 其有性繁殖过程中并不产生孢囊, 而是经过配子融合成合子后, 进而发育为新的个体[13, 25, 27]。Zingmark[25]对培养体系中的合子进行监测观察, 发现其在培养容器底部停止移动后并没有进一步发育, 且未在自然环境中发现配子两两融合后发育为营养细胞的证据。本研究在实验室模拟条件下观察到夜光藻配子融合现象, 但未能成功发育成营养细胞。Fukuda和Endoh[13]虽然对夜光藻的有性繁殖进行了详细描述, 但也提出配子细胞发生融合的概率非常低, 且提出合子发育失败可能是由于来自同一个母细胞的配子进行近亲繁殖导致。因此在后续研究中, 开展不同海区的夜光藻配子杂交实验, 有望在实验室条件下观察到夜光藻合子发育成营养细胞全过程。
尽管已对夜光藻的有性繁殖发生过程进行了详细描述, 但其有性繁殖发生的机制以及生态学意义尚不明确。早在1998年, 已有研究表明配子母细胞并不是随机发生的, 可能与营养细胞经历的无性繁殖(二分裂)次数有关, 并提出夜光藻营养细胞经历大约20~24次二分裂后, 该细胞很有可能转变为配子母细胞[28], 而Fukuda和Endoh却未能重复上述实验[13]。2021年, Lee等[29]对夜光藻有性繁殖发生机制进行深入研究, 结果表明夜光藻经历大规模生长繁殖后, 培养体系中饵料被逐渐消耗, 与此同时培养体系中配子母细胞发生率从1%左右提高至10 %, 并提出夜光藻有性繁殖的发生主要受饵料浓度的影响。本研究发现不同生长阶段培养体系中夜光藻配子母细胞的出现与营养细胞丰度确实有一定相关性。值得注意的是, Miyaguchi等[30]也发现夜光藻处于增殖期时群体中配子母细胞发生率升高。此外, Lee等[29]也曾提出夜光藻细胞需要增长到一定的浓度后才能进行有性繁殖。这些结果均表明夜光藻的配子母细胞发生与其细胞生长状态紧密相关, 但究竟是种群密度的增长诱导了有性繁殖发生, 还是有性繁殖的发生有助于种群密度的增加, 他们的因果关系还有待进一步研究。
为更好地明确夜光藻种群增长模式并深入理解其赤潮形成机制, 在后续研究中需对夜光藻的有性繁殖开展更深层次研究。探究各种环境、生物等因素对夜光藻有性繁殖发生的影响, 明确是哪一种或多种诱导因子诱导夜光藻配子母细胞发生, 揭示夜光藻的有性繁殖发生机制, 同时还可以结合夜光藻营养细胞、配子母细胞比例及其种群数量变化, 以探究有性繁殖对种群增长的贡献。
| [1] |
齐雨藻, 邹景忠, 梁松. 中国沿海赤潮[M]. 北京: 科学出版社, 2003. QI Yuzao, ZOU Jingzhong, LIANG Song. Red-tide in China Sea[M]. Beijing: Science Press, 2003. |
| [2] |
林森杰, 姬南京, 罗昊. 海洋有害藻华研究进展[J]. 海洋与湖沼, 2019, 50(3): 495-510. LIN Senjie, JI Nanjing, LUO Hao. Recent progress in marine harmful algal bloom research[J]. Oceanologia et Limnologia Sinica, 2019, 50(3): 495-510. |
| [3] |
于仁成, 吕颂辉, 齐雨藻, 等. 中国近海有害藻华研究现状与展望[J]. 海洋与湖沼, 2020, 51(4): 768-788. YU Rencheng, LÜ Songhui, QI Yuzao, et al. Progress and perspectives of harmful algal bloom studies in China[J]. Oceanologia et Limnologia Sinica, 2020, 51(4): 768-788. |
| [4] |
HARRISON P J, FURUYA K, GLIBERT P M, et al. Geographical distribution of red and green Noctiluca scintillans[J]. Chinese Journal of Oceanology and Limnology, 2011, 29(4): 807-831. DOI:10.1007/s00343-011-0510-z |
| [5] |
QI L, TSAI S F, CHEN Y L, et al. In search of red Noctiluca scintillans blooms in the East China Sea[J]. Geophysical Research Letters, 2019, 46(11): 5997-6004. DOI:10.1029/2019GL082667 |
| [6] |
SWEENEY B M. Pedinomonas Noctilucae (Prasinophyceae), the flagellate symbiotic in Noctiluca (dinophyceae) in southeast Asia[J]. Journal of phycology, 1976, 12(4): 460-464. DOI:10.1111/j.1529-8817.1976.tb02874.x |
| [7] |
HANSEN P J, MIRANDA L, AZANZA R. Green Noctiluca scintillans: a dinoflagellate with its own greenhouse[J]. Marine Ecology Progress Series, 2004, 275: 79-87. DOI:10.3354/meps275079 |
| [8] |
SAITO H, FURUYA K, LIRDWITAYAPRASIT T. Photoautotrophic growth of Noctiluca scintillans with the endosymbiont Pedinomonas noctilucae[J]. Plankton Benthos Research, 2006, 1(2): 97-101. DOI:10.3800/pbr.1.97 |
| [9] |
黄长江, 齐雨藻, 黄奕华, 等. 南海大鹏湾夜光藻种群生态及其赤潮成因分析[J]. 海洋与湖沼, 1997, 28(3): 245-255. HUANG Changjiang, QI Yuzao, HUANG Yihua, et al. The population ecology and causative mechanism of red tide of Noctiluca scintillans in Dapeng Bay, the South China Sea[J]. Oceanologia et Limnologia Sinica, 1997, 28(3): 245-255. DOI:10.3321/j.issn:0029-814X.1997.03.004 |
| [10] |
HUANG C, QI Y. The abundance cycle and influence factors on red tide phenomena of Noctiluca scintillans (Dinophyceae) in Dapeng Bay, the South China Sea[J]. Journal of Plankton Research, 1997, 19(3): 303-318. DOI:10.1093/plankt/19.3.303 |
| [11] |
田达玮, 宋书群, 陈田田, 等. 胶州湾夜光藻种群动态及其大量繁殖的生态机制[J]. 海洋与湖沼, 2017, 48(2): 276-284. TIAN Dawei, SONG Shuqun, CHEN Tiantian, et al. Noctiluca scintillans blooming in the Jiaozhou Bay: Population dynamic and ecological mechanism[J]. Oceanologia et Limnologia Sinica, 2017, 48(2): 276-284. |
| [12] |
DO ROSÁRIO GOMES H, GOES J I, MATONDKAR S P, et al. Massive outbreaks of Noctiluca scintillans blooms in the Arabian Sea due to spread of hypoxia[J]. Nature Communications, 2014, 5(1): 1-8. |
| [13] |
FUKUDA Y, ENDOH H. New details from the complete life cycle of the red-tide dinoflagellate Noctiluca scintillans (Ehrenberg) McCartney[J]. European Journal of Protistology, 2006, 42(3): 209-219. DOI:10.1016/j.ejop.2006.05.003 |
| [14] |
宋书群, 李才文, 孙军. 夜光藻有性繁殖研究进展[J]. 生态学报, 2016, 36(9): 2451-2459. SONG Shuqun, LI Wencai, SUN Jun. Progress on studies of sexual reproduction in Noctiluca scintillans[J]. Acta Ecologica Sinica, 2016, 36(9): 2451-2459. |
| [15] |
CALKINS G N. Mitosis in Noctiluca miliaris and its bearing on the nuclear relations of the Protozoa and Metazoa[J]. Journal of Morphology, 1899, 15: 711-770. DOI:10.1002/jmor.1050150306 |
| [16] |
ZHANG S, LIU H, CHEN B, et al. Effects of diet nutritional quality on the growth and grazing of Noctiluca scintillans[J]. Marine Ecology Progress Series, 2015, 527: 73-85. DOI:10.3354/meps11219 |
| [17] |
FRANGÓPULOS M, SPYRAKOS E, GUISANDE C. Ingestion and clearance rates of the red Noctiluca scintillans fed on the toxic dinoflagellate Alexandrium minutum (Halim)[J]. Harmful Algae, 2011, 10(3): 304-309. DOI:10.1016/j.hal.2010.11.002 |
| [18] |
KITATSUJI S, YAMAGUCHI H, ASAHI T, et al. Does Noctiluca scintillans end the diatom bloom in coastal water?[J]. Journal of Experimental Marine Biology, 2019, 510: 10-14. DOI:10.1016/j.jembe.2018.09.006 |
| [19] |
吴玉霖, 周成旭, 张永山. 夜光藻的室内培养[J]. 海洋与湖沼, 1994, 25(2): 165-167. WU Yulin, ZHOU Chengxv, ZHANG Yongshan. Laboratory culture of Noctiluca scintillans (Macartney)[J]. Oceanologia et Limnologia Sinica, 1994, 25(2): 165-167. DOI:10.3321/j.issn:0029-814X.1994.02.009 |
| [20] |
DEVI C A, VIMALKUMAR K, PADMAKUMAR K, et al. Understanding the microzooplankton mediated food web of the winter-spring Noctiluca bloom in the Northeastern Arabian Sea Ecosystem[J]. Regional Studies in Marine Science, 2021, 42: 101623. DOI:10.1016/j.rsma.2021.101623 |
| [21] |
UHLIG G, SAHLING G. Long-term studies on Noctiluca scintillans in the German Bight population dynamics and red tide phenomena 1968-1988[J]. Netherlands Journal of Sea Research, 1990, 25(1/2): 101-112. |
| [22] |
QI Y Z, CHEN J F, WANG Z H, et al. Some observations on harmful algal bloom (HAB) events along the coast of Guangdong, southern China in 1998[J]. Hydrobiologia, 512: 209-214.
|
| [23] |
JANG M C, SHIN K S, JANG P G, et al. Relationship between environmental factors and short-term variations of mesozooplankton during summer in Jangmok Bay, south coast of Korea[J]. Ocean and Polar Research, 2010, 32(1): 41-52. DOI:10.4217/OPR.2010.32.1.041 |
| [24] |
WANG W, SUN S, SUN X, et al. Seasonal phenology of the heterotrophic dinoflagellate Noctiluca scintillans (Macartney) in Jiaozhou Bay and adjacent coastal Yellow Sea, China[J]. Journal of Oceanology and Limnology, 2018, 36(4): 1280-1293. DOI:10.1007/s00343-018-6350-3 |
| [25] |
ZINGMARK R G. Sexual reproduction in the dinoflagellate Noctiluca miliaris Suriray[J]. Journal of Phycology, 1970, 6(2): 122-126. |
| [26] |
SATHISH T, THOMAS L C, PADMAKUMAR K. Vegetative and sexual reproduction of bloom-forming dinoflagellate Noctiluca Scintillans (Ehrenberg) McCartney from tropical Cochin estuary (Southwest coast of India): In-situ and laboratory studies[J]. Thalassas: An International Journal of Marine Sciences, 2021, 37(1): 31-37. DOI:10.1007/s41208-020-00247-3 |
| [27] |
PFIESTER L A. Sexual reproduction[M]//SPETOR D L. Dinoflagellates, Elsevier Inc., 1984: 181-199.
|
| [28] |
SATO M S, SUZUKI M, HAYASHI H. The density of a homogeneous population of cells controls resetting of the program for swarmer formation in the unicellular marine microorganism Noctiluca scintillans[J]. Experimental Cell Research, 1998, 245(2): 290-293. |
| [29] |
LEE J L N, CHIANG K P, TSAI S F. Sexual reproduction in dinoflagellates—The case of Noctiluca scintillans and its ecological implications[J]. Frontiers in Marine Science, 2021, 8: 704398. |
| [30] |
MIYAGUCHI H, KUROSAWA N, TODA T. Real-time polymerase chain reaction assays for rapid detection and quantification of Noctiluca scintillans zoospore[J]. Marine Biotechnology, 2008, 10(2): 133-140. |
 2023, Vol. 47
2023, Vol. 47


