文章信息
- 李盛楠, 王晶, 于玮洁, 卜晓翠, 单体锋. 2023.
- LI Sheng-nan, WANG Jing, YU Wei-jie, BU Xiao-cui, SHAN Ti-feng. 2023.
- 几种褐藻多糖硫酸酯的提取、成分分析及抗氧化活性研究
- Extraction, composition analysis, and antioxidant activity of polysaccharides from three species of seaweed
- 海洋科学, 47(3): 106-115
- Marine Sciences, 47(3): 106-115.
- http://dx.doi.org/10.11759/hykx20210803001
-
文章历史
- 收稿日期:2021-08-03
- 修回日期:2021-11-19
2. 中国科学院海洋研究所 海洋大科学研究中心, 山东省实验海洋生物学重点实验室, 山东 青岛 266071;
3. 崂山实验室海洋生物学与生物技术功能实验室, 山东 青岛 266237;
4. 青岛市食品药品检验研究院, 山东 青岛 266071
2. Institute of Oceanology, Chinese Academy of Sciences, Center for Ocean Mega-Science, Shandong Province Key Laboratory of Experimental Marine Biology, Qingdao 266071, China;
3. Qingdao National Pilot Laboratory of Marine Science and Technology, Laboratory for Marine Biology and Biotechnology, Qingdao 266237, China;
4. Qingdao Institute for Food and Drug Control, Qingdao 266071, China
现代医学研究表明, 皮肤衰老、炎症、血管硬化、脑组织损伤、癌变等许多疾病的发生和发展都与机体内过多的氧自由基有关[1]。超氧阴离子自由基是所有自由基的前身, 具有存留时间长、危害大、可以伤害较远靶目标等性质; 而羟基自由基是氧化性和毒性最强的氧自由基, 几乎所有的细胞都可以和它发生反应[2]。为了维持正常代谢, 机体的抗氧化防御系统要通过终止自由基链反应来清除自由基, 从而维持体内的氧自由基平衡[3]。参与机体抗氧化系统的非酶抗氧化剂除自身产生外, 还可以通过外来补充。抗氧化剂可以分为天然和人工合成两类, 由于许多合成抗氧化剂还没有经过长期毒理实验的检验, 其毒副作用尚未完全明确, 因此, 寻找高效、低毒的天然抗氧剂依然是今后很长时期内的研究热点[4]。
褐藻多糖硫酸酯是一类从褐藻中提取的天然硫酸多糖, 主要由岩藻糖和硫酸基组成, 由于来源的不同, 部分褐藻多糖硫酸酯还含有半乳糖、葡萄糖醛酸和甘露糖等。大量的研究表明, 褐藻多糖硫酸酯可以通过清除羟基自由基和超氧阴离子自由基, 使细胞内活性氧(reactive oxygen species, ROS)水平降低, 从而发挥抗氧化的作用[5-6]。多糖的化学结构与其清除自由基能力密切相关。体内外研究表明, 褐藻多糖硫酸酯的自由基清除能力主要受分子量、单糖组成、糖苷键构型及连接方式、取代基团的种类和数量等因素的影响。前期研究表明, 从海带中制备的褐藻多糖硫酸酯的抗氧化活性不仅与硫酸根的含量有关, 还与硫酸根和岩藻糖的百分比值有关[7]。乙酰基和苯甲酰基的引入可以显著提高褐藻多糖硫酸酯的抗氧化活性, 但是分子量对不同自由基的清除能力的影响并不一致[8-9]。总体而言, 低分子量褐藻多糖硫酸酯具有更好的抗氧化活性。
裙带菜(Undaria pinnatifida)、羊栖菜(Sargassum fusiforme)和铜藻(Sargassum horneri)是三种常见的褐藻, 《食疗本草》《中华海洋本草》等中药典籍中均对其药用价值有所记载。现代医学研究表明三种褐藻均具有抗氧化、免疫调节、抗肿瘤、抗凝血、降血脂等[10-12]多种生物活性。杨文盛等[13]从裙带菜和羊栖菜中提取的褐藻多糖硫酸酯清除超氧阴离子的IC50分别为0.33 mg/mL和0.17 mg/mL; 顾丽霞等[14]通过水提铜藻多糖测得其抗氧化活性与样品的剂量浓度呈正相关, 铜藻粗多糖在浓度为10 mg/mL时, 其超氧阴离子自由基的清除能力为34.2%。但是, 对于这三种海藻褐藻多糖硫酸酯化学组成、分子量与抗氧化活性的构效关系还缺乏系统深入的研究。
采集了中国科学院海洋研究所养殖的裙带菜、青岛汇泉湾野生羊栖菜和荣成海带养殖区的野生铜藻, 利用热水提取法制备三种褐藻多糖硫酸酯, 并且采用过氧化氢氧化降解的方法制备低分子量的褐藻多糖硫酸酯; 利用化学分光光度法、高效液相色谱法等方法阐明六种多糖的分子量、单糖组成等化学成分; 建立体外抗氧化活性模型, 比较分子量、单糖组成、硫酸基等对三种褐藻来源的褐藻多糖硫酸酯抗氧化活性的影响, 阐明构效关系, 筛选活性最好的褐藻多糖硫酸酯样品。本研究为褐藻多糖硫酸酯在抗氧化剂保健品和功能食品中的应用提供了基础数据支持, 也为裙带菜、羊栖菜和铜藻的高值化利用提供了理论依据。
1 材料与方法 1.1 实验材料裙带菜由中国科学院海洋研究所藻类养殖课题组提供, 羊栖菜于2020年6月采集自山东青岛汇泉湾, 铜藻为山东荣成海带养殖区的野生铜藻。海藻经自来水洗涤、自然晾燥后粉碎成藻粉保存备用。
实验试剂: 1-苯基-3-甲基-5-吡唑啉酮(1-Phenyl- 3-methyl-5-pyrazalone, PMP)、L-岩藻糖、D-甘露糖、L-鼠李糖、D-葡萄糖醛酸、D-葡萄糖、D-半乳糖、D-木糖和D-脱氧-核糖均购于美国Sigma公司; 不同分子量的右旋糖酐购自中国药品生物制品鉴定所; 浓硫酸、浓盐酸、氢氧化钠固体、硫酸钾、明胶、氯化钡、咔唑、邻苯三酚、硫酸亚铁、水杨酸、铁氰化钾、三氯乙酸、三氯化铁、乙酸铵、碳酸氢铵均为分析纯, 购于上海国药集团。
实验仪器: L2S可见分光光度计(上海仪电分析仪器有限公司)、恒温水浴锅(天津泰斯特仪器有限公司)、旋转蒸发仪(上海青浦沪仪器厂)、SHZ-D(Ⅲ)循环水多用真空泵(上海青浦沪仪器厂)、电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、高速离心机(中国天美科学仪器有限公司)和高效液相色谱仪LC- 20A(含PDA检测器、RID检测器)(日本岛津公司), C18色谱柱(4.6 mm×250 mm, 5 µm)(Agilent, 美国)、TSK G3000 PWxl凝胶色谱柱(300 mm×7.8 mm, 5 µm)(日本TOSOH)。
1.2 方法 1.2.1 褐藻多糖硫酸酯及降解产物的制备取海藻粉100 g, 放入烧杯中, 加入2 000 mL去离子水, 放入高压锅中, 120 ℃提取3 h。提取结束后, 筛绢过滤去除藻渣, 加入2 mol/L的CaCl2调节使CaCl2终浓度为0.1 mol/L, 静置1 h。用硅藻土抽滤, 收集滤液, 浓缩, 用截留分子量为3 600 Da透析袋透析。收集袋内溶液, 浓缩、冷冻干燥, 即得褐藻多糖硫酸酯。将从裙带菜、羊栖菜和铜藻提取获得的褐藻多糖硫酸酯分别记为1、2、3。
取褐藻多糖硫酸酯3 g, 配成0.5%的溶液。依次加入抗坏血酸和H2O2至终浓度为30 mmol/L, 70℃搅拌反应2 h。用截留分子量为3 600 Da的透析袋透析, 收集透析袋中溶液, 浓缩, 冻干, 即得低分子量褐藻多糖硫酸酯。将裙带菜、羊栖菜和铜藻来源的褐藻多糖硫酸酯降解得到的低分子量褐藻多糖硫酸酯分别记为4、5、6。
1.2.2 各产物理化性质分析分别采用苯酚-硫酸法[15]、半胱氨酸(Cys)盐酸盐法[16]、明胶-氯化钡(BaCl2)法[17]和咔唑比色法[18]测定样品的总糖、岩藻糖、硫酸根和糖醛酸。采用PMP柱前衍生高效液相色谱法[19]测定样品的单糖组成, 具体方法为: 样品用2 mol/L三氟乙酸于105 ℃水解4 h, 冷却后, 用2 mol/L氢氧化钠中和, 然后定容至10 mL。将200 μL水解液或核糖内标和200 μL单糖标准品溶液混合, 从中取100 μL依次加入120 μL 0.5 mol/L甲醇溶液和100 μL 0.3 mol/L氢氧化钠溶液, 混匀后放入70℃水浴1 h, 冷却后加入100 μL 0.3 mol/L盐酸中和, 分别加入500 μL氯仿萃取三次, 取上清液利用高效液相色谱法分析。采用高效凝胶液相色谱法检测样品分子量分布, 具体方法为: 选择TSK Gel G3000 PWxl凝胶色谱柱, 采用0.05 mol/L Na2SO4溶液为流动相, 设定流速为0.5 mL/min, 柱温40 ℃, 以不同分子量的右旋多糖酐系列标准品为参照, 分子量范围为2 500~133 800 Da。
1.2.3 抗氧化活性研究 1.2.3.1 邻苯三酚比色法检测超氧阴离子的清除能力超氧阴离子的清除能力的测定参照韩少华等[20]的方法, 稍作修改。在试管中按表 1的剂量加入缓冲液和试剂, 25℃恒温20 min, 添加经过25℃预热处理的60 mmol/L邻苯三酚, 若为对照管, 则将邻苯三酚替换为10 mmol/L盐酸。快速摇匀后移至比色杯(直径1 cm)内, 每30 s测定一次反应液420 nm处的吸光值A420, 合计测4 min, 3次重复取均值。对邻苯三酚溶液A420值和时间的关系(用自氧化速率ΔA1/Δt表示)进行测定计算。样品检测: 添加样品液0.1 mL, 相应降低同体积水用量, 对加样后邻苯三酚的A420值和时间的关系(用自氧化速率ΔA2/Δt表示)展开测定, 并对超氧阴离子清除率S(%)进行求解, 清除能力计算公式为:
| $ S=(ΔA_{{\mathit{1}}}/Δt–ΔA_{{\mathit{2}}}/Δt)/ΔA_{{\mathit{1}}}/Δt×{\rm{100\% ,}}$ | (1) |
| 试剂 | 加样量/mL | 终浓度/(mmol·L–1) | |
| 对照管 | 样品管 | ||
| 0.1 mol/L Tris-HCl(pH 8.20, 内含2 mmol·L–1 EDTA) | 2.8 | 2.8 | 50 |
| 双蒸水/样品 | 0.1 | 0.1 | |
| 10 mmol·L–1 HCL | 0.1 | — | 0.3 |
| 邻苯三酚 | — | 0.1 | 2 |
| 总体积 | 3.0 | 3.0 | |
| 注: “—”表示为不加入该试剂 | |||
式中S为超氧阴离子清除率, ΔA1为邻苯三酚溶液A420值, ΔA2加样后邻苯三酚的A420值, Δt为时间。
1.2.3.2 硫酸亚铁-水杨酸法测羟基自由基清除能力羟基自由基清除能力的测定参照田冰洁等[21]的方法, 稍作修改。在试管中按表 2的剂量加入FeSO4、水杨酸以及不同浓度的样品溶液, 最后加入H2O2启动反应。37 ℃温浴0.5 h后, 4 000 r/min离心6 min, 取其上清液测定510 nm处的吸光值A510, 3次重复取均值。抗坏血酸为阳性对照。·OH清除率C(%)的计算公式为:
| $ C=[1–(A_{i}–A_{i0})/A_{0}]×{\rm{100\% ,}}$ | (2) |
| 试剂 | 加样量/mL | ||
| 样品管 | 本底管 | 对照管 | |
| 9 mmol/L硫酸亚铁 | 0.2 | 0.2 | 0.2 |
| 9 mmol/L水杨酸 | 0.5 | 0.5 | 0.5 |
| 样品/维生素C | 1 | 1 | — |
| 双蒸水 | 7 | 7.3 | 8 |
| 8.8 mmol/L双氧水 | 0.3 | — | 0.3 |
| 注: “—”表示为不加入该试剂 | |||
其中, C代表·OH清除率, Ai代表某浓度样品的A值, Ai0为未加H2O2时样品溶液的本底A值, A0为未加样品溶液的对照A值。
1.2.3.3 铁氰化钾-三氯化铁法测定还原能力参照张忠山等[22]的方法, 稍作修改。1 mL各浓度样品液和等体积1%铁氰化钾溶液混合, 摇匀并于50℃水浴反应20 min, 加入0.1 %三氯乙酸溶液2 mL终止反应, 静置5 min, 添加1.2 mL 0.1 %三氯化铁溶液后摇匀, 在700 nm处测量反应溶液的吸光值A700, 3次重复取均值。
2 结果与讨论 2.1 理化性质分析 2.1.1 三种褐藻多糖硫酸酯的化学组成分析褐藻多糖硫酸酯1~3的化学组成如表 3所示, 3种褐藻多糖硫酸酯总糖含量为61.35%~70.33%, 其中样品3的总糖含量最高。岩藻糖是褐藻多糖硫酸酯的一个主要组成单糖, 样品1、2和3的岩藻糖含量分别为7.38%、15.62%和16.82%, 样品3岩藻糖含量最高。硫酸基对于褐藻多糖硫酸酯的生物活性有重要影响, 硫酸基含量最高的为样品3, 为11.99%, 其次是样品1, 为10.31%, 样品2的硫酸基含量最低, 仅为8.81%。这一结果与游丽君、蒋定文等测得的结果相差不大[23-25]。相较样品2与样品3, 样品1的糖醛酸含量明显偏高。三种褐藻多糖硫酸酯所含的单糖种类相同, 但是各单糖的含量有差异, 均以岩藻糖(Fucose, 简称Fuc)与半乳糖(Galactose, 简称Gal)为主, 还有少量的鼠李糖(Rhamnose, 简称Rha)、甘露糖(Mannose, 简称Man)等(表 3)。岩藻糖是样品2和3中含量最多的单糖, 其次是半乳糖。而样品1含量最多的单糖为半乳糖, 其次为岩藻糖。岩藻糖和半乳糖通常为裙带菜、羊栖菜等褐藻的主要单糖, 本研究测得的单糖组成除木糖(Xylose, 简称Xyl)外与已有文献报道的基本相同[26-27]。分子量也是影响多糖生物活性的因素之一, 3种褐藻多糖硫酸酯的分子量为29~42 kDa, 其中样品3的分子量最大, 为42 kDa, 其次是样品2, 1号样品分子量最小, 为29 kDa。不同藻类的化学组成存在一定差别, 推测它们的生物活性也存在差异, 本文抗氧化活性的研究结果对其进行了佐证。
| 样品 | 总糖/% | 岩藻糖/% | 糖醛酸/% | 硫酸基/% | 中性单糖 | 重均分子量/Da | |||||
| Man/% | Rha/% | GlcA/% | Glc/% | Gal/% | Fuc/% | ||||||
| 1 | 61.35 | 7.38 | 20.02 | 10.31 | 0.21 | 0.02 | 0.19 | 0.13 | 1.00 | 0.94 | 29 408 |
| 2 | 63.12 | 15.62 | 16.88 | 8.81 | 0.11 | 0.01 | 0.14 | 0.11 | 0.22 | 1.00 | 37 130 |
| 3 | 70.33 | 16.82 | 15.58 | 11.99 | 0.10 | 0.02 | 0.09 | 0.04 | 0.57 | 1.00 | 42 885 |
| 注: Glc: 葡萄糖, Fuc: 岩藻糖, Gal: 半乳糖, Xyl: 木糖, Rha: 鼠李糖, Man: 甘露糖 | |||||||||||
为了评价分子量对多糖抗氧化活性的影响, 本研究采用自由基降解方法对三种海藻褐藻多糖硫酸酯进行降解, 样品4~6的化学组分分析结果如表 4所示。降解后多糖的分子量明显降低, 范围为5.9~7.7 kDa, 降解产物的单糖组成变化不明显。样品4在岩藻糖、硫酸基含量上都明显低于5和样品6, 而糖醛酸含量均高于样品5和样品6。
| 样品 | 总糖/% | 岩藻糖/% | 糖醛酸/% | 硫酸基/% | 中性单糖 | 重均分子量/Da | |||||
| Man/% | Rha/% | Glc A/% | Glc/% | Gal/% | Fuc/% | ||||||
| 4 | 67.45 | 6.70 | 20.25 | 9.82 | 0.22 | 0.08 | 0.21 | 0.15 | 1.00 | 0.95 | 5 951 |
| 5 | 75.61 | 15.74 | 17.42 | 10.04 | 0.11 | 0.01 | 0.14 | 0.11 | 0.23 | 1.00 | 9 771 |
| 6 | 78.25 | 19.88 | 14.80 | 12.25 | 0.10 | 0.02 | 0.09 | 0.04 | 0.59 | 1.00 | 7 793 |
| 注: Glc: 葡萄糖, Fuc: 岩藻糖, Gal: 半乳糖, Xyl: 木糖, Rha: 鼠李糖, Man: 甘露糖 | |||||||||||
超氧阴离子自由基是所有自由基的前身, 具有存留时间长、危害大、可以伤害较远靶目标等性质。当遇到碱性环境, 邻苯三酚可快速发生自氧化, 产生·O2–, 产生有色的中间物质, 在抗氧化剂存在下, 邻苯三酚氧化为醌类与半醌氧化物质的反应会受到大幅阻抑, 由此使得相应A值下降。图 1为60 mmol/L邻苯三酚在pH=8.2下的自反应曲线。
 |
| 图 1 邻苯三酚的自反应曲线 Fig. 1 Self-reaction profile of pyrogallol |
实验结果表明随着样品浓度的增加, 邻苯三酚自氧化速率呈线性减小(表 5)。由IC 50值可知, 各样品都具有较强的清除超氧阴离子自由基的能力, 其中样品1具有最强的清除能力, IC50为0.214 mg/mL, 样品3清除能力相对最弱, 其IC50为0.376 mg/mL, 均小于铁皮石斛原球茎多糖的IC50(0.786 mg/mL)[28]。分子量对各样品清除超氧阴离子的影响不同, 铜藻来源的褐藻多糖硫酸酯降解后抗氧化能力增强。裙带菜来源的褐藻多糖硫酸酯清除超氧阴离子自由基的能力大于降解后的褐藻多糖硫酸酯。化学组成与样品的清除超氧阴离子自由基的能力有关, 样品1、2、3的·O2–清除能力依次减弱, 这与样品中糖醛酸含量依次降低的顺序一致, 而·O2–清除能力越低, 岩藻糖含量越高。早期研究证实, 褐藻多糖硫酸酯中糖醛酸含量与样品的抗氧化活性呈正相关[29-30], 本研究未降解组的褐藻多糖硫酸酯实验结果与这一结论相符。硫酸根含量会影响抗氧化活性, 样品6、5、4的·O2–清除能力依次减弱, 这与样品中硫酸根含量依次降低的顺序一致, 这也与前期研究结果一致[31-34]。Tsiapali等[35]发现磷酸化和硫酸化葡聚糖表现出更强的抗氧化能力, 表明聚电解质, 如硫酸葡聚糖或磷酸盐, 可能具有增加超氧阴离子清除活性的能力。虽然超氧阴离子是一种弱氧化剂, 但在大多数生物体中, 它可以持续降解并形成其他活性自由基, 引发脂质过氧化, 然后诱发关节炎和阿尔茨海默病等疾病[36-38], 这些实验结果均表明样品的抗氧化活性与其清除超氧阴离子的能力有关。本研究实验结果显示所有样品都有清除超氧自由基的能力, 所有样品都有一定的抗氧化活性。
| 样品 | 浓度/(mg·mL–1) | 自氧化速率 | IC50/(mg·mL–1) | 样品 | 浓度/(mg·mL–1) | 自氧化速率 | IC50/(mg·mL–1) | |
| Δ A / Δ t | Δ A / Δ t | |||||||
| 1 | 0.15 | 0.204 | 0.214 | 4 | 0.25 | 0.205 | 0.352 | |
| 0.20 | 0.153 | 0.30 | 0.155 | |||||
| 0.25 | 0.032 | 0.35 | 0.105 | |||||
| 2 | 0.30 | 0.160 | 0.288 | 5 | 0.20 | 0.206 | 0.292 | |
| 0.35 | 0.114 | 0.25 | 0.150 | |||||
| 0.40 | 0.097 | 0.30 | 0.094 | |||||
| 3 | 0.30 | 0.145 | 0.376 | 6 | 0.15 | 0.223 | 0.22 | |
| 0.35 | 0.134 | 0.20 | 0.138 | |||||
| 0.40 | 0.124 | 0.25 | 0.052 |
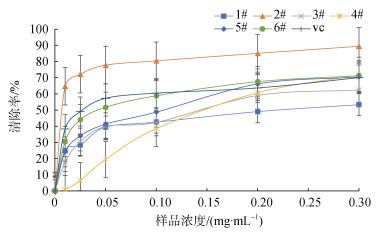
3种海藻及其降解物清除羟基自由基的能力如图 2所示, 所有样品清除羟基自由基的能力都比较显著, 且和浓度有正相关性。在浓度为0.1 mg/mL时, 2号样品的清除能力最强, 清除率为80%, IC50为0.010 mg/mL。样品1、3的IC50分别为0.218 mg/mL、0.120 mg/mL, 均高于抗坏血酸的IC50 0.037 mg/mL, 低于野生铁皮石斛多糖的IC50为1.065 mg/mL[28], 也低于陈杰等[39]测得的3种灵芝子实体粗多糖的IC50值依次为2.130 mg/mL (吉林通化)、2.550 mg/mL(安徽金寨)、3.050 mg/mL(吉林蛟河), 说明未降解的褐藻多糖硫酸酯有较强的羟基自由基清除能力, 但是除2号样品外, 其余样品的清除活性小于抗坏血酸的清除活性。低分子量样品5、6、4的IC50依次升高, 分别为0.044 mg/mL、0.046 mg/mL和0.141 mg/mL, 除羊栖菜外, 其他海藻低分子量褐藻多糖硫酸酯的IC50均低于未降解样品, 这说明对于样品1、3, 降解后的低分子量多糖清除羟基自由基的能力增强, 这一结果与孙立清等[40-41]的研究结果相符。硫酸根以及岩藻糖的含量在很大程度上会影响对·OH的清除能力, 样品2、3、1的·OH清除能力依次减弱, 这一顺序与样品的岩藻糖和硫酸根的比值一致(依次为1.77、1.40和0.72), 由此可见, 低硫酸基高岩藻糖组分具有更好的·OH清除能力, 与早前研究报道的多糖中硫酸根和岩藻糖的含量可能与多糖的抗氧化活性相关的结论[40]一致。而降解后的样品4、5、6的·OH清除活性并不完全符合硫酸根及岩藻糖硫酸根比值的顺序, 这可能和样品单糖组成、分子量的不同有关[42]。前期研究表明, 样品清除羟基自由基活性的机制为: 抑制羟基自由基的产生或者是清除产生的羟基自由基[43-44]。多数研究人员认为硫酸化多糖清除羟基自由基能力都与这两种机制有关, 可能是两种机制的协同作用[45-46]。Tsiapali等人指出, 自由基清除活性部分与单糖成分有关[35], 本研究中实验样品1–6具有不同的分子量、硫酸基含量及单糖组成, 样品对羟基自由基的清除能力不仅与分子量、硫酸根及岩藻糖硫酸根比值有关, 还有单糖组成有关, 是多种因素共同作用的结果。
 |
| 图 2 清除率变化的曲线 Fig. 2 Curve of clearance rate change |
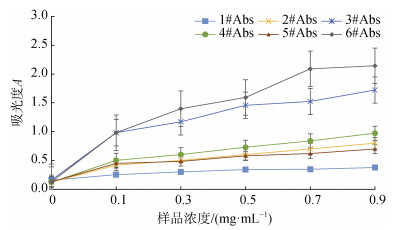
样品的还原能力是抗氧化能力的一种。在样品所含抗氧化成分的作用下, 铁氰化钾的Fe3+会转变成Fe2+, 同时继续和FeCl3发生作用, 得到蓝色化合物, 即普鲁士蓝, 该蓝色化合物在波长700 nm处有最大吸收值, 测定加入抗氧化剂后反应体系在波长700 nm处吸收值的高低可直接评价褐藻多糖硫酸酯还原能力的强弱。图 3所示为样品的还原活性和浓度之间的关系曲线。
 |
| 图 3 样品还原能力变化曲线 Fig. 3 Variation curves of sample reduction capacity |
实验结果显示, 随着样品浓度的增加, 待测样品的还原能力都不断提高。在0.09 mg/mL的浓度下, 样品6的吸光度最高, 还原能力最强, 其次是3, 其他样品按照样品4、2、5、1顺序依次减小。还原性通常与还原酮的存在有关, 还原酮通过提供氢原子来破坏自由基链, 从而发挥抗氧化作用。样品3、6具有较高的岩藻糖和硫酸基含量, 具有最强的还原活性。Zhu等[47]研究表明, 在大多数情况下, 大多数非酶抗氧化活性, 如清除自由基或抑制过氧化作用, 都是通过氧化还原反应介导的。实验结果表明, 3种海藻褐藻多糖硫酸酯对·O2–和·OHˉ不仅有清除活性, 还具备一定的还原活性, 抗氧化活性随着浓度增加逐渐增强; 除羊栖菜外, 相同样品浓度下, 降解后的低分子量多糖硫酸酯的还原活性均高于未降解的样品, 由此可见分子量对于多糖样品的还原活性有影响。这与王晶、马军等[7, 48-49]研究海藻多糖抗氧化能力的结果一致。
综上所述, 分子量对抗氧化活性有较大影响, 但是对不同海藻来源的褐藻多糖硫酸酯的影响趋势并不一致。通常情况下, 较大分子量的褐藻多糖降解成低分子量褐藻多糖硫酸酯, 可以使样品的抗氧化活性增高[40, 50-51], 但是多糖分子量过低, 其产生活性的聚合结构难以形成[52], 较好的抗氧化活性需要合适的分子量范围。本实验中野生羊栖菜来源的褐藻多糖硫酸酯抗氧化能力与其分子量呈正相关性, 而铜藻来源的褐藻多糖硫酸酯抗氧化能力与其分子量呈负相关性。裙带菜来源的褐藻多糖硫酸酯清除超氧阴离子自由基的能力大于降解后的褐藻多糖硫酸酯, 然而, 降解后的褐藻多糖硫酸酯对羟基自由基的清除能力和还原能力则相对更强。据目前研究表明, 多糖能够清除活性氧的原因可能是多糖分子上具有能够跟氧自由基发生氧化还原反应半缩醛羟基; 硫酸多糖以及多糖的硫酸化衍物在体内外均表现出不同程度的抗氧化活性, 部分原因是硫酸基团通常会使环境变成高酸性, 这削弱了多糖之间的氢键作用, 硫酸多糖以静电的方式吸附自由基[51]; Chen等[53]用高效液相色谱测定方法对茶多糖结合物中总糖醛酸含量进行测定, 发现多糖结合物中的糖醛酸含量越高, 对活性氧的清除活性越强, 多糖的抗氧化活性与糖醛酸的含量有关系, 这可能是由于多糖中有促进O-H键氢原子释放的醛或酮等亲电基团[54]。从本实验结果发现, 对于低分子量样品, 岩藻糖和硫酸基含量越高, 其清除超氧阴离子自由基的活性越强; 对于高分子量样品, 岩藻糖含量越低、糖醛酸含量越高, 则活性越强。这说明岩藻糖、硫酸基和糖醛酸含量对清除超氧阴离子自由基的影响与分子量有一定的关系。岩藻糖和硫酸根的比值对羟基自由基的清除能力有一定影响, 一般而言, 岩藻糖和硫酸根的比值越大, 羟基自由基的清除能力越强。
3 结论3种海藻褐藻多糖硫酸酯及其降解物的化学组成不同, 低分子量的褐藻多糖硫酸酯总糖含量高于未降解的褐藻糖硫酸酯。不同海藻制备的褐藻多糖硫酸酯中的单糖组成有较大区别, 裙带菜的海藻多糖中半乳糖占绝对优势, 而羊栖菜和铜藻的褐藻多糖硫酸酯中岩藻糖含量最高。
三种海藻褐藻多糖硫酸酯及其降解产物具有较好的抗氧化活性。褐藻多糖硫酸酯的抗氧化活性除了与分子量大小有关外, 还受到硫酸根、糖醛酸、岩藻糖和中性单糖构成的影响。总体而言, 分子量的影响最大, 其次是岩藻糖、硫酸基和糖醛酸的含量。综合考虑, 低分子量的褐藻多糖硫酸酯具有更好的抗氧化活性, 就三种海藻而言, 羊栖菜来源的褐藻多糖硫酸酯具有较好的抗氧化活性。
| [1] |
HAYYAN M, HASHIM M A, ALNASHEF I M. Superoxide ion: generation and chemical implications[J]. Che mical Reviews, 2016, 116(5): 3029-3085. DOI:10.1021/acs.chemrev.5b00407 |
| [2] |
顾晓慧, 张芹, 盛杰, 等. 岩藻黄质抗氧化作用及其机制研究进展[J]. 农产品加工, 2021, 1(1): 73-75. GU Xiaohui, ZHANG Qin, SHENG Jie, et al. A review of the research progress of antioxidant effect and mechanism of fucoxanthin[J]. Academic Periodical of Farm Products Processing, 2021, 1(1): 73-75. |
| [3] |
王忠雷, 杨丽燕, 张小华, 等. 天然产物抗氧化活性成分研究进展[J]. 药物评价研究, 2012, 35(5): 386-390. WANG Zhonglei, YANG Liyan, ZHANG Xiaohua, et al. Research progress on active anti-oxidative components from natural products[J]. Drug Evaluation Research, 2012, 35(5): 386-390. |
| [4] |
孟庆华, 于晓霞, 张海凤, 等. 天然黄酮类化合物清除自由基机理及其应用进展[J]. 云南民族大学学报(自然科学版), 2012(2): 79-83. MENG Qinghua, YU Xiaoxia, ZHANG Haifeng, et al. Flavonoids' mechanism of scavenging free radicals and its application as natural antioxidants[J]. Journal of Yunnan University of Nationalities(Natural Sciences Edition), 2012(2): 79-83. |
| [5] |
EL RASHED Z, LUPIDI G, GRASSELLI E, et al. Antioxidant and antisteatotic activities of fucoidan fractions from marine and terrestrial sources[J]. Molecules, 2021, 26(15): 4467. DOI:10.3390/molecules26154467 |
| [6] |
LIM S, CHOI J, PARK H. Antioxidant activities of fucoidan degraded by gamma irradiation and acidic hydrolysis[J]. Radiation Physics and Chemistry, 2015, 109: 23-26. DOI:10.1016/j.radphyschem.2014.12.008 |
| [7] |
WANG J, ZHANG Q, ZHANG Z, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica[J]. International Journal of Biological Macromolecules, 2008, 42(2): 127-132. DOI:10.1016/j.ijbiomac.2007.10.003 |
| [8] |
WANG J, LIU L, ZHANG Q, et al. Synthesized oversulphated, acetylated and benzoylated derivatives of fucoidan extracted from Laminaria japonica and their potential antioxidant activity in vitro[J]. Food Chemistry, 2009, 114(4): 1285-1290. DOI:10.1016/j.foodchem.2008.10.082 |
| [9] |
WANG J, WANG F, ZHANG Q, et al. Synthesized different derivatives of low molecular fucoidan extracted from Laminaria japonica and their potential antioxidant activity in vitro[J]. International Journal of Biological Macromolecules, 2009, 44(5): 379-384. DOI:10.1016/j.ijbiomac.2009.02.001 |
| [10] |
石颖, 侯和胜. 裙带菜的生理作用及药用价值研究进展[J]. 食品与药品, 2013(3): 213-215. SHI Ying, HOU Hesheng. Physiological Effect and Pharmacological Importance of Undaria pinnatifida: A Literature Review[J]. Food and Drug, 2013(3): 213-215. |
| [11] |
杨铭, 郎朗, 季宇彬. 海藻羊栖菜药用功能研究进展[J]. 医学理论与实践, 2013, 26(4): 450-451. YANG Ming, LANG Lang, JI Yubin. Medicinal functions of seaweed Lamina propria[J]. The Journal of Medical Theory and Practice, 2013, 26(4): 450-451. |
| [12] |
彭雍博, 汪秋宽, 任丹丹, 等. 铜藻主要活性物质的提取及其功能[J]. 水产科学, 2017, 36(4): 531-537. PENG Yongbo, WANG Qiukuan, REN Dandan, et al. Extracting technology and bioactivity of major bioactive substances in marine brown alga Sargassum horneri[J]. Fisheries Science, 2017, 36(4): 531-537. |
| [13] |
杨文盛, 袁春红, 韩华. 海洋来源硫酸多糖体外抗氧化活性作用的初步研究[J]. 天然产物研究与开发, 2021, 33(7): 1081-1085. YANG Sheng, YUAN Chunhua, HAN Hua. The antioxidant activity in vitro of sulfated polysaccharides from marine sources[J]. Natural Product Research and Development, 2021, 33(7): 1081-1085. |
| [14] |
顾丽霞, 刘丽佳, 何淑婷, 等. 铜藻多糖水提法工艺优化及其抗氧化活性研究[J]. 安徽农业科学, 2014(29): 10139-10141. GU Lixia, LIU Lijia, HE Shuting, et al. Study on water extraction technology and antioxidative activity of polysaccharides from Sargassum horneri[J]. Journal of Anhui Agricultural Sciences, 2014(29): 10139-10141. |
| [15] |
SMITH F, GILLES M A, HAMILTON J K, et al. Colorimetric method for determination of sugar related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ac60111a017 |
| [16] |
GIBBONS M N. The determination of methylpentoses[J]. Analyst, 1955, 80(949): 268-276. DOI:10.1039/an9558000268 |
| [17] |
KAWAI Y, SENO N, ANNO K. A modified method for chondrosulfatase assay[J]. Analytical Biochemistry, 1969, 32(2): 314-321. DOI:10.1016/0003-2697(69)90091-8 |
| [18] |
BITTER T, MUIR H M. A modified uronic acid carbazole reaction[J]. Analytical Biochemistry, 1962, 4(4): 330-334. DOI:10.1016/0003-2697(62)90095-7 |
| [19] |
ZHANG J, ZHANG Q, WANG J, et al. Analysis of the monosaccharide composition of fucoidan by precolumn derivation HPLC[J]. Chinese Journal of Oceanology and Limnology, 2009, 27: 578-582. DOI:10.1007/s00343-009-9205-0 |
| [20] |
韩少华, 朱靖博, 王妍妍. 邻苯三酚自氧化法测定抗氧化活性的方法研究[J]. 中国酿造, 2009, 28(6): 155-157. HAN Shaohua, ZHU Jingbo, WANG Yanyan. Measurement of the antioxidant activity by pyrogallol autoxidation[J]. China Brewing, 2009, 28(6): 155-157. |
| [21] |
田冰洁. 番石榴叶总黄酮的提取, 分离纯化及体外生物活性的研究[D]. 广州: 华南理工大学, 2013. TIAN Bingjie. Studies on the extraction, separation, purification of guava leaf flavonoids and their vitro bioactivities[D]. Guangzhou: South China University of Technology, 2013. |
| [22] |
张忠山. 坛紫菜多糖的化学结构修饰及其构效关系研究[D]. 青岛: 中国科学院海洋研究所, 2010. ZHANG Zhongshan. Chemical modification of porphyran from Porphyra haitanesis and study of structure-activity relationship[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2010. |
| [23] |
游丽君, 黄诗铭, 郑桂青, 等. 裙带菜多糖的结构及抗氧化、免疫调节活性[J]. 华南理工大学学报(自然科学版), 2018, 46(11): 35-44. YOU Lijun, HUANG Shiming, ZHENG Guiqing, et al. Structural, antioxidant activity and immunomodulatory activity of polysaccharides isolated from Undaria pinnatifida[J]. Journal of South China University of Technology(Natural Science Edition), 2018, 46(11): 35-44. |
| [24] |
蒋定文, 沈先荣, 贾福星, 等. 羊栖菜多糖的提取及纯化[J]. 食品科学, 2007(12): 28. JIANG Dingwen, SHEN Xianrong, JIA Fuxing, et al. Extraction and purification of Sargassum fusiforme polysaccharides[J]. Food Science, 2007(12): 28. |
| [25] |
李伟. 铜藻多糖的纯化, 结构及免疫活性的研究[D]. 温州: 温州大学, 2015. LI Wei. The purification, structure and munological activity of polysaccharides from Sargassum horneri[D]. Wenzhou: Wenzhou University, 2015. |
| [26] |
KIM W J, CHOI J W, JANG W J, et al. Low-molecular weight mannogalactofucans prevent herpes simplex virus type 1 infection via activation of Toll-like receptor 2[J]. International Journal of Biological Macromolecules, 2017, 103: 286-293. |
| [27] |
李伟, 张旭, 吴明江. HPLC法分析羊栖菜与铜藻多糖的单糖组成[J]. 高师理科学刊, 2015(7): 49-53. LI Wei, ZHANG Xu, WU Mingjiang. Analysis of the monosaccharide composition of polysaccharides from Sargassum fusiorme and Sargassum horneri by HPLC[J]. Journal of Science of Teachers College and University, 2015(7): 49-53. |
| [28] |
王玲, 唐德强, 王佳佳, 等. 铁皮石斛原球茎与野生铁皮石斛多糖的抗菌及体外抗氧化活性比较[J]. 西北农林科技大学学报: 自然科学版, 2016, 44(6): 167-172, 180. WANG Ling, TANG Deqiang, WANG Jiajia, et al. Comparison of antibacterial and in vitro antioxidant activities of polysaccharides from Dendrobium candidum protocorms and wild Dendrobium[J]. Journal of Northwest A & F University(Natural Science Edition), 2016, 44(6): 167-172, 180. |
| [29] |
HU T T, LIU D, CHEN Y, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Undaria pinnitafida in vitro[J]. International Journal of Biological Macromolecules, 2010, 46: 193-198. |
| [30] |
王凌, 孙利芹. 绿色巴夫藻多糖及降解产品的抗氧化和保湿性能[J]. 食品科学, 2012(21): 87-90. WANG Ling, SUN Liqin. Antioxidant activity, hygroscopicity and water retention of natural and degraded polysaccharides from Pavlova viridi[J]. Food Science, 2012(21): 87-90. |
| [31] |
王晶. 海带褐藻多糖硫酸酯的结构、化学修饰与生物活性研究[D]. 青岛: 海洋生物技术研发中心, 2010. WANG Jing. Study on the structure, derivatives and activity of fucoidan extracted from Laminia japonica[D]. Qingdao: Chinese Academy of Sciences, 2010. |
| [32] |
ZHANG Q, LI N, ZHOU G, et al. In vivo antioxidant activity of polysaccharide fraction from Porphyra haitanesis (Rhodephyta) in aging mice[J]. Pharmacological Research, 2003, 48(2): 151-155. |
| [33] |
QI H, ZHANG Q, ZHAO T, et al. Antioxidant activity of different sulfate content derivatives of polysaccharide extracted from Ulva pertusa (Chlorophyta) in vitro[J]. International Journal of Biological Macromolecules, 2005, 37(4): 195-199. |
| [34] |
JIMÉNEZ-Escrig A, GÓMEZ-Ordóñez E, RUPÉREZ P. Infrared characterisation, monosaccharide profile and antioxidant activity of chemical fractionated polysaccharides from the edible seaweed sugar Kombu (Saccharina latissima)[J]. International Journal of Food Science & Technology, 2015, 50(2): 340-346. |
| [35] |
TSIAPALI E, WHALEY S, KALBFLEISCH J, et al. Glucans exhibit weak antioxidant activity, but stimulate macrophage free radical activity[J]. Free Radical Biology and Medicine, 2001, 30(4): 393-402. |
| [36] |
ZHU X, RAINA A K, LEE H, et al. Oxidative stress signalling in Alzheimer's disease[J]. Brain Research, 2004, 1000(1/2): 32-39. |
| [37] |
KORYCKA-DAHL M, RICHARDSON T. Photogeneration of superoxide anion in serum of bovine milk and in model systems containing riboflavin and amino acids[J]. Journal of Dairy Science, 1978, 61(4): 400-407. |
| [38] |
WADE C R, JACKSON P G, HIGHTON J, et al. Lipid peroxidation and malondialdehyde in the synovial fluid and plasma of patients with rheumatoid arthritis[J]. Clinica Chimica Acta, 1987, 164(3): 245-250. |
| [39] |
陈杰, 董扬, 鲁吉珂, 等. 3种不同产地灵芝子实体粗多糖体外抗氧化活性比较研究[J]. 食品工业科技, 2016, 37(21): 100-104. CHEN Jie, DONG Yang, LU Jike, et al. Study on in vitro antioxidant activities of crude polysaccharides of three Ganoderma lucidum from different origins[J]. Science and Technology of Food Industry, 2016, 37(21): 100-104. |
| [40] |
凌娜, 李玮璐, 汲晨锋, 等. 海藻多糖的化学结构及生物活性研究新进展[J]. 中国海洋药物, 2021, 40(1): 69-78. LING Na, LI Weilu, JI Chenfeng, et al. New research progress in the chemical structures and biological activities of seaweed polysaccharides[J]. Chinese Journal of Marine Drugs, 2021, 40(1): 69-78. |
| [41] |
SUN L, WANG L, LI J, et al. Characterization and antioxidant activities of degraded polysaccharides from two marine Chrysophyta[J]. Food chemistry, 2014, 160: 1-7. |
| [42] |
赵雪, 董诗竹, 孙丽萍, 等. 海带多糖清除氧自由基的活性及机理[J]. 水产学报, 2011(4): 531-538. ZHAO Xue, DONG Shizhu, SUN Liping, et al. The scavenging activities and mechanism on oxygen free radicals of polysaccharides from Laminaria japonica[J]. Journal of Fisheries of China, 2011(4): 531-538. |
| [43] |
HALLIWELL B, GUTTERIDGE J M C, ARUOMA O I. The deoxyribose method: a simple "test-tube" assay for determination of rate constants for reactions of hydroxyl radicals[J]. Analytical Biochemistry, 1987, 165(1): 215-219. |
| [44] |
SHON M Y, KIM T H, SUNG N J. Antioxidants and free radical scavenging activity of Phellinus baumii (Hymenochaetaceae) extracts[J]. Food Chemistry, 2003, 82(4): 593-597. |
| [45] |
QI H, ZHANG Q, ZHAO T, et al. Antioxidant activity of different sulfate content derivatives of polysaccharide extracted from Ulva pertusa (Chlorophyta) in vitro[J]. International Journal of Biological Macromolecules, 2005, 37(4): 195-199. |
| [46] |
XING R, YU H, LIU S, et al. Antioxidant activity of differently regioselective chitosan sulfates in vitro[J]. Bioorganic & Medicinal Chemistry, 2005, 13(4): 1387-1392. |
| [47] |
ZHU Q Y, HACKMAN R M, ENSUNSA J L, et al. Antioxidative activities of oolong tea[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6929-6934. |
| [48] |
JIN W, ZHANG W, WANG J, et al. The neuroprotective activities and antioxidant activities of the polysaccharides from Saccharina japonica[J]. International Journal of Biological Macromolecules, 2013, 58: 240-244. |
| [49] |
马军, 侯萍, 陈燕, 等. 几种海藻多糖抗氧化活性及体外抗脂质过氧化作用的研究[J]. 南方水产科学, 2017(6): 99-106. MA Jun, HOU Ping, CHEN Yan, et al. Study on antioxidant activity and anti-lipid peroxidation effect of several algal polysaccharides[J]. South China Fisheries Science, 2017(6): 99-106. |
| [50] |
LI G Y, LUO Z C, YUAN F, et al. Combined process of high-pressure homogenization and hydrothermal extraction for the extraction of fucoidan with good antioxidant properties from Nemacystus decipients[J]. Food and Bioproducts Processing, 2017, 106: 35-42. |
| [51] |
吴雅清, 冷小鹏. 多糖体外抗氧化作用及其影响因素[J]. 广州化工, 2018, 46(4): 4-9, 16. WU Yaqing, LENG Xiaopeng. Antioxidant activity and influencing factors of polysaccharides in vitro[J]. Guangzhou Chemical Industry, 2018, 46(4): 4-9, 16. |
| [52] |
刘淑贞, 周文果, 叶伟建, 等. 活性多糖的生物活性及构效关系研究进展[J]. 食品研究与开发, 2017, 38(18): 211-218. LIU Shuzhen, ZHOU Wenguo, YE Weijian, et al. Research advance on biological activity and structure-activity relationships of bioactive polysaccharide[J]. Food Research and Development, 2017, 38(18): 211-218. |
| [53] |
CHEN H, ZHANG M, XIE B. Quantification of uronic acids in tea polysaccharide conjugates and their antioxidant properties[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3333-3336. |
| [54] |
WU H, MIN T, LI X, et al. Physicochemical properties and antioxidant activities of acidic polysaccharides from wampee seeds[J]. International Journal of Biological Macromolecules, 2013, 59: 90-95. |
 2023, Vol. 47
2023, Vol. 47

