文章信息
- 吴斌. 2023.
- WU Bin. 2023.
- 棕点石斑鱼循环水养殖系统细菌多样性分析
- Bacterial diversity analysis of recirculating aquaculture Epinephelus fuscoguttatus
- 海洋科学, 47(3): 116-127
- Marine Sciences, 47(3): 116-127.
- http://dx.doi.org/10.11759/hykx20220617001
-
文章历史
- 收稿日期:2022-06-17
- 修回日期:2022-11-01
棕点石斑鱼(Epinephelus fuscoguttatus)俗称“老虎斑”, 隶属鲈形目(Perciformes)、鮨科(Serranidae)、石斑鱼属(Epinephelus)[1]。为暖水性鱼类, 最适生长温度为25~28℃, 适合在10~30的盐度中生长, 具有广盐性, 主要养殖模式有网箱[2-3]和工厂化养殖[4-5]两种, 均是开放性水源, 病害防控难度较大, 导致养殖成活率和养殖效益不稳定, 养殖风险较高。目前关于棕点石斑鱼养殖育种的研究主要集中在胚胎发育观察[6]、营养研究[7]、遗传多样性分析[8]和杂交育种[9]等方面, 尚未见针对棕点石斑鱼的工厂化循环水养殖研究的报道。
肠道微生物在调节鱼类免疫反应、抑制潜在病原体和疾病防治等方面有着重要作用[10-11], 其菌源主要来源于投饲的食物和养殖环境。研究表明肠道菌群多样性与养殖水体环境的菌群结构、水位高低、水温变化、盐度高低等环境因素密切相关[12-13], 养殖过程中投入药品也直接影响到鱼类肠道的菌群稳定[14-15]。因此维持养殖环境及肠道菌群结构稳定是养殖成功的关键。随着二代高通量测序技术的普及, 16S rRNA高通量测序技术已被广泛应用于微生物菌落鉴定及多样性分析。尤其在鱼类肠道微生物研究方面[16], 例如利用16S rRNA高通量测序技术分析云龙石斑鱼(Epinephelus moara♀×Epinephelus lanceolatus♂)[16]、鳢(Ophicephalus argus)[17]和大西洋鲑(Salmo salar)[18]等鱼类肠道微生物多样性, 以及开展养殖水体及肠道微生物的关联性分析[19-20]。
棕点石斑鱼养殖技术相对落后, 病害防控难度大, 养殖风险高, 养殖经济效益不稳定。从产业健康发展考虑, 亟需探索新的养殖模式, 提高成活率和生长速度, 增加养殖效益。本文依托“陆基工厂化循环水石斑鱼养殖试验示范”项目, 初步研究了棕点石斑鱼在工厂化循环水养殖模式下的养殖效果和菌群结构多样性变化情况, 以期为该模式的应用推广提供重要参考。
1 材料与方法 1.1 试验条件试验在泉盈(福建)科技有限公司陆基工厂化循环水养殖车间中进行。陆基工厂化循环水养殖车间的关键设备包括供水设备、管路系统、机械过滤器、生物过滤器、蛋白分离器、杀菌设备、溶解气体调控设备以及供电设备等(图 1)。通过去除养殖水体中残饵粪便、氨氮、亚硝酸盐氮等有害污染物, 达到净化养殖环境的目的, 利用物理过滤、生物过滤、去除CO2、消毒、增氧、调温等处理将净化后的水体重新输入养殖池的过程, 实现养殖水体自净并循环利用。工厂化养殖循环水系统为模块化设计, 每个模块设计22个养殖水槽, 配备一套完整的工厂化循环水净化系统。养殖水槽为PE材质、直径为8 m、水槽水位深度为1.5 m。
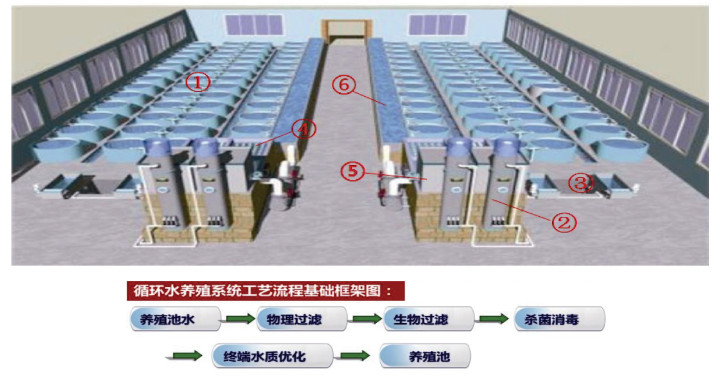 |
| 图 1 循环水养殖系统示意图 Fig. 1 Schematic of the recirculating aquaculture system 注: ①养殖缸体; ②臭氧系统; ③紫外线消杀系统; ④生物膜反应系统; ⑤蓄水池; ⑥出鱼系统 |
挑选体质健壮、体型正常、规格整齐、游动活泼的51 000尾棕点石斑鱼苗种, 平均体质量为(13.72± 0.51) g/尾、平均体长为(8.90±0.66) cm/尾, 所选苗种放养前用消毒剂溶液浸泡3 min, 杀死寄生在鱼体的病原微生物。苗种处理完后, 按1.93 kg/m3的养殖密度, 将试验鱼平均分配至6个养殖槽(约8 500尾/槽)中进行养殖试验(图 2)。
 |
| 图 2 棕点石斑鱼循环水养殖系统 Fig. 2 Recirculating aquaculture system of E. fuscoguttatus |
饲料为48%的石斑鱼专用配合饲料, 每天投喂两次: 8: 00~9: 00、15: 00~16: 00, 日投饵量控制在鱼体质量的2%~3%。
1.4 日常管理循环水养殖设备专人专管, 每日定时巡查循环水设备及监控系统, 观察棕点石斑鱼摄食及其他活动情况。实时采集水温、溶解氧、盐度、pH值等水质指标。每日用刷子清理养殖池1次, 清除池底和池壁上的附着物。
1.5 样品采集与检测 1.5.1 养殖棕点石斑鱼生长情况测量养殖过程中每个月每个槽随机抽测15尾棕点石斑鱼的体长和体质量, 分析生长情况。
1.5.2 养殖水质指标检测安装水质在线监控设备, 定期采集水温、溶解氧、盐度、pH值等水质指标。
1.5.3 养殖鱼肠道和水体样品采集棕点石斑鱼苗进入循环水养殖系统培育2个月后, 系统运行逐渐稳定, 第三个月开始每个月定期采集养殖鱼肠道和水体样品1次, 连续跟踪监测8个月, 用于16S rRNA高通量测序分析, 每个月从不同的养殖槽中随机采集3个鱼体肠道样品, 合并后作为代表当月的鱼体肠道样品; 同时采集3个水样, 合并后作为代表当月的水体样品。
随机取3尾棕点石斑鱼解剖, 取出肠道, 用70%酒精擦拭肠道外表面, 切取肠道的前、中和后3段, 分别用无菌ddH2O冲洗, 无菌离心管收集肠道内含物, 放入液氮速冻, –80 ℃超低温冰箱保存备用。
每个水样取3 L, 经过孔径为0.1 µm的滤膜过滤, 用无菌ddH2O冲洗滤膜至无菌离心管中, 离心后取沉淀组织, 放入液氮速冻, –80℃超低温冰箱保存备用。
1.5.4 总DNA提取和16S rRNA高通量测序将鱼体肠道样品用灭菌过的电动组织研磨器进行研磨, 离心后取沉淀组织, 参照磁珠法土壤 & 粪便基因组DNA抽提试剂盒(上海生工, B618763)说明书步骤提取总DNA。水样以同样的方法提取DNA。将所有样品针对细菌16S rRNA基因可变区(V3~V4区)进PCR扩增。使用细菌通用引物为: 341F(5′-CCTAYG GGRBGCASCAG-3′)和806R(5′-GGACTACNNGGG TATCTAAT-3′), 得到PCR产物在Illumina HiSeq测序平台上进行高通量测序。
1.6 数据分析 1.6.1 测序的数据处理首先, 原始数据通过Barcode序列拆分出各个样品的测序数据, 使用FastQC软件(v0.11.5)去除Barcode序列和引物序列。其次, 利用FLASH软件(v1.2.7)对各个样品的reads进行拼接、过滤, 得到高质量的数据。最后, 使用QIIME2软件(https://qiime2.org)检验并去除嵌合体序列, 得到可以分析的有效数据。
1.6.2 OTU聚类和物种注释利用Uparse算法(Uparse v7.0.1001, http://drive5.com/uparse/)对所有样品的全部数据进行聚类, 默认以97%的相似性将其聚类成操作分类单元OTUs(Operational Taxonomic Units)、根据软件默认参数, 筛选OTUs中出现频数最高的序列作为OTUs代表序列。使用MOTHUR软件(v 1.14.0)在SILVA数据库(v 123)中对得到的OTUs代表序列进行物种注释分析。
1.6.3 样品多样性分析和统计学分析使用QIIME2软件包计算群落丰富度指数(Chao)、群落多样性指数(Shannon and Simpson), 使用R软件(v3.5.2)绘制稀释曲线并进行Alpha多样性指数组间差异分析。使用STAMP(v.2.1.3)进行Metastats分析: 通过对组间样本进行比较, 在各分类水平上找出肠样和水样中具有显著差异的物种, 差异的显著性使用SPSS(v 20.0)进行配对t检验分析。
2 试验结果 2.1 生长情况经过12个月养殖并测产(2018年9月17日-2019年9月15日), 收集到棕点石斑鱼循环水养殖试验生长情况数据, 棕点石斑鱼41 620尾, 成活率83.2%±7.6%。生长情况如图 3所示, 棕点石斑鱼的平均体质量为(487.32±12.68) g/尾、平均体长为(31.24±1.22) cm/尾。与初始体质量相比, 棕点石斑鱼平均增质量473.62 g/尾, 平均日增质量为1.30 g。
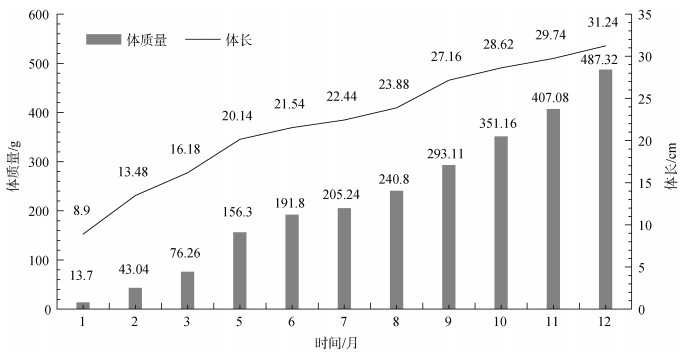 |
| 图 3 棕点石斑鱼在循环水养殖系统中的生长情况 Fig. 3 Growth performance of E. fuscoguttatus in the recirculating aquaculture system |
养殖过程中水温控制在20~30 ℃, 日变化幅度小于2 ℃, 保持水温稳定。养殖盐度范围控制在20~30, pH值范围为7~8。水中溶解氧饱和度在80%~110%, 二氧化碳浓度小于15 mg/L。
2.3 细菌多样性分析首先为了评估不同样品的测序量的饱和情况, 对肠样和水样的测序数据经过OTU比对后, 绘制稀疏性曲线(图 4), 所有样品的稀疏曲线随序列数量增加而趋于平缓且均达到饱和水平。棕点石斑鱼的肠道与水体样品平均有效OTUs(为了减少误差, 将序列数量≥5的OTU定义为有效OTU)数目分别为3 754和5 998个。通过OTUs聚类的结果表明, 肠道中微生物分属于4个门、6个纲、9个目、12个科、18个属; 水体中微生物分属于5个门、8个纲、11个目、18个科、26个属。肠道Chao1、Shannon、Simpson 3个指数均低于水体, 表明肠道微生物的物种数量和多样性均低于养殖水体(表 1)。
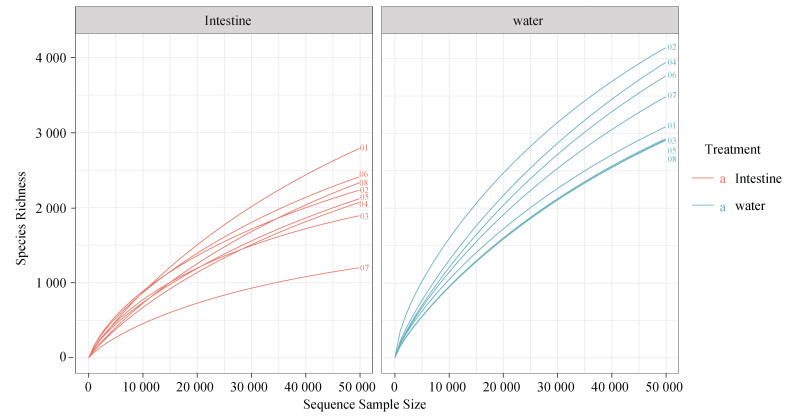 |
| 图 4 肠道和水体16S rRNA基因扩增子测序样品的稀疏性曲线 Fig. 4 Rarefaction curves of 16S rRNA gene-amplicon sequencing in the intestine and water samples 注: 图中不同的曲线代表不同月份的样品, 橙色为肠道组织样品, 绿色为水体样品 |
| 采样时间(年.月.日) | 有效OTU数目(个) | Chao1指数 | Shannon指数 | Simpson指数 | |
| Intestine_01 | 2018.11.17 | 3 820 | 25 339.449 | 1.994 995 3 | 1.809 742 |
| Intestine_02 | 2018.12.15 | 3 683 | 16 035.648 | 1.273 159 8 | 1.339 258 |
| Intestine_03 | 2019.1.15 | 4 162 | 18 368.242 | 3.445 137 | 6.892 24 |
| Intestine_04 | 2019.2.15 | 3 638 | 18 185.396 | 2.650 984 4 | 3.896 694 |
| Intestine_05 | 2019.3.16 | 4 294 | 25 596.769 | 2.376 659 | 3.420 235 |
| Intestine_06 | 2019.4.15 | 4 990 | 24 624.24 | 2.086 561 9 | 2.286 689 |
| Intestine_07 | 2019.5.15 | 3 731 | 20 135.498 | 2.057 854 9 | 1.704 583 |
| Intestine_08 | 2019.6.16 | 1 713 | 5 578.446 | 0.931 372 3 | 1.241 158 |
| Water_01 | 2018.11.17 | 6 815 | 38 798.957 | 4.107 671 4 | 12.321 988 |
| Water_02 | 2018.12.15 | 5 213 | 25 756.419 | 3.163 521 9 | 6.499 206 |
| Water_03 | 2019.1.15 | 5 274 | 29 934.116 | 3.559 222 8 | 8.819 085 |
| Water_04 | 2019.2.15 | 5 315 | 28 167.296 | 3.289 984 6 | 6.660 029 |
| Water_05 | 2019.3.16 | 6 330 | 33 423.068 | 3.778 593 3 | 9.048 347 |
| Water_06 | 2019.4.15 | 7 101 | 42 280.497 | 4.631 254 2 | 22.201 522 |
| Water_07 | 2019.5.15 | 5 468 | 26 751.306 | 3.722 105 1 | 9.132 291 |
| Water_08 | 2019.6.16 | 6 467 | 34 121.145 | 5.606 070 9 | 30.595 851 |
将不同月份肠样和水样进行NMDS分析, 聚类显示样品之间的分组情况。结果如图 5所示, 每个点代表 1个样本, 不同颜色的点分别代表肠道和水体, 两点之间的距离越近, 表明两个样本之间的细菌群落结构相似度越高, 差异越小。从图 5中可见肠道和水体之间大部分点的距离较远, 说明样本之间的细菌群落结构相似度较低, 差异较大。
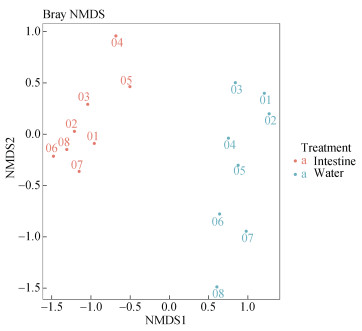 |
| 图 5 肠道和水体16S rRNA基因扩增子测序样品的NMDS聚类分析结果 Fig. 5 NMDS cluster analysis of 16S rRNA gene-amplicon sequencing in the intestine and water samples 注: 图中不同的圆圈代表不同月份的样品, 橙色为肠道组织样品, 绿色为水体样品 |
水体和肠道OTU维恩图分析结果如图 6所示, 水体样品一共得到34 540个特异性OTU, 肠道19 838个特异性OTU。二者共有的OTU只有2 259个。对水样和肠道共有的OTU进行微生物分类, 结果如图 7所示, 共有的OTU主要为发光杆菌属(Photobacterium)和弧菌属, 且不同月份之间的差异较小。
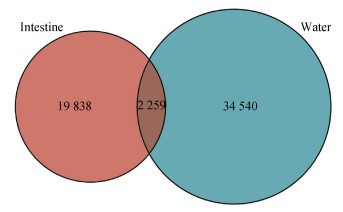 |
| 图 6 肠道和水体16S rRNA基因扩增子测序样品的OTU维恩图分析结果 Fig. 6 Venn analysis of 16S rRNA gene-amplicon sequencing OTUs in the intestine and water samples 注: 图中橙色为肠道组织样品, 绿色为水体样品, 肠道中特有的OTU数目为19 838, 水体中特有的OTU数目为34 540, 两者共有的OTU数目为2 259 |
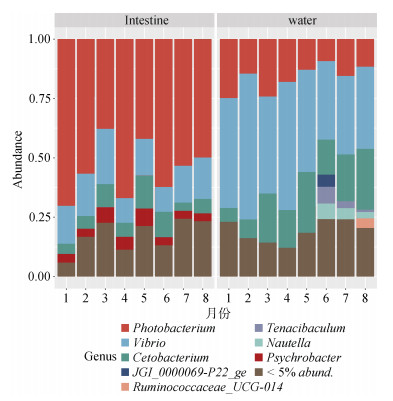 |
| 图 7 肠道和水体样品中共有的OTU在属水平上的分布情况 Fig. 7 Distribution of OTU at the genus level between the intestine and water samples 注: 图中不同颜色代表不同属的OTU, 横坐标为不同月份的样品, 纵坐标为丰度值 |
将肠道和水样的检测数据进行差异OTU分析, 绘制火山图, 结果如图 8所示, 在水样中处于丰度高水平的OTU有2 315个, 在肠道中处于丰度高水平的OTU有3 154个。
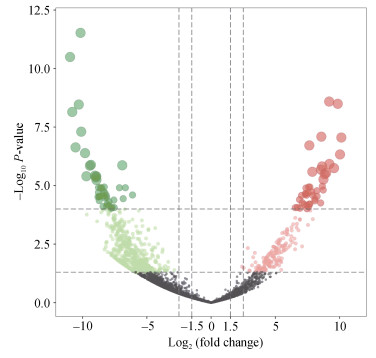 |
| 图 8 肠道和水体样品中差异OTU的火山图 Fig. 8 Volcano plot depicting the differential OTUs between the intestine and water samples 注: 图中左边是肠道组, 右边是水体组, 气泡大小代表相关丰度, 图中高亮的表示显著变化并且差异倍数大于2倍的OTU。X轴为两组OTU相对丰度比较的变化倍数取2的对数(log2), Y轴为两组OTU相对丰度相比统计上的显著性P-value值, 取负对数10变换-log10(P-value) |
进一步探究在肠道和水体样品中丰度差异显著的OTU在属(Genus)分类水平上的注释情况, 如图 9所示, 肠道中高丰度的OTU主要集中红树杆菌属(Mangrovibacter)、尿毒杆菌属(Ureibacillus)、叶状杆菌属(Phyllobacterium)、博斯氏菌属(Bosea)、伯克氏菌属(Burkholderia−Caballeronia−Paraburkholderia)、慢生根瘤菌属(Bradyrhizobium)、罗尔斯通菌属(Ralstonia)、厌氧芽胞杆菌属(Anaerobacillus)、Leuconostoc、鞘氨醇单胞菌属(Sphingomonas)、代尔夫特菌(Delftia)、奈瑟氏菌属(Neisseria)、杯状杆菌属(Cutibacterium)、嗜血杆菌(Haemophilus)、瘤球菌属(Ruminococcaceae_UCG−014)、不动杆菌属(Acinetobacter)、瘤球菌属(Ruminococcaceaege)、嗜冷杆菌属(Psychrobacter)、梭杆菌属(Fusobacterium)、寡养单胞菌属(Stenotrophomonas)、Pseudomonas、单胞菌属(Pelomonas)、链球菌属(Streptococcus)、瘤球菌属_ UCG−013 (Ruminococcaceae_UCG−013)、乳酸杆菌属(Lactobacillus)。水体中高丰度的OTU主要集中在海洋细胞菌属(Marinicella)、海绵杆菌属(Spongiibacter)极地杆菌(Polaribacter)、白杆海居菌(Marivivens)、类杆菌属(Bacteroidia)、海生棒状菌属(Thalassotalea)、单胞菌属(Algicola)、别单胞菌属(Alteromonas)、藏红花黄色线菌属(Crocinitomix)、雷辛格氏菌属(Leisingera)、中黄杆菌属(Mesoflavibacter)、沈氏菌属(Shimia)、疣微菌属(Persicirhabdus)、油螺旋菌属(Oleispira)、假黄杆菌属(Pseudofulvibacter)、海境华美菌属(Formosa)、慢杆菌属(Lentibacter)、韧杆菌属(Tenacibaculum)、李时珍菌属(Lishizhenia)、纤维弧菌属(Cellvibrionales)、拟杆菌属(Tamlana)、疣微菌属(Rubritalea)、嗜中温菌属(Glaciecola)、海洋细菌属(Marinobacterium)。
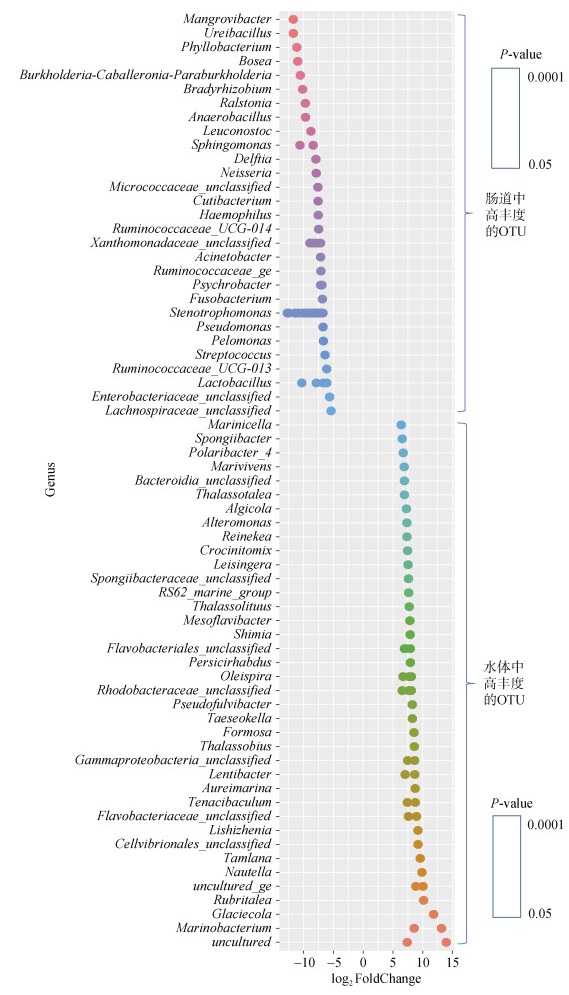 |
| 图 9 肠道和水体样品中丰度差异的OTU在属水平上的分布情况 Fig. 9 The abundances of differential OTU at the genus level between the intestine and water samples 注: 图中横坐标表示差异倍数的log2值, 纵坐标表示不同属的名称, 圆圈中的颜色的深浅表示显著性 |
细菌群落在不同的物种中具有高度的多样性, 通常以Chao1指数、Shannon指数和Simpson指数在内的几个指数来评估菌落的丰富度和均匀度。棕点石斑鱼肠道的有效OTU数、Chao1指数、Shannon指数和Simpson指数皆低于水体(表 1), 表明循环水水体中微生物物种数目、多样性和丰富度都比较高, 菌群多样性高于肠道。通过稀疏曲线图分析(图 4), 所测数据量同样反映了细菌群落结构和多样性, 结果与表 1相似。不同月份肠道和水体样品NMDS分析发现左边是肠道组, 右边是水体组, 两个样本间分组界限清晰, 说明两组样品之间的菌群多样性差异显著。
3.2 养殖水体微生物组成和相对丰度分析从分析结果看, 棕点石斑鱼肠道和水体共有的微生物主要为发光杆菌属(Photobacterium)和弧菌属(Vibiro), 且丰度高差异不显著, 这与对黑虎虾(Penaeus monodon)[21]、海水鱼[22]和马氏珠母贝(Pinctada martensii)[23]的研究结果一致。发光杆菌属多是兼性厌氧、异氧菌, 广泛分布在海水和动物肠道中[24-25], 与卵形鲹(Trachinotus ovatus)肠道屏障的功能障碍有关系[26], 参与降解有机物, 其代谢产物具有抗菌能力[27]。弧菌是海水养殖中常见的致病菌, 可导致水产动物大规模死亡[28]。弧菌还可以降解海藻多糖[29]; 产生部分蛋白酶有助于牙鲆(Paralichthys olivaceus)生长发育[30]; 参与机体消化碳水化合物和脂肪等[31], 是海洋环境和海水动物的组成部分, 维持海洋生态环境[32]。
除了肠道和水体共有微生物外, 二者间也有特异的菌群。棕点石斑鱼肠道中占优势地位的微生物主要是辅助肠道消化食物, 如慢生根瘤菌属是豆科植物共生的固氮微生物[33], 在虹鳟(Oncorhynchus mykiss)体内与脂肪代谢相关[34]。红树杆菌属常出现于植物体内[35], 推测慢生根瘤菌和红树杆菌是通过饲料定植在棕点石斑鱼肠道内。瘤胃菌属(Ruminococcaceaege)参与初级胆汁酸的生物转化[36]。嗜冷杆菌属、不动杆菌属、罗尔斯通氏菌属、梭杆菌属和鞘氨醇单胞菌属是棕点石斑鱼肠道中高丰度存在的菌群。鞘脂单胞菌属于鱼类肠道益生菌, 对于维持肠道功能、避免消化功能紊乱等具有重要作用[37]。嗜冷杆菌属和不动杆菌属在细鳞鱼(Brachymystax lenok)和黑斑狗鱼(Esox reicherti)肠道中也是优势菌[38]。乳酸杆菌属抗氧化活性强[39], 是多数鱼类肠道中的益生菌, 产生抗菌肽和蛋白, 抑制病原菌的生长[40]。
本研究跟踪采集了棕点石斑鱼肠道样品, 初步分析了肠道细菌在生长过程中的变化规律。在成长过程中, 发光杆菌属的细菌比例在逐步减少, 这可能是长期投喂人工饲料所致。而慢生根瘤菌属、红树杆菌属、瘤胃菌属和嗜冷杆菌属等优势菌群相对稳定, 大部分与鱼类肠道消化和维持肠道菌群平衡相关。水体中优势菌群主要是假黄杆菌、极地杆菌、嗜中温菌属、油螺旋菌属和海绵杆菌属等, 对维持水体中有机物代谢平衡和菌群稳定具有重要的作用。
石斑鱼的肠道微生物近年来也是水产养殖研究的热点。凌泽春等[41]研究了斜带石斑鱼幼鱼消化道与养殖水体中可培养的菌群的多样性, 在幼鱼肠道和水体中均检测到大量弧菌的存在, 这也与我们研究相一致。施兆鸿等[42]对工厂化循环水养殖条件下云纹石斑鱼(Epinehelus moara)消化道产酶菌的分离鉴定, 发现云纹石斑鱼幼鱼消化道内可培养的主要菌群为假单胞菌属(Pseudomonas)、微小杆菌属(Exiguobacterium)、不动杆菌属、寡养单胞菌属(Stenotrophomonas)和葡萄球菌属(Staphylococcus), 但是他们的研究是通过培养的方法, 有一些厌氧菌未能检测到。而本研究分析发现的棕点石斑鱼肠道中发光杆菌属占主要比例, 发光杆菌属多是兼性厌氧, 异氧菌, 补充了他们研究的不足, 能更好解析石斑鱼的肠道微生物多样性。麦浩彬等[43]比较了摄食不同水平饲料蛋白质对珍珠龙胆石斑鱼(Epinephelus lanceolatu♂×Epinephelus fuscoguttatus♀)幼鱼肠道组织形态和菌群组成的影响, 其中发现不同喂养组中红球菌属(Rhodococcus)、罗尔斯通氏菌属和不动杆菌属为各组的优势菌, 本研究也发现了罗尔斯通氏菌属和不动杆菌属为优势菌群。说明了棕点石斑鱼与其他的石斑鱼在肠道细菌的多样性方面, 具有相似性, 为石斑鱼的饲料和益生菌开发提供了一些思路。
3.3 循环水养殖棕点石斑鱼的前景分析循环水养殖系统为棕点石斑鱼提供了稳定生长环境, 有利于养殖水体和鱼类肠道有益微生物的繁殖和发挥功效。试验结果显示循环水养殖系统中的原生菌群对于棕点石斑鱼肠道菌群结构具有一定的影响, 例如发光杆菌属和弧菌属等, 既有有益菌也有病原菌。MA[16]和侯婷婷[20]等在云龙石斑鱼(Epinephelus moara♀×Epinephelus lanceolatus♂)和青石斑鱼(Epinephelus awoara)肠道微生物群体研究试验结果中也得到了这一结论。因此如何维持养殖水体中的菌群稳定, 做好起始水体和日常补充水源的消毒工作是循环水养殖成功的关键之一。此外, 封闭式循环水养殖可避免水源带入病原菌、减少药物的使用量, 同时也降低了病害损失的风险。裘钱玲琳等[19]研究发现循环养殖模式相较于土池养殖模式具有更稳定的菌群结构, 抗冲击能力强。传统棕点石斑鱼养殖模式具有耗时费力、成活率不稳定、病害防控难度大等缺点。而工厂化循环水养殖系统具有节水、病害少、高产、高效等优点。棕点石斑鱼属于凶猛型肉食海水鱼类, 在高密度养殖过程中, 容易出现大小分化, 甚至发生互残现象。工厂化循环水养殖车间池子多, 便于定期开展人工筛选, 将鱼苗分级培育, 提升养殖成活率, 保障不同级别鱼苗的生长空间和营养需求, 可实现精细化管理, 提升养殖效益。
4 结论陆基工厂化循环水养殖模式作为新型的绿色养殖模式, 通过设施设备实现水质自动调节, 将养殖过程中产生的氨态氮氧化成无毒的硝态氮, 实现封闭循环水养殖生产。与传统养殖方式相比, 具有节水、节地、高密度、集约化和排放可控的特点, 符合中国水产养殖未来发展的要求。循环水养殖水体和石斑鱼的肠道的细菌菌群具有一定的关联性, 二者之间共有细菌主要有发光杆菌属和弧菌属。在不同养殖阶段, 棕点石斑鱼的肠道和养殖水体的细菌菌群多样性变化不显著, 体现了循环水养殖环境可控的优势。棕点石斑鱼在陆基工厂化循环水养殖模式中经过12个月的养殖, 单位水体产量达到43.45 kg/m3, 平均利润达20.5元/kg, 而普通水泥池塘养殖产量约为20 kg/m3, 平均利润为15.3元/kg, 封闭式循环水养殖, 大大节约了养殖用水量和病害损失, 单位水体的产量提升了2倍多, 试验达到预期目标和效果, 为今后示范推广工作提供重要参考。
致谢: 本论文工作完成过程中, 得到福建省淡水水产研究所薛凌展副研究员、廖梦香助理农艺师, 福建师范大学黄镇副教授以及福建省水产技术推广总站林楠工程师、李苗苗工程师的支持与帮助, 在此, 由衷地表示感谢!
| [1] |
成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987: 10-41. CHENG Qingtai, ZHENG Baoshan. Chinese fish system retrieval[M]. Beijing: Science Press, 1987: 10-41. |
| [2] |
符书源, 刘金叶, 王永波, 等. 棕点石斑鱼池塘网箱养殖模式研究[J]. 水产科技情报, 2013, 40(2): 64-66. FU Shuyuan, LIU Jinye, WANG Yongbo, et al. Study on pond cage culture model of Epinephelus fuscoguttatus[J]. Aquatic Science and Technology Information, 2013, 40(2): 64-66. |
| [3] |
严俊贤, 许小华, 梁晓春, 等. 棕点石斑鱼网箱养殖试验研究[J]. 安徽农业科学, 2012, 40(11): 6524-6526. YAN Junxian, XU Xiaohua, LIANG Xiaochun, et al. Experimental study on the culture of Epinephelus fuscoguttatus with shallow net cages[J]. Journal of Anhui Agricultural Sciences, 2012, 40(11): 6524-6526. |
| [4] |
张国安. 北方地区老虎斑工厂化养殖技术[J]. 科学养鱼, 2009, 2: 25. ZHAGN Guoan. Industrial farming technology of tiger spot in northern China[J]. Scientific Fish Farming, 2009, 2: 25. |
| [5] |
马建忠, 单乐州, 吴洪喜, 等. 棕点石斑鱼陆海接力养殖试验[J]. 科学养鱼, 2020, 1: 60-61. MA Jianzhong, SHAN Lezhou, WU Hongxi, et al. Experiment on landsea relay culture of Epinephelus fuscoguttatus[J]. Scientific Fish Farming, 2020, 1: 60-61. |
| [6] |
林彬, 黄宗文, 骆剑, 等. 棕点石斑鱼胚胎发育的观察[J]. 海南师范大学学报(自然科学版), 2010, 23(1): 87-92. LIN Bin, HUANG Zongwen, LUO Jian, et al. Embryonic development observation of Epinephelus fuscoguttatus[J]. Journal of Hainan Normal University (Natural Science), 2010, 23(1): 87-92. |
| [7] |
郭永军, 邢克智, 徐大为, 等. 棕点石斑鱼的肌肉营养成分分析[J]. 水产科学, 2009, 28(11): 635-638. GUO Yongjun, XING Kezhi, XU Dawei, et al. Evaluation of nutritive quality and components in muscle of brownmarbled grouper Epinephelus fuscoguttatus[J]. Fisherties Science, 2009, 28(11): 635-638. |
| [8] |
周翰林, 杨森, 高川, 等. 两种杂交石斑鱼子一代及其亲本的线粒体COI基因遗传变异分析[J]. 热带生物学报, 2012, 3(1): 1-10. ZHOU Hanlin, YANG Sen, GAO Chuan, et al. Analysis of genetic variability of mtDNA COI genes between two grouper hybrids and their parents[J]. Journal of South China University of Tropical Agriculture, 2012, 3(1): 1-10. |
| [9] |
田永胜, 唐江, 马文辉, 等. 蓝身大斑石斑鱼冷冻精子(♂)与棕点石斑鱼(♀)杂交后代发育及生长特征分析[J]. 渔业科学进展, 2019, 40(6): 46-47. TIAN Yongsheng, TANG Jiang, MA Wenhui, et al. Development and growth of hybrid offspring of brown grouper Epinephelus fuscoguttatus (♀)×blue speckled grouper Epinephelus tulcula (♂) using cryopreserved sperm[J]. Progress in Fishery Science, 2019, 40(6): 46-47. |
| [10] |
VERSCHUERE L, ROMBAUT G, SORGELOOS P, et al. Probiotic bacteria as biological control agents in aquaculture[J]. Microbiology and Molecular Biology Reviews, 2000, 64(4): 655-671. DOI:10.1128/MMBR.64.4.655-671.2000 |
| [11] |
GÓMEZ G D, BALCÁZAR J L. A review on the interactions between gut microbiota and innate immunity of fish[J]. FEMS Immunology & Medical Microbiology, 2008, 52(2): 145-154. |
| [12] |
翟万营, 郭安宁. 鱼类肠道微生物研究进展[J]. 河南水产, 2016, 4: 18-21. ZHAI Wanying, GUO Anning. Research progress on the fish intestinal microbiota[J]. Henan Shuichan, 2016, 4: 18-21. |
| [13] |
SPANGGAARD B, HUBER I, NIELSEN J, et al. The microflora of rainbow trout intestine: a comparison of traditional and molecular identification[J]. Aquaculture, 2000, 182(1): 1-15. |
| [14] |
NAVARRETE P, MARDONES P, OPAZO R, et al. Oxytet-racycline treatment reduces bacterial diversity of intestinal microbiota of Atlantic salmo[J]. Journal of Aquatic Animal Health, 2008, 20(3): 177-183. DOI:10.1577/H07-043.1 |
| [15] |
吴欢欢, 王伟继, 吕丁, 等. 应用高通量测序技术分析大菱鲆幼鱼肠道及其养殖环境的微生物群落结构[J]. 渔业科学进展, 2019, 40(4): 84-94. WU Huanhuan, WANG Weiji, LÜ Ding, et al. Turbot (Scophthalmus maximus) biodiversity assessment using high-throughput illumina sequencing to analyze juvenile turbot intestines and their bacterial cultures[J]. Pro g ress in Fishery Sciences, 2019, 40(4): 84-94. |
| [16] |
MA C, CHEN C X, JIA L, et al. Comparison of the intestinal microbiota composition and function in healthy and diseased Yunlong grouper[J]. AMB Express, 2019, 9(1): 187. |
| [17] |
徐晟云, 陈昆慈, 罗青, 等. 基于16S rRNA高通量测序的鳢肠道微生物群落结构研究[J]. 大连海洋大学学报, 2020, 35(5): 693-700. XU Shengyun, CHEN Kunci, LUO Qing, et al. Microbial community in intestine of snakehead based on 16S rRNA high-throughput sequencing[J]. Journal of Dalian Fisheries University, 2020, 35(5): 693-700. |
| [18] |
WANG C, SUN G X, LI S S, et al. Intestinal microbiota of healthy and unhealthy Atlantic salmon Salmo salar. in a recirculating aquaculture system[J]. Journal of Oceanology & Limnology, 2018, 36(2): 414-426. |
| [19] |
裘钱玲琳, 徐如卫, 朱建林, 等. 凡纳滨对虾土塘养殖与循环养殖系统细菌群落结构比较研究[J]. 生物学杂志, 2015, 32(6): 45-49. QIU Qianlinglin, XU Ruwei, ZHU Jianlin, et al. Comparison of bacterial communities in the earthen pond and the recirculating aquaculture system for Litopenaeus vannamei cultivation[J]. Journal of Biology, 2015, 32(6): 45-49. |
| [20] |
侯婷婷, 钟志平, 刘缨, 等. 青石斑鱼海水循环水养殖水体的细菌群落特征[J]. 微生物学报, 2016, 56(2): 253-263. HOU Tingting, ZHONG Zhiping, LIU Ying, et al. Bacterial community characterization of rearing water of marine recirculating aquaculture systems for yellow grouper (Epinephelus awoara)[J]. Acta Microbiologica Sinica, 2016, 56(2): 253-263. |
| [21] |
MINAMI K, TING H W L, VIVIANA L, et al. Biodiversity of the intestinal microbiota of black tiger prawn, Penaeus monodon, increases with age and is only transiently impacted by major ingredient replacement in the diet[J]. Aquaculture Reports, 2022, 22: 100948. |
| [22] |
SIAN E, SARAH C, JASSON W, et al. The gut microbiota of marine fish[J]. Front Microbiol, 2018, 9: 873. |
| [23] |
陈琨, 黄湾, 廖永山, 等. 马氏珠母贝肠道及其养殖水体可培养细菌群落结构[J]. 广东海洋大学学报, 2021, 41(1): 47-54. CHEN Kun, HUANG Wan, LIAO Yongshan, et al. Community structure of culturable bacterial communities in the intestine of Pinctada fucata martensii and its aquaculture water[J]. Journal of Guangdong Ocean University, 2021, 41(1): 47-54. |
| [24] |
薛超波, 王国良, 金珊, 等. 滩涂贝类养殖环境中细菌生态分布的初步研究[J]. 中国卫生检验杂志, 2005, 15(10): 1191-1193. XUE Chaobo, WANG Guoliang, JIN Shan, et al. The preliminary study on the bacteria ecological distribution in the culture environment of marine interdial shellfish[J]. Chinese Journal of Health Laboratory, 2005, 15(10): 1191-1193. |
| [25] |
OSORIO C R, TORANZO A E, ROMALDE J L, et al. Multiplex PCR assay for ureC and 16S rRNA genes clearly discriminates between both subspecies of Photobacterium damselae[J]. Diseases of Aquatic Organisms, 2000, 40(3): 177-183. |
| [26] |
ZHAO D H, SUN J J, LIU L, et al. Characterization of two phenotypes of Photobacterium damselae subsp. damselae isolated from diseased juvenile Trachinotus ovatus reared in cage mariculture[J]. Journal of World Aquaculture Society, 2009, 40(2): 281-289. |
| [27] |
郑立, 林伟, 严小军, 等. 海洋细菌抗菌和细胞毒活性的初步研究[J]. 应用生态学报, 2004, 15(9): 1633-1636. ZHENG Li, LIN Wei, YAN Xiaojun, et al. A primary study on antimicrobial and cytotoxic activity of marine bacteria[J]. Chinese Journal of Applied Ecology, 2004, 15(9): 1633-1636. |
| [28] |
HUGHES J B, HELLMANNell J J, RICKETTS T H, et al. Counting the uncountable: statistical approaches to estimating microbial diversity[J]. Applied and Environmental Microbiology, 2001, 67(10): 4399-4406. |
| [29] |
杨求华, 葛辉, 方旅平, 等. 池塘养殖刺参病原菌塔式弧菌的分离与鉴定[J]. 南方水产科学, 2014, 10(4): 45-51. YANG Qiuhua, GE Hui, FANG Lvping, et al. Identification of Vibrio tubiashii isolated from diseased pond cultured sea cucumbers (Apostichopus japonicus)[J]. Southern Fisheries Science, 2014, 10(4): 45-51. |
| [30] |
ASFIE M, YANAGI H, OKANO R, et al. The proteaseproducing ability of vibrios isolated from larvae and juveniles of Japanese flounder[J]. Aquaculture Science, 2000, 48(1): 139-140. |
| [31] |
HAMID A, SAKATA T, KAKIMOTO D. Microflora in the alimentary tract of gray mullet-Ⅱ: a comparison of the mullet intestinal microflora in fresh and sea water[J]. Bulletin of the Japanese Society of Scientific Fisheri, 1978, 44(1): 53-57. |
| [32] |
TANAKA R, SHIBATA T, MIYAKE H, et al. Temporal fluctuation in the abundance of alginate-degrading bacteria in the gut of abalone Haliotis gigantea over 1 year[J]. Aquaculture Research, 2016, 47(9): 2899-2908. |
| [33] |
TIIROLA M A, MANNISTO M K, PUHAKKA J A, et al. Isolation and characterization of novosphingobium sp strain MT1, a dominant polychlorophenol-degrading strain in a groundwater bioremediation system[J]. Applied and Environmental Microbiology, 2002, 68(1): 173-180. |
| [34] |
李礼, 姜海波, 姜志强, 等. 饲料添加杜仲皮水提物对虹鳟生长、肠道组织学及菌群多样性的影响[J]. 大连海洋大学学报, 2020, 35(4): 481-490. LI Li, JIANG Haibo, JIANG Zhiqiang, et al. Effects of aqueous extract of Eucommia ulmoides Oliver bark on growth, and intestinal histology and microbiota diversity in rainbow trout Oncorhynchus mykiss[J]. Journal of Dalian Ocean University, 2020, 35(4): 481-490. |
| [35] |
李家怡, 周文红, 李菲, 等. 红海榄内生细菌多样性及其抑制鱼类致病菌活性研究[J]. 广西植物, 2017, 37(3): 308-314. LI Jiayi, ZHOU Wenhong, LI Fei, et al. Diversity of cultivated marine bacteria and antibacterial activity of endophytic bacterial in Rhizophora stylosa[J]. Guihaia, 2017, 37(3): 308-314. |
| [36] |
GENCIANA T, ELISABETTA G, LAURA G, et al. Effects of full replacement of dietary fishmeal with insect meal from Tenebrio molitor on rainbow trout gut and skin microbiota[J]. Journal of Animal Science and Biotechnology, 2021, 12(3): 1042-1055. |
| [37] |
张棋麟, 江宇航, 董志祥, 等. 汞暴露对斑马鱼肠道菌群结构和肝脏抗氧化指标的影响[J]. 生态环境学报, 2020, 29(8): 1645-1653. ZHANG Qilin, JIANG Yuhang, DONG Zhixiang, et al. Effects of mercury exposure on intestinal flora structure and liver antioxidant ability in adult zebrafish[J]. Ecology and Environment Sciences, 2020, 29(8): 1645-1653. |
| [38] |
黄丽丽, 张艳, 周红, 等. 基于16S rRNA高通量测序方法比较新疆冷水鱼肠道中微生物多样性[J]. 食品科学, 2018, 39(10): 138-144. HUANG Lili, ZHANG Yan, ZHOU Hong, et al. Comparison of the microbial diversity in cold-water fishes intestine of Xinjiang by 16S rRNA high-throughput sequencing[J]. Food Science, 2018, 39(10): 138-144. |
| [39] |
赵凤, 李小义, 张效平, 等. 鲟鱼发酵过程中微生物的演替变化分析[J]. 食品科学技术学报, 2019, 37(3): 67-75. ZHAO Feng, LI Xiaoyi, ZHANG Xiaoping, et al. Bacterial community succession analysis of fermented sturgeon at different stages[J]. Journal of Food Science and Technology, 2019, 37(3): 67-75. |
| [40] |
SUN F, XU Z. Significant differences in intestinal microbial communities in aquatic animals from an aquaculture area[J]. Journal of Marine Science and Engineering, 2021, 9(2): 104-112. |
| [41] |
凌泽春, 杨红玲, 孙云章, 等. 斜带石斑鱼幼鱼消化道与养殖水体中可培养菌群的研究[J]. 大连海洋大学学报, 2016, 24(6): 497-503. LING Zechun, YANG Hongling, SUN Yunzhang, et al. Cultivable microbiota in the gut of juvenile grouper Epinephelus coioides and in aquaculture water[J]. Journal of Dalian Fisheries University, 2016, 24(6): 497-503. |
| [42] |
施兆鸿, 王建建, 高权新. 工厂化循环水养殖条件下云纹石斑鱼消化道产酶菌的分离鉴定[J]. 中国水产科学, 2015, 5: 941-949. SHI Zhaohong, WANG Jianjian, GAO Quanxin. Isolation and identification of enzyme-producing bacteria from the digestive tract of Epinehelus moara in recirculating aquaculture systems[J]. Journal of Fishery Sciences of China, 2015, 5: 941-949. |
| [43] |
麦浩彬, 郭鑫伟, 王金港, 等. 摄食不同水平饲料蛋白质对珍珠龙胆石斑鱼幼鱼肠道组织形态和菌群组成的影响[J]. 大连海洋大学学报, 2020, 35(1): 63-70. MAI Haobin, GUO Xinwei, WANG Jingang, et al. Effects of dietary protein levels on intestinal tract histomorphology and microflora composition in juvenile pearl gentian grouper (Epinephelus lanceolatu ♂× E. fuscoguttatus ♀)[J]. Journal of Dalian Fisheries University, 2020, 35(1): 63-70. |
 2023, Vol. 47
2023, Vol. 47

