文章信息
- 苏杭, 黄海军, 刘艳霞, 严立文. 2023.
- SU Hang, HUANG Hai-jun, LIU Yan-xia, YAN Li-wen. 2023.
- 基于遥感反演的浒苔绿潮暴发对有色溶解有机物与叶绿素时空分布特征的影响
- Effects of Enteromorpha prolifera blooms on the spatial and temporal distributions of CDOM and chlorophyll by remote sensing
- 海洋科学, 47(4): 9-24
- Marine Sciences, 47(4): 9-24.
- http://dx.doi.org/10.11759/hykx20201225001
-
文章历史
- 收稿日期:2020-12-25
- 修回日期:2021-04-05
2. 中国科学院海洋地质与环境重点实验室, 山东 青岛 266071;
3. 中国科学院大学, 北京 100049;
4. 中国科学院海洋大科学研究中心, 山东 青岛 266071
2. CAS Key Laboratory of Experimental Marine Geology and Environment, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
自2007年以来, 在每年的春夏之际黄海海域都会暴发浒苔绿潮。每年的3、4月份浒苔微观繁殖体首次出现在江苏近岸浅滩海域, 随后不断聚集生长并在风与海流的作用下向北部海域移动, 直到6、7月份大规模出现在山东半岛附近海域, 8月份之后再渐渐消亡[1]。浒苔的暴发能够快速吸收水体中的氮、磷等营养盐以供自身生长繁殖, 但其消亡时的腐烂分解也会导致水体营养盐水平的整体上升, 此外浒苔在海水中还会遮蔽阳光、大量消耗氧气。浒苔的暴发可以给所在海域的水体环境造成巨大影响, 会对海洋生态系统产生严重的破坏[2]。Zhang等[3]的研究表明, 浒苔在消亡时期会释放出大量的溶解有机物(dissolved organic matter, DOM), 这些溶解有机物经过细菌的降解作用一部分会转换成具有荧光性质的有色溶解有机物(CDOM)。孙一鑫等[4]对浒苔释放CDOM的光降解过程进行了研究, 发现光降解作用可以将浒苔释放的大分子质量荧光物质转化为小分子质量的荧光物质, 或者使其失去荧光特性。耿倩倩等[5]对温度在浒苔释放DOM的过程中的影响作用进行了研究。王林项等[6]通过现场调查数据, 用三维荧光-平行因子分析(EEMs- PARAFAC)对浒苔暴发过程DOM的变化特征及影响因素进行了分析。基于实验室藻类培养的研究表明, 浒苔的繁殖速度优于其他藻类, 且与其他浮游藻类之间存在竞争关系, 过量生长的浒苔会对浮游藻类的群落多样性和种群结构造成影响[7-9], 而海水中的浮游微藻生物量一般用叶绿素浓度的大小来表示。
目前浒苔绿潮的暴发对海洋生态环境的影响多是基于现场采样以及实验室分析, 难以大范围快速地获得浒苔暴发过程中生态因子的变化规律。而遥感技术具有快速、大范围并且连续观测的优势, 目前用遥感的手段监测海洋生态环境因子以及反演水色的技术已经相当成熟。针对二类水体CDOM的经验反演模型以波段比值法最为常见。Tassan[10]提出了基于SeaWiFS传感器Rrs(490)、Rrs(555)和Rrs(443)的模型, 在近岸浑浊水体中有着较好的应用。Siswanto等[11]对Tassan模型进行了系数优化, 成为了GOCI传感器反演黄色物质产品的标准算法。陈楚群等[12]利用Rrs(670)和Rrs(412)建立了珠江口海域的CDOM反演模型。王林等与周亚明等[13-14]分别在大洋河河口与官厅水库选取了Rrs(412)、Rrs(443)、Rrs(488)、Rrs(531)以及Rrs(551)进行波段比值反演对比。OC3M模型是利用MODIS数据反演叶绿素的应用最广泛的遥感反演经验算法[15]。唐军武等[16]经过改进Tassan模式, 建立了中国黄、东海近岸二类水体叶绿素统计反演模式, 使反演叶绿素的精度有了一定的提升。对浒苔的遥感监测主要有归一化植被指数法(normalized difference vegetation index, NDVI)与浮游藻类指数法(floating algae index, FAI)[17]。利用遥感的手段可快速确定浒苔的暴发区域、时间和聚集度, 绘制浒苔分布示意图, 提高大范围灾情分析的准确度在最短时间内控制住浒苔灾害的发展态势, 遥感技术已成为浒苔灾害监测的主要技术之一。
本文利用现场采样测定的CDOM吸收系数与叶绿素浓度以及同步实测的光谱数据建立经验遥感反演模型, 然后利用往年卫星影像数据提取山东半岛南侧近岸海域浒苔绿潮暴发前期、暴发期以及暴发后期水体表层CDOM与叶绿素浓度的变化特征。本文的目的为分析浒苔暴发对CDOM与叶绿素时空分布的响应机制, 为浒苔防治与黄海海域浮游生物多样性保护以及沿岸海域水质监测与治理提供科学依据。
1 数据与研究方法 1.1 采样站位与实测数据海阳市位于山东半岛东南部, 濒临黄海, 东侧靠近乳山口, 西侧为丁字河口。本文的采样区为海阳市海阳港东侧近岸海域, 共24个站位, 采样时间为2019年7月7日至8日以及2019年10月10日至11日, 站位分布如图 1所示。将采集的水样放置在避光处保存, 并且当天带回实验室用预先灼烧过的GF/F玻璃纤维滤膜(Whatman)进行过滤。过滤得到的溶液即为CDOM样品, 将约75 mL样品倒入棕色瓶中冷冻保存, 然后将过滤后的滤膜对折, 用锡箔纸包好冷冻保存。CDOM吸收系数的测定使用紫外可见分光光度计, 计算公式为:
| $a_{\mathrm{g}}(\lambda)=\frac{2.303}{l}\left[D_{\mathrm{s}}(\lambda)-D_{\mathrm{bs}}(\lambda)-D_{\text {null }}(\lambda)\right], $ | (1) |
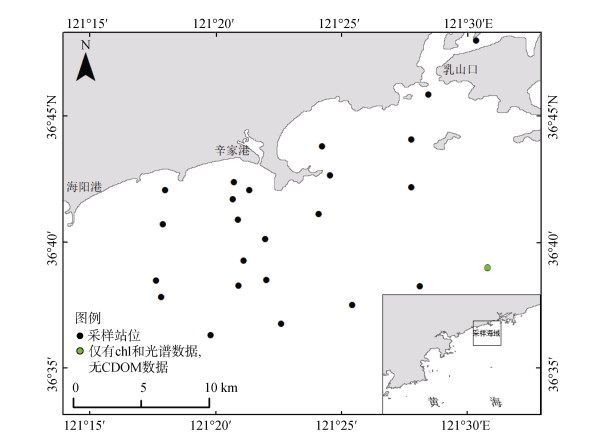 |
| 图 1 研究区地理位置及采样站位分布 Fig. 1 Location and sampling stations of the study area |
式中: l是比色皿的光程; Ds(λ)是样品相对于参比纯水的光密度; Dbs(λ)是空白纯水相对于参比纯水的光学密度; Dnull(λ)是在可见光波段或近红外波段样品表观残余光密度。由于CDOM的浓度难以直接测量得到, 所以在研究中一般采用其吸收系数ag(λ)(单位: m–1)代替浓度, 本文采用CDOM在400 nm处的吸收系数ag(400)表示其浓度。
叶绿素的测定使用紫外可见分光光度计。将解冻后的滤膜研磨后放入离心管, 加入10 mL 90%的丙酮溶液进行离心萃取。将萃取液放入1 cm的石英比色皿中, 以90%的丙酮溶液作为参比溶液, 用紫外可见分光光度计测量其吸光度。然后使用630、647、664、750 nm处的吸光度按Jeffrey-Humphrey的方程计算叶绿素浓度[18]:
| $ \begin{gathered} {c_\text{chl}} = \{ 11.85 \times [A(664) - A(750)] \\ \; - 1.54 \times [A(647) - A(750)] \\ \; - 0.08 \times [A(630) - A(750)]\} \times \frac{{{V_1}}}{{{V_2}}}, \\ \end{gathered} $ | (2) |
式中: cchl为叶绿素浓度(μg∙L–1), A为样品在不同波长下的吸光度, V1为试样的定容体积(mL), V2为取样体积(L)。
光谱的测量使用了美国ASD(analytical spectral devices)公司的地物光谱仪, 其波长测量范围为350~ 2 500 nm。测量过程遵循了唐军武等[19]提出的水面以上测量法, 观测方位与太阳光的夹角为135°, 仪器与水面法线夹角为40°, 完成水面光谱采集后, 将仪器观测平面向上旋转90°, 对天空光辐亮度进行测量。
1.2 遥感影像数据及预处理MODIS影像有较高的光谱分辨率和时间分辨率, 在全球生态环境监测、气候变化研究以及海洋环境研究中发挥着重要的作用[20]。本文使用的遥感影像来自美国NASA(https://ladsweb.nascom.nasa.gov)提供的MODIS L1B数据。自2007年浒苔大规模暴发以来, 每个年份黄海的浒苔发展分布情况都有学者进行研究。浒苔多暴发在每年的5月至8月, 在不同海域的暴发时间有所差异[20-25], 因此根据前人的研究来确定各个年份研究区海域暴发浒苔的时间。采用2009年、2013年、2015年、2017年以及2019年共5年的影像, 然后选取了5月初至9月初分别包含了浒苔暴发前期、暴发期以及暴发后期的每年3景无云或少云的影像。其中2015年5月初与2019年9月初的影像云较多, 因此分别用2015年4月22日和2019年8月28日的影像代替。2006年黄海没有大规模地暴发浒苔, 因此也选取了2006年5月初至9月初的3景影像作为对比分析。MODIS L1B遥感影像自带地理信息, 经过投影转换、辐射定标以及大气校正, 最后得到地表反射率图像用于CDOM和叶绿素的遥感反演以及浒苔的识别, 本文所用到的MODIS波段范围和分辨率如表 1所示。此外, 漂浮在水面的浒苔会对遥感反射率产生影响, 反演得到的这部分浒苔覆盖的水体信息与实际情况会有较大的偏差, 因此在进行遥感反演之前, 需要将陆地、云以及浒苔直接覆盖的水体进行掩膜处理。
| 波段 | 光谱范围/(nm) | 分辨率/(m) |
| B1 | 620~670 | 250 |
| B2 | 841~876 | 250 |
| B8 | 405~420 | 1 000 |
| B9 | 438~448 | 1 000 |
| B10 | 483~493 | 1 000 |
| B11 | 526~536 | 1 000 |
| B12 | 546~556 | 1 000 |
| B13 | 662~672 | 1 000 |
| B14 | 673~683 | 1 000 |
首先将实测的光谱数据按照MODIS波段进行重采样。利用同步实测的16组CDOM吸收系数与光谱数据建立经验回归方程, 其余7组数据用作对模型精度的验证。综合考虑, 选用MODIS波段中的B8~B14共7个波段, 分别与B12、B13、B14进行两两组合建立反射率比值, 与实验室测得的CDOM吸收系数ag(400)进行回归分析。同时也对反射率比值取以10为底的对数, 与CDOM吸收系数的对数lg[ag(400)]进行回归分析。首先将这30种波段组合模式与ag(400)或lg[ag(400)]进行Pearson相关性分析, 结果发现相比于直接将反射率进行比值, 对数模式的相关性更好。其中相关性最好的5种模式如表 2所示。
| 比值模式 | |||||
| 决定系数 | −0.766 | −0.835 | −0.838 | −0.847 | −0.835 |
| $\begin{array}{l} \lg [{a_\text{g}}(400)] = - 1.835\, \, 98 \times {\text{lg}}\frac{{{R_\text{rs}}({B_{10}})}}{{{R_\text{rs}}({B_{13}})}} + 0.088\, \, 01 \hfill \\ {r^2} = 0.743, \hfill \\ \end{array} $ | (3) |
其中Rrs(B10)与Rrs(B13)分别为MODIS第10和第13波段的遥感反射率。用其余的7个站位的实测光谱数据与CDOM吸收系数对该反演模型进行精度分析, 结果见表 3。平均相对误差为23.6%, 该反演模型能够满足实际反演需求。
| 实测ag(400)/(m–1) | 反演ag(400)/(m–1) | 绝对误差/(m–1) | 相对误差 |
| 0.324 1 | 0.410 8 | 0.086 7 | 26.7% |
| 0.473 4 | 0.642 1 | 0.168 7 | 35.6% |
| 0.198 6 | 0.228 8 | 0.030 2 | 15.2% |
| 0.256 7 | 0.154 8 | 0.101 9 | 39.7% |
| 0.182 4 | 0.175 5 | 0.006 9 | 3.8% |
| 0.259 4 | 0.264 5 | 0.005 1 | 2.0% |
| 0.136 1 | 0.161 6 | 0.025 5 | 18.8% |
| 平均误差 | 0.060 7 | 20.3% | |
本文对叶绿素浓度的反演也采用与CDOM类似的波段比值法, 同样采取对数模式, 对反射率比值取以10为底的对数, 与叶绿素浓度的对数lg(cchl)进行相关性分析。利用16组实测叶绿素浓度与光谱数据构建叶绿素浓度反演模型, 其余8组数据用作对模型精度的验证。其中相关性最好的5种模式如表 4所示。
| 比值模式 | |||||
| 决定系数 | −0.830 | −0.870 | −0.863 | −0.870 | −0.744 |
| $ \begin{gathered} \lg \left( {{c_\text{chl}}} \right) = 108.566\;6 \times {\left[ {\lg \frac{{{R_\text{rs}}\left( {{B_{11}}} \right)}}{{{R_\text{rs}}\left( {{B_{12}}} \right)}}} \right]^2} \hfill \\ \;\;\;\;\;\;\;\;\;\;\;\;\;\; - 11.342\;09 \times \lg \frac{{{R_\text{rs}}\left( {{B_{11}}} \right)}}{{{R_\text{rs}}\left( {{B_{12}}} \right)}} \hfill \\ \;\;\;\;\;\;\;\;\;\;\;\;\;\; - 0.279\;78\;\;\;\;\;\;{r^2} = 0.788\;, \hfill \\ \end{gathered} $ | (4) |
其中Rrs(B11)与Rrs(B12)分别为MODIS第11和第12波段的遥感反射率。用其余8个站位的实测光谱数据与叶绿素浓度对该反演模型进行精度分析, 结果见表 5。平均相对误差为17.2%, 该反演模型能够满足实际反演需求。
| 实测cchl/(μg∙L–1) | 反演cchl/(μg∙L–1) | 绝对误差/(μg∙L–1) | 相对 误差 |
| 0.824 6 | 0.931 5 | 0.106 9 | 13.0% |
| 0.292 2 | 0.278 2 | 0.014 | 4.8% |
| 0.808 4 | 0.756 3 | 0.052 1 | 6.4% |
| 0.970 9 | 0.710 3 | 0.260 6 | 26.8% |
| 0.645 3 | 0.838 9 | 0.193 6 | 30.0% |
| 1.073 7 | 0.881 1 | 0.192 6 | 18.0% |
| 1.422 4 | 1.184 8 | 0.237 6 | 16.7% |
| 0.507 5 | 0.619 7 | 0.112 2 | 22.1% |
| 平均误差 | 0.146 2 | 17.2% | |
浒苔水域在可见光波段反射率较低, 在近红外波段反射率较高, 在短波红外的反射率近似为0。在以短波红外、近红外和可见光合成的RGB假彩色影像上, 海水呈现黑色或者深蓝色, 浒苔水域为翠绿色, 陆地植被则为黄绿色, 三者具有比较明显的差异。利用这一光谱特性可以区分出浒苔水体与正常海水[24]。本文采用归一化植被指数提取浒苔信息:
| $ {x_{NDVI}} = \frac{{{R_\text{rs}}({B_2}) - {R_\text{rs}}({B_1})}}{{{R_\text{rs}}({B_2}) + {R_\text{rs}}({B_1})}}, $ | (5) |
xNDVI为归一化植被指数, Rrs(B1)和Rrs(B2)分别是MODIS的第1和第2波段的遥感反射率, 通常浒苔水域的归一化植被指数为正值, 非浒苔水域为负值。由于浒苔分布的密度差异, 会出现与海水的光谱混合的现象, 因此采用动态阈值法, 在实际的浒苔提取过程中需要根据假彩色图像修正归一化植被指数的提取阈值[25]。
1.4 反演模型误差敏感性分析将模型输入的遥感反射率数据引入±5%的误差, 检验模型输出结果的误差波动情况。如果遥感反射率的微小变化使得模型的输出数据产生很大的变化, 则说明模型是病态的, 使用该方式可以检验模型对于误差的敏感性。将检验CDOM吸收系数和叶绿素浓度反演精度的站位的遥感反射率引入±5%的误差, 设计了4种情形, 如表 6所示。
| ag(400)反演模型误差敏感性分析 | cchl反演模型误差敏感性分析 | |
| 情形1 | Rrs(B10)检验=1.05×Rrs(B10) Rrs(B13)检验=1.05×Rrs(B13) |
Rrs(B11)检验=1.05×Rrs(B11) Rrs(B12)检验=1.05×Rrs(B12) |
| 情形2 | Rrs(B10)检验=0.95×Rrs(B10) Rrs(B13)检验=1.05×Rrs(B13) |
Rrs(B11)检验=0.95×Rrs(B11) Rrs(B12)检验=1.05×Rrs(B12) |
| 情形3 | Rrs(B10)检验=1.05×Rrs(B10) Rrs(B13)检验=0.95×Rrs(B13) |
Rrs(B11)检验=1.05×Rrs(B11) Rrs(B12)检验=0.95×Rrs(B12) |
| 情形4 | Rrs(B10)检验=0.95×Rrs(B10) Rrs(B13)检验=0.95×Rrs(B13) |
Rrs(B11)检验=0.95×Rrs(B11) Rrs(B12)检验=0.95×Rrs(B12) |
将以上4种情形的分析结果列入表 7。可以看出, 将反演模型输入的遥感反射率引入±5%的误差, 使得CDOM吸收系数的反演误差最大增加8.0%, 叶绿素浓度的反演误差最大增加6.9%, 总体上误差波动不大, 可以认为该反演算法是准确稳定的。
| ag(400) | cchl | ||||
| 平均相对误差 | 绝对相对误差 | 平均相对误差 | 绝对相对误差 | ||
| 未引入误差 | 20.3% | 17.2% | |||
| 情形1 | 16.5% | 3.8% | 19.6% | 2.4% | |
| 情形2 | 26.7% | 6.4% | 21.4% | 4.2% | |
| 情形3 | 28.3% | 8.0% | 24.1% | 6.9% | |
| 情形4 | 14.9% | 5.4% | 11.5% | 5.7% | |
黄海海域的浒苔绿潮自2007年以来开始大规模暴发, 因此先观察未发生浒苔的2006年春夏季CDOM吸收系数与叶绿素浓度的时空分布情况, 如图 2所示。
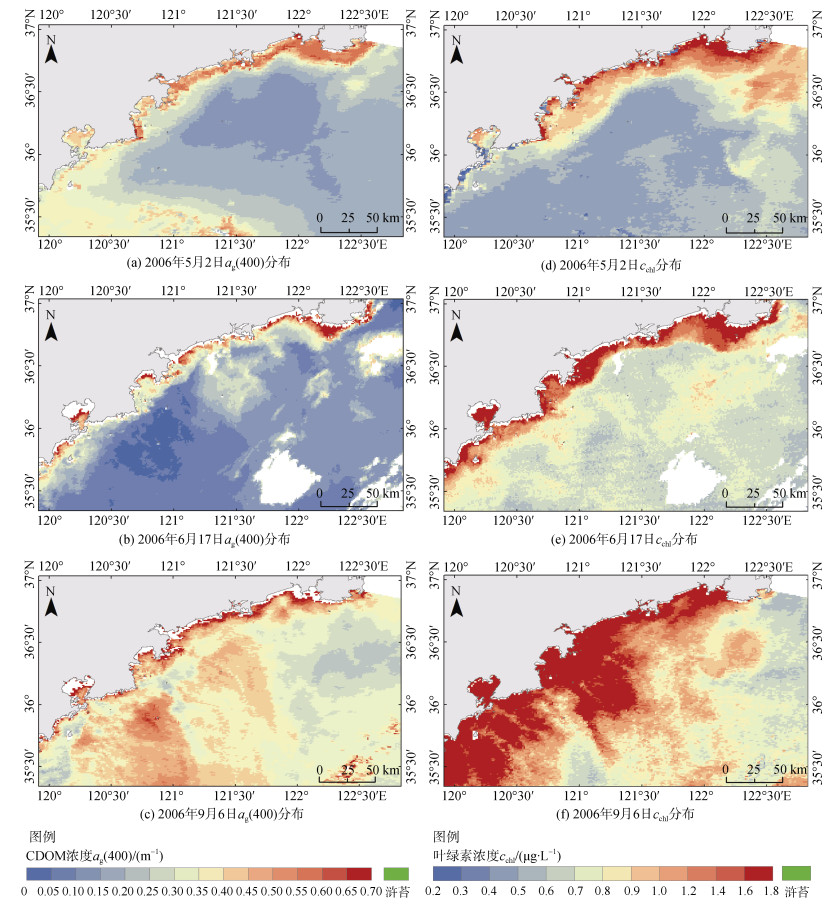 |
| 图 2 2006年遥感反演ag(400)(左)与cchl(右)分布 Fig. 2 Remote sensing inversion of the ag(400) (left) and cchl (right) distributions in 2006 |
从图中可以看到CDOM吸收系数呈现明显的近岸高远海低的分布趋势。从5月初到6月中旬再到9月初, 近岸的CDOM吸收系数从0.5~0.6 m–1增加到0.6~0.7 m–1, 这是由于夏季雨水充沛, 来自近岸与入海河流的输入量增加, 使得近岸的CDOM吸收系数有所增加。此外可以看到自5月份到6月中旬研究区海域在远海的CDOM吸收系数有所降低。5月份远海CDOM吸收系数呈现北低南高的分布趋势, 海阳市外海普遍在0.1~0.3 m–1, 而胶州湾南侧海域CDOM吸收系数则值较高, 为0.2~0.4 m–1。而到了6月中旬, 远海的CDOM吸收系数普遍在0.15 m–1以下, 相比5月初有一定的降低, 而6月份叶绿素浓度依然维持在较高的水平, 这主要与夏季强烈的光降解作用有关。9月初的CDOM吸收系数相比6月份又有着显著的提升, 远海海域普遍高达0.3~0.5 m–1。
无论是近岸还是远海, 自5月初到6月中旬再到9月初, 叶绿素浓度均呈现递增的趋势。5月初和6月中旬远海叶绿素浓度范围分别为0.3~0.5 μg∙L–1、0.5~0.7 μg∙L–1。到了9月初, 可以看到远海大范围分布叶绿素浓度超过1 μg∙L–1的区域, 最高甚至同近岸一样达到了1.8 μg∙L–1。
有学者对黄渤海叶绿素浓度时空变化的研究表明, 从春季到夏季, 山东半岛相对近岸海域的叶绿素浓度持续增加, 并且一直保持相对较高的浓度直至9月, 而黄海中部的叶绿素浓度在夏季则明显低于春季和冬季[26], 这与本文得到的叶绿素浓度的时空变化特征相同。在黄海中部, 春季的浮游生物的增长大量消耗了营养盐, 到了夏季水温升高出现温跃层, 导致海水的垂向混合作用减弱, 表层营养盐得不到补充, 因而表层叶绿素浓度会有所降低[27]。而本文的研究范围距岸较近, 海水层化较弱, 更多地受到陆源输入的影响, 海水中营养物质能够得到快速补充, 因此本文研究区海域夏季的叶绿素浓度不仅不会降低反而会略有升高。
2.2 浒苔暴发年份CDOM浓度分布特征研究区海域遥感反演各个年份的CDOM吸收系数分布如图 3所示。其中2009年黄海浒苔暴发时间为6月初, 相对较晚, 而直到8月中旬仍可检测到零星的浒苔分布, 在整个7月份海阳市外海海域均有浒苔的分布[24], 因此本文选取了2009年7月15日的MODIS影像。就空间分布而言, 不同月份CDOM吸收系数的差异较大, 但总体上在近岸海域比较高, 由近岸向远海逐渐减小。丁字湾、乳山口、五垒岛湾等近岸海域以及胶州湾的CDOM吸收系数明显较高, 这主要与陆源物质输入有关。大多数年份的近岸CDOM吸收系数最高能达到0.6~0.7 m–1, 而2017年的三个月份近岸最高仅为0.4~0.5 m–1。由5月初至6月下旬或者7月上旬的浒苔暴发期, 大部分年份研究区海域CDOM吸收系数呈现一定的上升趋势, 而2015年则有所不同, 2015年浒苔暴发的规模相比其他年份要大, 但6月下旬浒苔暴发期的CDOM吸收系数相比浒苔暴发前不仅没有提升, 反而有微弱的降低。另外2019年6月下旬浒苔暴发的规模同样较大, 但CDOM吸收系数相比浒苔暴发前仅有微弱的提升。到了9月份, 各个年份的研究区海域CDOM吸收系数相比6月份显著降低。
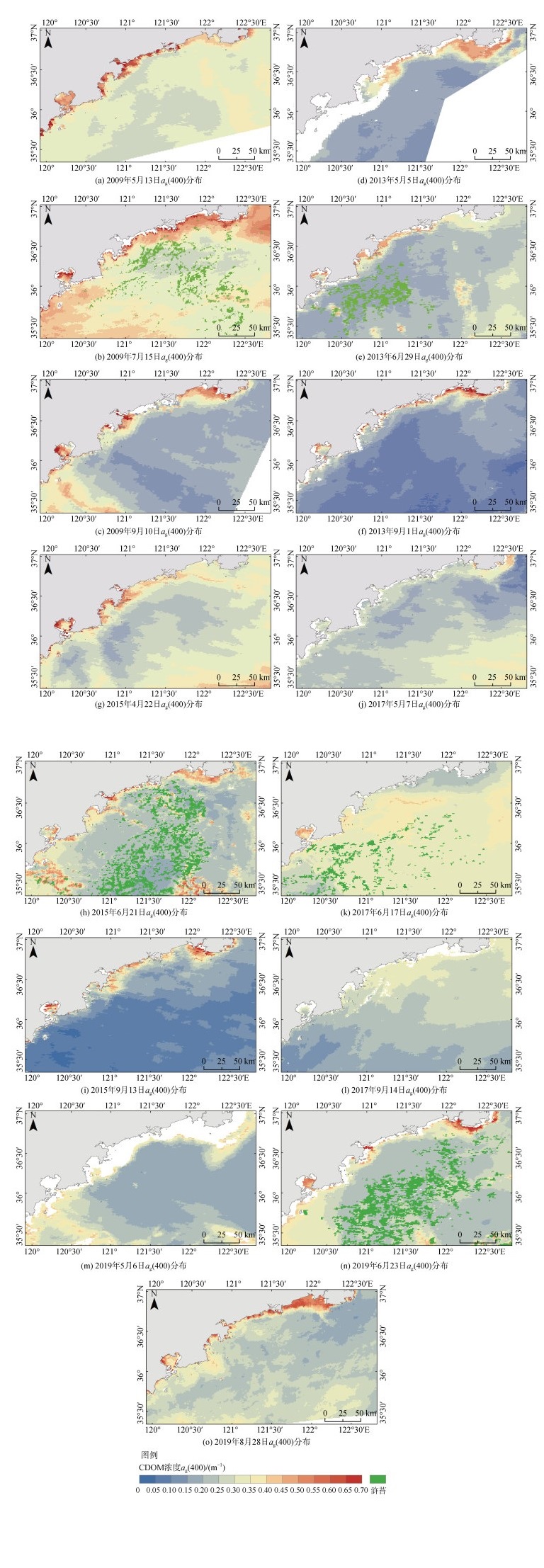 |
| 图 3 研究区遥感反演ag(400)分布 Fig. 3 Retrieval of the ag(400)distribution by remote sensing in the study area |
研究区海域普遍在6月初开始出现浒苔, 6月下旬至7月上旬浒苔达到最大规模。2009年5月外海的CDOM吸收系数普遍在0.25~0.35 m–1, 到了7月浒苔暴发期CDOM吸收系数显著上升到0.3~0.5 m–1。但同时也可以看到, 7月份浒苔所覆盖的海域周围CDOM吸收系数反而不高, 甚至出现了显著较低的区域。而没有浒苔的区域, 例如青岛市南侧海域以及石岛附近海域, 其CDOM吸收系数反而较高, 2013年和2019年的浒苔暴发期同样也有这种情况。这是因为浒苔总是在不断地生长和消亡, 处在一个动态平衡过程中。浒苔的消亡能够产生CDOM, 但另一方面CDOM能通过光漂白过程分解为小分子物质作为能源供给浮游植物利用[28]。因此CDOM也是处在不断生成并不断被浒苔以及其他浮游藻类所利用的动态平衡之中。CDOM是一种可溶性的有机物, 其在海中生成之后便在风和海流的作用下迅速扩散到附近海域, 而浒苔的聚集与快速生长繁殖使得浒苔附近海域对有机物的需求较为强烈, CDOM在浒苔覆盖的海域大量被生长中的浒苔吸收利用, 因此其附近海域CDOM浓度偏低。到了9月份, CDOM浓度相比6月份有所降低, 甚至略微低于浒苔暴发前的水平, 例如2009年、2013年和2015年的9月份黄色物质吸收系数低于0.25 m–1, 而2017年和2019年的9月份和5月份的黄色物质吸收系数分布类似。
总体上可以看到研究区海域CDOM吸收系数在浒苔暴发期有小幅上升。CDOM的来源有两种, 一是陆源输入, 主要由江河携带; 另外一种是由浮游生物和微生物等原地降解所产生。CDOM可以参与各种生物地球化学过程, 为水体中的微生物提供非常重要的能量来源, 除了微生物的降解作用之外, CDOM最主要的消亡途径是光化学反应[29]。研究表明, 水体中的CDOM对紫外线较为敏感, 光化学降解反应不仅会使CDOM吸收性质和荧光性质发生改变, 还可将高分子量的有机物分解成为可被生物利用的低分子量有机物和矿化成碳、氮的无机物, 因此对海洋中碳、氮的生物地球化学循环产生重要的影响[30-31]。虽然浒苔的暴发会产生大量的CDOM[3], 但浒苔暴发的时间均为每年的6、7月份, 此时也是一年中光照较为强烈的时期, CDOM的光化学作用也较为强烈。因此, 虽然海水中CDOM的产量增加, 但其消解速率也大大增加。因此, 研究区海域表层CDOM浓度的变化趋势为: 浒苔的暴发使得CDOM浓度略微升高, 暴发期结束浒苔消亡后CDOM浓度开始回落。
2.3 浒苔暴发年份叶绿素浓度分布特征研究区遥感反演各个年份的叶绿素浓度分布如图 4所示, 研究区海域叶绿素浓度在各个年份的变化比较稳定。在空间分布上, 总体上所有月份都呈现出近岸高叶绿素浓度向远海低浓度过渡的趋势, 近岸叶绿素浓度普遍达到1 μg∙L–1以上, 而远海海域叶绿素浓度均在0.8 μg∙L–1以下, 其中低于0.5 μg∙L–1的叶绿素分布最为广泛。由5月初至6月下旬或者7月上旬的浒苔暴发期, 研究区海域叶绿素浓度在大部分年份呈现略微下降的趋势。2009年则例外, 7月份的浒苔暴发期叶绿素浓度相比5月初有所上升, 同时也可以看到2009年7月丁字湾至乳山口的近岸海域叶绿素浓度极高且范围较广, 推测2009年7月的陆源输入较其他年份要多, 因此整体叶绿素浓度较高。到了9月初, 整体上叶绿素浓度再次回升, 甚至在2013年和2015年超过了浒苔暴发之前的叶绿素浓度。
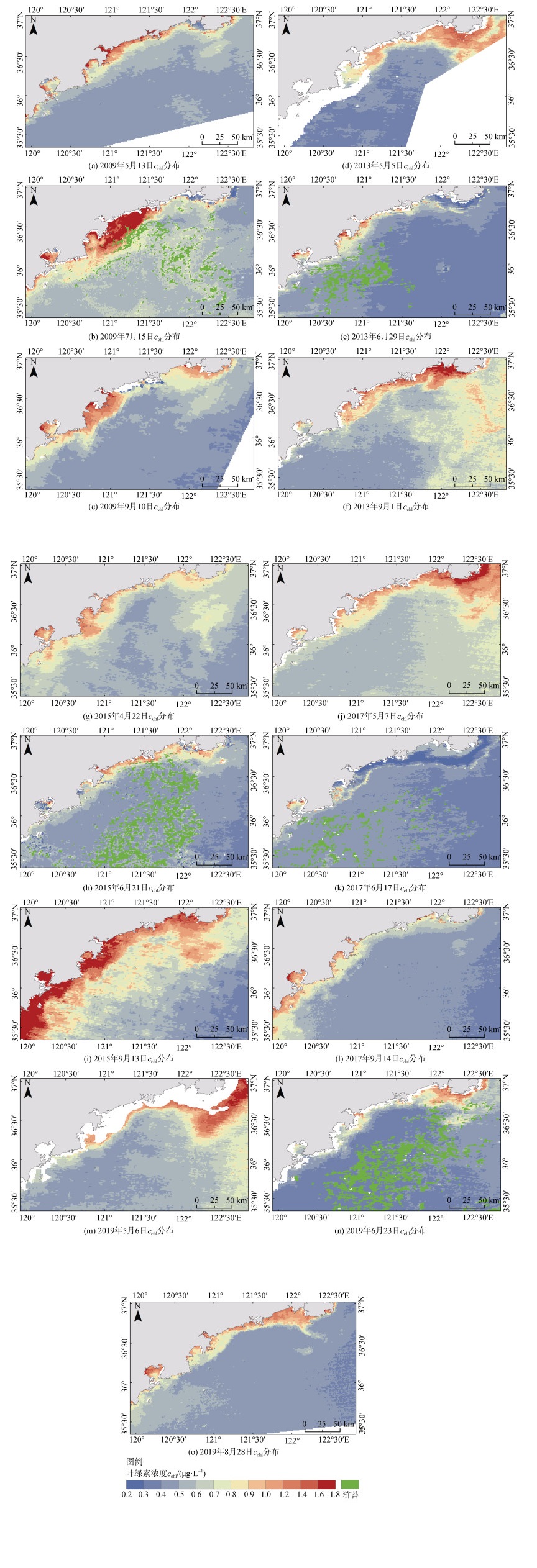 |
| 图 4 研究区遥感反演cchl分布 Fig. 4 Retrieval of the cchl distribution by remote sensing in the study area |
研究区海域普遍在6月初开始出现浒苔, 6月下旬至7月上旬浒苔达到最大规模, 其中2015年和2019年的浒苔规模较其他年份大许多。2015年浒苔暴发前研究区远海海域叶绿素浓度普遍在0.5~0.7 μg∙L–1, 在石岛附近外海甚至达到了0.7~0.8 μg∙L–1。到了6月下旬, 浒苔大规模出现, 甚至在乳山口附近登陆, 此时研究区海域叶绿素浓度出现较大规模的降低, 除了近岸海域仍维持在较高浓度, 远海海域的叶绿素浓度普遍在0.4 μg∙L–1以下。到了9月份浒苔已消亡殆尽, 研究区海域的叶绿素浓度大规模升高, 甚至超过了浒苔暴发前的叶绿素浓度, 近岸海域大规模分布浓度在1.2~1.8 μg∙L–1的叶绿素, 远海叶绿素浓度则普遍超过0.6 μg∙L–1。在对2019年的影像进行云掩膜处理后, 失去了近岸数据。2019年浒苔暴发前, 石岛附近的叶绿素浓度较高, 达到了1.2 μg∙L–1以上, 研究区海域南侧稍低为0.4~0.6 μg∙L–1。2019年6月下旬在研究区海域出现较大规模浒苔, 与往年不同的是2019年浒苔范围有所扩大, 甚至到达石岛附近海域并且有越过石岛继续向北移动的趋势。此时叶绿素浓度在研究区海域大幅降低, 仅为0.2~0.4 μg∙L–1。到了8月底, 叶绿素浓度有所回升, 达到0.4~0.6 μg∙L–1, 但依然比浒苔暴发之前的叶绿素浓度低。因此, 分析发现研究区海域表层叶绿素浓度的变化趋势为: 在浒苔暴发前浓度较高, 浒苔暴发时浓度整体降低, 暴发期结束浒苔消亡后叶绿素浓度缓慢升高。
总体上可以看到浒苔的暴发使研究区海域叶绿素浓度所有降低, 但浒苔的规模与叶绿素浓度降低的幅度并没有明显的联系。例如2017年6月份浒苔规模不大, 但叶绿素浓度相比浒苔暴发前大幅降低了0.3~0.4 μg∙L–1, 而2015年浒苔规模较大但叶绿素浓度的降低并不显著。另外浒苔的空间分布与叶绿素的空间分布不存在直接的联系, 浒苔分布周围的叶绿素浓度并没有低于远离浒苔的海域。虽然在诸多的实验室研究中浒苔与其他藻类存在竞争关系, 并且浒苔会释放“感化物质”影响其他浮游藻类的生长繁殖[8], 但在现实海洋环境中, 影响叶绿素的各种生物和非生物的因素多样且复杂多变, 浒苔对叶绿素的影响也将更为复杂。通过遥感手段的研究结果表明浒苔大量暴发时, 叶绿素浓度有所降低, 浒苔消亡后叶绿素浓度又有所上升, 而关于浒苔暴发与叶绿素浓度的空间分布和叶绿素浓度变化幅度之间的定量研究尚不完善。
3 讨论本文利用GIS的空间分析功能计算研究区域叶绿素与CDOM的平均浓度, 同时计算出浒苔的直接覆盖面积与分布面积, 将浒苔暴发时的覆盖面积与分布面积之比定义为浒苔的聚集度。表 8为统计的本文所用的5个浒苔暴发年份在研究区域的叶绿素和CDOM浓度与浒苔暴发时的覆盖面积、分布面积及聚集度之间的相关性。可以看到浒苔的聚集度与叶绿素浓度及CDOM浓度存在一定的负相关性, 而浒苔的分布面积与CDOM浓度则呈现一定的正相关。即针对不同年份的浒苔暴发, 浒苔的聚集度越高, 平均叶绿素浓度与CDOM浓度则越低; 浒苔的分布面积越高, 平均CDOM浓度则越高。
| 平均cchl/(μg∙L–1) | 平均ag(400)/(m–1) | |
| 浒苔覆盖面积/(km2) | −0.37 | −0.41 |
| 浒苔分布面积/(km2) | −0.18 | 0.50 |
| 浒苔聚集度 | −0.49 | −0.76 |
从CDOM的平面分布可以看出, 陆源输入是影响CDOM浓度的主要因素之一, 离岸与河口越近, CDOM吸收系数则越高。浒苔在研究区海域大规模暴发的时间是6月下旬至7月中旬, 7月下旬至8月开始消亡, 但浒苔每时每刻都在消亡也在不断生长, 处于一个动态平衡之中, 因此其消亡所释放的溶解有机物从浒苔的暴发期至消亡期会持续地对所在海域造成影响。浒苔分布面积的增加会使得CDOM浓度相应有所提升, 但同时, 浒苔的生长繁殖会大量消耗CDOM作为供能物质, 而浒苔的聚集则会加速对CDOM消耗, 使得聚集区CDOM的净消耗大于净生长。此外浒苔暴发的季节光照较为强烈, 此时强烈的光化学作用对CDOM的消解也产生了重要作用。因此在整个海域CDOM浓度升高的同时, 浒苔所覆盖的海域附近CDOM浓度升高幅度略低。并且表现出CDOM浓度与浒苔聚集度的负相关性。
浒苔与浮游微藻之间存在一定的竞争关系, 浒苔通过大量消耗水体中的营养物质以及释放“感化物质”影响水体理化环境从而抑制浮游微藻的生长繁殖[32]。当浒苔大规模消亡腐烂时, 对浮游微藻的竞争胁迫开始缓解。与此同时, 浒苔消亡所释放的铵盐、磷酸盐和溶解有机物等又会被浮游藻类吸收利用, 进而使得浒苔消亡后的浮游微藻生物量增加, 叶绿素浓度也相应升高。孙晓[33]的研究结果表明, 浒苔绿潮面积升高时, 叶绿素浓度会有降低的趋势, 但无论绿潮面积升高多少, 叶绿素浓度均值都会保持在一定的值以上, 不会继续降低, 即浒苔暴发的强度与叶绿素浓度的降低程度没有明显的相关性。在本文的研究中, 2015年浒苔暴发规模较大, 而叶绿素浓度仅从浒苔暴发前的0.4~0.5 μg∙L–1下降到浒苔暴发时的0.3~0.4 μg∙L–1; 而2017年浒苔的分布密集度与范围均较2015年有所下降, 但叶绿素浓度从浒苔暴发前的0.5~0.7 μg∙L–1剧烈降低到浒苔暴发时的0.2~0.4 μg∙L–1。这是由于浮游微藻的生物量受到多种因素影响, 包括温度、光照以及营养盐等生态因子, 也受到水文动力条件、海陆关系等物理机制的影响, 在这些因素的共同作用下也决定了叶绿素浓度的时空部分特征, 同样浒苔的生长繁殖也受到上述影响。当浒苔大量暴发时, 此时的生态环境有利于藻类的生长, 除浒苔之外, 浮游微藻也会大量生长繁殖。因此虽然浒苔在一定程度上会抑制浮游微藻的生长, 但水体环境的其他理化因素却对浮游微藻的生长起到一定的促进作用。
4 结论利用现场实测数据建立研究区海域的CDOM吸收系数和叶绿素浓度的波段比值法遥感反演模型, 模型相关系数分别达到0.743和0.788。根据该模型使用MODIS影像研究CDOM和叶绿素浓度的分布特征, 验证了该模型在研究区海域有着较好的应用。
研究区海域浒苔的暴发丰富了CDOM的来源, 对CDOM浓度的增加有一定的促进作用, 但浒苔的生长繁殖也会消耗水体中的CDOM。此外CDOM还受到光照强度、陆源物质以及其他浮游微藻的影响。在这些因素的综合作用下, 研究区海域的CDOM浓度在浒苔暴发期微弱升高, 浒苔消亡之后CDOM浓度开始回落。同时发现平均CDOM浓度与浒苔分布面积呈正相关, 但与浒苔的聚集度呈负相关。
在浒苔的暴发期由于浒苔对其他浮游微藻的胁迫作用, 叶绿素浓度有所下降。但在各种生物地球化学因素的作用下, 叶绿素下降幅度与浒苔的暴发规模没有直接关系, 而浒苔消亡后所释放的营养物质会促使叶绿素浓度的升高。
在未来的研究中需要结合CDOM的具体成分分析以及温盐等环境因子, 以及收集更多年份的数据来综合分析CDOM与叶绿素浓度对浒苔暴发的响应机制。
| [1] |
李大秋, 贺双颜, 杨倩, 等. 青岛海域浒苔来源与外海分布特征研究[J]. 环境保护, 2008(16): 45-46. LI Daqiu, HE Shuangyan, YANG Qian, et al. Study on the origin and distribution characteristics of Enteromorpha in Qingdao Sea area[J]. Environmental Protection, 2008(16): 45-46. DOI:10.3969/j.issn.0253-9705.2008.16.016 |
| [2] |
王宗灵, 傅明珠, 肖洁, 等. 黄海浒苔绿潮研究进展[J]. 海洋学报, 2018, 40(2): 1-13. WANG Zongling, FU Mingzhu, XIAO Jie, et al. Progress on the study of the Yellow Sea green tides caused by Ulva prolifera[J]. Haiyang Xuebao, 2018, 40(2): 1-13. |
| [3] |
ZHANG T, WANG X. Release and microbial degradation of dissolved organic matter(DOM)from the macroalgae Ulva prolifera[J]. Marine pollution bulletin, 2017, 125(1/2): 192-198. |
| [4] |
孙一鑫, 王嘉旋, 宋可心, 等. 浒苔释放有色溶解有机物的光降解研究[J]. 江苏海洋大学学报(自然科学版), 2020, 29(2): 27-32. SUN Yixin, WANG Jiaxuan, SONG Kexin, et al. Research on photodegradation of chromophoric dissolved organic matter released by Ulva prolifera[J]. Journal of Jiangsu Ocean University (Natural Science Edition), 2020, 29(2): 27-32. |
| [5] |
耿倩倩, 陈晶, 李鸿妹, 等. 温度对浒苔降解过程中溶解有机物释放及其组成的影响[J]. 渔业科学进展, 2020, 41(2): 27-34. GENG Qianqian, CHEN Jing, LI Hongmei, et al. Release dynamics and composition of dissolved organic matter from the macroalgae Ulva prolifera unde different temperature regimes[J]. Progress in Fishery Sciences, 2020, 41(2): 27-34. |
| [6] |
王林项, 李修竹, 唐新宇, 等. 浒苔绿潮暴发对南黄海海域溶解有机物的影响[J]. 中国环境科学, 2020, 40(2): 806-815. WANG Linxiang, LI Xiuzhu, TANG Xinyu, et al. Effects of the occurrence of green tide (Ulva prolifera blooms) on dissolved organic matters in the Southern Yellow Sea[J]. China Environmental Science, 2020, 40(2): 806-815. DOI:10.3969/j.issn.1000-6923.2020.02.041 |
| [7] |
宋秀凯, 张秀珍, 刘爱英, 等. 浒苔过量繁殖后海区环境因子与浮游植物群落演替规律研究[J]. 安全与环境学报, 2011, 11(2): 150-157. SONG Xiukai, ZHANG Xiuzhen, LIU Aiying, et al. Relationship between phytoplankton community succession and environmental factors after Enteromorpha prolifra bloom[J]. Journal of Safety and Environment, 2011, 11(2): 150-157. DOI:10.3969/j.issn.1009-6094.2011.02.035 |
| [8] |
孙颖颖, 刘筱潇, 王长海. 浒苔提取物对4种赤潮微藻生长的抑制作用[J]. 环境科学, 2010, 31(6): 1662-1669. SUN Yingying, LIU Xiaoxiao, WANG Changhai. Growth inhibition of the four species of red tide microalgae by extracts from Enteromorpha prolifera extracted with the five solvents[J]. Environmental Science, 2010, 31(6): 1662-1669. |
| [9] |
赵妍. 大型海藻缘管浒苔(Enteromorpha linza)对两种海洋微藻克生效应的初步研究及克生物质的分离与鉴定[D]. 青岛: 中国海洋大学, 2010. ZHAO Yan. Allelopathic effect of Enteromorpha linza on two species of marine microalgae and the allelochemical's isolation and characterization[D]. Qingdao: Ocean University of China, 2010. |
| [10] |
TASSAN S. Local algorithms using SeaWiFS data for the retrieval of phytoplankton, pigments, suspended sediment, and yellow substance in coastal waters[J]. Applied Optics, 1994, 33(12): 2369-2378. DOI:10.1364/AO.33.002369 |
| [11] |
SISWANTO E, TANG J, YAMAGUCHI H, et al. Empirical ocean-color algorithms to retrieve Chlorophyll-a, total suspended matter, and colored dissolved organic matter absorption coefficient in the Yellow and East China Seas[J]. Journal of Oceanography, 2011, 67(5): 627-650. DOI:10.1007/s10872-011-0062-z |
| [12] |
陈楚群, 潘志林, 施平. 海水光谱模拟及其在黄色物质遥感反演中的应用[J]. 热带海洋学报, 2003(5): 33-39. CHEN Chuqun, PAN Zhilin, SHI Ping. Simulation of sea water reflectance and its application in retrieval of yellow substance by remote sensing data[J]. Journal of Tropical Oceanography, 2003(5): 33-39. |
| [13] |
王林, 赵冬至, 杨建洪, 等. 大洋河河口海域有色溶解性有机物的光学特性及遥感反演模型[J]. 海洋学报(中文版), 2011, 33(1): 45-51. WANG Lin, ZHAO Dongzhi, YANG Jianhong, et al. The optical properties and remote sensing retrieval model of chromophoric dissolved organic matter in the Dayang Estuary[J]. Haiyang Xuebao, 2011, 33(1): 45-51. |
| [14] |
周亚明, 李俊生, 申茜, 等. 基于水面光谱数据的官厅水库有色可溶性有机物反演[J]. 光谱学与光谱分析, 2015, 35(4): 1015-1019. ZHOU Yaming, LI Junsheng, SHEN Qian, et al. Retrieving chromophoric dissolved organic matter in Guanting reservoir based on in-situ measured reflectance data[J]. Spectroscopy and Spectral Analysis, 2015, 35(4): 1015-1019. |
| [15] |
范宪创, 陈圣波, 周超, 等. 基于MODIS数据的海洋叶绿素反演算法研究[J]. 科学技术与工程, 2017, 17(10): 74-80. FAN Xianchuang, CHEN Shengbo, ZHOU Chao. Research on ocean Chlorophyll retrieval algorithm based on MODIS data[J]. Science Technology and Engineering, 2017, 17(10): 74-80. |
| [16] |
唐军武, 王晓梅, 宋庆君, 等. 黄、东海二类水体水色要素的统计反演模式[C]//遥感专业委员会. 第十四届全国遥感技术学术交流会论文选集. 青岛: 中国海洋学会, 2003: 7. TANG Junwu, WANG Xiaomei, SONG Qingjun. Statistical inversion models for Case Ⅱ water color elements in the Yellow Sea and East China Sea[C]//Committee on Remote Sensing. Selected papers of the 14th National Symposium on Remote Sensing Technology. Qingdao: Chinese Society for Oceanography, 2003: 7. |
| [17] |
XING Q, HU C, TANG D, et al. World's largest macroalgal blooms altered phytoplankton biomass in summer in the Yellow Sea: satellite observations[J]. Remote Sensing, 2015, 7(9): 12297-12313. |
| [18] |
JEFFREY S W, HUMPHREY G F. New spectrophotometric equations for determining Chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton[J]. Biochemie und Physiologie der Pflanzen, 1975, 167(2): 191-194. |
| [19] |
唐军武, 田国良, 汪小勇, 等. 水体光谱测量与分析Ⅰ: 水面以上测量法[J]. 遥感学报, 2004(1): 37-44. TANG Junwu, TIAN Guoliang, WANG Xiaoyong, et al. The methods of water spectra measurement and analysis Ⅰ: Above-water method[J]. Journal of Remote Sensing, 2004(1): 37-44. |
| [20] |
孙慧, 谢小平. 基于MODIS数据的日照市近海浒苔监测及影响因子分析[J]. 国土资源遥感, 2016, 28(1): 144-151. SUN Hui, XIE Xiaoping. Monitoring of Enteromorpha prolifera and analysis of impact factors based on MODIS data in Rizhao offshore[J]. Remote Sensing for Land & Resources, 2016, 28(1): 144-151. |
| [21] |
韩君君, 黄惠明, 张薇娜, 等. 2018年黄海浒苔分布特征及动力机制分析[J]. 海洋科学, 2020, 44(6): 37-44. HAN Junjun, HUANG Huiming, ZHANG Weina, et al. Distribution characteristics and dynamic mechanism of Enteromorpha prolifera in the Yellow Sea in 2018[J]. Marine Sciences, 2020, 44(6): 37-44. |
| [22] |
陆荣洋, 申辉, 李大伟. 2015年黄海浒苔演变特征的遥感分析[J]. 海洋科学, 2016, 40(10): 134-142. LU Rongyang, SHEN Hui, LI Dawei. Remote sensing of the Yellow Sea green tide evolution in 2015[J]. Marine Sciences, 2016, 40(10): 134-142. |
| [23] |
宋德彬, 高志强, 徐福祥, 等. 基于GOCI的2017年南黄海浒苔演变遥感分析[J]. 海洋与湖沼, 2018, 49(5): 1068-1074. SONG Debin, GAO Zhiqiang, XU Fuxiang, et al. Spatial and temporal variability of the green tide in the south yellow sea in 2017 deciphered from the goci image[J]. Oceanologia et Limnologia Sinica, 2018, 49(5): 1068-1074. |
| [24] |
吴孟泉, 郭浩, 张安定, 等. 2008年—2012年山东半岛海域浒苔时空分布特征研究[J]. 光谱学与光谱分析, 2014, 34(5): 1312-1318. WU Mengquan, GUO Hao, ZHANG Anding, et al. Research on the characteristics of ulva proliferain Shandong Peninsula during 2008—2012 based on MODIS data[J]. Spectroscopy and Spectral Analysis, 2014, 34(5): 1312-1318. |
| [25] |
章志, 陈艳拢, 罗锋. 基于遥感技术的2014年南黄海浒苔时空分布特征研究[J]. 淮海工学院学报(自然科学版), 2016, 25(1): 80-85. ZHANG Zhi, CHEN Yanlong, LUO Feng. Temporal and spatial distribution characteristics of Enteromorpha prolifera in the south yellow sea based on remote sensing data of 2014[J]. Journal of Jiangsu Ocean University(Natural Science Edition), 2016, 25(1): 80-85. |
| [26] |
赵娜. 基于黄渤海海域的叶绿素A浓度时空特征监测[D]. 青岛: 青岛大学, 2020. ZHAO Na. Monitoring of temporal and spatial characteristics of chlorophyll a concentration in the Yellow Sea and Bohai Sea[D]. Qingdao: Qingdao University, 2020. |
| [27] |
杨曦光. 黄海叶绿素及初级生产力的遥感估算[D]. 青岛: 中国科学院研究生院(海洋研究所), 2013. YANG Xiguang. Chlorophyll and primary productivity estimation based on remote sensing in Yellow Sea[D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanology, Chinese Academy of Sciences), 2013. |
| [28] |
刘艳芳, 苏荣国, 周倩倩, 等. 基于CDOM光学参数的近海富营养化快速评价技术[J]. 中国激光, 2014, 41(12): 243-250. LIU Yanfang, SU Rongguo, ZHOU Qianqian, et al. Rapid modeling offshore eutrophication technique using optical parameters of CDOM[J]. Chinese Journal of Lasers, 2014, 41(12): 243-250. |
| [29] |
COBLE P, HU C, GOULD R W, et al. Colored dissolved organic matter in the coastal ocean: an optical tool for coastal zone environmental assessment and management[J]. Oceanography, 2004, 17(2): 50-59. |
| [30] |
VODACEK A, HOGE F E, SWIFT R N, et al. The use of in situ and airborne fluorescence measurements to determine UV absorption coefficients and DOC concentrations in surface waters[J]. Limnology and Oceanography, 1995, 40(2): 411-415. |
| [31] |
SKOOG A, WEDBORG M, FOGELQVIST E. Photobleaching of fluorescence and the organic carbon concentration in a coastal environment[J]. Marine Chemistry, 1996, 55(3/4): 333-345. |
| [32] |
LIU X Q, LI Y, WANG Z L, et al. Cruise observation of Ulva prolifera bloom in the southern Yellow Sea, China[J]. Estuarine Coastal & Shelf Science, 2015, 163(13): 17-22. |
| [33] |
孙晓. 黄海绿潮和叶绿素a浓度的遥感时空分异及两者响应机制[D]. 烟台: 鲁东大学, 2018. SUN Xiao. Spatial and temporal variations and response mechanism of green tide and chlorophyll a concentrations based on remote sensing in southern Yellow Sea[D]. Yantai: Ludong University, 2018. |
 2023, Vol. 47
2023, Vol. 47


