文章信息
- 周齐家, 潘滢, 陈佳, 郑炜强, 王军. 2023.
- ZHOU Qi-jia, PAN Ying, CHEN Jia, ZHENG Wei-qiang, WANG Jun. 2023.
- 大黄鱼Lcnkl3基因的分子结构、表达特征及多肽片段抗菌活性
- Molecular structure, expression characteristics, and antibacterial activity of polypeptide fragment of Lcnkl3 in large yellow croaker
- 海洋科学, 47(4): 25-36
- Marine Sciences, 47(4): 25-36.
- http://dx.doi.org/10.11759/hykx20201106003
-
文章历史
- 收稿日期:2020-11-06
- 修回日期:2020-12-07
2. 大黄鱼育种国家重点实验室, 宁德市富发水产有限公司, 福建 宁德 352103
2. State Key Laboratory of Large Yellow Croaker Breeding, Ningde Fufa Fishery Company Limited, Ningde 352103, China
NK-lysin是由毒性T细胞(cytotoxic T lymphocytes)和自然杀伤细胞(natural killer cells)产生的小分子多肽, 属于鞘脂激活蛋白样蛋白(saposin-like protein)家族成员[1-2], 在鱼类免疫系统对抗病原感染的过程中发挥着重要作用[3]。NK-lysin的多肽序列中具有鞘脂激活蛋白B(Saposin B)结构域及6个半胱氨酸残基[4], 该特征在鱼类到哺乳动物NK-lysin序列中高度保守。NK-lysin具备广谱的抗病原活性, 不仅能够杀灭细菌、真菌、病毒、原生动物以及寄生虫[5-9], 还能抑制肿瘤细胞生长[10-11], 因此具备良好的应用前景。目前在脊椎动物体内已发现了多种类型的NK-lysin基因, 围绕其结构与免疫活性的研究也不断增加。
NK-lysin最初被发现于猪(Sus scrofa)的小肠组织[1, 12], 随后在脊椎动物体内陆续有NK-lysin基因得到鉴定。在硬骨鱼类中, NK-lysin基因最先由Wang等发现于斑点叉尾鮰(Ictalurus punctatus)体内[13-14], 随后其他鱼类中的NK-lysin基因也相继得到分析, 特别是近几年在鱼类中发现的NK-lysin基因数量增长迅速。除斑点叉尾鮰外, 其他已被发现具有NK-lysin基因的鱼类有: 牙鲆(Paralichthys olivaceus)[15]、半滑舌鳎(Cynoglossus semilaevis)[16]、斑马鱼(Danio rerio)[17]、团头鲂(Megalobrama amblycephala)[18]、草鱼(Ctenopharyngodon idella)[19]、鲤鱼(Cyprinus carpio)[20]、罗非鱼(Oreochromis niloticus)[21]、大菱鲆(Scophthalmus maximus)[22]、达氏鲟(Acipenser dabryanus)[23]、褐菖鲉(Sebastiscus marmoratus)[24]、大西洋鲑(Salmo salar)[25-26]、弹涂鱼(Boleophthalmus pectinirostris)[27]、巴马拟缨鱼(Pseudocrossocheilus bamaensis)[28]、卵形鲳鲹(Trachinotus ovatus)[29]、黄颡鱼(Pelteobagrus fulvidraco)[30]、大西洋鲷(Sparus aurata)[31]、欧洲海鲈(Dicentrarchus labrax)[31-32]等。
大黄鱼(Larimichthys crocea)养殖业在我国水产养殖业中占据重要地位, 但其发展长期受养殖病害问题制约, 而不断深化对大黄鱼免疫功能基因的了解则可为制定并优化具有针对性的病害防控策略提供支持。在前期的研究中, 我们在大黄鱼组织中发现了2种NK-lysin基因, 对其基因序列结构及表达调控趋势的分析表明Lc-nk-lysin为典型的硬骨鱼类NK-lysin成员[33], 而Lcnkl2则属于新型的鱼类NK-lysin基因[34]。在本文中, 我们对在大黄鱼组织中发现的第3种NK- lysin基因——Lcnkl3进行了研究, 分析了该基因的序列特征、组织表达特性、诱导表达趋势及其多肽片段的抗菌活性, 通过将其与另外2种大黄鱼NK-lysin基因进行比较, 发现该基因与Lcnkl2更为相似。本文围绕Lcnkl3基因开展分析研究, 以期增进对于大黄鱼NK-lysin基因家族的了解, 为后续进一步探索大黄鱼NK-lysin的免疫调控机制及其多肽序列组成与抗病原活性的关系提供参考。
1 材料与方法 1.1 大黄鱼Lcnkl3基因的克隆与序列分析实验用鱼购买自福建宁德三都澳大黄鱼养殖区, 暂养两周至其状态稳定并随机分组, 随后利用刺激隐核虫(Cryptocaryon irritans)感染实验组大黄鱼并采集各组织样品保存, 同时采集未感染大黄鱼各组织样品保存,用于转录组测序以及基因的组织表达与诱导表达测定, 采集方法如前文所述[33, 35]。测序后利用生物信息学分析方法在大黄鱼肝脏转录组数据库中筛选获得了Lcnkl3的参考基因序列, 以该序列为模板克隆验证Lcnkl3基因并分析序列结构, 主要步骤如下: 在未受感染的大黄鱼肝脏组织中提取总RNA并立即将其反转录为cDNA, 通过特异性引物(Nkl3-F1与Nkl3-R1)扩增Lcnkl3基因序列。PCR扩增程序为: 首先于94 ℃预变性5 min, 随后以94 ℃变性30 s、55 ℃退火45 s、72 ℃延伸1 min为一个循环, 共进行30个循环, 最后于72 ℃下延伸10 min。将PCR扩增产物加至浓度为1%的琼脂糖凝胶(Biowset), 将凝胶放置于TBE电泳缓冲液中分离基因片段, 随后切下包含Lcnkl3基因片段的凝胶条带并使用DNA回收试剂盒(Tiangen)回收和纯化目的基因片段。将纯化的Lcnkl3基因片段与pMD19-T载体(TaKaRa)连接后转入化学感受态细胞(TransGen), 使用LB培养基于37 ℃恒温培养箱中将包含目的基因片段的菌液培养8~10 h。随机挑取单个菌落, 使用通用引物扩增验证后送交上海生工生物工程公司测定重组阳性克隆的基因序列。获得经过验证的Lcnkl3基因片段后以该序列片段为模板设计特异性引物, 利用cDNA末端快速扩增技术扩增Lcnkl3基因片段的3′端及5′端的序列, 用于扩增Lcnkl3基因cDNA 3′端序列的引物的退火温度分别为59 ℃、57 ℃、59 ℃, 用于扩增Lcnkl3基因cDNA 5′端序列的引物退火温度为57 ℃。Lcnkl3基因克隆步骤所使用的引物序列见表 1。
| 引物名称 | 引物序列(5′→3′) | 作用 |
| Nkl3-F1 | GCAGTTGTTGTGAAGTCGTGGGA | 基因片段克隆 |
| Nkl3-R1 | TCTTTGCTATGTAGTTGCTCAGTCT | 基因片段克隆 |
| Nkl3-F31 | CATCGCTCTTCTCCTGCTCTCCG | cDNA 3′扩增 |
| Nkl3-F32 | CCGCAGTTGTTGTGAAGTCGTGG | cDNA 3′扩增 |
| Nkl3-F33 | GGGCTCCTGTTATGCCTGTCGGT | cDNA 3′扩增 |
| Nkl3-R51 | GCCTGCCGCTTTACTTTGGACAC | cDNA 5′扩增 |
| Nkl3-R52 | ATGTACCGACAGGCATAACAGGAGC | cDNA 5′扩增 |
| Nkl3-R53 | CTTCCTCCTCTTCAGTTTCGTCCTC | cDNA 5′扩增 |
| RA | AAGCAGTGGTATCAACGCAGAGTAC | cDNA 5′扩增 |
| dT-RA | AAGCAGTGGTATCAACGCAGAGTAC(T)30VN | 反转录 |
| Nkl3-FL-F | ATCGCTCTTCTCCTGCTCTC | 序列拼接验证 |
| Nkl3-FL-R | CCTTCTCAATAAAGCTTTACACGC | 序列拼接验证 |
| Nkl3-FQ | CGCCTGCAAGAAGGTCACCA | 荧光定量PCR |
| Nkl3-RQ | AAATTCTCCGGGAAGATCCGTT | 荧光定量PCR |
| ActinF | AAGCCAACAGGGAGAAGATGAC | 荧光定量PCR |
| ActinR | ACGACCAGAGGCATACA | 荧光定量PCR |
使用BioEdit软件对获得的Lcnkl3基因片段进行拼接, 使用VecScreen(https://www.ncbi.nlm.nih.gov/tools/vecscreen/)识别Lcnkl3基因序列及pMD19-T载体序列, 使用BLAST(https://blast.ncbi.nlm.nih. gov/Blast.cgi)程序分析和比较不同基因序列的相似性, 开放阅读框位置及其编码的多肽序列利用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder)进行预测, 使用SignalP预测LcNkl3多肽的信号肽区域, 利用PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/)和SMART(http://smart.embl.de/) 预测LcNkl3多肽的二级结构, 利用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)比对不同NK-lysin多肽序列的相似性, 利用MEGA-X进行系统进化分析, 计算方法使用邻接法(Neighbor-Joining, NJ)。本文中用于多肽序列比对以及系统进化分析的物种名称见表 2。
| 物种及序列名称 | GenBank登录号 | 参考文献 |
| 大黄鱼Larimichthys crocea Lc-Nk-lysin | KJ865299 | [33] |
| 大黄鱼Larimichthys crocea Lcnkl2 | KP301138 | [34] |
| 大黄鱼Larimichthys crocea Lcnkl3 | KP301139 | [本文] |
| 斑点叉尾鮰Ictalurus punctatus type1 | NM_001200208 | [14] |
| 斑点叉尾鮰Ictalurus punctatus type2 | DQ153186 | [14] |
| 斑点叉尾鮰Ictalurus punctatus type3 | DQ153187 | [14] |
| 斑马鱼Danio rerio Nkla | KP100115 | [17] |
| 斑马鱼Danio rerio Nklb | KP100116 | [17] |
| 斑马鱼Danio rerio Nklc | KP100117 | [17] |
| 斑马鱼Danio rerio Nkld | KP100118 | [17] |
| 大西洋鲑Salmo salar Nk-lysin-1 | NM_001141110 | [25] |
| 大西洋鲑Salmo salar Nk-lysin-2 | EG932844 | [25] |
| 大西洋鲑Salmo salar Nk-lysin-3 | EG810337 | [25] |
| 大西洋鲑Salmo salar Nk-lysin-4 | EG819316 | [25] |
| 巴马拟缨鱼Pseudocrossocheilus bamaensis Nkla | MH910093 | [28] |
| 巴马拟缨鱼Pseudocrossocheilus bamaensis Nklb | MH916607 | [28] |
| 巴马拟缨鱼Pseudocrossocheilus bamaensis Nklc | MH916605 | [28] |
| 巴马拟缨鱼Pseudocrossocheilus bamaensis Nkld | MK263337 | [28] |
| 巴马拟缨鱼Pseudocrossocheilus bamaensis Nkle | MH916606 | [28] |
| 鲤鱼Cyprinus carpio Nkl1 | XM_019120973 | [20] |
| 鲤鱼Cyprinus carpio Nkl2 | KX034213 | [20] |
| 鲤鱼Cyprinus carpio Nkl3 | XM_019071085 | [20] |
| 鲤鱼Cyprinus carpio Nkl4 | XM_019092430 | [20] |
| 鲤鱼Cyprinus carpio Nkl5 | XP_018952410.1 | [20] |
| 鲤鱼Cyprinus carpio Nkl6 | XP_018970060 | [20] |
| 团头鲂Megalobrama amblycephala Nkla | / | [18] |
| 团头鲂Megalobrama amblycephala Nklb | / | [18] |
| 牙鲆Paralichthys olivaceus | AU260449 | [15] |
| 半滑舌鳎Cynoglossus semilaevis | KC346974 | [16] |
| 草鱼Ctenopharyngodon idella | KT877168 | [19] |
| 罗非鱼Oreochromis niloticus | MF67882 | [21] |
| 大菱鲆Scophthalmus maximus | KU705506 | [22] |
| 卵形鲳鲹Trachinotus ovatus | MN648454 | [29] |
| 弹涂鱼Boleophthalmus pectinirostris | XM_020919797 | [27] |
| 褐菖鲉Sebastiscus marmoratus | MK913633 | [24] |
| 黄颡鱼Pelteobagrus fulvidraco | MN131138 | [30] |
| 欧洲海鲈Dicentrarchus labrax | ASD56696 | [32] |
| 大西洋鲷Sparus aurata | MN240490 | [31] |
| 达氏鲟Acipenser dabryanus | AZL56981 | [23] |
在组织表达测定实验中, 采集3尾未感染大黄鱼的皮肤、鳃、头肾、脑、心脏、肝脏、脾脏、胃、肠、肌肉等10种组织, 分别在上述组织中提取总RNA并立即反转录为cDNA, 利用β-actin作为内参基因, 设计特异性引物用于检测Lcnkl3基因在未感染大黄鱼上述10种组织中的表达情况, 以肝脏组织中Lcnkl3基因的表达量为基准, 计算不同组织中Lcnkl3基因的基础表达量。随后, 分别以大黄鱼受病原感染6 h、24 h、48 h、72 h、96 h、120 h、144 h的鳃、头肾、脾脏和肝脏为模板提取总RNA并立即将其反转录为cDNA, 利用β-actin作为内参基因, 以未感染大黄鱼相应组织中基因的表达量为基准, 测定Lcnkl3基因在大黄鱼4种组织中的诱导表达情况。使用ABI 7500-FAST荧光定量PCR仪进行基因表达量的测定, 根据使用说明书设定扩增程序为: 95 ℃预变性30 s, 之后以95 ℃ 5 s、55 ℃ 30 s、72 ℃ 30 s为一个扩增循环, 共进行40次循环。反应设置空白对照及3个平行对照, 通过标准曲线评估特异性引物与内参基因引物的扩增效率, 通过熔解曲线检验扩增的特异性, 使用SPSS 21软件中的单因素方差分析以及2-△△Ct方法对获得的数据进行计算, 显著性水平设定为P值< 0.05, 数据以平均值±标准误表示。荧光定量PCR检测所使用的引物序列见表 1。
1.3 Lcnkl3多肽片段合成与抗菌活性测定通过分析已有的鱼类NK-lysin多肽序列特征, 选取了一段位于Lcnkl3成熟肽区域的序列片段(VCNGFRSRFVRSACKKVTRRYQYR), 由苏州强耀生物科技有限公司利用化学方法合成。经过高效液相色谱仪分离纯化和质谱检测, 将以干粉形态保存的Lcnkl3多肽片段溶解于超纯水中, 并通过2倍稀释法将多肽溶液稀释为不同浓度(3 μmol/L, 6 μmol/L, 12 μmol/L, 24 μmol/L, 48 μmol/L, 96 μmol/L, 192 μmol/L)用于后续实验。
测定了不同浓度的Lcnkl3多肽溶液对于常见的革兰氏阳性细菌及革兰氏阴性细菌的抑制与杀灭效果, 所用细菌为金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、哈维氏弧菌(Vibrio harveyi)、副溶血弧菌(Vibrio Parahaemolyticus)、嗜水气单胞菌(Aeromonas hydrophila)和美人鱼发光杆菌(Photobacterium damselae), 实验细菌菌株由集美大学水产学院赠予并于本实验室保存。测定前, 将保存于–80 ℃环境中的菌株复苏、活化并培养至对数期, 其中金黄色葡萄球菌和大肠杆菌放置于37 ℃环境中培养, 其他菌株放置于28 ℃环境中培养。多肽片段的抗菌实验步骤参照文献中方法操作[33, 36], 主要步骤如下: 使用浓度为10 mmol/L的磷酸钠缓冲液洗脱经活化的细菌菌落并将其吸光度值稀释调节至0.001 8, 将菌液与不同浓度的多肽溶液等体积混匀后转入96孔板, 空白对照组中使用无菌超纯水代替不同浓度的多肽溶液与细菌悬浮液等体积混合, 阴性对照组中使用3 μmol/L的多肽溶液与无菌的液体培养基等体积混合, 各浓度均设置3次平行对照实验。将96孔板放置于37 ℃或28 ℃环境中培养24 h并记录不同浓度多肽溶液对细菌的抑制作用, 之后再将96孔板中的悬浮液吸出并均匀涂布于固体培养基继续培养12 h, 记录各浓度多肽溶液对细菌的杀灭作用, 抗菌活性实验进行3次重复测定。
2 结果 2.1 Lcnkl3基因序列特征通过基因克隆, 获得了一段包含完整开放阅读框区域的大黄鱼Lcnkl3基因序列(图 1)。Lcnkl3基因序列全长604 bp, 其中5′非翻译区长度27 bp, 开放阅读框区域长度435 bp, 3′非翻译区长度142 bp。开放阅读框区域能够编码由144个氨基酸残基组成的多肽序列, 多肽序列具有信号肽区域和Saposin B结构域。预测的信号肽切割位点位于第21与第22个氨基酸残基(VKS-WE)之间, Saposin B结构域起始于第63个氨基酸残基, 终止于第139个氨基酸残基。Lcnkl3基因已提交至GenBank数据库, 登录号为KP301139。Lcnkl3多肽的6个半胱氨酸残基分别位于序列的第65, 68, 96, 108, 133, 139位, 与其他鱼类NK-lysin多肽序列的多重比对结果显示6个半胱氨酸残基在不同鱼类物种间高度保守(图 2)。系统进化分析表明, Lcnkl3与Lcnkl2最先聚为一类, 而与其他鱼类NK-lysin序列的相似程度则较低(图 3)。
2.2 Lcnkl3基因的组织表达及诱导表达特征Lcnkl3基因在未受感染的大黄鱼10种组织中的表达量差异较为明显, 其表达量最高的组织为心脏, 其次为脾脏、头肾、鳃。肝脏与肌肉中也检测到Lcnkl3基因的表达, 但在皮肤、肠、胃及脑组织中Lcnkl3基因的表达量较低(图 4)。
 |
| 图 1 大黄鱼Lcnkl3基因的cDNA及其编码的多肽序列 Fig. 1 cDNA and the encoded polypeptide sequence of L. crocea Lcnkl3 注: 开放阅读框区域以及预测的多肽序列以大写字母表示, 非翻译区以小写字母表示, 转录起始位点ATG、终止位点TAA、6个半胱氨酸残基及多腺苷酸化终止信号aataaa通过下划线标出, 信号肽区域及Saposin B区域以阴影标出。 |
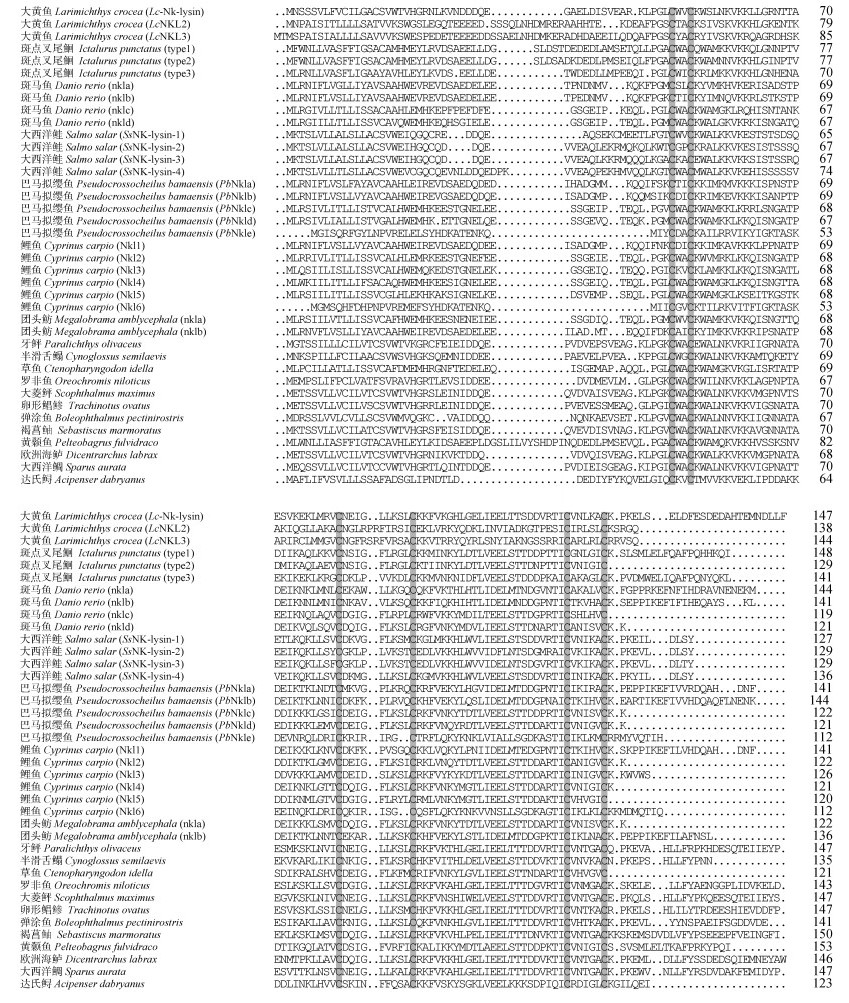 |
| 图 2 鱼类NK-lysin多肽序列多重比对 Fig. 2 Multiple alignments of the NK-lysin polypeptide sequences of fish species 注: 多肽序列引自相关研究论文, 序列间完全保守的6个半胱氨酸残基通过阴影标出。 |
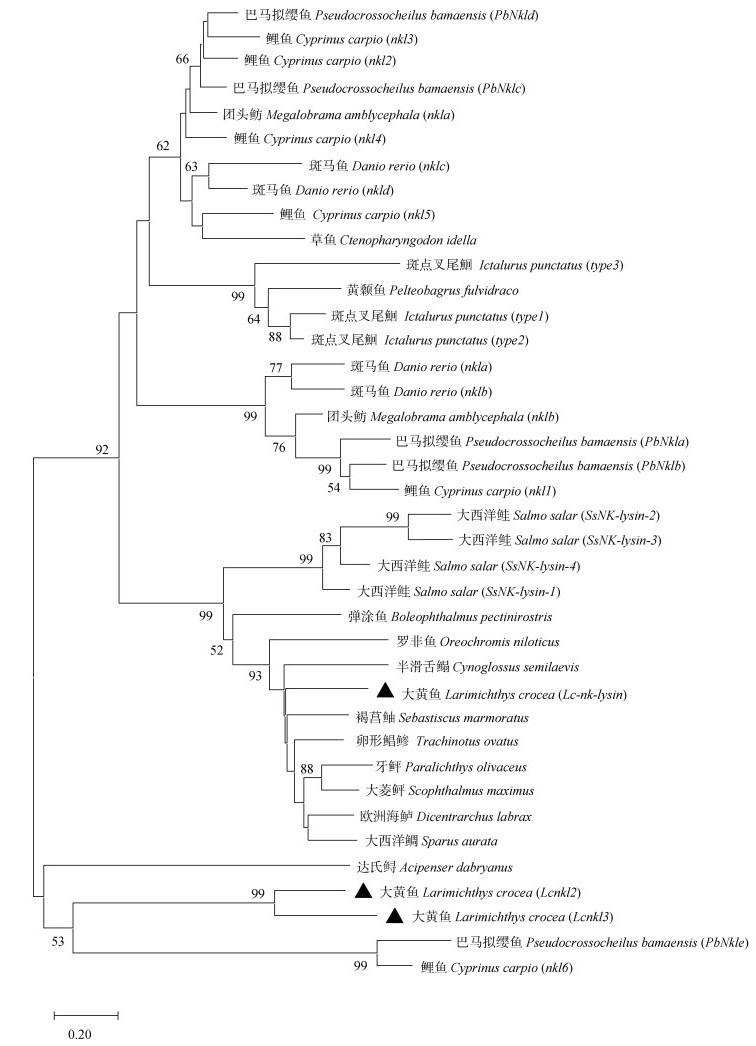 |
| 图 3 硬骨鱼类NK-lysin系统发育分析 Fig. 3 Phylogenetic analysis of NK-lysin in teleosts 注: 数字表示置信度, 只显示置信度 > 50的聚类结果。 |
在受病原感染的大黄鱼4种组织中, Lcnkl3基因在不同组织中的表达趋势存在显著差异。在鳃组织与头肾组织中, 0 h时Lcnkl3基因表达量最高, 此后总体呈现出持续下调的变化趋势(图 5a、5b)。在脾脏中, 感染后72 h内Lcnkl3基因的变化不显著(P > 0.05), 到96 h时则显著上调表达(P < 0.05), 在120 h至168 h又恢复至基础表达水平(图 5c)。在肝脏中, Lcnkl3基因表达量在6 h和24 h时显著上调表达(P < 0.05), 在48 h和72 h时的表达量又显著下调(P < 0.05), 96 h时恢复至基础表达水平, 此后又于120 h和168 h时再次上调表达(P < 0.05)(图 5d)。
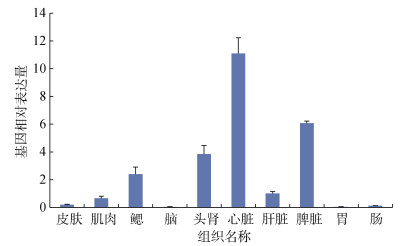 |
| 图 4 未受病原感染的大黄鱼组织中Lcnkl3基因的相对表达量 Fig. 4 Relative expression profiles of Lcnkl3 in tissues of uninfected large yellow croaker |
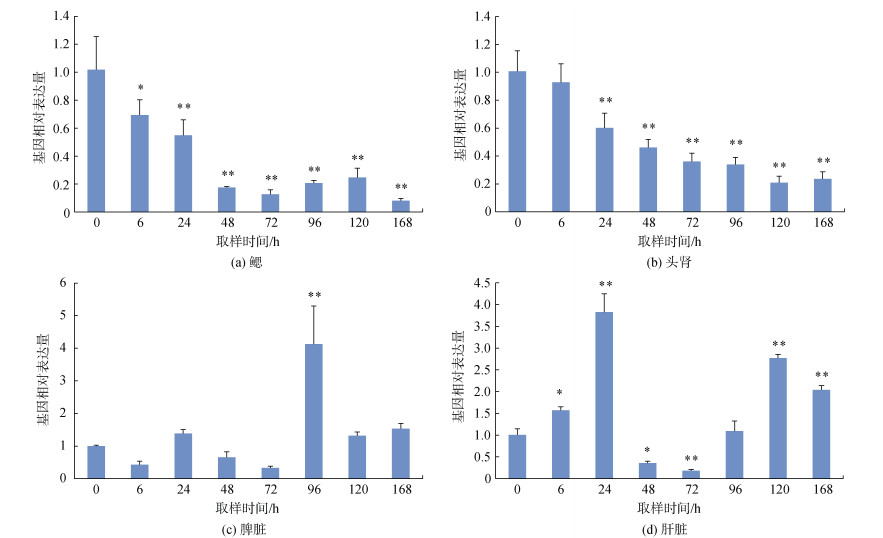 |
| 图 5 病原诱导过程大黄鱼鳃、头肾、脾脏、肝脏中Lcnkl3基因的相对表达量 Fig. 5 Relative expression profiles of Lcnkl3 in thegill, head kidney, spleen, andliver of large yellow croaker during pathogen infection 注: 显著差异表达(P < 0.05)与极显著差异表达(P < 0.01)分别以“*”“**”表示。 |
经过色谱分离纯化及质谱鉴定, Lcnkl3多肽片段纯度为99.16%, 多肽的抗菌活性测定结果表明Lcnkl3多肽片段对金黄色葡萄球菌、哈维氏弧菌具有较强的抗菌活性, 其最小抑菌浓度及最小杀菌浓度均低于1.5 μmol/L。而浓度为12 μmol/L的多肽溶液能够有效抑制大肠杆菌与副溶血弧菌的生长。但对于嗜水气单胞菌和美人鱼发光杆菌, Lcnkl3多肽片段没有抑制效果(表 3)。
| 实验细菌菌株 | Lcnkl3多肽片段抗菌活性 | |
| 最小抑菌浓度(μmolּL–1) | 最小杀菌浓度(μmolּL–1) | |
| 金黄色葡萄球菌Staphylococcus aureus | < 1.5 | < 1.5 |
| 大肠杆菌Escherichia coli | 3~6 | 6~12 |
| 哈维氏弧菌Vibrio harveyi | < 1.5 | < 1.5 |
| 副溶血弧菌Vibrio Parahaemolyticus | 3~6 | 6~12 |
| 嗜水气单胞菌Aeromonas hydrophila | > 96 | > 96 |
| 美人鱼发光杆菌Photobacterium damselae | > 96 | > 96 |
在前期的研究中, 我们报道了2种类型的大黄鱼NK-lysin基因, 即较为保守的Lc-nk-lysin以及相对不保守的Lcnkl2, 在本研究中通过对大黄鱼Lcnkl3基因结构进行分析预测, 我们发现Lcnkl3的成熟肽序列具有NK-lysin家族成员的主要特征, 即具有Saposin B结构域以及6个在不同序列间高度保守的半胱氨酸残基, 6个半胱氨酸残基可形成3个分子内二硫键, 而Saposin B结构域可参与鞘脂降解, 这对于NK-lysin发挥其抗病原活性至关重要[37-38]。系统进化分析结果显示Lcnkl3与Lcnkl2最先聚类并形成独立的进化分支, 两者与包括Lc-Nk-lysin在内的其他NK-lysin多肽序列相似性较低, 表明Lcnkl3与Lcnkl2均属于相对不保守的大黄鱼NK-lysin序列。至今在大黄鱼组织中已鉴定出3种NK-lysin基因, 其他已被证实存在多个NK-lysin家族成员的鱼类有: 团头鲂(2种)[18], 斑点叉尾鮰(3种)[14], 斑马鱼(4种)[17], 大西洋鲑(4种)[25], 巴马拟缨鱼(5种)[28], 鲤鱼(6种)[20], 以上结果表明NK-lysin在硬骨鱼类中可能出现了特异性分化。
荧光定量PCR测定结果显示Lcnkl3基因在大黄鱼不同组织以及受病原刺激不同阶段的表达量存在显著差异。Lc-nk-lysin和Lcnkl2主要在大黄鱼免疫相关组织中表达, 两者表达量最高的组织分别为鳃与头肾, 而Lcnkl3在心脏中的表达量最高, 这与在牙鲆中发现的NK-lysin基因具有相似的表达模式[15]。此外, Lc-nk-lysin、Lcnkl2与Lcnkl3在各组织及各诱导时间点并未呈现出相似的表达调控规律, 而是具有各不相同的表达趋势, 提示3种类型的NK-lysin基因均参与了大黄鱼免疫应答, 并且三者在大黄鱼免疫应答过程中可能存在着功能分化。在其他硬骨鱼类中, 不同类型的NK-lysin基因也具有不同的表达模式, 例如在巴马拟缨鱼5种NK-lysin基因(PbNkla、PbNklb、PbNklc、PbNkld、PbNkle)中, PbNkla在肠组织中高表达, PbNklc在皮肤中高表达, PbNkld在脑组织中高表达, PbNkle在鳃、脾脏和头肾中表达量较高, 而PbNklb在未感染的鱼体内不表达, 仅在受嗜水气单胞菌诱导后表达[28]。
多肽片段的抗菌活性测定结果表明Lcnkl3的活性与Lcnkl2较为相似, 两者整体上优于Lc-Nk-lysin的2种多肽片段[33-34]。Lcnkl3与Lcnkl2均能有效抑制和杀灭金黄色葡萄球菌和哈维氏弧菌, 但抑制嗜水气单胞菌和美人鱼发光杆菌的能力较弱。相较于Lcnkl2多肽片段, 更低浓度的Lcnkl3多肽溶液即可有效抑制并杀灭大肠杆菌, 而Lcnkl3多肽溶液对副溶血弧菌的最小杀菌浓度则要高于Lcnkl2。相关研究表明NK-lysin的抗菌活性与肽段的氨基酸组成及其二级结构密切相关, 例如源自哺乳动物的P-NK-2对于革兰氏阳性菌的致死浓度远低于源自牙鲆的JF-NK-2[15]; 半滑舌鳎NKLP27能够通过破坏细胞膜的完整性实现对革兰氏阳性菌和革兰氏阴性菌的杀灭, 然而由NKLP27末端截短5个氨基酸残基所生成的衍生肽(NKLP22)则可能由于α-螺旋结构的缩短而导致其活性降低[5]。目前有关鱼类NK-lysin对病原菌作用构效关系的研究仍相对较少, 因此需进一步围绕大黄鱼3种NK-lysin的多肽结构及其抗菌能力开展研究。
4 结论对Lcnkl3序列结构的分析表明其与除Lcnkl2之外的鱼类NK-lysin基因存在较大差异, 但仍属于大黄鱼NK-lysin基因家族。对Lcnkl3基因表达特征及Lcnkl3成熟肽片段抗菌活性的分析则提示Lcnkl3可能在大黄鱼对抗细菌感染的免疫应答过程中发挥了免疫防御作用, 有必要围绕Lcnkl3成熟肽抗菌活性的构效关系开展深入研究。
| [1] |
ANDERSSON M, GUNNE H, AGERBERTH B, et al. NK-lysin, a novel effector peptide of cytotoxic T and NK cells. Structure and cDNA cloning of the porcine form, induction by interleukin 2, antibacterial and antitumour activity[J]. The EMBO Journal, 1995, 14(8): 1615-1625. DOI:10.1002/j.1460-2075.1995.tb07150.x |
| [2] |
ANDERSSON M, GUNNE H, AGERBERTH B, et al. NK-lysin, structure and function of a novel effector molecule of porcine T and NK cells[J]. Veterinary Immunology and Immunopathology, 1996, 54(1/4): 123-126. |
| [3] |
FISCHER U, KOPPANG E O, NAKANISHI T. Teleost T and NK cell immunity[J]. Fish & Shellfish Immunology, 2013, 35(2): 197-206. |
| [4] |
LIEPINSH E, ANDERSSON M, RUYSSCHAERT J M, et al. Saposin fold revealed by the NMR structure of NK-lysin[J]. Nature Structural & Molecular Biology, 1997, 4(10): 793-795. |
| [5] |
ZHANG M, LI M F, SUN L. NKLP27: a teleost NK-lysin peptide that modulates immune response, induces degradation of bacterial DNA, and inhibits bacterial and viral infection[J]. PLoS One, 2014, 9(9): e106543. DOI:10.1371/journal.pone.0106543 |
| [6] |
PEREIRO P, ROMERO A, DÍAZ-ROSALES P, et al. Nucleated teleost erythrocytes play an Nk-lysin- and autophagy-dependent role in antiviral immunity[J]. Frontiers in Immunology, 2017, 8: 1458. DOI:10.3389/fimmu.2017.01458 |
| [7] |
JACOBS T, BRUHN H, GAWORSKI I, et al. NK-lysin and its shortened analog NK-2 exhibit potent activities against Trypanosoma cruzi[J]. Antimicrobial Agents and Chemotherapy, 2003, 47(2): 607-613. DOI:10.1128/AAC.47.2.607-613.2003 |
| [8] |
GELHAUS C, JACOBS T, ANDRÄ J, et al. The antimicrobial peptide NK-2, the core region of mammalian NK-lysin, kills intraerythrocytic Plasmodium falciparum[J]. Antimicrobial Agents and Chemotherapy, 2008, 52(5): 1713-1720. DOI:10.1128/AAC.01342-07 |
| [9] |
SHAN Z G, YANG Y P, GUAN N, et al. NKL-24: A novel antimicrobial peptide derived from zebrafish NK-lysin that inhibits bacterial growth and enhances resistance against Vibrio parahaemolyticus infection in Yesso scallop, Patinopecten yessoensis[J]. Fish & Shellfish Immunology, 2020, 106: 431-440. |
| [10] |
SCHRÖDER-BORM H, BAKALOVA R, ANDRÄ J. The NK-lysin derived peptide NK-2 preferentially kills cancer cells with increased surface levels of negatively charged phosphatidylserine[J]. FEBS Letters, 2005, 579(27): 6128-6134. DOI:10.1016/j.febslet.2005.09.084 |
| [11] |
FAN K H, LI H Q, WANG Z R, et al. Expression and purification of the recombinant porcine NK-lysin in Pichia pastoris and observation of anticancer activity in vitro[J]. Preparative Biochemistry & Biotechnology, 2016, 46(1): 65-70. |
| [12] |
ANDERSSON M, CURSTEDT T, JÖRNVALL H, et al. An amphipathic helical motif common to tumourolytic polypeptide NK-lysin and pulmonary surfactant polypeptide SP-B[J]. FEBS Letters, 1995, 362(3): 328-332. DOI:10.1016/0014-5793(95)00268-E |
| [13] |
WANG Q, BAO B L, WANG Y P, et al. Characterization of a NK-lysin antimicrobial peptide gene from channel catfish[J]. Fish & Shellfish Immunology, 2006, 20(3): 419-426. |
| [14] |
WANG Q, WANG Y P, XU P, et al. NK-lysin of channel catfish: gene triplication, sequence variation, and expression analysis[J]. Molecular Immunology, 2006, 43(10): 1676-1686. DOI:10.1016/j.molimm.2005.09.023 |
| [15] |
HIRONO I, KONDO H, KOYAMA T, et al. Characterization of Japanese flounder (Paralichthys olivaceus) NK-lysin, an antimicrobial peptide[J]. Fish & Shellfish Immunology, 2007, 22(5): 567-575. |
| [16] |
ZHANG M, LONG H, SUN L. A NK-lysin from Cynoglossus semilaevis enhances antimicrobial defense against bacterial and viral pathogens[J]. Developmental and Comparative Immunology, 2013, 40(3/4): 258-265. |
| [17] |
PEREIRO P, VARELA M, DIAZ-ROSALES P, et al. Zebrafish Nk-lysins: First insights about their cellular and functional diversification[J]. Developmental and Comparative Immunology, 2015, 51(1): 148-159. DOI:10.1016/j.dci.2015.03.009 |
| [18] |
詹柒凤, 丁祝进, 崔蕾, 等. 团头鲂NK-lysin基因鉴定和表达分析[J]. 水产学报, 2016, 40(8): 1145-1155. ZHAN Qifeng, DING Zhujin, CUI Lei, et al. Identification, characterization and expression of NK-lysin in Megalobrama amblycephala[J]. Journal of Fisheries of China, 2016, 40(8): 1145-1155. |
| [19] |
王改玲, 王明成, 李传凤, 等. 草鱼NK-lysin基因的克隆、原核表达与活性分析[J]. 水产学报, 2017, 41(10): 1500-1511. WANG Gailing, WANG Mingcheng, LI Chuanfeng, et al. The cDNA cloning, expression and antibacterial activity of NK-lysin from grass carp (Ctenopharyngodon idella)[J]. Journal of Fisheries of China, 2017, 41(10): 1500-1511. DOI:10.11964/jfc.20160910553 |
| [20] |
WANG G L, WANG M C, LIU Y L, et al. Identification, expression analysis, and antibacterial activity of NK-lysin from common carp Cyprinus carpio[J]. Fish & Shellfish Immunology, 2018, 73: 11-21. |
| [21] |
HUANG Y, ZHENG Q, NIU J Z, et al. NK-lysin from Oreochromis niloticus improves antimicrobial defence against bacterial pathogens[J]. Fish & Shellfish Immunology, 2018, 72: 259-265. |
| [22] |
LAMA R, PEREIRO P, COSTA M M, et al. Turbot(Scophthalmus maximus)Nk-lysin induces protection against the pathogenic parasite Philasterides dicentrarchi via membrane disruption[J]. Fish & Shellfish Immunology, 2018, 82: 190-199. |
| [23] |
HAN P P, TIAN G M, GAO W H, et al. Expression analysis of cathelicidin and NK-lysin in Dabry's sturgeon(Acipenser dabryanus)[J]. Journal of Applied Ichthyology, 2019, 35(4): 825-830. |
| [24] |
BO J, YANG Y, ZHENG R H, et al. Antimicrobial activity and mechanisms of multiple antimicrobial peptides isolated from rockfish Sebastiscus marmoratus[J]. Fish & Shellfish Immunology, 2019, 93: 1007-1017. |
| [25] |
ACOSTA J, ROA F, GONZÁLEZ-CHAVARRÍA I, et al. In vitro immunomodulatory activities of peptides derived from Salmo salar NK-lysin and cathelicidin in fish cells[J]. Fish & Shellfish Immunology, 2019, 88: 587-594. |
| [26] |
VALERO Y, CORTÉS J, MERCADO L. NK-lysin from skin-secreted mucus of Atlantic salmon and its potential role in bacteriostatic activity[J]. Fish & Shellfish Immunology, 2019, 87: 410-413. DOI:10.11964/jfc.20180411224 |
| [27] |
DING F F, LI C H, CHEN J. Molecular characterization of the NK-lysin in a teleost fish, Boleophthalmus pectinirostris: Antimicrobial activity and immunomodulatory activity on monocytes/macrophages[J]. Fish & Shellfish Immunology, 2019, 92: 256-264. |
| [28] |
ZHANG M, WANG Z G, WANG C G, et al. Identification and characterization of five Nk-lysins from Pseudocrossocheilus bamaensis and their diverse expression patterns in response to bacterial infection[J]. Fish & Shellfish Immunology, 2019, 94: 346-354. DOI:10.3969/j.issn.1004-2490.2019.03.010 |
| [29] |
LIU B, LIU G D, GUO H Y, et al. Functional characterization of NK-lysin in golden pompano Trachinotus ovatus(Linnaeus 1758)[J]. Developmental and Comparative Immunology, 2020, 107: 103658. DOI:10.1016/j.dci.2020.103658 |
| [30] |
ZHU R, WU Y S, LIU X X, et al. Membrane disruptive antimicrobial potential of NK-lysin from yellow catfish(Pelteobagrus fulvidraco)[J]. Fish & Shellfish Immunology, 2020, 97: 571-580. DOI:10.3969/j.issn.1004-2490.2020.05.007 |
| [31] |
VALERO Y, CHAVES-POZO E, CUESTA A. NK-lysin is highly conserved in European sea bass and gilthead seabream but differentially modulated during the immune response[J]. Fish & Shellfish Immunology, 2020, 99: 435-441. DOI:10.3969/j.issn.1004-2490.2020.04.007 |
| [32] |
VALERO Y, ARIZCUN M, CORTÉS J, et al. NK-lysin, dicentracin and hepcidin antimicrobial peptides in European sea bass. Ontogenetic development and modulation in juveniles by nodavirus[J]. Developmental and Comparative Immunology, 2020, 103: 103516. DOI:10.1016/j.dci.2019.103516 |
| [33] |
ZHOU Q J, WANG J, LIU M, et al. Identification, expression and antibacterial activities of an antimicrobial peptide NK-lysin from a marine fish Larimichthys crocea[J]. Fish & Shellfish Immunology, 2016, 55: 195-202. |
| [34] |
ZHOU Q J, WANG J, MAO Y, et al. Molecular structure, expression and antibacterial characterization of a novel antimicrobial peptide NK-lysin from the large yellow croaker Larimichthys crocea[J]. Aquaculture, 2019, 500: 315-321. DOI:10.1016/j.aquaculture.2018.10.012 |
| [35] |
NIU S F, JIN Y, XU X, et al. Characterization of a novel piscidin-like antimicrobial peptide from Pseudosciaena crocea and its immune response to Cryptocaryon irritans[J]. Fish & Shellfish Immunology, 2013, 35(2): 513-524. |
| [36] |
WANG K J, CAI J J, CAI L, et al. Cloning and expression of a hepcidin gene from a marine fish(Pseudosciaena crocea)and the antimicrobial activity of its synthetic peptide[J]. Peptides, 2009, 30(4): 638-646. DOI:10.1016/j.peptides.2008.12.014 |
| [37] |
ANDERSSON M, HOLMGREN A, SPYROU G. NK-lysin, a disulfide-containing effector peptide of T-lymphocytes, is reduced and inactivated by human thioredoxin reductase. Implication for a protective mechanism against NK-lysin cytotoxicity[J]. Journal of Biological Chemistry, 1996, 271(17): 10116-10120. DOI:10.1074/jbc.271.17.10116 |
| [38] |
OLMEDA B, GARCÍA-ÁLVAREZ B, PÉREZ-GIL J. Structure-function correlations of pulmonary surfactant protein SP-B and the saposin-like family of proteins[J]. European Biophysics Journal, 2013, 42(2/3): 209-222. |
 2023, Vol. 47
2023, Vol. 47


