
文章信息
- 刘瑀, 陆超, 焦点, 刘宇馨, 王国光. 2023.
- LIU Yu, LU Chao, JIAO Dian, LIU Yu-xin, WANG Guo-guang. 2023.
- 低磷胁迫下翅碱蓬生长特性及脂肪酸含量的变化机制
- Effects of low phosphorus conditions on the growth characteristics and fatty acid content of Suaeda heteroptera Kitagawa
- 海洋科学, 47(4): 117-125
- Marine Sciences, 47(4): 117-125.
- http://dx.doi.org/10.11759/hykx20201113001
-
文章历史
- 收稿日期:2020-11-13
- 修回日期:2021-01-20
辽河口湿地位于辽河三角洲的最南方, 是多个河流支流的重要汇集地, 其特殊的地理位置形成了淡水沼泽、盐沼、沙滩和潮间泥滩等[1-2], 也赋予辽河口湿地多种生态功能, 如调节气候, 降解污染物, 固碳固氮等。2014年全国第二次湿地资源调查结果显示辽河口湿地面积192.20万公顷[3], 占全国自然湿地面积的4.12%。近年来, 虽然受保护的湿地面积增加, 但自然湿地面积依旧减少了9.33%[3]。污染、过度捕捞和采集、围垦、外来物种入侵和基建占用是导致自然湿地退化严重的主要原因[3-4]。翅碱蓬(Suaeda heteroptera)是隶属于藜科碱蓬属[5]的一年生双子叶草本植物, 是辽河口湿地的优势物种; 在污染控制、防浪减灾等多方面均发挥重要的作用[6]。湿地生态系统失衡导致翅碱蓬的生长环境恶化, 植被退化, 已对湿地系统造成了不良影响。
中国大部分土壤处于磷缺乏水平, 农业上主要采取施肥来缓解低磷所带来的危害, 每年施加的磷肥仅有6%能够转化为有效磷被作物吸收利用[7]。翅碱蓬不属于农业植物, 故并未有人对其产生过多关注。测定发现盘锦辽河口湿地土壤无机磷含量在8~15 mg·kg–1范围内, 处于磷缺乏水平[8], 且翅碱蓬生长区域无机磷水平要高于其他潮间带区域。磷是植物体内细胞核、ATP(腺嘌呤核苷三磷酸)及脂肪酸等重要化合物的构成部分, 直接影响植物光合效率及糖、蛋白质和脂肪的形成与代谢[9-10]。低磷导致植物生长发育迟缓、器官组织脱落、成熟延迟、植株保护酶系统活性升高及膜脂的过氧化等[11-12], 严重时会导致植株死亡。目前针对翅碱蓬的研究多聚焦在重金属[13-14]、溢油[15]及除草剂[16]等人为因素对其生长的影响上, 并未聚焦在天然低磷条件对翅碱蓬生长的影响。所以采用室内盆栽实验, 通过研究低磷条件对翅碱蓬生理生长特性及脂肪酸含量等指标的影响, 分析翅碱蓬植被退化与磷含量的关系, 以为盘锦辽河口湿地修复及翅碱蓬保护提供科学依据。
1 材料与方法 1.1 材料实验所用翅碱蓬种子采自盘锦红海滩保护区, 风干后在实验室保存。种植土壤为大连花鸟市场购买的黑土。营养液为实验室配置的不同磷浓度Hoagland营养液(pH = 6.0)。
1.2 前处理土壤晒干, 过10目分级筛; 部分于高温灭菌锅中121 ℃灭菌20 min, 烘干备用, 其余土壤不做灭菌处理。种植前一天, 用0.25%的高锰酸钾溶液浸泡翅碱蓬种子30 min, 后用流动水反复冲洗, 再用纯水冲洗1~2次, 沥去多余水分后平铺于托盘中置于阴凉处备用。
1.3 培养条件实验分为两组, 一组为正常土壤组(USS), 另一组为灭菌土壤组(SS); 正常土壤组处理皆用自来水, 灭菌土壤组处理皆用纯水。在直径16 cm的塑料花盆底部铺上保鲜膜防止水土过快流失, 花盆中放入土壤0.6 kg, 倒入400 mL水混匀, 使土壤完全浸湿后铺平土壤表面。称取处理好的种子5 g, 均匀平铺于土壤上, 种子表层覆盖厚度约为0.1~0.2 mm的土壤。植株置于室外棚内培养, 隔天浇水。一个月后待植株生长情况大概一致时, 进行低磷浓度处理; 分为5个浓度处理组, 分别为P1(1.00 mmol·L–1)、P0.75(0.75 mmol·L–1)、P0.5(0.50 mmol·L–1)、P0.25(0.25 mmol·L–1)和P0.01(0.01 mmol·L–1), 每处理组内设置3组平行。每两周处理组施加不同磷浓度的Hoagland营养液240 mL, 生长60 d后将所有处理组植株完整取出, 收集植物根际土壤。
1.4 实验指标的测定 1.4.1 翅碱蓬生长指标的测定收获后测定翅碱蓬植株的株高、茎粗、茎长、主根根长及叶片数量; 用烘干法测定植株含水率。
1.4.2 翅碱蓬生理指标的测定参考明东风[17]及李合生[18]的方法, 测定翅碱蓬叶片叶绿素及丙二醛(MDA)含量。
1.4.3 翅碱蓬无机磷酸盐吸收率的测定采用碳酸氢钠浸提–钼锑抗比色法测定土壤无机磷酸盐含量。无机磷吸收率(S)计算公式如下:
A为种植前土壤无机磷本底值; B为不同浓度组施加无机磷含量; C为收获后土壤无机磷含量。
1.4.4 翅碱蓬叶片、茎与根部脂肪酸的测定将翅碱蓬根、茎、叶分离后用冷冻干燥机干燥, 研磨成粉末过100目分级筛, 并于-20 ℃下冷冻保存。分别称取50 mg, 加入7 mL二氯甲烷-甲醇溶液[19], 于37 ℃超声处理30 min。过夜提取、离心, 收集氯仿层[20-21]。氮吹获得总脂质后, 加入2 mL硫酸-甲醇溶液[22-23], 70 ℃水浴60 min。冷却至室温, 加入2 mL正己烷, 提取振荡静置分层后的上清液于上样瓶中, 上机分析[24]。气相色谱–质谱联用仪气相色谱条件[25]: DB-5色谱柱; 氦气作为载气, 气流速度为1.2 mL·min–1。升温程序: 初始温度70 ℃, 保持1 min, 然后以8 ℃·min–1升至170 ℃, 保持6 min, 最后以4 ℃·min–1升至280 ℃, 保持10 min。质谱条件: 传输线温度250 ℃, 离子源温度230 ℃。
1.5 数据处理数据整理与画图采用Excel 2010, 数据统计分析采用SPSS 22.0。
2 结果与讨论 2.1 低磷对翅碱蓬植株生长指标的影响由图 1可知, 翅碱蓬的株高、茎长、叶片数量和株重与磷浓度显著正相关(P < 0.05), 在P0.01处理组达最低值。USSP0.01处理组与P1.00组相比, 株高、茎长、茎粗、叶片数量、株重降低了36.25%、24.80%、27.77%、27.61%、62.24%; SS组则分别降低了47.31%、49.60%、18.80%、71.63%、74.92%。而翅碱蓬主根长除P0.01处理组外皆随着磷浓度的减小而升高, 证明磷浓度的减小促进了植物根系的伸长, 类似现象在对杉木[26]的研究中也有发现。因极度低磷条件抑制了翅碱蓬正常生长, 所以P0.01处理组根长出现下降。
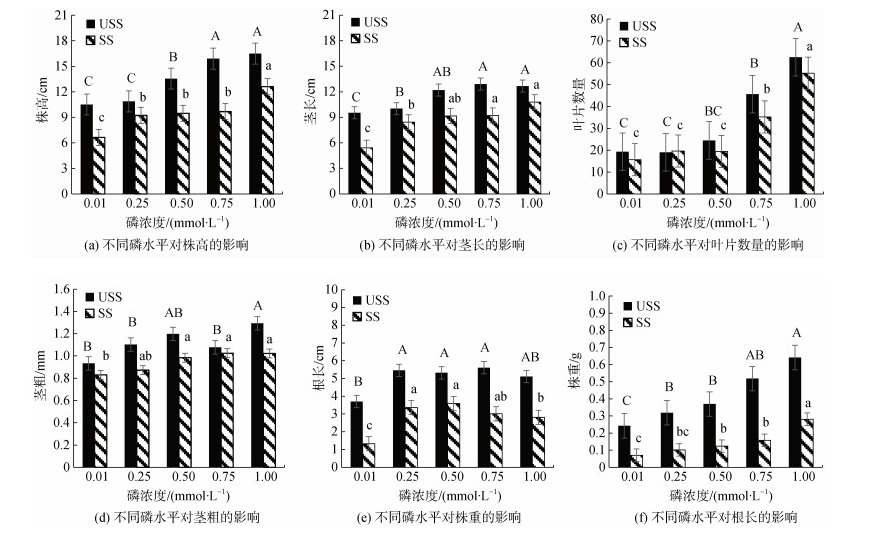 |
| 图 1 不同磷水平对翅碱蓬株高、茎长、叶片数量、茎粗、株重及根长的影响 Fig. 1 Effects of plant height, stem length, number of leaves, stem thickness, plant weight, and root length of Suaeda pentaphylla under different phosphorus levels *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
由图 2可知, USS组含水率曲线趋于平缓, SS组含水率随着磷浓度的升高翅碱蓬含水率逐渐升高, 但普遍低于USS组; P0.01处理组与P1.00处理组含水率相差11.71%。由图 3可知, 翅碱蓬植株干重随P浓度升高而先升高后降低又升高。
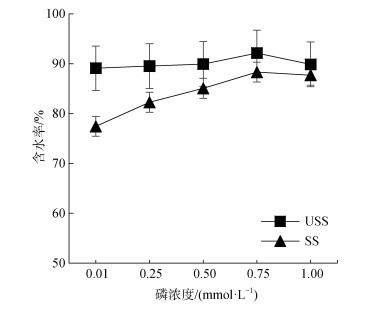 |
| 图 2 不同磷水平对翅碱蓬含水率的影响 Fig. 2 Effects of different phosphorus levels on the water content of Suaeda pentaphylla *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
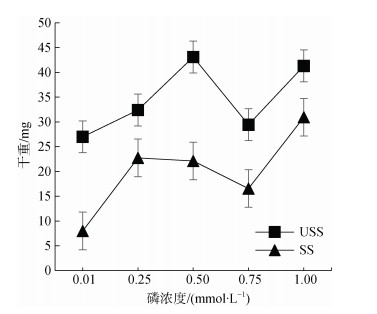 |
| 图 3 不同磷水平对翅碱蓬干重的影响 Fig. 3 Effects of different phosphorus levels on the dry weight of Suaeda pentaphylla *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
由图 4可知, 相同处理下, SS组叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均高于USS组; P1.00组色素含量均显著高于其他磷处理组(P < 0.05)。从总体趋势来看, 叶绿素a、叶绿素b、总叶绿素含量降低再升高。类胡萝卜素对磷含量变化尤其敏感, P0.01处理组相对于P1.00处理组含量下降45.48%。
 |
| 图 4 不同磷水平对翅碱蓬叶绿素含量的影响 Fig. 4 Effects of different phosphorus levels on the chlorophyll content of Suaeda pterocarpus *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
丙二醛(MDA)是脂质过氧化的产物[27], 能作为度量膜脂损伤程度的指标[28]。所以, 植株体内丙二醛含量的变化能反映其抗逆性[29]。由图 5可知, 丙二醛与磷浓度显著负相关(USS组, P < 0.05; SS组, P < 0.01)。SS组丙二醛含量显著高于USS组, 高达5.30倍。在不同P浓度处理下, 最高值均出现在P0.01组, 分别为P1.00组的2.92倍(USS组)和1.94倍(SS组)。
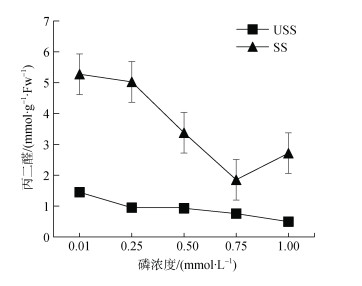 |
| 图 5 不同磷水平对翅碱蓬丙二醛含量的影响 Fig. 5 Effects of different phosphorus levels on the malondialdehyde content of Suaeda pterocarpus *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
本实验对不同施磷水平下翅碱蓬土壤的磷吸收效率进行了分析。结果发现, 土壤的磷吸收效率与施磷浓度显著正相关(P < 0.05)。值得注意的是正常土壤组0.01 mmol·L–1处理组吸收效率出现负值。主要是因为在长期进化过程中, 植物为适应低磷环境, 故形成了一系列自我应对机制[30], 如植物根系会分泌磷酸水解酶、有机酸[31-35]等物质进入到土壤, 与土壤微生物相互作用, 释放出无机磷酸盐供植被等利用; 而当植物水解磷量大于吸收量时, 会导致吸收率出现负值。
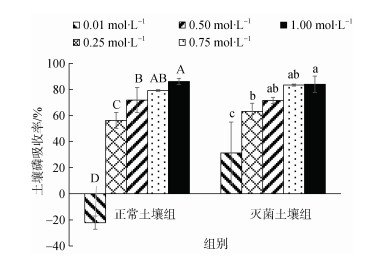 |
| 图 6 不同施磷水平下翅碱蓬无机磷酸盐(Pi)的吸收效率 Fig. 6 Absorption efficiency of Suaeda pentaphyllum inorganic phosphate(Pi)at different levels of phosphorus application *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
由表 1可知, 翅碱蓬叶片含有9种脂肪酸, 多为中长、超长链饱和脂肪酸(SFAs), 不饱和脂肪酸(UFAs)集中在中长链。由图 7可知, 翅碱蓬叶片优势脂肪酸为反式油酸(C18:1n9t)和棕榈酸(C16:0), C18:1n9t相对含量达50%以上。翅碱蓬叶片脂肪酸含量排序为: 反式油酸 > 棕榈酸 > 亚麻酸 > 油酸 > 硬脂酸 > 二十四碳酸 > 二十二碳酸 > 肉豆蔻酸 > 花生酸。C16:0与C18: 1n9t变化则趋势相反, 故C16:0减少了向C18:1n9t的转化。C18:3n6随施磷浓度的降低呈现降低的趋势, 而C14:0和C18:0上升。这是因为在植物受到外界胁迫时, 光合作用受到限制, 植物会优先选择耗能低的物质进行合成储存, 长链脂肪酸相比短链脂肪酸需多进行一轮碳链延长, 耗能较高, 所以植物会提高短链脂肪酸的合成。C22:0、C24:0略微上升但变化不明显; C18:1n9c含量基本保持不变。
| 序号 | 脂肪酸名称 | 结构式 | ||
| 根 | 茎 | 叶片 | ||
| 1 | 肉豆蔻酸 | — | 肉豆蔻酸 | C14:0 |
| 2 | 棕榈酸 | 棕榈酸 | 棕榈酸 | C16:0 |
| 3 | –亚麻酸 | –亚麻酸 | –亚麻酸 | C18:3n6 |
| 4 | 反式亚油酸 | — | — | C18:2n6t |
| 5 | 油酸 | 油酸 | 油酸 | C18:1n9c |
| 6 | 反式油酸 | 反式油酸 | 反式油酸 | C18:1n9t |
| 7 | 硬脂酸 | 硬脂酸 | 硬脂酸 | C18:0 |
| 8 | 花生酸 | — | 花生酸 | C20:0 |
| 9 | 二十二碳酸 | — | 二十二碳酸 | C22:0 |
| 10 | 二十四碳酸 | — | 二十四碳酸 | C24:0 |
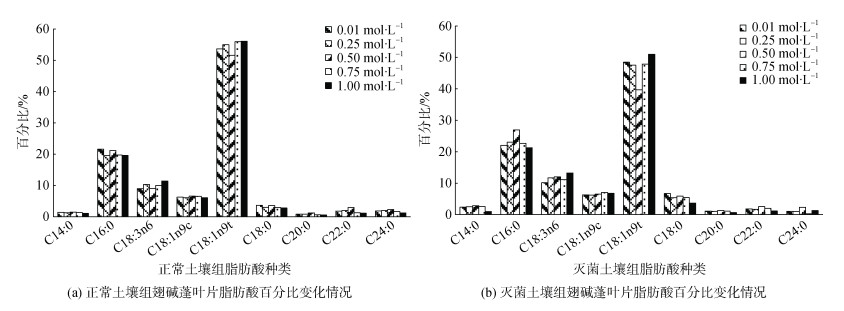 |
| 图 7 不同磷水平对翅碱蓬叶片脂肪酸百分比的影响 Fig. 7 Effects of different phosphorus levels on the fatty acid percentage of Suaeda heteroptera leaves *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
翅碱蓬茎部脂肪酸种类如表 1所示, 多为中长链脂肪酸。由图 8可知, 其优势脂肪酸为棕榈酸(C16:0)和反式油酸(C18:1n9t), 正常土壤组与灭菌土壤组两处理组中其相对含量分别高达76.75%、80.64%和14.80%、11.48%; 其他脂肪酸含量依次为棕榈酸 > 反式亚油酸 > 油酸 > γ-亚麻酸 > 硬脂酸。两处理组脂肪酸相对含量无太大差异, 在不同磷浓度处理下, C16: 0随着浓度降低有小幅度的升高, C18: 1n9t随磷浓度的降低而小幅度地降低。
 |
| 图 8 不同磷水平对翅碱蓬茎肪酸百分比的影响 Fig. 8 Effects of different phosphorus levels on the fatty acid percentage of Suaeda heteroptera stems *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
由图 9可知, 正常土壤组根部优势脂肪酸为棕榈酸(C16:0)和反式亚油酸(C18:2n6t), 棕榈酸相对含量高达30.72%。其他脂肪酸含量依次为棕榈酸 > 反式亚油酸 > 硬脂酸 > 二十二碳酸 > 二十四碳酸 > 油酸 > 肉豆蔻酸 > 花生酸 > γ-亚麻酸 > 反式油酸。灭菌土壤组组根部优势脂肪酸为反式亚油酸和棕榈酸, 其他脂肪酸含量排序与USS组相同, 其中反式亚油酸相对含量高达27.46%。由图可看出, C16:0, C18:0, C20:0, C22:0, C24:0随着磷浓度的增加均呈现一定程度的增加; 仅C18:2n6t, C18:1n9c随着磷浓度的增加均呈现一定程度的降低。C14:0和C20:0的变化则不明显。
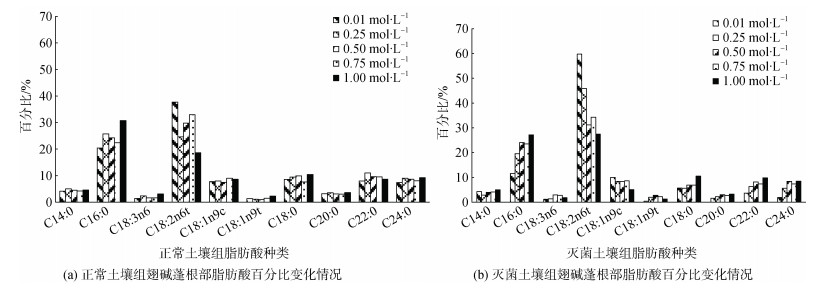 |
| 图 9 不同磷水平对翅碱蓬根部肪酸百分比的影响 Fig. 9 Effects of different phosphorus levels on the percentage of fatty acids in the roots of Suaeda heteroptera *注: 不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著 |
本研究发现翅碱蓬对低磷胁迫有明显的生理生长响应。低磷会使翅碱蓬株高、茎长、叶片数量、株重显著降低, 叶绿素a、叶绿素b及总叶绿素含量减少、类胡萝卜素变化尤其明显。低磷胁迫下翅碱蓬代谢紊乱, MDA含量显著增加, 脂质过氧化程度加重, 不同组织脂肪酸组成也存在差异。随着施磷浓度的升高, 叶片中多不饱和脂肪酸相对含量升高, 中长链脂肪酸相对含量降低, 茎中脂肪酸含量无明显变化。说明低磷迫使植物优先合成耗能低的能源物质来维持自身能量的循环与储备, 从而减少磷的消耗。此外, 土壤微生物对翅碱蓬生长也存在很大影响, 灭菌组植株生长迟缓, 株高等指标显著低于同等磷浓度处理的未灭菌组。
本实验通过对翅碱蓬生长指标、光合色素、丙二醛及不同组织脂肪酸含量变化的研究, 研究了低磷条件对翅碱蓬生理生长的影响, 发现低磷条件会影响翅碱蓬生长发育。针对低磷对翅碱蓬植被造成的负面影响, 可以通过在翅碱蓬退化区施加定量的含磷肥料或添加一定量的微生物来解决。添加磷肥在一定程度上可以促进翅碱蓬的生长, 但施肥量不能很好地控制, 存在污染近海域的风险, 所以要慎重施肥。而植物吸收土壤中磷元素时通常都在解磷微生物的帮助下进行, 所以可以在翅碱蓬退化区添加一定量的解磷微生物来提高土壤中的磷转移效率, 促进翅碱蓬植株的生长发育。相比之下我们更加倾向于施加微生物这种既清洁又简便的方法。从而达到保护湿地植物翅碱蓬及湿地修复的目的。
| [1] |
安鑫龙, 齐遵利, 李雪梅, 等. 中国海岸带研究Ⅲ——滨海湿地研究[J]. 安徽农业科学, 2009, 37(4): 1712-1713. AN Xinlong, QI Zunli, LI Xuemei, et al. Research on China coastal zones Ⅲ[J]. Journal of Anhui Agricultural Sciences, 2009, 37(4): 1712-1713. DOI:10.3969/j.issn.0517-6611.2009.04.125 |
| [2] |
何文珊. 中国滨海湿地[M]. 北京: 中国林业出版社, 2008. HE Wenshan. China coastal wetlands[M]. Beijing: China Forestry Press, 2008. |
| [3] |
第二次全国湿地资源调查结果公布[J]. 湿地科学与管理, 2014, 10(1): 65. Results of the second national wetland resource survey announced[J]. Wetland Science & Management, 2014, 10(1): 65. |
| [4] |
孟泰舟. 关于实施盘锦滨海湿地保护工程建设的建议[J]. 现代农业, 2020(6): 84. MENG Taizhou. Suggestions on the construction of Panjin coastal wetland protection project[J]. Modern Agriculture, 2020(6): 84. DOI:10.14070/j.cnki.15-1098.2020.06.063 |
| [5] |
田锐, 于子超, 李作扬, 等. 辽宁盘锦三角洲翅碱蓬根系及内生细菌群落多样性[J]. 微生物学通报, 2016, 43(7): 1462-1472. TIAN Rui, YU Zichao, LI Zuoyang, et al. Diversity of endophytic and rhizospheric bacteria of Suaeda heteroptera kitag from Panjin delta in Liaoning province[J]. Microbiology China, 2016, 43(7): 1462-1472. DOI:10.13344/j.microbiol.china.150538 |
| [6] |
孙圳. 辽河口湿地翅碱蓬植被年际变化及其影响因素的相关性研究[D]. 大连: 大连海洋大学, 2018. SUN Zhen. Interannual variations of Suaeda pentaphylla vegetation and correlation of influencing factors in wetland of Liaohe estuary[D]. Dalian: Dalian Ocean University, 2018. |
| [7] |
鲁如坤. 土壤磷素水平和水体环境保护[J]. 磷肥与复肥, 2003, 18(1): 4-8. LU Rukun. The phosphorus level of soil and environmental protection of water body[J]. Phosphate & Compound Fertilizer, 2003, 18(1): 4-8. DOI:10.3969/j.issn.1007-6220.2003.01.002 |
| [8] |
蔡露明, 华明, 许伟伟, 等. 江苏金坛西部农用地土壤中磷元素地球化学特征[J]. 地质学刊, 2020, 44(Z1): 198-203. CAI Luming, HUA Ming, XU Weiwei, et al. Geochemical characteristics of phosphorus in agricultural soil in western Jintan, Jiangsu province[J]. Journal of Geology, 2020, 44(Z1): 198-203. |
| [9] |
陈健晓, 王小娟, 屠乃美, 等. 磷水平对不同香稻品种苗期形态生理的影响[J]. 华北农学报, 2020, 35(2): 117-125. CHEN Jianxiao, WANG Xiaojuan, TU Naimei, et al. Effects of different concentration of phosphorus nutrient on morphophysiology of different scented rice varieties at the seedling stage[J]. Acta Agriculturae Boreali-Sinica, 2020, 35(2): 117-125. |
| [10] |
MORI A, FUKUDA T, VEJCHASARN P, et al. The role of root size versus root efficiency in phosphorus acquisition in rice[J]. Journal of Experimental Botany, 2016, 67(4): 1179-1189. DOI:10.1093/jxb/erv557 |
| [11] |
王剑, 周志春, 饶龙兵, 等. 不同磷效率马褂木种源对磷胁迫的生理反应[J]. 林业科学研究, 2006, 19(4): 527-531. WANG Jian, ZHOU Zhichun, RAO Longbing, et al. Hysiological response of Liriodendron chinense provenances with different phosphorus efficiency under low phosphorus stress[J]. Forest Research, 2006, 19(4): 527-531. DOI:10.3321/j.issn:1001-1498.2006.04.023 |
| [12] |
陈雯彬, 欧阳泽怡, 欧阳硕龙, 等. 低磷胁迫对植物生长及生理特性影响的研究进展[J]. 湖南林业科技, 2020, 47(3): 132-136. CHEN Wenbin, OUYANG Zeyi, OUYANG Shuolong, et al. Research progress on effects of low phosphorus stress on plant growth and physiological characteristics[J]. Hunan Forestry Science & Technology, 2020, 47(3): 132-136. DOI:10.3969/j.issn.1003-5710.2020.03.024 |
| [13] |
赵玥茹, 蔡恒江, 张靖凡, 等. Cu2+和Zn2+对翅碱蓬种子萌发及幼苗渗透调节物质的影响[J]. 安徽农业科学, 2019, 47(15): 45-47. ZHAO Yueru, CAI Hengjiang, ZHANG Jingfan, et al. Effects of Cu2+and Zn2+on seed germination, osmotic adjustment substances in seedling of Suaeda hetroptera Kitagawa[J]. Journal of Anhui Agricultural Sciences, 2019, 47(15): 45-47. DOI:10.3969/j.issn.0517-6611.2019.15.014 |
| [14] |
苏芳莉, 孙旭, 孙权, 等. 湿地翅碱蓬生长及渗透调节物质对盐度的响应[J]. 生态学杂志, 2018, 37(7): 1997-2002. SUN Fangli, SUN Xu, SUN Quan, et al. Responses of growth and osmoregulatory substances of Suaeda heteroptera to salt concentrations in wetlands[J]. Chinese Journal of Ecology, 2018, 37(7): 1997-2002. |
| [15] |
李志杰, 郭长城, 石杰, 等. 高通量测序解析多环芳烃污染盐碱土壤翅碱蓬根际微生物群落多样性[J]. 微生物学通报, 2017, 44(7): 1602-1612. LI Zhijie, GUO Changcheng, SHI Jie, et al. Diversity of bacterial community in Suaeda roots rhizosphere growth in PAHs-contaminated saline soil estimated by high throughput sequencing method[J]. Microbiology China, 2017, 44(7): 1602-1612. |
| [16] |
赵雨朦, 魏海峰, 马晴晴, 等. 烟嘧磺隆对翅碱蓬生理代谢的影响研究[J]. 环境生态学, 2019, 1(6): 8-12. ZHAO Yumeng, WEI Haifeng, MA Qingqing, et al. Effect of nicosulfuron on physiological metabolism of Suaeda heterptera[J]. Environmental Ecology, 2019, 1(6): 8-12. |
| [17] |
明东风. 硅对水分胁迫下水稻生理生化特性、亚显微结构及相关基因表达的调控机制研究[D]. 杭州: 浙江大学, 2012. MING Dongfeng. Study on the regulation mechanism of silicon on the physiological and biochemical characteristics, submicroscopic structure and related gene expression of rice under water stress[D]. Hangzhou: Zhejiang University, 2012. |
| [18] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. LI Hesheng. Principles and techniques of plant physiology and biochemistry experiments[M]. Beijing: Higher Education Press, 2000. |
| [19] |
韩菊, 段文仲. 二氯甲烷代替氯仿提取脂肪的可行性研究[J]. 分析化学, 1998, 26(9): 1164. HAN Ju, DUAN Wenzhong. Study on the feasibility of dichloromethane instead of chloroform to extract fat[J]. Chinese Journal of Analytical Chemistry, 1998, 26(9): 1164. DOI:10.3321/j.issn:0253-3820.1998.09.037 |
| [20] |
楼乔明, 王玉明, 刘小芳, 等. 南极磷虾脂肪酸组成及多不饱和脂肪酸质谱特征分析[J]. 中国水产科学, 2011, 18(4): 929-935. LOU Qiaoming, WANG Yuming, LIU Xiaofang, et al. Analysis of fatty acid composition and mass spectrometry characterization of polyunsaturated fatty acids in Euphausua superba[J]. Journal of Fishery Sciences of China, 2011, 18(4): 929-935. |
| [21] |
YAO J, LIU Y, LIU Y, et al. Effects of pretreatment procedures on fatty acid composition and stable carbon isotopes in the marine microalga Isochrysis zhanjiangenisis[J]. Acta Oceanologica Sinica, 2016, 35(6): 1-6. |
| [22] |
寇秀颖, 于国萍. 脂肪和脂肪酸甲酯化方法的研究[J]. 食品研究与开发, 2005, 26(2): 46-47. DOU Xiuying, YU Guoping. Study on the method of fat and fatty acid methyl esterification[J]. Food Research and Development, 2005, 26(2): 46-47. |
| [23] |
伍新龄, 王凤玲, 关文强. 植物油脂肪酸甲酯化方法比较与含量测定[J]. 食品研究与开发, 2015, 36(7): 84-87. WU Xinling, WANG Fengling, GUAN Wenqiang. Methods of methyl esterification and gas chromatography analysis of fatty acids in edible vegetable oil[J]. Food Research and Development, 2015, 36(7): 84-87. |
| [24] |
刘瑀, 姚敬元, 李颖, 等. 预处理方法对海洋微藻脂肪酸萃取量及其碳稳定同位素组成的影响[J]. 海洋环境科学, 2015, 34(3): 457-461. LIU Yu, YAO Jingyuan, LI Ying, et al. Effects of pretreatment methods on the extraction amount and the stable carbon isotopic composition of marine microalgae fatty acid[J]. Marine Environmental Science, 2015, 34(3): 457-461. |
| [25] |
张旭峰. 海洋底栖动物稳定同位素和脂肪酸组成的地域性差异研究[D]. 大连: 大连海事大学, 2017. ZHANG Xufeng. Study on the regional differences of stable isotope and fatty acid composition of marine benthos[D]. Dalian: Dalian Maritime University, 2017. |
| [26] |
韦如萍, 胡德活, 晏姝, 等. 不同供磷浓度对杉木苗根系和盆栽土壤的影响[J]. 华南农业大学学报, 2016, 37(6): 77-83. WEI Ruping, HU Dehuo, YAN Shu, et al. Effect of phosphorus concentration on Cunninghamia lanceolate seedling roots and potting soil[J]. Journal of South China Agricultural University, 2016, 37(6): 77-83. |
| [27] |
韩多红, 李善家, 王恩军, 等. 外源钙对盐胁迫下黑果枸杞种子萌发和幼苗生理特性的影响[J]. 中国中药杂志, 2014, 39(1): 34-39. HAN Duohong, LI Shanjia, WANG Enjun, et al. Effect of exogenous calcium on seed germination and seedling physiological characteristics of Lycium ruthenium[J]. China Journal of Chinese Materia Medica, 2014, 39(1): 34-39. |
| [28] |
艾如波, 徐彩瑶, 吴承祯, 等. 低磷胁迫下内生真菌对宿主杉木幼苗生理生化的影响[J]. 贵州农业科学, 2020, 48(1): 108-113. AI Rubo, XU Caiyao, WU Chengzhen, et al. Effects of endophytic fungi on physiological and biochemical properties of host cunninghamia lanceolata saplings under low phosphorus stress[J]. Guizhou Agricultural Sciences, 2020, 48(1): 108-113. |
| [29] |
高福元, 张吉立, 刘振平, 等. 持续低温胁迫对园林树木电导率和丙二醛含量的影响[J]. 山东农业科学, 2010(2): 47-49, 81. GAO Fuyuan, ZHANG Jili, LIU Zhenping, et al. Effects of continuous low temperature stress on electrical conductivity and malondialdehyde content of garden trees[J]. Shandong Agricultural Sciences, 2010(2): 47-49, 81. |
| [30] |
田江, 梁翠月, 陆星, 等. 根系分泌物调控植物适应低磷胁迫的机制[J]. 华南农业大学学报, 2019, 40(5): 175-185. TIAN Jiang, LIANG Cuiyue, LU Xing, et al. Mechanism of root exudates regulating plant adaptation to low phosphorus stress[J]. Journal of South China Agricultural University, 2019, 40(5): 175-185. |
| [31] |
TZYY J C, SHU I L. Signaling network in sensing phosphate availability in plants[J]. Annual Review Plant Biology, 2011, 62: 185-206. |
| [32] |
LING C Y, WANG J X, ZHAO J, et al. Control of phosphate homeostasis through gene regulation in crops[J]. Current Opinion in Plant Biology, 2014, 21(14): 59-66. |
| [33] |
GUTIÉRREZ-ALANÍS D, OJEDA-RIVERA, J O, YONG-VILLALOBOS L, et al. Adaptation to phosphate scarcity: Tips from Arabidopsis roots[J]. Trends in Plant Science, 2018, 23(8): 721-730. |
| [34] |
HAM B, CHEN J Y, YAN Y, et al. Insights into plant phosphate sensing and signaling[J]. Currrent Opinion Biotechnoogyl, 2018, 49: 1-9. |
| [35] |
SHAHZAD Z, AMTMANN A. Food for thought: How nutrients regulate root system architecture[J]. Current Opinion Plant Biology, 2017, 39: 80-87. |
 2023, Vol. 47
2023, Vol. 47

