
文章信息
- 史存卓, 程学文, 刘鹰, 王秀利, 庞洪帅, 刘奇, 田野, 熊玉宇. 2023.
- SHI Cun-zhuo, CHENG Xue-wen, LIU Ying, WANG Xiu-li, PANG Hong-shuai, LIU Qi, TIAN Ye, XIONG Yu-yu. 2023.
- 光照周期对红鳍东方鲀雌鱼繁殖调控的初步研究
- Preliminary study on photoperiod regulation of reproduction in female tiger puffer Takifugu rubripes
- 海洋科学, 47(4): 137-144
- Marine Sciences, 47(4): 137-144.
- http://dx.doi.org/10.11759/hykx20220809001
-
文章历史
- 收稿日期:2022-08-09
- 修回日期:2022-11-29
2. 设施渔业教育部重点实验室(大连海洋大学), 辽宁 大连 116023;
3. 大连海洋大学 海洋科技与环境学院, 辽宁 大连 116023;
4. 大连海洋大学 信息工程学院, 辽宁 大连 116023;
5. 浙江大学 生物系统工程与食品科学学院, 浙江 杭州 310058
2. Key Laboratory of Environment Controlled Aquaculture(Dalian Ocean University), Ministry of Education, Dalian 116023, China;
3. College of Marine Technology and Environment, Dalian Ocean University, Dalian 116023, China;
4. College of Information Engineering, Dalian Ocean University, Dalian 116023, China;
5. College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China
鱼类的繁殖时间与环境因子年变化节律相适应, 具有季节性[1]。光周期及其季节变化与地球的自转和公转有关, 是最可预测的环境信号之一, 能够被大多数温带鱼类利用[2]。在诸多环境因素中, 最有可能决定鱼类繁殖时间的直接信号是光照时间的季节变化模式[1]。光周期季节变化幅度随纬度升高而增大[3]。大多数温带鱼类属于分批同步产卵类型[4], 一年繁殖一次, 繁殖时间集中在春末夏初或者秋末冬初。鱼类的性腺发育对光周期的响应与其发育阶段有关, 且具有物种特异性。大量研究表明, 光周期调控是促进或延迟养殖鱼类性腺发育的有效工具, 延长或者缩短光照时间能够调控亲鱼成熟产卵时间。理论上, 光周期调控包括光周期季节节律的时相迁移和速率改变。时相迁移是指时相整体前移或者后移一段时间。PAVLIDIS等[5]将光周期季节变化进行3个月的前移和后移, 将细点牙鲷(Dentex dentex)的产卵时间提前4个月或推迟2个月。速率改变是指季节变化周期缩短或者延长。NORBERG等[6]将大西洋鳕(Gadus morhua)置于缩短6个月或延长18个月的光周期季节变化下, 产卵时间相应地发生了明显的提前、延后。生产中, 鱼类繁殖周期的调控可以根据物种的繁殖生物学特征、发育时期灵活地采用时相迁移或者速率改变光周期调控方法。
东方鲀属(Takifugu)鱼类是隶属于鲀形目(Tetraodontiformes)鱼类的一个区域性分布类群, 具有较高经济价值[7]。而红鳍东方鲀是其中最名贵的一种, 主要分布于北日本、朝鲜半岛和中国沿海, 是中国北方沿海地区重要的出口水产品[8]。红鳍东方鲀属于一次性产卵鱼类, 卵巢发育为部分同步发育型[9], 繁殖期为每年的3—5月[10]。雷霁霖等[11]于1990年5月中旬, 在山东省南部沿海, 从围网作业船上收购到红鳍东方鲀亲鱼, 成功开展了繁育试验, 为工厂化育苗技术突破奠定了基础。由于天然亲鱼资源日渐减少, 红鳍东方鲀繁殖生产亲鱼主要依赖人工培育。与室外养殖相比, 工厂化循环水养殖具有环境可控的优势, 更容易控制温度、光照和营养等环境条件, 从而可以更精准更有效地进行亲鱼繁殖调控。开展红鳍东方鲀亲鱼工厂化培育生产, 需要为其性腺发育和繁殖产卵提供适宜的温光环境。虽然近年来已经开展了红鳍东方鲀的工厂化养殖, 但是其繁殖调控研究较少, 温度、光照等环境条件相对较难控制或者成本较高, 生产中大多采用随自然温光条件的变化促熟的方式, 尚无法达到人工调控的全季节繁殖, 不利于其工厂化养殖的开展, 也不能满足市场日益多元化的需求。
本研究通过调节光周期的变化速率, 以期缩短红鳍东方鲀繁殖周期, 为其繁殖调控研究及实现全年度繁殖生产提供有价值的数据。
1 材料和方法 1.1 实验鱼和培育环境红鳍东方鲀亲鱼选自大连天正实业有限公司。2020年1月, 挑选270尾3龄个体在循环水养殖车间暂养, 所有个体注射PIT电子芯片进行个体识别, 部分亲鱼于5月成功繁殖产卵。2020年6月, 从这批亲鱼中挑选出90尾进行温光调控实验, 并采用amhr2的SNP标记[12]进行了遗传性别鉴定。自然组共44尾亲鱼, 初始平均体质量为142 8±154 g, 性比(雌∶雄)为24∶20; 加速组共46尾亲鱼, 初始平均体质量为151 1±193 g, 性比(雌∶雄)为26∶20。实验开始时, 实验鱼体质量没有显著性差异。
实验鱼随机分到两个独立的亲鱼温光调控系统中培育。亲鱼温光调控系统包括循环水养殖系统、光照智能调控系统和温度自动调控系统。循环水养殖系统包括约40 m3的养殖池和约9 m3的循环水处理系统。循环水处理系统包括残饵粪便集污器、生化棉过滤池、蛋白分离器、生物过滤池、曝氧装置、缓冲池以及紫外杀菌装置。光照智能调控系统包括LED灯和智能光环境控制器。考虑到绿色光谱对红鳍东方鲀体细胞生长存在促进作用[13], 并且能够促进如星点东方鲀(Takifugu niphobles)等的性腺发育、繁殖性能[14-17]。距离养殖池水面1.5 m处悬挂2盏LED灯, 一盏为全光谱, 另一盏为绿光谱。LED灯启闭缓变时间设置为30 min。养殖池的光环境分为3个区, 由外及里分别为: 绿光谱LED灯照射区、全光谱LED灯照射区和循环水处理系统遮蔽区。由智能光环境控制器控制控制LED灯的启闭时间和辐照度, 可设置灯光渐变模式, 模拟日出日落。温度控制系统包括调温蓄水池、加热棒自动调温装备和空气能冷暖机调温装备, 调温范围10~30℃, 调温精度可达0.1℃。
两组亲鱼采用相同的饲养管理方式。实验期间两组亲鱼均采用饱食投喂的方式, 亲鱼每天投喂1~2次, 投喂量为亲鱼总质量的2%~4%。饵料包括配合饲料和生物饵料。生物饵料包括冰冻饵料鱼、鱿鱼(Loligo japonic)和活体沙蚕(Nereis succinea)、螃蟹(Hemigrapsus sanguineus)等。养殖系统的重要水质参数为: pH(7.00~8.20), DO(6.50~8.50)mg/L, 氨氮(< 0.20)mg/L, 亚硝酸盐(< 0.005)mg/L。
1.2 温光调控实验鱼在两种不同光周期季节变化模式下培育1年。光周期调控起始时间为2020年6月, 对应红鳍东方鲀繁殖期结束时间。实验在大连天正实业有限公司开展, 光照时间的设置参考大连(北纬39°)地区日升和日落时间, 光照时间变化范围为9 h29 min- 14 h51 min。参考红鳍东方鲀最适水温范围和室内养殖水温周年变化数据调控水温。在实验过程中, 最低水温出现在2020年11月, 为13.8℃, 最高水温出现在2020年8月, 为23.7℃。实验设置两种不同光周期、水温调控程序, 如图 1所示: 自然组, 光周期季节变化速率与自然光周期季节变化速率相同, 变化周期12个月; 加速组, 光周期变化速率为自然光周期变化速率的2倍, 变化周期6个月。光照时间每周调节1次。自然组和加速组水温变化如图 1所示。自然组和加速组水温在2020年6月—2021年1月基本相同, 均先升高再降低; 在2021年1月—3月水温较为接近, 均维持在16℃~18℃; 在2021年3—5月自然组水温维持稳定, 而加速组水温降至15.0℃后维持此水温至5月; 在2021年5月—7月水温均逐渐升高。
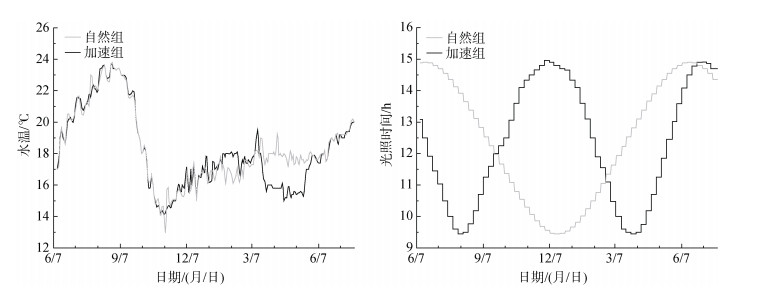 |
| 图 1 自然组和加速组光照时间(h)、水温(℃)变化 Fig. 1 Changes in the lighting time(h)and temperature(℃)in the natural group and accelerated group |
在2020年6月—2021年7月, 对亲鱼性腺发育状况进行跟踪观察, 并根据亲鱼成熟情况进行人工催产。2020年6月、9月、12月, 2021年1月、3月、5月、7月对所有亲鱼进行检测, 测量体长、体质量并拍摄形态照片。体质量(Body mass, M)采用电子天平测量(量程5 kg, 精度0.1 g), 体长(Body length, L)采用刻度尺测量(精度1 mm), 体宽(Body width, WB)和头宽(Head width, WH)采用ImageJ软件从形态照片上测量(图 2)。体宽头宽比(ratio of
 |
| 图 2 红鳍东方鲀形态测量示意图 Fig. 2 Schematic diagram of the morphometrics of tiger puffer |
式中, R为体宽头宽比, WB为体宽, WH为头宽。
估计性腺指数(estimated gonad somatic index, eGSI)根据亲鱼实测体质量和估计体质量计算获得。计算方法如下:
首先, 根据BINOHLAN[18]所提出的体长体质量经验公式, 利用非繁殖期红鳍东方鲀体长体质量数据拟合体质量体长关系方程:
式中, M为体质量(g), L为体长(mm), a, b为常数。
然后, 利用实测体长代入体质量体重关系方程, 计算估计体质量, 最后利用实测体质量和估计体质量的差值作为估计性腺质量, 利用估计性腺质量计算估计性腺指数(eGSI):
式中, eGSI为估计性腺指数(%), M为体质量(g), Me为估计体质量(g)。
通过亲鱼体质量和体宽变化跟踪亲鱼性腺发育过程, 参考eGSI和R值挑选亲鱼, 并用人工催产方法确定亲鱼成熟产卵时间。人工催产方法参照红鳍东方鲀人工繁殖技术规范[19]进行。如表 1所示, 催产使用的药物包括促黄体素释放激素类似物(HLRH-A2)和绒促性素(HCG)。如表 2所示, 实验过程中共进行6次的人工催产实验。
| 针次 | HLRH-A2(µg/kg) | HCG(IU/kg) |
| 第1针 | 10~15 | - |
| 第2针 | 10~15 | 200~500 |
| 催产批次 | 分组 | 催产日期(年.月.日) | 数量(尾) | 体质量(g) | 水温(℃) |
| 1 | 加速组 | 2021.01.16 | 3 | 2831±247 | 17.0~17.6 |
| 2 | 自然组 | 2021.03.05 | 2 | 2585±67 | 17.2~18.0 |
| 3 | 自然组 | 2021.04.03 | 3 | 2301±141 | 17.0~18.1 |
| 4 | 自然组 | 2021.04.16 | 3 | 2569±80 | 17.9~18.0 |
| 5 | 自然组 | 2021.06.08 | 2 | 2043±42 | 17.5~18.2 |
| 6 | 加速组 | 2021.06.22 | 3 | 2232±184 | 18.3~19.2 |
数据以“平均值±标准差(Mean±SD)”表示, 采用软件SPSS 20.0进行统计分析。采用一般线性模型(One-way analysis of variance, ANOVA)比较组间均值差异, P < 0.05表示差异显著。
2 结果 2.1 体质量和体长周年变化特征亲鱼的体质量和体长周年变化特征如表 3所示。经过1周年培育, 自然组和加速组亲鱼体质量和体长均明显增长。雌鱼的生长速度较雄鱼的快, 其体质量和体长均比雄鱼的更高。两组亲鱼的体质量生长变化均较大, 在6月—9月生长缓慢, 在9月—12月生长最快, 在12月—翌年3月生长减慢, 在3月—7月呈负增长。雄鱼的体质量达到最大值后开始下降, 而雌性的直到5月底才明显下降。加速组的体质量在12月达到峰值, 而自然组的体质量在3月才达到峰值。总体上, 两组亲鱼的体长在整个实验期间均呈正增长趋势, 在9月—12月生长最快, 在12月—翌年3月生长缓慢, 3月—7月生长加快。
| 日期(年.月) | 自然组 | 加速组 | |||||||||
| 体质量(g) | 体长(mm) | 体质量(g) | 体长(mm) | ||||||||
| 雌 | 雄 | 雌 | 雄 | 雌 | 雄 | 雌 | 雄 | ||||
| 2020.06 | 1 479±121 | 1 371±172 | — | — | 1 555±168 | 1 444±214 | — | — | |||
| 2020.09 | 1 548±173 | 1 447±182 | 356±12 | 353±19 | 1 723±177 | 1 529±240 | 371±14 | 349±19 | |||
| 2020.12 | 2 085±218 | 2 003±333 | 384±11 | 365±16 | 2 287±253 | 2 180±303 | 397±17 | 370±20 | |||
| 2021.01 | 2 179±287 | 1 952±349 | 386±13 | 369±15 | 2 239±265 | 2 090±255 | 399±16 | 371±21 | |||
| 2021.03 | 2 347±383 | 2 041±363 | 389±12 | 371±16 | 2 293±261 | 1 947±268 | 399±17 | 370±21 | |||
| 2021.05 | 2 206±225 | 1 803±275 | 398±12 | 373±16 | 2 297±327 | 1 920±269 | 404±16 | 377±20 | |||
| 2021.07 | 2 093±285 | 1 780±276 | 402±15 | 383±16 | 2 217±279 | 1 889±325 | 406±15 | 382±22 | |||
红鳍东方鲀在9月时, 体质量与体长的关系方程为: M=0.019 7×L1.9194, R2=0.630 6。根据关系方程, 计算获得了eGSI。
雌鱼的eGSI的季节变化如图 3所示。自然组的eGSI在3月达到最大值, 加速组的eGSI在12月达到最大值。自然组的eGSI在5月开始下降; 加速组的eGSI在1月开始下降。在1月、3月和5月, 自然组和加速组雌鱼的eGSI存在显著的组间差异(P < 0.05)。
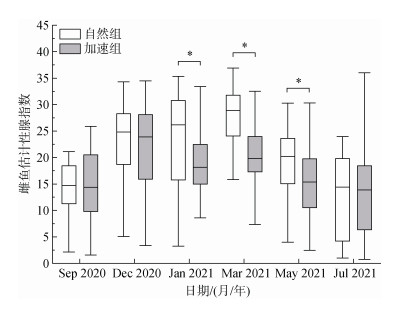 |
| 图 3 红鳍东方鲀雌鱼估计性腺指数变化 Fig. 3 Changes in the eGSI of female tiger puffer 注: 方框表示第一和第三四分位数, 虚线表示每组的最小值和最大值, 而每个方框中的粗线表示中值。*代表组间存在差异性显著(P < 0.05)。 |
雌鱼的体宽头宽比R的变化如图 4所示。自然组的R值在3月达到峰值, 与同期加速组的R值没有显著差异; 加速组的R值在1月达到峰值, 且显著高于同期自然组的R值(P < 0.05)。在5月, 自然组的R值开始下降, 而加速组雌鱼R值表现出上升趋势。
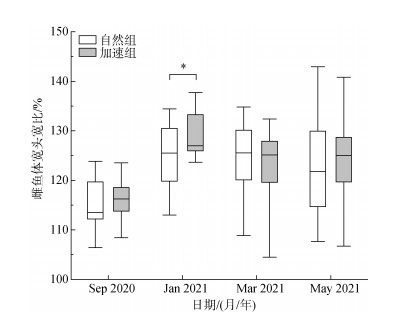 |
| 图 4 红鳍东方鲀雌鱼体宽头宽比变化 Fig. 4 Changes in the R of female tiger puffer 注: 方框表示第一和第三四分位数, 虚线表示每组的最小值和最大值, 而每个方框中的粗线表示中值。*代表组间存在差异性显著(P < 0.05)。 |
自然组4个批次共计挑选10尾雌鱼, 8尾雌鱼产卵, 催产率为80%; 加速组2个批次共计挑选6尾雌鱼, 3尾雌鱼产卵, 催产成功率为50%。成功产卵雌鱼的产卵时间如表 4所示。两组亲鱼的产卵量没有显著性差异。自然组和加速组产卵雌鱼的最小初始体质量分别为1 358 g和1 356 g, 成熟产卵前最小体质量分别为2 032 g和2 064 g, 成熟产卵前最小eGSI分别为18%和15%, 成熟产卵前最小体宽头宽比R值分别为1.168 2和1.240 9。自然组的产卵时间为3月—6月, 加速组的产卵时间为1月和7月。
| 催产批次 | 分组 | 个体ID(PIT号) | 成熟体质量(g) | 体长(mm) | 体宽头宽比 | 估计性腺指数(%) | 产卵日期(年.月.日) | 产卵量(g) |
| 1 | 加速组 | 4 865 | 3 107 | 427 | 1.377 1 | 30 | 2021.1.25 | 576 |
| 1 | 加速组 | 4 756 | 2 250 | 399 | 1.240 9 | 19 | 2021.1.30 | 254 |
| 2 | 自然组 | 4 977 | 2 651 | 405 | 1.311 4 | 29 | 2021.3.10 | 162 |
| 2 | 自然组 | 4 950 | 2 620 | 395 | 1.281 0 | 33 | 2021.3.14 | 344 |
| 2 | 自然组 | 4 840 | 2 854 | 400 | 1.341 2 | 36 | 2021.3.15 | 286 |
| 3 | 自然组 | 4 770 | 2 156 | 365 | 1.289 5 | 34 | 2021.4.8 | 283 |
| 4 | 自然组 | 4 791 | 2 408 | 395 | 1.348 1 | 27 | 2021.4.19 | 220 |
| 4 | 自然组 | 4 980 | 2 125 | 360 | 1.267 8 | 35 | 2021.4.19 | 163 |
| 5 | 自然组 | 4 786 | 2 144 | 395 | 1.220 2 | 18 | 2021.6.13 | 275 |
| 5 | 自然组 | 4 808 | 2 032 | 380 | 1.168 2 | 22 | 2021.6.13 | 255 |
| 6 | 加速组 | 5 003 | 2 064 | 395 | 1.254 0 | 15 | 2021.7.2 | 114 |
总体上, 无论是体质量还是体长, 红鳍东方鲀亲鱼在6—9月均表现为慢速生长, 在9—12月均表现为快速生长, 在12月—翌年3月均表现为慢速生长。但是, 在3—7月, 亲鱼的体质量表现为负增长而体长表现为正增长。红鳍东方鲀的这种生长周年变化特征可能与其性腺发育周期相关。在一个繁殖周期内, 鱼类的性腺质量在发育期快速增加, 在退化期快速降低, 是引起体质量大幅度变化的主要原因。但是, 这种性腺质量的快速变化不会引起体长的变化[20]。因此, 参照体长, 体质量的周年变化特征能够一定程度上反映鱼类性腺发育周期特征。
鱼类的性腺发育周期可以分为再生期、发育期、成熟期和退化期4个时期[21]。红鳍东方鲀在9—12月, 一方面性腺由Ⅱ期发育至Ⅳ期[9], 即性腺处于发育期, 性腺质量大幅度增加; 另一方面水温为14℃~23℃, 处于生长适宜水温范围(14℃~27℃)[10], 体生长速度较快。因此, 红鳍东方鲀在9—12月的体质量大幅度增长的特征一定程度上反映了性腺发育变化。红鳍东方鲀在12月—翌年3月, 体长增长缓慢, 表明体生长缓慢, 体质量的变化主要是性腺质量的变化。在性腺成熟期, 亲鱼的能量主要用于性腺的发育。在3—7月亲鱼体质量快速下降, 主要是由于精子或者卵子排出, 或者性腺退化, 性腺质量降低的结果。亲鱼在进入成熟期后, 体质量降低意味着性腺进入退化期。
鱼类性腺发育周期特征表现为性腺体积和质量的季节性变化。性腺体积的变化引起亲鱼腹部轮廓的变化, 轮廓变化从背面观看就是体宽的变化(图 2), 因此性腺体积的变化可以使用体宽来描述。但是, 体宽除了与性腺大小有关, 还与体大小有关。体宽与头宽均与体长轴垂直, 因此, 体宽与头宽的比值可以消除体大小的影响。因此本研究中采用R值来描述性腺体积的大小。
亲鱼性腺质量可以解剖后直接测量, 也可以进行估算。实际生产中, 亲鱼往往非常珍贵, 不宜解剖, 所以有必要对性腺质量进行估计。性腺的质量为亲鱼总体质量与非性腺部分体质量的差值。在退化期或再生期, 性腺质量相对较小, 亲鱼总体质量约等于非性腺部分体质量。因此, 利用退化期或再生期的体质量体长关系方程, 亲鱼的非性腺部分的体质量可以通过体长来估算。估计性腺指数用估计性腺质量代替实测性腺质量, 与性腺指数一样, 用来描述性腺发育周期特征。
3.2 光周期季节变化对红鳍东方鲀成熟产卵的影响亲鱼性腺发育和催产结果表明, 红鳍东方鲀在相同的温度条件下, 通过光周期季节变化速率加快2倍处理, eGSI和R值分别提前3个月和2个月到达峰值, 首次产卵时间也提前近2个月。这种改变光周期季节变化速率对亲鱼性腺发育和产卵时间的影响, 在其他鱼类中也有报道[6]。例如, 圆鳍鱼(Cyclopterus lumpus)在9个月和6个月一个光周期季节变化周期的加速处理模式下, 与自然组相比, 产卵时间分别提前了1个月和2个月[22]。另外, 加速光周期季节变化速率能够缩短鱼类的繁殖周期。例如, 三刺鱼(Gasterosteus aculeatus)在2倍加速光周期季节变化的调控下, 繁殖周期缩短, 实现了一年两次繁殖[23]。光周期时相迁移同样能够改变鱼类的繁殖时间。例如, 大菱鲆(Scophthalmus maximus)在光周期季节变化时相前移3个月的处理条件下, 产卵时间提前约3个月[24]。光周期季节变化加速处理和时相前移处理均能够有效调控鱼类的繁殖时间, 如果将这两种光周期调控方法结合使用, 有望实现亲鱼全年繁殖。
鱼类的繁殖时间除了与光周期有关, 还受温度的影响。通过温度的调控也能够改变鱼类的产卵时间[25-27]。对大口黑鲈(Micropterus salmoides)进行降温–低温维持–升温的温度调控, 可以实现其反季节产卵[28]。本研究中, 由于受环境条件的限制, 加速组在第一次繁殖前仅进行了光周期的处理, 未进行温度变化加速处理, 这可能是加速组产卵时间较预期晚的原因。加速组在产卵后, 进行了小幅度的降温处理, 温度的变化模式类似于光周期的加速模式。结果表明, 加速组在3—5月eGSI和R值变化较小, 且在7月能够产卵。这可能是因为红鳍东方鲀成熟后在低温条件下性腺延迟退化[29], 也可能是因为低温处理刺激了性腺再次成熟。通过光周期调控处理和温度调控处理, 红鳍东方鲀的繁殖时间由3—5月扩展至1—7月。如果进行温光协同调控, 可能会取得更好的效果。温光协同调控方法在鱼类全年繁殖生产中具有广阔的应用前景[30, 31], 值得进一步深入研究。
4 结论本研究中, 红鳍东方鲀亲鱼的生长具有季节性, 总体特征为繁殖期前快速增长, 繁殖期增长缓慢或者为负增长, 体质量的周年变化特征与性腺发育周期有关。基于体长体质量关系的估计性腺指数eGSI值和基于腹部形态变化的体宽头宽比R值能够指示亲鱼性腺发育状态。工厂化循环水养殖条件下, 对红鳍东方鲀亲鱼进行等速光照周期季节变化的调控, 红鳍东方鲀亲鱼能够在自然繁殖期产卵; 通过加速光周期季节变化的调控, 能够将红鳍东方鲀的产卵时间提前到1月。在相同的温度条件下, 加速光照周期季节变化的调控方法能够实现亲鱼提前成熟产卵。
致谢: 感谢大连天正实业有限公司张涛、孙群汶和大连海洋大学王冠、徐浩同学在亲鱼培育方面提供的帮助。感谢审稿人在论文修改上提出的宝贵建议。
| [1] |
BROMAGE N, PORTER M, RANDALL C. The environmental regulation of maturation in farmed finfish with special reference to the role of photoperiod and melatonin[J]. Aquaculture, 2001, 197(1): 63-98. |
| [2] |
FALCÓN J, MIGAUD H, MUÑOZ-CUETO J A, et al. Current knowledge on the melatonin system in teleost fish[J]. Gen Comp Endocrinol, 2010, 165(3): 469-482. DOI:10.1016/j.ygcen.2009.04.026 |
| [3] |
WOOTTON R J, SMITH C. Reproductive biology of teleost fishes[M]. New Jersey: Wiley-Blackwell, 2014.
|
| [4] |
NIKOLSKY G V. On some zonal features in the process of fish production in waterbodies of different latitudes[J]. Ber Dtsch Wiss Komm Meeresforsch, 1970, 21: 27-32. |
| [5] |
PAVLIDIS M, KERAVEC S, GREENWOOD L, et al. Reproductive performance of common dentex, Dentex dentex, broodstock held under different photoperiod and constant temperature conditions[J]. Fish Physiology and Biochemistry, 2001, 25(3): 171-180. DOI:10.1023/A:1022284511903 |
| [6] |
NORBERG B, BROWN C L, HALLDORSSON O, et al. Photoperiod regulates the timing of sexual maturation, spawning, sex steroid and thyroid hormone profiles in the Atlantic cod(Gadus morhua)[J]. Aquaculture, 2004, 229(1/4): 451-467. |
| [7] |
张玉波, 何舜平. 细胞色素b和12S rRNA基因序列变异与东方鲀属鱼类系统发育[J]. 科学通报, 2007, 52(21): 2507-2516. ZHANG Yubo, HE Shunping. Phylogenetic relationships of the genus Takifugu(Tetraodon tiformes, Tetraodon tidae)tested by sequence variation of cytochrome b and 12S rRNA genes[J]. Kexue Tongbao(Chinese Science Bulletin), 2007, 52(21): 2507-2516. DOI:10.3321/j.issn:0023-074x.2007.21.008 |
| [8] |
雷霁霖. 海水鱼类养殖理论与技术[M]. 北京: 中国农业出版社, 2005. LEI Jilin. Marine fish culture and techniques[M]. Beijing: China Agriculture Press, 2005. |
| [9] |
李伟缘, 熊玉宇, 王子维, 等. 红鳍东方鲀性腺发育的组织学研究[J]. 水产科学, 2021, 41(5): 1-17. LI Weiyuan, XIONG Yuyu, WANG Ziwei, et al. Histological study on the gonadal development of Takifugu rubripes[J]. Fisheries Science, 2021, 41(5): 1-17. DOI:10.3969/j.issn.1004-2091.2021.05.001 |
| [10] |
马爱军, 李伟业, 王新安, 等. 红鳍东方鲀养殖技术研究现状及展望[J]. 海洋科学, 2014, 38(2): 116-121. MA Aijun, LI Weiye, WANG Xinan, et al. Reasearch progress and outlook of Takifug rubripes culture techniques[J]. Marine Sciences, 2014, 38(2): 116-121. |
| [11] |
雷霁霖, 陈超, 徐延康, 等. 红鳍东方鲀工厂化育苗技术研究[J]. 渔业科学进展, 1992, 13: 62-71. LEI Jilin, CHEN Chao, XU Yankang, et al. Studies on productive scale seedling rearing of tiger puffer (Takifugu rubripes)[J]. Progress in Fishery Sciences, 1992, 13: 62-71. |
| [12] |
KAMIYA T, KAI W, TASUMI S, et al. A trans-species missense SNP in Amhr2 is associated with sex determination in the tiger pufferfish, Takifugu rubripes (fugu)[J]. Plos Genetics, 2012, 8(7): e1002798. DOI:10.1371/journal.pgen.1002798 |
| [13] |
KIM B H, HUR S P, HUR S W, et al. Relevance of light spectra to growth of the rearing tiger puffer Takifugu rubripes[J]. Development & Reproduction, 2016, 20(1): 23-29. |
| [14] |
BAIRWA M K, SAHARAN N, RAWAT K D, et al. Effect of LED light spectra on reproductive performance of Koi carp (Cyprinus carpio)[J]. Indian Journal of Animal Research, 2017, 51(6): 1012-1018. |
| [15] |
CHOI S H, KIM B H, HUR S P, et al. Effects of different light spectra on the oocyte maturation in grass puffer Takifugu niphobles[J]. Development & Reproduction, 2018, 22(2): 175-182. |
| [16] |
鲁纪刚. 特定波段光谱对光唇鱼(Acrossocheilus fasciatus)行为、生长、性腺发育及氧化防御能力的影响[D]. 金华: 浙江师范大学, 2019. LU Jigang. Effects of specific spectral-wavelength on behavior, growth, gonadal development and oxidative defensive ability in Acrossocheilus fasciatus[D]. Jinhua: Zhejiang Normal University, 2019. |
| [17] |
JI Y C, CHOI C Y. Gonadotropin-releasing hormone- independent effects of recombinant vertebrate ancient long opsin in the goldfish Carassius auratus reveal alternative reproduction pathways[J]. Fish Physiology and Biochemistry, 2020, 46(6): 1219-1227. |
| [18] |
BINOHLAN C, FROESE R. Empirical equations for estimating maximum length from length at first maturity[J]. Journal of Applied Ichthyology, 2009, 25(5): 611-613. |
| [19] |
GB/T 27625-2011. 红鳍东方鲀人工繁育技术规范[S]. GB/T 27625-2011. Specification of the technology of artificial breeding for Takifugu rubripes[S]. |
| [20] |
WOOTTON R J. Ecology of teleost fishes[M]. Boston: Kluwer Academic Pub, 1998.
|
| [21] |
BROWN-PETERSON N J, WYANSKI D M, SABORIDO- REY F, et al. A standardized terminology for describing reproductive development in fishes[J]. Marine and Coastal Fisheries, 2011, 3: 52-70. |
| [22] |
IMSLAND A K, HANGSTAD T A, JONASSEN T M, et al. The use of photoperiods to provide year round spawning in lumpfish Cyclopterus lumpus[J]. Comparative Biochemistry and Physiology, Part A, 2019, 228: 62-70. |
| [23] |
SATTLER J L, BOUGHMAN J W. Advancing breeding in stickleback (Gasterosteus aculeatus) to produce two reproductive cycles per year[J]. Journal of Fish Biology, 2020, 97(5): 1576-1581. |
| [24] |
POLAT H, OZTURK R C, TERZI Y, et al. Effect of photoperiod manipulation on spawning time and performance of turbot (Scophthalmus maximus)[J]. Aquaculture Studies, 2021, 21(3): 109-115. |
| [25] |
HERMELINK B, WUERTZ S, TRUBIROHA A, et al. Influence of temperature on puberty and maturation of pikeperch, Sander lucioperca[J]. Gen Comp Endocrinol, 2011, 172(2): 282-292. |
| [26] |
MAZZEO I, PEÑARANDA D S, GALLEGO V, et al. Temperature modulates the progression of vitellogenesis in the European EEL[J]. Aquaculture, 2014, 434: 38-47. |
| [27] |
MILLA S, KHENDEK A, ZARSKI D, et al. Duration of chilling phase, but not thermal condition, influence the gonad maturation of male and female domesticated pikeperch (Sander lucioperca)[J]. Aquaculture, Fish and Fisheries, 2021, 1(1): 51-59. |
| [28] |
HANSEN T, KARLSEN Ø, TARANGER G L. Growth, gonadal development and spawning time of Atlantic cod (Gadus morhua) reared under different photoperiods[J]. Aquaculture Amsterdam, 2001, 203(1-2): 51-67. |
| [29] |
KING H R, PANKHURST N W, WATTS M. Reproductive sensitivity to elevated water temperatures in female Atlantic salmon is heightened at certain stages of vitellogenesis[J]. Journal of Fish Biology, 2007, 70(1): 190-205. |
| [30] |
AKHOUNDIAN M, SALAMAT N, SAVARI A, et al. Influence of photoperiod and temperature manipulation on gonadal development and spawning in Caspian roach (Rutilus rutilus caspicus): Implications for artificial propagation[J]. Aquaculture Research, 2020, 51: 1623-1642. |
| [31] |
LEE C H, HUR S W, KIM B H, et al. Induced maturation and fertilized egg production of the red-spotted grouper, Epinephelus akaara, using adaptive physiology of photoperiod and water temperature[J]. Aquaculture Research, 2020, 51: 2084-2090. |
 2023, Vol. 47
2023, Vol. 47


