文章信息
- 臧帆, 李文军, 秦松, 林剑. 2023.
- ZANG Fan, LI Wen-jun, QIN Song, LIN Jian. 2023.
- 藻蓝蛋白对博来霉素肺纤维化小鼠肠道菌群的影响
- Effect of phycocyanin on the intestinal flora of mice with bleomycin-induced pulmonary fibrosis
- 海洋科学, 47(6): 42-51
- Marine Sciences, 47(6): 42-51.
- http://dx.doi.org/10.11759/hykx20210206001
-
文章历史
- 收稿日期:2021-02-06
- 修回日期:2021-02-27
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003;
3. 中国科学院海洋大科学研究中心, 山东 青岛 266071
2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
博来霉素(bleomycin, BLM)是从轮状链霉菌中分离出的一类抗生素[1], 可以用于治疗头颈癌、鳞状细胞癌、睾丸癌和某些淋巴瘤等癌症[2]。但是, 使用BLM可能诱使患者发生肺炎样症状以及肺纤维化(fulmonary fibrosis, PF), 甚至造成患者死亡[3]。BLM通过静脉注射后, 迅速与血液中的二价铜离子结合并被转运至细胞中, 引起DNA损伤[4]。这会产生一系列的毒副作用, 其中主要影响了患者的肺组织和皮肤组织。研究表明, BLM诱导的肺毒性与PF的病理过程非常相似[5], 其特征均为上皮修复异常和细胞外基质沉积紊乱。患者随着肺功能丧失、呼吸衰竭等病症的出现, 逐渐走向死亡[6]。目前吡非尼酮和尼达尼布等药物已在临床上用于PF的长期治疗中, 但这些疗法无法有效地阻止其进一步发展, 同时经常会引起不良副作用[7]。为了减轻患病人员的痛苦以及经济压力, 亟需寻找可以更好延缓甚至治疗PF病程的药物和方法。
藻蓝蛋白(phycocyanin, PC)是藻类生物中的一类色素蛋白, 主要存在于蓝藻、红藻以及部分隐藻, 此外, 在极少数甲藻(如蓝裸甲藻Gymnodinium cyaneum)中也发现了PC的存在[8]。学者们已经研究了PC的多种活性, 包括抗氧化性以及抗炎性等[9]。据报道, PC可以通过在早期抑制TLR2-MyD88-NF-κB信号通路来促进免疫细胞的增殖和分化, 从而在减轻肺损伤和纤维化过程中发挥作用[10]。
随着对PF研究的深入, “肠-肺”轴的概念开始得到认可, 肺组织与肠道微生物之间存在重要串扰, 肠道菌群与肺部的免疫调节系统息息相关[11]。前期的研究表明, 当肺部受到刺激时, 肠道微生物的功能发生紊乱, 促使脂多糖(LPS)的产生[12]。LPS通过与Toll样受体4结合进一步诱导肺部疾病[13]。PC干预可以影响肠道菌群的组成, 通过增加肠道微生物中双歧杆菌和乳酸菌等有益细菌的相对丰度, 提高菌群的免疫力[14]。同时证明了PC干预能够增加与短链脂肪酸生产相关细菌的含量, 例如费氏杆菌和拉氏梭菌, 其通过促进短链脂肪酸的合成, 增强了对G蛋白偶联受体的抑制作用, 从而引起肺部的免疫调节[15]。
基于以上研究, 本研究采用尾静脉注射BLM诱导小鼠PF, 并通过肺部病理切片染色及肠道微生物水平来评估PC对PF的影响。
1 材料与方法 1.1 伦理声明该研究所涉及的所有动物实验方法均按照滨州医学院《动物实验保护指南》制定, 实验方案经过了山东国际生物技术园动物保养委员会的批准。
1.2 实验材料和动物30只雄性ICR小鼠, 6~8周龄, 体重18~22 g, 购自济南朋悦实验动物繁育中心[许可证号: SCXK(鲁) 20140007]。动物房严格控制12 h/12 h明/暗循环, 环境温度在(23±2) ℃, 环境湿度在50%~60%, 小鼠自由饮食, 适应性培养1周。
PC从螺旋藻中提取, 购自新大泽螺旋藻有限公司(中国福清)。小鼠饲料购自济南朋悦动物繁育中心(中国济南)。HE和masson染色试剂盒购自solarbio (中国北京)。
1.3 实验设计小鼠常规饲养1周后, 根据体重按SPSS随机分为3组: 对照组(Con组)、多次静脉注射组(R组)、多次静脉注射+藻蓝蛋白组(RPC组), 每组10只。R组和RPC组小鼠经尾静脉注射博来霉素10 mg/kg, 每周2次, 共8次; RPC组每天灌胃50 mg/kg藻蓝蛋白; Con组小鼠通过尾静脉注射等量0.9% NaCl溶液, 每周2次, 共8次。
在实验期间, 检测小鼠的活动状态、饮食、体重和死亡情况。
1.4 样品采集与处理在第一次BLM处理后的第14、28 d, 每组随机选取5只小鼠进行处死, 取出其左肺置于4%多聚甲醛中固定48 h; 在第28 d时, 早6点将每只小鼠置于单独的无菌笼中, 同时采用无菌冻存管收集约150 mg新鲜的粪便样品, 并立即保存在−80 ℃中直至使用。
1.5 肺组织的病理学观察肺部组织进行石蜡包埋, 制成切片后分别进行HE和masson染色; 使用BX-51M荧光显微镜(Olympus, Japan)观察切片。参照ashcroft评分来确定肺泡炎及肺间质纤维化的程度[16]。
1.6 肠道微生物的高通量测序 1.6.1 粪便中DNA的提取和测序从小鼠粪便样本中分离细菌基因组DNA, 采用TransStart Fastpfu DNA聚合酶反应体系在V3-V4可变区内使用特异性引物338F和806R进行PCR扩增(ABI GeneAmp® 9700型PCR仪)(表 1)。通过2%的琼脂糖凝胶电泳检测PCR产物并进行回收(axygen公司)。使用DNA样品制备试剂盒(illumina公司)构建MiSeq文库, 并根据测序流程利用illumina MiSeq测序平台进行测序。通过美吉生物云平台(https://cloud.majorbio.com)进行生物信息学分析。
| 测序区域 | 引物名称 | 引物序列 |
| V3-V4可变区 | 338F | ACTCCTACGGGAGGCAGCAG |
| 806R | GGACTACHVGGGTWTCTAAT |
对原始序列进行质量过滤, 并使用QIIME平台的默认参数根据其条形码将其分配给样品, 使用usearch软件平台提取优化序列的非重复序列, 取出不重复的单个序列。在97%的相似性下, 对非重复序列进行OTU聚类。
通过alpha多样性分析, 反应肠道菌群的丰富度和多样性, 包括以下几种统计学分析指数: sobs、chao、shannon、simpson、coverage。使用R语言PCoA统计分析和作图软件进行UniFrac PCoA分析, 基于所选距离矩阵进行作图, 分析不同组之间的差异, 并通过SPSS分析LPS与肠道菌群的相关性。
进行组件显著性差异检验, 根据得到的群落丰度数据, 对不同组微生物群落之间的物种进行假设检验。评估物种丰度差异的显著性水平, 并获得各组之间具有显著性差异的物种。
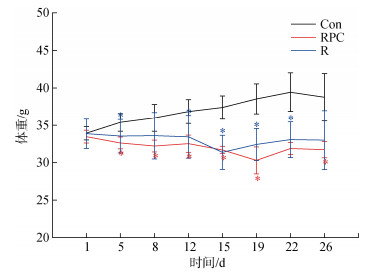
2 结果与讨论 2.1 一般情况及小鼠体质量变化实验过程中, 每周对小鼠称重两次。如图 1所示, Con组小鼠的平均体重呈上升趋势, 在第22 d时, 平均体重达到最大39.44 g, 而后平均体重降低至38.76 g, 整个实验过程中小鼠的平均体重增长了4.83 g。与Con组比较, R组和RPC组体重明显下降(*P < 0.05)。R组小鼠的体重呈缓慢降低再升高的趋势, 在给药第15 d时, 平均体重降至最低31.37 g, 这可能是由于多次静脉注射BLM后对小鼠的肠、胃等器官造成了影响, 而后平均体重有所上升, 增长至33 g, 整个实验过程中, 体重降低了0.87 g。与R组相比, RPC组平均体重的变化趋势与其相似, 但最终结束时, 小鼠平均体重降低了1.75 g, 略低于R组。
 |
|
图 1 实验开始后各组小鼠的平均体重变化 Fig. 1 Changes in the average weight of mice in each group after the start of the experiment 注: Con: 对照组; R: 多次静脉注射BLM组; RPC: 多次静脉注射BLM加PC干预组。数据表示为 |
为了验证PC的抗纤维化水平, 本课题组采用尾静脉注射BLM的方法建立PF模型。而后通过组织学分析, 包括masson染色和HE染色, 评估PC的抗纤维化作用。
HE染色和ashcroft评分[16]用于评估PF程度。如图 2a所示, PF建模第14 d, R组小鼠的肺组织有明显的淋巴细胞和中性粒细胞浸润(如图 2a橙色箭头), 肺泡隔和肺泡出现炎性渗出增加, 肺泡隔增宽, 此时PC给药组肺泡隔毛细血管扩张且肺泡巨噬细胞稍微增加。ashcroft评分显示, 与Con组相比, R组的肺纤维化评分显著升高(P < 0.05), 纤维化等级处于1和2之间; 口服PC后, RPC组小鼠肺纤维化程度减轻(P < 0.05)。在建模第28 d, R组小鼠肺组织的肺泡隔和肺泡中的炎性细胞浸润有所减少, 但肺泡隔进一步增宽, 并出现大量成纤维细胞增生结节(图 2b绿色箭头), 此时RPC组小鼠的肺泡隔宽度稍微增加。ashcroft评分显示, 与Con组相比, R组小鼠肺纤维化评分显著增加(P < 0.01), 为5±0.5, 小鼠肺部受累面积大于50%, 肺泡系统紊乱, 与R组相比, RPC组的肺纤维化评分显著降低(P < 0.05), 小鼠肺部的受累面积在20%~50%(图 2c)。结果表明, 小鼠经过尾静脉注射BLM后, 肺组织受到了严重破坏, 而PC给药显著保护了肺泡组织的结构并改善了炎症细胞的浸润, 肺纤维化程度降低。
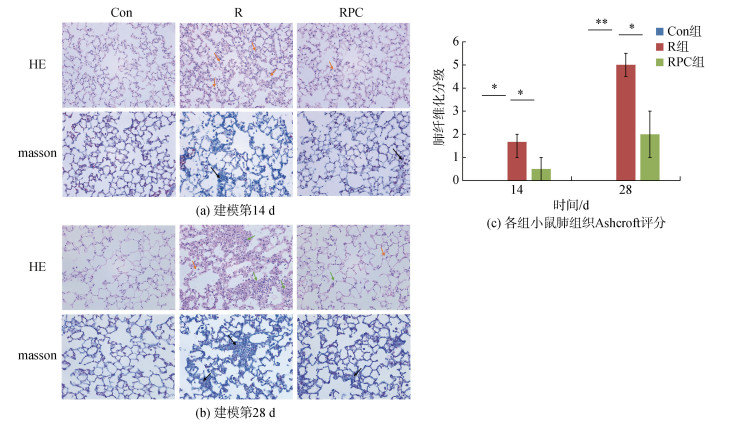 |
| 图 2 PC对尾静脉注射BLM诱导的肺组织损伤和纤维化的影响 Fig. 2 Effects of phycocyanin on lung tissue injury and fibrosis induced by tail vein injection of bleomycin 注: Con: 对照组; R: 多次静脉注射BLM组; RPC: 多次静脉注射BLM加PC干预组。比例尺长度为100 μm。n=5, *P < 0.05, **P < 0.01 |
Masson三色染色显示, BLM静脉注射第14 d, R组小鼠有少量胶原纤维沉积, 肺泡隔成纤维细胞局限性增生且结节增多, 同时结节内有少量胶原纤维沉积(图 2b黑色箭头), PC给药组的肺组织结节增多但无明显胶原纤维沉积(图 2b)。实验进行至第28 d, R组小鼠在肺血管外膜的外部区域观察到蓝色染色逐渐增加, 肺泡隔和结节内有大量胶原纤维沉积, 表明胶原蛋白在肺组织和周围的分泌和沉积逐渐增加, 此时PC给药组明显减少了胶原纤维的沉积(图 2b)。结果表明BLM诱导导致大量胶原蛋白沉积在肺组织, 通过PC给药可以抑制胶原沉积, 进而减轻BLM引起的PF。
2.3 PC对BLM诱导的肺纤维化小鼠肠道菌群的调节 2.3.1 多样性分析对15只小鼠的粪便样品(每组5个)进行16S rRNA测序, 总共得到359 970个序列。其中包括345个操作生物分类单位(OTU), 共分为9个门和85个属。随着样本数量的增加, Pan(图 3a)/Core(图 3b)曲线趋于平缓, 说明实验的数据量足够反映出小鼠肠道微生物组成的真实情况。
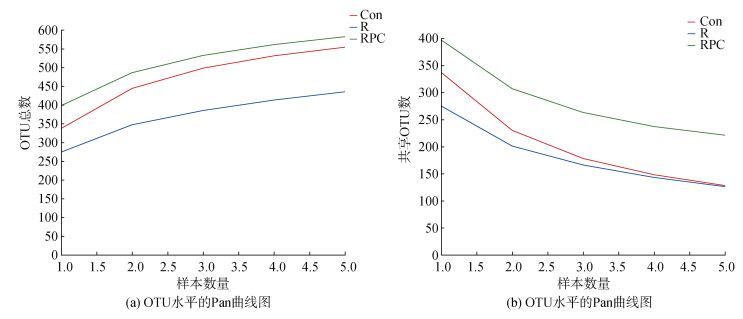 |
| 图 3 OTU水平的Pan(a)和Core(b)曲线图 Fig. 3 Pan (a) and Core (b) curves of the OUT level 注: Con: 对照组; R: 多次静脉注射BLM组; RPC: 多次静脉注射BLM加PC干预组 |
通过alpha多样性分析反映小鼠肠道微生物群的丰富度和多样性。sobs指数显示了菌群丰富度的实际观测值。与Con组相比, BLM诱导显著降低了菌群丰富度的实际观测值。口服PC后, RPC组菌群丰富度的实际观测值增加(图 4a)。chao和ace指数被用于反应群落丰富度。如图 4b和c所示, 与Con组相比, BLM诱导显著降低了chao和ace指数, 而口服PC改善了这些指标, chao和ace指数相对于Con组和R组均显著升高(P < 0.05), 进一步印证BLM静脉注射后降低了小鼠粪便群落的丰富度, 而服用PC使粪便中的菌群丰富度增加。在群落多样性分析中, Shannon和Simpson指数被用作反映群落的多样性, 它们的变化趋势成反比。相较于R组, RPC组的Shannon指数显著增加, Simpson指数显著降低(图 4d和e), 这表明口服PC对肠道菌群多样性产生正面影响, 相比于其他两组均能增加小鼠粪便中的群落多样性(P < 0.05)。肠绒毛是位于肠上皮上的手指状突起, 肠绒毛长度增加有利于营养物质的吸收。因此推测口服PC后, RPC组的肠绒毛的长度增加, 保护了肠黏膜, 从而促进食物的吸收和利用, 同时增加了到达下消化道的可微生物利用的物质的数量, 从而增加了小鼠肠道菌群的丰富度和多样性[14]。
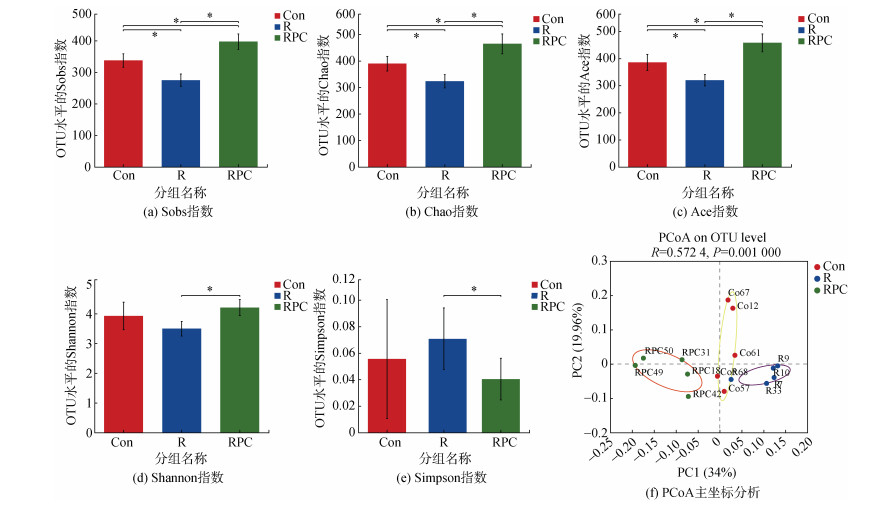 |
| 图 4 各组小鼠肠道菌群的alpha和beta多样性指数 Fig. 4 Alpha and beta diversity indices of mice intestinal flora in each group 注: Con: 对照组; R: 多次静脉注射BLM组; RPC: 多次静脉注射BLM加PC干预组。*P < 0.05 |
beta多样性分析用于比较各组样品之间的物种多样性差异[17]。为了评估各组小鼠细菌的差异, 本课题组进行了beta多样性中的主坐标分析(weighted_ unifrac_full_free距离算法的PCoA分析)[18]。结果显示Con、R和RPC组沿着主纵坐标轴形成明显的微生物种类群集, R组小鼠粪便中的菌群类型主要聚集在对照组的右侧, 而PC给药后, 差异向Con组的左侧方向发展, 口服PC后RPC组的肠道菌群向Con组左侧偏移(图 4f)。由此本课题组推测, 口服PC后, PF小鼠的肠道菌群中的物种分布趋于正常, PC对PF的干预是起积极作用的。
2.3.2 PC对小鼠肠道菌群结构的影响通过venn图统计Con、R和RPC三组样品中共有和独有的物种数目, 选用相似水平为97%的OTU作为样本表进行分类, 如图 5所示, Con组、R组和RPC组共有的OTU数为379个, 其中, Con组独有的OTU数为35个, R组独有的OTU数为9个, RPC组独有的OTU数为68个。结果表明, BLM诱导后, 会降低小鼠肠道菌群的物种数, 而口服PC后小鼠肠道菌群中物种数目增加。
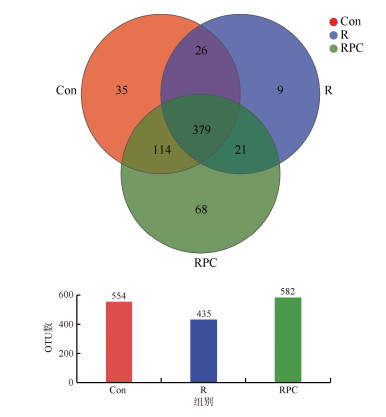 |
| 图 5 小鼠粪便肠道菌群的venn图 Fig. 5 Venn diagram of intestinal flora in mouse feces from the three groups 注: Con: 对照组; R: 多次静脉注射BLM组; RPC: 多次静脉注射BLM加PC干预组 |
为了进一步研究PC对于PF小鼠的作用, 本课题组在门和属水平上对Con、R和RPC三个组肠道菌群的组成情况进行了比较。
在门水平上, 小鼠粪便中的主要菌群组成如图 6a所示。Con、R、RPC三组小鼠的优势菌依次是厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、弯曲杆菌门(Campylobacterota), 但各菌群的相对丰度存在差异。其中Firmicutes和Bacteroidota是小鼠肠道菌群中含量最多的菌门, 占细菌总数的80%以上[19]。两者比例的变化与宿主健康息息相关, 与正常组相比, 经BLM诱导后, Firmicutes的占比降低, Bacteroidota的占比增加; 而口服PC后, Firmicutes的占比增加, Bacteroidota的占比降低(表 2)。研究认为, Bacteroidota门的细胞表面含有丰富的脂蛋白BtuG2, 其可以与维生素B12结合, 通过关键转运蛋白-内在因子来吸收维生素B12, 因此Bacteroidota门的菌群争夺肠道中的关键维生素[20]。
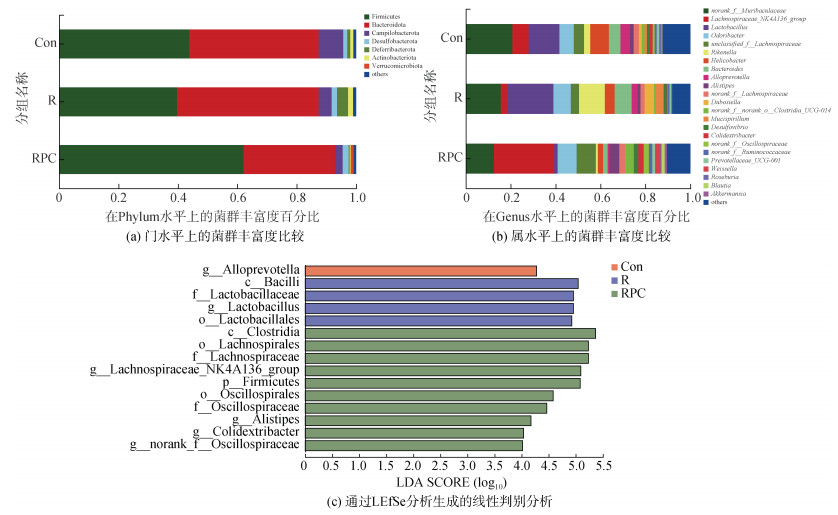 |
| 图 6 不同组小鼠肠道菌群的比较 Fig. 6 Differences in the fecal bacterial composition in the three groups 注: Con: 对照组; R: 多次静脉注射BLM组; RPC: 多次静脉注射BLM加PC干预组。通过LEfSe分析生成的线性判别分析, LSA阈值> 4 |
| 丰度/% | |||
| Con | R | RPC | |
| Firmicutes | 43.80 | 39.64 | 62.09 |
| Bacteroidota | 43.58 | 47.75 | 31.09 |
| Campylobacterota | 8.26 | 4.33 | 2.27 |
| Desulfobacterota | 1.34 | 1.88 | 2.25 |
| 总占比/% | 96.98 | 93.60 | 97.70 |
| 注: Con: 正常对照组; R: 多次静脉注射组; RPC: 多次静脉注射+口服PC组 | |||
在属水平, 根据丰度排名前十的细菌如表 3所示, 占总菌群的70%左右。PC干预后显著调节了几种细菌的丰度, 如图 6b所示, 3组按照Con、R、RPC的顺序, 菌群的平均占比较大的有明确命名的菌属依次为Lachnospiraceae、Odoribacter、Rikenella、Helicobacter等。与对照组相比, BLM诱导组中的Alistipes、Lachnospiraceae_NK4A136_group、unclassified_f_Lachnospiracea等细菌的丰度降低, 而口服PC后增加了这些细菌群落的丰富度。与此同时, 相比于对照组, BLM组中Rikenella、Bacteroides等菌群的丰富度增加, 口服PC后抑制了它的上升趋势。
| 丰度/% | |||
| Con | R | RPC | |
| norank_f__Muribaculaceae | 20.76 | 15.57 | 12.52 |
| Lachnospiraceae_NK4A136_group | 7.21 | 2.740 | 26.850 |
| Lactobacillus | 13.68 | 20.690 | 1.510 |
| Odoribacter | 6.44 | 7.730 | 8.430 |
| unclassified_f__Lachnospiracea | 4.58 | 3.670 | 8.580 |
| Rikenella | 2.76 | 11.54 | 0.92 |
| Helicobacter | 8.26 | 4.33 | 2.27 |
| Bacteroides | 5.13 | 7.58 | 2.11 |
| Alloprevotella | 4.33 | 2.65 | 0.77 |
| Alistipes | 1.56 | 1.22 | 4.35 |
| 总占比/% | 74.71 | 77.72 | 68.31 |
| 注: Con: 正常对照组; R: 多次静脉注射组; RPC: 多次静脉注射+口服PC组 | |||
为了进一步评估PC干预后优势菌群的变化, 对从门到属水平的物种进行LEfSe多级物种差异判别分析。如图 6c所示, 线性判别分析得分(LDA > 4)的结构总共发现了15个具有统计意义的分类单元, 其中R组中差异丰富的分类单元的数量是Con组的4倍, 其显著增加了Bacilli、Lactobacillaceae等有害菌群。而口服PC后, 增加了包括Oscillospiraceae、Lachnospiraceae等有益菌的含量, 该结论与上述门和属水平上的小鼠肠道菌群的结构相对应。
PC可以通过增加有益细菌并减少有害细菌的含量来改善由于尾静脉注射BLM造成的小鼠肠道菌群失衡。主要的有害细菌包括Rikenella, 其含量增加通常发生在肠炎类疾病的发展过程中, 这表明BLM静脉注射过程中不仅对肺部造成了损伤, 还可能影响肠组织的功能, 而口服PC可以减轻BLM引起的肠损伤[21]。同时研究表明, 有益菌可以通过杀死病原细菌, 定植和拮抗有害细菌, 与有害细菌竞争氧气和营养, 为肠道提供微生物屏障以及维持或恢复宿主与肠道微生物之间的平衡[18]。Alistipes是一类有益细菌, 它可以通过赖氨酸发酵产生丁酸, 在鼠模型和人类中已分别显示出与结肠炎和肝病密切相关[22]。它是具有与双歧杆菌相似功能的益生菌, 可以调节小鼠的能量代谢并帮助其适应周围环境[23]。Lachnospiraceae_NK4A136_ group和unclassified_f_Lachnospiracea均属于Lachnospiraceae科, 研究认为Lachnospiraceae科细菌在肠道中用于丁酸盐的生产, 其中丁酸酯可以与其他短链脂肪酸(SCFA)通过不同的机制抑制肠道炎症, 维持肠道屏障并调节肠蠕动[24-25]。
PC对肺纤维化小鼠的肠道菌群起到恢复作用, 本课题组猜测可能是由于PC经过消化道被胃、肠内的消化酶降解, 进而产生了氨基酸、小肽、藻胆素等小分子, 这些小分子参与调节肠道菌群的结构, 增加了有益细菌的数量, 并起到增强SCFA合成提高机体免疫力的作用[26]。同时这些益生细菌可能通过抑制病原微生物对肠上皮细胞的黏附和侵袭并在肠道定植后与病原微生物竞争而有效地抑制病原微生物的生长。
2.4 LPS与优势菌群之间的相关性通过相关性热图分析LPS含量与RPC组粪便中优势菌群的相关性, 在属水平上评估分类水平在总丰度前20的物种, 以找到在PF疾病发生过程中起作用的关键性微生物群。如图 7所示这些菌属与至少一项LPS的指标呈正相关或负相关。
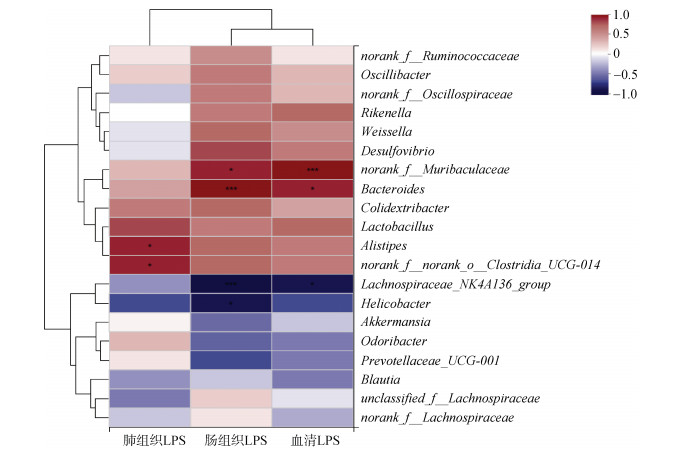 |
| 图 7 口服PC后肠道菌群在属水平的丰度与小鼠肺组织、肠组织和血清中LPS含量的相关性分析 Fig. 7 Correlation analysis of the abundance of intestinal flora in the RPC group at the genus level and the LPS content in lung tissue, intestinal tissue, and serum 注: 红色表示正相关, 蓝色表示负相关, 属丰度与环境因子之间的相关程度由颜色的强度表示。数据表示为平均值±SD(n=5); *P < 0.05, ** P < 0.01, ***P < 0.001 |
大量研究表明, 肠道菌群中的许多细菌与炎症相关。例如, Muribaculaceae代表的拟杆菌门中的菌群, 一般情况下它的含量与LPS含量成正比, 它可以参与自然杀伤细胞和NF-κB信号传导, 同时其可以通过IgA与先天性和适应性免疫反应相互作用[27]。Lachnospiraceae_NK4A136_group、Akkermansia、Blautia等有益菌与小鼠肺组织、肠组织以及血清中的LPS含量成反比。Akkermansia可以增强肠壁屏障, 其通过在肠壁屏障中摄取黏蛋白并将其转变为SCFA, 包括乙酸盐[28]。因此猜测PC口服后经过胃、肠内的消化酶降解, 产生了氨基酸、小肽、藻胆素等小分子, 这些小分子促进了有益菌生长并进一步生成丁酸、丙酸盐等SCFA的生物合成。本课题组推测口服PC后可能通过抑制LPS的含量来抑制TLR4途径的活化, 同时增加肠道菌群中有益细菌的含量, 降低有害细菌的含量。与此同时, 本课题组的数据强调小鼠口服PC后观察到的LPS的降低可能与毛螺菌科细菌的水平有关, 这与2.3.2节的结论相符。因此猜测肠道菌群可能与小鼠的炎症有关, 而PC的抗炎作用在一定程度上与特定的肠道菌群有关。PC可以促进肠道细菌的生长, 相反, 肠道细菌也可以利用未消化的蛋白质, 然后通过发酵这些饮食营养以产生代谢产物, 例如SCFA, 它们可以用作结肠上皮细胞的养料并诱导肠道细胞增殖。因此, PC有益于人体健康。
3 结论本研究采用多次静脉注射BLM的方式诱导ICR小鼠肺纤维化, 证实了口服PC可以减轻小鼠肺纤维化程度。PF小鼠口服PC后, 增加了肠道菌群的丰富度和多样性, 这可能是由于PC能够促进肠道绒毛的生长, 这对肠黏膜起到了保护作用, 进而增强了小鼠本身对食物的消化吸收能力, 从而增加了肠道菌群可利用的营养。同时BLM诱导后, 小鼠肠道菌群中的有益菌群减少, 有害菌群增加, PC处理可以通过增加肠道菌群中Akkermansia, Lachnospiraceae等有益细菌的数量并减少有害细菌的数量来调节肠道菌群, 这为研究疾病和微生态学提供了一些基础数据。为PC减轻小鼠PF的潜在功能和机制提供了新的线索(图 8)。随后的研究需要进一步阐明PC的活性是由蛋白质本身还是由其代谢产物决定的, 以及蛋白质的代谢产物如何在体内不同的菌群中发挥不同的作用。
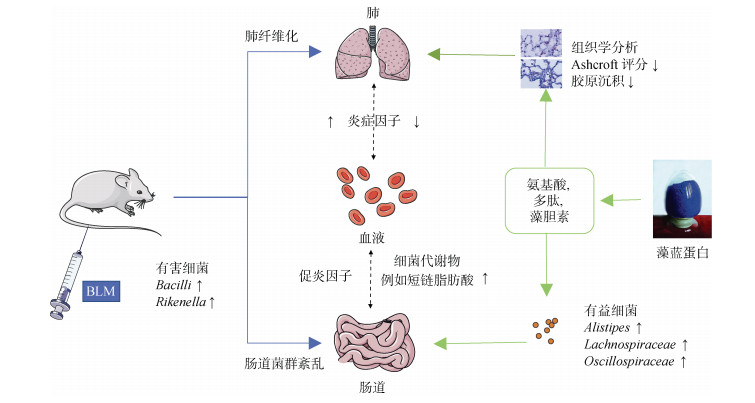 |
| 图 8 藻蓝蛋白对BLM诱导的肺纤维化的潜在机制 Fig. 8 Potential mechanism of phycocyanin on bleomycin- induced pulmonary fibrosis |
| [1] |
HECHT S M. Bleomycin: New perspectives on the mechanism of action[J]. Journal of Natural Products, 2000, 63(1): 158-168. DOI:10.1021/np990549f |
| [2] |
YU L, SUN D Y, LIANG F, et al. Ion-pair LC–UV method for the determination of boanmycin in mouse plasma and its application to a pharmacokinetic study[J]. Chroma tographia, 2010, 72(s3/4): 357-359. |
| [3] |
余林, 苟宝迪. 博来霉素的抗肿瘤活性及诱导肺纤维化毒性的研究进展[J]. 包头医学院学报, 2018, 34(11): 126-129. YU Lin, GOU Baodi. Research progress on the antitumor activity of bleomycin and the toxicity of induced pulmonary fibrosis[J]. Journal of Baotou Medical College, 2018, 34(11): 126-129. |
| [4] |
POVIRK L F, WERNER W, WOLFGANG K, et al. DNA double-strand breaks and alkali-labile bonds produced by bleomycin[J]. Nucleic Acids Research, 1977, 4(10): 3573-3580. DOI:10.1093/nar/4.10.3573 |
| [5] |
DELLA LATTA V, CECCHETTINI A, DEL RY S, et al. Bleomycin in the setting of lung fibrosis induction: from biological mechanisms to counteractions[J]. Phar macological Research, 2015, 97: 122-130. DOI:10.1016/j.phrs.2015.04.012 |
| [6] |
VOGELMEIER C F, CRINER G J, MARTINEZ F J, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report: gold executive summary[J]. European Respiratory Journal, 2017, 49(6): 575-601. |
| [7] |
BARCZI E, STAROBINSKI L, KOLONICS-FARKAS A, et al. Long-term effects and adverse events of nintedanib therapy in idiopathic pulmonary fibrosis patients with functionally advanced disease[J]. Advances in Therapy, 2019, 36(5): 1221-1232. DOI:10.1007/s12325-019-00906-9 |
| [8] |
王庭健, 林凡, 赵方庆, 等. 藻胆蛋白及其在医学中的应用[J]. 植物生理学通讯, 2006(2): 303-307. WANG Tingjian, LIN Fan, ZHAO Fangqing, et al. Phycobiliprotein and its application in medicine[J]. Plant Physiology Journal, 2006(2): 303-307. |
| [9] |
HAO S, LI S, WANG J, et al. Phycocyanin exerts anti- proliferative effects through down-regulating TIRAP/NF- kappa B activity in human non-small cell lung cancer cells[J]. Cells, 2019, 8(6): 588. DOI:10.3390/cells8060588 |
| [10] |
LI C, YU Y, LI W, et al. Phycocyanin attenuates pulmonary fibrosis via the TLR2-MyD88-NF-κB signaling pathway[J]. Scientific Reports, 2017, 7(1): 5843. DOI:10.1038/s41598-017-06021-5 |
| [11] |
赵喆, 白桦, 费凯伦, 等. 人体肺部与肠道细菌在肺癌诊治中的研究进展[J]. 中华结核和呼吸杂志, 2020, 43(7): 585-588. ZHAO Zhe, BAI Hua, FEI Kailun, et al. Research progress of human lung and intestinal bacteria in the diagnosis and treatment of lung cancer[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2020, 43(7): 585-588. DOI:10.3760/cma.j.cn112147-20191119-00772 |
| [12] |
XIE Y Y, LI W J, LU C, et al. The effects of phycocyanin on bleomycin-induced pulmonary fibrosis and the intestinal microbiota in C57BL/6 mice[J]. Applied Microbiology and Biotechnology, 2019, 103(20): 8559-8569. DOI:10.1007/s00253-019-10018-7 |
| [13] |
LU L, LI W, SUN C, et al. Phycocyanin ameliorates radiation‐induced acute intestinal toxicity by regulating the effect of the gut microbiota on the TLR4/Myd88/ NF‐κB pathway[J]. Journal of Parenteral and Enteral Nutrition, 2019, 44(7): 1308-1317. |
| [14] |
XIE Y Y, LI W J, ZHU L M, et al. Effects of phycocyanin in modulating the intestinal microbiota of mice[J]. MicrobiologyOpen, 2019, 8(9): 11. |
| [15] |
LI WJ, LU LN, LIU B, et al. Effects of phycocyanin on pulmonary and gut microbiota in a radiation-induced pulmonary fibrosis model[J]. Biomedicine & Pharmacotherapy, 2020, 132: 110826. |
| [16] |
SZAPIEL S V, ELSON N A, FULMER J D, et al. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse[J]. American Review of Respiratory Disease, 1979, 120(4): 893-899. |
| [17] |
MOHD SHAUFI M, SIEO C, CHONG C, et al. Deciphering chicken gut microbial dynamics based on high-throughput 16S rRNA metagenomics analyses[J]. Gut Pathogens, 2015, 7(1): 4. DOI:10.1186/s13099-015-0051-7 |
| [18] |
QI H T, LIU Y, QI X, et al. Dietary recombinant phycoerythrin modulates the gut microbiota of h22 tumor-bearing mice[J]. Marine Drugs, 2019, 17(12): 665. DOI:10.3390/md17120665 |
| [19] |
LI A L, NI W W, LI Y, et al. Effect of 2′-fucosyllactose supplementation on intestinal flora in mice with intestinal inflammatory diseases[J]. International Dairy Journal, 2020, 110: 104797. |
| [20] |
XU J, GE J, HE X, et al. Caffeic acid reduces body weight by regulating gut microbiota in diet-induced-obese mice[J]. Journal of Functional Foods, 2020, 74: 104061. |
| [21] |
DONG W, HUANG K, YAN Y, et al. Long-term consumption of 2-O-beta-D-Glucopyranosyl-L-ascorbic acid from the fruits of lycium barbarum modulates gut microbiota in C57BL/6 mice[J]. Journal of Agricultural and Food Chemistry, 2020, 68(33): 8863-8874. |
| [22] |
VAN DEN ABBEELE P, BELZER C, GOOSSENS M, et al. Butyrate-producing clostridium cluster XIVA species specifically colonize mucins in an in vitro gut model[J]. The ISME Journal, 2013, 7(5): 949-961. |
| [23] |
MA T Y, IWAMOTO G K, HOA N T, et al. TNF-alpha- induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2004, 286(3): 367-376. |
| [24] |
TAN W, ZHANG Q, DONG Z, et al. Phosphatidylcholine ameliorates lps-induced systemic inflammation and cognitive impairments via mediating the gut-brain axis balance[J]. Journal of Agricultural and Food Chemistry, 2020, 68(50): 14884-14895. |
| [25] |
MA L, NI Y, WANG Z, et al. Spermidine improves gut barrier integrity and gut microbiota function in diet- induced obese mice[J]. Gut Microbes, 2020, 12(1): 1-19. |
| [26] |
CHEN L, LI H, CHEN Y, et al. Probiotic Lactobacillus rhamnosus GG reduces mortality of septic mice by modulating gut microbiota composition and metabolic profiles[J]. Nutrition, 2020, 78: 110863. |
| [27] |
SCHANZ O, CHIJIIWA R, CENGIZ S C, et al. Dietary AhR ligands regulate ahrr expression in intestinal immune cells and intestinal microbiota composition[J]. International Journal of Molecular Sciences, 2020, 21(9): 3189. |
| [28] |
ANHE F, PILON G, ROY D, et al. Triggering akkermansia with dietary polyphenols: a new weapon to combat the metabolic syndrome?[J]. Gut Microbes, 2016, 7(2): 146-153. |
 2023, Vol. 47
2023, Vol. 47


