文章信息
- 林德菊, 王楠, 李浩帅, 张海洋, 包锐. 2023.
- LIN De-ju, WANG Nan, LI Hao-shuai, ZHANG Hai-yang, BAO Rui. 2023.
- 海洋沉积物中铁保护的有机碳埋藏研究进展
- Preservation of sedimentary organic carbon protected by iron: a review
- 海洋科学, 47(6): 108-123
- Marine Sciences, 47(6): 108-123.
- http://dx.doi.org/10.11759/hykx20230927001
-
文章历史
- 收稿日期:2022-09-27
- 修回日期:2022-12-20
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458;
4. 中国海洋大学 海底科学与探测技术教育部重点实验室, 山东 青岛 266100;
5. 中国海洋大学 海洋地球科学学院, 山东 青岛 266100
2. Laboratory for Marine Ecology and Enviromental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China;
4. Key Laboratory of Submarine Geosciences and Prospecting Techniques, MOE, Ocean University of China, Qingdao 266100, China;
5. College of Marine Geosciences, Ocean University of China, Qingdao 266100, China
海洋沉积物中有机碳(organic carbon, OC)的埋藏和封存, 对大气中二氧化碳(CO2)的浓度具有长尺度的调控作用[1-2]。面对当前日益严重的全球变暖现象和频繁发生的极端气候事件, 合理揭示海洋和陆地碳汇与气候系统的互馈机理、阐明地质碳封存的过程机制和增汇潜力, 对于模拟和预测碳循环、加快实现碳中和至关重要。全球约有150 Pg(1 Pg=1015 g)的OC被封存在海洋表层沉积物中[1], 据研究, 这些OC中有相当大的比例(21.5%±8.6%)是通过与铁(Fe)发生相互作用才避免降解并被稳定埋藏下来[3]。铁与OC复合物的形成是有机碳在海洋沉积物中长久保存的重要因素之一, 需要重视和深入探究Fe对OC的保护作用。由于二者往往是相互耦合交联的[4-5], 我们对Fe的地球化学循环过程的理解和对碳的理解都具有重要意义。Fe作为地球表面最丰富的氧化还原敏感金属, 对地球化学循环以及海洋沉积物中碳、氧、硫和多种微量元素的去向有着深远的影响[6]。铁氧化物(包括Fe的氧化物, 氢氧化物以及羟基氧化物)作为主要的具有反应性的Fe, 主要通过河流和冰川颗粒物被运输到陆架边缘海[7], 在促进OC的埋藏中起着关键作用[8]。首先, 铁氧化物具有较大的比表面积和较高的吸附系数, 它的吸附能力比普通铝硅酸盐黏土至少高一个数量级[9-10], 对OC自然的物理吸附是二者发生相互作用的重要方式。其次, 铁氧化物还可以与OC通过强共价键连接在一起形成螯合物, 该相互作用通常发生在铁与有机碳在沉积物氧化还原界面中的共沉淀过程[3, 11], 有机金属螯合物的形成能够有效延缓海洋沉积物中有机碳的降解。由此可见, 铁氧化物在物理和化学性质方面都具备保护沉积物中OC的能力。
文献中Fe的定量提取实验表明, 在海洋沉积物中, 与Fe结合的OC(the OC associated with iron, OC-Fe)占比最高可达总有机碳(total organic carbon, TOC)的41.69%[3], 而在森林土壤中可高达57.75%[12]。铁氧化物能够通过吸附和共沉淀作用, 捕捉一定量的有机质, 使部分原本活性的、易于降解的OC避免微生物的降解, 稳定地埋藏在沉积物中[3]。除了对OC的保护作用, 铁氧化物还对其具有一定的转化作用。铁氧化物可作为OC的重要电子受体[13], 微生物的Fe还原过程往往伴随OC的氧化, 二者的交联占据边缘海沉积物中OC氧化过程的90%[13-14]。在有氧条件下, 铁氧化物还会进行非生物Fe(Ⅱ)氧化产生活性氧(ROS), 通过芬顿反应抵消OC的矿物保护, 促进OC分解和CO2排放[15]。该反应无处不在, 对碳循环起着双重作用: 刺激OC矿化, 并且由于剩余有机矿物复合物的顽固性增加而促进长期碳稳定[15-16]。此外, Barber等[17]的实验室培养研究结果表明, 活性铁氧化物的存在有利于优先保存溶解的藻类OC, 但同时会加速有机氮的降解。这表明, 有机质生物地球化学转化过程和沉积OC的命运在很大程度上受到活性铁氧化物保护和转化的调节作用。因此, 铁氧化物是沉积物中OC长久稳定存在的一个重要“生锈的碳汇”[3, 18]。
本文梳理了海洋沉积物中Fe对OC埋藏中发挥的作用, 并对全球各区域中OC-Fe的含量进行了讨论与评估, 探究沉积物中Fe与OC的相互作用对于深入理解碳封存机制和矿物的长久保护是非常有必要的。本文从以往的研究中得到新的启发: 1) OC-Fe的含量可能受到多种因素的制约: 如, 水动力过程对OC的搬运和分选; 海洋环境的氧化还原条件对Fe和OC的还原和再氧化的影响; 以及OC的源和OC的反应性等。2) 碳同位素方法用于研究被Fe保护的OC的源及其年龄分布; 3) Fe结合OC的过程, 即Fe对OC的保护机制, 认识到不同的海洋沉积环境能够显著影响二者结合机制, 并控制其封存的碳含量; 4) 铁循环与碳循环之间的密切生物地球化学联系对海洋碳的封存具有重要意义。综合来说, 理解Fe与OC在海洋沉积物中的相互作用是海洋碳循环研究的重点, 也是研究气候变化与全球碳循环之间作用和反馈的关键。
1 铁对有机碳的保护在含量上的体现准确测定OC-Fe的含量在确定和进一步量化Fe的保护作用方面是及其重要的。Lalonde等[3]提出, 海洋沉积物中的OC可以直接与Fe结合来避免降解, 在缺氧与正常水体下的沉积物, 深海与三角洲沉积物, 表层及其5 m下的沉积物中, Fe都在其含量上展现出较强的保护能力[3]。因此, 全面分析OC-Fe的含量可以帮助我们更加深入地评估Fe的保护作用, 并合理估算海洋中的碳封存潜力。
柠檬酸钠-碳酸氢钠-连二亚硫酸钠(bicarbonate- citrate-buffered dithionite, BCD)的铁还原方法常被用来还原并提取沉积物中的活性铁氧化物, 同时溶解基质中的OC-Fe[3, 19]。利用连二亚硫酸钠将Fe还原到溶液中, 与柠檬酸钠形成含Fe的螯合物使其稳定存在于溶液中。该反应在约中性的pH下进行, 碳酸氢钠作为缓冲液防止在酸性条件下发生有机物水解及其质子化和再吸附到沉积物颗粒上。同时, 设置一组对照实验, 用等离子强度的氯化钠代替柠檬酸三钠(络合剂)和连二亚硫酸钠(还原剂), 来排除实验中溶解有机碳的影响。实际OC-Fe的量为单独控制实验中剩余的有机碳量(OC控制)减去提取实验剩余沉积物中有机碳量[OC提取, 也就是不与铁结合的有机碳(the OC non associated with iron, OCnon-Fe)]的结果。即,
| OC−Fe(%)=OC控制 (%)−OC提取 (%), | (1) |
上述铁及其有机碳的提取方法被广泛应用到全球各地区的海洋沉积物中来估算OC-Fe的含量[3, 20-24]。利用OC-Fe在总有机碳(total organic carbon, TOC)中的比例(fOC-Fe):
| fOC−Fe(%)=100(%)×OC−Fe(%)TOC(%), | (2) |
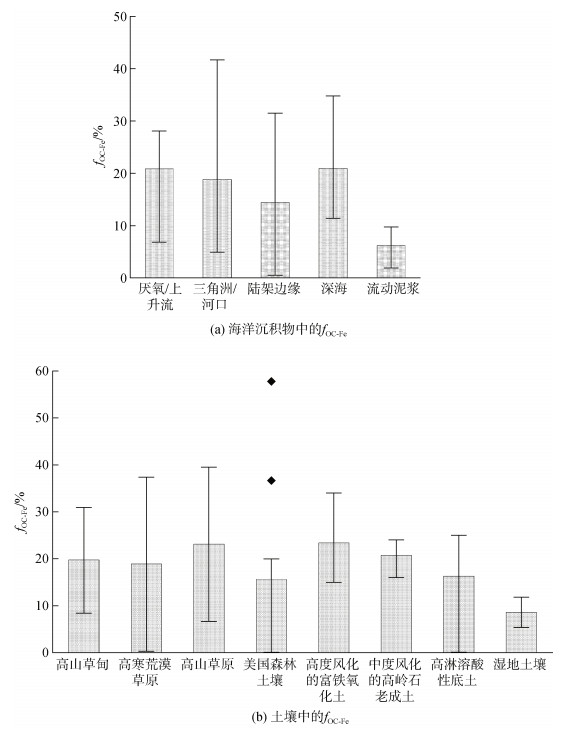
它将OC-Fe与TOC联系起来, 可能比OC-Fe含量更适合在TOC背景和可变的沉积物中进行比较[3, 20-24]。如图 1a所示, fOC-Fe在不同类型的海洋沉积物中的含量变化非常广泛, 其中在与含氧水体接触的陆架边缘海、三角洲和河口沉积物中, fOC-Fe的范围为0.51% ~ 41.7%[3, 20-24]; 在具有生产力驱动的季节性缺氧水域沉积物中fOC-Fe范围为10.81% ~ 28.09%[3]; 以及在深海沉积物中有12.16% ~ 34.79%的OC是与Fe结合的[3]。甚至在作为氧化还原反应器的流动泥浆中, 也发现了约1.89% ~ 9.72%的OC与Fe结合在一起[20]。与海洋沉积物相比, 土壤中Fe对OC的保护作用更为显著(图 1b), 在美国的森林土壤中fOC-Fe高达58%[12], 在高山和湿地等各种类型的土壤中均有高于10%的OC是通过与铁氧化物的相互作用而免于降解被封存下来的[8, 25-26]。Fe作为含量高且对氧化还原条件敏感的金属元素, 参与促进土壤中OC稳定存在的过程: Fe促进土壤团聚体的形成、Fe与土壤中的溶解有机碳发生共沉淀、Fe对部分OC的吸附作用以及Fe对土壤中微生物的作用等[27]。这些Fe与OC的相互作用过程, 造成了土壤OC与铁氧化物含量之间显著的相关性, 也表明铁氧化物在土壤中OC的积累和稳定中的重要性[8]。这一方面显示出与OC-Fe的含量在不同的地区展示出很大的空间异质性; 另一方面也进一步肯定了Fe对地球系统中的OC都存在实质性的保护作用。
沉积物中OC-Fe的广泛变化可能受到多种因素的影响, 包括研究区域的海洋水动力过程、氧化还原条件以及有机碳输入源的控制作用等。水动力过程在大陆边缘和深海矿物相关OC的扩散和分布中起着关键作用[28-30]。再悬浮过程会影响沉积在底层沉积物中的OC的组成和与矿物的相互作用[31], 反之, 有机质-矿物相互作用会控制着保存在沉积物中的OC的分布、组成和年龄, 从而影响有机质的反应性和流体力学性质[32-33]。再悬浮-沉积循环作用中的长时间沉积物夹带过程增强了OC的再矿化作用, 促使部分OC被释放到大气中, 而那些不进行再矿化的、稳定性相对较高的难溶有机碳则可能被埋藏下来成为沉积物中长期的碳汇[31, 34]。因此, 由水动力引发的再分配过程与有机质-矿物作用是相互影响和彼此制约的, 它们的不断变化时刻影响着海洋沉积物中OC的埋藏和气候变化。此外, Fe与OC的氧化还原过程与海洋水动力过程也是彼此联系的。再悬浮过程中伴随着沉积物被长时间夹带和暴露在有氧环境下, OC氧化的同时也会加快Fe的氧化还原循环[35]。例如, 东海内陆架流动泥浆中Fe的氧化还原循环降低了OC-Fe的含量[20, 36], 而渤海和黄海相对静止的沉积环境下较低的Fe含量却能够产生更多的OC-Fe含量[21, 37]。此外, OC源的输入在很大程度上控制着与Fe发生相互作用的OC的组成。在有大量陆源物质输入的边缘海地区, 如渤海和拉普捷夫海, OC-Fe可能会表现出较高的陆源信号[20, 24]。而在初级生产力较高的海洋环境中如黄海、东海和西伯利亚海, Fe倾向于优先捕获藻类和浮游植物生产的海洋新鲜OC, 二者之间的结合通常被认为是“可逆过程”, 即在海洋环境的物理改造过程中会中断结合, 出现海洋OC的氧化和降解[20, 23-24]。综上所述, 多种相互联系、相互交结的因素会影响OC在沉积物中的量和反应性, 进而控制和影响OC与Fe的相互作用过程。
2 碳同位素技术在铁与有机碳相互作用中的应用碳同位素技术可以帮助我们理解OC在海洋沉积物中的埋藏形式和过程。OC携带着产生它的生物体的信息[38], 可以指示生产者的身份和来源, 从而揭示其在生态系统中的位置。天然合成的有机化合物的碳同位素组成取决于所利用的碳源、与生产者对碳吸收相关的同位素效应、与代谢和生物合成相关的同位素作用以及细胞组织内的碳转化与收支[38]。自然界中的碳有2个稳定同位素(12C和13C), 沉积物有机碳的2个同位素的相对丰度经过标准物的校正后可获得稳定碳同位素比值13C/12C(该比值通常用δ13C表示)。陆源植物通常比海洋植物含有更丰富的轻质同位素12C, 进而二者有着不同的稳定碳同位素比值[39]。海洋浮游植物的δ13C值通常为–19‰ ~ –22‰; 陆源C3植物的δ13C值为–26‰ ~ –28‰, C4植物的δ13C值为–10‰ ~ –16‰[40-42]。利用稳定碳同位素组成及其变化趋势, 可以探究陆源物质从河流进入海洋后的运移轨迹并估算陆源和海洋有机碳在沉积物中的相对比例。因此, 将稳定碳同位素分析方法用于研究陆架海洋沉积物, 可以揭示海洋沉积动力学和沉积环境并探讨沉积物来源。
除了稳定性碳同位素, 放射性碳同位素14C也是研究海洋生物地球化学循环的有力手段。在大气中形成的放射性碳会结合氧转化为CO2, 并通过物理(如海水溶解)和生物(如光合作用)过程进入生物地球化学循环[43-44]。陆生和海洋植物有着截然不同的14C信号, 异养消费者获得碳的比例基本上与其食物来源相同。生物体存活时, 其14C含量保持和反映其碳源的水平; 生物体死亡后, 它与环境之间的碳交换停止, 此后放射性碳的含量仅由衰变控制[44]。因此, 放射性同位素14C追踪碳在环境储层中的路径和停留时间的能力可以用于研究海洋生物地球化学循环。利用稳定碳同位素和放射性碳同位素的分析技术, 这可以让我们从不同角度去研究埋藏于沉积物中数千年乃至万年的OC的信息。这些OC的同位素信息相当于是碳的“指纹”, 可以利用它去以古鉴今, 了解过去的OC沉积历史, 预测未来的碳汇潜力。
将碳同位素方法应用到研究Fe与OC的相互作用方面, 可以从多个角度提供更多Fe与OC相互性作用的信息。不仅可以了解OC-Fe的组成、性质及其反应性, 还可以进一步评估Fe在促进OC保存有机地球化学循环中的作用。Fe提取实验和控制实验后剩余沉积物中经酸处理除去无机碳后, 利用同位素质谱仪测定其δ13C, 根据同位素质量平衡即可换算出OC-Fe的δ13C(δ13C-Fe)[3, 23-24], 即,
| 100(%)×δ13C控制 (‰)=(100(%)−fOC−Fe(%))×δ13C提取 (‰)+fOC−Fe(%)×δ13C−Fe(%), | (3) |
| δ13C−Fe(‰)={100(%)×δ13C控制 (‰)−[100(%)−fOC−Fe(%)]×δ13C提取 (‰)}/fOC−Fe(%), | (4) |
利用加速器质谱仪测定其放射性碳同位素值, 同样根据同位素质量平衡换算出OC-Fe的Δ14C(Δ14C-Fe)[24], 即,
| 100(%)×Δ14C控制 (‰)=[100(%)−fOC−Fe(%)]×Δ14C提取 (‰)+fOC−Fe(%)×Δ14C−Fe(‰), | (5) |
| Δ14C−Fe(‰)=[100(‰)×Δ14C控制 (‰)−(100(%)−fOC−Fe(%))×Δ14C提取 (‰)]/fOC−Fe(%), | (6) |
δ13C控制和δ13C提取[也指不与铁结合的有机碳的δ13C (the δ13C non associated with iron, δ13Cnon-Fe)]分别是控制实验和Fe提取实验中剩余沉积物的稳定碳同位素值, Δ14C控制和Δ14C提取[也指不与铁结合的有机碳的Δ14C (the Δ14C non associated with iron, Δ14Cnon-Fe)]分别是控制实验和Fe提取实验中剩余沉积物的放射性碳同位素值。
δ13C-Fe可以用来解释OC-Fe的组成并反映其来源[3, 22-23]。广义上, 将海洋沉积物中的有机物作为海洋来源与陆源的混合物质, 前者比后者OC具有较低的C/N比和较高的δ13C值[45]。海洋有机物通常被认为是浮游植物或生物碎屑, 其化学成分主要是蛋白质(氨基酸)、碳水化合物(糖)和脂质。陆地有机质包括活的生物体、植物凋落物和土壤有机质(如土壤腐殖质[1]), 主要以溶解态或颗粒态形式通过河流输运被带入海洋。与海洋OC混合后在海洋流体力学和氧化还原条件下被进一步改造为具有复杂的组成和性质的OC团聚体。
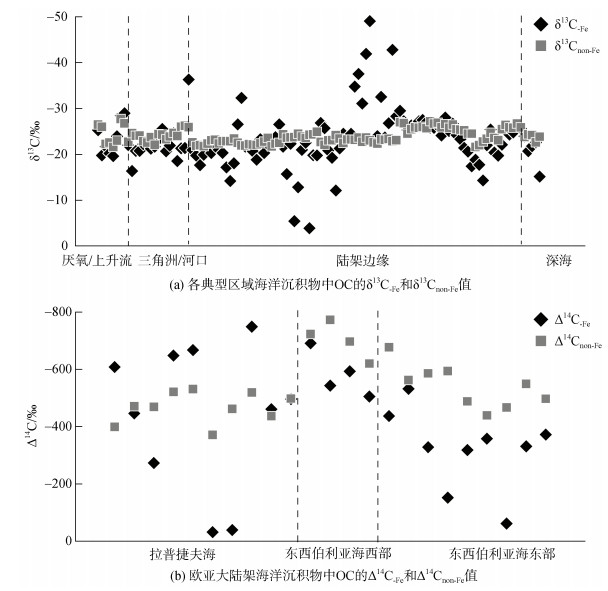
目前全球各地区的研究结果显示(图 2a), δ13C-Fe和δ13Cnon-Fe在全球海洋沉积物中并没有表现出一致的规律。据分析, OC的来源很大程度上影响了Fe所能结合的OC的组成, 即OC-Fe取决于沉积物中的OC是海洋或陆地OC占主导。Lalonde等[3]的研究结果表示, 在各地区表层沉积物中δ13C-Fe普遍表现出高于δ13Cnon-Fe, 偏正1.7‰±2.8‰。富含13C的天然有机化合物(蛋白质和碳水化合物[46])同时含氮和氧元素, 更有利于与Fe的结合。这种高度不稳定的有机化合物与Fe的优先结合可以解释为什么活性有机化合物可以被稳定保存在沉积物中, 而其他活性不强的有机分子则会被降解[3]。然而, 这一现象和解释并不适用于全球所有海洋地区, 比如, 在欧亚大陆边缘出现了两种截然不同的情况, 欧亚大陆边缘的卡拉海和拉普捷夫海表层沉积物中δ13C-Fe大部分表现出低于δ13Cnon-Fe的现象; 而西伯利亚海域则与之相反, 表层沉积物中δ13C-Fe普遍高于δ13Cnon-Fe[24]。对此现象的解释是OC-Fe的同位素组成受到OC的输入来源影响。西伯利亚海域受太平洋水流的影响, 海洋浮游植物是大量OC的重要来源[47-48]; 而拉普捷夫海则受到附近冻土中融化的预老化的冻土OC输入的影响, 造成Fe会更多地结合陆源OC[24]。这表明了OC来源影响了Fe对OC的捕获和封存, 并显著地表现在δ13C-Fe上。
此外, Fe的氧化还原过程在影响OC-Fe含量的同时也可能会造成δ13C-Fe的变化。中国边缘海中的黄海地区, 生物标志物的混合模型显示该区域内海洋OC占据绝对的主导地位, 约为59% ~ 100%[49], 在该地区δ13C-Fe比13Cnon-Fe表现出更少的损耗, 这可能意味着在黄海中部沉积物中不稳定的海源OC被选择性封存[23]。黄海地区独特的水文地球化学状态可以促进Fe在沉积物的好氧-缺氧界面的氧化还原循环[21, 50]。Fe的氧化还原循环增强, 会倾向于选择性地结合不稳定且13C损耗较少的脂肪族化合物[51-53], 并优先释放更多13C贫瘠的芳香族和木质素类的化合物[51-52]。而在渤海地区, OC-Fe表现出显著的陆源信号, 这表明富含芳香族和类木质素部分的陆生OC化合物优先封存[21]。这一方面受到黄河陆源物质输入的影响, 另一方面, 渤海频繁的沉积物再悬浮[54]可能会极大地抑制沉积物中Fe的氧化还原循环。这可能是渤海沉积物中的δ13C-Fe显著低于δ13Cnon-Fe的主要原因。东海则相对更加复杂, δ13C-Fe有着更加广泛的变化, 有些站位沉积物中δ13C-Fe高于δ13Cnon-Fe, 而有些偏低[20, 23]。较高的海洋生产力和季节性洋流虽然能够补充大量海洋有机碳, 但陆源有机碳高通量的输入和流动泥浆中有机碳的有效氧化[20], 会使东海部分地区沉积物中的δ13C-Fe表现较多陆源信号。另一方面, Fe在该地区的氧化还原循环促进了Fe与海洋不稳定脂肪族化合物的相互作用。这意味着, Fe的氧化还原循环可能导致OC-Fe的成分和同位素分馏程度不同, 而这一过程很大程度上取决于氧化还原状态[21, 23]。因此, OC-Fe的变化可能是铁氧化物选择性结合OC和缺氧条件下Fe还原溶解期间选择性释放OC的净结果。
放射性同位素14C技术作为表征海洋沉积物中OC来源和循环的重要工具。它不仅反映OC的年龄, 还可以解释OC的沉积过程、埋藏的OC的来源、性质等。比如, 利用大洋水体中14C的断面分布区来验证大洋环流对海洋中碳循环的影响, 北太平洋和北大西洋的14C年龄差异可以精确地计算大洋底层水循环的时间尺度[55]。此外, 开展单一有机分子的14C研究可以帮助我们了解海洋沉积物中的OC组成和转化[56]。14C也可以反映沉积物扩散路径中OC年龄的变化, 解释水动力驱动下横向运移过程中有机质的老化是大陆架碳循环的一个重要组成部分[31, 57]。然而, 利用14C技术研究海洋沉积物中Fe与OC相互作用的研究还相对较少, 以欧亚大陆边缘的相关研究为例, Δ14C-Fe结果有着广泛的变化范围(图 2b), 包含年轻和古老的OC[24]。这一结果在很大程度上受到OC来源的影响, 在以海洋OC为主的西比利亚海域, Δ14C表现出的OC-Fe的年龄低于OCnon-Fe的年龄。相反, 有大量融化的冻土OC输入的拉普捷夫海, OC-Fe的年龄则表现较老。利用14C进行的端元混合模型显示, 欧亚大陆边缘中, 冻土OC占OC-Fe比例的44% ~ 78%。由此可见, 14C技术在研究矿物-有机碳的相互作用方面具有显著的优势, 是一种极为灵敏、有效的研究手段, 这对我们了解不同有机化合物与矿物在海洋中的来源、分解和转换过程以及从评估碳封存潜力的角度了解海洋中OC的循环都有重大的意义。
碳同位素技术在研究OC在海洋沉积物中的沉积物和矿物-有机碳的相互作用方面都有着显著的优势。以海洋沉积物不同组成的有机化合物为研究对象而开展的研究对于了解沉积物的沉积环境以及古海洋地质都具有很大意义。利用这些指标深入地分析铁-有机碳的相互作用的过程及其变化机理, 既可以评估当前海洋环境下Fe对OC表现出的保护能力, 还可能量化未来碳输入下Fe对OC的保护作用和评估海洋碳汇潜力。
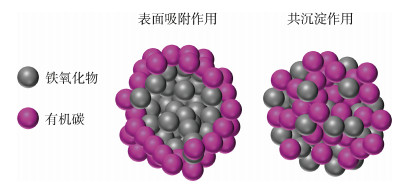
3 铁与有机碳的相互结合机制海洋沉积物中OC可以直接与铁氧化物结合来达到稳定存在[3], 但对于Fe和OC是否真正发生化学结合, 协同的变化是否是由每种元素对同一颗粒表面具有高亲和力引起的, 机理仍尚未明晰。由于海洋沉积物与上覆水体界面中氧化还原条件是不断变化的, 而氧化还原条件的变化导致了Fe和OC的化学性质及其组成变得复杂[58]。目前的研究表明, Fe与OC之间的相互作用机制主要为表面吸附作用和/或共沉淀作用。表面吸附机制是指OC不参与铁氧化物内部的改造, 仅以OC表面涂层的形式存在于铁氧化物表面[59-61](图 3a, b)。而共沉淀机制则是OC参与到铁氧化物形成的过程中, 并以含OC的铁氧化物颗粒形式存在[62-63](图 3c, d)。吸附和共沉淀机制是两种OC参与方式完全不同的铁-有机碳结合形式, 也是OC能够在沉积物中保存和积累的最重要的相互作用方式[3, 11]。
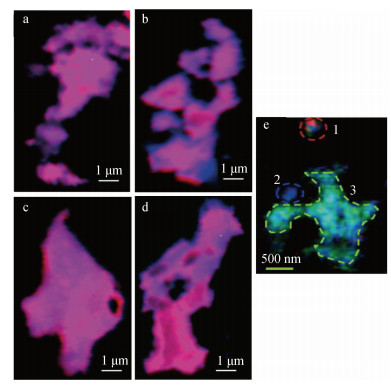 |
| 图 3 铁与有机碳络合物的X射线吸收精细结构谱[70]和扫描透射X射线显微镜图像[71] Fig. 3 Color-coded composite maps of iron and organic carbon by X-ray absorption fine structure[70] and scanning transmission X-ray microscopy[71] 注: a-d图是X射线吸收精细结构谱, a和b表示C/Fe的摩尔比分别为1.5和4.5的吸附络合物, c和d表示C/Fe的摩尔比分别为1.5和4.5的共沉淀络合物, 蓝色代表碳, 红色代表铁; e图为扫描透射X射线显微镜图像, 表示碳的不同官能团在铁上的分布, 红色、蓝色和绿色分别代表富含芳烃、氨基和羧基组分 |
Fe与OC之间的吸附机制已经被广泛研究, 主要吸附方式包括静电相互作用[64-65]和配体交换表面络合[64, 66]等。表面电荷是静电相互作用的一个关键控制因素[67], 这是因为OC分子带有几个带负电荷的官能团, 包括羧基(—COO–和—COOH)和酚羟基(—OH), 它们可以通过静电相互作用吸附到带有正表面电荷的Fe氧化物上[67-68]。而配体交换是指OC的官能团, 如—COOH和—OH, 与Fe氧化物上的—OH发生部分的配体复合, 形成球内络合物[60, 67, 69]。研究表明, 以配体交换方式为主的多种吸附方式共存的OC-Fe结合机制是OC能够在海洋沉积物中积累和保存的重要作用方式。
发生在海洋沉积物中的铁氧化物与OC的吸附机制受到多种因素的影响, 包括但不限于铁氧化物和OC的种类组成, 存在介质的pH变化, 离子强度和组成, 以及存在环境的温度等。其中, 种类组成是最能够影响吸附机制的关键和本质原因[59-60]。每种Fe氧化物都有其独特的形态、表面特征和结晶度, 更大的比表面积和吸附位置可以为铁氧化物提供更高的吸附亲和力和吸附容量[72-73]。低结晶度的铁氧化物(例如铁氢化物, 水铁矿和施氏矿物)通常比高结晶度的铁氧化物(例如赤铁矿、针铁矿和磁铁矿)对OC的吸附能力大[61, 74-75]。大多数铁氧化物不稳定, 在条件允许的情况下, 往往会发生矿物转化, 从而形成更多结晶的热力学相[76-77]。OC的组成和性质对其在铁氧化物表面的吸附机制也至关重要。大量研究表明, 铁氧化物对OC可能存在选择性保护和降解[20, 22-23, 51, 78]。Shields等[22]的研究中发现溶解的芳香酸和木质素衍生的OC会优先被活性铁保存。Adhikari等[51]发现, 芳香族碳优先被赤铁矿吸附, 而不是脂肪族碳被吸附。Sowers等[78]表明, 细菌生成的铁氧化物与芳香族和含羧基OC之间存在更大的亲和力。Zhao等[20]的调查中发现, 频繁的物理再改造会减少铁氧化物对OC的保护并选择性地丢失海洋OC。铁氧化物和OC的种类组成及其性质能够从多个角度对二者之间的吸附机制产生影响。
此外, pH, 离子强度和温度也会影响铁氧化物对OC的吸附作用。OC和铁氧化物的电荷都依赖于pH, OC的形态也依赖于pH。大量研究显示pH可以通过改变铁氧化物的电离和OC的表面官能团来影响吸附容量[60, 79]。Bäckström等[80]发现针铁矿对OC的吸附能力从pH=3 ~ 7.5时的90%降低到pH=10时的10%。因此, pH也是OC吸附到铁氧化物上的决定性因素。其次, 在高离子强度下, 铁氧化物表面的双电层厚度减小, 因此静电斥力减小。但离子强度的增加可能会使其他物质和OC竞争吸附位置, 导致被吸附的OC减少[81]。在某些情况下, 如吸附剂和吸附质之间的排斥作用, 增加离子强度有利于吸附[82-83], 一些共存阳离子反而增加铁氧化物对OC的吸附能力[84]。温度也会影响OC在铁氧化物上的吸附, OC在铁氧化物上的吸附随温度升高而增加[85]。铁氧化物对OC的吸附作用是较为敏感的, 受到多种因素的共同影响, 了解海洋环境的变化对于加快OC在海洋沉积物中的稳定和积累至关重要。
除了吸附机制, 铁氧化物与OC之间的共沉淀机制在有机碳的埋藏过程中也发挥了重要作用。Fe(Ⅲ)水解并立即与OC结合形成新的铁氧化物, 同时发生OC与铁氧化物的沉淀, 定义为“共沉淀”[62]。铁氧化物对OC的吸附已引起广泛关注, 但针对二者之间的共沉淀机制开展的研究相对较少。Fe(Ⅲ)和OC的共沉淀有多种方式, 包括包裹、堵塞和吸附, 这可以解释为OC进入到铁氧化物结构、OC在生长的铁氧化物晶体中的物理堵塞, 以及OC在新形成的铁氧化物上的吸附[59, 86]。水解的Fe离子与有机分子相互作用, 形成铁-碳复合物[86-87]。随着Fe离子水解的继续成长和聚集成更大的铁氧化物颗粒, 当颗粒的大小可能超过有机分子的大小, 就实现了进一步的吸附反应, 在聚集过程中, 共沉淀中的铁氧化物捕获的有机分子往往“嵌入或封闭”在铁-碳复合物中[86-87]。与之前存在的铁氧化物表面的OC涂层吸附不同, 共沉淀最终会形成混有OC的较纯的铁氧化物[59, 70]。共沉淀机制几乎完全区别于吸附机制, 主要在于OC是否真正参与到了铁氧化物的形成和稳定存在。
相关研究结果表明, 影响铁氧化物和OC共沉淀的主要因素是沉积物中OC-Fe与Fe的摩尔比(即碳铁摩尔比)、OC的种类组成和pH。增加的碳铁摩尔比可能会增加铁氧化物与OC之间反应的可能性[59]。Eusterhues等[89]的一项调查表明, 随着初始碳铁摩尔比的增加, 共沉淀的碳浓度增加。此外, 随着沉积物中pH的降低, 有机官能团(主要是—COOH)的质子化降低了有机聚电解质在低pH下的溶解度, 金属对有机结合位点的竞争也相应增加, 从而降低了Fe诱导絮凝和OC沉淀的影响[59]。铁氧化物和OC之间的共沉淀是选择性的: 在低碳铁摩尔比条件下, Fe(Ⅲ)优先与OC中的芳香碳发生共沉淀[70]。而在Henneberry等[71]的扫描透射X射线显微镜(STXM)图像显示, OC-Fe主要为富含羧基的官能团, 而富含氨基和芳烃官能团的富集区与Fe含量呈负相关(图 3e)。Lalonde等[3]发现富含13C的蛋白质和碳水化合物很容易与Fe形成内环复合物, 并优先保存。Eusterhues等[90]发现, 在森林表层土壤中, 铁氢化物主要与水溶性多糖结合, 如甘露糖和葡萄糖, 当发生共沉淀时, 这种选择性结合更为明显。与OC共沉淀不仅会改变铁氧化物的表面性质[62], 还会干扰其晶体结构[89], 导致Fe-OC复合物高度无序[86], 这都会对铁氧化物和OC的反应性和稳定性产生影响[70, 91]。
综上所述, 共沉淀机制和吸附机制之间存在显著差异。在地球系统中, 吸附可能是Fe与OC在地球系统中最为普遍且易于发生的结合方式, 吸附络合物是OC通过表面吸附在先前存在的铁氧化物表面变为OC涂层而形成的, OC在吸附过程并不改变铁氧化物的结晶状态及其内部结构, 但能改变其矿物表面性质(图 4)。共沉淀是OC进入铁氧化物内部[63], 对其晶体结构内部进行包裹和堵塞, 以及在新形成的铁氧化物上的嵌入行为[86](图 4)。与吸附复合体不同, 共沉淀通常包含铁氧化物和含OC的铁氧化物的可变混合物[62]。此外, 与吸附复合物相比, 共沉淀可能会封存更多OC[70], 并且其中的铁氧化物和OC比吸附复合物中的更“均匀混合”[59, 88], 更重要的是共沉淀中的OC更稳定且不容易释放[87, 92]。
铁-有机碳之间的相互作用在促进海洋OC的储存方面发挥了重要作用。海洋作为全球最大的碳库, 海水中溶解OC约1 000 Pg, 溶解无机碳37 400 Pg[93], 沉积物每年吸收约2 Pg CO2, 是大气CO2唯一的净汇[94], 具有较大的固碳空间, 海洋生态系统在全球碳循环中发挥决定性作用[95]。上述我们提到Fe有利于海洋沉积物中有机碳的封存, 因此, 阐明碳循环与铁循环的生物地球化学联系能够帮助我们正确认识和理解海洋中“生锈的碳汇”的概念。
海洋碳循环是全球碳循环中的关键环节, 对全球气候控制与调节具有重要作用[96-97]。大气中的CO2进入海水后通过真光层内浮游植物的光合作用被转化为颗粒有机碳和溶解有机碳, 一部分溶解有机碳通过异养细菌形成颗粒有机碳, 转移至各级动物。各级动物的消费、排泄和浮游动植物的死亡、分解等会产生大量的碎屑、粪团, 使颗粒有机碳沉降[98]。溶解有机碳主要分布在海水真光层, 也会通过海水的垂直混合作用发生迁移[99]。外壳和骨骼中含有碳酸钙的海洋生物的死亡、珊瑚沉积和颗粒无机碳的沉降造成的无机碳的转移[98]。除了垂直转移, 碳的水平输送也是海洋碳循环的重要环节。通过海洋环流、沿岸边界流和上升流、水平对流等作用, 碳和营养盐可以从高初级生产力的河口和近海陆架向斜坡区再到大洋区转移, 提高外海的CO2储存能力[100]。在整个海洋碳循环过程中, 碳的转化和迁移通常会伴随其他元素的耦合, 在一定程度上会影响碳的循环路径。
铁循环的驱动因素比碳循环更为复杂, 主要作用包括深海Fe源、Fe在下沉过程中的清除与再生, 以及具有明显铁-配体特征的水团从高纬度俯冲并向赤道方向输送[101]。Fe作为微量元素在海洋中出现, 其分布具有空间异质性。研究表明, 沉积物和热液的Fe供应推动了高纬度地区的海洋碳循环, 浮游动物和细菌通过铁循环维持生物活动[101-102]。由于高纬度地区往往Fe有限, Fe浓度影响的群落产生的配体和溶解Fe的耗尽留下了过量的Fe配位体, 这些配位体可以被俯冲并向赤道方向运输[103]。而低纬度地区的粉尘供应有助于维持海洋的氮固定, 相关的Fe供应促进了毛壳菌和其他重氮营养菌的固氮[101]。在海洋表层和沉积到海洋内部的过程中, 灰尘可能充当Fe的来源或汇。例如, 在富含Fe的地中海, 由于颗粒清除能力的增强, 灰尘沉积消耗了溶解的Fe含量[104]。低纬度地区的地下Fe将受到下沉有机物质的局部Fe再生和清除成岩和有机颗粒之间的平衡的影响[105]。此外, 铁氧化物的动力学稳定性、Fe(Ⅱ)的快速氧化和Fe(Ⅲ)在含氧水中的低溶解度确保了只要水体中含有溶解氧, Fe就会被捕获在沉积物中[106]。Fe循环对海洋中营养物质和生态群落的平衡起到至关重要的作用。
铁循环与碳循环之间的密切生物地球化学联系是值得关注的。浮游植物的光合作用是海洋固定大气CO2的主要方式, 是海洋动植物食物网碳循环的主要推手, Fe的利用与再生为该网络的运行提供了驱动力(图 5)。Fe是浮游植物生长和存活所需的最重要的微量营养素之一。它是金属酶和蛋白质的辅因子, 对光合作用、呼吸、电子传递、硝酸盐还原和活性氧的解毒等代谢过程至关重要。浮游植物、细菌和病毒的Fe再生作用在Fe的生物供应中扮演着“中转站”的作用。有研究发现, Fe的吸收对于碳循环有着根本的影响, 添加Fe刺激浮游植物生长和光合效率并有利于提升浮游植物的固碳效率[107]。Firme等[108]的Fe添加实验, 证明了Fe限制浮游植物的生长, 主要因为钝化了体内OC的合成。同时, 有研究表明, 有机配体可以控制海水中溶解Fe的浓度[109]。由此可见, 海洋中碳循环与铁循环是相互影响相互交结的, 在一定程度上作用于对碳在海洋中的迁移与埋藏。
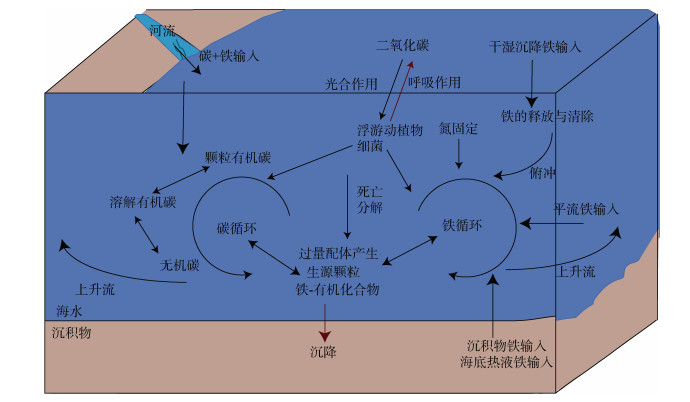 |
| 图 5 海洋碳循环与铁循环关系示意图 Fig. 5 Schematic of the links between iron and carbon cycling |
微生物-铁的相互作用可能影响长期碳转化、储存和周转[110]。海洋中大部分的生物Fe存在于微生物体内[111], 自养细菌的光合作用需要Fe的参与, 异养细菌在电子传输中也需要Fe作为催化剂[112], 这些过程都存在生物OC的积累与转化。此外, 微生物介导下Fe的氧化还原也在一定程度上驱动着碳循环。铁氧化菌在进行Fe氧化的同时需要C的参与, 例如, 自养型硝化菌会从CO2中获得C并在酶的作用下氧化铁, 而化学反硝化菌则不需要酶只供给有机碳就可进行铁的氧化[113]。而铁还原菌的机制则相对复杂, 在一定条件下, Fe的溶解和C的释放是由微生物介导的异化铁还原带动的, 在厌氧环境中利用铁还原酶的催化, 将电子传递给末端受体Fe并产生其所需能量。这一过程有时会伴随OC的氧化, 也可能会减小铁氧化物的表面积而降低碳封存潜力, 将OC释放出使其更容易受到微生物降解[110]。由此可见, 微生物在碳-铁循环过程中发挥着重要作用。
探究海底沉积物中碳-铁循环的相互作用对OC的长时间尺度的封存具有重要意义。一方面, 含Fe的有机配体在向下沉降清除的过程中, 部分会被转移至沉积物中; 另一方面, 含碳物质在沉积物中与Fe化合物接触。在有氧或生物扰动的情况下, 伴随着种类的变化, 碳-铁可能会不断解除-重新耦合并进一步达到碳封存。Fe和OC之间的相互作用最可能在有机质最易降解的含氧沉积物中形成。研究表明, 与单独的有机化合物相比, OC-Fe的降解速率显著降低[114]。OC与Fe的结合机制可能是通过配体交换, Fe表面的羟基被OC的电负性官能团所取代[115]。Fe的保护持续的时间尺度在很大程度上取决于解吸或反络合的速率[116]。如果铁-有机碳络合物没有被分解, 那么该络合物可能会保存足够长的时间, 从而被逐渐埋藏在有机质降解率低得多的缺氧沉积物中。在这种情况下, Fe可能穿梭在碳循环过程中, 在氧化还原条件发生变化时OC的反复溶解和再沉淀过程, 从含氧表层沉积物到缺氧沉积物。
在海洋沉积物中, Fe可能还调节碳保存和再矿化之间的平衡。在含氧和缺氧之间快速过渡的流动泥浆是研究Fe的氧化还原化学与OC之间关系的理想场所。与“正常”沉积环境相反, 快速氧化还原循环导致Fe(Ⅱ)自发的再氧化, 通过超氧自由基的分解生成过氧化物, 特殊的条件组合也在含氧-缺氧界面处产生了Fe和有机质之间复杂的相互作用, Fe加速了这些泥浆中OC的降解速率[117]。过渡的氧化还原条件使沉积物界面富含活性铁氧化物, 这些活性铁氧化物从溶解的Fe(Ⅱ)中沉淀, 并从下方的缺氧区扩散[58]。沉积物含氧表层中氧化铁的沉淀通过凝固去除了大量溶解有机碳。质谱结果显示, 当富含羧基的脂肪族保留在溶液中时, 芳香族和热解化合物优先附着在Fe的氧化还原界面上[118]。Fe还改变了黏土颗粒的表面化学, 增加了颗粒对溶解有机碳、痕量金属和磷酸盐的亲和力, 并限制了溶液和颗粒之间溶质的流动性[119]。Fe作为地球上许多碳产生、降解和封存的关键元素, 可能对进一步解决相关的有机地球化学问题至关重要。
5 总结总的来说, Fe在促进沉积物OC保存中发挥了至关重要的作用。通过对过去研究的梳理与总结, 我们1) 从含量、性质及其影响因素等方面系统论述了不同地区中Fe对OC埋藏的保护程度; 2) 利用碳同位素方法了解OC-Fe的组成、性质及其反应性, 从多个角度提供Fe与有机碳相互作用的信息, 进一步评估Fe在促进OC保存的有机地球化学循环中的作用; 3) 探究铁-有机碳结合机制可以从相对微观的角度去分析Fe对OC保存的影响, 进一步推测Fe在促进OC埋藏过程中可能存在的更大潜力; 4) 碳循环与铁循环相互作用的生物地球化学联系对OC长时间尺度的封存具有重要意义。揭示沉积物中Fe与OC的相互作用对于深入理解碳封存机制和矿物的长久保护是非常有必要和有意义的。
理解OC在海洋沉积物中的长期保存机制一直是海洋碳循环研究的重点, 也是研究气候变化与全球碳循环之间作用和反馈的关键。为了更好地了解OC-Fe的结合在延缓当前气候变化过程中所起的作用, 在对气候变化响应敏感的极地地区开展相关研究是很有必要的, 准确判断铁结合有机碳的分布、来源和结合方式, 理清铁氧化物延缓有机碳分解和释放到大气中的程度和机制。此外, 除了加强对Fe与OC的作用机制的定量研究外, 还应开展更多深入性的研究, 例如, 铁结合的有机碳的结构组成; 不同种类的铁氧化物在有机碳的埋藏过程中的贡献; 铁与有机碳结合形成团聚体后在沉积物中的变化; Fe与OC的相互作用在极端环境(如冷泉热液等)与正常海洋沉积环境下是否存在显著性差异。这些问题都是今后研究的重点, 也是探究OC-Fe在地球系统中的命运和评估地球碳封存潜力的关键。
| [1] |
HEDGES J I, KEIL R G. Sedimentary organic matter preservation: an assessment and speculative synthesis[J]. Marine Chemistry, 1995, 49(2/3): 81-115. |
| [2] |
BLAIR N E, ALLER R C. The fate of terrestrial organic carbon in the marine environment[J]. Annual Review of Marine Science, 2012, 4: 401-423. DOI:10.1146/annurev-marine-120709-142717 |
| [3] |
LALONDE K, MUCCI A, OUELLET A, et al. Preservation of organic matter in sediments promoted by iron[J]. Nature, 2012, 483(7388): 198-200. DOI:10.1038/nature10855 |
| [4] |
BERNER R A. Sedimentary pyrite formation[J]. American Journal of Science, 1970, 268(1): 1-23. DOI:10.2475/ajs.268.1.1 |
| [5] |
RUE E L, BRULAND K W. Complexation of iron (Ⅲ) by natural organic ligands in the Central North Pacific as determined by a new competitive ligand equilibration/adsorptive cathodic stripping voltammetric method[J]. Marine Chemistry, 1995, 50(1/4): 117-138. |
| [6] |
RAISWELL R, CANFIELD D E. The iron biogeochemical cycle past and present[J]. Geochemical Perspectives, 2012, 1(1): 1-220. DOI:10.7185/geochempersp.1.1 |
| [7] |
POULTON S WRAISWELL R. Chemical and physical characteristics of iron oxides in riverine and glacial meltwater sediments[J]. Chemical Geology, 2005, 218(3/4): 203-221. |
| [8] |
WAGAI R, MAYER L M. Sorptive stabilization of organic matter in soils by hydrous iron oxides[J]. Geochimica et Cosmochimica Acta, 2007, 71(1): 25-35. DOI:10.1016/j.gca.2006.08.047 |
| [9] |
KAISER K, GUGGENBERGER G. Sorptive stabilization of organic matter by microporous goethite: sorption into small pores vs. surface complexation[J]. European Journal of Soil Science, 2007, 58(1): 45-59. DOI:10.1111/j.1365-2389.2006.00799.x |
| [10] |
CHOROVER J, AMISTADI M K. Reaction of forest floor organic matter at goethite, birnessite and smectite surfaces[J]. Geochimica et Cosmochimica Acta, 2001, 65(1): 95-109. DOI:10.1016/S0016-7037(00)00511-1 |
| [11] |
MAYER L M. Extent of coverage of mineral surfaces by organic matter in marine sediments[J]. Geochimica et Cosmochimica Acta, 1999, 63(2): 207-215. DOI:10.1016/S0016-7037(99)00028-9 |
| [12] |
ZHAO Q, POULSON S R, OBRIST D, et al. Iron-bound organic carbon in forest soils: quantification and characterization[J]. Biogeosciences, 2016, 13(16): 4777-4788. DOI:10.5194/bg-13-4777-2016 |
| [13] |
CANFIELD D E, THAMDRUP B, HANSEN J W. The anaerobic degradation of organic matter in Danish coastal sediments: iron reduction, manganese reduction, and sulfate reduction[J]. Geochimica et Cosmochimica Acta, 1993, 57(16): 3867-3883. DOI:10.1016/0016-7037(93)90340-3 |
| [14] |
KRISTENSEN E, MANGION P, TANG M, et al. Microbial carbon oxidation rates and pathways in sediments of two Tanzanian mangrove forests[J]. Biogeochemistry, 2011, 103(1): 143-158. |
| [15] |
CHEN C M, HALL S J, COWARD E, et al. Iron- mediated organic matter decomposition in humid soils can counteract protection[J]. Nature Communications, 2020, 11: 2255. DOI:10.1038/s41467-020-16071-5 |
| [16] |
YU G H, KUZYAKOV Y. Fenton chemistry and reactive oxygen species in soil: Abiotic mechanisms of biotic processes, controls and consequences for carbon and nutrient cycling[J]. Earth-Science Reviews, 2021, 214: 103525. DOI:10.1016/j.earscirev.2021.103525 |
| [17] |
BARBER A, LALONDE K, MUCCI A, et al. The role of iron in the diagenesis of organic carbon and nitrogen in sediments: a long-term incubation experiment[J]. Marine Chemistry, 2014, 162: 1-9. DOI:10.1016/j.marchem.2014.02.007 |
| [18] |
EGLINTON T I. A rusty carbon sink[J]. Nature, 2012, 483(7388): 165-166. DOI:10.1038/483165a |
| [19] |
MEHRA O P, JACKSON M L. Iron oxide removal from soils and clays by a dithionite-citrate system buffered with sodium bicarbonate[J]. Clays and Clay Minerals, 1958, 7(1): 317-327. DOI:10.1346/CCMN.1958.0070122 |
| [20] |
ZHAO B, YAO P, BIANCHI T S, et al. The role of reactive iron in the preservation of terrestrial organic carbon in estuarine sediments[J]. Journal of Geophysical Research: Biogeosciences, 2018, 123(12): 3556-3569. DOI:10.1029/2018JG004649 |
| [21] |
WANG D, ZHU M X, YANG G P, et al. Reactive iron and iron-bound organic carbon in surface sediments of the river‐dominated Bohai Sea (China) versus the Southern Yellow Sea[J]. Journal of Geophysical Research: Biogeosciences, 2019, 124(1): 79-98. DOI:10.1029/2018JG004722 |
| [22] |
SHIELDS M R, BIANCHI T S, GéLINAS Y, et al. Enhanced terrestrial carbon preservation promoted by reactive iron in deltaic sediments[J]. Geophysical Research Letters, 2016, 43(3): 1149-1157. DOI:10.1002/2015GL067388 |
| [23] |
MA W W, ZHU M X, YANG G P, et al. Iron geochemistry and organic carbon preservation by iron (oxyhydr) oxides in surface sediments of the East China Sea and the south Yellow Sea[J]. Journal of Marine Systems, 2018, 178: 62-74. DOI:10.1016/j.jmarsys.2017.10.009 |
| [24] |
SALVADÓ J A, TESI T, ANDERSSON A, et al. Organic carbon remobilized from thawing permafrost is resequestered by reactive iron on the Eurasian Arctic Shelf[J]. Geophysical Research Letters, 2015, 42(19): 8122-8130. DOI:10.1002/2015GL066058 |
| [25] |
MU C C, ZHANG T J, ZHAO Q, et al. Soil organic carbon stabilization by iron in permafrost regions of the Qinghai-Tibet Plateau[J]. Geophysical Research Letters, 2016, 43(19): 10286-10297. |
| [26] |
WANG Y Y, WANG H, HE J S, et al. Iron-mediated soil carbon response to water-table decline in an alpine wetland[J]. Nature Communications, 2017, 8: 15972. DOI:10.1038/ncomms15972 |
| [27] |
王璐莹, 秦雷, 吕宪国, 等. 铁促进土壤有机碳累积作用研究进展[J]. 土壤学报, 2018, 55(5): 1041-1050. WANG Luying, QIN Lei, LV Xianguo, et al. Progress in researches on effect of iron promoting accumulation of soil organic carbon[J]. Acta Pedologica Sinica, 2018, 55(5): 1041-1050. |
| [28] |
MCCAVE I N, HALL I R. Size sorting in marine muds: Processes, pitfalls, and prospects for paleoflow-speed proxies[J]. Geochemistry, Geophysics, Geosystems, 2006, 7(10): Q10N05. DOI:10.1029/2006GC001284 |
| [29] |
THOMSEN L, GUST G. Sediment erosion thresholds and characteristics of resuspended aggregates on the western European continental margin[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2000, 47(10): 1881-1897. DOI:10.1016/S0967-0637(00)00003-0 |
| [30] |
BRöDER L, TESI T, ANDERSSON A, et al. Bounding cross-shelf transport time and degradation in Siberian- Arctic land-ocean carbon transfer[J]. Nature Commu nications, 2018, 9: 806. DOI:10.1038/s41467-018-03192-1 |
| [31] |
BAO R, MCINTYRE C, ZHAO M X, et al. Widespread dispersal and aging of organic carbon in shallow marginal seas[J]. Geology, 2016, 44(10): 791-794. DOI:10.1130/G37948.1 |
| [32] |
BURDIGE D J. Burial of terrestrial organic matter in marine sediments: A re-assessment[J]. Global Biogeochemical Cycles, 2005, 19: GB4011. |
| [33] |
DENG B, ZHANG J, WU Y. Recent sediment accumulation and carbon burial in the East China Sea[J]. Global Biogeochemical Cycles, 2006, 20(3): B3014. |
| [34] |
HWANG J, DRUFFEL E R M. Lipid-like material as the source of the uncharacterized organic carbon in the ocean?[J]. Science, 2003, 299(5608): 881-884. DOI:10.1126/science.1078508 |
| [35] |
ZHAO B, YAO P, BIANCHI T, et al. Controls on organic carbon burial in the Eastern China Marginal Seas: A regional synthesis[J]. Global Biogeochemical Cycles, 2021, 35(4): e2020GB006608. |
| [36] |
ZHU M X, CHEN K K, YANG G P, et al. Sulfur and iron diagenesis in temperate unsteady sediments of the East China Sea inner shelf and a comparison with tropical mobile mud belts (MMBs)[J]. Journal of Geophysical Research: Biogeosciences, 2016, 121(11): 2811-2828. DOI:10.1002/2016JG003391 |
| [37] |
POULTON S W, RAISWELL R. The low-temperature geochemical cycle of iron: from continental fluxes to marine sediment deposition[J]. American Journal of Science, 2002, 302(9): 774-805. DOI:10.2475/ajs.302.9.774 |
| [38] |
HAYES J. Factors controlling 13C contents of sedimentary organic compounds: principles and evidence[J]. Marine Geology, 1993, 113(1/2): 111-125. |
| [39] |
CRAIG H. The geochemistry of the stable carbon isotopes[J]. Geochimica et Cosmochimica Acta, 1953, 3(2): 53-92. |
| [40] |
SHARP Z. Principles of stable isotope geochemistry[M]. Upper Saddle River, NJ: Pearson/Prentice Hall, 2007.
|
| [41] |
MAMPUKU M, YAMANAKA T, UCHIDA M, et al. Changes in C3/C4 vegetation in the continental interior of the Central Himalayas associated with monsoonal paleoclimatic changes during the last 600 kyr[J]. Climate of the Past Discussions, 2007, 3: 871-898. |
| [42] |
BRODIE C R, LENG M J J, CASFORD J S L, et al. Evidence for bias in C and N concentrations and δ13C composition of terrestrial and aquatic organic materials due to pre-analysis acid preparation methods[J]. Chemical Geology, 2011, 282: 67-83. DOI:10.1016/j.chemgeo.2011.01.007 |
| [43] |
GODWIN H. Half-life of radiocarbon[J]. Nature, 1962, 195(4845): 984. |
| [44] |
MCNICHOL A P, ALUWIHARE L I. The power of radiocarbon in biogeochemical studies of the marine carbon cycle: Insights from studies of dissolved and particulate organic carbon (DOC and POC)[J]. Chemical Reviews, 2007, 107(2): 443-466. DOI:10.1021/cr050374g |
| [45] |
HEDGES J I, KEIL R G, BENNER R. What happens to terrestrial organic matter in the ocean?[J]. Organic Geochemistry, 1997, 27(5/6): 195-212. |
| [46] |
WANG X C, DRUFFEL E R, GRIFFIN S, et al. Radiocarbon studies of organic compound classes in plankton and sediment of the northeastern Pacific Ocean[J]. Geochimica et Cosmochimica Acta, 1998, 62(8): 1365-1378. DOI:10.1016/S0016-7037(98)00074-X |
| [47] |
SEMILETOV I, DUDAREV O, LUCHIN V, et al. The East Siberian Sea as a transition zone between Pacific- derived waters and Arctic shelf waters[J]. Geophysical Research Letters, 2005, 32: L10614. DOI:10.1029/2005GL022490 |
| [48] |
STEIN R, MACDONALD R W, STEIN R, et al. The organic carbon cycle in the Arctic Ocean[M]. Berlin: Springer, 2004.
|
| [49] |
YOON S H, KIM J H, YI H I, et al. Source, composition and reactivity of sedimentary organic carbon in the river-dominated marginal seas: a study of the eastern Yellow Sea (the northwestern Pacific)[J]. Continental Shelf Research, 2016, 125: 114-126. DOI:10.1016/j.csr.2016.07.010 |
| [50] |
LIU D Y, LI X, EMEIS K C, et al. Distribution and sources of organic matter in surface sediments of Bohai Sea near the Yellow River Estuary, China[J]. Estuarine, Coastal and Shelf Science, 2015, 165: 128-136. DOI:10.1016/j.ecss.2015.09.007 |
| [51] |
ADHIKARI D, YANG Y. Selective stabilization of aliphatic organic carbon by iron oxide[J]. Scientific Reports, 2015, 5: 11214. DOI:10.1038/srep11214 |
| [52] |
ADHIKARI D, POULSON S R, SUMAILA S, et al. Asynchronous reductive release of iron and organic carbon from hematite–humic acid complexes[J]. Chemical Geology, 2016, 430: 13-20. DOI:10.1016/j.chemgeo.2016.03.013 |
| [53] |
COWARD E K, OHNO T, PLANTE A F. Adsorption and molecular fractionation of dissolved organic matter on iron-bearing mineral matrices of varying crystallinity[J]. Environmental Science & Technology, 2018, 52(3): 1036-1044. |
| [54] |
WU X, BI N S, KANAI Y, et al. Sedimentary records off the modern Huanghe (Yellow River) delta and their response to deltaic river channel shifts over the last 200 years[J]. Journal of Asian Earth Sciences, 2015, 108: 68-80. DOI:10.1016/j.jseaes.2015.04.028 |
| [55] |
王旭晨, 戴民汉. 天然放射性碳同位素在海洋有机地球化学中的应用[J]. 地球科学进展, 2002, 17(3): 348-354. WANG Xuchen, DAI Minhan. The application naturally occurred radiocarbon (14C) in marine organic geochemistry studies[J]. Advances in Earth Science, 2002, 17(3): 348-354. |
| [56] |
赵美训, 于蒙, 张海龙, 等. 单体分子放射性碳同位素分析在海洋科学及环境科学研究中的应用[J]. 海洋学报, 2014, 36(4): 1-10. ZHAO Meixun, YU Meng, ZHANG Hailong, et al. Applications of compound-specific radiocarbon analysis in oceanography and environmental science[J]. Acta Oceanologica Sinica, 2014, 36(4): 1-10. |
| [57] |
BAO R, BLATTMANN T M, MCINTYRE C, et al. Relationships between grain size and organic carbon 14C heterogeneity in continental margin sediments[J]. Earth and Planetary Science Letters, 2019, 505: 76-85. DOI:10.1016/j.epsl.2018.10.013 |
| [58] |
BURDIGE D J. The biogeochemistry of manganese and iron reduction in marine sediments[J]. Earth-Science Reviews, 1993, 35(3): 249-284. DOI:10.1016/0012-8252(93)90040-E |
| [59] |
KLEBER M, EUSTERHUES K, KEILUWEIT M, et al. Mineral-organic associations: formation, properties, and relevance in soil environments[J]. Advances in Agronomy, 2015, 130: 1-140. |
| [60] |
WU H H, LIN Y Y, WU J Y, et al. Surface adsorption of iron oxide minerals for phenol and dissolved organic matter[J]. Earth Science Frontiers, 2008, 15(6): 133-141. DOI:10.1016/S1872-5791(09)60013-0 |
| [61] |
BAO Y P, BOLAN N S, LAI J H, et al. Interactions between organic matter and Fe (hydr) oxides and their influences on immobilization and remobilization of metal (loid)s: A review[J]. Critical Reviews in Environmental Science and Technology, 2022, 52(22): 4016-4037. DOI:10.1080/10643389.2021.1974766 |
| [62] |
MIKUTTA R, LORENZ D, GUGGENBERGER G, et al. Properties and reactivity of Fe-organic matter associations formed by coprecipitation versus adsorption: Clues from arsenate batch adsorption[J]. Geochimica et Cosmochimica Acta, 2014, 144: 258-276. DOI:10.1016/j.gca.2014.08.026 |
| [63] |
LIU Q J, LI X, TANG J P, et al. Characterization of goethite-fulvic acid composites and their impact on the immobility of Pb/Cd in soil[J]. Chemosphere, 2019, 222: 556-563. DOI:10.1016/j.chemosphere.2019.01.171 |
| [64] |
CHEN H F, KOOPAL L K, XU J L, et al. Selective adsorption of soil humic acid on binary systems containing kaolinite and goethite: Assessment of sorbent interactions[J]. European Journal of Soil Science, 2019, 70(5): 1098-1107. |
| [65] |
ZHU M, HU X F, TU C, et al. Sorption mechanisms of diphenylarsinic acid on ferrihydrite, goethite and hematite using sequential extraction, FTIR measurement and XAFS spectroscopy[J]. Science of the Total Environment, 2019, 669: 991-1000. DOI:10.1016/j.scitotenv.2019.03.166 |
| [66] |
LV J T, ZHANG S Z, WANG S S, et al. Molecular-scale investigation with ESI-FT-ICR-MS on fractionation of dissolved organic matter induced by adsorption on iron oxyhydroxides[J]. Environmental Science & Technology, 2016, 50(5): 2328-2336. |
| [67] |
YANG Y, SAIERS J E, BARNETT M O. Impact of interactions between natural organic matter and metal oxides on the desorption kinetics of uranium from heterogeneous colloidal suspensions[J]. Environmental Science & Technology, 2013, 47(6): 2661-2669. |
| [68] |
CHEKLI L, PHUNTSHO S, ROY M, et al. Characterisation of Fe-oxide nanoparticles coated with humic acid and Suwannee River natural organic matter[J]. Science of the Total Environment, 2013, 461: 19-27. |
| [69] |
RAHMAN M S, WHALEN M, GAGNON G A. Adsorption of dissolved organic matter (DOM) onto the synthetic iron pipe corrosion scales (goethite and magnetite): effect of pH[J]. Chemical Engineering Journal, 2013, 234: 149-157. DOI:10.1016/j.cej.2013.08.077 |
| [70] |
CHEN C M, DYNES J J, WANG J, et al. Properties of Fe-organic matter associations via coprecipitation versus adsorption[J]. Environmental Science & Technology, 2014, 48(23): 13751-13759. |
| [71] |
HENNEBERRY Y K, KRAUS T E, NICO P S, et al. Structural stability of coprecipitated natural organic matter and ferric iron under reducing conditions[J]. Organic Geochemistry, 2012, 48: 81-89. DOI:10.1016/j.orggeochem.2012.04.005 |
| [72] |
DIXIT S, HERING J G. Comparison of arsenic (Ⅴ) and arsenic (Ⅲ) sorption onto iron oxide minerals: implications for arsenic mobility[J]. Environmental Science & Technology, 2003, 37(18): 4182-4189. |
| [73] |
GIMENEZ J, MARTíNEZ M, DE PABLO J, et al. Arsenic sorption onto natural hematite, magnetite, and goethite[J]. Journal of Hazardous Materials, 2007, 141(3): 575-580. DOI:10.1016/j.jhazmat.2006.07.020 |
| [74] |
BAO Y P, GUO C L, WANG H L, et al. Fe-and S-metabolizing microbial communities dominate an AMD-contaminated river ecosystem and play important roles in Fe and S cycling[J]. Geomicrobiology Journal, 2017, 34(8): 695-705. DOI:10.1080/01490451.2016.1243596 |
| [75] |
FAN C, GUO C L, ZHANG J H, et al. Thiocyanate- induced labilization of schwertmannite: Impacts and mechanisms[J]. Journal of Environmental Sciences, 2019, 80: 218-228. DOI:10.1016/j.jes.2018.12.015 |
| [76] |
BAO Y P, GUO C L, LU G N, et al. Role of microbial activity in Fe (Ⅲ) hydroxysulfate mineral transformations in an acid mine drainage-impacted site from the Dabaoshan Mine[J]. Science of the Total Environment, 2018, 616: 647-657. |
| [77] |
VITHANA C L, SULLIVAN L A, BURTON E D, et al. Stability of schwertmannite and jarosite in an acidic landscape: Prolonged field incubation[J]. Geoderma, 2015, 239: 47-57. |
| [78] |
SOWERS T D, HOLDEN K L, COWARD E K, et al. Dissolved organic matter sorption and molecular fractionation by naturally occurring bacteriogenic iron (oxyhydr) oxides[J]. Environmental Science & Technology, 2019, 53(8): 4295-4304. |
| [79] |
WENG L P, VAN RIEMSDIJK W H, KOOPAL L K, et al. Adsorption of humic substances on goethite: comparison between humic acids and fulvic acids[J]. Environmental Science & Technology, 2006, 40(24): 7494-7500. |
| [80] |
BäCKSTRöM M, DARIO M, KARLSSON S, et al. Effects of a fulvic acid on the adsorption of mercury and cadmium on goethite[J]. Science of the Total Environment, 2003, 304(1/3): 257-268. |
| [81] |
WENG L P, VAN RIEMSDIJK W H, HIEMSTRA T. Adsorption of humic acids onto goethite: Effects of molar mass, pH and ionic strength[J]. Journal of Colloid and Interface Science, 2007, 314(1): 107-118. DOI:10.1016/j.jcis.2007.05.039 |
| [82] |
ABATE G, MASINI J C. Influence of pH and ionic strength on removal processes of a sedimentary humic acid in a suspension of vermiculite[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2003, 226(1/3): 25-34. |
| [83] |
ARNARSON T S, KEIL R G. Mechanisms of pore water organic matter adsorption to montmorillonite[J]. Marine Chemistry, 2000, 71(3/4): 309-320. |
| [84] |
WENG L P, VAN RIEMSDIJK W H, HIEMSTRA T. Cu2+ and Ca2+ adsorption to goethite in the presence of fulvic acids[J]. Geochimica et Cosmochimica Acta, 2008, 72(24): 5857-5870. DOI:10.1016/j.gca.2008.09.015 |
| [85] |
ISLAM M A, MORTON D W, JOHNSON B B, et al. Adsorption of humic and fulvic acids onto a range of adsorbents in aqueous systems, and their effect on the adsorption of other species: A review[J]. Separation and Purification Technology, 2020, 247: 116949. DOI:10.1016/j.seppur.2020.116949 |
| [86] |
SODANO M, LERDA C, NISTICÒ R, et al. Dissolved organic carbon retention by coprecipitation during the oxidation of ferrous iron[J]. Geoderma, 2017, 307: 19-29. DOI:10.1016/j.geoderma.2017.07.022 |
| [87] |
MIKUTTA C. X-ray absorption spectroscopy study on the effect of hydroxybenzoic acids on the formation and structure of ferrihydrite[J]. Geochimica et Cosmochimica Acta, 2011, 75(18): 5122-5139. DOI:10.1016/j.gca.2011.06.002 |
| [88] |
DU H H, HUANG Q Y, LEI M, et al. Sorption of Pb (Ⅱ) by nanosized ferrihydrite organo-mineral composites formed by adsorption versus coprecipitation[J]. ACS Earth and Space Chemistry, 2018, 2(6): 556-564. DOI:10.1021/acsearthspacechem.8b00005 |
| [89] |
EUSTERHUES K, WAGNER F E, HÄUSLER W, et al. Characterization of ferrihydrite-soil organic matter coprecipitates by X-ray diffraction and Mossbauer spectroscopy[J]. Environmental Science & Technology, 2008, 42(21): 7891-7897. |
| [90] |
EUSTERHUES K, RENNERT T, KNICKER H, et al. Fractionation of organic matter due to reaction with ferrihydrite: coprecipitation versus adsorption[J]. Environmental Science & Technology, 2011, 45(2): 527-533. |
| [91] |
EUSTERHUES K, HäDRICH A, NEIDHARDT J, et al. Reduction of ferrihydrite with adsorbed and coprecipitated organic matter: microbial reduction by Geobacter bremensis vs. abiotic reduction by Na-dithionite[J]. Biogeosciences, 2014, 11(18): 4953-4966. DOI:10.5194/bg-11-4953-2014 |
| [92] |
CHEN C M, THOMPSON A. Ferrous iron oxidation under varying pO2 levels: the effect of Fe (Ⅲ)/Al (Ⅲ) oxide minerals and organic matter[J]. Environmental Science & Technology, 2018, 52(2): 597-606. |
| [93] |
秦大河, 丁一汇, 毛耀顺, 等. 全球碳循环[M]. 北京: 气象出版社, 2003. QIN Dahe, DING Yihui, MAO Yaoshun, et al. The global carbon cycle[M]. Beijing: China Meteorological Press, 2003. |
| [94] |
SABINE C L, FEELY R A, GRUBER N, et al. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305(5682): 367-371. DOI:10.1126/science.1097403 |
| [95] |
周莉, 李保国, 周广胜. 土壤有机碳的主导影响因子及其研究进展[J]. 地球科学进展, 2005, 20(1): 99-105. ZHOU Li, LI Baoguo, ZHOU Guangsheng. Advances in controlling factors of soil organic carbon[J]. Advances in Earth Science, 2005, 20(1): 99-105. |
| [96] |
FALKOWSKI P, SCHOLES R, BOYLE E, et al. The global carbon cycle: a test of our knowledge of earth as a system[J]. Science, 2000, 290(5490): 291-296. DOI:10.1126/science.290.5490.291 |
| [97] |
JOOS F, PLATTNER G K, STOCKER T F, et al. Global warming and marine carbon cycle feedbacks on future atmospheric CO2[J]. Science, 1999, 284(5413): 464-467. DOI:10.1126/science.284.5413.464 |
| [98] |
殷建平, 王友绍, 徐继荣, 等. 海洋碳循环研究进展[J]. 生态学报, 2006, 26(2): 566-575. YIN Jianping, WANG Youshao, XU Jirong et al. Adavances of studies on marine carbon cycle[J]. Acta Ecologica Sinica, 2006, 26(2): 566-575. |
| [99] |
SHARP J H, BENNER R, BENNETT L, et al. Analyses of dissolved organic carbon in seawater: the JGOFS EqPac methods comparison[J]. Marine Chemistry, 1995, 48(2): 91-108. DOI:10.1016/0304-4203(94)00040-K |
| [100] |
THOMAS H, BOZEC Y, ELKALAY K, et al. Response to comment on "enhanced open ocean storage of CO2 from shelf sea pumping"[J]. Science, 2004, 306(5701): 1477. |
| [101] |
TAGLIABUE A, BOWIE A R, BOYD P W, et al. The integral role of iron in ocean biogeochemistry[J]. Nature, 2017, 543(7643): 51-59. DOI:10.1038/nature21058 |
| [102] |
NISHIOKA J, ONO T, SAITO H, et al. Iron supply to the western subarctic Pacific: Importance of iron export from the Sea of Okhotsk[J]. Journal of Geop hysical Research: Oceans, 2007, 112: C10012. DOI:10.1029/2006JC004055 |
| [103] |
TAGLIABUE A, WILLIAMS R G, ROGAN N, et al. A ventilation-based framework to explain the regeneration- scavenging balance of iron in the ocean[J]. Geophysical Research Letters, 2014, 41(20): 7227-7236. DOI:10.1002/2014GL061066 |
| [104] |
WAGENER T, GUIEU C, LEBLOND N. Effects of dust deposition on iron cycle in the surface Mediterranean Sea: results from a mesocosm seeding experiment[J]. Biogeosciences, 2010, 7(11): 3769-3781. DOI:10.5194/bg-7-3769-2010 |
| [105] |
BOYD P W, ELLWOOD M J. The biogeochemical cycle of iron in the ocean[J]. Nature Geoscience, 2010, 3(10): 675-682. DOI:10.1038/ngeo964 |
| [106] |
KATSEV S, CHAILLOU G, SUNDBY B, et al. Effects of progressive oxygen depletion on sediment diagenesis and fluxes: A model for the lower St. Lawrence River Estuary[J]. Limnology and Oceanography, 2007, 52(6): 2555-2568. DOI:10.4319/lo.2007.52.6.2555 |
| [107] |
NORMAN L, CABANESA D J, BLANCO-AMEIJEIRAS S, et al. Iron biogeochemistry in aquatic systems: from source to bioavailability[J]. CHIMIA International Journal for Chemistry, 2014, 68(11): 764-771. DOI:10.2533/chimia.2014.764 |
| [108] |
FIRME G F, RUE E L, WEEKS D A, et al. Spatial and temporal variability in phytoplankton iron limitation along the California coast and consequences for Si, N, and C biogeochemistry[J]. Global Biogeochemical Cycles, 2003, 17(1): 1016. |
| [109] |
JOHNSON K S, GORDON R M, COALE K H. What controls dissolved iron concentrations in the world ocean?[J]. Marine Chemistry, 1997, 57(3/4): 137-161. |
| [110] |
PAN W N, KAN J J, INAMDAR S, et al. Dissimilatory microbial iron reduction release DOC (dissolved organic carbon) from carbon-ferrihydrite association[J]. Soil Biology and Biochemistry, 2016, 103: 232-240. DOI:10.1016/j.soilbio.2016.08.026 |
| [111] |
TORTELL P D, MALDONADO M T, PRICE N M. The role of heterotrophic bacteria in iron-limited ocean ecosystems[J]. Nature, 1996, 383(6598): 330-332. DOI:10.1038/383330a0 |
| [112] |
冯世博, 姜玥璐, 蔡中华, 等. 海洋环境中铁的来源、微生物作用过程及生态效应[J]. 地球科学进展, 2019, 34(5): 513-522. FENG Shibo, JIANG Yuelu, CAI Zhonghua, et al. The state of arts: Sources, microbial processes and ecological effects of iron in the marine environment[J]. Advances in Earth Science, 2019, 34(5): 513-522. |
| [113] |
BRYCE C, BLACKWELL N, SCHMIDT C, et al. Microbial anaerobic Fe(Ⅱ) oxidation-Ecology, mechanisms and environmental implications[J]. Environme ntal Microbiology, 2018, 20: 3462-3483. DOI:10.1111/1462-2920.14328 |
| [114] |
JONES D L, EDWARDS A C. Influence of sorption on the biological utilization of two simple carbon substrates[J]. Soil Biology and Biochemistry, 1998, 30(14): 1895-1902. DOI:10.1016/S0038-0717(98)00060-1 |
| [115] |
GU B H, SCHMITT J, CHEN Z H, et al. Adsorption and desorption of natural organic matter on iron oxide: mechanisms and models[J]. Environmental Science & Technology, 1994, 28(1): 38-46. |
| [116] |
HENRICHS S M. Sedimentary organic matter preservation: an assessment and speculative synthesis—a comment[J]. Marine Chemistry, 1995, 49(2/3): 127-136. |
| [117] |
ALLER R, BLAIR N, XIA Q, et al. Remineralization rates, recycling, and storage of carbon in Amazon shelf sediments[J]. Continental Shelf Research, 1996, 16(5/6): 753-786. |
| [118] |
RIEDEL T, ZAK D, BIESTER H, et al. Iron traps terrestrially derived dissolved organic matter at redox interfaces[J]. Proceedings of the National Academy of Sciences, 2013, 110(25): 10101-10105. DOI:10.1073/pnas.1221487110 |
| [119] |
COUTURE R M, GOBEIL C, TESSIER A. Chronology of atmospheric deposition of arsenic inferred from reconstructed sedimentary records[J]. Environmental Science & Technology, 2008, 42(17): 6508-6513. |
 2023, Vol. 47
2023, Vol. 47