文章信息
- 张雅婷, 韦章良, 龙丽娟, 杨芳芳, 肖志梁. 2023.
- ZHANG Ya-ting, WEI Zhang-liang, LONG Li-juan, YANG Fang-fang, XIAO Zhi-liang. 2023.
- 长心卡帕藻应对海洋酸化和升温的环境适应性研究
- Environmental adaptability of the red seaweed Kappaphycus alvarezii in response to ocean acidification and warming
- 海洋科学, 47(7): 12-21
- Marine Sciences, 47(7): 12-21.
- http://dx.doi.org/10.11759/hykx20220824002
-
文章历史
- 收稿日期:2022-08-24
- 修回日期:2022-10-28
2. 中国科学院大学, 北京 100049;
3. 中国科学院南海海洋研究所 粤东上升流区海洋生态系统综合观测研究站, 广东 汕头 515041;
4. 三亚海洋生态环境工程研究院 海南省热带海洋生物技术重点实验室, 海南 三亚 572024
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Guangdong Provincial Observation and Research Station for Coastal Upwelling Ecosystem, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Shantou 515041, China;
4. Hainan Key Laboratory of Tropical Marine Biotechnology, Sanya Institute of Ocean Eco-Environmental Engineering, Sanya 572024, China
自工业化时代以来, 化石燃料的大量消耗导致温室气体排放量大幅增加。截止到2022年, 大气中二氧化碳(CO2)浓度已经由工业革命前(1850年)的280×10–6增加至415.9×10–6, CO2累计碳排放量(1850—2020年)达(4.55±0.25)×1011 t, 其中约35%被海洋所吸收, 形成海水无机碳体系(dissolved inorganic carbon, DIC), 主要以三种形态存在: HCO3–、CO32–和H2CO3, 其中大约90%为HCO3–, 其次是CO32–(约占总量的8%), H2CO3的占比最少(约占1%)[1]。海水碳酸盐体系在内部以不同形态相互转化变动, 同时与大气不断发生物质交换, 因此海水CO2浓度与大气CO2浓度密切相关; 由于深海环境条件非常稳定, 相比之下, 表层海水更易受到CO2浓度变化的影响。持续监测结果表明, 海洋表面pH值已经下降了0.1个单位(相当于[H+]上升了26%)[1], 预计到2100年末将会下降(0.44±0.005)个单位[2]。同时, 2011—2020年全球表面温度比1850— 1900年高1.09 ℃, 并且预计到21世纪末期(2081— 2100年), 全球表面温度升高幅度可能超过1.5 ℃[1]。因此, 全球变暖和海洋酸化已成为当前无法回避的重要环境问题。
海水中存在着复杂的碳酸盐系统, 对由季节性海水温度变化和生物行为导致的pH波动具有一定的缓冲能力, 然而大气CO2浓度持续增加正在削弱这种缓冲作用[3]。大型海藻是海洋中的重要初级生产者之一, 贡献了大约10%的海洋初级生产力[4-5], 在近海碳循环中具有重要的作用。在海洋生态系统中, 大型海藻通过光合作用吸收海水中的DIC, 进而影响海水的碳酸盐系统和海气CO2交换; 这种影响反过来又促进大气CO2更多地向海洋溶解, 增加了海洋碳汇[6]。大气CO2浓度升高导致的海洋酸化和升温显著影响了海水的理化性质, 大型海藻的生长代谢活动和生物特性会受到一定程度的影响, 如生长速率、光合作用、呼吸作用以及钙化作用等[7-9]。在适宜的环境条件下, 一定范围内CO2浓度升高会促进大型海藻的生长, 如羊栖菜(Hizikia fusiforme), 大气CO2浓度升高增加了海水无机碳浓度, 为光合作用提供了充足的碳源, 抑制藻体光呼吸, 降低了代谢消耗, 进而加快了藻体的生长[10]。另外, 已有研究表明, CO2浓度升高可显著提高龙须菜(Gracilariopsis lemaneiformis)[11]和坛紫菜(Porphyra haitanensis)[12]的胞内碳酸酐酶活性和硝酸还原酶活性, 导致C、N组分积累, 促进藻类生长。但对于另一些钙化藻类, 如仙掌藻(Halimeda opuntia)[13]和赫氏颗石藻(Emiliania huxleyi)[14], 海洋酸化效应降低了海水pH, 对其生长和钙化作用产生负面影响。
CO2浓度会与其他环境因素, 如温度和光照强度等, 形成耦联效应, 对不同种甚至同种海藻产生不同程度的影响。例如, 高浓度CO2能显著提高坛紫菜热稳定性, 推测该影响可能与生长温度密切相关, 表现为高温(25 ℃)时坛紫菜相对生长速率和色素浓度比低温要高, 且这种生长趋势在高CO2浓度下更加显著[8]。类似的正面效应在条斑紫菜(Porphyra yezoensis)中也有体现, 光照降低对其生长有显著的抑制作用, 但在低光条件下, CO2浓度升高显著增加了条斑紫菜的相对生长率和最大净光合速率[15]。另外, 浒苔(Enteromorpha prolifera)幼苗在正常CO2浓度和高光条件下生长最快, 但在高光处理时提高CO2浓度, 会使得藻体二氧化碳浓缩机制(CO2 concentrating mechanism, CCM)活动过程下调, 加速了高光下的光抑制, 进而在一定程度上抑制了浒苔幼苗的生长[16]。
长心卡帕藻(Kappaphycus alvarezii)是红藻门红翎菜科卡帕藻属, 主要分布在热带和亚热带海区, 是国际上主要栽培的经济红藻之一。因其富含κ-卡拉胶, 在食品、医学、工业等方面具有重要的经济价值。中国长心卡帕藻的主要产地在海南, 最早自菲律宾引入国内后, 在海南省陵水黎安泻湖实现规模化养殖, 年产量占国内需求的37.5%[17]。本研究通过测定不同处理条件下长心卡帕藻的光合作用、代谢产物指标和酶活指标, 探究海洋酸化背景下, 长心卡帕藻应对海水升温的环境适应性变化趋势, 以期为长心卡帕藻在未来全球变化背景下的规模化栽培提供指导。
1 材料与方法 1.1 实验材料长心卡帕藻(红色品系)样品为采集自海南省陵水县的人工栽培种, 放置在装满当地海水的充氧密封塑料箱中, 低温条件下转移至海南三亚实验室内的循环水培养缸中暂养7 d。暂养条件为水温28~30 ℃, 盐度31~32, pH为8.11~8.19, 光照周期为12L︰12D, 海藻实际接收到的光照强度约40~45 μmol·m–2·s–1(红色品系长心卡帕藻的光照强度适宜范围为30~65 μmol·m–2·s–1[18])。暂养期间长心卡帕藻生长状态良好。
1.2 实验设计暂养结束后, 选取健康且状态一致的长心卡帕藻进行实验。除去表面附着物, 用过滤海水洗净后分别称重15 g, 放入不同处理的实验缸中培养28 d。联合国政府间气候变化专门委员会(IPCC)预测在2100年末大气CO2浓度将会达到1 200×10–6[1], 因此, 酸化组的CO2浓度设定为1 200×10–6; 对照组为三亚临海平均CO2浓度, 约为450×10–6。此外, 中国主要养殖区海南三亚地区的夏季海水表层温度约为29 ℃[19]。因此, 实验设置了2个CO2浓度水平, 分别为450×10–6(LC)(当地CO2平均浓度)和1 200×10–6(HC), 以及3个温度水平, 即26 ℃(LT)、29 ℃(MT)和32 ℃(HT), 一共6种处理组, 每个处理组设置3个生物学重复(表 1)。
| 实验组 | CO2浓度/(×10−6) | 温度/℃ |
| LC-LT | 450 | 26 |
| LC-MT | 450 | 29 |
| LC-HT | 450 | 32 |
| HC-LT | 1 200 | 26 |
| HC-MT | 1 200 | 29 |
| HC-HT | 1 200 | 32 |
| 注: LC-LT(低碳低温组), LC-MT(低碳中温组), LC-HT(低碳高温组), HC-LT(高碳低温组), HC-MT(高碳中温组), HC-HT(高碳高温组) | ||
实验缸(尺寸30 cm×7 cm×30 cm)培养水体为15 L洁净的砂滤自然海水, 盐度31±1, 在水下海藻实际接收到的光照强度约30 μmol photons·m–2·s–1(L︰D= 12 h︰12 h)。培养过程中使用小型造浪泵(200 L/h, AT-301, Atman, China)模拟海水流动, 并使用数显式温度控制器和钛合金加热棒(Weipro, China)维持所需水温。利用海水CO2分压控制器(CE100C, Wuhan Ruihua Instrument and Equipment Ltd., Wuhan, China)设置实验所需CO2浓度(表 1), 通过向海水中鼓入纯CO2与空气的混合气体来模拟海洋酸化, 经处理后酸化组pH为7.70~7.80, 非酸化组pH为7.95~8.05。配置浓度分别为200 μmol·L–1和20 μmol·L–1的NaNO3溶液和Na2HPO4溶液(N︰P=10︰1), 培养过程中, 每日各添加4 mL进行硝酸盐和磷酸盐的补充。每天更换5 L过滤海水, 每周彻底更换所有海水。在实验过程中, 每天进行3次海水监测(9: 00、15: 00、21: 00), 使用多参数测试仪S220测量海水温度、盐度和pH(Mettler-Toledo International Inc., Shanghai, China)。用自动电位滴定仪测定海水总碱度(Total alkalinity, TA)(Metrohm 877 Titrino Plus, Titrando® Metrohm USA, Inc.); 根据测定的水温、盐度、pH和TA, 采用CO2SYS推算海水碳酸盐体系参数: p(CO2)、c(HCO3–)、c(CO32–)和c(CO2)。
1.3 指标测定1) 相对生长速率: 实验期间, 每隔一周用电子天平(AR224CN, OHAUS, New Jersey, USA; accuracy, ~0.1 mg)准确称取每个实验组的长心卡帕藻鲜重(精确到0.01 g), 称量前用吸水纸将藻体表面的水吸干。
通过下列公式计算海藻的相对生长速率R(% d–1):
| $ R=(ln M_{t} – ln M_{0}) / t×100%, (1) $ | (1) |
式中, Mt、M0分别为第t天和初始培养时海藻的鲜重(g)。
本实验所得到的长心卡帕藻的相对生长速率范围为0.31~0.74%·d–1, 增长缓慢, 低于吴翔宇等人[17]的实验结果(2.52±0.31)%·d–1。因为本实验设置的光照强度为30 μmol photons·m–2·s–1, 是原位栽培的长心卡帕藻生长末期底部藻体接收光照的最小值, 临近藻体适宜生长的光照强度范围30~65 μmol photons·m–2·s–1下限[20], 旨在探究藻体内的光合作用、代谢产物指标和酶活指标方面在生长末期, 长心卡帕藻应对海洋酸化和升温影响的适应性变化。
2) 最大光量子产量(Fv /Fm): 实验期间, 每隔一天用DIVING-PAM(Heinz Walz GmbH, Effeltrich, Germany)测定每个实验组中长心卡帕藻分枝的荧光参数, 将长心卡帕藻藻体暗处理15 min, 测定其分枝最大光量子产量Fv /Fm。
3) 叶绿素a浓度: 28 d培养结束后, 用电子天平准确称取约100 mg长心卡帕藻样品(分枝), 加入1 mL蒸馏水, 在避光条件下冰浴研磨, 1 000 r/min、4 ℃离心20 min (Eppendorf centrifuge 5810 R, Hamburg, Germany), 取上清, 置冰上待测。后续测定步骤遵循Plant Chlorophyll ELISA KIT(Mlbio, Shanghai, China)试剂盒。
4) 碳酸酐酶(CA)浓度: 实验结束后, 称取约100 mg长心卡帕藻样品(分枝), 加入1 mL PBS缓冲液(pH 7.2~7.4)进行冰浴匀浆, 1 000 r/min、4 ℃离心20 min, 取上清, 置冰上待测。后续测定步骤遵循Plant CA ELISA KIT(Mlbio, Shanghai, China)试剂盒。
5) 游离氨基酸(FAA)浓度: 上清液提取方法与碳酸酐酶相同。后续测定步骤遵循Microcystis FAA ELISA KIT(Jake BIO, Shanghai, China)试剂盒说明书。
6) 丙二醛(MDA)、可溶性糖(SS)浓度: 实验结束后, 称取约100 mg长心卡帕藻样品(分枝)并记录其质量(精确到0.1 mg), 具体测定步骤遵循相应的检测试剂盒(Sangon Biotech, Shanghai, China)。
通过下列公式计算丙二醛的浓度M(nmol/g):
| $ M=5×[12.9×(ΔA_{532}–ΔA_{600})–1.12×ΔA_{450}]÷W, $ | (2) |
式中, A为对应波长的吸光值, W为样品质量(g)。
7) 总有机碳(TOC)、总氮(TN)浓度: 实验结束后, 在各实验组随机称取约2 g长心卡帕藻样品(分枝), 用蒸馏水清洗后, 放入烘箱60 ℃烘干至恒重。将样品研磨成粉末, 用超微量天平(XP6, Mettler-Toledo International Inc., Greifensee, Switzerland)称取约2 mg并记录其具体质量(精确到0.001 mg), 锡纸包裹成球状, 每个实验组称取3次。用CHNS/O元素分析仪(Flash EA3000, Thermo Scientific, Milan, Italy)测定组织中TOC和TN干质量(%, dry weight, DW)。
1.4 统计分析所有实验数据整理于Microsoft Excel 2021, 使用Origin Pro 2021b进行处理, 结果均以平均值±标准误差表示。在统计分析前使用Minitab 19进行正态性检验和方差齐性分析。采用双因素方差分析(Two-way ANOVA)(假设有交互作用)检验温度和CO2浓度对长心卡帕藻生理状态的影响。所有统计分析以P < 0.05为差异显著水平, P < 0.01为差异极显著水平。图中不同字母表述不同处理组间具有显著差异。
2 结果 2.1 海水理化参数实验期间各处理组的海水理化参数相对稳定, 如表 2所示。温度处理控制在设定值±0.2 ℃范围内, 设定值分别为26 ℃、29 ℃和32 ℃。各温度处理下酸化组与非酸化组之间的海水pH相差约0.36个单位, 两种CO2处理下的最高pH值均出现在29 ℃, 分别为8.10±0.03和7.73±0.04。酸化组的海水p(CO2)约为非酸化组的2.5倍, 其中酸化组控制在93.83~105.68 Pa, 最高值(101.12±4.56) Pa; 非酸化组范围为32.12~ 41.34 Pa, 最高值(35.26±3.14) Pa。在海水碳酸盐体系中, HCO3–浓度最高, 酸化处理时最高达到(2 077.1± 3.7) μmol/kg; 其次是CO32–; CO2最少, 酸化组约为非酸化组的3倍。
| 实验组 | 温度/℃ | pH | p(CO2)/Pa | c(HCO3–)/(μmol·kg–1) | c(CO32–)/(μmol·kg–1) | c(CO2)/(μmol·kg–1) |
| LC-LT | 26.05±0.14 | 8.07±0.02 | 38.91±2.43 | 1 810.8±3.5 | 220.12±1.5 | 10.83±0.15 |
| LC-MT | 28.98±0.09 | 8.10±0.03 | 35.26±3.14 | 1 733.3±2.8 | 253.62±2.1 | 9.11±0.14 |
| LC-HT | 32.00±0.11 | 8.08±0.02 | 36.68±2.84 | 1 694.5±4.1 | 262.39±1.8 | 8.86±0.26 |
| HC-LT | 26.04±0.08 | 7.72±0.04 | 99.81±4.15 | 2 077.1±3.7 | 113.12±1.4 | 27.77±0.27 |
| HC-MT | 29.31±0.04 | 7.73±0.04 | 97.78±3.95 | 2 046.8±4.4 | 129.18±2.2 | 25.09±0.16 |
| HC-HT | 32.03±0.07 | 7.72±0.02 | 101.12±4.56 | 2 035.1±3.2 | 137.25±2.8 | 24.40±0.22 |
| 注: LC-LT(低碳低温组), LC-MT(低碳中温组), LC-HT(低碳高温组), HC-LT(高碳低温组), HC-MT(高碳中温组), HC-HT(高碳高温组)。p(CO2)指二氧化碳在海水中的浓度, c(HCO3–)、c(CO32–)、c(CO2)指二氧化碳分别以上述形式存在于海水中的浓度。 | ||||||
在不同Fv /Fm p(CO2)与温度条件下培养28 d后, 方差分析结果表示CO2浓度与温度对长心卡帕藻的最大光量子产量Fv /Fm产生了显著影响(P < 0.05)(表 3)。低CO2水平(450×10–6)条件下, 随着水温的升高, Fv /Fm由0.592±0.031增加至0.610±0.036; 高CO2水平(1 200× 10–6)时, Fv /Fm则由0.601±0.014增加至0.623±0.025 (图 1a)。无论是否经过CO2加富处理, 藻体Fv /Fm均在26 ℃时最低, 在32 ℃时为最大值。叶绿素a浓度受CO2和温度影响不显著(P > 0.05), 但在非酸化条件下温度升高对叶绿素a的积累有一定程度的促进作用, 叶绿素a的平均浓度由(0.566±0.040) pmol/g (450×10–6, 26 ℃) 增加至(0.773±0.107) pmol/g(450×10–6, 32 ℃)(图 1b)。酸化条件下(1 200×10–6)叶绿素a浓度在不同温度处理之间无显著差异。对比同一温度下不同CO2浓度处理, 藻体在32 ℃时叶绿素a浓度伴随CO2浓度升高而下降的幅度最大, 从(0.773±0.108) pmol/g下降为(0.608± 0.179) pmol/g。
| 变量 | p(CO2) | 温度 | p(CO2)×温度 | |||||
| F | P | F | P | F | P | |||
| Fv /Fm | 4.54 | 0.036 | 3.62 | 0.031 | 0.06 | 0.940 | ||
| 叶绿素 | 1.08 | 0.304 | 1.78 | 0.179 | 2.59 | 0.084 | ||
| 丙二醛 | 70.19 | 0.000 | 20.5 | 0.000 | 10.43 | 0.000 | ||
| 可溶性糖 | 2.198 | 0.147 | 0.418 | 0.662 | 3.605 | 0.037 | ||
| 碳酸酐酶 | 91.615 | 0.000 | 16.683 | 0.000 | 38.714 | 0.000 | ||
| 游离氨基酸 | 0.5 | 0.484 | 14.61 | 0.000 | 0.01 | 0.988 | ||
| TOC | 0 | 0.981 | 0.01 | 0.986 | 0.05 | 0.949 | ||
| TN | 11.35 | 0.004 | 7.28 | 0.006 | 15.17 | 0.000 | ||
| 注: 分析不同CO2浓度和温度处理对长心卡帕藻生理特性的影响(带有下划线的P值表示该因素具有显著影响) | ||||||||
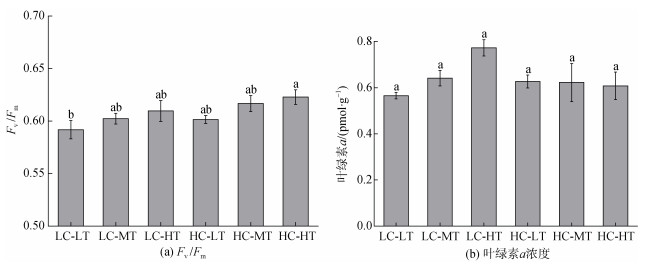 |
| 图 1 不同生长条件下长心卡帕藻的Fv /Fm与叶绿素a浓度 Fig. 1 The effects of CO2 enrichment crossed with three temperature levels on Fv/Fm (a) and Chl-a content (b) of K. alvarezii |
由表 3可知, CO2浓度、温度及二者的交互作用对长心卡帕藻的碳酸酐酶(CA)活性具有显著影响(P < 0.05)。非酸化条件下, 碳酸酐酶活性在26 ℃~29 ℃范围内无显著变化, 但当温度升高至32 ℃, 其活性显著下降为(141.26±9.07) U/L。而在酸化条件下碳酸酐酶活性伴随温度的升高而增加, 从(134.037±12.973) U/L显著上升至(149.988±4.377) U/L。由图 2a还能发现, LC-LT (450×10–6, 26 ℃)和LC-MT处理组(450×10–6, 29 ℃)的碳酸酐酶活性显著高于其他处理组。对比同一温度生长条件, 发现26 ℃和29 ℃时, 升高CO2浓度会显著降低碳酸酐酶活性, 而32 ℃下非酸化与酸化组之间的碳酸酐酶活性差异不显著。长心卡帕藻的可溶性糖(SS)浓度不受CO2浓度和温度的显著影响(P > 0.05), 但二者的交互作用对可溶性糖浓度存在显著影响(P < 0.05)(表 3)。如图 2b所示, 藻体的可溶性糖浓度在非酸化组与酸化组之间的变化情况相反。在非酸化条件下, 可溶性糖浓度伴随温度升高先增加后减少, 29 ℃时达到最高值(4.273± 1.249) mg/g; 而在酸化条件下, 长心卡帕藻的可溶性糖浓度随着温度的升高先减少后增加, 29 ℃时为最小值(3.421±1.330) mg/g。HC-LT处理组(1 200×10–6, 26 ℃)的可溶性糖浓度最高, 为(5.030±0.658) mg/g, 与LC-LT和HC-MT处理组之间差异显著。
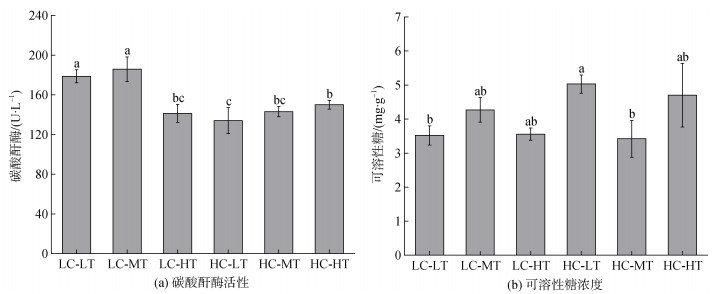 |
| 图 2 不同生长条件下长心卡帕藻的碳酸酐酶(U/L)活性与可溶性糖(mg/g)浓度 Fig. 2 The effects of CO2 enrichment crossed with three temperature levels on carbonic anhydrase activity (a) and soluble sugar (b) content of K. alvarezii |
长心卡帕藻的丙二醛(MDA)浓度受到CO2浓度、温度及二者的交互作用的极显著影响(P < 0.01)(表 3)。如图 3a所示, 26 ℃时, 丙二醛浓度随着CO2浓度的升高, 由(14.698±2.095) nmol/g显著增加至(26.279± 2.754) nmol/g, 29 ℃时由(15.548±3.485) nmol/g明显增加至(22.351±3.065) nmol/g, 表明藻体可能受到了一定程度的酸化胁迫。然而在酸化条件下, 丙二醛浓度随温度上升而降低, 且在29~32 ℃时出现明显降低, 由(26.279±2.754) nmol/g明显降低至(15.179± 3.905) nmol/g, 推测随着温度的升高, 长心卡帕藻对高CO2浓度的适应性增强。同时, 温度升高对长心卡帕藻的游离氨基酸(FAA)浓度影响极显著(P < 0.01), 而CO2浓度及CO2与温度的交互作用对游离氨基酸无显著影响(P > 0.05) (表 3)。在两种CO2水平下, 提高温度均会降低长心卡帕藻组织中的游离氨基酸浓度, 二者变化趋势一致, 在26 ℃时达到最大值, 而温度升高至32 ℃时达到最小值。当p(CO2)=450×10–6时, 游离氨基酸平均浓度由(0.929±0.158) mg/g降低至(0.725±0.087) mg/g; 当p(CO2)=1 200×10–6时, 游离氨基酸浓度由(0.904±0.056) mg/g降低至(0.701± 0.047) mg/g (图 3b)。
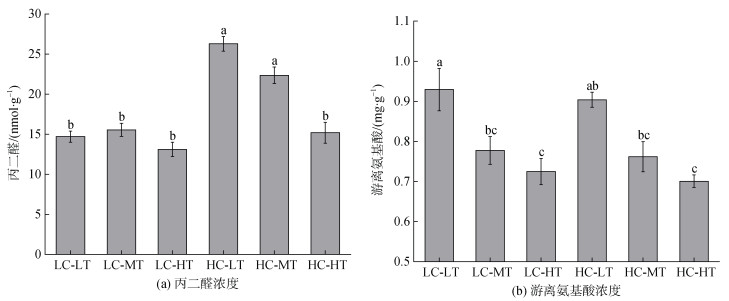 |
| 图 3 不同生长条件下长心卡帕藻的丙二醛与游离氨基酸浓度 Fig. 3 The effects of CO2 enrichment crossed with three temperature levels on malondialdehyde (a) and free amino acids (b) contents of K. alvarezii |
CO2浓度的温度的变化对长心卡帕藻的总有机碳(TOC)浓度无显著影响(P > 0.05)(表 3), 但从图 2.4a可知, 在两种CO2水平下, 温度升高总有机碳浓度有微弱的变化规律, 即非酸化时随温度升高而增加, 酸化时随温度升高而降低, 二者趋势相反。如表 3所示, 藻体的总氮(TN)浓度受到CO2浓度、温度及二者交互作用的显著影响(P < 0.01)。低CO2浓度水平下, 26 ℃与29 ℃时TN浓度变化不明显, 在32 ℃达到最低值, 为(1.186±0.113)% DW; 而高CO2水平时, TN浓度在29 ℃与32 ℃变化不明显, 在26 ℃时最低, 达到(1.375±0.755)% DW(图 4b)。
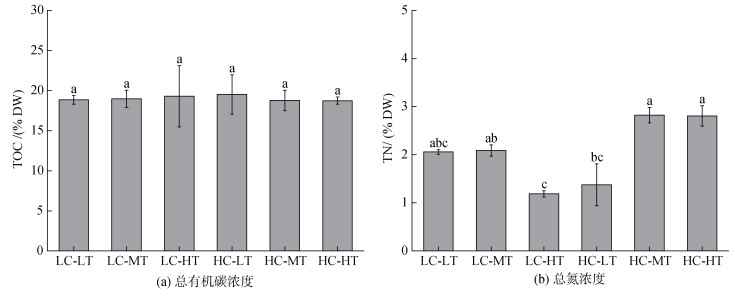 |
| 图 4 不同生长条件下长心卡帕藻的总有机碳与总氮浓度(%DW) Fig. 4 The effects of CO2 enrichment crossed with three temperature levels on TOC (a) and TN (b) content of K. alvarezii |
在2011—2020年十年间, 大气CO2的碳年增长率为(5.1±0.02)×109 t, 到2021年全球CO2排放量约为每年3.64×1010 t(碳年排放量9.9×109 t), 大气CO2浓度达到414.7×10–6, 比工业化前水平高50%[20]。海洋作为地球上重要的碳汇, 储存了全球约93%的CO2, 在减缓全球升温和降低大气CO2浓度方面具有重要作用[21]。世界上经捕获得到的生物碳中超过一半(55%)是由海洋生物捕获的, 主要包括大型海藻、红树林、盐沼和海草等。目前为止, 已有大量研究指出大气CO2浓度升高导致的海洋酸化对大型海藻的生理活动会产生不同的影响[14-15, 22]。本研究表明, 海洋酸化对大型经济海藻长心卡帕藻(Kappaphycus alvarezii)的碳固定具有一定的负面效应, 但并未对藻体生长形成显著胁迫, 而温度的上升在一定程度上可以缓解海水酸化对光合作用带来的不利影响。
叶绿素荧光参数常用于描述植物的光合生理状况, 光合色素浓度也是评估植物光合作用强度的重要指标。Fv /Fm表示PSⅡ最大光量子产量, 非胁迫条件下该参数的变化极小, 不受物种和生长条件的影响, 胁迫条件下该参数明显下降[23]。本研究结果显示, Fv /Fm在相同的CO2水平下伴随温度升高表现出明显增加, 同时受到了CO2浓度升高的显著影响,
表明升温和酸化并未对长心卡帕藻的光合作用产生压力, 光合作用进程仍在良好运转。温度在一定程度上对藻体的光合活性产生正面影响, 提高了光合作用效率, 这可能与长心卡帕藻本身的高温耐受性有关。此结果与李虎[9]报道的结论类似, 长心卡帕藻能耐受29 ℃和32 ℃高温, 但在35 ℃时光系统会受到严重损伤, 影响光系统的正常运转。对于一些高温耐受性较低的大型海藻, 温度升高可能会导致相反的现象, 如当温度在环境温度的基础上提高4 ℃时, 石莼的Fv /Fm值下降显著[24]。本实验中, 虽然叶绿素a (Chl a)浓度的变化在统计学上并不显著, 但非酸化处理(450×10–6)下其变化趋势与Fv /Fm相同, 即随温度升高而增加, 说明在当前CO2浓度下温度升高对叶绿素的积累有一定程度的促进作用。然而酸化处理(1 200×10–6)后, 三个温度水平(26 ℃、29 ℃、32 ℃)下的叶绿素a浓度却无明显差别; 与非酸化处理对比, 叶绿素a浓度在29 ℃和32 ℃出现下降。类似的结果在其他大型海藻中也有发现。如CO2浓度升高显著降低了浒苔的叶绿素a、叶绿素b和类胡萝卜素浓度[25]。藻体通过下调其光合色素浓度, 避免更多的光能传递到光系统中, 这种在高CO2浓度下光合色素浓度降低的效应可能是藻体适应环境的一种策略, 即“色素节约(pigment economy)”现象[3]。长心卡帕藻通过下调光合色素的合成适应pCO2浓度升高的变化, 从而增强藻体在酸化条件下的高温耐受性, 使其在同时面对海水酸化和升温两种气候变化时仍然表现出较好的光合作用运转情况, 对于长心卡帕藻的环境适应和规模化栽培具有一定的积极意义。还有另一个可能是由于实验提供的光照强度为长心卡帕藻生长末期底部藻体所接收到的光强, 而此时的光强不足以在p(CO2)升高后仍然维持与当前p(CO2)生长条件下相同的叶绿素a浓度。
藻体CCM的存在建立在有效利用HCO3–的基础上, 其中通过胞外碳酸酐酶将HCO3–转化为CO2再进行利用的方式是大型海藻无机碳利用最普遍的方式, 在大型绿藻、红藻及褐藻中普遍存在[26]。本研究中, 非酸化生长条件下, 26 ℃和29 ℃时用于转换HCO3–的碳酸酐酶(CA)活性无显著差异, 且当温度升高至32 ℃时发生显著降低, 因此推测当前CO2浓度下长心卡帕藻的碳利用受到32 ℃高温的负面影响。对比同一温度生长条件, 发现藻体的碳酸酐酶活性在26 ℃~29 ℃范围内伴随CO2浓度的升高而显著降低, 推测酸化抑制了藻体的碳酸酐酶活性。这可能是因为酸化引起海水中的CO2浓度升高, 使长心卡帕藻能够更多地直接吸收利用海水中的CO2, 减少了利用碳酸酐酶转化HCO3–的过程, 进而导致了碳酸酐酶活性下降。丙二醛(MDA)是衡量膜脂过氧化程度的一个指标, 被认为是生物材料中脂质自由基损伤的良好标志物, 通过测定酸化和升温条件下藻体内丙二醛的浓度, 可以反映出藻体对酸化和升温的适应程度, 浓度越高, 表明细胞损伤程度越高[27]。实验结果显示, 长心卡帕藻在酸化条件下丙二醛浓度明显高于非酸化条件(26 ℃和29 ℃), 表明藻体在该温度范围内受到了一定程度的酸化损伤。但酸化条件下, 丙二醛浓度随温度升高而降低, 推测在温度的升高同时, 长心卡帕藻对高CO2浓度的适应性增强, 印证了之前对藻体叶绿素a浓度降低而可能出现“色素节约”现象的推测, 即藻体增加了在酸化和升温两种气候变化的环境适应性。同时, 可溶性糖(SS)浓度也是体现植物所受胁迫程度的指标, 通过调节藻体内的渗透压来适应环境变化, 在一定程度上反映环境对能量代谢产生的影响以及个体的适应能力水平[28]。非酸化条件下, 长心卡帕藻的可溶性糖浓度从26 ℃~29 ℃时增加, 从29 ℃~32 ℃时降低, 说明在29 ℃~32 ℃温度范围内长心卡帕藻的糖类物质积累受到了负面影响, 因此通过比较得知, 在450×10–6的CO2浓度下, 长心卡帕藻在26 ℃~29 ℃温度范围内有更好的糖类物质积累。而在酸化条件下长心卡帕藻的可溶性糖浓度伴随温度的升高先减少后增加, 出现增加的温度范围是29 ℃~32 ℃, 因此按照同样的结论推测, 认为在海洋酸化的生长条件下, 长心卡帕藻进行糖类物质积累在29 ℃~32 ℃范围内更适宜。实验结果中藻体的可溶性性糖浓度在26 ℃时伴随CO2浓度升高而显著升高, 说明在该温度下增加水体的p(CO2)能够促进藻体的糖类物质积累。氨基酸是生物大分子蛋白质的基本组成单位, 在植物氮代谢与环境胁迫抗性方面占据重要地位, 游离氨基酸能够直接或间接对环境中的生物与非生物压力做出响应, 以缓解环境胁迫带来的不利影响, 增强植物的环境适应性[29]。温度显著影响了长心卡帕藻的游离氨基酸浓度, 无论CO2浓度如何, 游离氨基酸浓度从26 ℃到32 ℃都出现明显降低, 说明藻体的氮代谢速度加快, 氮需求增多, 这可能是长心卡帕藻适应高温环境的表现, 还可能与光合作用受到高温抑制有关。此外, 藻体的总有机碳浓度在酸化和高温时未发生显著变化, 而总氮浓度受到CO2浓度、温度及二者交互作用的显著影响。当环境中具有充足的氮浓度时, 藻体可以吸收足够的营养用以储存, 在受到环境胁迫时, 藻体就会利用储存的氮源进行生长代谢。因此, 当非酸化条件下温度升高至32 ℃时, 长心卡帕藻体内的总氮消耗速率增加, 浓度随之降低。实验结果说明, 非酸化条件下, 长心卡帕藻在32 ℃时受到温度的负面影响, 氮代谢速率大于氮吸收速率; 酸化条件下, 温度升高藻体总氮浓度增加, 氮吸收速率大于氮代谢速率, 推测在海水酸化时藻体具有相比于非酸化条件更好的高温适应性。同一温度下进行对比发现, 藻体在26 ℃时受到酸化的负面影响, 在29 ℃和32 ℃时提高CO2浓度, 总氮浓度增加, 藻体的氮积累增加以适应CO2浓度升高的环境变化。
综上所述, 长心卡帕藻的光合作用整体来看未受到海水酸化的显著影响, 但温度升高对藻体光合作用具有积极影响。在当前CO2浓度(450×10–6)下, 长心卡帕藻在26 ℃~29 ℃温度范围内表现出了更高的可溶性内含物积累(C、N)。但从29 ℃开始, 随着温度升高长心卡帕藻的代谢速率加快, 碳利用受到抑制, 总氮浓度减少, 藻体营养质量下降。此次研究中, 高CO2浓度(1 200×10–6)造成的酸化条件对长心卡帕藻的生化组分产生了一定程度的负面影响, 可能与生长末期藻体底部接收到的光照强度临近藻体的最适光照强度下限存在一些关联(受到光抑制)。但在海水酸化的条件下, 长心卡帕藻在29 ℃~32 ℃表现出更好的碳氮积累。
| [1] |
IPCC (The Intergovernmental Panel on Climate Change). Climate Change 2021: The Physical Science Basis[R]. Cambridge: United Kingdom, Cambridge University Press, 2021.
|
| [2] |
CALDEIRA K, WICKETT M E. Anthropogenic carbon and ocean pH[J]. Nature, 2003, 425(6956): 365-365. DOI:10.1038/425365a |
| [3] |
GORDILLO F J L, FIGUEROA F L, NIELL F X. Photon- and carbon-use efficiency in Ulva rigida at different CO2 and N levels[J]. Planta, 2003, 218(2): 315-322. DOI:10.1007/s00425-003-1087-3 |
| [4] |
董开升. 孔石莼和鼠尾藻对UV-B辐射的生理生化响应[D]. 青岛: 中国海洋大学, 2008. DONG Kaisheng. Response of activitiy of antioxidant enzymes to UV-B radiation enhancement in Ulva pertusa Kjellman and Sargassum. Hunbergia (Mert. ) O. Kuntze[D]. Qingdao: Ocean University of China, 2008. |
| [5] |
郑伟, 钟志海, 杨梓, 等. 大气CO2增加对不同生长光强下龙须菜光合生理特性的影响[J]. 生态学报, 2014, 34(24): 7293-7299. ZHENG Wei, ZHONG Zhihai, YANG Zi, et al. Effects of elevated CO2 concentration on the photosynthetic physiological characteristics of Gracilaria lemaneiformis grown under different light levels[J]. Acta Ecologica Sinica, 2014, 34(24): 7293-7299. |
| [6] |
范祥. 富营养化水体的贝-藻生态修复与增汇实验生态研究[D]. 厦门: 自然资源部第三海洋研究所, 2021. FAN Xiang. Experimental ecological research on shellfish-macroalgae ecological restoration amplify carbon sink in eutrophic water[D]. Xiamen: Third Institute of Oceanography, Ministry of Natural Resources, 2021. |
| [7] |
丁柳丽. 几种大型海藻生理生化特性对大气CO2浓度和温度变化的响应[D]. 广州: 华南理工大学, 2013. DING Liuli. Responses of physiological and biochemical traits to the changes of CO2 concentrations and temperature in marine macroalgae[D]. Guangzhou: South China University of Technology, 2013. |
| [8] |
丁柳丽, 刘露, 邹定辉. 不同温度与CO2浓度对坛紫菜生长和光合作用温度反应特性的影响[J]. 生态科学, 2013, 32(2): 151-157. DING Liuli, LIU Lu, ZOU Dinghui. Effects of different temperature and CO2 concentrations on the growth and photosynthetic response to temperature in Porphyra haitanensis[J]. Ecological Science, 2013, 32(2): 151-157. DOI:10.3969/j.issn.1008-8873.2013.02.003 |
| [9] |
李虎. 卡帕藻和麒麟菜光合和抗氧化系统对温度胁迫的响应[D]. 青岛: 中国科学院海洋研究所, 2017. LI Hu. Effects of the temperature stress on photosystem and antioxidant system in Kappaphycus and Eucheuma[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2017. |
| [10] |
ZOU D H. Effects of elevated atmospheric CO2 on growth, photosynthesis and nitrogen metabolism in the economic brown seaweed, Hizikia fusiforme (Sargassaceae, Phaeophyta)[J]. Aquaculture, 2005, 250(3/4): 726-735. |
| [11] |
徐智广, 邹定辉, 张鑫, 等. CO2和硝氮加富对龙须菜(Gracilaria lemaneiformis)生长、生化组分和营养盐吸收的影响[J]. 生态学报, 2008(8): 3752-3759. XU Zhiguang, ZOU Dinghui, ZHANG Xin, et al. Effects of increased atmospheric CO2 and N supply on growth, biochemical compositions and uptake of nutrients in Gracilaria lemaneiformis (Rhodophyta)[J]. Acta Ecologica Sinica, 2008(8): 3752-3759. |
| [12] |
CHEN B B, ZOU D H, YANG Y F. Increased iron availability resulting from increased CO2 enhances carbon and nitrogen metabolism in the economical marine red macroalga Pyropia haitanensis (Rhodophyta)[J]. Chemosphere, 2017, 173: 444-451. DOI:10.1016/j.chemosphere.2017.01.073 |
| [13] |
韦章良, 莫嘉豪, 胡群菊, 等. 不同光照强度下仙掌藻(Halimeda opuntia)对海洋酸化的生理响应[J]. 海洋通报, 2019, 38(5): 574-584. WEI Zhangliang, MO Jiahao, HU Qunju, et al. The physiological performance of the calcifying green macroalga Halimeda opuntia in response to ocean acidification with irradiance variability[J]. Marine Science Bulletin, 2019, 38(5): 574-584. |
| [14] |
RIEBESELL U, ZONDERVAN I, ROST B, et al. Reduced calcification of marine plankton in response to increased atmospheric CO2[J]. Nature, 2000, 407(6802): 364-367. DOI:10.1038/35030078 |
| [15] |
BAO M L, WANG J H, XU T P, et al. Rising CO2 levels alter the responses of the red macroalga Pyropia yezoensis under light stress[J]. Aquaculture, 2019, 501: 325-330. DOI:10.1016/j.aquaculture.2018.11.011 |
| [16] |
高秀秀, 李亚鹤, 段维军, 等. 光强和二氧化碳浓度变化对浒苔幼苗生长及生理的影响[J]. 海洋学报, 2015, 37(10): 80-87. GAO Xiuxiu, LI Yahe, DUAN Weijun, et al. The effects of light and increased CO2 on the growth and physiological performances in marine green algae Ulva prolifera seeding[J]. Acta Oceanologica Sinica, 2015, 37(10): 80-87. |
| [17] |
吴翔宇, 邢诒炫, 曾俊, 等. 长心卡帕藻两种颜色藻株的生长差异研究[J]. 河北渔业, 2020, 323(11): 20-22. WU Xiangyu, XIN Yixuan, ZENG Jun, et al. The growth difference of two colored marine algae Kappaphycus alvarezii[J]. Hebei Fisheries, 2020, 323(11): 20-22. DOI:10.3969/j.issn.1004-6755.2020.11.005 |
| [18] |
赵素芬, 何培民. 光照强度和盐度对长心卡帕藻生长的影响[J]. 热带海洋学报, 2009, 28(1): 74-79. ZHAO Sufen, HE Peimin. Effects of light intensity and salinity on growth of Kappaphycus alvarezii[J]. Journal of Tropical Oceanography, 2009, 28(1): 74-79. |
| [19] |
许慎栋, 张志楠, 余克服, 等. 南海造礁珊瑚Favia palauensis营养方式的空间差异及其对环境适应性的影响[J]. 中国科学: 地球科学, 2021, 64(6): 839-852. XU Shendong, ZHANG Zhinan, YU Kefu, et al. Spatial variations in the trophic status of Favia palauensis corals in the South China Sea: Insights into their different adaptabilities under contrasting environmental conditions[J]. Science China Earth Sciences, 2021, 64(6): 839-852. |
| [20] |
FRIEDLINGSTEIN P, JONES MW, O'SULLIVAN M, et al. Global Carbon Budget 2021[J]. Earth System Science Data, 2022, 14(4): 1917-2005. DOI:10.5194/essd-14-1917-2022 |
| [21] |
LUBCHENCO J, HAUGAN P M, PANGESTU M E. Five priorities for a sustainable ocean economy[J]. Nature, 2020, 588(7836): 30-32. DOI:10.1038/d41586-020-03303-3 |
| [22] |
HOFMANN L C, STRAUB S, BISCHOF K. Elevated CO2 levels affect the activity of nitrate reductase and carbonic anhydrase in the calcifying Rhodophyte Corallina officinalis[J]. Journal of Experimental Botany, 2013, 64(4): 899-908. DOI:10.1093/jxb/ers369 |
| [23] |
BAKER N R. Chlorophyll Fluorescence: A Probe of photosynthesis in vivo[J]. Annual Review of Plant Biology, 2008, 59(1): 89-113. DOI:10.1146/annurev.arplant.59.032607.092759 |
| [24] |
FIGUEROA F L, BONOMI-BARUFI J, CELIS-PLA P S M, et al. Short-term effects of increased CO2, nitrate and temperature on photosynthetic activity in Ulva rigida (Chlorophyta) estimated by different pulse amplitude modulated fluorometers and oxygen evolution[J]. Journal of Experimental Botany, 2021, 72(2): 491-509. DOI:10.1093/jxb/eraa473 |
| [25] |
MA J, WANG W, CAO J Y, et al. Response of the green alga Ulva prolifera grown at different irradiance levels under ocean acidification at different life cycle stages[J]. Botanica Marina, 2022, 65(5): 347-356. DOI:10.1515/bot-2022-0019 |
| [26] |
JI Y, XU Z G, ZOU D H, et al. Ecophysiological responses of marine macroalgae to climate change factors[J]. Journal of Applied Phycology, 2016, 28(5): 2953-2967. DOI:10.1007/s10811-016-0840-5 |
| [27] |
GONG N, SHAO K S, HAN X, et al. Enrichment and physiological responses of dechlorane plus on juvenile marine macroalgae (Ulva pertusa)[J]. Chemosphere, 2018, 205: 594-600. DOI:10.1016/j.chemosphere.2018.04.137 |
| [28] |
SUN Y, LIU Q, SHANG S, et al. Physiological responses and metabonomics analysis of male and female Sargassum thunbergii macroalgae exposed to ultraviolet-B stress[J]. Frontiers in Plant Science, 2022, 13: 778602. DOI:10.3389/fpls.2022.778602 |
| [29] |
ASHRAF M, HARRIS P J C. Potential biochemical indicators of salinity tolerance in plants[J]. Plant Science, 2004, 166(1): 3-16. DOI:10.1016/j.plantsci.2003.10.024 |
 2023, Vol. 47
2023, Vol. 47


