
文章信息
- 杨建朋, 曹亮, 董玉国, 刘金虎, 窦硕增. 2023.
- YANG Jian-peng, CAO Liang, DONG Yu-guo, LIU Jin-hu, DOU Shuo-zeng. 2023.
- 海水酸化和甲基汞胁迫条件下文蛤免疫应答和生物矿化响应
- Immune response and biomineralization in the gills and visceral mass of the clam, Meretrix petechialis, to methylmercury toxicity under ocean acidification conditions
- 海洋科学, 47(7): 22-34
- Marine Sciences, 47(7): 22-34.
- http://dx.doi.org/10.11759/hykx20230411001
-
文章历史
- 收稿日期:2023-04-11
- 修回日期:2023-05-16
2. 中国科学院大学, 北京 100049;
3. 华能霞浦核电有限公司, 福建 宁德 355100
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Huaneng Xiapu Nuclear Co. Ltd., Ningde 355100, China
自工业革命以来, 海洋作为最大的碳汇大量地吸收大气中的CO2, 导致海水pH降低和碳酸盐平衡体系发生变化即海洋酸化[1-3]。根据预测, 2100年和2300年末海水pH将分别降至7.7~7.8和7.3~7.4[4]。海洋酸化对海洋生物尤其钙化生物的生物过程如生长发育、繁殖、免疫应答和生物矿化等有着负面影响[5-7](Cao, 2018 #6)(Cao, 2018 #6)。海洋贝类缺少高效的酸碱平衡调节机制, 对海洋酸化更为敏感[8]。
人类活动等导致污染物(重金属)不断地进入近岸海域中, 与海洋酸化共同作用, 对海洋生态系统产生影响[9]。海洋酸化可以造成海洋生物的生理生化功能的改变, 导致它们消耗更多的能量来应对环境胁迫压力, 降低了其对重金属毒性的抵御能力。同时, 重金属污染会引起海洋生物受到体内的氧化胁迫, 造成DNA损伤和脂质过氧化等伤害[10]。例如, 海水中CO2含量升高能促进Cd和Cu在贝类中的生物积累, 产生高碳酸血症和金属应激对能量状态的负面影响, 进一步影响重金属对海洋双壳贝类的毒性和生物种群的持续繁衍[11]。
汞在大气中的寿命长, 并随大气运输和沉降, 因此, 汞污染具有区域性和全球性的环境影响[12-13]。甲基汞(MeHg)是汞在水生生物中的主要存在形式, 因其高生物利用性和神经毒性等特征备受研究者的关注[14-15]。文蛤(Meretrix petechialis)是中国近海重要经济贝类之一。文蛤体内生理指标对多种污染物胁迫响应比较敏感, 是近海环境质量状况的指示物种[16]。贝类可以通过溶菌酶(LZM)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)等多种水解酶类, 进行免疫调节, 避免生物体受到外源物质的危害[17]; 热休克蛋白(HSP)能够保护细胞免受高温、重金属和海水酸化等多种应激源的伤害, 修复受损蛋白[18]。碳酸酐酶(CA)、钙-ATP酶(Ca2+-ATPase)和钠/钾-ATP酶(Na+/K+-ATPase)维持细胞内酸碱平衡、离子稳态和生物矿化[19]。文蛤受到海洋酸化、重金属等多种胁迫时, 这些酶与非酶蛋白会协同作用, 帮助生物机体应对毒性损伤, 维持免疫功能和矿化作用的稳态。海洋双壳类在海洋生境中提供重要的生态服务, 并且在沿海地区具有重要的社会经济意义, 因此, 本文研究了不同海水酸化条件下甲基汞暴露对文蛤免疫和生物矿化相关酶活性的作用机制, 为评估海洋酸化情景下重金属污染对贝类生理过程和种群数量变动的影响提供科学依据。
1 材料与方法 1.1 实验设计文蛤(壳长43.7±6.8 mm)取自渤海莱州湾(山东潍坊)滩涂海域。自然条件下, 将文蛤置于养殖池中(3 m×3 m×1 m)驯化1周, 所用自然海水经过砂滤(平均温度17.0℃, 盐度32.5, pH 8.07)引入驯化水槽。驯化过程中, 每日定期投喂定量小球藻(Chlorella sp.), 并更新海水。
本研究设计5个甲基汞(MeHg)浓度和3种海水pH水平的交互实验, 解析文蛤免疫功能与生物矿化对两种胁迫因素共同暴露的响应。
参照IPCC海水酸化预测情景, 以自然海水(pH 8.10)为对照, 设置pH 7.7/中度酸化和7.30/高度酸化水平[4, 20]。利用CO2分压法维持SA水平[19], 即通过一种CO2自动控制系统将海水pH稳定控制至各标定pH水平。对照组仅通入空气, 酸化组通入空气-CO2混合气体。实验过程中每两天使用pH计(PB-10; Sartorius Instruments, Germany)校对控制系统的pH探头精度。
使用氯化甲基汞(纯度≥99.5%; Sigma-Aldrich Chemical Co., USA), 甲醇助溶, 用去离子水溶解, 配制MeHg母液。参考贝类亚致死浓度剂量[21-22], 设置浓度梯度: 空白、溶剂对照(甲醇)、0.1(低)、1(中)和5(高)μg/L MeHg+。每组暴露处理水平设置4个重复。
实验开始前, 每组处理选取20只健康文蛤个体, 置于30 L透明聚乙烯水槽中(25 L过滤海水), 持续充气。在室温、适量通风条件下, 为避免其他因素如光照的影响, 实验水槽随机放置在实验架上。每日定量添加新配置甲基汞母液, 维持更新的海水达到标定浓度。每日更新海水前清洗水箱, 以防止残饵、粪便等碎屑的积累或细菌增殖影响文蛤的代谢或对MeHg的生物利用度[23]。实验暴露持续21 d。
1.2 实验水体理化参数测定实验过程中, 每天使用水质参数仪(YSI, Yellow Spring, OH, USA)测定实验水体pCO2相关的理化参数和pH水平, 每周测水体的总碱度1次, 并依据各实验水体的温度、盐度、pHNBS和碱度等参数, 利用CO2SYS系统计算其碳酸盐参数、碳酸钙饱和度和pCO2值。
1.3 文蛤生化指标测定实验暴露结束时, 从每个实验水槽中选取3~4只文蛤个体进行解剖, 采集鳃和内脏团, 分别合并为一个生物组织样品储存于液氮中至生化分析, 即每个水槽的文蛤个体组成5~6个生物组织样本。
以溶菌酶(LZM)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、热休克蛋白(HSP 70)作为文蛤免疫应答的生物标志物; 以碳酸酐酶(CA)、钠/钾-ATP酶(Na+/K+-ATPase)和钙-ATP酶(Ca2+-ATPase)作为生物矿化过程的生物标志物。利用相关试剂盒(南京建成生物工程研究所, 南京, 中国)测定各组织样本中目标生物标志物的活性或表达量[19]。
1.4 数据分析生物标志物数据均以各处理的平均值±标准差(SD)表示。利用Kolmogorov-Smirnov test和Levene’s test分别检验生物标志物数据的正态性和方差齐性。在数据满足上述假设条件下, 利用双因素方差分析(two-way ANOVA)检验MeHg浓度和SA水平对生物标志物影响的显著性, 并利用Duncan test检验处理水平间的差异显著性。利用皮尔逊相关系数(Pearson’s correlation coefficient)检验各SA水平上生物标志物之间的相关性, 利用相关系数图可视化相关性指数[24]。
在本研究中, pH对照是指在每个MeHg浓度下在pH 8.10水平上的处理, MeHg对照组是指在每个pH水平下无溶剂(甲醇)处理的MeHg处理组。各生物标志物的组间差异性比较指同一MeHg浓度下SA处理组与pH对照组之间的比较, 或同一pH水平上MeHg处理组与MeHg对照组之间的比较。
统计差异显著性设置在P < 0.05水平上。统计分析在Excel(office 2019, USA)、SPSS(IBM Statistics SPSS 26 for Windows, USA)和R 3.6.2(R Foundation, Vienna, Austria)上进行。
2 结果 2.1 实验水体的理化参数实验过程中, 各标定pH处理组的实测海水pH值平均分别为8.06±0.02、7.72±0.03和7.29±0.02, 对应pCO2为492.4±23.1、1165.3±48.3和3267.1±131.7 μatm。相同pH值处理水平上各水槽内海水实测pH值在MeHg处理组之间无显著差异(one-way ANOVA, P > 0.05)。
实验过程中, 所有实验水槽内海水的平均水温和盐度为16.2±1.5(12.9~18.8℃)和32.8±0.2(32.4~33.1)。在不同水槽或处理中, 水温和盐度均无显著差异(P > 0.05)。
2.2 不同组织中免疫应答酶对海水酸化和甲基汞胁迫的响应 2.2.1 内脏团甲基汞(MeHg)与海水酸化(SA)胁迫均显著影响内脏团组织中免疫相关生物标志物的应答(ACP、AKP和LZM活性和HSP 70表达量), 两种应激源的交互作用均显著影响其活性或表达量(two-way ANOVAP < 0.05)。
各pH处理水平上4个生物标志物在溶剂组与相应的对照组之间均无显著性差异(Duncan test, P < 0.05, 图 1)。
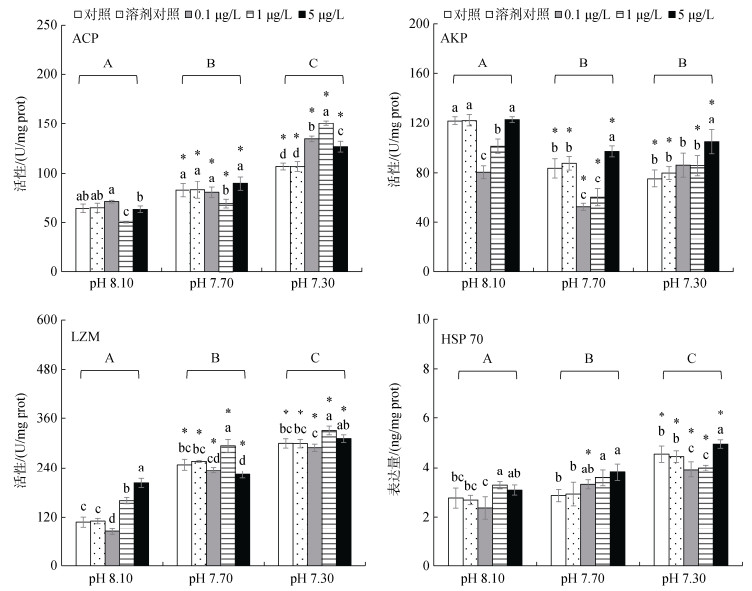 |
| 图 1 海水酸化和甲基汞胁迫对文蛤内脏团内免疫应答生物标志物的影响 Fig. 1 Effects of seawater acidification and methylmercury exposure on immune response biomarkers in the visceral mass of the clam 注: 不同小写字母表示同一pH水平下, MeHg质量浓度处理组与MeHg对照组之间差异显著(P > 0.05); 不同大写字母表示所有MeHg浓度下, 不同pH处理组之间差异显著(P < 0.05); *. 同一MeHg质量浓度下, 海水酸化处理组与pH对照组之间差异显著(P < 0.05), 图 2、图 4同 |
未海水酸化(pH 8.10)和中度SA(7.70)条件下, 相对于MeHg对照组(0 μg/L), 低质量浓度MeHg (0.1 μg/L)暴露组的ACP活性被显著抑制; 高度SA水平(pH 7.30)上, 与MeHg对照组相比, ACP活性在各MeHg浓度组中显著升高。在各MeHg浓度组中, 相较于pH对照组, 中、高度SA均显著提高ACP活性(P > 0.05, 图 1)。
未海水酸化条件下, 低、中MeHg质量浓度组(1 μg/L)中的AKP活性显著降低, 但高MeHg质量浓度(5 μg/L)对AKP活性无显著影响; 而在中、高度酸化水平下, AKP活性在各MeHg质量浓度组中均显著降低。在各MeHg质量浓度组中, 除在中度SA-低MeHg质量浓度处理组外, 中、高度SA均显著抑制AKP活性(P < 0.05, 图 1)。
未海水酸化条件下, 低质量浓度MeHg显著抑制LZM活性。中、高质量浓度MeHg处理显著诱导LZM活性。在各MeHg质量浓度组中, 中、高度SA均显著提高LZM活性(P < 0.05, 图 1)。
未海水酸化条件下, HSP 70表达量在低MeHg质量浓度组中显著降低, 中质量浓度MeHg显著促进HSP 70产生; 中度SA水平上, 中、高质量浓度MeHg显著诱导HSP 70表达量; 高度SA水平上, 低、中质量浓度MeHg显著抑制HSP 70表达量, 而高质量浓度MeHg则显著提高HSP 70表达量。各MeHg质量浓度中, 高度SA显著诱导HSP 70产生(P > 0.05, 图 1)。
甲基汞和海水酸化对内脏团中免疫应答相关酶的作用依赖于二者的暴露水平。总体而言, 海水酸化显著诱导ACP和LZM活性以及HSP 70表达量, 但显著抑制AKP活性(图 1)。
2.2.2 鳃海水酸化显著影响鳃组织中ACP、AKP和LZM活性及HSP 70表达量, 甲基汞显著影响ACP和AKP活性, 二者的交互作用显著影响ACP、AKP和LZM活性(two-way ANOVA, P < 0.05)。
各pH处理水平上4个生物标志物在溶剂组与相应的对照组之间均无显著性差异(Duncan test, P < 0.05, 图 2)。
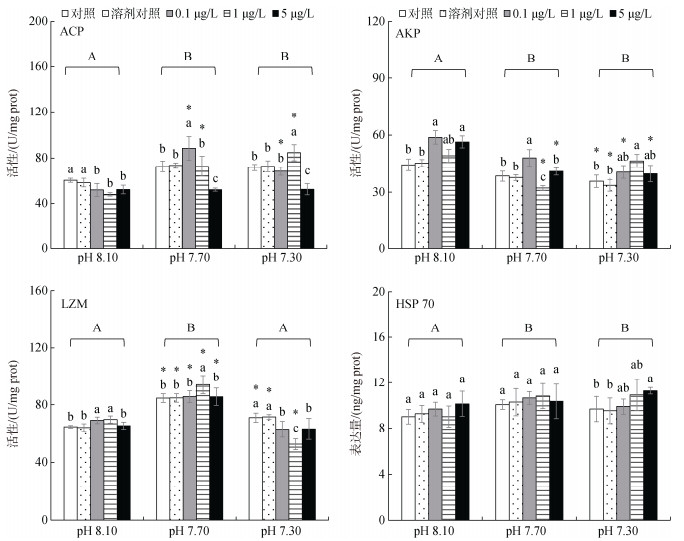 |
| 图 2 海水酸化和甲基汞胁迫对文蛤鳃内免疫应答生物标志物的影响 Fig. 2 Effects of seawater acidification and methylmercury exposure on immune response biomarkers in the gill of the clam |
未海水酸化条件下, ACP活性被MeHg显著抑制; SA下, 低质量浓度MeHg显著诱导但高质量浓度MeHg显著抑制ACP活性。低、中质量浓度MeHg组中, 中、高度SA显著诱导ACP活性(P < 0.05, 图 2)。
未海水酸化条件下, 低、高质量浓度MeHg显著诱导AKP活性; 中度SA水平上, AKP活性在低、中MeHg质量浓度组分别被显著升高和抑制; 高度SA水平上, 中质量浓度MeHg显著诱导AKP活性。在高质量浓度MeHg组中, 中、高度SA均显著降低AKP活性(P < 0.05, 图 2)。
未海水酸化和中度SA条件下, 中质量浓度MeHg显著诱导LZM活性。各MeHg质量浓度中, 中度SA显著诱导LZM活性(P < 0.05, 图 2)。
HSP 70表达量在中度SA-高MeHg质量浓度处理组中被显著提高(P < 0.05)。各MeHg质量浓度下, 海水酸化对HSP 70表达量影响不显著(P > 0.05, 图 2)。
总体而言, 海水酸化显著诱导ACP和HSP 70表达量, 但显著抑制AKP活性(图 2)。
2.2.3 免疫相关生物标志物对共同胁迫响应的相关性皮尔逊相关系数分析表明, 内脏团中, 未酸化海水条件下, ACP活性与HSP 70表达量和LZM活性显著负相关, LZM活性与AKP活性和HSP 70表达量显著正相关(图 3A); 中度SA使ACP活性与AKP活性显著正相关, 而与LZM活性显著负相关(图 3B); 高度SA条件下, ACP活性与LZM活性显著正相关, 而与HSP 70表达量显著负相关(Pearson’s correlation coefficient, P < 0.05, 图 3C)。
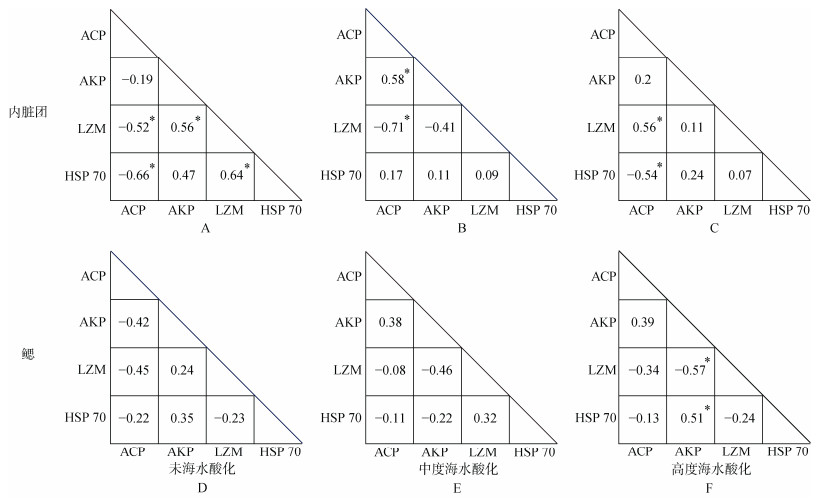 |
| 图 3 海水酸化和甲基汞胁迫下对文蛤内脏团(A、B、C)和鳃(D、E、F)内免疫应答相关生物标志物间的相关系数图 Fig. 3 Correlation coefficient maps of immune response biomarkers to methylmercury in the visceral mass (A, B, and C) and gill (D, E, and F) of the clam under seawater acidification conditions 注: 生物标志物之间相关关系: 未海水酸化(A、D)、中度海水酸化(B、E)和高度海水酸化(C、F); 正负相关系数(r值)分别对应正、负线性关系; *表示生物标志物之间的线性相关性显著(P > 0.05), 图 5同 |
鳃中, 未海水酸化和中度SA条件下, 各免疫相关生物标志物之间无显著相关性(图 3D, E); 高度SA条件下, AKP活性和LZM活性显著负相关, 而与HSP 70表达量显著正相关(P < 0.05, 图 3F)。
2.3 海水酸化与甲基汞胁迫对文蛤生物矿化相关生物标志物的作用 2.3.1 内脏团海水酸化和甲基汞胁迫对Na+/K+-ATPase和Ca2+-ATPase活性均有显著影响, CA表达量仅受SA水平影响, 3种生物标志物均受两种胁迫交互作用的影响(two-way ANOVA, P < 0.05)。
各pH处理水平上3个生物标志物在溶剂组与相应的对照组之间均无显著性差异(Duncan test, P > 0.05, 图 4)。
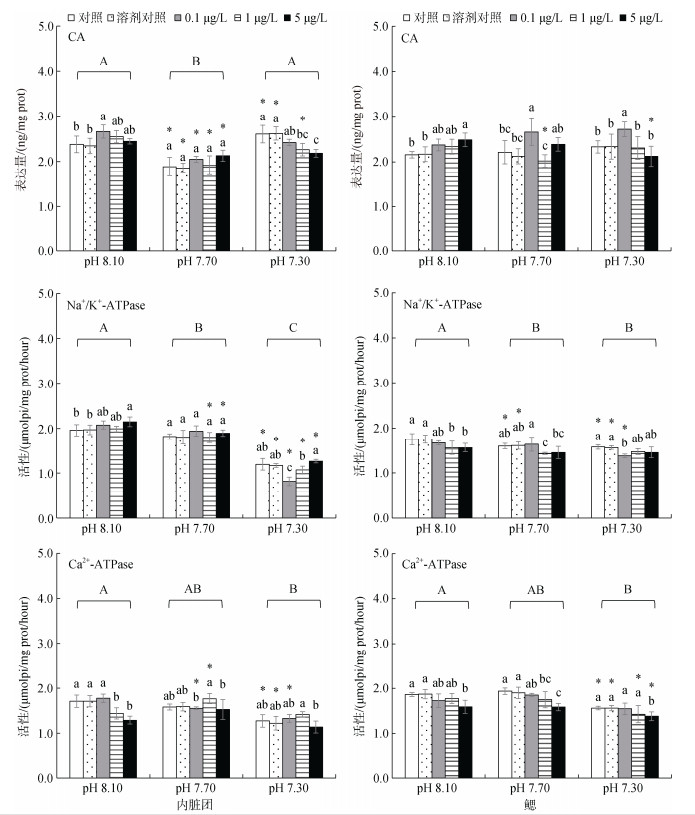 |
| 图 4 海水酸化和甲基汞胁迫对文蛤内脏团和鳃内生物矿化生物标志物的影响 Fig. 4 Effects of seawater acidification and methylmercury exposure on biomineralization biomarkers in the visceral mass and gill of the clam |
未海水酸化条件下, 中质量浓度MeHg显著提高CA表达量; 中度SA水平上, 各MeHg质量浓度组间的CA表达量无显著变化; 高度SA水平上, 高质量浓度MeHg显著降低CA表达量。各MeHg质量浓度组中, 中度酸化显著降低CA表达量(P < 0.05, 图 4)。
未海水酸化条件下, 高质量浓度MeHg显著诱导Na+/K+-ATPase活性; 高度SA水平上, 低质量浓度MeHg显著降低Na+/K+-ATPase活性。在中、高质量MeHg浓度中, 中、高度SA显著降低Na+/K+-ATPase活性(P < 0.05, 图 4)。
未海水酸化条件下, 中、高质量浓度MeHg显著抑制Ca2+-ATPase的活性; 在中、高度SA水平上, 各MeHg质量浓度组的Ca2+-ATPase活性无显著变化(P > 0.05)。低MeHg质量浓度组中, 中度、高度酸化显著降低Ca2+-ATPase活性(P < 0.05, 图 4)。
甲基汞和海水酸化对内脏团中生物矿化相关酶的作用依赖于二者的暴露水平。总体上, 海水酸化显著抑制Na+/K+-ATPase活性(图 4)。
2.3.2 鳃海水酸化和甲基汞显著影响鳃组织中Na+/K+- ATPase和Ca2+-ATPase的活性, 二者的交互作仅显著影响CA表达量(two-way ANOVA, P < 0.05)。
各pH处理水平上3个生物标志物在溶剂组与相应的对照组之间均无显著性差异(Duncan test, P < 0.05, 图 4)。
未海水酸化条件下, 高质量浓度MeHg显著提高CA表达量; 中度SA水平上, 低质量浓度MeHg显著促进; 高度酸化水平上, 低质量浓度MeHg显著提高CA表达量。高MeHg质量浓度组中, 高度SA显著降低CA表达量(P < 0.05, 图 4)。
未海水酸化和中度SA条件下, 中质量浓度MeHg显著抑制Na+/K+-ATPase活性; 高度SA水平上, 低质量浓度MeHg显著抑制Na+/K+-ATPase活性。未MeHg暴露组中, 中、高度SA水平均显著抑制Na+/K+-ATPase活性(P < 0.05, 图 4)。
各pH水平上, 高质量浓度MeHg显著抑制Ca2+-ATPase活性。除了在低质量浓度MeHg组外, 高度SA显著降低Ca2+-ATPase活性(P < 0.05, 图 4)。
总体上, 海水酸化总体上显著抑制Na+/K+-ATPase活性(图 4)。
2.3.3 生物矿化生物标志物对共同胁迫响应的相关性用皮尔逊相关系数对内脏团和鳃中生物矿化相关生物标志物参数之间进行线性相关分析, 解析两种组织的生物矿化作用在海水酸化和甲基汞共同胁迫下的响应。
内脏团中, 非酸化和中度SA条件下, 矿化相关生物标志物之间无显著影响(图 5A, B); 高度SA海水使得CA表达量与Ca2+-ATPase活性显著负相关(Pearson’s correlation coefficient, P < 0.05, 图 5C)。
 |
| 图 5 海水酸化和甲基汞胁迫下对文蛤内脏团(A、B、C)和鳃(D、E、F)内生物矿化相关生物标志物间的相关系数图 Fig. 5 Pearson correlation coefficient maps of biomineralization to methylmercury in the visceral mass (A, B, and C) and gill (D, E, and F) of the clam under seawater acidification conditions |
鳃中, 非海水酸化条件下, CA表达量与Ca2+- ATPase活性显著负相关(图 5D); 中度SA条件下, Na+/K+-ATPase活性和Ca2+-ATPase活性显著正相关(图 5E); 高度SA条件下, 矿化相关生物标志物之间无显著相关性(Pearson’s correlation coefficient, P < 0.05, 图 5F)。
2.4 免疫功能和矿化作用对共同胁迫的整合响应分别对内脏团和鳃中免疫功能和生物矿化相关的所有生物标志物进行主成分分析, 解析两种组织的两个生理功能对海水酸化(SA)和甲基汞(MeHg)共同胁迫的整合响应。
内脏团中的3个PCs解释了86.55%的总方差: PC1-52.45%, PC2-23.22%, PC3-10.88%。PC1和PC2有效地将3个pH组分离(图 6A), PC1和PC3将高度SA与未海水酸化组分开(图 6B), 显示了生物标志物整体上对海水酸化的敏感性。PC1轴分离主要由ACP、LZM、HSP 70、Na+/K+-ATPase表达决定; PC2轴分离主要由AKP、Ca2+-ATPase表达决定; PC3轴分离主要由CA表达决定(图 6A, B)。
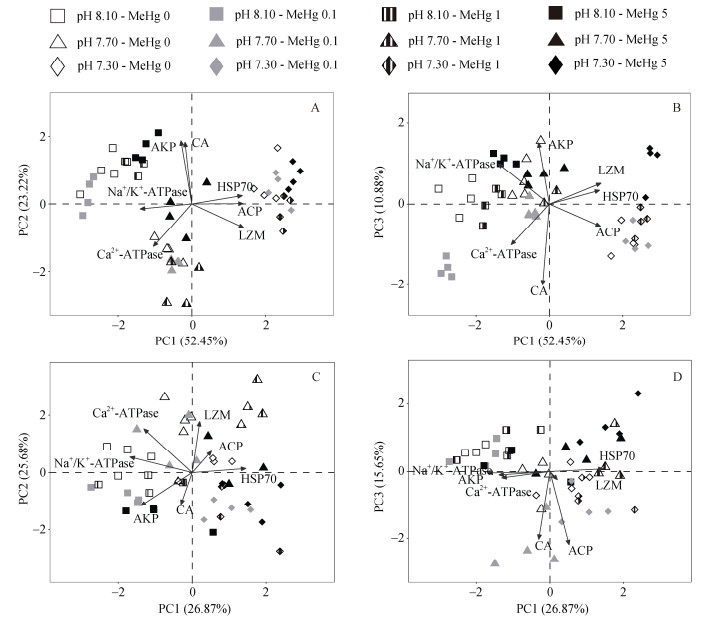 |
| 图 6 海水酸化和甲基汞胁迫下文蛤内脏团(A、B)和鳃(C、D)内免疫应答和生物矿化相关生物标志物的整合响应 Fig. 6 Integrative responses of immune and biomineralization related biomarkers to the co-exposure of seawater acidification and MeHg in the visceral mass (A, B) and gill (C, D) of the clam |
鳃中的3个PCs解释了68.21%的总方差: PC1- 26.87%, PC2-25.68%, PC3-15.65%。其中, PC1和PC3能有效地将未海水酸化组与中、高度SA组分开。PC1轴分离主要由ACP、LZM、HSP 70、Na+/K+-ATPase表达决定; PC2轴分离主要由AKP、Ca2+-ATPase表达决定; PC3轴分离主要由CA表达决定(图 6C, D)。
这些结果表明, ACP、LZM、HSP 70、Na+/K+- ATPase等对海水酸化响应比较敏感, 可以作为评价海水酸化对文蛤内脏团和鳃组织免疫功能和矿化作用影响的潜在生物标志物。
3 讨论 3.1 海水酸化条件下文蛤对MeHg胁迫的免疫应答的响应海洋贝类具有开放的循环系统, 其生理功能易受环境污染的直接或间接作用, 包括免疫系统在内的稳态机制的改变等, 影响免疫应答[25]。贝类一般通过细胞免疫和多种体液免疫因子的协同作用来对抗污染物影响, 并将其排出体外[17, 26]。贝类受到海水酸化和甲基汞胁迫时会产生大量的ROS, 影响其吞噬作用和体液免疫因子如凝集素、溶菌酶(LZM)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)等的表达。此外, 大多数免疫酶类存在于细胞溶酶体中, 甲基汞与其膜蛋白上的-SH结合, 导致膜通透性增加甚至裂解和酶的释放[27-28]。研究表明, 海水酸化和重金属单一胁迫或共同胁迫会抑制贝类的吞噬作用, 同时改变体液免疫相关酶的活性, 导致生物体免疫抑制或免疫刺激[29-31]。
甲基汞胁迫产生过量ROS引起细胞膜脂质过氧化, 破坏了免疫细胞的结构和功能, 阻碍LZM的分泌; 另一方面, ROS引起免疫细胞内DNA损伤, 干扰与LZM产生过程相关基因的转录和表达, 阻碍LZM的合成[32-33]。此外, Cd和海水酸化暴露下, 褐牙鲆(Paralichthys olivaceus)的一些免疫因子特别是溶菌酶水平被诱导以调动自身的免疫系统来补偿免疫力下降[19]。中度海水酸化(pH 7.60)则显著促进了硬壳蛤(Mercenaria mercenaria)血细胞中LZM的产生[29]。本研究中, 海水酸化显著诱导LZM的活性; 在未酸化海水中, 甲基汞胁迫显著促进了内脏团LZM的活性, 这与汞暴露诱导鱼类的溶菌酶活性一致[33-34]。因此, 文蛤通过调动通过免疫应答, 刺激LZM生成以提高自身免疫力, 应对外源胁迫带来的免疫毒性。
ACP和AKP分布于海洋生物溶酶体内, 可以用作评估双壳贝类重金属污染的免疫应答生物标志物[35]。ACP可以经由水解作用破坏病原体内的磷酸酯键, 分解入侵的病原体, 起到免疫的功能; AKP存在于细胞质膜上, 其免疫功能主要是改变或修饰入侵异物表面的分子结构, 增加免疫细胞对异物的识别能力[36-37]。本研究中, 海水酸化胁迫显著诱导了文蛤鳃和内脏团中的ACP活性, 同时提高了LZM活性和HSP 70表达量的增加, 协同提高文蛤体内的免疫防御。但是, 海水酸化抑制了AKP活性, 表现出ACP和AKP两种磷酸酶出对海水酸化胁迫响应的组织差异性。
热休克蛋白(HSP)是具有高度保守性的热应激蛋白, 生物体在受到物理或化学应激源(如高温、海水酸化或者重金属)胁迫时可通过调节体内的HSP表达应对毒性损伤[18, 38]。HSP 70作为分子伴侣在促进
贝类蛋白质折叠、膜转运、错误折叠蛋白的降解和维持细胞内稳态等过程中起着重要作用, 可以调节细胞内体液免疫因子的生成和分泌[38-39]。甲基汞易形成亲水复合物进行跨细胞膜运输, 并可能被富含半胱氨酸的蛋白质或谷胱甘肽螯合在HSP中[40], 因此, HSP 70具有较高的生物标志物潜能[41]。本研究中, 未酸化与中度海水酸化海水中, 甲基汞胁迫未显著影响文蛤鳃中HSP 70的表达, 共同胁迫对文蛤鳃内蛋白质的损伤较小, 生物体不需要额外生成HSP 70来修复和清除受损蛋白。而在高甲基汞胁迫下, 文蛤内脏团诱导HSP 70产生, 而且其表达量在高度海水酸化条件下随甲基汞浓度升高而升高, 这有助于文蛤及时应对蛋白质损伤, 减缓免疫应答损伤。类似结果也出现在海水酸化(pH 7.80)和Cd(10 μg/L)胁迫下长牡蛎(Crassostrea gigas)中, 即消化腺和鳃内HSP 70的表达量被显著上调, 促进受损蛋白的修复和清除[7]。
3.2 MeHg和海水酸化共同胁迫对文蛤生物矿化相关酶的影响贝类通过生物矿化作用构建碳酸钙保护贝壳。研究表明, 海水酸化和重金属暴露会影响贝类壳生长和性能, 降低贝壳结构完整性和生物矿化能力[42-44]。其中, 碳酸酐酶(CA)在无脊椎动物的矿化如贝壳的发育生长中起着重要作用, 而Ca2+-ATP酶和Na+/K+-ATP酶是重要的跨膜蛋白, 参与调节生物体的呼吸、离子转运、酸碱调节和钙化等多种生理功能[45-46]。本研究中, 文蛤内脏团内CA表达, Na+/K+-ATP酶和Ca2+- ATP酶的活性未受中度海水酸化和甲基汞共同胁迫的影响; 在此胁迫条件下, 内脏团中的CO2、HCO3–和H+浓度以及甲基汞蓄积量的增加未超出文蛤自身的酸碱调节能力和解毒能力, 因而未引起这些酶的显著变化[47]。高海水酸化胁迫下, 内脏团CA对甲基汞胁迫的敏感性增加, 其表达被抑制, 干扰了文蛤的酸碱调节能力, CO2不能及时被转化或清除, 对生物矿化作用产生负面影响[5, 47-49], 这与Cd胁迫显著抑制了紫贻贝(Mytilus galloprovincialis)体内CA表达这一现象一致[42]。此外, 文蛤鳃和内脏团中Na+/ K+-ATP酶和Ca2+-ATP酶对高度海水酸化更为敏感, 海水酸化引起的碳酸盐平衡的变化一定程度上抑制了两种ATP酶的活性, 进而干扰能量供给和Ca2+吸收、转运过程, 影响生物矿化作用[50], 这与海水酸化(pH≤7.80)显著抑制缢蛏(Sinonovacula constricta)的Ca2+/Mg2+-ATP酶的活性类似[51]。在文蛤鳃中, 海水酸化和甲基汞共同胁迫未显著影响CA表达量的变化。但是, 海水酸化和砷胁迫显著抑制了长牡蛎(C. gigas)和福建牡蛎(Crassostrea angulata)体内CA表达[5], 说明二者共同胁迫对CA表达的影响在物种或金属之间存在差异。另一方面, 文蛤鳃内Na+/K+- ATP酶和Ca2+-ATP酶的活性相较于CA对甲基汞胁迫更为敏感。甲基汞胁迫导致文蛤鳃内ROS和重金属蓄积, 会破坏酶的结构和功能并抑制其活性, 阻碍能量供给和Ca2+吸收、转运过程, 最终可能影响文蛤的生物矿化作用[47]。高度海水酸化的作用下, 高浓度甲基汞胁迫显著抑制Na+/K+-ATP酶和Ca2+-ATP酶的活性, 表示海水酸化能潜在地加剧甲基汞对文蛤生物矿化作用的毒性效应。
总体而言, 海水酸化和甲基汞胁迫显著影响文蛤内脏团和鳃免疫应答和生物矿化作用, 并表现出组织差异性。相较于单一生物标志物评价法, 综合生物标志物评价能够更加客观地评估受试生物的整体生理响应。ACP、LZM、HSP 70、Na+/K+-ATPase等生物标志物对二者共同胁迫的响应比较敏感, 在评价海洋酸化背景下甲基汞对文蛤的毒性效应中具有潜在的生物指示能力。
| [1] |
SABINE C L, FEELY R A, GRUBER N, et al. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305: 367-371. DOI:10.1126/science.1097403 |
| [2] |
ORR J C, FABRY V J, AUMONT O, et al. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J]. Nature, 2005, 437(29): 681-686. |
| [3] |
STOCKDALE A, TIPPING E, LOFTS S, et al. Effect of ocean acidification on organic and inorganic speciation of trace metals[J]. Environmental Science & Technology, 2016, 50(4): 1906-1913. |
| [4] |
CALDEIRA K, WICKETT M E. Oceanography: Anthropogenic carbon and ocean pH[J]. Nature, 2003, 425: 365. DOI:10.1038/425365a |
| [5] |
MOREIRA A, FIGUEIRA E, SOARES A M. The effects of arsenic and seawater acidification on antioxidant and biomineralization responses in two closely related Crassostrea species[J]. Science of the Total Environment, 2016, 545-546: 569-581. DOI:10.1016/j.scitotenv.2015.12.029 |
| [6] |
SILVA C S, NOVAIS S C, LEMOS M F, et al. Effects of ocean acidification on the swimming ability, development and biochemical responses of sand smelt larvae[J]. Science of the Total Environment, 2016, 563-564: 89-98. DOI:10.1016/j.scitotenv.2016.04.091 |
| [7] |
CAO R W, LIU Y L, WANG Q, et al. The impact of ocean acidification and cadmium on the immune responses of Pacific oyster, Crassostrea gigas[J]. Fish & Shellfish Immunology, 2018, 81: 456-462. |
| [8] |
WITTMANN A C, PORTNER H O. Sensitivities of extant animal taxa to ocean acidification[J]. Nature Climate Change, 2013, 3(11): 995-1001. DOI:10.1038/nclimate1982 |
| [9] |
ZENG X F, CHEN X J, ZHUANG J. The positive relationship between ocean acidification and pollution[J]. Marine Pollution Bulletin, 2015, 91(1): 14-21. DOI:10.1016/j.marpolbul.2014.12.001 |
| [10] |
AHMAD I, MOHMOOD I, MIEIRO C L, et al. Lipid peroxidation vs. antioxidant modulation in the bivalve Scrobicularia plana in response to environmental mercury—organ specificities and age effect[J]. Aquatic Toxicology, 2011, 103(3/4): 150-158. |
| [11] |
GOETZE S, MATOO O B, BENIASH E, et al. Interactive effects of CO2 and trace metals on the proteasome activity and cellular stress response of marine bivalves Crassostrea virginica and Mercenaria mercenaria[J]. Aquatic Toxicology, 2014, 149: 65-82. DOI:10.1016/j.aquatox.2014.01.027 |
| [12] |
ALAVA J J, CISNEROS-MONTEMAYOR A M, SUMAILA U R, et al. Projected amplification of food web bioaccumulation of MeHg and PCBs under climate change in the Northeastern Pacific[J]. Scientific Reports, 2018, 8(1): 13460. DOI:10.1038/s41598-018-31824-5 |
| [13] |
RODRIGUES P D, FERRARI R G, DOS SANTOS L N, et al. Mercury in aquatic fauna contamination: A systematic review on its dynamics and potential health risks[J]. Journal of Environmental Sciences, 2019, 84: 205-218. DOI:10.1016/j.jes.2019.02.018 |
| [14] |
BURGER J, GOCHFELD M. Mercury and selenium levels in 19 species of saltwater fish from New Jersey as a function of species, size, and season[J]. Science of the Total Environment, 2011, 409(8): 1418-1429. DOI:10.1016/j.scitotenv.2010.12.034 |
| [15] |
CAMACHO C, MAULVAULT A L, SANTOS M T, et al. Mercury in juvenile Solea senegalensis: Linking bioaccumulation, seafood safety, and neuro-oxidative responses under climate change-related stressors[J]. Applied Sciences, 2020, 10(6): 1993. DOI:10.3390/app10061993 |
| [16] |
KUMAR M R, KRISHNAN K A, VIMEXEN V. Effect of trace metal contamination in sediments on the bioaccumulation of bivalve Meretrix meretrix[J]. Marine Pollution Bulletin, 2022, 176: 113422. DOI:10.1016/j.marpolbul.2022.113422 |
| [17] |
WANG L, PAN L Q, LIU N, et al. Biomarkers and bioaccumulation of clam Ruditapes philippinarum in response to combined cadmium and benzo[a]pyrene exposure[J]. Food and Chemical Toxicology, 2011, 49: 3407-3417. DOI:10.1016/j.fct.2011.06.015 |
| [18] |
RAJESHKUMAR S, MUNUSWAMY N. Impact of metals on histopathology and expression of HSP 70 in different tissues of Milk fish (Chanos chanos) of Kaattuppalli Island, South East Coast, India[J]. Chemosphere, 2011, 83(4): 415-421. DOI:10.1016/j.chemosphere.2010.12.086 |
| [19] |
CUI W T, LIU J H, CAO L, et al. Toxicological effects of cadmium on the immune response and biomineralization of larval flounder Paralichthys olivaceus under seawater acidification[J]. Chemosphere, 2022, 291: 132919. DOI:10.1016/j.chemosphere.2021.132919 |
| [20] |
IPCC. Climate change 2014: Synthesis report. Contribution of working groups I; II and III to the fifth assessment report of the intergovernmental panel on climate change[R]. Switzerland: IPCC Geneva, 2014.
|
| [21] |
CANESI L, VIARENGO A, LEONZIO C, et al. Heavy metals and glutathione metabolism in mussel tissues[J]. Aquatic Toxicology, 1999, 46(1): 67-76. DOI:10.1016/S0166-445X(98)00116-7 |
| [22] |
FARIA M, CARRASCO L, DIEZ S, et al. Multi-biomarker responses in the freshwater mussel Dreissena polymorpha exposed to polychlorobiphenyls and metals[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 149(3): 281-288. |
| [23] |
BELIVERMIS M, WARNAU M, METIAN M, et al. Limited effects of increased CO2 and temperature on metal and radionuclide bioaccumulation in a sessile invertebrate, the oyster Crassostrea gigas[J]. ICES Journal of Marine Science, 2016, 73(3): 753-763. DOI:10.1093/icesjms/fsv236 |
| [24] |
XIAO Z T, CAO L, LIU J H, et al. pCO2-driven seawater acidification affects aqueous-phase copper toxicity in juvenile flounder Paralichthys olivaceus: Metal accumulation, antioxidant defenses and detoxification in livers[J]. Science of the Total Environment, 2023, 858: 160040. DOI:10.1016/j.scitotenv.2022.160040 |
| [25] |
THIAGARAJAN R, GOPALAKRISHNAN S, THILAGAM H. Immunomodulation the marine green mussel Perna viridis exposed to sub-lethal concentrations of Cu and Hg[J]. Archives of Environmental Contamination and Toxicology, 2006, 51(3): 392-399. DOI:10.1007/s00244-005-0192-7 |
| [26] |
MATOZZO V, BALLARIN L, PAMPANIN D M, et al. Effects of copper and cadmium exposure on functional responses of hemocytes in the clam, Tapes philippinarum[J]. Archives of Environmental Contamination and Toxicology, 2001, 41: 163-170. DOI:10.1007/s002440010234 |
| [27] |
SHARMA M K, KUMAR M, KUMAR A. Protection against mercury-induced renal damage in Swiss albino mice by Ocimum sanctum[J]. Environmental Toxicology and Pharmacology, 2005, 19(1): 161-167. DOI:10.1016/j.etap.2004.06.002 |
| [28] |
KONG X H, WANG S P, JIANG H X, et al. Responses of acid/alkaline phosphatase, lysozyme, and catalase activities and lipid peroxidation to mercury exposure during the embryonic development of goldfish Carassius auratus[J]. Aquatic Toxicology, 2012, 120-121: 119-125. DOI:10.1016/j.aquatox.2012.05.005 |
| [29] |
IVANINA A V, HAWKINS C, SOKOLOVA I M. Immunomodulation by the interactive effects of cadmium and hypercapnia in marine bivalves Crassostrea virginica and Mercenaria mercenaria[J]. Fish & Shellfish Immunology, 2014, 37(2): 299-312. |
| [30] |
LIU S, SHI W, GUO C, et al. Ocean acidification weakens the immune response of blood clam through hampering the NF-kappa β and toll-like receptor pathways[J]. Fish & Shellfish Immunology, 2016, 54: 322-327. |
| [31] |
LU Z, WANG S, SHAN X J. Differential biological effects in two pedigrees of clam Ruditapes philippinarum exposed to cadmium using iTRAQ-based proteomics[J]. Environmental Toxicology and Pharmacology, 2019, 65: 66-72. DOI:10.1016/j.etap.2018.12.002 |
| [32] |
KIM J H, KANG J C. Oxidative stress, neurotoxicity, and non-specific immune responses in juvenile red sea bream, Pagrus major, exposed to different waterborne selenium concentrations[J]. Chemosphere, 2015, 135: 46-52. DOI:10.1016/j.chemosphere.2015.03.062 |
| [33] |
REN Z H, LIU J H, HUANG W, et al. Antioxidant defenses and immune responses of flounder Paralichthys olivaceus larvae under methylmercury exposure[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2019, 225: 108589. |
| [34] |
SUN Y L, LI Y W, RAO J D, et al. Effects of inorganic mercury exposure on histological structure, antioxidant status and immune response of immune organs in yellow catfish (Pelteobagrus fulvidraco)[J]. Journal of Applied Toxicology, 2018, 38(6): 843-854. DOI:10.1002/jat.3592 |
| [35] |
RAJALAKSHMI S, MOHANDAS A. Impact of mercury on the activity pattern of a marker enzyme in a freshwater bivalve[J]. The Environmentalist, 2008, 28(3): 249-252. DOI:10.1007/s10669-007-9135-3 |
| [36] |
BLASCO J, PUPPO L, SARASQUETE M C. Acid and alkaline phosphatase activities in the clam Ruditapes philippinarum[J]. Marine Biology, 1993, 115: 113-118. DOI:10.1007/BF00349392 |
| [37] |
MAZORRA M T, RUBIO J A, BLASCO J. Acid and alkaline phosphatase activities in the clam Scrobicularia plana: kinetic characteristics and effects of heavy metals[J]. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2002, 131: 241-249. DOI:10.1016/S1096-4959(01)00502-4 |
| [38] |
MORAGA D, MEISTERTZHEIM A L, TANGUY- ROYER S. Stress response in Cu2+ and Cd2+ exposed oysters (Crassostrea gigas): an immunohistochemical approach[J]. Comparative Biochemistry and Physiology Part C Comparative Pharmacology & Toxicology, 2005, 141(1): 151-156. |
| [39] |
SOKOŁOWSKI A, BRULIŃSKA D. The effects of low seawater pH on energy storage and heat shock protein 70 expression in a bivalve Limecola balthica[J]. Marine Environmental Research, 2018, 140: 289-298. DOI:10.1016/j.marenvres.2018.06.018 |
| [40] |
SIMMONS-WILLIS T A, KOH A S, CLARKSON T W, et al. Transport of a neurotoxicant by molecular mimicry: the methylmercury-L-cysteine complex is a substrate for human L-type large neutral amino acid transporter (LAT) 1 and LAT 2[J]. Biochemical Journal, 2002, 367: 239-246. DOI:10.1042/bj20020841 |
| [41] |
DANG F, WANG W X. Subcellular controls of mercury trophic transfer to a marine fish[J]. Aquatic Toxicology, 2010, 99(4): 500-506. DOI:10.1016/j.aquatox.2010.06.010 |
| [42] |
LIONETTO M G, CARICATO R, ERROI E, et al. Potential application of carbonic anhydrase activity in bioassay and biomarker studies[J]. Chemistry and Ecology, 2006, 22(S1): 119-125. |
| [43] |
FITZER S C, TORRES GABARDA S, DALY L, et al. Coastal acidification impacts on shell mineral structure of bivalve mollusks[J]. Ecology and Evolution, 2018, 8(17): 8973-8984. DOI:10.1002/ece3.4416 |
| [44] |
ZHENG X N, LEI S S, ZHAO S X, et al. Temperature elevation and acidification damage microstructure of abalone via expression change of crystal induction genes[J]. Marine Environmental Research, 2020, 162: 105114. DOI:10.1016/j.marenvres.2020.105114 |
| [45] |
SOYUT H, BEYDEMIR Ş AND HISAR O. Effects of Some Metals on Carbonic Anhydrase from Brains of Rainbow Trout[J]. Biological Trace Element Research, 2008, 123(1): 179-190. |
| [46] |
KREISS C M, MICHAEL K, LUCASSEN M, et al. Ocean warming and acidification modulate energy budget and gill ion regulatory mechanisms in Atlantic cod (Gadus morhua)[J]. Journal of Comparative Physiology B: Biochemical, Systemic, and Environmental Physiology, 2015, 185(7): 767-781. DOI:10.1007/s00360-015-0923-7 |
| [47] |
IVANINA A V, JARRETT A, BELL T. Effects of seawater salinity and pH on cellular metabolism and enzyme activities in biomineralizing tissues of marine bivalves[J]. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2020, 248: 110748. DOI:10.1016/j.cbpa.2020.110748 |
| [48] |
MICHAELIDIS B, OUZOUNIS C, PALERAS A, et al. Effects of long-term moderate hypercapnia on acid-base balance and growth rate in marine mussels Mytilus galloprovincialis[J]. Marine Ecology Progress Series, 2005, 293: 109-118. DOI:10.3354/meps293109 |
| [49] |
THOMSEN J, HAYNERT K, WEGNER K M, et al. Impact of seawater carbonate chemistry on the calcification of marine bivalves[J]. Biogeosciences, 2015, 12: 4209-4220. DOI:10.5194/bg-12-4209-2015 |
| [50] |
LI J Q, MAO Y Z, JIANG Z J, et al. Impact of seawater carbonate variables on post-larval bivalve calcification[J]. Journal of Oceanology and Limnology, 2018, 36(2): 405-413. DOI:10.1007/s00343-017-6277-0 |
| [51] |
PENG C, ZHAO X G, LIU S X, et al. Ocean acidification alters the burrowing behaviour, Ca2+/Mg2+-ATPase activity, metabolism, and gene expression of a bivalve species, Sinonovacula constricta[J]. Marine Ecology Progress Series, 2017, 575: 107-117. DOI:10.3354/meps12224 |
 2023, Vol. 47
2023, Vol. 47


