文章信息
- 黄星美, 赵旺, 邓正华, 温为庚, 陈明强, 王雨, 张钰伟, 于刚. 2023.
- HUANG Xing-mei, ZHAO Wang, DENG Zheng-hua, WEN Wei-geng, CHEN Ming-qiang, WANG Yu, ZHANG Yu-wei, YU Gang. 2023.
- 大珠母贝精子短期保藏条件的初步筛选
- Preliminary screening of the short-term preservation conditions for Pinctada maxima sperm
- 海洋科学, 47(7): 122-129
- Marine Sciences, 47(7): 122-129.
- http://dx.doi.org/10.11759/hykx20220624001
-
文章历史
- 收稿日期:2022-06-24
- 修回日期:2022-12-29
2. 中国水产科学研究院南海水产研究所热带水产研究开发中心, 海南 三亚 572018;
3. 三亚热带水产研究院, 海南 三亚 572018;
4. 海南省深远海渔业资源高效利用与加工重点实验室, 海南 陵水 572426
2. Tropical Fishery R & D Center, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Sanya 572018, China;
3. Sanya Tropical Fisheries Research Institute, Sanya 572018, China;
4. Key Laboratory of Efficient Utilization and Processing of Marine Fishery Resources of Hainan Province, Lingshui 572426, China
大珠母贝(Pinctada maxima)别称白蝶贝, 隶属于软体动物门(Mousca), 双壳纲(Bivalvia), 珍珠贝目(Pterioida)、珍珠贝科(Pteriidae)、珍珠贝属(Pinctada), 是一种热带海洋珍珠贝类, 具有重要的经济和生态价值[1-3]; 主要分布于印度洋和南太平洋沿海, 中国主要分布于广东、广西、海南等近海海域[4-6]。近年来, 由于过度捕捞及近海养殖环境恶化等原因[7-8], 导致大珠母贝人工育苗、养殖及插核技术的相关研究受到了诸多因素的限制, 特别是养殖区域由于水质、表面附着物、寄生等原因, 出现人工养殖成活率低的情况[9], 这些因素都制约着大珠母贝养殖业的发展。
大珠母贝是雌雄异体, 进行体外受精, 繁殖期一般为每年的4月至11月, 繁殖盛期一般在5至8月。在人工育苗过程中, 通常使用阴干、化学物质诱导等手段[10]收集精子和卵子, 但诱导时常出现不能正常排放精子或精子与卵子排放不同步的现象。当出现上述现象时, 出现排卵与精子不同步时, 要求精子在体外存活且保持一定活力进行受精作用; 研究表明, 水环境的pH值、温度、离子浓度的变化影响精子的活力[11-12], 并且可通过改变基础液、保藏温度、降温程序等条件[10, 13-15], 有效延长精子活力时间; 在4 ℃条件下葡萄牙牡蛎的精子活力能够保持3 d[16], 扇贝精子保存6 d后精子活力从60%降至0%[15], 合浦珠母贝精子在5 d后活力从80%降至51%, 其中24 h内是最佳低温保存时间, 精子总运动率保持在74%左右[17]。因此, 针对生殖细胞成熟或排放不同步的情况, 为后续超低温长期保藏大珠母贝精子提供理论依据, 对大珠母贝的人工繁育具有重要意义。
目前, 生物种质资源保藏在各行各业中发挥着重要作用[18], 精子保藏对提升育种研究效率和维护生物多样性具有重要意义。在软体动物方面的相关报道主要集中在合浦珠母贝(Pinctada martensii)[19]、太平洋牡蛎(Crassostrea gigas)[20]、扇贝[21]等, 对大珠母贝精子保藏的相关报道较少, 研究方向主要偏重于精子超低温保藏的方法, 对低温短期保存的相关研究存在空白之处; 同时, 养殖场地存在无精子超低温冷冻设备及保存设施等问题。本实验以繁殖时期大珠母贝的新鲜精子作为研究对象, 探究短期内低温条件对精子活力的影响, 旨在为后续超低温长期保藏大珠母贝精子提供理论依据, 以期解决目前大珠母贝人工育苗过程中存在的实际问题, 为大珠母贝种质保藏、人工受精与育苗等工作提供科学参考依据。
1 材料与方法 1.1 实验材料大珠母贝取自海南三亚, 采用生长良好、体壮、无寄生虫感染或其他病害同一批次生长的3~5年的大珠母贝(壳长: 24.52±0.56 cm; 壳高: 40.18±0.5 mm)进行试验, 在中国水产科学研究院南海水产研究所热带水产研究中心盐度30±0.2, 温度25±2 ℃, pH为8.0±0.2的海水中进行暂养备用。
1.2 精子的收集挑取6只性腺成熟且饱满的大珠母贝, 通过性腺颜色对其进行性别鉴定, 使用灭菌后的解剖刀小心切断大珠母贝闭壳肌, 打开贝壳, 用干纱布去除水分和多余的的组织液, 用剪刀镊子将性腺与其他组织进行分离, 放入灭菌后的烧杯中, 无菌手术刀划开大珠母贝性腺, 吸管将精液转移至无菌冻存管中, 将6只大珠母贝活力达标的精液进行等比例混匀并分装好, 放于4 ℃备用。
1.3 精子基础液的选择5种基础液的分组及配置方案见表 1, 共分为5组, 分别对精液稀释(精液∶基础液为1∶10), 每个实验组设置3个重复, 将其放置4 ℃下1 h后进行观察; 同时记录1 mmol/L人工氨海水(取74.8 μL 25%浓氨水用无氨人工海水稀释至1 L, 充分混匀, 现配现用, 用于大珠母贝精子的激活)激活精子后的活力情况, 每管样品测定6个视野。
在选择最佳基础液的基础上, 对大珠母贝精子进行稀释(精液∶基础液为1∶10), 分别在室温(23 ℃)和低温(4 ℃)条件下保藏, 每个实验组设置3个重复, 记录在0~120 h内1 mmol/L人工氨海水激活精子后的活力情况。
1.5 精子保护剂的选择在温度实验结果上, 分别设置对照组(不加保护剂)、5% 的二甲基亚砜(DMSO)溶液、5% 的二甲基甲酰胺(DMF)溶液、5%的甲基乙酰胺(DMA)溶液和5% 的乙二醇(EG)溶液[19]5个组别, 精液与保护剂的比例为1∶20, 每个实验组设置3个重复, 记录在0~120 h内1 mmol/L人工氨海水激活精子后的活力情况。
1.6 精子活力的激活将1 mmol/L人工氨海水作为大珠母贝精子激活液, 精子悬浮液与激活液以1∶1 000的比例将其混合, 激活30 s, 取5 μL待测样品在精子质量分析系统下连续观察, 每个样分析6个视野。
1.7 精子活力检测质量评价利用精子质量分析仪对大珠母贝精子活力进行分析, 每次镜头捕捉的精子个数控制在300~500个之间, 每个样随机选取6个视野进行精子活力检测; 将精子总运动率(total motility, TM, %)、曲线运动速率(curvilinear velocity, VCL, μm/s)、直线运动速率(straight-line velocity, VSL, μm/s)、平均路径运动速率(average path velocity, VAP, μm/s)、头部位移距离(head displacement, ALH, μm)、鞭毛摆动频率(beat-cross frequency, BCF, Hz)作为精子活力质量评价参数。
1.8 数据分析试验过程中, 测定的精子各指标数据使用统计分析软件SPSS19.0进行统计分析, 并且使用该软件进行方差齐性检验, 利用单因素方差分析法对实验数据进行分析, 采用Origin 2019进行作图。
2 结果 2.1 基础液对大珠母贝精子活力的影响5组基础液分别稀释精液后, 通过显微镜观察, 结果表明(表 2), A、B、C三组在没有激活剂的情况下都存在部分精子被激活的情况, 其中C组比A、B两组精子更加活跃, 精子活力达到5.9%~10%; 在相同条件下, D、E两组无法激活精子, 观察发现并没有进行活动或颤动的精子, 由此可见, D、E两组基础液的效果均优于其他组。
| 基础液 | 精子活动情况 | 精子总运动率/% |
| A | 极小部分颤动 | 0.8~1.2 |
| B | 极小部分颤动 | 0.8~1.2 |
| C | 小部分精子活动和颤动 | 5.90~10.00 |
| D | 不动 | 0.00 |
| E | 不动 | 0.00 |
| 注: 大珠母贝精子的运动状态分为极活跃、活跃、活动、颤动。 | ||
分别使用1 mmol/L人工氨海水激活5组精子, 测定其总运动率, 结果表明(图 1), A、B、C、D、E组精子总运动率分别为59.23%、58.51%、43.91%、37.98%和80.79%, E组的精子总运动率与其他组具有显著性差异(P<0.05); A、B两组之间无显著性差异, 但与C、D、E各组中间具有显著性差异, A、B两组基础液对精子总运动率的影响具有相似影响; C组的基础液与其他组具有显著性差异, 精子总运动率高于D组; D组精子总运动率最低, 结合活力观察结果(表 2), 表明D组的基础液可能对精子活力具有一定抑制作用。
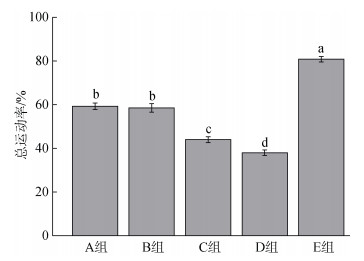 |
| 图 1 五组基础液对精子总运动率的影响 Fig. 1 Effect of the five extenders on total spermatozoa motility 注: 不同小写字母代表不同组之间的差异达到显著水平(P<0.05) |
通过基础液筛选实验后, 选取1× D-Hank’s溶液作为大珠母贝新鲜精子的基础保存液, 1 mmol/L人工氨海水激活精子, 探究不同温度条件下保藏时间对精子总运动率的影响, 结果表明(图 2), 低温(4 ℃)组大珠母贝精子总运动率显著(P<0.05)高于室温(23 ℃)组, 低温组精子活力的保持明显优于室温组, 36 h内精子总运动率保持在78.30%~85.08%之间。
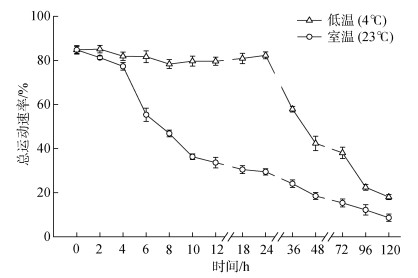 |
| 图 2 保藏时间对不同温度条件下大珠母贝精子总运动率的影响 Fig. 2 Effect of storage time on the total motility of Pinctada maxima spermatozoa at two temperatures |
在低温(4 ℃)条件下保藏120 h内, 精子激活后的总运动率呈先平稳后逐步下降趋势, 在36 h以内为精子活力最佳保藏时间, 精子总运动率无显著变化(P>0.05), 保持在78.30%~85.08%之间; 保藏时间为36 h时, 与36 h内精子总运动率相比显著降低(P<0.05), 精子总运动率为57.87%; 保藏时间超过36 h后, 精子总运动率显著下降(P<0.05), 至72 h时, 精子总运动率为38.10%, 至120 h时, 精子总运动率显著下降(P<0.05)至18.06%。在室温(23 ℃)条件保藏120 h内, 精子总运动率呈先缓慢下降再快速下降趋势, 在6 h内为精子活力的最佳保藏时间, 精子总运动率无显著性变化(P>0.05), 保持在77.29%~ 84.75%之间, 保藏至6 h时, 精子总运动率开始显著下降, 保存至24 h时, 精子总运动率已低于30%。
2.3 低温(4 ℃)保藏时间对大珠母贝精子游泳运动速率的影响在4 ℃条件下保藏时间120 h内, 精子激活后游泳运动速率(曲线运动速率VCL、直线运动速率VSL、平均路径运动速率VAP)呈先平稳后下降的趋势(图 3)。曲线运动速率VCL在24 h内无显著变化(P>0.05), 保持在88.55~101.965 μm/s; 保藏时间为24 h时, VCL显著性下降至81.95 μm/s; 直至120 h, VCL显著下降至35.18 μm/s(P<0.05), 因此, VCL在4 ℃的最佳保藏时间为24 h内。直线运动速率VSL在36 h内无显著性变化(P>0.05), 保持在37.95~ 50.38 μm/s之间; 在36 h骤降至32.59 μm/s, 在36 h后直至120 h显著性下降至13.77 μm/s, VSL在4 ℃下的最佳保藏时间为36 h内。平均路径运动速率VAP在4 ℃保藏条件24 h内无显著变化(P>0.05), 保持在79.68~89.90 μm/s; 在24 h时, VAP降至70.00 μm/s; 在24 h后骤降至39 μm/s以下, 因此, VPA在4 ℃下的最佳保藏时间为24 h内。
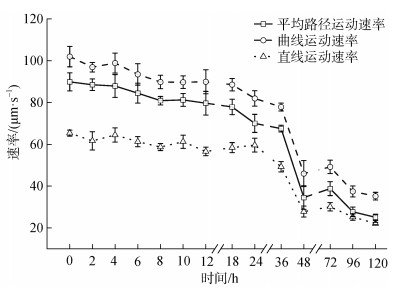 |
| 图 3 低温(4 ℃)保藏时间对大珠母贝精子曲线运动速率、直线运动速率、平均路径运动速率的影响 Fig. 3 Effect of storage at 4 ℃ on curvilinear velocity, straight-line velocity, and average path velocity of spermatozoa |
探究低温保藏时间对精子头部位移距离的影响, 结果表明(图 4), 低温保藏时间在72 h内, 精子头部位移距离无显著性变化(P>0.05), 精子头部位移距离保持在2.62~3.03 μm之间; 保藏时间为72 h时, 精子头部位移距离降至1.95 μm(P<0.05); 保藏时间至120 h时, 精子头部位移距离显著降低至1.12 μm(P<0.05)。
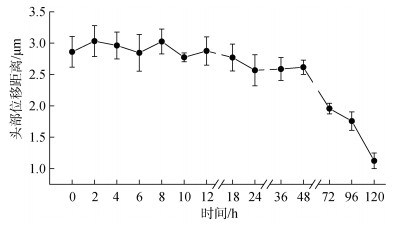 |
| 图 4 低温(4 ℃)保藏时间对大珠母贝精子头部位移距离的影响 Fig. 4 Effect of storage at 4 ℃ on the spermatozoa head displacement |
探究低温保藏时间对精子鞭毛摆动频率的影响, 结果表明(图 5), 4 ℃冷藏时间在120 h内, 精子鞭毛摆动频率呈先平稳后逐步下降趋势, 在保藏24 h内, 精子鞭毛摆动频率无显著性变化(P>0.05), 频率保持在4.21~4.62 Hz之间; 冷藏达到24 h时, 精子鞭毛摆动频率显著性下降(P<0.05), 频率降至2.93 Hz; 超过24 h后, 精子鞭毛摆动频率继续逐步下降, 直至120 h, 精子鞭毛摆动频率降至1.0 Hz一下; 根据精子鞭毛摆动频率在4 ℃下的最佳保藏时间为24 h内。
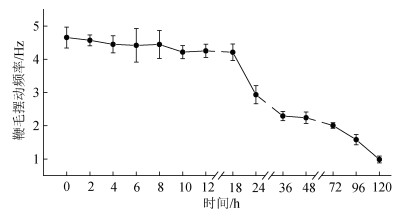 |
| 图 5 低温(4 ℃)保藏时间对精子鞭毛摆动频率的影响 Fig. 5 Effect of storage at 4 ℃ on spermatozoa beat-cross frequency |
通过对比低温(4 ℃)保藏12 h内5组大珠母贝精子总运动率的变化趋势, 结果表明(图 6), 对照组精子活力无显著性(P>0.05)变化, 精子总运动速率保持在80%以上; 与对照组相比, 4组加入保护剂的精子活力呈现逐步下降趋势, 精子总运动率显著性(P<0.05)下降, 其精子总运动率低于45%以下; 在4组加入保护剂的组别中, 5% 乙二醇(EG)溶液组的精子总运动速率显著(P<0.05)高于其他3组, 当保藏至6 h时, 5% 二甲基亚砜(DMSO)溶液组精子总运动速率显著性下降(P<0.05), 保藏至12 h时, 精子总运动率已低于30%。
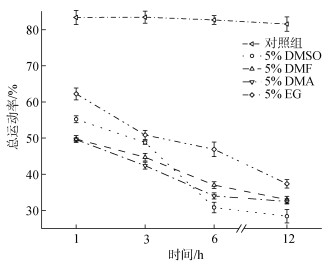 |
| 图 6 低温保藏时间对加入不同保护剂大珠母贝精子活力的影响 Fig. 6 Effect of cryogenic storage with different protectants on Pinctada maxima sperm motility |
精子保藏的基本原则应是尽可能地保持精子的活力及形态的完整。精子保藏温度、基础液类型、pH等因素都会对其活力产生影响[11-12], 基础液的选择在精子低温保藏中至关重要, 合适的基础液在应对精子没有激活作用, 并且能够更好地保留精子的活力[20]。大多数海洋双壳贝类精子成熟后在释放到水环境中才会被激活, 天然海水和人工海水对大珠母贝精子的活力有一定影响, 使一部分精子进行颤动, 使用激活剂后, 精子总运动率约60%, 表明天然海水和人工海水对精子的活性没有不利影响, 但是, 在没有激活剂的情况下, 能够使一部分精子进行颤动, 这与合浦珠母贝的相关研究存在差异[24], 可能是不同水域海水的理化性质存在差异, 需要对大珠母贝精子保藏进行深入研究; 柠檬酸钠溶液广泛用于精子冷冻保存中[25], KCl和NaCl混合溶液作为基础液时效果好[24], 不能直接激活精子, 与本研究结果一致。D-Hank’s溶液是精子保存中常用的基础液[26], 其成分中含有葡糖糖成分和微量酚酞红, 有效控制精液中的细菌, 可以有效的减少微生物对精子活力的影响, 可一定程度延长精子保存时间[27-29], 而酚酞红对细菌具有一定的抑制作用, 可避免在精子保存过程中细菌的大量滋生; 精子在体外存活需要消耗能量, 葡萄糖可为精子的生理活动提供能量[30], 一定程度上有利于延长精子的寿命, 因此, E组基础液在大珠母贝精子保藏方面具有明显优势。
3.2 温度及其低温保藏时间对精子活力的影响精子的运动活力是检验精子活力及功能的关键因素, 决定着精子的质量和受精能力。精子运动率、速度、位移程度及持续时间受温度的影响[31-32], 当环境温度超过最适温度时, 细胞的呼吸作用和能量代谢增强, 能量消耗加快, 导致精子运动提前停止[32]; 精子内含有许多种酶, 温度可以影响酶的催化活性[33-34], 从而影响精子的生物化学的反应速度。精子一旦被激活后, 精子内储存的能量很快将被消耗掉, 大幅降低精子的寿命; 目前, 一般通过降低保藏温度, 以此达到降低精子的能效消耗和延长精子寿命的目的[12]; 在针对精子和卵子成熟或排放不同步时选择4 ℃低温保藏, 虽然4 ℃低温保藏可以大幅降低精子的生理生化反应及代谢活动, 但是并不能完全阻止其活动, 依然在消耗能量, 因此, 探究4 ℃低温保存时间对精子活力的影响变得尤为重要。本研究实验结果与合浦珠母贝、葡萄牙牡蛎[20]在4 ℃低温条件下保存时间接近, 但是其保藏时间短于扇贝等[12], 造成这种差异的因素可能是由于不同物种之间的精子运动能力水平存在一定的差异; 低温保藏时间对大珠母贝精子活力的影响结果为大珠母贝精子短期保存提供科研依据, 同时, 可为人工繁育及种质保藏等相关研究提供理论基础。
3.3 保护剂对精子活力的影响精子低温或超低温保存时, 影响精子活力降低的主要原因是温度转化过程对其造成的伤害, 添加保护剂是在精子保存过程中常用来提高精子运动能力的手段[19]。二甲基亚砜(DMSO)、二甲基甲酰胺(DMF)、二甲基乙酰胺(DMA)、乙二醇(EG)是精子保存技术中常用的几种保护剂[12, 19], 但本实验结果表明, 在低温保藏条件下, 加入保护剂的组别精子运动能力显著低于对照组, 且经过保藏时间的延长, 精子运动能力逐步下降, 而对照组的活力无显著变化。保护剂虽然有渗透性强、亲水性好, 能够降低温度变化给精子带来的物理性伤害[35-37], 但是其本身具有一定毒性, 容易因保护剂的毒性导致精子的质膜结构发生变化、运动能力的降低等[38]。加入保护剂组与对照组的精子运动能力存在显著差异, 很有可能是该实验中使用的保护剂不适用大珠母贝精子低温保藏, 亦或者是保护剂浓度过高, 导致其对大珠母贝精子造成不可逆伤害, 有待进一步研究进行确认, 同时, 建议在进行大珠母贝低温短期保藏时, 可不加保护剂。
4 结论本研究对比5组基础液对精子活力影响的结果, 发现E组基础液在保持精子活力方面具有显著优势, 同时通过分析不同温度及其低温保藏时间对大珠母贝精子活力的影响, 表明在低温条件下, 大珠母贝精子在不加任何保护剂的情况下最佳保藏时间是24 h, 该时间内大珠母贝精子各项指标都能保持在较高水平。当人工育苗过程中, 出现精子与卵子排放不同步时, 可将精子置于D-Hank’s溶液中在4 ℃下进行短期保存。目前, 我国大珠母贝人工繁育技术存在难点与瓶颈, 制约着大珠母贝养殖业的发展, 因此, 有必要进一步探究大珠母贝精子低温或超低温保存技术对其精子活力的影响, 为今后大珠母贝的人工繁育及种质保藏工作做准备。
| [1] |
蒙钊美, 李有宁, 邢孔武. 珍珠养殖理论与技术[M]. 北京: 科学出版社, 1996: 172-191, 208-209. MENG Zhaomei, LI Youning, XING Kongwu. Pearl culture theory and technology[M]. Beijing: Science Press, 1996: 172-191, 208-209. |
| [2] |
王新星, 陈作志, 黄梓荣, 等. 南海北部沿岸自然保护区内大珠母贝资源现状初步分析[J]. 南方水产科学, 2016, 12(2): 110-115. WANG Xinxing, CHEN Zuozhi, HUANG Zirong, et al. Preliminary analysis of Pinctada maxima in nature reserves along coastal area in the northern South China Sea[J]. South China Fisheries Science, 2016, 12(2): 110-115. DOI:10.3969/j.issn.2095-0780.2016.02.016 |
| [3] |
NAYFA M G, ZENGER K R. Unravelling the effects of gene flow and selection in highly connected populations of the silver-lip pearl oyster (Pinctada maxima)[J]. Marine genomics, 2016, 28: 99-106. DOI:10.1016/j.margen.2016.02.005 |
| [4] |
LIANG F L, XIE S H, FU S, et al. Growth pattern and biometric relationship of pearl oyster Pinctada maxima cultured in Beibu Bay, China[J]. Journal of Applied Aquaculture, 2016, 28(2): 110-118. DOI:10.1080/10454438.2016.1172535 |
| [5] |
HAO R J, WANG Z M, YANG C Y, et al. Metabolomic responses of juvenile pearl oyster Pinctada maxima to different growth performances[J]. Aquaculture, 2018, 491: 258-265. DOI:10.1016/j.aquaculture.2018.03.050 |
| [6] |
梁飞龙, 王钦贵, 邓岳文, 等. 珠核规格、植核位置和贝龄对大珠母贝植核育珠的影响[J]. 广东海洋大学学报, 2015, 35(4): 51-56. LIANG Feilong, WANG Qingui, DENG Yuewen, et al. Effects of nucleus size, nucleus implantation location and age on round nucleated pear production of Pinctada maxima[J]. Journal of Guangdong Ocean University, 2015, 35(4): 51-56. DOI:10.3969/j.issn.1673-9159.2015.04.008 |
| [7] |
TUAN V S, TUYEN H T. Restoration of the silver-lipped pearl oyster Pinctada maxima (Jameson, 1901) in phu quoc marine protected area, Vietnam[J]. Phuket Marine Biological Center Research Bulletin, 2021, 78: 117-124. |
| [8] |
MCDOUGALL C, MOASE P, DEGNAN B M. Host and donor influence on pearls produced by the silver-lip pearl oyster, Pinctada maxima[J]. Aquaculture, 2016, 450: 313-320. DOI:10.1016/j.aquaculture.2015.08.008 |
| [9] |
LI J H, YANG C Y, WANG Q H, et al. Growth and survival of host pearl oyster Pinctada fucata martensii (Dunker, 1880) treated by different biofouling-clean methods in China[J]. Estuarine, Coastal and Shelf Science, 2018, 207: 104-108. DOI:10.1016/j.ecss.2018.04.009 |
| [10] |
BEIRÃO J, BOULAIS M, GALLEGO V, et al. Sperm handling in aquatic animals for artificial reproduction[J]. Theriogenology, 2019, 133: 161-178. DOI:10.1016/j.theriogenology.2019.05.004 |
| [11] |
BOULAIS M, SUQUET M, ARSENAULT-PERNET E J, et al. pH controls spermatozoa motility in the Pacific oyster (Crassostrea gigas)[J]. Biology Open, 2018, 7(3): bio031427. |
| [12] |
LIU Y P, LI X X, ROBINSON N, et al. Sperm cryopreservation in marine mollusk: a review[J]. Aquaculture international, 2015, 23: 1505-1524. DOI:10.1007/s10499-015-9900-0 |
| [13] |
KIM S C, HOSSEN S, KHO K H. Cryopreservation of sperm from farmed Pacific abalone, Haliotis discus hannai[J]. Cryobiology, 2020, 94: 49-56. DOI:10.1016/j.cryobiol.2020.04.011 |
| [14] |
HASSAN M M, QIN J G, LI X X. Sperm cryopreservation in oysters: A review of its current status and potentials for future application in aquaculture[J]. Aquaculture, 2015, 438: 24-32. DOI:10.1016/j.aquaculture.2014.12.037 |
| [15] |
SUQUET M, ARSENAULT-PERNET M E J, RATISKOL D, et al. Cryopreservation of great scallop (Pecten maximus) sperm: effect of extender, cryoprotectant and cooling rate on sperm survival[J]. Aquatic living resources, 2014, 27(1): 35-40. DOI:10.1051/alr/2014002 |
| [16] |
RIESCO M F, FÉLIX F, MATIAS D, et al. First study in cryopreserved Crassostrea angulata sperm[J]. General Comparative Endocrinology, 2017, 245: 108-115. DOI:10.1016/j.ygcen.2016.05.003 |
| [17] |
王弢, 郑兴, 杨金灵, 等. 马氏珠母贝精子低温条件下的活力保鲜期[J]. 海南热带海洋学院学报, 2019, 26(5): 1-5. WANG Tao, ZHEN Xin, YANG Jingling, et al. The quality guarantee period of spermatozoa from Pinctada fucatamartensii sperm under refrigerator temperature condtion[J]. Journal of Hainan Tropical Ocean University, 2019, 26(5): 1-5. |
| [18] |
马一鸣, 周晓, 田云青, 等. 生物遗传资源保藏技术与生物安全材料的研究进展[J]. 应用化学, 2021, 38(5): 482-497. MA Yiming, ZHOU Xiao, TIAN Yunqing, et al. Research progress of biosafety materials and technology of genetic resource preservation[J]. Chinese Journal of Applied Chemistry, 2021, 38(5): 482-497. DOI:10.19894/j.issn.1000-0518.210056 |
| [19] |
ZHENG X, GU Z F, HUANG Z W, et al. The effects of cryoprotectants on sperm motility of the Chinese pearl oyster, Pinctada fucata martensii[J]. Cryobiology, 2018, 82: 64-69. DOI:10.1016/j.cryobiol.2018.04.007 |
| [20] |
RIESCO M F, FÉLIX F, MATIAS D, et al. Comparative study on cellular and molecular responses in oyster sperm revealed different susceptibilities to cryopreservation[J]. Aquaculture, 2019, 498: 223-229. DOI:10.1016/j.aquaculture.2018.08.049 |
| [21] |
SUQUET M, GOURTAY C, DONVAL A, et al. The quality of great scallop (Pecten maximus) sperm after thawing[J]. General and Comparative Endocrinology, 2016, 229: 127-131. DOI:10.1016/j.ygcen.2016.02.023 |
| [22] |
秦鹏春. 哺乳动物胚胎学[M]. 北京: 科学技术出版社, 2001: 444-447. QIN Pengchun. Mammalian embryology[M]. Beijing: Science and Technology Press, 2001: 444-447. |
| [23] |
江世贵, 苏天凤, 喻达辉, 等. 中华乌塘鳢精子的生物学特性及其超低温保存[J]. 水产学报, 2000, 24(2): 119-122. JIANG Shigui, SU Tianfeng, YU Dahui, et al. The biological characteristics of Bostrichthys sinensis spermatozoa and its cryopreservation[J]. Journal of Fisheries of China, 2000, 24(2): 119-122. |
| [24] |
喻达辉, 江世贵, 陈竞春, 等. 合浦珠母贝精子激活的离子选择性[J]. 中国水产科学, 1999, 6(3): 102-104. YU Dahui, JIANG Shigui, CHEN Jingchun, et al. Selectivity of ions for spermatozoa activation of Japanese pearl oyster, Pintada fucata[J]. Journal of Fishery Sciences of China, 1999, 6(3): 102-104. |
| [25] |
ANA T M, VIVEIROS, NAIARA C, et al. Ions and osmolality on post-thaw sperm motility activation of the endangered Brycon insignis (Characiformes)[J]. Journal of Applied Ichthyology, 2019, 35(3): 739-746. DOI:10.1111/jai.13857 |
| [26] |
SU Y F, HE L T, HU Z Y, et al. Obesity causes abrupt changes in the testicular microbiota and sperm motility of zebrafish[J]. Frontiers in Immunology, 2021, 12: 639239. DOI:10.3389/fimmu.2021.639239 |
| [27] |
KUSTER C E, ALTHOUSE G C. The impact of bacteriospermia on boar sperm storage and reproductive performance[J]. Theriogenology, 2016, 85(1): 21-26. DOI:10.1016/j.theriogenology.2015.09.049 |
| [28] |
BOONTHAI T, KHAOPONG W, SANGSONG J, et al. Evaluation of the potential source of bacterial contamination during cryopreservation process of silver barb (Barbodes gonionotus) sperm[J]. Aquaculture Research, 2016, 47(7): 2101-2113. DOI:10.1111/are.12664 |
| [29] |
BAUD D, PATTARONI C, VULLIEMOZ N, et al. Sperm microbiota and its impact on semen parameters[J]. Frontiers in Microbiology, 2019, 10: 234. DOI:10.3389/fmicb.2019.00234 |
| [30] |
QIU J H, LI Y W, XIE H L, et al. Effects of glucose metabolism pathways on sperm motility and oxidative status during long-term liquid storage of goat semen[J]. Theriogenology, 2016, 86(3): 839-849. |
| [31] |
DADRAS H, DZYUBA B, COSSON J, et al. Effect of water temperature on the physiology of fish spermatozoon function: a brief review[J]. Aquaculture Research, 2017, 48(3): 729-740. |
| [32] |
PINHEIRO J P S, DE ASSIS C B, SANCHES E A, et al. Aluminum, at an environmental concentration, associated with acidic pH and high water temperature, causes impairment of sperm quality in the freshwater teleost Astyanax altiparanae (Teleostei: Characidae)[J]. Environmental Pollution, 2020, 262: 114252. |
| [33] |
DADRAS H, SAMPELS S, GOLPOUR A, et al. Analysis of common carp Cyprinus carpio sperm motility and lipid composition using different in vitro temperatures[J]. Animal Reproduction Science, 2017, 180: 37-43. |
| [34] |
DZYUBA V, DZYUBA B, COSSON J, et al. Enzyme activity in energy supply of spermatozoon motility in two taxonomically distant fish species (sterlet Acipenser ruthenus, Acipenseriformes and common carp Cyprinus carpio, Cypriniformes)[J]. Theriogenology, 2016, 85(4): 567-574. |
| [35] |
余祥勇, 王梅芳, 陈钢荣, 等. 马氏珠母贝精子低温保存主要影响因素的研究[J]. 华南农业大学学报, 2005, 26(3): 96-99. YU Xiangyong, WANG Meifang, CHEN Gangrong, et al. Studies on main factors influencing cryopreservation of spermatozoa of Pinctada martensii[J]. Journal of South China Agricultural University, 2005, 26(3): 96-99. |
| [36] |
蒋玉荣, 李霞, 秦艳杰, 等. 皱纹盘鲍精子的激活及超低温保存研究[J]. 烟台大学学报(自然科学与工程版), 2017, 30(4): 348-351. JIANG Yurong, LI Xia, QIN Yanjie, et al. Activation and cryopreservation of spermatozoa in Haliotis discus[J]. Journal of Yantai University (Natural Science and Engineering Edition), 2017, 30(4): 348-351. |
| [37] |
周洲, 李世凯, 赵飞, 等. 不同抗冻剂对西伯利亚鲟精子冷冻保存的影响[J]. 西南农业学报, 2021, 34(6): 1347-1350. ZHOU Zhou, LI Shikai, ZHAO Fei, et al. Effect of different cryoprotectants on spermatozoa cryopreservation of Siberian sturgeon(Acipenser baerii baeri)[J]. Southwest China Journal of Agricultural Sciences, 2021, 34(6): 1347-1350. |
| [38] |
王晓爱, 杨君兴, 陈小勇, 等. 4种渗透性抗冻剂对暗色唇鱼精子冷冻保存的影响[J]. 水生态学杂志, 2012, 33(5): 88-93. WANG Xiaoai, YANG Junxin, CHEN Xiaoyong, et al. Effects of four penetrating cryoprotectants on cryopreservation of Semilabeo obscurus sperm[J]. Journal of Hydroecology, 2012, 33(5): 88-93. |
 2023, Vol. 47
2023, Vol. 47


