文章信息
- 杨千元, 李敏, 胡高宇, 陈然, 肖国强, 滕爽爽. 2023.
- YANG Qian-yuan, LI Min, HU Gao-yu, CHEN Ran, XIAO Guo-qiang, TENG Shuang-shuang. 2023.
- 哈维氏弧菌对泥蚶的毒性及半致死浓度研究
- Toxicity test and median lethal concentration of Vibrio harveyi for the blood clam Tegillarca granosa
- 海洋科学, 47(7): 130-137
- Marine Sciences, 47(7): 130-137.
- http://dx.doi.org/10.11759/hykx20210806001
-
文章历史
- 收稿日期:2021-08-06
- 修回日期:2021-10-13
2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
泥蚶(Tegillarca granosa)隶属软体动物门(Mollusca)、双壳纲(Bivalvia)、列齿目(Taxodonta)、蚶科(Arcidae)、泥蚶属(Tegillarca), 俗称“血蛤”, 因其血细胞中含有特殊的血红蛋白而得名, 是栖息于浅海滩涂的习见双壳贝类, 具有重要的商业和生态价值[1-2]。病原体入侵是贝类流行性疾病和大规模死亡的重要原因之一[3-4]。据不完全统计, 每年中国养殖贝类因病害造成的直接经济损失高达20亿~30亿元[5]。其中由弧菌病所造成的经济损失占据重要部分[6], 贝类弧菌病作为影响最严重的细菌性疾病, 制约着养殖产业的健康发展[7]。因此, 开展泥蚶弧菌病的研究, 对加强泥蚶病害免疫预防和促进泥蚶养殖产业健康可持续发展尤为重要。
哈维氏弧菌(Vibrio harveyi)是常见的海洋动物致病弧菌之一。已有研究表明, 哈维氏弧菌可感染紫贻贝(Mytilus galloprovincialis)[8]、菲律宾蛤仔(Ruditapes philippinarum)[9]、魁蚶(Scapharca broughtonii)[10]、海湾扇贝(Argopecten irradins)[11]、长牡蛎(Crassostrea gigas)[12-13]和文蛤(Meretrix meretrix)[14]等经济贝类, 并导致其死亡, 给贝类产业带来严重的经济损失。但目前有关泥蚶感染哈维氏弧菌的研究报道较少。
半致死浓度(median lethal concentration, LC50)或半致死剂量(median lethal dose, LD50)是指某种因素(如药物、毒物、细菌、理化刺激等)在急性实验动物中引起半数动物死亡的浓度或剂量, 常用来衡量该因素对实验动物毒力或效力的指标[15-16]。腹腔注射哈维氏弧菌感染健康牙鲆(Paralichthys olivaceus), 攻毒后14 d牙鲆的半致死剂量(LD50)为4.64×106 CFU/mL[17]。腹腔注射哈维氏弧菌感染石斑鱼(Epinephelus spp.) 4 d的半致死剂量(LD50)为1.2×105 CFU/g[18]。腹腔注射哈维氏弧菌感染凡纳滨对虾(Litopenaeus vannamei), 感染4 d后凡纳滨对虾的半数致死浓度为8.12×103 CFU/mL[19]。高晓建等[13]通过闭壳肌注射的方式对长牡蛎(C. gigas)进行感染, 发现4株哈维氏弧菌对长牡蛎48 h的半数致死剂量LD50分别为2.8×105、1.1×105、1.8×105和1.6×105 CFU/mL。何婷婷[20]采用浸泡感染和肌肉注射两种方式, 研究了哈维氏弧菌对皱纹盘鲍(Haliotis discus hannai)和绿盘鲍(H. fulgens)毒性效应, 结果表明半致死浓度与受试物种规格、实验胁迫条件、感染方式等有关。由此可见, 哈维氏弧菌对水产经济物种具有一定的毒害作用, 但目前还未见有关哈维氏弧菌对泥蚶的半致死浓度的研究。本研究采用浸泡感染和注射胁迫两种方式, 通过不同浓度哈维氏弧菌对泥蚶进行胁迫, 记录个体死亡情况, 进一步统计出哈维氏弧菌导致泥蚶死亡的半致死浓度(剂量)。为探索泥蚶对哈维氏弧菌耐受性、养殖环境条件要求等提供有价值的实验数据, 并且为泥蚶弧菌病防治提供了一定的理论依据。
1 材料与方法 1.1 实验材料实验所用泥蚶[壳长: (30.69±1.28) mm, 总重: (9.84±1.13) g]取自浙江省温州市乐清湾(121°E, 28°N), 用海水小心冲洗壳表污物后, 用浓度为5 mg/L高锰酸钾溶液浸泡5~10 min。注射实验所用泥蚶在壳缘中间部位用电钻进行打孔处理(孔径约为1 mm), 再将泥蚶置于室内400 L大桶中暂养1周[砂滤海水的pH: 8.1±0.2, 盐度: 22.4±0.1, 温度: (28±2.0) ℃]。暂养期间未发现疾病及死亡症状, 期间持续曝气, 每24 h换水一次, 每天早晚定时投喂球等鞭金藻(Isochrysis galbana)。
实验所用的哈维氏弧菌菌株是本实验室2014年从浙江滩涂发生规模性死亡的泥蚶中分离并放于–80 ℃冰箱中长期保存。将菌株划线于2216E固体培养基上, 28 ℃培养24 h后挑取单菌落于50 mL的2216E液体培养基试管中, 28 ℃振动摇床中培养12 h, 摇床转速为160 r/min, 然后将其接种于大体积的2216E液体培养基扩大培养。将弧菌菌液5 000 r/min, 离心5 min, 以无菌PBS缓冲溶液二次等体积重悬。菌液浓度通过分光光度计在吸光度为560 nm比浊测定后根据计数标准曲线计算得到[21]。
1.2 实验方法 1.2.1 浸泡感染实验设置1×107、1.25×107、1.5×107、1.75×107、2×107、3×107、4×107 CFU/mL 7种不同浓度弧菌浸泡感染, 每组3个重复, 每个重复40颗泥蚶, 以不添加哈维氏弧菌的砂滤海水为对照组, 整个过程持续曝气, 维持水温(28±0.5) ℃。实验共进行15 d, 浸泡感染7 d, 后8 d停止添加弧菌(即当实验泥蚶的累计死亡率达约50%时停止攻毒), 感染期间24 h全换水并重新添加弧菌, 停止感染后继续每24 h更换海水。同时对泥蚶每天的存活情况进行监测, 个体死亡以外套膜萎缩破损, 双壳持久张开, 数次刺激无闭壳反应为标准。当泥蚶连续3 d未出现死亡即停止实验。
1.2.2 注射胁迫根据预实验结果, 设定5个不同剂量组分别为5×106、1.5×107、3.0×107、4.5×107、6.0×107 CFU/g。注射胁迫实验操作参考Yue等[22]具体步骤如下: 哈维氏弧菌培养液经无菌的PBS溶液洗涤两次后, 洗净残留培养基后重悬菌液, 利用弧菌计数标准曲线确定弧菌浓度, 用无菌PBS溶液调整弧菌浓度为1×109、3×109、6×109、9×109、1.2×1010 CFU/mL的菌悬液, 以注射不添加弧菌的无菌PBS溶液作对照组, 共6组处理, 每个处理3个平行, 每个平行20颗泥蚶。随机选取经打孔处理的健康泥蚶, 用无菌微量注射器吸取50 μL菌悬液, 从打孔处经斧足注射至肝胰腺中。保证每颗泥蚶的注射位置、深度基本接近, 注射后室温放置2 h后, 再置于砂滤海水中, 维持水温(28±0.5) ℃, 持续曝气, 24 h全换水并投喂球等鞭金藻。在12 h、24 h、48 h、72 h、96 h观察泥蚶存活状态, 清理并记录各注射组死亡泥蚶个数。
1.3 数据分析本研究实验数据采用SPSS 22.0软件和Origin 2019b软件进行分析绘图, 数据以平均数±标准差表示。采用Kaplan-Meier生存分析中Log Rank检验不同浸泡感染浓度下泥蚶存活率的差异, P<0.05被认为具有显著性差异。运用Probit回归分析计算泥蚶的半致死浓度(剂量)。采用Pearson相关分析泥蚶死亡率与弧菌注射浓度的相关性。
2 结果 2.1 哈维氏弧菌浸泡感染下泥蚶死亡情况对不同浓度哈维氏弧菌浸泡感染导致的泥蚶死亡情况进行统计分析。结果显示(图 1), 感染后3 d泥蚶开始出现死亡, 弧菌感染组2×107 CFU/mL、3×107 CFU/mL和4×107 CFU/mL, 泥蚶日死亡率分别为(0.83±1.44)%、(1.67±2.89)%和(3.33±3.82)%。弧菌感染浓度为1× 107 CFU/mL、1.25×107 CFU/mL、1.75×107 CFU/mL和2×107 CFU/mL的感染组, 泥蚶在7 d死亡率最高, 分别为(2.50±4.33)%、(10.83±8.78)%、(13.33±5.77)%和(17.50± 5.00)%; 浸泡浓度为1.50×107 CFU/mL时, 在8 d死亡率最高为(14.17±1.44)%; 在3×107 CFU/mL时, 在6 d死亡率最高为(41.67±3.82)%; 在4×107 CFU/mL时, 在5 d死亡率最高为(39.17±5.20)%。由此可见, 随着感染水体中弧菌浓度升高, 泥蚶死亡起始时间和最大日死亡率时间均有提前的趋势。
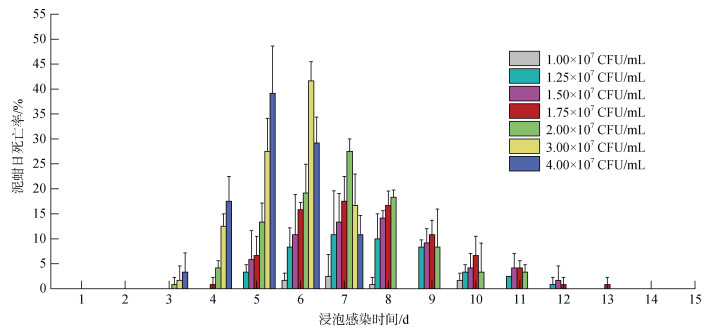 |
| 图 1 不同浓度哈维氏弧菌浸泡感染过程中泥蚶的日死亡率 Fig. 1 Daily mortality rate of T. granosa during 15 days of its immersion in different doses of Ⅴ. harveyi |
对不同浓度哈维氏弧菌浸泡下泥蚶进行生存分析发现(图 2), 对照组泥蚶在15 d内能正常生活, 无死亡个体出现, 由此可证明感染组泥蚶个体死亡均是哈维氏弧菌刺激导致。浸泡浓度为1×107、1.25×107、1.5×107、1.75×107、2×107、3×107、4×107 CFU/mL泥蚶的平均存活时间为(14.51±0.17) d、(11.56±0.35) d、(10.41±0.34) d、(9.06±0.30) d、(7.10±0.17) d、(5.59±0.09) d和(5.27±0.09) d, 各组间的生存天数具有显著性差异(P<0.05)。
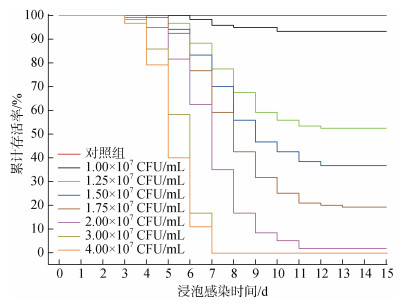 |
| 图 2 不同浓度哈维氏弧菌浸泡下泥蚶的Kaplan-Meier生存曲线 Fig. 2 Kaplan-Meier survival estimates of T. granosa immersed in different doses of Ⅴ. harveyi |
此外, 从图 3可看出, 在1×107 CFU/mL的感染条件下, 泥蚶累计死亡率为(6.67±2.89)%; 在1.25× 107 CFU/mL条件下, 累计死亡率为(47.50±8.66)%; 1.50×107 CFU/mL条件下, 累计死亡率为(63.33± 5.20)%, 1.75×107 CFU/mL条件下泥蚶累计死亡率为(80.83±3.82)%; 2×107 CFU/mL条件下泥蚶累计死亡率为(98.33±1.44)%, 在3×107 CFU/mL和4×107 CFU/mL泥蚶累计死亡率高达100%。由此可见, 泥蚶死亡情况先是呈现迅速上升, 当浸泡浓度超过2×107 CFU/mL, 泥蚶15 d累计死亡率接近100%。上述结果表明弧菌感染导致泥蚶死亡是一个阈值性状。
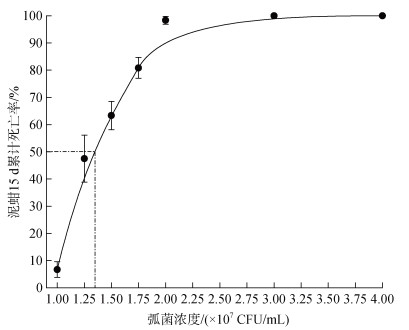 |
| 图 3 不同浓度哈维氏弧菌浸泡下泥蚶的累计死亡率 Fig. 3 Proportion of T. granosa that died after being immersed in different doses of Ⅴ. harveyi |
运用SPSS22.0对所得实验数据进行Probit回归分析后, 得到回归方程为: Y=10.89X–77.66 (R2=0.954, P<0.001), 浸泡感染下泥蚶半致死浓度LC50为1.35× 107 CFU/mL, 在置信系数a=0.05时的置信区间为1.26×107 CFU/mL≤LC50≤1.44×107 CFU/mL。
2.3 哈维氏弧菌注射胁迫下泥蚶死亡情况通过注射实验观察, 在96 h内注射PBS溶液的对照组泥蚶能正常生活, 无死亡个体。由此可证明不同注射组泥蚶个体死亡均是哈维氏弧菌刺激导致。随着弧菌注射浓度从5×106 CFU/g~6.0×107 CFU/g逐渐升高, 实验泥蚶总体死亡情况先呈现迅速上升的趋势, 当注射浓度≥3×107 CFU/g, 泥蚶96 h累计死亡率缓慢上升(图 4)。
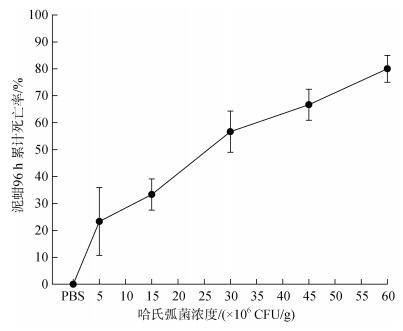 |
| 图 4 不同浓度哈维氏弧菌注射胁迫泥蚶96 h累计死亡率 Fig. 4 The 96-h mortality rate of T. granosa after being injected with different doses of Ⅴ. harveyi |
根据不同浓度哈维氏弧菌注射胁迫下泥蚶不同时间段死亡情况发现(图 5), 相同时间内不同注射组泥蚶死亡数量与哈维氏弧菌胁迫浓度呈显著正相关(r=0.964, P<0.01), 而且在最高浓度注射组(6.0× 107 CFU/g)中泥蚶死亡率在实验开始的24 h内达到(38.33±5.77)%。
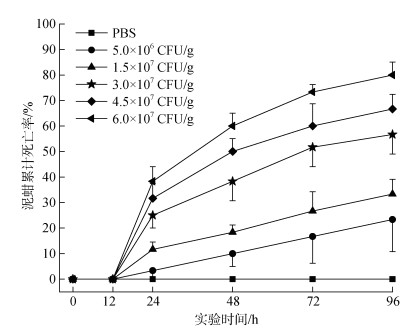 |
| 图 5 不同浓度哈维氏弧菌注射胁迫下泥蚶不同时间段死亡情况 Fig. 5 Mortality rates of T. granosa after being injected with different concentrations of Ⅴ. harveyi at different times |
运用SPSS22.0对所得实验数据进行Probit回归分析后, 得到回归方程为: Y=1.42X–0.4 (R2=0.928, P<0.001), 注射胁迫下泥蚶96 h半致死剂量(96 h LD50)为2.12×107 CFU/g, 在置信系数a=0.05时的置信区间为1.63×107 CFU/g≤LD50≤2.70×107 CFU/g。
3 讨论 3.1 哈维氏弧菌浸泡感染下泥蚶死亡情况分析哈维弧菌的致病性与胞外产物(extracellular products, ECP)的分泌(如蛋白酶、溶血素、脂肪酶和脂多糖等)、群体效应、形成特殊的生物膜、噬菌体感染以及结合铁的能力等因素相关。弧菌刺激后早期泥蚶体内会产生一系列免疫反应, 机体会出现组织损伤等症状[23-24]。本研究发现随着感染水体中弧菌增加, 泥蚶起始死亡和最大日死亡率时间均有提前趋势。在副溶血弧菌(Ⅴ. parahaemolyticus)浸泡感染文蛤的实验中, 也发现与本文相似的实验结果[25]。推测可能海水中弧菌浓度越高, 有更多的弧菌黏附、侵袭、在宿主体内增殖及产生毒素, 对宿主的细胞、组织和器官造成损伤程度越大, 最终高浓度的弧菌感染, 会提前泥蚶的死亡时间。本研究还发现泥蚶死亡情况先是呈现迅速上升, 当浸泡浓度超过2×107 CFU/mL, 泥蚶15 d累计死亡率接近100%。推测当弧菌侵入泥蚶体内, 会激发宿主细胞免疫和体液免疫来抵御外来入侵病原弧菌, 泥蚶免疫反应存在个体差异性, 少数免疫调节能力弱的个体会提前死亡, 当外界环境中的弧菌浓度高于泥蚶自身免疫调节阈值时, 泥蚶会出现大规模死亡。这与Xia等[26]利用哈维氏弧菌感染凡纳滨对虾的研究结果一致。
3.2 哈维氏弧菌注射胁迫下泥蚶死亡情况分析无脊椎动物的免疫防御主要依赖于其先天免疫系统, 其中肝胰腺是一个重要的免疫器官, 在软体动物中, 免疫分子主要来源于肝胰腺的上皮细胞[27]。本实验通过泥蚶肝胰腺注射哈维氏弧菌的方式, 来观察泥蚶在哈维氏弧菌感染下的个体死亡情况。研究发现注射组泥蚶仅在12 h内维持生存正常, 继而相继出现死亡现象。这与樊英等[28]人的研究结果相似。分析其原因可能是在哈维氏弧菌感染下激发泥蚶自身固有免疫, 能在短时间内发挥一定作用来抵抗病原体。但自身固有免疫调节范围有限, 随着菌体数量的增加, 最终较高浓度病原体释放的有毒物质超出机体自身固有免疫可调节范围, 最终导致机体死亡。另外, 本研究还发现在相同时间内不同注射组之间, 泥蚶累计死亡率与弧菌浓度呈显著正相关。葛端阳[29]利用鳗弧菌注射青蛤的实验中也发现相同变化规律。其原因可能是泥蚶自身固有免疫调节能力有限, 有害物质胁迫浓度越高, 依靠自身免疫起到的抵抗作用相对越弱, 因此相同时间内受高浓度刺激个体更容易发生组织损伤而死亡。
3.3 浸泡感染与注射胁迫比较病原菌对生物体的半数致死量与实验水温、菌株毒力强弱、宿主规格大小、感染途径、注射剂量等都有关联[20]。目前, 在病原弧菌感染水产经济物种的研究中, 主要采用浸泡感染和注射胁迫两种方式。其中, 浸泡感染被认为是最能模拟泥蚶在自然条件下感染弧菌的方式[25, 30]。此方法操作简单、适合大量实验样本感染; 缺点是需要培养大量的弧菌、耗时、造成环境污染等。注射胁迫优点主要是需要弧菌用量较少、省时、能消除培养基对泥蚶造成的影响; 缺点有注射操作要求较高, 对宿主组织造成机械损伤。
4 结论1) 浸泡感染过程中, 随着感染水体中弧菌浓度升高, 泥蚶死亡起始时间和最大日死亡率时间均有提前的趋势。泥蚶死亡情况先是呈现迅速上升, 当浸泡浓度超过2×107 CFU/mL, 泥蚶15 d累计死亡率接近100%并趋于平缓。弧菌浸泡感染泥蚶7 d后停止实验, 15 d的半致死浓度(LC50)为1.35×107 CFU/mL。
2) 泥蚶死亡率与弧菌注射浓度呈显著正相关(r=0.964, P<0.01); 弧菌注射胁迫下泥蚶的96 h半致死剂量(96 h LD50)为2.12×107 CFU/g。
3) 哈维氏弧菌对泥蚶有明显的毒害作用。
| [1] |
BAO Y B, ZENG Q F, WANG J, et al. Genomic insights into the origin and evolution of molluscan red-bloodedness in the blood clam Tegillarca granosa[J]. Molecular Biology and Evolution, 2021, 38(6): 2351-2365. DOI:10.1093/molbev/msab030 |
| [2] |
LIU G X, SHU M A, CHAI X L, et al. Effect of chronic sublethal exposure of major heavy metals on filtration rate, sex ratio, and gonad development of a bivalve species[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 92(1): 71-74. DOI:10.1007/s00128-013-1138-9 |
| [3] |
梁玉波, 杨波, 王立俊, 等. 辽宁黄海沿岸水域增养殖贝类病害发生机理和防治对策[J]. 海洋环境科学, 2000, 19(1): 5-10. LIANG Yubo, YANG Bo, WANG Lijun, et al. Disease triggering mechanism and protecting policy of the mariculture shellfish in coast of Yellow Sea[J]. Marine Environmental Science, 2000, 19(1): 5-10. |
| [4] |
曹华. 沿海滩涂青蛤死亡原因初探及对策[J]. 科学养鱼, 2004(4): 47-48. CAO Hua. Death causes and countermeasures of clam Cyclina sinensis in coastal beaches[J]. Scientific Fish Farming, 2004(4): 47-48. |
| [5] |
陈爱平. 2004年中国水产养殖病害监测报告(二)[J]. 科学养鱼, 2005(10): 48-49. CHEN Aiping. 2004 China aquaculture disease monitoring report(2)[J]. Scientific Fish Farming, 2005(10): 48-49. |
| [6] |
陈爱平, 朱泽闻, 王立新, 等. 2006年中国水产养殖病害监测报告(一)[J]. 科学养鱼, 2007(7): 48-49. CHEN Aiping, ZHU Zewen, WANG Lixin, et al. 2006 China aquaculture disease monitoring report(Ⅰ)[J]. Scientific Fish Farming, 2007(7): 48-49. |
| [7] |
张颖雪, 苏洁, 樊景凤, 等. 海水养殖贝类弧菌病流行暴发及其环境影响因素研究进展[J]. 海洋环境科学, 2020, 39(3): 480-487. ZHANG Yingxue, SU Jie, FAN Jingfeng, et al. Outbreaks of vibriosis in mariculture shellfish and its research progress[J]. Marine Environmental Science, 2020, 39(3): 480-487. |
| [8] |
LIU X L, JI C L, ZHAO J M, et al. Metabolic profiling of the tissue-specific responses in mussel Mytilus galloprovincialis towards Vibrio harveyi challenge[J]. Fish & Shellfish Immunology, 2014, 39(2): 372-377. |
| [9] |
LIU X L, ZHAO J M, WU H F, et al. Metabolomic analysis revealed the differential responses in two pedigrees of clam Ruditapes philippinarum towards Vibrio harveyi challenge[J]. Fish & Shellfish Immunology, 2013, 35(6): 1969-1975. |
| [10] |
WEI Z X, XIN L S, ZHANG W W, et al. Isolation and characterization of Vibrio harveyi as a major pathogen associated with mass mortalities of ark clam, Scapharca broughtonii, in summer[J]. Aquaculture, 2019, 511: 734248. |
| [11] |
张晓华, 廖绍安, 李筠, 等. 海湾扇贝病原菌(飘浮弧菌)的研究[J]. 青岛海洋大学学报(自然科学版), 1998, 28(3): 426-432. ZHANG Xiaohua, LIAO Shaoan, LI Yun, et al. Studies on pathogenic bacteria (Vibrio natriegen) of Argopecten irradins Lamarck[J]. Journal of Qingdao Ocean University (Natural Science Edition), 1998, 28(3): 426-432. |
| [12] |
DAVIDE N, NATALIE K, SEAN A, et al. Adaption potential of Crassostrea gigas to ocean acidification and disease caused by Vibrio harveyi[J]. ICES Journal of Marine Science, 2021, 78(1): 360-367. |
| [13] |
高晓建, 姚东瑞, 孙晶晶, 等. 4株长牡蛎(Crassostrea gigas)致病性哈维氏弧菌(Vibrio harveyi)鉴定及其毒力基因检测[J]. 海洋湖沼通报, 2015(3): 87-96. GAO Xiaojian, YAO Dongrui, SUN Jingjing, et al. Identification of 4 pathogenic Vibrio harveyi strains isolated from diseased oyster (Crassostrea gigas) and detection of their virulence genes[J]. Transactions of Oceanology and Limnology, 2015(3): 87-96. |
| [14] |
朱贝贝, 方晧, 李煜, 等. 文蛤病原菌哈氏弧菌的分离鉴定与药敏试验[J]. 山东畜牧兽医, 2017, 38(9): 4-5. ZHU Beibei, FANG Hao, LI Yu, et al. Isolation, identification and antibiotic sensitivity of Vibrio harleyi from clam (Meretrix petechialis)[J]. Shangdong Journal of Animal Science and Veterinary Medicine, 2017, 38(9): 4-5. |
| [15] |
金锡鹏. 半数致死剂量的应用及其局限性[J]. 化工劳动卫生通讯, 1992, 9(4): 16-17. JIN Xipeng. The use and limitation of median lethal dose[J]. Chemical Labor Health Newsletter, 1992, 9(4): 16-17. |
| [16] |
李翠萍, 吴民耀, 王宏元. 3种半数致死浓度计算方法之比较[J]. 动物医学进展, 2012, 33(9): 89-92. LI Cuiping, WU Minyao, WANG Hongyuan. LC50 caculated by kochi, probit analysis and linear regression methods[J]. Progress in Veterinary Medicine, 2012, 33(9): 89-92. |
| [17] |
刘冉阳. 哈维氏弧菌(Vibrio harveyi)疫苗免疫保护效果及褐龙斑虹彩病毒病的研究[D]. 上海: 上海海洋大学, 2018. LIU Ranyang. Study on immune protective efficacy of formalin-inactivated Vibrio harveyi vaccine and iridovirus disease of Hybrid Grouper Epinephelus bruneus (♀)×E. lanceolatus (♂)[D]. Shanghai: Shanghai Ocean University, 2018. |
| [18] |
许凯伦, 马建忠, 胡园, 等. 噁喹酸在健康和染病石斑鱼体内代谢规律比较[J]. 浙江农业科学, 2020, 61(11): 2373-2376. XU Kailun, MA Jianzhong, HU Yuan, et al. Comparison of oxolinic acid metabolism in healthy grouper and diseased grouper[J]. Journal of Zhejiang Agricultural Sciences, 2020, 61(11): 2373-2376. |
| [19] |
苏杭. 养殖凡纳滨对虾病原菌(哈维氏弧菌)的分离鉴定与防治[D]. 成都: 四川农业大学, 2010. SU Hang. Isolation and identification of Vibrio harveyi in cultured Litopenaeus vannamei and its prevention and treatment[D]. Chengdu: Sichuan Agricultural University, 2010. |
| [20] |
何婷婷. 哈维氏弧菌胁迫下不同规格皱纹盘鲍和绿盘鲍免疫应答研究[D]. 厦门: 厦门大学, 2018. HE Tingting. Comparative study on immunological responses of pacific abalone and its hybrids with green abalone under Vibrio harveyi stress[D]. Xiamen: Xiamen University, 2018. |
| [21] |
杨千元, 滕爽爽, 蔡逸龙, 等. 哈维氏弧菌浸泡感染下泥蚶(Tegillarca granosa)不同组织弧菌载量的变化规律分析[J]. 海洋与湖沼, 2021, 52(6): 1506-1513. YANG Qianyuan, TENG Shuangshuang, CAI Yilong, et al. Load variation of Vibrio harveyi in the blood clam Tegillarca granosa[J]. Oceanologia et Limnologia Sinica, 2021, 52(6): 1506-1513. |
| [22] |
YUE X, LIU B, XIANG J, et al. Identification and characterization of the pathogenic effect of a Vibrio parahaemolyticus-related bacterium isolated from clam Meretrix meretrix with mass mortality[J]. Journal of Invertebrate Pathology, 2010, 103(2): 109-115. |
| [23] |
李洋, 李强, 张显昱. 哈维弧菌及其主要致病因子的研究进展[J]. 中国农业科技导报, 2014, 16(4): 159-166. LI Yang, LI Qiang, ZHANG Xianyu. Research progress on Vibrio harveyi and its main pathogenic factors[J]. Journal of Agricultural Science and Technology, 2014, 16(4): 159-166. |
| [24] |
钟爱华, 储张杰, 王伟洪, 等. 泥蚶(Tegillarca granosa)血细胞转录组序列中免疫相关基因的结构与mRNA表达量分析[J]. 海洋与湖沼, 2020, 51(2): 354-363. ZHONG Aihua, CHU Zhangjie, WANG Weihong, et al. Analysis of the structure and expression of immune-related genes in bloody clam Tegillarca granosa based on haemocyte transcriptome sequencing[J]. Oceanologia et Limnologia Sinica, 2020, 51(2): 354-363. |
| [25] |
王瑞. 文蛤在弧菌感染过程中载菌量及免疫相关因子变化的初步研究[D]. 青岛: 中国科学院海洋研究所, 2019. WANG Rui. Study on bacterial load and the changes of immune-related factors of Meretrix petechialis in Vibrio infection[D]. Qingdao: Institute of Oceanology, Chinese Academy of Science, 2019. |
| [26] |
XIA Q, WANG B J, LIU M, et al. A new method to evaluate the effects of bacterial dosage, infection route and Vibrio strain in experimental challenges of Litopenaeus vannamei, based on the Cox proportional hazard model[J]. Fish & Shellfish Immunology, 2015, 46(2): 686-692. |
| [27] |
ROSZER T. The invertebrate midintestinal gland ("hepatopancreas") is an evolutionary forerunner in the integration of immunity and metabolism[J]. Cell and Tissue Research, 2014, 358: 685-695. |
| [28] |
樊英, 许拉, 王晓璐, 等. 凡纳滨对虾对哈维氏弧菌不同攻毒方式的响应[J]. 福建农林大学学报(自然科学版), 2018, 47(3): 342-346. FAN Ying, XU La, WANG Xiaolu, et al. Response of Litopenaeus vannamei to different infection methods of Vibrio harveyi[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2018, 47(3): 342-346. |
| [29] |
葛端阳, 赵婷, 潘宝平. 鳗弧菌(Vibrio anguillarum)对青蛤(Cyclina sinensis)的毒性及半致死浓度研究[J]. 海洋与湖沼, 2012, 43(6): 1192-1195. GE Duanyang, ZHAO Ting. PAN Baoping, Toxicity test and half lethal concentration of Vibrio anguillarum to the clam Cyclina sinensis[J]. Oceanologia et Limnologia Sinica, 2012, 43(6): 1192-1195. |
| [30] |
NAKANISHI T, KIRYU I, OTOTAKE M. Development of a new vaccine delivery method for fish: percutaneous administration by immersion with application of a multiple puncture instrument[J]. Vaccine, 2002, 20(31): 3764-3769. |
 2023, Vol. 47
2023, Vol. 47


