
文章信息
- 高云涛, 高云红, 王嘉伟, 李明月, 曲江波, 贾玉东, 孟振. 2023.
- GAO Yun-tao, GAO Yun-hong, WANG Jia-wei, LI Ming-yue, QU Jiang-bo, JIA Yu-dong, MENG Zhen. 2023.
- 氨氮急性胁迫对许氏平鲉血液生化指标影响
- Effect of acute ammonia stress on the plasma biochemicalindexes of Sebastes schlegelii
- 海洋科学, 47(8): 49-59
- Marine Sciences, 47(8): 49-59.
- http://dx.doi.org/10.11759/hykx20210306001
-
文章历史
- 收稿日期:2021-03-06
- 修回日期:2021-05-02
2. 上海海洋大学水产与生命学院, 上海 201306;
3. 烟台开发区天源水产有限公司, 山东 烟台 264006
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Tianyuan Aquaculture Co., Ltd of Yantai Economic Development Zone, Yantai 264006, China
氨氮(TAN)是养殖环境中对鱼类造成生理应激和损害的重要环境因子[1], 受pH、温度等因素影响, 以非离子氨(NH3-N)和离子铵(NH4+)的形式在水体中呈现动态平衡[2]。两者中, NH3由于不带电荷和脂溶性的特点, 能够穿透生物膜系统进入鱼体血液循环, 可快速引发毒性效应, 是引起水生生物毒害的主要因子, 而NH4+毒性较低[3]。
许氏平鲉(Sebastes schlegelii)是中国北方沿海的主要养殖鱼类品种, 养殖模式以“陆海接力”为主, 即在工厂化条件下完成育苗和大规格苗种培育, 再转运至网箱中养成至商品鱼[4-5]。在苗种的工厂化养殖期间和陆海接力运输中, 因水体生物负载过高, 可能导致氨氮持续或瞬间升高, 影响鱼体生长和存活, 造成养殖损失。氨氮对许氏平鲉大规格幼鱼毒性效应的研究较少, 而在氨氮胁迫引起鱼类应激反应中, 血液生理生化指标可以作为应激的重要评价标准[6]。
本研究通过对许氏平鲉大规格幼鱼进行96 h急性毒性实验, 获得氨氮的半致死浓度(LC50)和安全浓度(SC), 研究氨氮浓度、胁迫时间及二者交互作用对血液生化指标的影响, 查明氨氮胁迫的敏感指标及其变化规律, 可为许氏平鲉大规格幼鱼的养殖管理和海陆接力养殖的苗种转运提供指导。
1 材料和方法 1.1 实验材料实验地点为烟台开发区天源水产有限公司, 实验苗种平均体质量(63.60±10.14) g, 全长(15.90±3.29) cm, 苗种体表无损伤、规格整齐、活力较好。实验前暂养48 h, 禁食。
实验采用体积为120 L的圆柱形玻璃钢水槽, 海水经砂滤、紫外消毒处理, 水温(18.6±0.5) ℃, pH 7.85, 盐度30, 溶氧(8.6±0.5) mg/L, TAN < 0.1 mg/L, 光照(610~630) lx。
1.2 半致死剂量实验通过预实验, 获得氨氮浓度的上、下限, 按等对数间距设置浓度梯度。本实验TAN质量浓度为10.09、12.72、16.01、20.19、25.44、32.03和40.37 mg/L, 对应非离子氨(NH3-N)浓度0.15、0.19、0.24、0.30、0.38、0.48和0.60 mg/L, 同时设置对照组(不添加NH4Cl, 表 1)。
| 组号 | 氨氮浓度/(mg·L–1) | 非离子氨浓度/(mg·L–1) | 实验鱼数/ind | 累计死亡数量/ind | |||
| 24 h | 48 h | 72 h | 96 h | ||||
| A | 10.09 | 0.15 | 30 | 0 | 0 | 1 | 1 |
| B | 12.72 | 0.19 | 30 | 1 | 1 | 2 | 5 |
| C | 16.01 | 0.24 | 30 | 3 | 4 | 5 | 7 |
| D | 20.19 | 0.30 | 30 | 10 | 13 | 14 | 20 |
| E | 25.44 | 0.38 | 30 | 10 | 19 | 20 | 26 |
| F | 32.03 | 0.48 | 30 | 17 | 23 | 27 | 30 |
| G | 40.37 | 0.60 | 30 | 30 | 30 | 30 | 30 |
TAN浓度以分析纯NH4Cl(中国医药集团有限公司)配制, 即加入相应体积新鲜配制的NH4Cl母液(10 g/L)。每个处理浓度组设3个平行样, 分别放入同规格苗种10尾, 保持正常通气, 每24 h更换一次水体。每隔2 h观察一次苗种行为表现, 记录水温、溶氧、pH和鱼体死亡量, 将死亡鱼体及时捞出、处理。
1.3 急性氨氮胁迫实验根据半致死计量实验分析结果, 设置TAN浓度0、3.5、10、20 mg/L, 对应NH3-N浓度0、0.05、0.15、0.30 mg/L, 分析急性氨氮胁迫下许氏平鲉幼鱼血液生化指标的变化规律。每个实验组设3个平行样, 分别放入许氏平鲉幼鱼30尾, 规格同上。
1.3.1 血液样品采取血液样品采集时间为胁迫后的0、6、12、24、48、72和96 h。采血时, 每个时间点由同一浓度组3个平行样中各随机抽取3尾鱼(共9尾), 将鱼体快速捞出, 采用MS-222(200 mg/L, Sigma)快速深度麻醉, 尾静脉采血, 血液置于EDTAK2抗凝管中4 ℃保存, 5 000 r/min离心10 min制备血浆, 血浆保存于–80 ℃, 用于检测血液生化指标。
1.3.2 血液样品检测血浆胆固醇(TCH, COD-PAP法)、甘油三酯(TG, GPO-PAP酶法)、血氨(PA, 无蛋白滤液法)、谷丙转氨酶(ALT, 赖氏法)、谷草转氨酶(AST, 赖氏法)、还原型谷胱甘肽(GSH, 比色法)、碱性磷酸酶(AKP, 微量酶标法)、葡萄糖(GLU, 葡萄糖氧化酶-过氧化物酶法)测定试剂盒均购于南京建成生物工程研究所, 采用上海酶联生物研究所Elisa试剂盒(Cortisol, Fish Cortisol Elisa Kit ml003467)测定皮质醇(Cor)。
1.4 数据分析NH3-N浓度由TAN浓度采用《海水水质标准》(GB 3097—1997)公式换算, 换算公式为:
| a= 14×10−5 b·f, | (1) |
| f=10010c−d+1, | (2) |
| c=9.245+0.002949S+0.0324(298–T), | (3) |
其中, a为水样中NH3-N浓度(mg/L), b为TAN浓度(μmol/L), f为氨的水溶液中非离子氨的摩尔百分比, c为温度T(T=273+t)盐度S的海水中NH4+的解离平衡常数KaS·T的负对数, d为水体pH值。
TAN和NH3-N的96 h半致死浓度(LC50, m)使用SPSS 17.0软件以概率单位加权回归(Probit)法计算, 安全浓度(SC, s)计算公式为:
| s=0.1×m. | (4) |
用平均值±标准差(Mean±SD)表示血浆生化指标数据, 数据采用双因素方差分析(Two-way ANOVA)进行检验(SPSS 17.0), 同一浓度不同时间和同一时间不同浓度处理组间的差异性(P < 0.05)使用Tukey’s多重比较分析。
2 结果 2.1 行为反应胁迫初期(0~6 h), 高浓度氨氮组(32.03和40.37 mg/L)幼鱼即表现出运动频繁、急速和无方向游泳等现象, 且幼鱼的急性应激反应随氨氮浓度的增加而剧烈, 胁迫2~24 h时, 40.37 mg/L组幼鱼受惊后会盲目冲击池壁或冲出水面, 短暂、快速运动后鱼体逐渐失去平衡, 沉于水底。低浓度处理组(A、B、C组)实验鱼在实验开始24 h内无明显反应, 随着胁迫时间的延长, 也表现出游泳频繁等现象。此外, 所有处理组幼鱼均出现体色变淡的现象, 高浓度处理组体色变化快于低浓度处理组。
2.2 半致死浓度和安全浓度氨氮急性胁迫对许氏平鲉幼鱼的毒性效应见表 1, 幼鱼死亡率随TAN浓度升高而增加, 随处理时间延长, 死亡率逐渐上升, 氨氮对幼鱼的毒性作用受氨氮浓度和胁迫时间的双重影响。
SPSS 17.0软件概率单位加权回归(Probit)法分析结果表明, 总氨氮(TAN)和非离子氨(NH3-N)对许氏平鲉24、48、72和96 h的半致死浓度分别为26.33、22.71、21.05、18.01 mg/L和0.39、0.34、0.31、0.27 mg/L。TAN质量安全浓度为1.80 mg/L, NH3-N质量安全浓度为0.03 mg/L。
2.3 血液生化指标血浆皮质醇(Cor)含量变化受氨氮浓度、处理时间的显著影响(图 1)。同一浓度下, 各处理组血浆Cor含量随着处理时间延长呈先升后降趋势, 处理12 h起始升高, 至72 h达最高值, 此后呈下降趋势; 同一处理时间, 高浓度处理组(20 mg/L)Cor含量自12 h显著高于对照组和低浓度组(0和3.5 mg/L, P < 0.05), 96 h与对照组无显著差异(P > 0.05), 低浓度组(3.5 mg/L组)Cor含量在整个处理期间略高于对照组, 两者仅在72 h存在显著性差异(P < 0.05)。
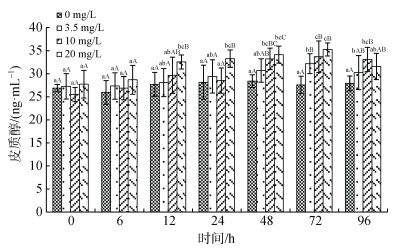 |
| 图 1 许氏平鲉血浆皮质醇含量受氨氮胁迫的变化 Fig. 1 Plasma cortisol content changes in Sebastes schlegelii under acute ammonia stress 注: 双因素方差分析结果表明, 氨氮浓度和处理时间对皮质醇含量具有显著影响, 两者间交互作用无显著性影响; 柱形上方小写字母表示同一浓度不同时间实验组之间的差异性; 大写字母表示同一时间不同浓度实验组之间的差异性 |
氨氮浓度、处理时间及交互作用对血浆血糖(GLU)含量有显著影响(图 2)。同一浓度下, 对照组和低浓度处理组(3.5 mg/L)GLU含量随处理时间延长无显著性变化, 而高浓度处理组(10 mg/L和20 mg/L)则随处理时间延长呈先升后降的趋势, 起始上升时间与浓度正相关。同一处理时间下, 20 mg/L组GLU含量在处理的6~12 h即显著高于其余3组(P < 0.05), 随后快速下降, 96 h显著低于对照组和3.5 mg/L组(P < 0.05); 10 mg/L组GLU含量则在处理后12 h起始升高, 在24 h达最高值, 显著高于对照组和3.5 mg/L处理组, 96 h与对照组相当; 3.5 mg/L组血糖含量在处理后期显著高于高浓度处理组, 与对照组间无显著性差异。
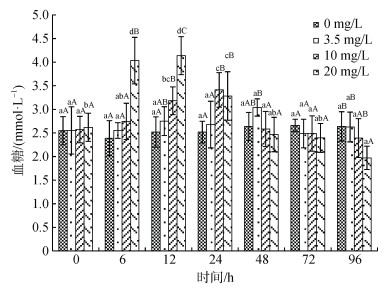 |
| 图 2 许氏平鲉血浆血糖含量受氨氮急性胁迫的变化 Fig. 2 Plasma glucose content changes in Sebastes schlegelii under acute ammonia stress 注: 双因素方差分析结果表明, 氨氮浓度、处理时间及交互作用对血糖含量均具有显著影响; 柱形上方小写字母表示同一浓度不同时间实验组之间的差异性; 大写字母表示同一时间不同浓度实验组之间的差异性 |
氨氮浓度、浓度和时间交互作用对血浆胆固醇(TCH)含量影响显著, 处理时间对其含量无显著性影响(图 3)。同一浓度下, 对照组和3.5 mg/L处理组血浆TCH含量随处理时间延长无显著性变化, 10 mg/L处理组TCH含量则在96 h显著高于其余时间(P < 0.05), 20 mg/L处理组TCH含量随处理时间延长呈先升后降的趋势, 于处理后12 h达最高值(P < 0.05)。同一处理时间下, 20 mg/L处理组TCH含量在处理的12 h显著高于其余3组, 72 h后显著低于其余各种; 低浓度处理组(3.5 mg/L和10 mg/L)处理48 h内与对照组均无显著性差异(P > 0.05), 72 h稍高于对照组, 96 h显著高于对照组(P < 0.05)。
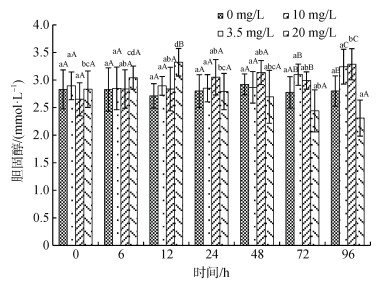 |
| 图 3 许氏平鲉血浆胆固醇含量受氨氮急性胁迫的变化 Fig. 3 Plasma cholesterol (TCH) content changes in Sebastes schlegelii under acute ammonia stress 注: 双因素方差分析结果表明, 氨氮浓度和交互作用对胆固醇含量具有显著影响, 处理时间对其影响不显著; 柱形上方小写字母表示同一浓度不同时间实验组之间的差异性; 大写字母表示同一时间不同浓度实验组之间的差异性 |
血氨(PA)浓度受氨氮浓度、处理时间及交互作用的显著影响(图 4)。同一浓度下, 10 mg/L和20 mg/L组血氨浓度自12 h后达最高值(P < 0.05), 此后处于平台期, 对照组和3.5 mg/L处理组PA浓度随处理时间无显著性变化(P > 0.05)。同一处理时间, 20 mg/L组12 h后PA浓度即显著高于其他组(P < 0.05), 且始终保持最高值, 48 h后10 mg/L组PA浓度显著高于对照组和3.5 mg/L处理组, 各处理组12 h后PA浓度与氨氮处理浓度呈正相关。
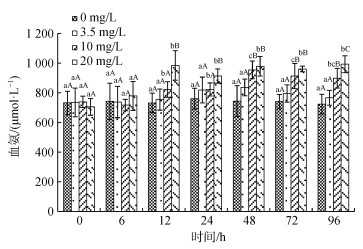 |
| 图 4 许氏平鲉血浆血氨含量受氨氮急性胁迫的变化 Fig. 4 Plasma ammonia content changes in Sebastes schlegelii under acute ammonia stress 注: 双因素方差分析结果表明, 氨氮浓度、处理时间及交互作用对血氨含量均具有显著影响; 柱形上方小写字母表示同一浓度不同时间实验组之间的差异性; 大写字母表示同一时间不同浓度实验组之间的差异性 |
血浆还原型谷胱甘肽(GSH)含量受氨氮浓度、处理时间及二者的交互作用的显著影响(图 5)。同一浓度下, 10 mg/L和20 mg/L处理组GSH含量随处理时间呈先升后降的趋势, 响应时间与浓度正相关; 同一处理时间, 20 mg/L处理组GSH含量在6 h处达到最大值, 显著高于其他组(P < 0.05), 24 h后则显著低于其他组(P < 0.05), 10 mg/L组24 h前与对照组无显著性差异, 至96 h显著低于对照组和3.5 mg/L组(P < 0.05)。
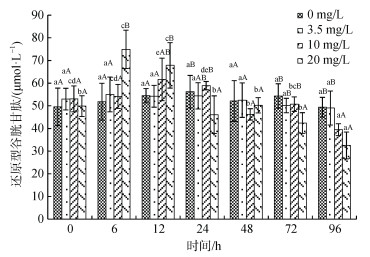 |
| 图 5 许氏平鲉血浆还原型谷胱甘肽含量受氨氮急性胁迫的变化 Fig. 5 Plasma reduced glutathione (GSH) activity changes in Sebastes schlegelii under acute ammonia stress 注: 双因素方差分析结果表明, 氨氮浓度、处理时间及交互作用对还原型谷胱甘肽含量均具有显著影响; 柱形上方小写字母表示同一浓度不同时间实验组之间的差异性; 大写字母表示同一时间不同浓度实验组之间的差异性 |
血浆碱性磷酸酶(AKP)活性受氨氮浓度、处理时间及交互作用的显著影响(图 6), 同一浓度下, 对照组和3.5 mg/L处理组血浆AKP活性随处理时间延长无显著性变化, 10 mg/L处理组呈逐渐上升的趋势, 20 mg/L处理组AKP活性则呈先升后降的趋势, 于处理后48 h达最高值。同一处理时间下, 20 mg/L处理组AKP活性在处理的6 h即显著高于其余3组, 72 h后与10 mg/L处理组无显著性差异; 10 mg/L处理组72 h后显著高于对照组和3.5 mg/L组; 3.5 mg/L处理组和对照组在整个处理周期内均无显著性差异。
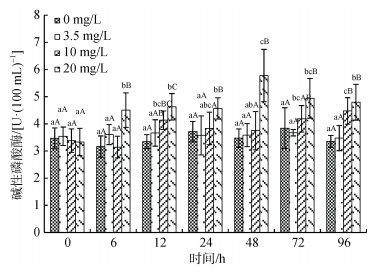 |
| 图 6 许氏平鲉血浆碱性磷酸酶活性受氨氮急性胁迫的变化 Fig. 6 Plasma alkaline phosphatase (AKP) activity changes in Sebastes schlegelii under acute ammonia stress 注: 双因素方差分析结果表明, 氨氮浓度、处理时间及交互作用对碱性磷酸酶活性均具有显著影响; 柱形上方小写字母表示同一浓度不同时间实验组之间的差异性; 大写字母表示同一时间不同浓度实验组之间的差异性 |
氨氮浓度、处理时间对许氏平鲉血浆谷丙转氨酶(ALT)活性有显著影响(图 7), 同一浓度下, 随处理时间的延长对照组及3个处理组ALT活性显著性增高(P < 0.05), 至48 h后处于平台期。同一处理时间下, 3个处理组ALT活性在处理的6 h即显著高于对照组, 在48 h处活性最高, 各处理组间无显著性差异。
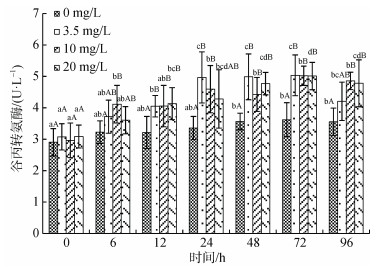 |
| 图 7 许氏平鲉血浆谷丙转氨酶活性受氨氮急性胁迫的变化 Fig. 7 Plasma alanine aminotransferase (ALT) activity changes in Sebastes schlegelii under acute ammonia stress 注: 双因素方差分析结果表明, 氨氮浓度和处理时间对谷丙转氨酶活性含量具有显著影响, 两者间交互作用无显著性影响; 柱形上方小写字母表示同一浓度不同时间实验组之间的差异性; 大写字母表示同一时间不同浓度实验组之间的差异性 |
氨氮浓度、处理时间及其交互作用对许氏平鲉血浆谷草转氨酶(AST)活性有显著影响(图 8), 同一浓度下, 3个处理组血浆AST活性都在12 h达到最高水平, 显著高于处理前(P < 0.05)此后, 处于平台期。同一处理时间, 3个处理组6 h后AST活性即显著高于对照组(P < 0.05), 各处理组间除96 h外无显著性差异。
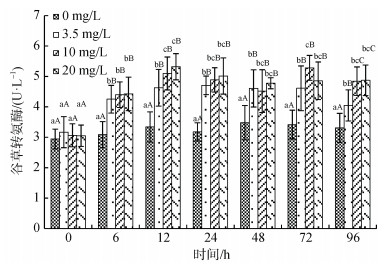 |
| 图 8 许氏平鲉血浆谷草转氨酶活性受氨氮急性胁迫的变化 Fig. 8 Plasma aspartate aminotransferase (AST) activity changes in Sebastes schlegelii under acute ammonia stress 注: 双因素方差分析结果表明, 氨氮浓度、处理时间及交互作用对谷草转氨酶活性均具有显著影响; 柱形上方小写字母表示同一浓度不同时间实验组之间的差异性; 大写字母表示同一时间不同浓度实验组之间的差异性 |
氨氮对鱼类的毒性作用一般认为是非离子氨(NH3-N)可穿过细胞膜, 经过主动转运后进入血液, 造成血液和组织中氨的积累, 导致机体缺氧[7-8], 刺激鱼体兴奋, 使鱼类表现昏迷、窒息、死亡等行为特征[9-10]。此外, 氨氮胁迫会引起体内激素和神经递质的变化, 进而影响鱼类体色[11-13]。本研究中, 高浓度氨氮急性胁迫的许氏平鲉表现出呼吸急促、游窜挣扎、碰撞池壁和丧失平衡等症状以及体色变淡的体表色素变化, 与已报道的大菱鲆(Scophthalmus maximus)[14]、斜带石斑鱼(Epinephelus coioides)[15]、黄颡鱼(Pelteobagrus fulvidraco)[16]、中华鳑鲏(Rhodeus sinensis)[17]等鱼类表现出相似的氨氮胁迫行为反应。
半致死剂量(LC50)和质量安全浓度(SC)是反映鱼类对环境耐受力的重要指标[18]。本研究中, 平均体质量为(63.60±10.14) g[平均全长(15.90±3.29) cm]的大规格许氏平鲉幼鱼, 96 h TAN和NH3-N的LC50分别为18.01和0.27 mg/L, SC分别为1.80和0.03 mg/L。氨氮对鱼类的毒性效应除受水体pH、温度和盐度等影响外, 还与鱼类品种、健康水平[19]和水中溶解氧含量[16]等相关。与已有研究相比, 许氏平鲉大规格幼鱼NH3-N的半致死浓度(LC50, 96h)低于大菱鲆[14]、圆斑星鲽(Verasper variegatus)[20]、半滑舌鳎(Cynoglossus semilaevis)[21]等底栖性海水养殖鱼类, 与斜带石斑鱼[15]、黄颡鱼[16]、青鱼(Mylopharyngodon piceus)[22]、草鱼(Ctenopharyngodon idella)[23]等游泳性鱼类相似, 这可能意味着游泳性鱼类比底栖性海水鱼类对氨氮更为敏感, 也可能与许氏平鲉生态习性相关。
鱼类通过下丘脑-垂体-肾间组织(hypothalamic- pituitary-interrenal, HPI)轴的神经和内分泌反应调节或适应外界环境刺激[22, 24-25]。其中, 皮质醇是鱼类应对环境胁迫的重要标志物[26-28]。本研究中, 各处理组血浆皮质醇含量随着处理时间延长呈现先升后降的趋势, 20 mg/L处理组12 h时Cor含量达最高值, 48~72 h维持最高水平, 至96 h呈下降趋势, 这与其他鱼类氨氮胁迫结果相似。高浓度氨氮胁迫对云纹石斑鱼(Epinehelus moara)[29]、大鳞副泥鳅(Paramisgurnus dabryanus)[30]和大菱鲆[14]血浆皮质醇含量影响显著, 血浆Cor含量分别在胁迫后的6 h、12 h和24 h达最大值, 证实皮质醇同样是鱼类氨氮应激的重要标志物。
血糖(GLU)[31-32]和胆固醇(TCH)[33-34]等是判断动物健康的常用血液生化指标, 其含量受生理状态和外界环境因子刺激的影响。本研究中, 高浓度(20 mg/L)氨氮急性胁迫初期(6~12 h)即可引起许氏平鲉血糖含量显著上升, 这一规律在团头鲂(Megalobrama amblycephala)[35]、大西洋鲑(Salmo salar)[36]和斑点叉尾鮰(Ictalurus punctatus)[37]等多种鱼类得到验证。鱼类血糖浓度在氨氮胁迫初期的快速升高可能是由于急性胁迫引起鱼体对能量的额外需求, 肝糖原快速分解成葡萄糖进入血液, 同时糖异生关键酶被激活, 糖异生作用增强, 维持鱼体能量和代谢平衡[35], 随着胁迫时间延长, 肝糖原被大量分解, 机体内相关酶活性降低, 糖异生反应受阻, 血糖被消耗以继续供应能量, 导致血糖含量呈下降趋势[36]。本研究中, 胆固醇的缓慢上升与皮质醇含量的增加有相同趋势, 推测胆固醇可能参与了神经内分泌调节机制中类固醇激素的产生[38-39], 但胆固醇含量波动与氨氮胁迫时间无显著的相关性, 不宜作为许氏平鲉氨氮胁迫的标志物。
血氨与环境中氨氮浓度密切相关, 是鱼类氨氮胁迫的重要标志物[40-41]。本研究中高浓度氨氮胁迫组(20 mg/L组)血氨浓度在12 h处显著上升, 之后维持高水平; 中间浓度处理组(10 mg/L组)血氨48 h后显著高于对照组, 48 h后各处理组血氨浓度与环境中氨氮浓度正相关, 表明血氨是许氏平鲉氨氮胁迫的重要标志物, 与已有研究结论一致。
氨氮胁迫可诱导水生动物产生大量活性氧(reactive oxygen species, ROS), 从而导致氧化应激启动抗氧化反应[36]。GSH作为重要的抗氧化酶, 可以清除体内累积的ROS, 同时也是GST和GSH-PX两种抗氧化酶进行酶促反应的底物[42-44]。许氏平鲉血浆GSH含量在高浓度处理组(20 mg/L组)胁迫6 h后达到最大值, 显著高于处理前, 之后则快速下降, 这可能与高浓度氨氮导致鳃、肝脏和肾脏等组织细胞结构性损伤, 大量内源性GSH释放进入血清有关, 从而导致GSH短暂快速升高[45-46]。而低浓度氨氮(10 mg/L)胁迫初期并不能造成机体组织细胞的结构性变化, 仅导致ROS的逐渐积累, GSH浓度的升高相对延后(48 h)。氨氮急性胁迫对鱼类血浆GSH含量的影响在其他多种鱼类得到相似结论[47-49], 表明GSH可以作为许氏平鲉氨氮胁迫的标志物。
鱼体健康状态下, 血浆中AST和ALT含量相对较低, 当肝脏、心脏组织细胞发生病变时, 细胞膜通透性增加, 胞浆内的酶释放进入血液, 会导致其血浆浓度升高, 因此AST和ALT是反映鱼体应激造成肝脏、心脏等组织细胞损伤的重要标志[50-51]。王琨等[52]通过将鲤鱼(Cyprinus carpio)幼鱼暴露在氨氮胁迫环境下, 发现经42 d后, 血浆ALT、AST活性呈不同程度升高, 其中AST更容易受到氨氮胁迫的影响, 表明其相比于ALT受到氨氮胁迫更敏感[52]。许氏平鲉血浆AST和ALT活性在急性氨氮胁迫初期即呈升高趋势, 暗示氨氮胁迫导致许氏平鲉肝细胞或心肌细胞受损, 但其上升幅度与氨氮浓度无显著相关性, 因此, AST和ALT不宜作为许氏平鲉氨氮胁迫的标志物。
碱性磷酸酶(AKP)是重要的非特异性免疫标志酶, 存在于多种鱼类组织, 具有防御和消化的双重作用[53]。史文竞等[54]在克氏原螯虾(Procambarus clarkii)氨氮胁迫中证实, 血浆AKP含量受氨氮浓度的显著影响, 点篮子鱼(Siganus guttatus)和哲罗鱼(Hucho taimen)血浆AKP含量同样受外界环境的影响[55-56]。许氏平鲉血浆AKP含量在高浓度氨氮胁迫初期(6 h)即显著升高, 48 h达到峰值, 之后逐渐下降, 而低浓度组响应时间则相对滞后。研究表明, 短时间内高浓度氨氮即可导致细胞损伤, 释放胞内AKP酶, 使血浆AKP酶短时间快速升高[57], 与本实验结论相符, 而之后其活性下降则与鱼类维持基本生命体征而降低自身新陈代谢水平有关[58], AKP可以作为许氏平鲉氨氮胁迫的重要标志物。
综上所述, 在水温18.6 ℃, pH 7.85, 盐度30和溶氧(8.6±0.5) mg/L的环境下, 许氏平鲉大规格幼鱼(63.60±10.14) g TAN和NH3-N的96 h半致死浓度(LC50)分别为18.01和0.27 mg/L。血浆GLU、PA、GSH、AKP和AST含量/活性受氨氮浓度、暴露时间及两者交互作用的显著影响, GLU、GSH和AKP含量/活性随处理时间延长呈先升后降趋势, 随氨氮浓度升高响应时间提前; PA浓度与环境TAN浓度正相关; 血浆GLU、和GSH可以作为氨氮胁迫早期(6~12 h)的敏感指标, AKP和PA可以作为氨氮胁迫后期(48~96 h)的敏感指标。
| [1] |
管雪婷, 杨佳伟, 贾晟昊, 等. 养殖水体氨氮含量对鲤鱼养殖的影响[J]. 畜牧兽医科技信息, 2018(7): 30-31. GUAN Xueting, YANG Jiawei, JIA Shenghao, et al. Effect of ammonia nitrogen content on carp culture[J]. Chinese Journal of Animal Husbandryand Veterinary Medicine, 2018(7): 30-31. |
| [2] |
陈启亮, 段雨池, 马跃岗, 等. 氨氮胁迫对斑马鱼繁殖行为的影响[J]. 重庆师范大学学报(自然科学版), 2020, 37(6): 39-44. CHEN Qiliang, DUAN Yuchi, MA Yuegang, et al. Effects of ammonia nitrogen stress on reproductive behavior of Zebrafish[J]. Journal of Chongqing Normal University (Natural Science), 2020, 37(6): 39-44. |
| [3] |
董玉波, 王轲, 王林同. 氨氮对水生生物毒性的研究进展[J]. 天津水产, 2011(2/3): 6-11. DONG Yubo, WANG Ke, WANG Lintong. Research progress on toxicity of ammonia nitrogen to aquatic organisms[J]. Tianjin Aquaculture, 2011(2/3): 6-11. |
| [4] |
史丹, 温海深, 杨艳平. 许氏平鲉卵巢发育的周年变化研究[J]. 中国海洋大学学报(自然科学版), 2011, 41(9): 25-30. SHI Dan, WEN Haishen, YANG Yanping. The annual change of ovarian development in female Sebastes schlegeli[J]. Periodical of Ocean University of China, 2011, 41(9): 25-30. |
| [5] |
严全根, 解绶启, 雷武, 等. 许氏平鲉幼鱼的赖氨酸需求量[J]. 水生生物学报, 2006(4): 459-465. YAN Quangen, XIE Shouqi, LEI Wu, et al. Quantitative dietary lysine requirement for juvenile Sebastes schlegeli. Acta Hydro Bioligica Sinica, 2006(4): 459-465. |
| [6] |
于飞, 陆波, 潘元潮, 等. 海州湾陆海接力养殖的关键技术[J]. 养殖与饲料, 2016(11): 12-14. YU Fei, LU Bo, PAN Yuanchao, et al. Key technologies of marine relay breeding in Haizhou Bay[J]. Breeding and Feed, 2016(11): 12-14. |
| [7] |
李莉, 王雪, 潘雷, 等. 斑点鳟陆海接力养殖初步研究[J]. 渔业现代化, 2017, 44(6): 9-12, 18. LI Li, WANG Xue, PAN Lei, et al. Preliminary study on land-sea relay aquaculture of Oncorhynchus mykiss[J]. Fishery Modernization, 2017, 44(6): 9-12, 18. DOI:10.3969/j.issn.1007-9580.2017.06.002 |
| [8] |
王美姿. 氨氮胁迫下饲料蛋白质水平对吉富罗非鱼生长、血清生化指标和组织结构的影响[D]. 上海: 上海海洋大学, 2018. WANG Meizi. Effects of dietary protein levels on growth, serum biochemical index and histological structure of GIFT under ammonia-nitrogen[D]. Shanghai: Shanghai Ocean University, 2018. |
| [9] |
ROUMIEH R, BARAKAT A, ABDELMEGUID N E, et al. Acute and chronic effects of aqueous ammonia on marbled spinefoot rabbitfish, Siganus rivulatus (Forsskål 1775)[J]. Aquaculture Research, 2013, 44(11): 1777-1790. |
| [10] |
WEIHRAUCH D, WILKIE M P, WALSH P J. Ammonia and urea transporters in gills of fish and aquatic crustaceans[J]. The Journal of Experimental Biology, 2009, 212(11): 1716-1730. DOI:10.1242/jeb.024851 |
| [11] |
IP Y K, CHEW S F, RANDALL D J. Ammonia toxicity, tolerance, and excretion[J]. Fish Physiology, 2001, 20: 109-148. |
| [12] |
SILVA M J D S, COSTA F F B D, LEME F P, et al. Biological responses of Neotropical freshwater fish Lophiosilurus alexandri exposed to ammonia and nitrite[J]. Science of the Total Environment, 2018, 616/617: 1566-1575. DOI:10.1016/j.scitotenv.2017.10.157 |
| [13] |
王家沛, 陆伟, 王玉群. 鱼类氨氮中毒与解毒方法[J]. 科学养鱼, 2019(10): 89. WANG Jiapei, LU Wei, WANG Yuqun. Poisoning and detoxification of fish ammonia nitrogen[J]. Scientific fish culture, 2019(10): 89. DOI:10.14184/j.cnki.issn1004-843x.2019.10.050 |
| [14] |
孟振, 张鸿丽, 刘新富, 等. 氨氮急性胁迫对大菱鲆幼鱼的毒性效应[J]. 渔业科展, 2020, 41(2): 51-60. MENG Zhen, ZHANG Hongli, LIU Xinfu, et al. Toxic effects of acute ammonia stress on young turbot Scophthalmus maximus[J]. Progress in Fishery Sciences, 2020, 41(2): 51-60. |
| [15] |
郑乐云. 氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J]. 海洋科学, 2012, 36(5): 81-86. ZHENG Yueyun. Acute toxic effects of ammonia and nitrite on Epinephelus coioides fry[J]. Marine Sciences, 2012, 36(5): 81-86. |
| [16] |
李波, 樊启学, 张磊, 等. 不同溶氧水平下氨氮和亚硝酸盐对黄颡鱼的急性毒性研究[J]. 淡水渔业, 2009, 39(3): 31-35. LI Bo, FAN Qixue, ZHANG Lei, et al. Acute toxic effects of ammonia and nitrite on yellow catfish (Pelteobagrus fulvidraco) at different dissolved oxygen levels[J]. Freshwater Fisheries, 2009, 39(3): 31-35. |
| [17] |
封琦, 朱光来, 王建国, 等. 氨氮对中华鳑鲏的急性毒性及2种代谢酶活性的影响[J]. 淡水渔业, 2018, 48(1): 91-96. FENG Qi, ZHU Guanglai, WANG Jianguo, et al. Acutetoxicity of ammonia nitrogen to Rhodeus sinensis and its effects on two metabolism enzymes[J]. Freshwater Fisheries, 2018, 48(1): 91-96. |
| [18] |
胡春亭. 急性氨氮胁迫与溶氧水平对斑马鱼(Danio rerio)的联合毒性效应研究[D]. 上海: 华东师范大学, 2020. HU Chunting. Combined toxic effects of acute ammonia nitrogen stress and dissolved oxygen levels on zebrafish (Danio rerio)[D]. Shanghai: East China Normal University, 2020. |
| [19] |
王甜, 杜劲松, 高攀, 等. 氨氮对白斑狗鱼幼鱼的急性毒性研究[J]. 水产学杂志, 2010, 23(3): 37-39. WANG Tian, DU Jinsong, GAO Pan, et al. The toxic effect of ammonia and nitrogen on the larve of Esox lucius[J]. Chinese Journal of Fisheries, 2010, 23(3): 37-39. |
| [20] |
王贞杰, 陈四清, 曹栋正, 等. 急性氨氮胁迫对圆斑星鲽(Verasper variegatus)幼鱼鳃和肝组织结构及相关酶活性的影响[J]. 渔业科学进展, 2017, 38(2): 59-69. WANG Zhenjie, CHEN Siqing, CAO Dongzheng, et al. Effects of acute ammonia nitrogen stress on histopathology of gill and liver and enzyme activities of juvenile Verasper variegatus[J]. Progress in Fishery Sciences, 2017, 38(2): 59-69. |
| [21] |
徐勇, 张修峰, 曲克明, 等. 不同溶氧条件下亚硝酸盐和氨氮对半滑舌鳎的急性毒性效应[J]. 海洋水产研究, 2006(5): 28-33. XU Yong, ZHANG Shaofeng, QU Keming, et al. Acute toxic effects of nitrite and ammonia on Cynoglossus semilaevis at different dissolve oxygen levels[J]. Marine Fisheries Research, 2006(5): 28-33. |
| [22] |
胡毅, 黄云, 钟蕾, 等. 氨氮胁迫对青鱼幼鱼鳃丝Na+/K+-ATP酶、组织结构及血清部分生理生化指标的影响[J]. 水产学报, 2012, 36(4): 538-545. HU Yi, HUANG Yun, ZHONG Lei, et al. Effects of ammonia stress on the gill Na+/K+-ATPase, microstructure and some serum physiological-biochemical indices of juvenile black carp (Mylopharyngodon piceus)[J]. Journal of Fisheries of China, 2012, 36(4): 538-545. |
| [23] |
刘娥. 草鱼幼鱼对氨氮胁迫的形态及生理学响应[D]. 济南: 山东大学, 2013. LIU E. Morphology and physiological response of juvenile grass carp to ammonia[D]. Jinan: Shandong University, 2013. |
| [24] |
董学兴. 罗氏沼虾对氨氮的胁迫响应及其不同养殖模式的环境效应[D]. 上海: 上海海洋大学, 2019. DONG Xuexing. Stress response of Macrobrachium rosenbergii to ammonia-N and its environmental effects in different culture patterns[D]. Shanghai: Shanghai Ocean University, 2019. |
| [25] |
周鑫, 董云伟, 王芳, 等. 急性氨氮胁迫对于草鱼sod和hsp90基因表达及鳃部结构的影响(英文)[J]. 水生生物学报, 2013, 37(2): 321-328. ZHOU Xin, DONG Yunwei, WANG Fang, et al. The effect of high ammonia concentration on gill structure altrenation and expression of SOD and HSP90 genes in grass carp, Ctenopharyngodon idella[J]. Acta Hydrobiologica Sinica, 2013, 37(2): 321-328. |
| [26] |
王庆萍, 方春林, 芮学党. 鱼类的应激反应[J]. 江西水产科技, 2013(3): 36-39. WANG Qingping, FANG Chunlin, RUI Xuedang. Stress response in fish[J]. Jiangxi Fishery Science and Technology, 2013(3): 36-39. |
| [27] |
BERNIER N J, ALDERMAN S L, BRISTOW E N. Heads or tails? Stressor-specific expression of corticotropin-releasing factor and urotensin Ⅰ in the preoptic area and caudal neurosecretory system of rainbow trout[J]. The Journal of Endocrinology, 2008, 196(3): 637-648. |
| [28] |
HOU H Z, WANG B, LIANG Y K, et al. Hepatoprotective and antioxidant effects of licorice extract against CCl4-induced oxidative damage in rats[J]. Shanghai Ocean University, 2011, 12(10): 6529-6543. |
| [29] |
张艳亮. 维生素E对云纹石斑鱼幼鱼生长、免疫及抗胁迫能力的影响[D]. 上海: 上海海洋大学, 2015. ZHANG Yanliang. Effects of dietary vitamin E supplementation on growth, immunity and stress resistance of Epinehelus moara[J]. Shanghai: Shanghai Ocean University, 2015. |
| [30] |
丁淑荃, 陈范, 马欢, 等. 氨和空气暴露对大鳞副泥鳅血浆皮质醇、乳酸及血糖含量的影响[J]. 淡水渔业, 2019, 49(6): 15-19. DING Shuquan, CHEN Fan, MA Huan, et al. Changes in physiological responses of Paramisgurnus dabryanus suffering from aerial exposure and ammonia loading stress[J]. Freshwater Fisheries, 2019, 49(6): 15-19. |
| [31] |
JANSSENS P A, WATERMAN J. Hormonal regulation of gluconeogenesis and glycogenolysis in carp (Cyprinus carpio) liver pieces cultured in vitro[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1988, 91(3): 451-455. |
| [32] |
BARTON B A. Stress in fishes: a diversity of responses with particular reference to changes in circulating corticosteroids[J]. Integrative and Comparative Biology, 2002, 42(3): 517-525. |
| [33] |
贾媛媛. 亚急性瘤胃酸中毒对山羊血液皮质醇浓度和肝脏脂代谢的影响及其机制研究[D]. 南京: 南京农业大学, 2013. JIA Yuanyuan. Effect of subacute ruminal acidosis on cortisol concentration and hepatie lipid metabolism and its mechanism in dairy goats[D]. Nanjing: Nanjing Agricultural University, 2013. |
| [34] |
王喜红. 胆固醇在水产动物中的应用[J]. 湖南饲料, 2019(3): 36-37, 48. WANG Xihong. Application of cholesterol in aquatic animals[J]. Hunan Feed, 2019(3): 36-37, 48. |
| [35] |
CHEN N, WU M, TANG G P, et al. Effects of acute hypoxia and reoxygenation on physiological and immune responses and redox balance of wuchang bream (Megalobrama amblycephala Yih, 1955)[J]. Frontiers in Physiology, 2017, 8: 375. |
| [36] |
GONZÁLEZ M P, VARGAS-CHACOFF L, MARÍN L S. Stress response of Salmo salar (Linnaeus 1758) when heavily infested by Caligus rogercresseyi (Boxshall & Bravo 2000) copepodids[J]. Fish Physiology and Biochemistry, 2016, 42(1): 263-274. |
| [37] |
REFAEY M, TIAN X, TANG R, et al. Changes in physiological responses, muscular composition and flesh quality of channel catfish Ictalurus punctatus suffering from transport stress[J]. Aquaculture, 2017, 478: 9-15. |
| [38] |
梁健. α-酮戊二酸对草鱼氨氮胁迫的缓解作用研究[D]. 长沙: 湖南农业大学, 2014. LIANG Jian. Studies of α-Ketoglutarate on alleviating ammonia nitrogen stress of Ctenopharyngodon idellus[D]. Changsha: Hunan Agricultural University, 2014. |
| [39] |
周艳玲, 孙育平, 曹俊明, 等. 饲料中添加谷胱甘肽对黄颡鱼幼鱼生长性能、体成分、血清生化指标和抗氨氮应激能力的影响[J]. 动物营养学报, 2017, 29(11): 4189-4197. ZHOU Yanling, SUN Yuping, CAO Junming, et al. Effects of dietary glutathione on growth performance, body composition, serum biochemical indices and anti- ammonia-nitrogen stress ability of juvenile Yellow Catfish (Pelteobagrus fulvidraco)[J]. Acta Zoonutrimenta Sinica, 2017, 29(11): 4189-4197. |
| [40] |
涂翰卿, 赵金良, 黄思颖, 等. 碱胁迫下罗非鱼鳃氨转运蛋白Rh基因的表达[J]. 水产科学, 2019, 38(2): 194-200. TU Hanqing, ZHAO Jinliang, HUANG Siying, et al. Ammonia transporter expression of RH protein gen in gills of nile tilapia Oreochromis niloticus under stress of Alkali[J]. Journal of Fishery Sciences, 2019, 38(2): 194-200. |
| [41] |
涂翰卿. 碳酸盐碱胁迫下尼罗罗非鱼氨代谢途径与Rh蛋白氨转运作用[D]. 上海: 上海海洋大学, 2018. TU Hanqing. Ammonia metabolism pathway and ammonia transport of Rh proteins of Oreochromis niloticus under the stress of carbonate alkalinity[J]. Shanghai: Shanghai Ocean University, 2018. |
| [42] |
OOST R, BEYER J, VERMEULEN N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: a review[J]. Environmental Toxicology and Pharmacology, 2003, 13(2): 57-149. |
| [43] |
PAULINO M G, SOUZA N E S, FERNANDES M N. Subchronic exposure to atrazine induces biochemical and histopathological changes in the gills of a Neotropical freshwater fish, Prochilodus lineatus[J]. Ecotoxicology and Environmental Safety, 2012, 80: 6-13. |
| [44] |
YANG W, SUN H J, XIANG F H, et al. Response of juvenile crucian carp (Carassius auratus) to long-term ammonia exposure: feeding, growth, and antioxidant defenses[J]. Journal of Freshwater Ecology, 2011, 26(4): 563-570. |
| [45] |
SHIN K W, KIM S H, KIM J H, et al. The toxic effects of ammonia exposure on antioxidant and immune responses in Rockfish, Sebastes schlegelii during thermal stress[J]. Environmental Toxicology and Pharmacology, 2015, 40(3): 954-959. |
| [46] |
马粒雅, 王闻, 迟雯丹, 等. 溶解氧变化对中华乌塘鳢酶活的影响及其低氧耐受力研究[J]. 安徽农业科学, 2020, 48(3): 91-94. MA Liya, WANG Wen, CHI Wendan, et al. Study on the effects of dissolved oxygen changes on the enzyme activity of Chinese black sleeper and its low-oxygen tolerance[J]. Journal of Anhui Agricultural Sciences, 2020, 48(3): 91-94. |
| [47] |
张云龙, 商泽昊, 王光毅, 等. 氨和空气暴露对大鳞副泥鳅肝脏抗氧化能力的影响[J]. 中国水产科学, 2020(12): 1-10. ZHANG Yunlong, SHANG Zehao, WANG Guangyi, et al. Effects of ammonia and aerial exposure on hepatic antioxidant capacity of Paramisgurnus dabryanus[J]. Journal of Fishery Sciences of China, 2020(12): 1-10. |
| [48] |
杨维. 氨及其与藻毒素对鲫鱼幼鱼的生态毒理效应[D]. 南京: 南京师范大学, 2011. YANG Wei. Ecotoxicological effects of ammoniad algal toxin on juvenile crucian carp[D]. Nanjing: Nanjing Normal University, 2011. |
| [49] |
FOSS A, IMSLAND A K, ROTH B, et al. Interactive effects of oxygen saturation and ammonia on growth and blood physiology in juvenile turbot[J]. Aquaculture, 2007, 271(1): 244-251. |
| [50] |
倪嘉豪, 朱晓静, 季益平, 等. 养殖密度对银鲳幼鱼生长、代谢酶活力及其相关基因表达的影响[J]. 热带海洋学报, 2020, 39(2): 54-64. NI Jiahao, ZHU Xiaojing, JI Yiping, et al. Effects of breeding density on the growth, metabolic enzyme activity and related gene expression level of juvenile Pampus argenteus[J]. Journal of Tropical Oceanography, 2020, 39(2): 54-64. |
| [51] |
孙丽颖, 张木子, 黎明, 等. 急性氨氮胁迫对黄颡鱼组织抗氧化酶活性及HSP70和HSP90基因mRNA表达水平的影响[J]. 水产学报, 2020, 44(5): 707-714. SUN Liying, ZHANG Muzi, LI Ming, et al. Effects of acute ammonia stress on antioxidant enzyme activity and mRNA expression levels of HSP70 and HSP90 genes in tissues of yellow catfish (Pelteobagrus fulvidraco)[J]. Journal of Fisheries of China, 2020, 44(5): 707-714. |
| [52] |
王琨. 氨氮对鲤(Cyprinus carpio Linnaeus)幼鱼部分组织及血液指标的影响[D]. 哈尔滨: 东北农业大学, 2007. WANG Kun. Effects of ammonia on some tissue and haematological rarameters of juvenile carp (Cyprinus carpio Linnaeus)[D]. Harbin: Northeast Agricultural University, 2007. |
| [53] |
谭春明, 赵旺, 吴开畅, 等. 氨氮胁迫对方斑东风螺六种免疫酶活性的影响[J]. 海洋科学, 2019, 43(4): 8-15. TAN Chunming, ZHAO Wang, WU Changkai, et al. Effects of ammonia nitrogen stress on the activities of six immune enzymes of Babylonia areolata[J]. Marine Sciences, 2019, 43(4): 8-15. |
| [54] |
史文竞, 王龙, 朱传坤, 等. 温度和氨氮对克氏原螯虾免疫相关酶活的影响[C]. 西安: 2018年中国水产学会学术年会, 2018: 375. SHI Wenjing, WANG Long, ZHU Chuankun, et al. Effect of temperature and ammonia nitrogen on the activities of immunity-related enzymes in Procambarus clarkii[C]. Xi'an: 2018 Chinese Fisheries Society Annual Conference, 2018: 375. |
| [55] |
庄平, 王妤, 章龙珍, 等. 盐度骤降对点篮子鱼存活率及肝脏抗氧化酶活性的影响[J]. 复旦学报(自然科学版), 2011, 50(3): 366-372. ZHUANG Ping, WANG Yu, ZHANG Longzhen, et al. The effects of ambient salinity decrement on survival and the activity of antioxidant enzymes in livers of Siganus guttatus[J]. Fudan University Journal, 2011, 50(3): 366-372. |
| [56] |
丰程程, 张颖, 张永泉, 等. 哲罗鱼胚胎至仔稚幼鱼期主要免疫指标和抗氧化酶的活性变化[J]. 淡水渔业, 2013, 43(6): 35-38, 50. FENG Chengcheng, ZHANG Ying, ZHANG Yongquan, et al. The activities of immunological indicators and antioxidant enzyme in Hucho taimen during the development from the embryo to juvenile[J]. Freshwater Fisheries, 2013, 43(6): 35-38, 50. |
| [57] |
彭军辉, 陈丽英, 程长洪, 等. 氨氮对拟穴青蟹的急性毒性及对其血清免疫相关酶活力的影响[J]. 渔业科学进展, 2018, 39(5): 114-121. PENG Junhui, CHEN Liying, CHENG Changhong, et al. Acute toxicity of ammonia nitrogen to Scylla paramamosain and its influence on immune factors in serum[J]. Progress in Fishery Sciences, 2018, 39(5): 114-121. |
| [58] |
张赛赛, 宋晓阳, 尚宏鑫, 等. 氨氮和亚硝酸盐对单环刺螠幼体的急性毒性实验[J]. 河北渔业, 2020(7): 8-12, 29. ZHANG Saisai, SONG Xiaoyang, SHANG Hongxin, et al. Acute toxicity test of ammonia and initrit on Urechis unicinctus larva[J]. Hebei Fisheries, 2020(7): 8-12, 29. |
 2023, Vol. 47
2023, Vol. 47


