
文章信息
- 王娟, 宋迎春, 张烨, 李诗川, 刘小玉, 慕芳红. 2023.
- WANG Juan, SONG Ying-chun, ZHANG Ye, LI Shi-chuan, LIU Xiao-yu, MU Fang-hong. 2023.
- 东寨港红树林凋落叶附生小型底栖动物的群落特征及影响因素
- Community characteristics and factors affecting meiofauna on mangrove leaf litter from Dongzhai Harbor
- 海洋科学, 47(9): 28-39
- Marine Sciences, 47(9): 28-39.
- http://dx.doi.org/10.11759/hykx20230225001
-
文章历史
- 收稿日期:2023-02-25
- 修回日期:2023-04-10
2. 海南东寨港国家级自然保护区管理局, 海南 海口 571129
2. Hai Nan Dong Zhai Gang National Nature Reserve Authority, Haikou 571129, China
红树林是分布于热带、亚热带海岸潮间带的木本植物群落, 处于陆地与海洋的交界面, 周期性地遭潮水浸淹[1]。红树林具有防浪防风、促淤排污、保护堤岸, 维持生物多样性, 美化环境等多种生态功能[2], 在维持海湾河口生态系统的稳态中起着重要的作用[3]。
小型底栖动物(meiobenthos)是指分选时能通过孔径为0.5 mm的网筛, 而被孔径为0.031 mm的网筛所截留的底栖动物[4], 主要包括自由生活海洋线虫(以下简称线虫类), 底栖桡足类(以下简称桡足类), 动吻类, 多毛类, 寡毛类, 缓步类等22类[5], 具有体型小, 数量多, 分布广, 生活周期短等特点。在复杂的碎屑食物链中, 小型底栖动物不仅是消费者, 也是一些鱼类、虾和贝类幼体时期的食物来源, 在加快有机物降解[6]、促进微生物生产与营养物质再循环[7], 对环境污染做出指示等多方面具有重要作用[8]。
目前, 我国红树林总面积为3万余公顷, 主要分布于海南、广东、广西、福建、浙江等地区, 其中广东占全国红树林总面积的46%、广西占32%、海南占17%, 福建和浙江面积较小[9]。随着国家对红树林湿地生物多样性和生态服务功能的重视, 我国对红树林小型底栖动物研究日渐丰富和多样, 如邹明明等[10]对新英港红树林湿地的海洋线虫群落结构进行了研究。何永姑[11]研究了微塑料对东寨港红树林线虫的毒性。刘均玲等[12]、袁超[13]、何永姑等[14]对东寨港红树林小型底栖动物的分布及其沉积环境进行了相关研究; 赵爽[15]对海南东寨港线虫的多样性进行了相关研究。然而, 以上所有的调查工作几乎都集中于沉积物中生活的小型底栖动物群落, 对于凋落叶中小型底栖动物的研究尚未见报道。凋落叶是红树林生态系统初级生产力的主要部分之一[16], 可被微生物以及红树林其他生物分解和利用, 并为邻近浅海域的生物提供有机碎屑、可溶性物质和能量, 对维持邻近海域生态系统的稳定和发展具有重要作用[17-18], 部分凋落叶还可进入红树林沉积物埋藏[19]。同时, 凋落叶作为复杂的红树林生态系统中除沉积物以外的另一重要小生境, 可为红树林小型底栖动物提供栖息场所和可能的食物来源。凋落叶附生小型底栖动物群落的组成、分布规律及其在凋落叶分解利用过程中功能的相关研究亟待进一步开展。
本研究在海南岛东寨港红树林自然保护区选取5个典型的红树群落, 对凋落叶附生小型底栖动物与其环境要素进行了调查采样, 研究小型底栖生物丰度、生物量和群落结构及其与环境变量的关系, 研究结果可为红树林小型底栖动物的研究提供基础数据, 也可为红树林的保护、开发和利用提供科学依据。
1 采样地点、材料与方法 1.1 采样地点本研究于2020年11月在海南东寨港国家级自然保护区(110°34′59.4′′E, 19°56′29.5′′N), 开展了林下凋落叶小型底栖动物及其环境因子的调查采样。
1.2 采样方案及方法在东寨港国家级自然保护区选取了5个红树林进行调查采样, 分别以白骨壤(Avicennia marina)、红海榄(Rhizophora stylosa)、榄李(Lumnitzera racemosa)、角果木(Ceriops tagal)为建群种的红树林, 以及海莲(Bruguiera sexangula)、木榄(Bruguiera gymnorhiza)和尖瓣海莲(Bruguiera sexangul var. rhynchopetala)为主要树种的红树林。在每个红树林设置2个采样点, 2个采样点间隔20 m左右。
采集凋落叶, 现场将其分选为3种不同分解程度的样品。其中, 第一种程度: 叶片仍然完整, 没有明显可见的腐烂迹象, 即至少部分叶子仍然是黄色或棕色; 第二种程度: 叶片颜色变黑, 少量叶片组织脱落; 第三种程度: 分解后期, 叶片的大部分软组织已经腐烂, 但叶脉和叶柄仍然或多或少保存。下文第一、二和三种腐烂程度分别用数字1、2和3表示。每种腐烂程度取4个重复样, 每个重复样90 g。凋落叶样品于–20 ℃条件下运输和保存。用过滤自来水(0.031 mm筛绢过滤)冲洗放置于0.5 mm和0.031 mm两层筛网上的凋落叶, 流速和水压控制为既可将凋落叶充分冲洗, 又不致使小型底栖动物冲出网筛。将保留在0.031 mm筛网上的生物, 用密度为1.15 g/cm3的Ludox-TM溶液冲洗到100 mL离心管的2/3处, 于1 800 r/min离心5 min, 保留上清液, 离心3次后, 将上清液过0.031 mm的网筛置于样品瓶中, 加入等体积10%的甲醛溶液保存待染色[20]。每个样品中加入大约4 mL的0.5 g/L的虎红染色剂, 静置染色不少于24 h。将染色样品用过滤自来水冲洗到划线培养皿中, 在台式解剖镜(Motic SMZ-168)下分选计数。分选出的小型底栖动物用5%的甲醛溶液保存。
1.3 环境因子测定方法沉积物粒度的测定采用激光粒度法(激光粒度分析仪: 英国马尔文, MS3000)。叶绿素a、脱镁叶绿酸含量的测定参照《海洋调查规范》的荧光分光光度法[20], 并参照修正公式[21]计算含量。有机碳含量的测定参照《海洋监测规范》[22]。利用福林酚-比色法测定沉积物中水解单宁的含量[23], 利用盐酸-正丁醇法测定凋落叶中蛋白质缩合单宁、纤维素缩合单宁、可溶性缩合单宁的含量[24]。碳氮比值的测定利用元素分析仪(德国Elementar, Vario EL Ⅲ)对凋落叶中的碳氮比值进行测定。
1.4 数据处理与分析丰度: 计算每克凋落叶上小型底栖动物的个体数, 即得小型底栖动物的丰度值(ind·g–1)。生物量采用各类群丰度乘以该类群的个体平均干重经验值的方法: 线虫类平均个体干重为0.4 µg, 桡足类为1.86 µg, 动吻类为2 µg, 轮虫类为3.5 µg, 海螨类为1.5 µg, 寡毛类为13.98 µg, 缓步类为3.5 µg, 腔肠水螅体为3.5 µg, 双壳类为4.2 µg, 腹毛类为3.5 µg, 昆虫类为3.5 µg, 无节幼体类为3.5 µg[25-28]。
应用SPSS 25.0软件对生物数据和环境因子数据进行单因素方差分析(one-way ANOVA)分析和单变量相关分析(Pearson)。方差不齐时, 采用非参数检验(Kruskal-Wallis)。
应用PRIMER 6.0软件对数据进行多元统计分析: 丰度数据经标准化和平方根转换后建立Bray-Curtis相似性矩阵进行MDS(Non-metric multidimensional scaling)标序分析; 采用ANOSIM(Analysis of similarities)检验群落组间差异的显著性并通过SIMPER(Similarities percentages procedure)分析组间类群的差异; 以百分比含量表示的环境因子数据经对数转换后, 对环境因子数据整体进行正态化处理并建立Euclidean distance矩阵, 然后进行PCA分析(Principal Components Analysis); 环境与生物群落之间的关系采用生物-环境分析(BIOENV)。
2 结果与分析 2.1 环境特征对5个红树林3种不同腐烂程度凋落叶进行缩合单宁和碳氮比测定的结果见表 1。非参数检验结果(表 2)显示, 凋落叶缩合单宁含量在不同红树林、不同腐烂程度间存在显著差异(P<0.05), 分别表现为榄李凋落叶蛋白质缩合单宁含量显著高于角果木和混合红树林(P<0.05); 角果木凋落叶纤维素缩合单宁含量显著高于混合红树林(P<0.05); 第一种腐烂程度凋落叶可溶性缩合单宁含量极显著地高于第二种和第三种腐烂程度的凋落叶(P<0.01)。
| 红树林 | 腐烂程度 | 可溶性缩合单宁含量/(mg·g–1) | 蛋白质缩合单宁含量/(mg·g–1) | 纤维素缩合单宁含量/(mg·g–1) | 碳/氮比/% |
| 白骨壤 Avicennia marina |
1 | 80.98±30.60 | 49.69±12.10 | 19.71±2.60 | 55.57±39.22 |
| 2 | 19.50±2.07 | 30.22±3.90 | 24.97±1.50 | 70.43±24.13 | |
| 3 | 26.94±5.40 | 50.35±9.90 | 47.51±14.10 | 74.15±20.41 | |
| 红海榄 Rhizophora stylosa |
1 | 37.66±28.50 | 66.76±23.12 | 23.43±4.50 | 20.23±3.56 |
| 2 | 48.81±23.43 | 35.69±2.56 | 22.78±20.45 | 36.31±23.56 | |
| 3 | 34.59±3.10 | 64.35±5.40 | 27.59±4.58 | 103.02±5.60 | |
| 混合红树 Mixed forest |
1 | 45.00±25.50 | 22.00±4.80 | 34.70±17.50 | 57.62±43.60 |
| 2 | 43.20±2.60 | 38.10±28.50 | 16.40±3.10 | 82.95±4.54 | |
| 3 | 17.00±6.00 | 19.30±5.60 | 20.90±2.00 | 116.97±28.80 | |
| 角果木 Ceriops tagal |
1 | 58.00±18.90 | 34.80±1.50 | 51.10±24.00 | 98.01±56.05 |
| 2 | 59.20±44.70 | 28.60±2.60 | 55.80±8.70 | 130.67±9.66 | |
| 3 | 18.10±1.40 | 18.10±0.20 | 47.60±28.60 | 46.53±3.99 | |
| 榄李 Lumnitzera racemosa |
1 | 67.10±11.30 | 45.10±31.90 | 43.70±30.80 | 47.59±9.90 |
| 2 | 96.10±2.50 | 67.20±15.50 | 43.30±13.30 | 97.13±23.51 | |
| 3 | 36.80±13.30 | 65.1±50.0 | 42.50±16.10 | 43.50±5.94 |
| 小生境 | 环境因子 | 因素 | df | H/F | P |
| 凋落叶 | 碳/氮比 | 树种 | 4 | 3.927 | 0.416 |
| 腐烂程度 | 2 | 2.565 | 0.277 | ||
| 蛋白质缩合单宁 | 树种 | 4 | 9.729 | 0.045* | |
| 腐烂程度 | 2 | 0.797 | 0.671 | ||
| 可溶性缩合单宁 | 树种 | 4 | 4.961 | 0.291 | |
| 腐烂程度 | 2 | 9.195 | 0.010** | ||
| 凋落叶 | 纤维素缩合单宁 | 树种 | 4 | 11.745 | 0.019* |
| 腐烂程度 | 2 | 0.204 | 0.903 | ||
| 沉积物 | 中值粒径 | 树种 | 4 | 2.466 | 0.107 |
| 偏态系数 | 树种 | 4 | 1.196 | 0.366 | |
| 有机碳含量 | 树种 | 4 | 13.179 | 0.010* | |
| 脱镁叶绿酸含量 | 树种 | 4 | 0.721 | 0.595 | |
| 分选系数 | 树种 | 4 | 1.890 | 0.182 | |
| 叶绿素a含量 | 树种 | 4 | 1.573 | 0.249 | |
| 水解单宁含量 | 树种 | 4 | 0.659 | 0.633 | |
| 注: *表示在0.05水平(双侧)上显著相关; **表示在0.01水平(双侧)上显著相关 | |||||
沉积物环境因子测定的结果见表 3。单因素方差分析结果见表 2, 沉积物有机碳含量在不同红树林间有显著差异(P<0.05), 其中混合红树显著高于红海榄(P<0.05)。
| 红树林 | 中值粒径/mm | 分选系数 | 偏态系数 | 叶绿素a含量/(μg·g–1) | 脱镁叶绿酸含量/(μg·g–1) | 有机碳含量/% | 水解单宁含量/(mg·g–1) |
| 白骨壤 | 0.02±0.01 | 2.41±0.02 | 0.12±0.20 | 0.48±0.16 | 1.71±0.07 | 3.48±1.11 | 25.70±1.29 |
| 红海榄 | 0.03±0.01 | 2.30±0.08 | 0.13±0.02 | 0.44±0.49 | 2.36±0.51 | 3.04±1.23 | 22.57±1.97 |
| 混合红树 | 0.03±0.01 | 2.58±0.07 | 0.06±0.03 | 0.19±0.09 | 1.03±0.38 | 16.77±6.86 | 25.10±0.00 |
| 角果木 | 0.02±0.00 | 2.45±0.25 | 0.08±0.09 | 0.48±0.30 | 2.46±2.00 | 9.70±3.41 | 25.90±0.50 |
| 榄李 | 0.02±0.01 | 2.66±0.20 | 0.07±0.06 | 0.28±0.15 | 1.75±1.33 | 17.72±15.68 | 24.90±4.30 |
对5个红树林的沉积物和凋落叶环境因子分别进行PCA分析, 结果如图 1所示。沉积物环境因子PCA分析结果显示主成分1和主成分2累计的信息量为67.1%。对主成分1贡献较大的变量依次是偏态系数、分选系数、有机碳含量; 对主成分2贡献较大的变量依次是叶绿素a含量、脱镁叶绿酸含量、有机碳含量等。ANOSIM分析显示, 沉积物环境因子在不同腐烂程度间差异不显著, 但在不同红树林之间差异极显著(R=0.36, P<0.01), 其中混合红树与角果木差异极显著(P<0.01), 白骨壤、红海榄与混合红树、角果木呈显著差异(P<0.05)。凋落叶环境因子PCA分析结果显示主成分1和主成分2累计的信息量为64.3%。对主成分1贡献较大的变量依次是可溶性缩合单宁含量、蛋白质缩合单宁含量; 对主成分2贡献较大的变量依次是蛋白质缩合单宁含量、纤维素缩合单宁含量。ANOSIM分析显示, 环境因子在不同腐烂程度间差异不显著, 但在不同红树林之间差异显著(R=0.178, P<0.05), 其中红海榄与角果木, 榄李与角果木、混合红树林差异显著(P<0.05)。
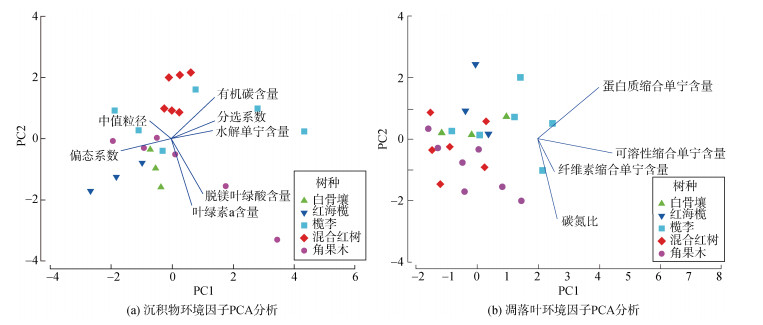 |
| 图 1 沉积物和凋落叶环境因子PCA分析结果 Fig. 1 Results of the PCA analysis on environmental factors of sediment and leaf litter |
凋落叶样品中共鉴定出12个小型底栖动物类群, 线虫类和桡足类均为第一和第二优势类群, 其次为轮虫类、无节幼体, 其他各类包括动吻类、寡毛类、海螨类、缓步类、腔肠水螅体、双壳类、腹毛类、昆虫类, 其相对丰度仅占0.27%。白骨壤、红海榄、榄李、角果木以及混合群落分别鉴定出9、9、6、8、7个小型底栖动物类群。其中, 寡毛类仅在红海榄群落发现, 腔肠类和腹毛类仅在白骨壤群落发现。5个红树群落中小型底栖动物各主要类群的相对丰度见图 2。线虫类相对丰度分布趋势为角果木群落(80.80%)最高, 其余依次为红海榄群落(65.97%)、混合红树群落(60.97%)、白骨壤群落(57.75%)、榄李群落(55.17%), 桡足类的相对丰度分布趋势为榄李群落(40.29%)最高, 其余依次为白骨壤群落(37.99%)、混合红树群落(35.54%)、红海榄群落(29.97%)、角果木群落(18.00%), 与线虫类相对丰度的分布趋势相反。
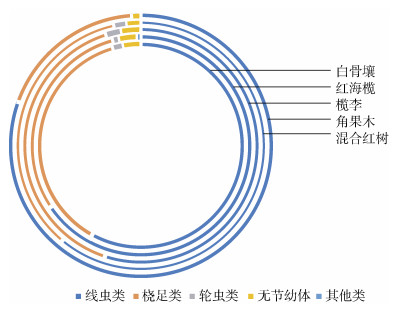 |
| 图 2 五个红树林小型底栖动物主要类群的相对丰度 Fig. 2 Relative abundance of the main meiofaunal taxa in the five mangrove forests |
5个红树林3种不同腐烂程度的凋落叶附生小型底栖动物的丰度见图 3。5个红树群落小型底栖动物平均丰度为(5.67±3.13) ind·g–1, 其中, 白骨壤群落为(7.39±4.06) ind·g–1、红海榄群落为(7.52±1.39) ind·g–1、榄李群落为(3.42±0.81) ind·g–1、角果木群落为(7.12± 3.68) ind·g–1、混合红树群落为(2.88±2.04) ind·g–1; 3种腐烂程度凋落叶附生小型底栖动物丰度分别为: 第一种腐烂程度(3.76±1.81) ind·g–1、第二种腐烂程度(4.92± 2.27) ind·g–1、第三种腐烂程度(8.32±3.46) ind·g–1。
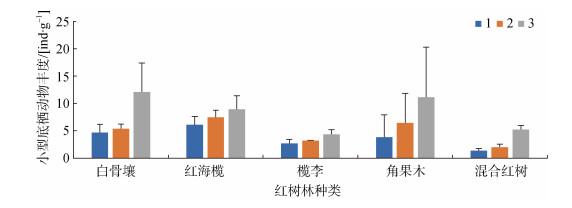 |
| 图 3 五个红树林间和凋落叶3种腐烂程度间小型底栖动物丰度的比较 Fig. 3 Comparison of meiofauna abundance among the five mangrove forests and among the decay levels of leaf litter 注: 1、2和3分别代表凋落叶的3种腐烂程度 |
非参数检验结果见表 4, 小型底栖动物的丰度在不同红树林、不同腐烂程度间差异显著(P<0.05), 其中混合红树群落小型底栖动物丰度显著地低于红海榄群落和白骨壤群落(P<0.05), 角果木群落显著地高于混合红树群落(P<0.05); 第三种腐烂程度小型底栖动物丰度分别极显著地高于第一种和第二种腐烂程度(P<0.01)。
| 变量 | 因素 | df | H | P |
| 小型底栖动物丰度 | 红树林 | 4 | 27.686 | 0.000** |
| 腐烂程度 | 2 | 17.224 | 0.000** | |
| 小型底栖动物生物量 | 红树林 | 4 | 30.743 | 0.000** |
| 腐烂程度 | 2 | 20.430 | 0.000** | |
| 注: **表示在0.01水平(双侧)上显著相关 | ||||
5个红树林3种不同腐烂程度的凋落叶上小型底栖动物的生物量见图 4, 5个红树群落小型底栖动物平均生物量为(5.38±2.87) µg dwt·g–1, 其中, 白骨壤群落为(8.01± 3.76) µg dwt·g–1、红海榄群落为(7.19±1.17) µg dwt·g–1、榄李群落为(3.73±0.93) µg dwt·g–1、角果木群落为(4.99± 3.08) µg dwt·g–1、混合红树群落为(2.95±1.79) µg dwt·g–1; 三种腐烂程度凋落叶附生小型底栖动物生物量为: 第一种腐烂程度(3.68±1.88) µg dwt·g–1、第二种腐烂程度(4.71 ±2.17) µg dwt·g–1、第三种腐烂程度(7.73±3.08) µg dwt·–1。
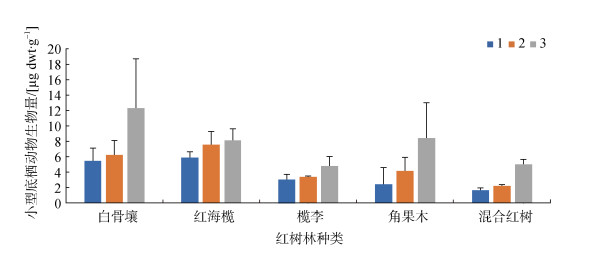 |
| 图 4 五个红树林间和凋落叶3种腐烂程度间小型底栖动物生物量的比较 Fig. 4 Comparison of meiofauna biomass among the five mangrove communities and among the decay levels of leaf litter 注: 1、2和3分别代表凋落叶的3种腐烂程度 |
对东寨港凋落叶小型底栖动物群落进行标序(MDS)分析, 结果如图 5所示, 角果木群落和混合红树群落的点位比较分散, 与其他地点之间有一定程度的混杂。白骨壤、红海榄以及榄李群落的点位相对较集中。ANOSIM分析结果显示不同腐烂程度间小型底栖动物群落差异不显著, 不同红树林间小型底栖动物群落存在显著性差异(R=0.182, P<0.05), 其中, 榄李群落与角果木群落、红海榄群落和白骨壤群落间差异显著(P<0.05), 其余组间差异不显著。结合SIMPER分析(表 5)可得: 线虫类和桡足类两个优势类群对以上红树群落组间差异具有主要贡献, 其中榄李群落的线虫类丰度低于角果木群落, 而桡足类略高于角果木群落; 榄李群落的线虫类和桡足类丰度均低于红海榄和白骨壤群落。
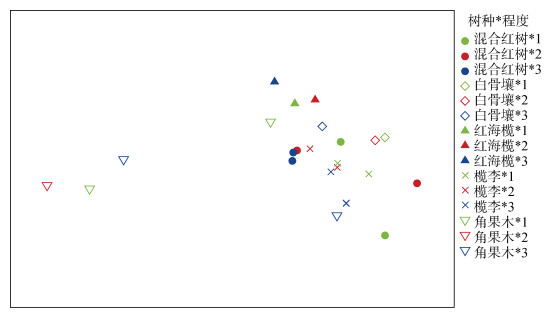 |
| 图 5 不同红树林及不同凋落叶腐烂程度附生小型底栖动物群落标序分析结果 Fig. 5 MDS results on meiofauna communities from different mangrove forests and different decay levels of leaf litter 注: 1、2和3分别代表凋落叶的3种腐烂程度 |
| 凋落叶类型 | 线虫类 | 桡足类 | |||||
| 丰度/(×10–1 ind·g–1) | 贡献度/% | 累计贡献度/% | 丰度/(×10–1 ind·g–1) | 贡献度/% | 累计贡献度/% | ||
| 榄李 | 19.52 | 75.89 | 75.89 | 13.34 | 21.61 | 97.50 | |
| 角果木 | 57.54 | 12.82 | |||||
| 榄李 | 19.52 | 71.92 | 71.92 | 13.34 | 23.63 | 95.55 | |
| 红海榄 | 49.63 | 22.55 | |||||
| 榄李 | 19.52 | 55.17 | 55.17 | 13.34 | 39.74 | 94.92 | |
| 白骨壤 | 42.70 | 28.09 | |||||
对小型底栖动物丰度、生物量与环境因子间进行Pearson相关性分析, 结果见表 6。结果显示小型底栖动物丰度与可溶性缩合单宁含量呈显著负相关(P<0.05), 与分选系数呈极显著负相关(P<0.01), 与偏态系数呈极显著正相关(P<0.01); 小型底栖动物生物量与可溶性缩合单宁含量呈显著负相关(P<0.05), 与分选系数呈极显著负相关(P<0.01), 与偏态系数呈显著正相关(P<0.01); 丰度和生物量与其他环境因子间均无显著性相关性。BIOENV分析结果显示叶绿素a含量、纤维素缩合单宁含量、分选系数和偏态系数的环境因子组合能最好地解释小型底栖动物的群落结构, 相关系数为0.360。
| 小型底栖动物丰度 | 小型底栖动物生物量 | |
| 可溶性缩合单宁含量 | –0.418* | –0.469* |
| 蛋白质缩合单宁含量 | –0.115 | –0.15 |
| 纤维素缩合单宁含量 | –0.388 | 0.186 |
| 水解单宁含量 | –0.006 | –0.044 |
| 碳/氮比 | –0.129 | –0.216 |
| 叶绿素a含量 | 0.051 | 0.137 |
| 脱镁叶绿酸含量 | –0.006 | 0.07 |
| 有机碳含量 | –0.285 | –0.333 |
| 分选系数 | –0.613** | –0.561** |
| 偏态系数 | 0.550** | 0.506* |
| 中值粒径 | –0.191 | –0.152 |
| 注: *表示在0.05水平(双侧)上显著相关; **表示在0.01水平(双侧)上显著相关 | ||
对东寨港红树林自然保护区凋落叶附生小型底栖动物及其沉积环境进行调查, 研究了小型底栖动物的分布及其影响因素。结果显示, 5个红树林的凋落叶附生小型底栖动物的丰度、生物量以及群落结构差异显著; 分解程度较高的凋落叶上小型底栖动物的丰度和生物量较高; 凋落叶附生小型底栖动物的群落特征既与凋落叶环境因子相关, 也与沉积物环境因子相关。
3.1 凋落叶环境因子及分解程度对小型底栖动物的影响小型底栖动物的丰度和生物量在5个红树林的空间分布规律基本一致, 都表现为红海榄和白骨壤群落的丰度和生物量较高, 而榄李和混合红树群落的丰度和生物量较低, 角果木群落居中。凋落叶的可溶性缩合单宁含量与小型底栖动物丰度和生物量呈显著的负相关。红树林主要依靠单宁的聚盐性抗盐机制适应高盐度环境[29]。同时由于含量较高的单宁具有涩味, 可为红树植物提供自我保护能力, 避免被动物直接啃食, 并抑制微生物活动、杀灭病原菌, 增强红树植物的抗病能力和抗海水腐蚀的能力[30]。不同红树的凋落叶具有显著不同的单宁含量[31]。当单宁含量较高时会降低植物的适口性, 已有研究表明凋落叶的单宁含量可以影响大型底栖动物的取食偏好性, 如随着叶片中单宁含量的降低, 相手蟹的取食量相应地呈逐渐上升的趋势[32]。在红树林小型底栖动物的研究中, 环境因子很少包括单宁分析, 目前仅几例研究开展了沉积物中单宁含量的测定并讨论其与沉积物生活小型底栖动物之间的关系[33-34]。单宁可通过衍生的酸度或给碎屑带来有毒味道来阻止小型底栖动物摄食有机碎屑, 对澳大利亚东北海岸热带红树林沉积物小型底栖动物群落产生负面影响[34]。而Abdullah等[33]对澳大利亚东部亚热带红树林沉积物小型底栖动物研究却发现适度的水解单宁含量, 可使小型底栖动物丰度达到最高值。单宁对凋落叶附生小型底栖动物的影响效应目前尚未见报道, 本研究发现沉积物水解单宁含量与凋落叶小型底栖动物之间无显著相关性, 说明沉积物中水解单宁对凋落叶上的小型底栖动物影响甚微, 可能与凋落叶能为小型底栖动物提供与沉积物相对隔离的表面, 使其免受沉积物中水解单宁的影响有关; 凋落叶蛋白质缩合单宁含量和纤维素缩合单宁含量与小型底栖动物丰度和生物量之间也未呈现显著相关性, 这可能与二者结构较为稳定, 不易水解有关[35]; 但小型底栖动物丰度和生物量与凋落叶可溶性缩合单宁含量呈显著负相关, 说明可溶性缩合单宁对在凋落叶上生存的小型底栖动物表现出明显的抑制作用。本研究结果还显示凋落叶的分解程度对附生小型底栖动物具有显著的影响效应, 分解程度较高的凋落叶上生活着丰度和生物量更高的小型底栖动物。新鲜叶片中单宁含量较高[31], 在凋落叶分解过程中, 单宁和碳氮比含量发生一定变化[36]。随着凋落叶的分解, 单宁含量下降, 不仅有利于动物的摄食, 同时有利于细菌和微生物作用, 加速叶片分解, 并通过吸收固定作用使环境中的氮流向腐烂叶子从而降低碳氮比, 从而提高营养价值[32]。本研究中, 3种腐烂程度的凋落叶间碳氮比差异不显著, 第一种腐烂程度凋落叶的可溶性缩合单宁含量却显著高于第二和第三种程度。如前所述, 可溶性缩合单宁对小型底栖动物具有抑制效应, 随着分解程度增高, 可缩合单宁含量降低, 抑制效应减弱; 此外凋落叶的机械组织或物理结构对其上生物的摄食也有一定的影响[32], 随着分解程度加剧, 凋落叶角质层被破坏, 叶表皮脱落、叶肉离散, 可为微生物生长提供更多的附着面积, 进而为小型底栖动物提供了更多可能的食物来源, 从而使得分解程度最高的凋落叶支持了较高的小型底栖动物丰度和生物量。Fell等[37]发现在红树林凋落叶腐烂过程中碳氮比下降, 并且在下降的过程中, 以线虫类和桡足类为主的小型底栖动物类群的密度有增加的趋势。Torres-Pratts等[38]发现线虫类和桡足类的丰度随叶片的腐烂程度而增加。Gee等[39]发现在凋落叶腐烂过程中小型底栖动物群落存在显著差异。本研究和以上这些研究证明了小型底栖动物群落与凋落叶的分解过程是密切相关的, 但它们在凋落叶分解利用过程中的具体功能尚待进一步开展研究。
3.2 沉积物环境因子对小型底栖动物的影响本研究5个红树林间沉积物有机碳含量具有显著差异, 这可能与不同红树林凋落物的生产量不同有关[1], 也可能与不同红树林林分密度不同而导致有机碳截留效率不同有关, 但有机碳含量与小型底栖动物之间却未呈现显著相关性, 因此在高生产力的红树林生态系统中, 丰富的有机碎屑作为食物来源, 可能并不是营碎屑食性的小型底栖动物的主要直接限制性因素。本研究还发现沉积物的分选系数和偏态系数与凋落叶附生小型底栖动物丰度和生物量显著相关。沉积物粒度是决定小型底栖动物分布的关键因子, 对沉积物生活的小型底栖动物的生存空间以及理化环境具有重要影响[40]。分选系数反映了沉积物粒度的分选程度, 本研究中5个红树林沉积物的分选系数值分布于2~3, 都属于分选差的沉积物[40], 不同粒径的颗粒紧密地堆积在一起, 内部孔隙体积较小。尽管都属分选差的沉积物, 但本研究的5个红树林相比, 红海榄和白骨壤林沉积物的分选系数均值比其他3个红树林低。偏态系数反映了沉积物颗粒频率分布的不对称程度, 本研究红海榄和白骨壤林沉积物偏态值大于0.1, 为正偏, 沉积物以粗颗粒成分为主; 其他3种红树林沉积物偏态值在0~0.1, 近对称。因此从分选系数和偏态系数看, 红海榄和白骨壤林的沉积物与其他3个红树林相比, 内部孔隙体积较大, 粗颗粒成分较多, 在红树林沉积物有机碳含量高、普遍缺氧的环境条件下, 这样的沉积物可能较适于对缺氧较敏感的小型底栖动物类群生存, 且它们仅能生存于沉积物最表面的氧化层。当红树林中的海水随潮汐退却, 底质露出水面时, 这些对缺氧敏感的表层小型底栖动物很可能向上迁移至凋落叶中, 利用凋落叶上的空间和食物资源, 从而使红海榄和白骨壤林的凋落叶中小型底栖动物的丰度值升高。Somerfield等[41]人曾报道马来西亚红树林凋落叶附生线虫的种类全部与底泥相同, 说明沉积物与凋落叶之间存在物种交换过程, 该研究还发现, 凋落叶附生桡足类群落存在一些特有种类, 与沉积物桡足类群落具有明显的差异[41]。因此, 红树林凋落叶和沉积物作为陆海边缘底栖生态系统中的2个重要小生境, 二者各有特点, 彼此之间存在相互联系和相互影响, 对小型底栖动物群落的影响是综合性的。
小型底栖动物群落在5个红树林之间存在显著差异。与凋落叶小型底栖动物群落特征密切相关的环境因子, 除了沉积物粒径参数和缩合单宁外, 叶绿素a是与小型底栖动物群落结构密切相关的环境因子之一。沉积物叶绿素a含量表征沉积物中微藻的生物量, 叶绿素a含量与凋落叶小型底栖动物群落有较密切的关系, 表明沉积物微藻很可能为凋落叶上植食性的小型底栖动物提供部分食物来源。本研究榄李和混合红树林中沉积物的叶绿素a含量较低, 可能与这两种红树的树形更为高大、群落郁闭度高、透光性低, 不利于林内底栖微藻的生长, 从而影响了以底栖微藻为食物来源的小型底栖动物。有研究指出红树群落郁闭度越高, 底栖动物的栖息密度和多样性越低[42-43]; Chinnadurai等[44]发现红树植物类型不同可能会决定沉积物和食物的类型, 进而使不同植被间小型底栖动物密度存在显著差异, 因此不同红树植物的高度、郁闭度、林下通风性、透光性以及食物来源和质量等生态特征的差异也可能是造成不同红树林林下小型底栖动物群落差异的重要原因。
4 结论本研究对我国海南省东寨港5个不同红树林凋落叶附生小型底栖动物群落开展了比较研究。凋落叶附生小型底栖动物的丰度、生物量以及群落结构在不同红树林间差异显著; 小型底栖动物的丰度和生物量在分解程度高的凋落叶上较高; 凋落叶附生小型底栖动物的空间分布既与凋落叶缩合单宁含量相关, 也与沉积物粒度参数和叶绿素a含量有关。研究结果揭示了凋落叶也是红树林生态系统的重要小生境, 其上生活着类群丰富的小型底栖动物群落, 其群落特征受不同红树群落生境条件及凋落叶分解程度的共同影响。未来应进一步探索其生物多样性以及在红树林生态系统中的功能。
| [1] |
陈雅萍, 叶勇. 红树林凋落物生产及其归宿[J]. 生态学杂志, 2013, 32(1): 204-209. CHEN Yaping, YE Yong. Litterfall production and its fates in mangrove forest: A review[J]. Chinese Journal of Ecology, 2013, 32(1): 204-209. |
| [2] |
林鹏. 中国红树林研究进展[J]. 厦门大学学报(自然科学版), 2001, 40(2): 592-603. LIN Peng. A review on the mangrove research in China[J]. Journal of Xiamen University (Natural Science), 2001, 40(2): 592-603. |
| [3] |
曹启民, 郑康振, 陈耿, 等. 红树林生态系统微生物学研究进展[J]. 生态环境, 2008, 17(2): 839-845. CAO Qimin, ZHENG Kangzhen, CHEN Geng, et al. A review of studies on microbiology of mangrove ecosystems[J]. Ecology and Environment, 2008, 17(2): 839-845. |
| [4] |
张志南, 周红, 华尔, 等. 中国小型底栖生物研究的40年——进展与展望[J]. 海洋与湖沼, 2017, 48(4): 657-671. ZHANG Zhinan, ZHOU Hong, HUA Er, et al. Meiofauna study for the forty years in China―progress and prospect[J]. Oceanologia et Limnologia Sinica, 2017, 48(4): 657-671. |
| [5] |
HIGGINS R P, THIEL H. Introduction to the study of meiofauna[M]. Washington D C: Smithsonian Institution Press, 1988.
|
| [6] |
TENORE K R. Utilization of aged detritus derived from different sources by the polychaete Capitella capitata[J]. Marine Biology, 1977, 44(1): 51-55. DOI:10.1007/BF00386904 |
| [7] |
MONTAGNA P A, BLANCHARD G F, DINET A, et al. Effect of production and biomass of intertidal microphytobenthos on meiofaunal grazing rates[J]. Journal of Experimental Marine Biology and Ecology, 1995, 185(2): 149-165. DOI:10.1016/0022-0981(94)00138-4 |
| [8] |
DEZFOULI T T, NABAVI S M B, GHATROMI E R, et al. Study on the Meiofauna community structure in Sajafi shores as the bio-indicator of environmental pollution[J]. Open Journal of Ecology, 2016, 6(10): 632-644. DOI:10.4236/oje.2016.610059 |
| [9] |
陈清华, 程琪, 赵蒙蒙, 等. 我国红树林生态修复现状研究[C]//中国环境科学学会科学技术年会论文集(第四卷). 北京: 中国农业大学出版社, 2019: 4098-4102. CHEN Qinghua, CHENG Qi, ZHAO Mengmeng, et al. Study on ecological restoration of Chinese mangroves[C]//Proceedings of the Annual Science and Technology Conference of the Chinese Society for Environmental Sciences. Beijing: China Agricultural University Press, 2019: 4098-4102. |
| [10] |
邹明明, 郭玉清, 甘加成. 秋季海南省新英港红树林湿地的海洋线虫群落结构研究[J]. 中国海洋大学学报(自然科学版), 2022, 52(5): 44-54. ZOU Mingming, GUO Yuqing, GAN Jiacheng. Studies on the community structure of Xinying Port (Hainan Province) mangrove wetland marine nematodes in Autumn[J]. Periodical of Ocean University of China, 2022, 52(5): 44-54. |
| [11] |
何永姑. 微塑料对东寨港红树林自由生活线虫Viscosia heterolaima毒性的研究[D]. 海口: 海南大学, 2020. HE Yonggu. Cultured and microplastic toxicity to free living mangrove nematode Viscosia heterolaima of Dongzhai Port mangrove[D]. Haikou: Hainan University, 2020. |
| [12] |
刘均玲, 袁超, 何永姑, 等. 东寨港红树林小型底栖动物丰度与Chl a、有机质的相关性[J]. 生态学报, 2019, 39(1): 189-191. LIU Junling, YUAN Chao, HE Yonggu, et al. Correlation of meiofauna abundance with chlorophyll a and organic matter of Dongzhai Harbor mangrove[J]. Acta Ecologica Sinica, 2019, 39(1): 189-191. |
| [13] |
袁超. 海南东寨港红树林小型底栖动物分布与主要环境因子的相关性研究[D]. 海口: 海南大学, 2017. YUAN Chao. Distribution of meiofauna and its correlation with main environmental factors in Dongzhai Port mangrove of Hainan Province[D]. Haikou: Hainan University, 2017. |
| [14] |
何永姑, 刘均玲, 袁超, 等. 不同季节东寨港红树林沉积物小型底栖动物的分布特征[J]. 海洋科学进展, 2019, 37(4): 681-688. HE Yonggu, LIU Junling, YUAN Chao, et al. Characteristics of meiofauna distribution in sediments of Dongzhai Bay mangrove in different seasons[J]. Advances in Marine Science, 2019, 37(4): 681-688. |
| [15] |
赵爽. 海南东寨港红树林海洋线虫多样性研究[D]. 海口: 海南大学, 2018. ZHAO Shuang. Distribution of the free-living marine nematode diversity in Dongzhai Port mangrove of Hainan Province[D]. Haikou: Hainan University, 2018. |
| [16] |
ALONGI D M, CLOUGH B F, ROBERTSON A I, et al. Nutrient-use efficiency in arid-zone forests of the mangroves Rhizophora stylosa and Avicennia marina[J]. Aquatic Botany, 2005, 82(2): 121-131. |
| [17] |
郑逢中, 林鹏, 卢昌义, 等. 福建九龙江口秋茄红树林凋落物年际动态及其能流量的研究[J]. 生态学报, 1998, 18(2): 3-8. ZHENG Fengzhong, LIN Peng, LU Changyi, et al. Interannual dynamic of litter fall of Kandelia Candel mangrove and energy flow through the litter in Jiulong River Estuary, Fujian Province, China[J]. Acta Ecologica Sinica, 1998, 18(2): 3-8. |
| [18] |
周如琼. 红树林凋落物产生过程及其营养物质形式研究概述[J]. 广西科学院学报, 2011, 27(1): 62-64. ZHOU Ruqiong. Formation process and nutrients form of litter fall of mangrove[J]. Journal of Guangxi Academy of Sciences, 2011, 27(1): 62-64. |
| [19] |
LIU X, XIONG Y M, LIAO B W. Relative contributions of leaf litter and fine roots to soil organic matter accumulation in mangrove forests[J]. Plantand Soil, 2017, 421(1/2): 493-503. |
| [20] |
国家海洋局. GB/T 12763.6—2007, 海洋调查规范第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2007. State Oceanic Administration. GB/T12763.6−2007, Specifications for Oceanographic Survey-Part 6: Marine biological survey[S]. Beijing: Standards Press of China, 2007. |
| [21] |
王荣. 荧光法测定浮游植物色素计算公式的修正[J]. 海洋科学, 1996, 10(8): 1-5. WANG Rong. Correction of the formula to convert fluorescence measurement to phaeophorbide a concentration in acidification method[J]. Marine Sciences, 1996, 10(8): 1-5. |
| [22] |
国家海洋局. GB/T 17378.5—2007, 海洋监测规范第5部分: 沉积物分析[S]. 北京: 中国标准出版社, 2007. State Oceanic Administration. GB/T 17378.5−2007, The specification for marine monitoring—Part 5: Sediment analysis[S]. Beijing: Standards Press of China, 2007. |
| [23] |
ALLEN S E, GRIMSHAW H M, PARKINSON J A, et al. Chemical analysis of ecological materials[M]. New York: Blackwell Scientific Publications, 1974.
|
| [24] |
刘晓伟. 红树植物红海榄、白骨壤叶片衰老过程中氮磷和单宁含量季节动态[D]. 厦门: 厦门大学, 2008. LIU Xiaowei. Seasonal dynamics of nitrogen, phosphorus and tannin contents of Rhizophora stylosa and Avicennia marina during leaf senescence[D]. Xiamen: Xiamen University, 2008. |
| [25] |
JUARIO J V. Nematode species composition and seasonal fluctuation of a sublittoral meiofauna community in the German Bight[J]. Verö ff Inst Meeresforsch Bremerh, 1975, 15: 283-337. |
| [26] |
WIDBOM B. Determination of average individual dry weights and ash-free dry weights in different sieve fractions of marine meiofauna[J]. Marine Biology, 1984, 84(1): 101-108. |
| [27] |
MCINTYRE A D. Meiobenthos of sub-littoral muds[J]. Journal of the Marine Biological Association of the United Kingdom, 1964, 44(3): 665-674. |
| [28] |
STRIPP K. Das Verhältnis von makrofauna und meiofauna in den sedimenten der helgoländer Bucht[J]. Verö ffentlichungen des Instituts fÜ r meeresforschung in Bremerhaven, 1969, 12: 143-148. |
| [29] |
HSU F, NONAKA G, NISHIOKA I. Tannins and related compounds. XXXI. Isolation and characterization of proanthocyanidins in Kandelia candel (L.) Druce[J]. Chemical & Pharmaceutical Bulletin, 1985, 33(8): 3142-3152. |
| [30] |
林益明, 向平, 林鹏. 红树林单宁的研究进展[J]. 海洋科学, 2005, 29(3): 59-63. LIN Yiming, XIANG Ping, LIN Peng. Studies on tannins of mangroves-a review[J]. Marine Sciences, 2005, 29(3): 59-63. |
| [31] |
ASHTON E C. Mangrove sesarmid crab feeding experiments in Peninsular Malaysia[J]. Journal of Experimental Marine Biology & Ecology, 2002, 273(1): 97-119. |
| [32] |
李旭林, 彭逸生, 万如, 等. 两种相手蟹对不同红树植物叶片取食的偏好性[J]. 生态学报, 2010, 30(14): 3752-3759. LI Xulin, PENG Yisheng, WAN Ru, et al. Food preference of two sesarmid crabs to different mangrove leaves[J]. Acta Ecologica Sinica, 2010, 30(14): 3752-3759. |
| [33] |
ABDULLAH M, LEE S Y. Structure of mangrove meiofaunal assemblages associated with local sediment conditions in subtropical eastern Australia[J]. Estuarine, Coastal and Shelf Science, 2017, 198: 438-449. |
| [34] |
ALONGI D M. Intertidal zonation and seasonality of meiobenthos in tropical mangrove estuaries[J]. Marine Biology, 1987, 95(3): 447-458. |
| [35] |
王俊宏, 郑向丽, 徐国忠. 缩合单宁功能性研究探讨[J]. 热带农业科学, 2011, 31(1): 91-95. WANG Junhong, ZHENG Xiangli, XU Guozhong. Discussion on the functions of condensed tannins[J]. Chinese Journal of Tropical Agriculture, 2011, 31(1): 91-95. |
| [36] |
LIN Y M, LIU J W, XIANG P, et al. Tannins and nitrogen dynamics in mangrove leaves at different age and decay stages (Jiulong River Estuary, China)[J]. Hydrobiologia, 2007, 583: 285-295. |
| [37] |
FELL J W, CEFALU R C, MASTERS I M, et al. Microbial activity in the mangrove (Rhizophora mangle) leaf detritus system[J]. Proceedings of the International Symposium on the Biology and Mangroves, 1975, 2: 661-679. |
| [38] |
TORRES-PRATTS H, SCHIZAS N V. Meiofaunal colonization of decaying leaves of the red mangrove Rhizophora mangle, in southwestern Puerto Rico[J]. Caribbean Journal of Science, 2007, 43(1): 127-137. |
| [39] |
GEE J M, Somerfield P J. Do mangrove diversity and leaf litter decay promote meiofaunal diversity[J]. Journal of Experimental Marine Biology and Ecology, 1997, 218(1): 13-33. |
| [40] |
GIERE O. Meibenthology: The microscopic motile fauna of aquatic sediments[J]. Choice (Chicago, Ⅲ.), 2009, 46(9): 46-5018. |
| [41] |
SOMERFIELD P J, GEE J M, ARYUTHAKA C. Meiofauna communities in a Malaysian mangrove forest[J]. Journal of the Marine Biological Association of the United Kingdom, 1998, 78: 717-732. |
| [42] |
COULL B C. Role of meiofauna in estuarine soft-bottom habitats[J]. Australian Journal of Ecology, 1999, 24(4): 327-343. |
| [43] |
韩淑梅, 李妮亚, 何平, 等. 引种红树与中国乡土红树幼苗光合特性研究[J]. 西北植物学报, 2010, 30(8): 1667-1674. HAN Shumei, LI Niya, HE Ping, et al. Photosynthetic characteristics of introduced and indigenous mangrove seedlings in China[J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(8): 1667-1674. |
| [44] |
CHINNADURAI G, FERNANDO O. Meiofauna of mangroves of the southeast coast of India with special reference to the free-living marine nematodes assemblage[J]. Estuarine, Coastal and Shelf Science, 2007, 72(1/2): 329-336. |
 2023, Vol. 47
2023, Vol. 47


