
文章信息
- 彭强, 王进京, 王春德, 卢霞, 刘相全, 刘桂龙, 徐鑫, 许贺, 宁军号. 2023.
- PENG Qiang, WANG Jin-jing, WANG Chun-de, LU Xia, LIU Xiang-quan, LIU Gui-long, XU Xin, XU He, NING Jun-hao. 2023.
- SsC1qDC基因在毛蚶免疫防御中的作用
- A novel C1q domain-containing gene (SsC1qDC) from Scapharca subcrenata participates in the immune defense against pathogen infection
- 海洋科学, 47(9): 40-52
- Marine Sciences, 47(9): 40-52.
- http://dx.doi.org/10.11759/hykx20230518001
-
文章历史
- 收稿日期:2023-05-18
- 修回日期:2023-08-06
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003;
3. 山东海洋资源与环境研究所, 山东 烟台 264006;
4. 烟台海之春水产种业有限公司, 山东 烟台 264006;
5. 江苏宝源生物科技有限公司, 江苏 连云港 222144;
6. 江苏海泰海洋科技有限公司, 江苏 连云港 222144
2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China;
3. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China;
4. Yantai Spring-Sea AquaSeed Co., Ltd., Yantai 264006, China;
5. Jiangsu Baoyuan Biotechnology Co., Ltd., Lianyungang 222144, China;
6. Jiangsu Haitai MariTech Co., Ltd., Lianyungang 222144, China
补体C1q是补体C1复合蛋白的一个重要组分, 能够激活补体经典途径, 该途径是脊椎动物中连接获得性免疫和先天免疫的重要枢纽[1, 2]。含C1q结构域蛋白(C1q domain containing proteins, C1qDCs)是包含一个或多个球状gC1q结构域的蛋白超家族[1, 3], 广泛存在于无脊椎动物和脊椎动物中[4, 5]。在脊椎动物中, C1qDCs不仅可以激活补体经典通路, 还可以作为模式识别受体(pattern recognition receptors, PRRs), 通过结合病原表面的病原相关分子模式(pathogen-associated molecular patterns, PAMP), 快速启动细胞吞噬等免疫过程, 有效遏制病原微生物的侵害[6]。例如, 鲤鱼(Cyprinus carpio)的C1qDC蛋白具有细菌凝集活性及脂多糖和肽聚糖结合活性[7]。此外, 斑马鱼(Danio rerio)C1qDC蛋白可以特异结合免疫球蛋白IgG和IgM, 并通过激活补体经典途径抑制血清的溶血活性[8]。
研究发现文昌鱼(Branchiostoma belcheri)C1q蛋白可以结合哺乳类的IgG, 但没有直接证据表明无脊椎动物中存在补体的经典激活途径[9]。越来越多的研究表明, 无脊椎动物的C1qDCs参与了多种免疫应答反应, 例如免疫识别、结合与凝集活性[10, 11], 抗菌活性[12, 13], 促吞噬作用[14, 15]和细胞迁移[16-18]等。然而, C1qDCs在无脊椎动物特定免疫途径中的主要作用鲜有报道, 需要进一步研究以丰富无脊椎动物的免疫机制。
本研究以毛蚶为研究对象, 利用PCR和RACE技术克隆得到SsC1qDC基因的cDNA序列。探究了SsC1qDC基因在毛蚶不同组织、早期胚胎以及弧菌刺激后的表达特征, 并利用RNA干扰技术敲降毛蚶SsC1qDC基因的表达, 分析其在弧菌胁迫后毛蚶血细胞吞噬和凋亡及抗弧菌感染中的功能特征。本研究为进一步阐明SsC1qDC在毛蚶免疫防御中的潜在功能提供了理论基础。
1 材料与方法 1.1 实验材料实验所用的毛蚶为合作公司的养殖群体, 均为壳形完整、健康无损伤的个体。实验前随机挑选30只毛蚶测量数据如下: 平均壳长为22.15±1.37 mm、平均壳高为24.17±1.08 mm、平均壳宽为19.56±0.44 mm、平均体质量为9.63±0.71 g。在实验室条件(pH 8.2±0.1、盐度23±1、温度28±0.5 ℃)下暂养7 d进行实验, 每日早晚各投喂1次螺旋藻饵料, 投喂后2 h更换全部海水。实验所用的弧菌是副溶血弧菌(Vibrio parahaemolyticus)PL2菌株, 菌种由浙江省海洋水产养殖研究所清江基地实验室提供。
1.2 实验方法 1.2.1 毛蚶总RNA提取及cDNA合成采用Trizol提取试剂盒(Invitrogen, 美国)提取毛蚶各组织总RNA, 采用1.0%的琼脂糖凝胶电泳检测RNA的完整性, 利用Nanodrop 2000(Thermo Scientific, 美国)检测RNA的纯度和浓度。然后采用HiScript® Ⅲ RT SuperMix反转录试剂盒(Vazyme, 中国)将毛蚶各组织的RNA反转录成cDNA, –20 ℃保存待用。
1.2.2 毛蚶SsC1qDC基因cDNA序列克隆以毛蚶的肝胰腺、血细胞和鳃等组织的cDNA为模板, 根据引物SsC1qDC-F、SsC1qDC-R和SsC1qDC-F1, SsC1qDC-F2(表 1)扩增SsC1qDC基因的ORF和cDNA全长, 利用PrimeSTAR® Max DNA Polymerase试剂盒(TaKaRa, 日本)进行PCR实验, PCR反应体系: 2.0 μL dNTP Mix、12.5 μL 10×PCR Buffer、0.5 μL正反向引物(10 μmol/L)、1.0 μL cDNA模板、0.2 μL Taq聚合酶和18.3 μL DEPC H2O(TaKaRa, 日本)。反应程序: 94 ℃预变性3 min, 35个循环(94 ℃变性30 s, 54 ℃退火50 s, 72 ℃延伸60 s), 72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳切胶纯化后, 将融合质粒转入大肠杆菌DH5α感受态细胞, 筛选阳性克隆质粒送北京擎科生物有限公司测序。
| 引物 | 序列(5′–3′) | 用途 | 退火温度(℃) |
| SsC1qDC-F | TGTCAGAGACAGAAACACTCTTACC | PCR | 57.5 |
| SsC1qDC-R | CTACTGTATCCACAGAATGTGTCCA | PCR | 58.7 |
| SsC1qDC-F1 | TGGCAACGGATTGAATACAACGGAC | 3′RACE | 68.9 |
| SsC1qDC-F2 | GATCACGCGTATGCTCAGATCCACA | 3′RACE | 68.1 |
| SsC1qDC-S1 | GATCACTAATACGACTCACTATAGGGCG | RNAi | 75.9 |
| ACAAGGTAGTAATGTATTT | |||
| SsC1qDC-S2 | AAATACATTACTACCTTGTCGCCCTATAG | RNAi | 75.9 |
| TGAGTCGTATTAGTGATC | |||
| SsC1qDC-A1 | GATCACTAATACGACTCACTATAGGGATA | RNAi | 74.9 |
| CATTACTACCTTGTCGTT | |||
| SsC1qDC-A2 | AACGACAAGGTAGTAATGTATCCCTATAG | RNAi | 74.9 |
| TGAGTCGTATTAGTGATC | |||
| 18S-RTF | CTTTCAAATGTCTGCCCTATCAACT | qPCR | 61.3 |
| 18S-RTR | TCCCGTATTGTTATTTTTCGTCACT | qPCR | 61.6 |
| SsC1qDC-RTF | TACTGATGAGAGTGGAAAGGGAAAG | qPCR | 61.2 |
| SsC1qDC-RTR | CTGTATCCACAGAATGTGTCCATTG | qPCR | 61.2 |
| LSZ-RTF | CTGGGAAACGACACCTGATGTAAA | qPCR | 58.3 |
| LSZ-RTR | CACATTCACATTGTACCGGAGGAT | qPCR | 58.1 |
| TEP-RTF | TACACATTTGGAAAGCCCGTCAA | qPCR | 57.8 |
| TEP-RTR | AGCTTTGTTTCTCAGCCACATCA | qPCR | 59.4 |
| Dscam-RTF | TGTGTATCAGGGGTAACAGTGGT | qPCR | 58.6 |
| Dscam-RTR | ATCATACCCTGCATGTTCTGCTG | qPCR | 61.7 |
| Vg-RTF | CGTTCGCTTGATGATGACTGCCTT | qPCR | 63.0 |
| Vg-RTR | TGGTAAGTAGCCGTTCGTCCTCTC | qPCR | 61.6 |
| PAF3-RTF | GCGGATCTGTGCAGGTTTTA | qPCR | 58.7 |
| PAF3-RTR | CTAGTGAAAGATGCCACGCC | qPCR | 58.2 |
| C3-RTF | AGTGATAGGAATGGCAGAAGTGA | qPCR | 58.3 |
| C3-RTR | TCTACAGTGACCGTGGATTGG | qPCR | 58.1 |
| SsC1qDC-1-RTF | ATGACTAAAGGGTCACCATCAAATG | qPCR | 58.6 |
| SsC1qDC-1-RTR | AGACACCACTGAAATACGAAACTCC | qPCR | 58.3 |
| SsC1qDC-2-RTF | ATGATACTTGAGTGGCTTCTTGGA | qPCR | 58.3 |
| SsC1qDC-2-RTR | TAGTTTGGTGCTTGAAAATGGGTG | qPCR | 57.4 |
| SsC1qDC-3-RTF | CGGTGGAAGTGTCAGCCTGGT | qPCR | 60.7 |
| SsC1qDC-3-RTR | ACCACTGAAAAATGAGTCTCCGCCA | qPCR | 61.8 |
在NCBI数据库中BLAST模块(http://www.ncbi.nlm.nih.gov/BLAST)进行SsC1qDC核苷酸和氨基酸序列分析; 利用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.htmL)在线预测SsC1qDC基因的开放阅读框和氨基酸序列; 使用ExPASy(https://www.ncbi.nlm.nih.gov/orffinder/)进行SsC1qDC理论等电点与相对分子量的预测; 使用DNAMAN 8.0软件对不同物种的C1qDC蛋白进行多序列比对; 利用MEGA-X软件的邻接法(neighbor-joining, NJ)对包括毛蚶在内的15个C1qDC氨基酸序列构建系统进化树, bootstrap值设为1 000。
1.2.4 不同组织、胚胎发育时期和弧菌刺激后SsC1qDC基因表达情况解剖雌、雄毛蚶各5只, 分别取血细胞、性腺、闭壳肌、斧足、外套膜、肝胰腺和鳃组织等样品, 其中毛蚶血细胞取样具体操作如下: 先用移液枪吸取500 μL的抗凝剂(336 mmol/L NaCl, 27 mmol/L柠檬酸钠, 115 mmol/L葡萄糖, 9 mmol/L EDTA-Na2, pH 7.0)加至无RNA酶的1.5 mL EP管中, 再用注射器或移液枪从毛蚶体内吸取500 μL的血液, 注入提前加入抗凝剂的EP管中轻轻吹打均匀, 4 ℃、1 000 r/min离心5 min收集血细胞, 用PBS洗两遍, 重悬于1 mmol/L的Trizol中。诱导毛蚶产卵后分别取卵细胞、卵裂期(2细胞到8细胞阶段)、囊胚期、原肠期、D型幼虫和眼点幼虫等不同发育时期样品, 每个发育时期取5个平行样品。此外, 将120只健康无损的毛蚶随机分成2组, 实验组向海水加入副溶血弧菌溶液至终浓度为3×107 CFU/mL, 对照组毛蚶在常规充气的海水中饲养。在弧菌攻毒0、3、6、12、24和48 h, 随机取5只毛蚶解剖取血细胞。上述所有样品均在液氮中速冻后置于–80℃冰箱保存、待用。
依据毛蚶SsC1qDC基因cDNA序列设计荧光定量引物(表 1), 利用qRT-PCR技术检测SsC1qDC基因在毛蚶不同组织、胚胎和幼虫发育时期及弧菌刺激后的表达模式, 实验设置4个不同样本重复, 内参基因为18S rRNA。利用Taq Pro Universal SYBR qPCR Master Mix试剂盒(Vazyme, 中国)进行qRT-PCR实验, 反应体系: 2×Taq Pro Universal SYBR qPCR Master Mix 5 μL、ddH2O 3.6 μL、cDNA模板1 μL、正、反向引物各0.2 μL。反应程序: 95 ℃, 30 s; 40个循环(95 ℃, 5 s; 60 ℃, 35 s)。反应在ABI QuantStudioTM 5 Real-Time PCR Instrument(Thermo Scientific, 美国)仪器中进行, 利用2–ΔΔCt 法分析SsC1qDC基因的相对表达水平[19]。
1.2.5 RNA干扰分析根据SsC1qDC基因的ORF序列设计其小干扰RNA序列为SsC1qDC-siRNA(5′-CGACAAGGUAGUA AUGUAU-3′), 将该序列随机打乱顺序获得SsC1qDC-random-siRNA(5′-AGACUAAUGGAUACUAUGG-3′)序列, 利用T7启动子体外转录试剂盒(Tiandz, 天恩泽, 中国)并按其说明书进行小RNA合成与纯化。
将120只健康无损的毛蚶随机分为实验组和对照组, 每组各60只, 利用微量注射器分别注射6 μL的SsC1qDC-siRNAs和SsC1qDC-random-siRNAs至毛蚶的体腔中。在注射后的0、12、24、48和72 h, 两组分别随机取5只毛蚶解剖取血细胞样品, 液氮冻存后转入–80℃冰箱保存。经RNA提取和反转录成cDNA后, 通过qRT-PCR检测实验组和对照组毛蚶SsC1qDC基因的表达量, 分析SsC1qDC-siRNA的干扰效率。
1.2.6 敲降毛蚶SsC1qDC基因后母源性免疫基因的表达分析敲降SsC1qDC基因的表达后, 通过qRT-PCR技术检测母源免疫相关基因的表达情况, 这些基因包括卵黄蛋白原(vitellogenin, Vg)、细胞黏附分子免疫球蛋白(down syndrome cell adhesion molecule, Dscam)、补体C3分子(complement, C3)、硫酯蛋白(thioester-containing protein, TEP)、溶菌酶(lysozyme, LSZ)、酚氧化酶原激活因子3(phenoloxidase-activating factor 3, PAF3)以及同源基因SsC1qDC-1、SsC1qDC-2和SsC1qDC-3。用于检测母源性免疫基因表达的特异性引物见表 1, 18S rRNA作为内参基因。
1.2.7 敲降SsC1qDC基因的毛蚶弧菌刺激后血细胞凋亡、吞噬活性、血细胞总数和存活率的变化将120只健康无损的毛蚶随机分为2组, 分别注射SsC1qDC-siRNA和SsC1qDC-random-siRNA后12 h, 分别向两组毛蚶养殖水体加入终浓度为3×107 CFU/mL的副溶血弧菌, 弧菌攻毒后的0、3、6、12、24、48和72 h取样, 每个时间点实验组和对照组各随机解剖5只毛蚶取血淋巴样品。用预装500 μL抗凝剂的无菌注射器收集500 μL血淋巴, 并用300目筛绢过滤。4 ℃、1 000 r/min离心5 min后倒去上清液, 重悬于1 mL的PBS缓冲液, 相同条件再次离心倒掉上清液, 重悬于1mL的PBS缓冲液中, 用制备好的血细胞工作液检测血细胞凋亡、吞噬活性、血细胞总数。
利用Annexin V-FITC凋亡试剂盒(碧云天, 中国)检测血细胞凋亡水平, 操作如下: 取200 μL血细胞工作液避光条件下加入195 μL的FITC结合液、5 μL FITC和10 μL碘化丙染色液(PI), 轻轻混匀, 25℃避光孵育20 min后用流式细胞仪(CytoFLEX, 美国)检测细胞凋亡率。设置仅添加FITC或PI的单一染料对照组和不添加染料的阴性对照组, 来确定散射图十字门的位置(图 1)。毛蚶血细胞的凋亡率用FITC阳性和PI阴性细胞的数量占细胞总数的百分比来表示[20]。
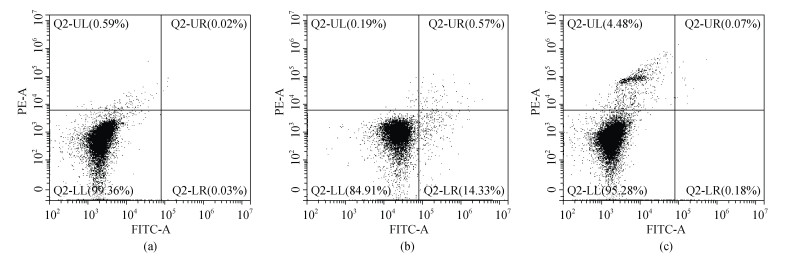 |
| 图 1 细胞凋亡散点图中十字门的位置 Fig. 1 The position of the cross gate in the scatter plot of apoptosis 注: 未添加染料的阴性对照组(a)和仅添加FITC(b)或PI(c)的单一染料对照组, 来确定散点图十字门的位置 |
血细胞吞噬率检测方法参考文献[21]并进行相应调整: 将200 mL血细胞工作液与20 μL 3.0%荧光微球(YG 1.0 μm, Polysciences, 美国)混匀, 在25 ℃黑暗环境中孵育1 h。后用10 μL 37%福尔马林溶液(上海吉至生化科技有限公司)固定, 并在1 000 r/min, 4 ℃条件下离心10 min, 重悬于200 mL PBS缓冲液中并通过流式细胞仪(FL-1通道)检测, 血细胞的吞噬率用吞噬微球的血细胞数目占血细胞总数的百分比表示(图 2)。
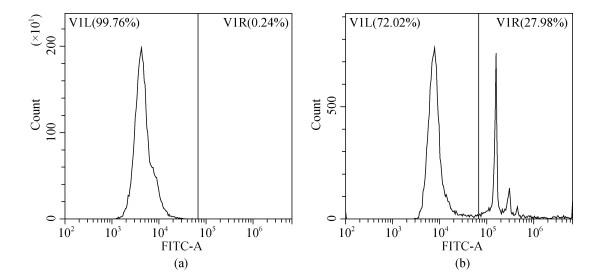 |
| 图 2 通过流式细胞术检测得到的毛蚶血细胞吞噬率的FITC直方图 Fig. 2 FITC histogram plot yielded by flow cytometric analysis of phagocytosis rate in Scapharca subcrenata a. 不加微球的阴性对照; b. 加微球的实验组 |
使用SYBR Green I荧光染料(Biosharp, 中国)对血细胞染色, SYBR Green I可以通过和细胞核中的DNA结合, 产生绿色荧光。取180 µL血细胞工作液, 加入20 µL 10×的SYBR Green I染料, 25 ℃避光孵育1 h, 孵育完成后用移液枪吸取50 μL反应液, 利用流式细胞仪(FL-1通道)检测绿色荧光的细胞并进行计数。
180只健康的毛蚶被随机分成SsC1qDC-siRNA和SsC1qDC-random-siRNA注射后加弧菌组以及SsC1qDC-siRNA注射后加PBS 3组, 每组设置3个平行, 每个平行20只毛蚶。在siRNA注射后12 h, SsC1qDC-siRNA和SsC1qDC-random-siRNA注射组的毛蚶在28℃的含有副溶血弧菌(3×107 CFU/mL)的海水中养殖。SsC1qDC-siRNA注射组中加入等量的PBS缓冲液(Solarbio, 中国)作为空白对照。每12 h统计3组毛蚶的存活个数。
1.2.8 数据分析实验数据结果采用SPSS 26.0软件进行统计分析, 数据以平均值±标准差(Mean±SD)表示, 单因素方差分析(One-Way ANOVA)比较不同数据组间的差异, 其中P < 0.05表示差异显著, P < 0.01表示差异极显著。
2 结果与分析 2.1 毛蚶SsC1qDC基因的克隆和序列特点利用PCR和RACE克隆技术得到毛蚶SsC1qDC基因(基因序列号: OQ264768)的cDNA全长序列为711 bp(图 3), 其中5′-UTR 21 bp, 3′-UTR 80 bp, ORF 600 bp, 共编码199个氨基酸。SsC1qDC的C1q结构域为第66~199个氨基酸, 预测相对分子量22.64 kDa, 理论等电点为8.60。
 |
| 图 3 毛蚶SsC1qDC核苷酸及预测的氨基酸序列 Fig. 3 The nucleotide and deduced amino acid sequences of SsC1qDC 注: 起始密码子(ATG)、信号肽、Clq结构域和终止密码子(TAG)分别用绿色、红色和黄色以及灰色阴影标出 |
将毛蚶SsC1qDC保守的C1q结构域序列与其他物种的C1q结构域序列对比, 结果如图 4所示, 毛蚶SsC1qDC与双壳类SsC1qDCs的同源性高于脊椎动物。毛蚶SsC1qDC与美洲牡蛎(Crassostrea virginica 41.23%)CvC1qDC、硬壳蛤(Mercenaria mercenaria 39.47%)MmC1qDC的相似性较高, 与人(Homo sapiens)和家鼠(Mus musculus)SsC1qDCs的相似性较低, 分别是28.83%、26.61%。
 |
| 图 4 C1qDCs蛋白质的多序列比对 Fig. 4 Multiple sequence alignment of C1qDC proteins 注: C1qDCs的物种和登录号如下: 人(NP_852100.3); 小鼠(NP_112150.1); 长牡蛎(XP_034333860.1); 美洲牡蛎(XP_022291269.1); 红鲍(XP_046377716.2); 欧洲平牡蛎(CAG2203397.1); 亚马逊花鳉(XP_007577129.1); 非洲爪蟾(XP_018122782.1); 硬壳蛤(XP_045158489.1); 贝氏隆头鱼(XP_020504487.1) |
利用15个不同动物门的C1qDCs结构域序列构建NJ进化树, 系统进化树如图 5所示, 进化树的拓扑结构明显分无脊椎动物和脊椎动物2大分支。毛蚶SsC1qDC与紫贻贝(Mytilus edulis)、硬壳蛤(Mercenaria mercenaria)C1qDCs聚为一支, 然后与其他贝类的C1qDCs形成无脊椎动物分支; 来自哺乳动物、鸟类、爬行动物、两栖动物和鱼类的C1qDCs聚为脊椎动物分支。
 |
| 图 5 不同物种C1qDCs蛋白的系统进化分析 Fig. 5 Phylogenetic analysis of C1qDCs proteins from different species 注: 利用MEGA-X软件, 采用邻接法构建系统进化树, 重复1 000次。C1qDCs的物种和登录号如下: 人(NP_852100.3); 小鼠(NP_112150.1); 蝙蝠(XP_0244 25520.1); 非洲爪蟾(XP_018122782.1); 斑马鱼(XP_ 009296972.1); 虾夷扇贝(XP_021374682.1); 滩栖螺(KAG5686619.1); 太平洋牡蛎(XP_034333860.1); 长牡蛎(XP_022291269.1); 红鲍(XP_046377716.2); 欧洲平牡蛎(CAG2203397.1); 紫贻贝(CAG2203397.1); 硬壳蛤(XP_045158489.1) |
如图 6a所示, SsC1qDC基因在毛蚶所有检测组织中均有表达, 在肝胰腺、闭壳肌和鳃中表达水平较高, SsC1qDC在雄性毛蚶性腺、斧足、外套膜和鳃中的表达量显著高于雌性毛蚶, 而在肝胰腺中的表达量呈相反趋势(图 6a所示)。SsC1qDC基因在胚胎发育阶段的表达模式如图 6b所示, 与卵细胞期相比, SsC1qDC的表达从卵裂期到眼点幼虫阶段均显著上调(P < 0.05)。
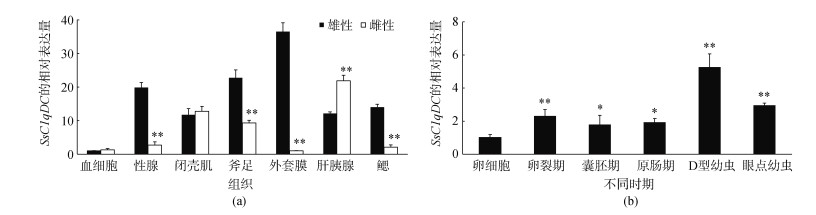 |
| 图 6 SsC1qDC在不同组织(a)和胚胎时期(b)的表达模式(平均值±标准差, n=3) Fig. 6 Expression profiles of SsC1qDC in different tissues (a) and at early development stages (b) (Mean±SD, n=3) |
副溶血弧菌刺激后, 毛蚶血细胞中SsC1qDC基因的表达量如图 7所示, 与对照组相比, SsC1qDC的表达量在3、6、24和48 h显著升高(P < 0.01), 呈现先升高再下降而后再升高的变化趋势, 并在6 h达到最大值(约为对照组的4.0倍)。随后SsC1qDC的表达水平显著下降, 在24 h达到表达量最低, 显著低于对照组的表达量(P < 0.01)。在48 h, SsC1qDC的表达量再次显著上调(P < 0.01)。
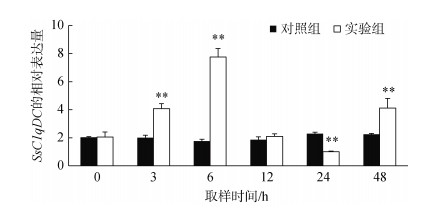 |
| 图 7 弧菌刺激后SsC1qDC的表达情况(平均值±标准差, n=3) Fig. 7 The expression profile of SsC1qDC in ark shell hemocytes challenged with V. parahaemolyticus (Mean±SD, n=3) |
合成的SsC1qDC-siRNA的干扰效率见图 8。与注射随机打乱序列的siRNA对照组相比, 毛蚶注射SsC1qDC-siRNA后12和24 h血细胞中SsC1qDC基因干扰效果显著(P < 0.01), 干扰效率分别为64.9%和59.9%。因此, 选择注射SsC1qDC-siRNA后12 h的血细胞用于后续实验分析。
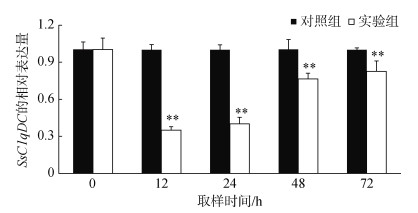 |
| 图 8 注射siRNA对SsC1qDC基因的干扰效率(平均值±标准差, n=3) Fig. 8 The silencing efficiency of siRNA on transcription level of SsC1qDC (Mean±SD, n=3) |
敲降SsC1qDC基因的表达后, 母源性免疫基因Vg、LSZ、Dscam、TEP、SsC1qDC-1的表达显著下调(P < 0.01), 而C3、PAF3、SsC1qDC-2和SsC1qDC-3的表达显著上调(P < 0.01), 其中 C3和PAF3基因的表达量约是对照组的两倍(图 9)。
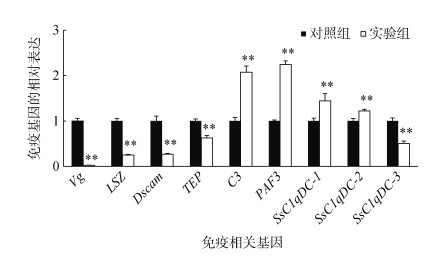 |
| 图 9 敲降SsC1qDC后免疫相关基因的表达情况(平均值±标准差, n=3) Fig. 9 Expression analyses of immune-related genes in the SsC1qDC-silenced ark shell mediated by siRNA (Mean±SD, n=3) |
如图 10a所示, 敲降SsC1qDC基因的表达, 副溶血弧菌刺激后实验组毛蚶血细胞的凋亡率在6 h显著高于对照组(P < 0.05), 并维持较高的凋亡水平到72 h; 实验组毛蚶血细胞的吞噬率在12和24 h显著低于对照组(P < 0.05), 与弧菌刺激前相比, 48和72 h的实验组和对照组毛蚶血细胞吞噬活力均明显下降(图 10b); 实验组毛蚶血细胞总数在3 h后显著低于对照组, 与弧菌刺激前相比, 6 h后实验组和对照组毛蚶血细胞总数均明显下降(图 10c); 副溶血弧菌胁迫后实验组的毛蚶的死亡率在24 h显著高于对照组, 且其死亡率在36 h超过60%, 在84 h全部死亡, 而对照组毛蚶在36 h死亡率不到20%, 在84 h仍有超过20%的毛蚶存活(图 10d)。
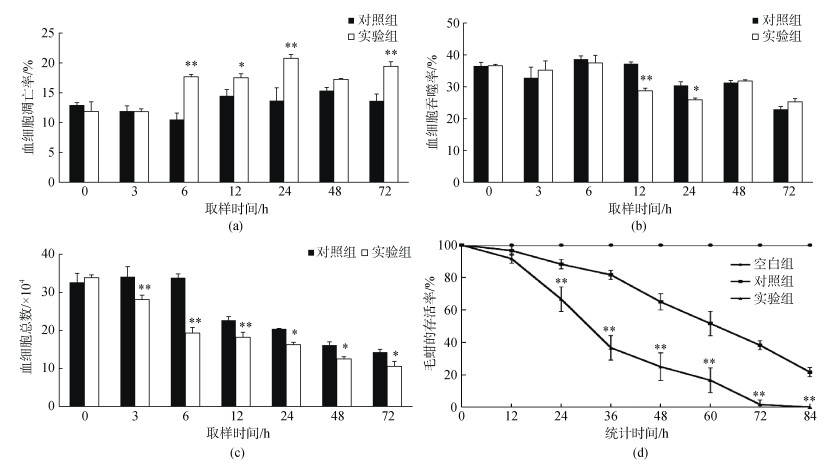 |
| 图 10 敲降SsC1qDC基因表达对弧菌刺激后毛蚶的血细胞凋亡率(a)、吞噬率(b)、血细胞总数(c)和毛蚶存活率(d)的影响(平均值±标准差, n=3) Fig. 10 Changes in apoptosis (a), phagocytosis (b), total hemocyte number (c) and survival rates (d) of SsC1qDC-knockdowned ark shells after V. parahaemolyticus challenge (Mean±SD, n=3) |
越来越多的研究发现双壳贝类C1qDC基因具有多种免疫功能, 在对不同病原的免疫防御反应中起重要作用[7, 9, 11, 14, 22]。本研究从毛蚶中克隆获得一个新的C1qDC基因(命名为SsC1qDC), 多序列比对显示该基因编码的蛋白不保守, 这与水生动物中C1qDC蛋白序列高度可变性的研究结果一致[14, 23]。系统进化分析显示SsC1qDC与紫贻贝、硬壳蛤的C1qDC蛋白聚为一支, 然后与其他软体动物C1qDC聚成一大支, 表明SsC1qDC是软体动物C1qDC家族中的新成员。
SsC1qDC基因在毛蚶所有检测的组织中均有表达, 尤其在肝胰腺和鳃等免疫组织中明显高表达, 提示该基因在毛蚶先天免疫中的潜在作用。已有的研究表明, C1qDC基因在双壳贝类不同组织中普遍表达[23-26], 通常在血细胞中高表达, 然而本研究发现SsC1qDC在毛蚶血细胞中表达量较低, 表明C1qDC基因在不同物种组织中存在表达差异。毛蚶SsC1qDC蛋白序列存在信号肽, 推测SsC1qDC是一种分泌型蛋白, 可通过开放式循环系统转运至机体的不同组织, 以发挥其免疫功能[17]。有研究发现成体三疣梭子蟹(Portunus trituberculatus)的母源性免疫基因在卵巢中的表达通常显著高于精巢[27, 28]。本研究中, SsC1qDC仅在雌性毛蚶肝胰腺中的表达水平显著高于雄性毛蚶中的表达, 但在雄性鳃、性腺、足和外套膜等组织中的表达显著高于雌性, 这一结果表明SsC1qDC可能不是母源性免疫基因。因为母源的mRNAs通常在早期胚胎发育中因为消耗而显著下调表达, 待合子基因组激活后通过转录而显著增加其表达量[29-31], SsC1qDC-1从受精卵到D形幼虫阶段的显著上调表达也暗示SsC1qDC-1不是母源基因。
副溶血弧菌刺激后, 毛蚶SsC1qDC的表达量在短时间内显著升高, 并且在6 h达到最高值, 提示SsC1qDC是一种可诱导的快速免疫效应分子, 这与马氏珠母贝(Pinctada martensi)感染溶藻弧菌(V. alginolyticus)后的表达模式一致[32]。通常在清除入侵的病原或外来刺激物时, C1qDCs的mRNA水平往往呈现先升高后降低的趋势[23, 31-34]。在本研究中, 副溶血弧菌刺激后毛蚶SsC1qDC基因表达呈先升高后降低而后再升高的变化趋势, SsC1qDC基因在6 h后表达降低, 可能是负反馈调节机制、抑制因子的产生以及清除被激活的细胞等调控作用造成SsC1qDC基因表达下降[35, 36]。由于刺激仍然存在, 免疫细胞可能会形成免疫记忆[37], 以便更好地应对未来的刺激, 造成48 h后SsC1qDC基因表达的再次升高, 暗示该基因在毛蚶血液系统中起到免疫功能调节的作用。此外, 敲降SsC1qDC的表达, 毛蚶在副溶血弧菌刺激后的死亡率显著高于对照组, 这一结果支持上述SsC1qDC参与毛蚶抗弧菌反应的观点。
在脊椎动物中, 补体经典途径由补体C1q与抗体-抗原复合物的相互作用激活并触发C3的蛋白水解, 进而清除入侵的病原[3, 11]。本研究中, 敲降SsC1qDC基因可以影响补体C3样基因(如C3和TEP)的表达, 这与脊椎动物中补体经典途径的激活的调控过程类似, 提示补体的经典激活途径是动物由低等向高等进化过程中逐渐完善而来的。通常双壳类动物缺乏免疫球蛋白, 因此缺少经典的补体途径, 但栉孔扇贝(Chlamys farreri)的CfC1qDC蛋白具有与免疫球蛋白IgG的结合活性[14], 推测无脊椎动物C1qDC蛋白可能通过凝集素激活途径激活补体系统[38]。
本研究中, 注射SsC1qDC-siRNA后12 h对SsC1qDC基因的干扰效果最佳, 12 h后干扰效果下降, 可能与SsC1qDC-siRNA在毛蚶体内的浓度降低有关, 这是因为SsC1qDC-siRNA的生物稳定性较差, 可能被毛蚶体内的核酸酶分解[39]。此外, 由于细胞更新和分裂, 注射的SsC1qDC-siRNA会逐渐稀释, 从而降低对SsC1qDC基因的干扰效率[40]。因此注射SsC1qDC-siRNA后的干扰效果只能在一定时间内观察到, 随后干扰效果会逐渐降低。Vg、LSZ、Dscam、TEP和C3是典型的母源性免疫基因, 在水生动物的早期发育和入侵病原快速清除中发挥重要作用[17, 28, 41, 42]。本研究中, 除补体C3外, 敲降SsC1qDC基因表达后, 上述免疫基因的表达均显著下调, 表明SsC1qDC基因可能参与调控毛蚶基础免疫。这与在三疣梭子蟹中的研究结果相一致, 当敲降gC1qR基因表达后, 补体C3样基因(alpha-2-macroglobulin和TEP)的表达显著上调[29]。
吞噬作用作为免疫细胞的第一道防线, 具有识别、吞噬和清除外源异物或自身凋亡细胞的作用[43]。先前的研究表明, C1qDCs可以作为调理素促进后生动物的吞噬作用[12, 32, 44]。本研究中, 敲降毛蚶SsC1qDC基因的表达后, 副溶血弧菌刺激后血细胞的吞噬率显著下降, 提示SsC1qDC可能参与调节毛蚶血细胞的吞噬作用。这与马氏珠母贝中敲降Pf-ghC1q基因表达能明显降低血细胞吞噬作用的结果一致[23]。同时, 已有文献报道双壳类的C1qDC蛋白可参与病原的识别, 从而直接增强其血细胞的吞噬作用[12, 17, 22]。
在软体动物的免疫反应中, 细胞凋亡通过应激信号或吞噬作用清除受损、衰老和受感染的细胞, 并引发凋亡细胞死亡[45]。本研究中, 敲降SsC1qDC基因表达可显著提升毛蚶血细胞的凋亡水平, 从而导致血细胞总数和吞噬活力的显著降低。此外, 当外界胁迫超过动物的耐受极限后, 随着胁迫的持续, 胁迫损伤变得不可修复, 最终导致动物死亡[46]。本研究发现, 敲降SsC1qDC表达, 副溶血弧菌刺激后毛蚶的死亡率显著高于对照组, 表明SsC1qDC在毛蚶抗弧菌感染中具有关键作用。
在三疣梭子蟹中的研究中发现, PtgC1qR可在蛋白和转录水平上抑制其酚氧化酶原激活系统[29]。在本研究中, 敲降SsC1qDC基因显著增强了PAF3的表达, 提示SsC1qDC基因可能通过酚氧化酶原激活系统参与毛蚶的体液免疫。有关毛蚶SsC1qDCs与下游调控基因及效应分子之间的调控关系有待于进一步研究。
4 结论综上, 本研究克隆获得了毛蚶SsC1qDC基因的cDNA全长序列, 并分析了该基因在响应主要病原感染后的功能特征。SsC1qDC的表达量从毛蚶卵细胞到眼点幼虫期随发育阶段显著增加, 该基因在成体毛蚶各组织广泛表达且可被副溶血弧菌诱导高表达。敲降SsC1qDC基因表达后, 母源免疫相关基因的表达受到显著影响。此外, 与对照组相比, 副溶血弧菌攻毒后SsC1qDC基因干扰实验组的毛蚶死亡率和血细胞凋亡水平显著升高, 因此导致其血细胞总数和吞噬活力显著降低。结果表明, SsC1qDC基因可能参与了毛蚶抗弧菌感染免疫防御反应。
| [1] |
KISHORE U, REID K B M. C1q: structure, function, and receptors[J]. Immunopharmacology, 2000, 49(1/2): 159-170. |
| [2] |
GABORIAUD C, THIELENS N M, GREGORY L A, et al. Structure and activation of the C1 complex of complement: unraveling the puzzle[J]. Trends in Immunology, 2004, 25(7): 368-373. DOI:10.1016/j.it.2004.04.008 |
| [3] |
GHAI R, WATERS P, ROUMENINA L T, et al. C1q and its growing family[J]. Immunobiology, 2007, 212(4-5): 253-266. DOI:10.1016/j.imbio.2006.11.001 |
| [4] |
CARLAND T M, GERWICK L. The C1q domain containing proteins: Where do they come from and what do they do?[J]. Developmental & Comparative Immunology, 2010, 34(8): 785-790. |
| [5] |
KISHORE U, GHAI R, GREENHOUGH T J, et al. Structural and functional anatomy of the globular domain of complement protein C1q[J]. Immunology Letters, 2004, 95(2): 113-128. DOI:10.1016/j.imlet.2004.06.015 |
| [6] |
ADZIGBLI L, HAO R, JIAO Y, et al. Immune response of pearl oysters to stress and diseases[J]. Reviews in Aquaculture, 2020, 12(2): 513-523. DOI:10.1111/raq.12329 |
| [7] |
ZHU L, GAO Y Y, YUAN G L, et al. Identification and immune functional analysis of a novel C1q domain-containing protein in Yellow River Carp (Cyprinus carpio L.)[J]. Aquaculture, 2020, 534: 736313. |
| [8] |
HU Y L, PAN X M, XIANG L X, et al. Characterization of C1q in teleosts: insight into the molecular and functional evolution of C1q family and classical pathway[J]. The Journal of Biological Chemistry, 2010, 285(37): 28777-28786. DOI:10.1074/jbc.M110.131318 |
| [9] |
GAO Z, LI M Y, MA J, et al. An amphioxus gC1q protein binds human IgG and initiates the classical pathway: implications for a C1q-mediated complement system in the basal chordate[J]. European Journal of Immunology, 2014, 44(12): 3680-3695. DOI:10.1002/eji.201444734 |
| [10] |
MATSUSHITA M, MATSUSHITA A, ENDO Y, et al. Origin of the classical complement pathway: lamprey orthologue of mammalian C1q acts as a lectin[J]. Proceedings of the National Academy of Sciences, 2004, 101(27): 10127-10131. DOI:10.1073/pnas.0402180101 |
| [11] |
WANG L L, WANG L L, ZHANG H, et al. A C1q domain containing protein from scallop Chlamys farreri serving as pattern recognition receptor with heat-aggregated IgG binding activity[J]. PLoS One, 2012, 7(8): e43289. DOI:10.1371/journal.pone.0043289 |
| [12] |
LV Z, WANG L L, JIA Z H, et al. Hemolymph C1qDC promotes the phagocytosis of oyster Crassostrea gigas hemocytes by interacting with the membrane receptor β-integrin[J]. Developmental & Comparative Immunology, 2019, 98: 42-53. |
| [13] |
LIANG X R, XIONG X W, CAO Y F, et al. Globular C1q domain-containing protein from Pinctada fucata martensii participates in the immune defense process[J]. Fish & Shellfish Immunology, 2022, 123: 521-527. |
| [14] |
BOHLSON S S, RASER D A, TENNER A J. Complement proteins C1q and MBL are pattern recognition molecules that signal immediate and long-term protective immune functions[J]. Molecular Immunology, 2007, 44(1-3): 33-43. DOI:10.1016/j.molimm.2006.06.021 |
| [15] |
JIANG S, Li H, ZHANG D X, et al. A C1q domain containing protein from Crassostrea gigas serves as pattern recognition receptor and opsonin with high binding affinity to LPS[J]. Fish & Shellfish Immunology, 2015, 45(2): 583-591. |
| [16] |
TAHTOUH M, CROP F, VIZIOLI J, et al. Evidence for a novel chemotactic C1q domain-containing factor in the leech nerve cord[J]. Molecular Immunology, 2009, 46: 523-531. DOI:10.1016/j.molimm.2008.07.026 |
| [17] |
LI D, WAN Z, LI X J, et al. Alternatively spliced down syndrome cell adhesion molecμLe (Dscam) controls innate immunity in crab[J]. Journal of Biological Chemistry, 2019, 294(44): 16440-16450. DOI:10.1074/jbc.RA119.010247 |
| [18] |
MORISS K M, ADEN D P, KNOELES B B, et al. Complement biosynthesis by the human hepatoma-derived cell line HepG2[J]. The Journal of clinical investigation, 1982, 70(4): 906-913. DOI:10.1172/JCI110687 |
| [19] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [20] |
SCHUTTE B, NUYDENS R, GEERTS H, et al. Annexin V binding assay as a tool to measure apoptosis in differentiated neuronal cells[J]. Journal of Neuroscience Methods, 1998, 86(1): 63-69. DOI:10.1016/S0165-0270(98)00147-2 |
| [21] |
DELAPORTE M, SOUDANT P, MOAL J, et al. Effect of a mono-specific algal diet on immune functions in two bivalve species-Crassostrea gigas and Ruditapes philippinarum[J]. The Journal of Experimental Biology, 2003, 206(17): 3053-3064. DOI:10.1242/jeb.00518 |
| [22] |
JIANG S, LI H, ZHANG D, et al. A C1q domain containing protein from Crassostrea gigas serves as pattern recognition receptor and opsonin with high binding affinity to LPS[J]. Fish & Shellfish Immunology, 2015, 45(2): 583-591. |
| [23] |
WANG J, THAIMUANGPHOL W, CHEN Z, et al. A C1q domain-containing protein in Pinctada fucata contributes to the innate immune response and elimination of the pathogen[J]. Fish & Shellfish Immunology, 2022, 131: 582-589. |
| [24] |
GERDOL M, MANFRIN C, DE MORO G, et al. The C1q domain containing proteins of the Mediterranean mussel Mytilus galloprovincialis: a widespread and diverse family of immune-related molecules[J]. Developmental and Comparative Immunology, 2011, 35(6): 635-643. DOI:10.1016/j.dci.2011.01.018 |
| [25] |
GERDOL M, GRECO S, PALLAVICINI A. Extensive tandem duplication events drive the expansion of the C1q-domain-containing gene family in bivalves[J]. Marine Drugs, 2019, 17(10): 583. DOI:10.3390/md17100583 |
| [26] |
GERDOL M, VENIER P, PALLAVICINI A. The genome of the Pacific oyster Crassostrea gigas brings new insights on the massive expansion of the C1q gene family in bivalvia[J]. Developmental & Comparative Immunology, 2015, 49(1): 59-71. |
| [27] |
NING J H, LIU Y, GAO F T, et al. 2019. Characterization and functional analysis of a novel gC1qR in the swimming crab Portunus tritubercμLatus[J]. Fish & Shellfish Immunology, 2019, 84: 970-978. |
| [28] |
NING J H, LIU Y, CUI Z X. Identification and functional analysis of a thioester-containing protein from Portunus trituberculatus reveals its involvement in the prophenoloxidase system, phagocytosis and AMP synthesis[J]. Aquaculture, 2019, 510: 9-21. DOI:10.1016/j.aquaculture.2019.05.025 |
| [29] |
宁军号. 三疣梭子蟹补体样分子结构及免疫功能研究[D]. 青岛: 中国科学院海洋研究所, 2019. NING Junhao. Study on complement-like molecular structure and immune function of Portunus trituberculatus[D]. Qingdao: Institute of Oceanography, Chinese Academy of Sciences, 2019. |
| [30] |
TADROS W, LIPSHITZ H D. The maternal-to-zygotic transition: a play in two acts[J]. Development, 2009, 136: 3033-3042. DOI:10.1242/dev.033183 |
| [31] |
WALSER C B, LIPSHITZ H D. Transcript clearance during the maternal-to-zygotic transition[J]. Current Opinion in Genetics and Development, 2011, 21(4): 431-443. DOI:10.1016/j.gde.2011.03.003 |
| [32] |
WANG Z L, WANG B, CHEN G et al. An alpha-2 macroglobμLin in the pearl oyster Pinctada fucata: characterization and function in hemocyte phagocytosis of Vibrio alginolyticus[J]. Fish & Shellfish Immunology, 2016, 55: 585-594. DOI:10.11964/jfc.20150709965 |
| [33] |
ZHU L, GAO Y, YUAN G et al. Identification and immune functional Analysis of an novel C1q domain-containing protein in Yellow River carp (Cyprinus carpio L.)[J]. Aquaculture, 2021, 534: 736313. DOI:10.1016/j.aquaculture.2020.736313 |
| [34] |
DU X, WANG G H, YUE B, et al. A novel C1q domain containing protein in black rockfish (Sebastes schlegelii) serves as a pattern recognition receptor with immunoregulatory properties and possesses binding activity to heat-aggregated IgG[J]. Fish & Shellfish Immunology, 2019, 87: 73-81. |
| [35] |
PERRIMON N, MCMAHON A P. Negative feedback mechanisms and their roles during pattern formation[J]. Cell, 1999, 97(1): 13-16. DOI:10.1016/S0092-8674(00)80710-2 |
| [36] |
SANCHEZ-MARTIN A, SANCHON-SANCHEZ P, ROMERO M R, et al. Impact of tumor suppressor genes inactivation on the multidrug resistance phenotype of hepatocellular carcinoma cells[J]. Biomedicine & Pharmacotherapy, 2023, 165: 115209. |
| [37] |
WERONIKA R, PAULINA N, BEATA T, et al. Immunological memory cells[J]. Central-European Journal of Immunology, 2018, 43(2): 194-203. DOI:10.5114/ceji.2018.77390 |
| [38] |
ENDO Y, TAKAHASHI M, FUJITA T. Lectin complement system and pattern recognition[J]. Immunobiology, 2006, 211(4): 283-293. DOI:10.1016/j.imbio.2006.01.003 |
| [39] |
LIEBERMAN J, SONG E, LEE S, et al. Interfering with disease: opportunities and roadblocks to harnesssing RNA interference[J]. Trends in Molecular Medicine, 2003, 9(9): 397-403. DOI:10.1016/S1471-4914(03)00143-6 |
| [40] |
CASTANOTTO D, ROSSI J J. The promises and pitfalls of RNA-interference-based therapeutics[J]. Nature, 2009, 457(7228): 426-433. |
| [41] |
MATSUMOTO T, YAMANO K, KITAMURA M, et al. Ovarian follicle cells are the site of vitellogenin synthesis in the Pacific abalone Haliotis discus hannai[J]. Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology, 2008, 149(3): 293-298. |
| [42] |
WANG Z P, ZHANG S C, TONG Z, et al. Maternal transfer and protective role of the alternative complement components in zebrafish Danio rerio[J]. PLoS One, 2009, 4(2): e4498. |
| [43] |
STUART L M, EZEKOWITZ R A. Phagocytosis and comparative innate immunity: learning on the fly[J]. Nature Reviews Immunology, 2008, 8(2): 131-141. |
| [44] |
NEPOMUCENO R R, HENSCHEN-EDMAN A H, BURGESS W H, et al. cDNA cloning and primary structure analysis of C1qRP, the human C1q/MBL/SPA receptor that mediates enhanced phagocytosis in vitro[J]. Immunity, 1997, 6(2): 119-129. |
| [45] |
TERAHARA K, TAKAHASHI K G. Mechanisms and immunological roles of apoptosis in molluscs[J]. Current Pharmaceutical Design, 2008, 14(2): 131-137. |
| [46] |
YANG C Y, GAO Q, LIU C, et al. The transcriptional response of the Pacific oyster Crassostrea gigas against acute heat stress[J]. Fish & Shellfish Immunology, 2017, 68: 132-143. |
 2023, Vol. 47
2023, Vol. 47


