
文章信息
- 吴燕玲, 孙飞, 蔡皓玮, 李鑫, 刘鹰, 刘松涛, 马贺. 2023.
- WU Yan-ling, SUN Fei, CAI Hao-wei, LI Xin, LIU Ying, LIU Song-tao, MA He. 2023.
- LED光谱对许氏平鲉视网膜形态的影响
- Effect of the LED spectrum on retinal morphology of Sebastes schlegelii
- 海洋科学, 47(9): 71-80
- Marine Sciences, 47(9): 71-80.
- http://dx.doi.org/10.11759/hykx20221124002
-
文章历史
- 收稿日期:2022-11-24
- 修回日期:2023-04-15
2. 大连海洋大学海洋科技与环境学院, 辽宁 大连 116023;
3. 浙江大学生物系统工程与食品科学学院, 浙江 杭州 310058
2. College of Marine Technology and Environment, Dalian Ocean University, Dalian 116023, China;
3. College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China
光照作为重要的环境因子之一, 其3要素(光谱、光强、光周期)均对鱼类的存活、摄食、生长及视觉均产重要影响[1]。光谱作为光照3要素之一, 其对鱼类的影响因光谱成分而异, 并具有种属特异性[2-4]。
大部分鱼类通过视觉进行捕食与躲避天敌, 视觉系统是鱼类重要的感光系统之一, 在鱼类生长发育过程中起着重要作用。视网膜作为视觉系统中的重要组成部分, 其上的光感受器能够区分不同类型的光谱成分, 并对光环境变化产生适应性响应。如欧洲舌齿鲈(Dicentrarchus labrax)、大西洋鳕(Gadus morhua)和大西洋鲑(Salmo salar)等在持续光照条件下, 其视网膜感光层变薄[5-6]; 蓝宝丽鱼(Aequidens pulcher)在不同光谱下饲养1~2 a后, 视网膜内层和视顶盖受光谱成分的影响, 主要表现为在近单色光条件下视觉色素的吸收特性未发生改变, 而在蓝光条件下中长波敏感的视锥细胞外节长度显著增加[7]。在对大菱鲆(Scophthalmus maximus)的视觉结构研究中发现, 不同光谱条件下大菱鲆视网膜中感光细胞的变化速率产生了较大差异[8]。还有研究发现, 蓝光对大菱鲆仔鱼的视觉发育具有促进作用, 而红光对其发育有延迟作用[9]。综上所述, 鱼类主要通过视觉系统感光, 由于光谱敏感性存在差异, 视网膜结构对光谱环境的适应性变化也存在种属特异性, 因此需根据特定物种开展相应研究, 揭示其视觉系统中视网膜对不同光谱环境响应规律。
许氏平鲉(Sebastods schlegelii)属鲉形目(Scorpaeniformes)平鲉科(Sebastidae)平鲉属(Seriola), 冷温性底层岩礁肉食性鱼类, 卵胎生, 洄游范围小, 食性凶猛, 属于游泳动物食性类型, 主要分布于中国、朝鲜半岛、日本、鄂霍次克海南部地区, 以小鱼、甲壳类、头足类等为食, 是中国北方沿海重要鱼类养殖物种之一[10]。随着工厂化人工养殖技术的发展, 发光二极管 (Light Emitting Diode, LED)光源逐步应用于室内养殖, 因为有关人工光源对鱼类视觉及其他生理方面的影响逐渐受到关注。基于不同光谱对鱼类影响具有物种特异性, 需要在针对不同鱼种开展深入研究后, 才能解析其影响规律, 而有关光谱对许氏平鲉幼鱼视网膜的影响未见报道。本文通过研究不同光谱对许氏平鲉视网膜的影响, 以期揭示许氏平鲉幼鱼在不同光谱环境下其视网膜的适应变化规律, 丰富环境生态学理论, 同时为人工养殖许氏平鲉的光环境调控参数提供一定理论参考。
1 材料和方法 1.1 实验材料实验用鱼源于河北天正实业有限公司, 实验开始前将1 200尾幼鱼(体质量为38.80±0.43 g、体长为10.20± 0.17 cm)运至大连海洋大学设施渔业教育部重点实验室, 并暂养于灰白色PVC养殖桶(直径: 0.8 m, 桶内壁高: 0.6 m, 水体积: 250 L)中, 暂养周期为7 d, 使其适应新环境。暂养期间每日08: 30和16: 30各投喂1次商业饲料, 7 d后选取1 000尾健康体格匀称的许氏平鲉幼鱼进行实验。
1.2 实验方法所有实验开展均在大连海洋大学设施渔业教育部重点实验室进行。实验系统所用光源为LED 光源(型号: GK5A), 设置于离水面高度1 m处。实验共设置4种光谱处理组和1组对照组, 分别是蓝光(λ450 nm)、绿光(λ525 nm)、黄光(λ590 nm)、红光(λ 630 nm)处理组及白光(λ460 nm)对照组。试验期间, 为避免自然光的干扰及不同处理组间的相互干扰, 不同处理组间均采用遮光布进行遮挡。每个处理组设置4个重复, 即每个处理组放置4个养殖桶, 每个养殖桶里放置50尾鱼。光照强度统一设定为250 mW/m2, 光周期设定为12L: 12D(光照时间: 7: 30—19: 30), 实验周期为60 d。实验期间饲料投喂量按照桶内鱼总体质量的2%进行计算, 每周根据鱼的体质量进行校准, 每次投喂前均使用电子天平进行饲料称量。为了保证水质清洁, 在每次投喂30 min后, 对桶底残饵粪便进行清理。实验期间采用流水养殖, 保持水温为19~23 ℃, 溶氧>6 mg/L。
1.3 样品采集实验结束时, 每组随机抽取5尾鱼用于组织切片及观察, 首先使用麻醉剂(MS-222, 200 mg/L)对实验鱼进行麻醉, 随后将其放置冰盘上尽快解剖, 并快速收集许氏平鲉的眼球及相关组织, 将其置于4%多聚甲醛固定液中进行固定24~48 h后, 转移到70%的乙醇中进行下一步处理。在一系列梯度乙醇(70%~ 100%)中脱水, 并用二甲苯清除, 最后包埋于石蜡中, 用于组织切片, 切片厚度为4 µm, 随后将组织切片安装在载玻片上, 并用苏木精和曙红染色, 随后在Leica DM4000 B LED荧光显微镜下进行组织切片观察, 并拍照保存。
视网膜的观测通过图像分析软件LAS进行, 主要观测与测量指标有视网膜的结构完整性, 视网膜色素上皮层(the retinal pigment epithelium layer, RPE)、感光层(the photoreceptor layer, PRO)、外核层(the outer nuclear layer, ONL)、外网层(the outer plexiform layer, OPL)、内核层(the inner nuclear layer, INL)、内网层(the inner plexiform layer, IPL)、神经节细胞层(the ganglion cell layer, GCL)、神经纤维层(the nerve fibre layer, NFL)的厚度与内核层、外核层、内网层和外核层的细胞数量。每个光谱处理组选取3尾鱼的眼部组织切片用于观察与计算。在视网膜切片中, 统计单位长度100 µm内的细胞数量, 并选择5个不同区域分别进行计数, 计算平均值, 并计算出视网膜外核层细胞数量与内核层细胞数量之比、外核层与神经节细胞层数量之比以及内核层与神经节细胞层数量之比(INL/GCL), 记录数据并制表, 其单位为个/100 µm; 运用ImageJ软件对许氏平鲉组织切片图像进行各层厚度测量, 在每一张切片观察与测量时注意选取与上一张切片尽可能相同位置, 每张切片均对各层厚度分别测量3次后计算平均值。
1.4 数据统计分析所有数据采用平均值±标准差(X±SD)表示; 运用SPSS-PASW软件对许氏平鲉视网膜细胞数量以及视网膜厚度进行单因素方差分析, 并利用 Duncan 多重比较分析不同处理组之间的差异, 以0.05作为差异显著水平, 并对不同光谱波长与视网膜细胞数量与厚度之间进行相关性分析, 其中相关系数的绝对值进行相关性强弱的判断: 相关系数绝对值介于0.8~1.0之间为极强相关, 介于0.6~0.8之间为强相关, 介于0.4~0.6之间为中等程度相关, 介于0.2~0.4之间为弱相关, 介于0.0~0.2极弱相关或不相关。相关系数的为正数代表正相关, 负数为负相关。
2 结果与分析 2.1 视网膜结构不同光谱处理组下许氏平鲉的视网膜切片如图1所示, 经光学显微镜观察, 发现5种光谱处理组下许氏平鲉视网膜结构主要包括10层, 分别为色素上皮层、光感受器层、外界膜、外核层、外网层、内核层、内网层、神经节细胞层、神经纤维层以及内界膜。通过对各组切片分析可知许氏平鲉幼鱼具有脊椎动物视网膜的所有结构, 在不同光谱下的视网膜各层结构均比较完整。不同光谱处理组中视网膜各层分化显著, 视网膜最外层主要为由色素上皮细胞构成的色素上皮层, 其中蓝光与红光处理组色素上皮层染色较深, 色素颗粒多呈细长状; 许氏平鲉视网膜经HE染色后外核层较为清晰, 外核层一般由视锥细胞与视杆细胞的细胞核组成, 细胞形态多呈细长状, 其中白光、黄光处理组下外核层着色较深; 内核层中所包含细胞类型较其他层复杂, 主要包含水平细胞、无长突细胞及双极细胞等。内核层最外侧为水平细胞胞体, 呈细长形, 双极细胞呈椭圆形, 在白光与红光处理组中内核层着色较浅, 细胞数量较少, 缝隙较大; 神经节细胞层主要由神经节细胞构成, 其中绿光下神经节细胞层细胞数量较多, 而红光下的细胞数量最少。
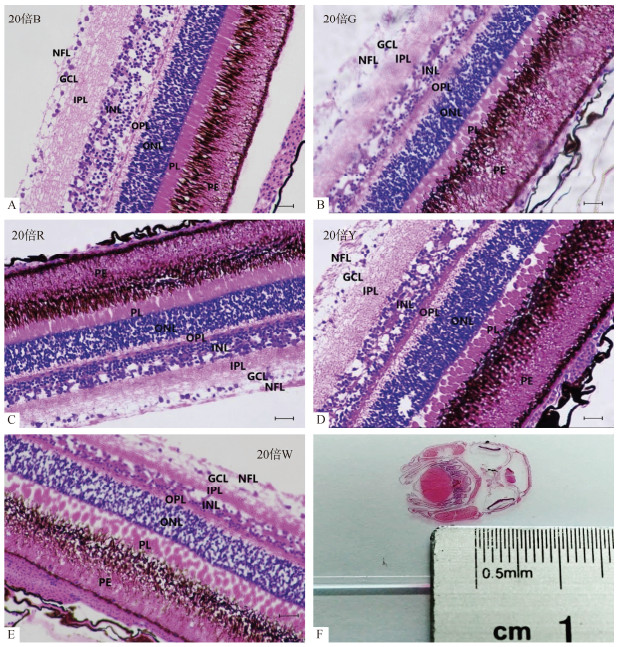 |
| 图 1 不同光谱下许氏平鲉视网膜及头部组织学切片 Fig. 1 Histological sections of the retina and head of Sebastes schlegelii under the different light spectra 注: A. 蓝光组; B.绿光组; C.红光组; D.黄光组;E.白光组; F.头部整体切片; PE.色素上皮层; PL.感光层; ONL.外核层; OPL.外网层; INL.内核层; IPL.内网层; GCL.神经节细胞层; NFL.神经纤维层; 比例尺=100 µm |
如图2可知, 在5种光谱处理组下均是色素上皮层厚度占总厚度比例最大, 神经节纤维层和神经节细胞层厚度占总厚度比例最小。蓝光下的内核层和内网层厚度占比总是高于其他处理组, 分别为17%和19%。在5种处理组下, 绿光组的内核层厚度占比13%, 与其他处理组相比所占比例最小, 黄光条件下外核层厚度占总厚度之比13%低于其他各组。蓝光组下, 色素上皮层厚度占比与其他处理组相比最低, 为28%。
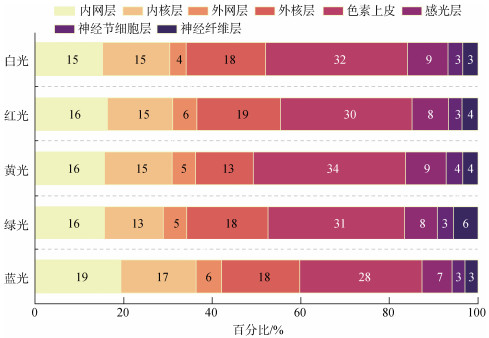 |
| 图 2 不同光谱下视网膜不同层厚度占比 Fig. 2 The ratio of the total thickness of different layers under different light spectrum |
对5种LED光谱下许氏平鲉的内网层、内核层、外网层、外核层细胞数量统计如表1所示。其中蓝光处理组下的视网膜中内网层的细胞数量最低(24.33±2.08), 并显著低于白光组、红光以及黄光处理组(P<0.05), 而与其他各组均无显著性差异(P>0.05)。就内核层而言, 黄光、绿光和蓝光组的细胞数量显著高于白光与红光组的细胞数量(P<0.05)。外网层上蓝光组在5种处理组中最低, 并显著低于白光组(P< 0.05), 而与绿光和黄光组无显著性差异(P>0.05)。在外核层上, 红光处理组细胞数量最少(30.33±3.51), 显著低于除白光组外的其他各组(P<0.05), 细胞数量最多的为黄光处理组(51.67±10.70)且显著高于红光和白光处理组(P<0.05)。
| 项目 | 光谱 | ||||
| 蓝光 | 绿光 | 黄光 | 红光 | 白光 | |
| 内网层 | 24.33±2.08d | 27.33±4.51cd | 31.67±2.08bc | 33.00±2.00ab | 37.67±2.08a |
| 内核层 | 36.33±5.86a | 35.33±6.66a | 37.33±7.51a | 25.00±3.00b | 22.00±3.61b |
| 外网层 | 8.00±1.00b | 13.00±3.61ab | 12.00±4.00ab | 9.33±1.53b | 15.00±1.73a |
| 外核层 | 43.00±1.73ab | 44.33±1.53ab | 51.67±10.70a | 30.33±3.51c | 35.00±1.00bc |
| 注: 同一行中标有不同字母的处理组之间差异显著(P<0.05) | |||||
不同光谱与许氏平鲉视网膜细胞数量的相关性分析如图3所示。就内网层而言, 内网层与外网层的细胞数量与光谱之间均呈正相关, 即随着光谱波段在430~650 nm范围内增加, 内网层与外网层的细胞数量也随之增加; 其中内网层细胞数量与光谱波长之间呈极强正相关(0.81, P>0.5), 而外网层细胞数量与光谱之间的则为极弱正向相关(0.11, P<0.5)。内核层与外核层的细胞数量与光谱波长之间呈负相关关系, 即随着光谱波段在430~650 nm范围内不断增加, 其细胞数量随之减少, 其中内网层细胞数量与光谱波长的相关性为中等负相关(–0.51, P>0.5), 外核层细胞数量与光谱波长呈现较弱负相关(–0.38, P<0.5)。
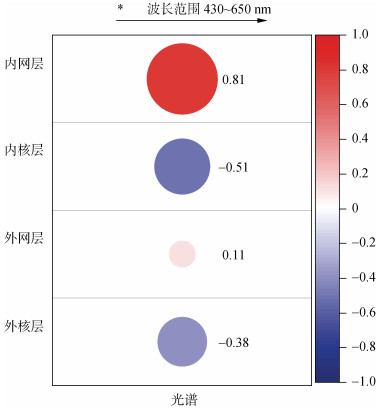 |
| 图 3 光谱与视网膜中各层细胞数量相关性分析 Fig. 3 Correlation analysis between the spectrum and the number of cells in each layer of retina |
不同光色处理组下的许氏平鲉内核层、外核层与神经节细胞层等3层细胞数目之间的比值(外核层/内核层、外核层/神经节细胞层和内核层/神经节细胞层)如图4所示。5种光谱处理组下, 就外核层/内核层的比值而言, 蓝光与绿光组差异显著 (P<0.05), 而与黄光、红光、白光组差异不显著(P>0.05)。在外核层/神经节细胞层比值中可发现各处理组间无显著性差异(P>0.05)。5种光谱处理组下的内核层/神经节细胞层的比值中, 蓝光处理组显著高于绿光和红光处理组(P<0.05), 而与其他各组无显著性差异(P>0.05)。
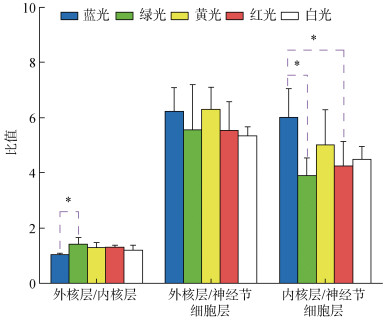 |
| 图 4 不同光谱下视网膜中不同层细胞数量之比 Fig. 4 Ratio of the number of cells in the retinal layers under the different light spectra 注: “*”. 两处理间差异显著(P<0.05) |
视网膜色素上皮层、感光层、外核层、外网层、内核层、内网层、神经节细胞层、神经纤维层厚度如表2所示。在蓝光处理组下内网层厚度为23.00± 2.15 μm, 显著高于其他各组(P<0.05), 内网层厚度在黄光组与红光组之间差异显著(P<0.05), 厚度分别为18.33±2.84 μm和13.83±1.71 μm, 与白光组(15.83±0.84 μm)和绿光组(17.1±1.50 μm)之间无显著性差异(P>0.05)。就内核层而言, 蓝光组内核层厚度(20.20±0.26 μm)显著高于绿光组(14.43±2.51 μm)、黄光组(16.37±1.39 μm)、红光组(13.53±1.60 μm)以及白光组(15.60±2.00 μm)(P<0.05), 而其他各组间无显著性差异(P>0.05)。在蓝光与黄光条件下, 视网膜外核层厚度分别为21.00±1.32 μm与20.97±2.35 μm, 显著高于红光组(17.67±1.29 μm)(P<0.05), 而与其他各组无显著性差异(P>0.05)。外网层、上皮层、感光层、神经节细胞层、神经纤维层厚度在5种不同光谱下无显著性差异(P>0.05)。
| 项目 | 光谱 | ||||
| 蓝光 | 绿光 | 黄光 | 红光 | 白光 | |
| 内网层 | 23.00±2.15a | 17.1±.1.50bc | 18.33±2.84b | 13.83±1.71c | 15.83±0.84bc |
| 内核层 | 20.20±0.26a | 14.43±2.51b | 16.37±1.39b | 13.53±1.60b | 15.60±2.00b |
| 外网层 | 6.77±1.07 | 5.77±1.33 | 6.23±3.02 | 4.57±0.47 | 3.77±0.91 |
| 外核层 | 21.00±1.32a | 19.93±0.29ab | 20.97±2.35a | 17.67±1.29b | 18.50±1.13ab |
| 色素上皮 | 32.73±3.91 | 33.43±4.97 | 33.27±6.18 | 30.27±2.40 | 33.00±1.91 |
| 感光层 | 8.07±0.46 | 8.23±0.35 | 9.20±2.12 | 8.13±1.19 | 9.50±0.30 |
| 神经节细胞层 | 3.43±0.68 | 3.83±1.31 | 3.37±0.67 | 3.23±0.42 | 3.47±0.23 |
| 神经纤维层 | 3.47±0.15 | 6.10±2.66 | 4.03±2.74 | 3.10±0.79 | 3.47±0.21 |
| 注: 同一行中标有不同字母的处理组之间差异显著(P<0.05) | |||||
不同光谱下与许氏平鲉视网膜中各层厚度如图5所示。内网层、内核层、外网层、外核层、上皮层等各层厚度与光谱波长之间均呈负相关, 即随着光谱波长在430~650 nm范围内增加时, 视网膜中所测各层的厚度随之减少。外核层与光谱波长之间呈中等程度负相关, 相关系数为–0.54, 外网层、内核层厚度与光谱波长之间的呈现强性负相关, 相关系数分别为–0.61、–0.64。而内网层光谱波长之间呈现极强负相关, 相关系数为–0.82, 而色素上皮层、感光层、神经节细胞层及神经纤维层厚度与光谱间的负相关性较弱, 数值分别为–0.13、–0.18、–0.15、–0.23。
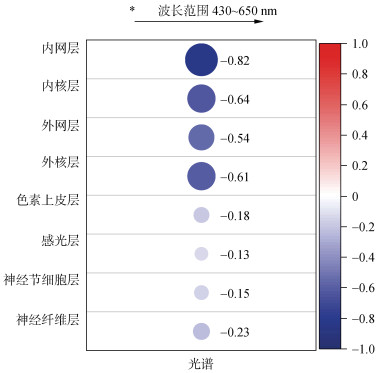 |
| 图 5 光谱与视网膜中各层厚度相关性分析 Fig. 5 Correlation analysis between the spectrum and thickness of each retinal layer |
视觉器官如眼球在鱼类的摄食、集群、繁殖等众多活动中起着至关重要的作用, 而视网膜作为眼球的主要结构之一, 是鱼类形成视觉的生理基础, 其结构特点的变化是反映鱼类是否受到所处环境影响的重要依据。硬骨鱼类视网膜具备脊椎动物视网膜的典型结构, 研究表明鲫鱼(Carassius auratus)和斑马鱼(Barchydanio rerio var)两种鱼类视网膜在组织学上从内到外大致分为10层[11], 同样在对褐菖鲉(Sebastiscus marmoratus)[12]视网膜中也发现, 其视网膜结构分为10层, 分别是内界膜、神经纤维层、神经节细胞层、内网层、内核层、外网层、外核层、外界膜、视锥视杆层以及色素上皮层。在本研究中, 不同光色环境下许氏平鲉幼鱼视网膜组织结构未发生变化, 除未发现可明显分辨的内界膜和外界膜外, 各处理组下的许氏平鲉的视网膜均含有其余8层组织结构。牛亚兵[13]在对玫瑰高原鳅(Triplophysa rosa)和贝氏高原鳅(Triplophysa bleekeri)视网膜形态结构研究中也发现其视网膜具有同样的10层结构。上述表明光谱未对许氏平鲉视网膜结构产生影响, 即不同光环境下, 视网膜结构未发生适应性变化, 鱼类视网膜结构主要受遗传因素影响较大, 而光环境因子对其视网膜总体结构的影响不大。
3.2 不同光谱对许氏平鲉幼鱼视网膜各层细胞数量的影响鱼类视觉系统的光敏度与视网膜中各层细胞的组成及功能直接相关。其中外核层由视细胞组成, 负责向下游传递视觉信号, 而内核层中细胞种类较多, 在视网膜发育过程中起层间支撑、保护及营养物质提供等作用, 此外, 外网层是视细胞和内核层细胞形成突触联系的一层, 内核层细胞体形成突触结构后内网层与外网层与视细胞相联系并传递信号[12]。在本研究中, 红光处理组下的内核层、外核层细胞数量最低, 且显著低于黄光、绿光、蓝光处理组。鱼类在适应生存环境中, 其视网膜细胞数量及视网膜厚度形成了较大差异, 生存环境为明亮环境的鱼类视觉系统发达, 内核层细胞数量较多, 且分化明显, 相反对于许氏平鲉这种底层弱光环境鱼类, 内核层细胞数量少, 分化不明显。有研究发现半滑舌鳎(Cynoglossussemilaevis Gunther)早期视网膜上的细胞数量变化与其生长阶段所处的环境具有较强关联, 即从水表层过渡到水底层(对应光谱环境由长波长占主导转变为短波长占主导)时, 其外核层细胞与内核层细胞数量也逐渐增加, 当然这一过程可能还需要考虑光照强度的变化[14]。同时在对香鱼(Plecoglossus altivelis)、真鲷(Pagrosomus major)、鳜鱼(Siniperca chuatsi)、乌鳢(Channaargus)等多种鱼类生活习性的研究中也发现了同样的视觉变化特点, 由此可见许氏平鲉幼鱼阶段的内核层、外核层细胞数量与光谱波长呈负相关性的特点和上述鱼类相一致, 视网膜中外核层与内核层的数量与其生活环境息息相关, 内核层与外核层主要功能为营养物质供给、保护及向下游传递视觉信号。因此不同光环境条件下视网膜各层细胞数量发生变化可能是对生存环境的一种适应性变化, 不同光谱会促使其内核层及外核层的细胞数量发生改变。此外, 有研究发现多数鱼类视觉系统中无眼睑结构, 不能通过调节瞳孔来控制入射光[15]。因此, 本实验中红光环境下幼鱼内核层、外核层细胞数量较低可能是因为长波长光谱作为不适光环境对其视网膜细胞产生不利影响, 并在细胞数目上有所体现, 然而关于红光对其产生的不利影响机制尚需进一步研究。
在对大菱鲆的视网膜研究中发现[9], 大菱鲆在蓝光下外核层与神经节细胞数量变化最快, 绿光下视网膜外核层与神经节细胞层发育异常, 细胞数量最少, 且大菱鲆死亡率最高, 这可能是由于物种特异性导致, 大菱鲆对绿光较为敏感。研究表明蓝宝丽鱼(Aequidens pulcher)处于蓝光谱条件下1~2 a后, 其视网膜中长波敏感的视锥细胞外节长度显著增加[7]; 在关于光照对金鱼(Carassius auratus)的影响研究发现蓝光会对视网膜造成损伤, 该光照条件下其视网膜中大量的视细胞由于细胞凋亡基因胱天冬酶-3(caspase-3)表达上调而发生凋亡[16]。在对人体视网膜研究也同样发现蓝光可作为一种应激源, 长时间照射可导致色素上皮细胞发生氧化损伤而凋亡[17]。在本研究中许氏平鲉在蓝光下视网膜细胞数量较少, 现蓝光下的IPL细胞数量与其他光照条件相比最低, 与上述研究结果相似, 但不同光谱是否对许氏平鲉幼鱼阶段的视网膜细胞产生损伤还需要进一步的实验进行验证。
3.3 不同光谱对许氏平鲉幼鱼视网膜厚度的影响视网膜位于眼球壁的最内层, 是鱼类形成视觉的生理基础。视网膜各层在各层细胞的作用下相互联系且可将光信号转换为电信号最终传入视觉神经中枢, 视网膜各层的厚度与细胞数量共同影响鱼类的光敏感性与视觉精确度, 在视网膜各层的结构特点上, 有研究发现内网状层的厚度与内核层的厚度大致相等, 并认为其反映了神经纤维相互作用的复杂程度[18]。许氏平鲉的视网膜内网状层的厚度与内核层大致相等, 但黄光组以及绿光组略高于其他各组, 内网状层是内核层各类神经元的神经纤维与神经节细胞树突相互连接构成的区域, 因此我们推测在黄光与绿光下许氏平鲉神经细胞间相互作用可能更为复杂。
一项对四指马鲅(Eleutheronema tetradactylum)视网膜组织学的研究表明, 其视网膜神经节细胞层与内核层厚度及各自占视网膜总厚度比例随着四指马鲅的活动与摄食从水域中上层转为水域中下层的转变(对应光谱环境由长波长占主导转变为短波长占主导)而逐渐减小, 而外核层厚度则呈现出先减少后增加的不规则变化趋势[19]。而在本研究中, 红光条件下的内核层、外核层以及内网层厚度显著低于蓝光条件下的其各层厚度, 同时3层厚度的变化与光谱波长变化之间呈现负相关性, 这与上述四指马鲅的研究结果不同。这可能是由于不同物种受到光谱对其各自视网膜各层厚度的影响不同所致, 长波长的红光会影响许氏平鲉视网膜发育进而导致各主要层厚度降低, 而内核层厚度较厚可以增强视信息接收能力和对视信息的分析能力, 具有较高的视觉分辨能力, 因此在红光下许氏平鲉的内核层厚度较低会影响其视信息接收能力。此外, 在本实验中我们发现相比于其他光谱条件, 蓝光下的许氏平鲉各主要层厚度值总是较高, 其内核层厚度值也较其他各组更大, 也具有较高的视觉分辨能力, 这与许氏平鲉自然种群的生活习性相一致, 由于其长栖息于岩礁区泥沙底质水域的近底层, 所以其视网膜的光敏感性强于视觉的精确度[20-22]。由此可见, 光谱对鱼类视网膜各层厚度的影响具有种属特异性, 而相比于其他光谱环境, 红光可能会对许氏平鲉视网膜产生不利影响。
4 结论综上所述, 在光周期为 12L: 12D、光照度为(250±20) mW/m2的环境下, 5种不同 LED 光谱下, 许氏平鲉的视网膜细胞数量和厚度发生了相应的变化。许氏平鲉视网膜在蓝光下相较于其他处理组, 细胞数最少, 因此在蓝光谱下可能会对鱼类的视觉发育与成像产生一定影响; 就视网膜厚度而言, 红光对视网膜厚度影响较为明显, 红光条件下的内核层、外核层以及内网层厚度显著低于蓝光条件下的其各层厚度, 其他光谱对各层厚度影响不显著。因此, 饲养于不同光谱处理组的许氏平鲉幼鱼的视网膜的厚度及细胞数量均会发生适应性改变, 以帮助其更好地适应外界光环境的变化。本研究为揭示许氏平鲉对光环境的适应变化规律提供了理论基础, 并对许氏平鲉养殖光照条件设置提供一定的理论参考。
| [1] |
刘松涛, 李伊晗, 李鑫, 等. 不同LED光谱对红鳍东方鲀幼鱼生长发育、摄食及消化酶活性的影响[J]. 中国水产科学, 2021, 28(8): 1011-1019. LIU Songtao, LI Yihan, LI Xin, et al. Effects of LED spectra on growth, feeding, and digestive enzyme activities of juvenile Takifugu rubripes[J]. Journal of Fishery Sciences of China, 2021, 28(8): 1011-1019. |
| [2] |
DOWING G, LITVAK M K. The effect of light intensity and spectrum on the incidence of first feeding by larval haddock[J]. Journal of Fish Biology, 2001, 59(6): 1566-1578. DOI:10.1111/j.1095-8649.2001.tb00221.x |
| [3] |
KARAKATSOULI N, PAPOUTSOGLOU S E, PIZZONIA G, et al. Effects of light spectrum on growth and physiological status of gilthead seabream Sparus aurata and rainbow trout Oncorhynchus mykiss reared under recirculating system conditions[J]. Aquacultural Engineering, 2007, 36(3): 302-309. DOI:10.1016/j.aquaeng.2007.01.005 |
| [4] |
POLITIS S N, BUTTS I, TOMKIEWICZ J. Light impacts embryonic and early larval development of the European eel, Anguilla Anguilla[J]. Journal of Experimental Marine Biology & Ecology, 2014, 461: 407-415. |
| [5] |
黄宇雯. 黄金鲈(Perca flavescens)在不同LED光谱下的光色偏好及生理响应的性别差异[D]. 金华: 浙江师范大学, 2019. HUANG Yuwen. Color preference and gender differences in physiological responses of yellow perch Perca flatescens under different light-emitting diode(LED) spectra[D]. Jinhua: Zhejiang Normal University, 2019. |
| [6] |
崔鑫. 光谱和光强对欧洲舌齿鲈(Dicentrarchuslabrax)幼鱼生长、存活和发育的影响[D]. 大连: 大连海洋大学, 2019. CUI Xin. Effects of spectrum and light intensity on the growth, survival and development of European sea bass (Dicentrarchus labrax)[D]. Dalian: Dalian Ocean University, 2019. |
| [7] |
WAGNER H J, KRGER R H. Adaptive plasticity during the development of colour vision[J]. Progress in Retinal and Eye Research, 2005, 24(4): 521-536. DOI:10.1016/j.preteyeres.2005.01.002 |
| [8] |
ZHANG Q, WU Y, LI W, et al. Retinal development and the expression profiles of opsin genes during larval development in Takifugu rubripes[J]. Journal of Fish Biology, 2023, 102(2): 380-394. DOI:10.1111/jfb.15270 |
| [9] |
HAN M M, LI X, WU L L, et al. The plasticity of vision and body development of turbot Scophthalmus maximus larvae under different light spectra[J]. Aquaculture Research, 2020, 51(8): 3347-3357. DOI:10.1111/are.14670 |
| [10] |
MAIA C M, VOLPATO G L. Environmental light color affects the stress response of Nile tilapia[J]. Zoology, 2013, 116(1): 64-66. DOI:10.1016/j.zool.2012.08.001 |
| [11] |
龚静, 彭新亮, 黄光玲, 等. 鲫鱼和斑马鱼视网膜结构的比较组织学研究[J]. 经济动物学报, 2012, 16(3): 151-153. GONG Jing, PENG Xinliang, HUANG Guangling, et al. Comparative histology study on retinal structure of crucian carp and zebrafish[J]. Journal of Economic Zoology, 2012, 16(3): 151-153. |
| [12] |
许诺, 林少珍, 朱晓静, 等. 褐菖鲉的视觉器官发育[J]. 动物学杂志, 2018, 53(5): 742-751. XU Nuo, LIN Shaozhen, ZHU Xiaojing, et al. The development of visual organs in the Sebastiscus marmoratus[J]. Chinese Journal of Zoology, 2018, 53(5): 742-751. |
| [13] |
牛亚兵. 玫瑰高原鳅和贝氏高原鳅视觉器官比较组织学研究[D]. 重庆: 西南大学, 2017. NIU Yabing. Comparative histological study of visual organs between Triplophysa rosa and Triplophysa bleekeri[D]. Chongqing: Southwest University, 2017. |
| [14] |
马爱军, 王新安, 庄志猛, 等. 半滑舌鳎仔、稚鱼视网膜结构与视觉特性[J]. 动物学报, 2007, 53(2): 354-363. MA Aijun, WANG Xinan, ZHUANG Zhimeng, et al. Structure of retina and visual characteristics of the half- smooth tongue-sole Cynoglossus semilaevis Günter[J]. Acta Zoologica Sinica, 2007, 53(2): 354-363. |
| [15] |
KUSMIC C, GUALTIERI P. Morphology and spectral sensitivities of retinal and extraretinal photoreceptors in freshwater teleosts[J]. Micron, 2000, 31(2): 183-200. DOI:10.1016/S0968-4328(99)00081-5 |
| [16] |
SONG J A, CHOI C Y. Effects of blue light spectra on retinal stress and damage in goldfish (Carassius auratus)[J]. Fish Physiology and Biochemistry, 2019, 45(1): 391-400. DOI:10.1007/s10695-018-0571-4 |
| [17] |
邹秀兰, 俞永珍, 徐哲, 等. 蓝光诱导的人视网膜色素上皮细胞的氧化损伤及其线粒体机制[J]. 中华实验眼科杂志, 2015, 33(2): 129-134. ZOU Xiulan, YU Yongzhen, XU Zhe, et al. Oxidative damage of human retinal pigment epithelium cells induced by blue light irradiationand mitochondria-participated mechanism[J]. Chin J Exp Ophthalmol, 2015, 33(2): 129-134. |
| [18] |
张瑞祺. 鳜视网膜、侧线系统结构与发育及捕食行为特征分析[D]. 上海: 上海海洋大学, 2020. ZHANG Ruiqi. The structure and development of vision and lateral line system of mandarin fish and its predatory behavior characteristics[D]. Shanghai: Shanghai Ocean University, 2020. |
| [19] |
周慧. 四指马鲅视网膜早期发育及其对不同光周期环境的适应性研究[D]. 上海: 上海海洋大学, 2017. ZHOU Hui. Early development of retina of Eleutheronema tetradactylum and its adaptation mechanism to different light cycle environments[D]. Shanghai: Shanghai Ocean University, 2020. |
| [20] |
席丹. 许氏平鲉(Sebastes schlegelii)早期发育生长模式与自残行为研究[D]. 青岛: 中国海洋大学, 2014. XI Dan. Growth pattern and cannibalism in black rockfish (Sebastes schlegelii) during early development stage[D]. Qingdao: Ocean University of China, 2014. |
| [21] |
张涛, 张洁明, 郭峰, 等. 日本鳗鲡早期幼苗趋光性及视觉发育特征[J]. 淡水渔业, 2009, 39(3): 18-25. ZHANG Tao, ZHANG Jieming, GUO Feng, et al. Characteristics of phototaxy and optical development of Japanese eel (Anguilla japonica) larva[J]. Freshwater Fisheries, 2009, 39(3): 18-25. |
| [22] |
MAIA C M, VOLPATO G L. Environmental light color affects the stress response of Nile tilapia[J]. Zoology, 2013, 116(1): 64-66. |
 2023, Vol. 47
2023, Vol. 47


