
文章信息
- 温丽联, 宋金明, 李学刚, 马骏, 戴佳佳, 袁华茂, 段丽琴, 王启栋. 2023.
- WEN Li-lian, SONG Jin-ming, LI Xue-gang, MA Jun, DAI Jia-jia, YUAN Hua-mao, DUAN Li-qin, WANG Qi-dong. 2023.
- 海洋环境中氟喹诺酮类抗生素(FQs)分析的样品前处理与检测技术
- Sample pretreatment and determination of fluoroquinolone antibiotics in marine environments
- 海洋科学, 47(9): 103-118
- Marine Sciences, 47(9): 103-118.
- http://dx.doi.org/10.11759/hykx20230208001
-
文章历史
- 收稿日期:2023-02-08
- 修回日期:2023-03-18
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049;
4. 中国科学院海洋大科学研究中心, 山东 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
氟喹诺酮类(fluoroquinolones, FQs)药物是一类人工合成的广谱抗生素, 具有抗菌谱广、组织扩散性好、半衰期长和毒性低等特点, 是全球使用量第三大的抗生素[1]。FQs在人和动物体内只部分发生代谢反应, 大部分以原药的形式排入环境中。由于高吸附性和难降解性, FQs成为“伪持久性”药物, 广泛存在于水体和沉积物等环境介质中, 并在水生生物体内不断富集, 逐渐成为一类新型污染物, 对人类健康和生态环境产生了深远的影响[2]。因此, 掌握FQs在海洋水体、沉积物和生物体中的含量水平不仅是认识其在环境中生物地球化学行为的基础, 也是评价其潜在环境风险的重要前提。
FQs在环境介质中含量较低, 且海水、沉积物和水生生物体的样品本身成分复杂, 需要经过萃取和分离富集等复杂的样品前处理过程来消除基质干扰, 再通过分析检测仪器进行定性和定量测定。因此, 理想的样品前处理和分离检测方法应具备选择性好、操作简单、灵敏度高、回收率高和基质效应低等特点。
目前, 与人类生活更为密切的食品领域中FQs的残留问题备受关注, 许多研究都报道了该领域FQs的样品前处理和分离检测方法, 如Zhang等[3]总结了食品中喹诺酮类药物的分析测定方法, Khatibi等[4]将固相萃取结合高效液相色谱-质谱法用于食品中FQs等抗生素残留的检测, Zhang等[5]总结了QuEChERS(quick, easy, cheap, effective, rugged and safe)在食品抗生素残留检测中的发展和应用, 李倩等[6]则归纳了动物性食品中喹诺酮类药物残留检测方法。然而, 目前尚缺乏海洋水体、沉积物和水生生物体等环境中FQs的样品前处理与分离检测方法的系统总结。
本研究归纳总结了海洋水体、沉积物和水生生物体等环境中FQs的样品前处理和分析检测技术的研究进展, 归纳了FQs的理化性质及其在海洋环境中的污染特征, 探讨了不同环境中FQs的萃取、分离富集流程、关键环节和优化条件, 比较分析了固相萃取(solid phase extraction, SPE)技术、QuEChERS萃取技术、磁性固相萃取(magnetic solid phase extraction, MSPE)技术等净化和浓缩技术的原理和适用范围, 总结了高效液相色谱(high performance liquid chromatography, HPLC)和超高效液相色谱(ultra performance liquid chromatography, UHPLC)结合质谱(mass spectrometry, MS)或荧光检测器(fluorescence detection, FLD)等分析检测技术的原理和优化条件。最后, 研究展望了FQs样品前处理和检测技术的发展趋势。
1 FQs的理化性质及在海洋环境中的污染特征 1.1 FQs的理化性质FQs是一类以1, 4-二氢-4-氧吡啶-3-羧酸为基本结构的广谱性人工合成抗生素, 由于其广谱抗菌活性、低毒性、高组织扩散性而广泛应用于人类和动物医学中, 已成为世界第三大类抗生素[7-8]。FQs是极性化合物, 易溶于稀酸溶液、碱溶液、极性强的有机溶剂等, 不溶于弱极性和非极性溶剂。FQs的结构中有一个羧基、一个氟原子和一个哌嗪基或哌嗪衍生物基团, 是既含有酸性基团又含有碱性基团的双质子分子, 可以以阳离子、两性离子、中性离子和阴离子的形式存在于环境中[9], 同时强配位体羧基和氟原子易与羟基反应, 这增强了它们的水溶性, 使它们具有与多种阳离子(例如镁、钙、铝、铁和锌)形成稳定配合物的强大能力[9]。
由于不同的FQs具有不同的解离常数(Ka, pKa= –lgKa)(表 1), 因此, 根据酸碱性质可将FQs分为两类: 酸性喹诺酮类(pKa 6.0~6.9)和带哌嗪基杂环的喹诺酮类(pKa1 5.5~6.3, pKa2 7.6~8.5)[10], 绝大多数FQs具有2个pKa值。FQs在不同pH条件下以不同的形式存在: 当pH<pKa1时, FQs主要以阳离子形态为主, 并存在少量两性离子形态; 当pKa1<pH<pKa2时, 溶液中存在3种离子形态的FQs, 以两性离子形态为主, 并且随着pH不断增大, 阳离子形态不断减少, 阴离子形态逐渐增多; 当pH>pKa2时, FQs主要以阴离子形态存在, 并存在少量两性离子[11]。研究表明, 在FQs的分析检测过程中, FQs的质子化形态对它们保留在固相萃取小柱上至关重要。因此, 为了将FQs转化为阳离子形式, 一般将样品pH调整在2.5~4范围内, 最常见的是将pH调至3[10]。
| 名称 | 缩写 | 分子式 | CAS | pKa | 水溶性/(mg/L) | ESI | 母离子/(m/z) | 子离子/(m/z) |
| 环丙沙星 Ciprofloxacin |
CIP | C17H18FN3O3 | 85721-33-1 | 3.1, 6.14 | 30 000.0(20 ℃) | + | 332 | 288/245 |
| 恩诺沙星 Enrofloxacin |
ENR | C19H22FN3O3 | 91306-60-6 | 3.86, 6.16 | 612.0 | + | 360 | 316/245 |
| 诺氟沙星 Norfloxacin |
NOR | C16H18FN3O3 | 70458-96-7 | 3.11, 6.10 | 280.0(25 ℃) | + | 320 | 276/233 |
| 氧氟沙星 Ofloxacin |
OFL | C18H20FN3O4 | 98105-99-8 | 5.97, 8.28 | 10 800.0(25 ℃) | + | 362 | 342/299 |
| 洛美沙星 Lomefloxacin |
LOM | C17H19F2N3O3 | 98079-51-7 | 5.00, 5.87 | 27 200.0 | + | 352 | 308/265 |
| 双氟沙星 Difloxacin |
DIF | C21H19F2N3O3 | 98106-17-3 | 5.66, 8.59 | — | + | 400 | 356/299 |
| 依诺沙星 Enoxacin |
ENO | C15H17FN4O3 | 74011-58-8 | 5.50, 8.59 | 3.4 | + | 321 | 275/232 |
| 氟甲喹 Flumequine |
FLU | C14H12FNO3 | 428835-25-6 | 6.50 | 2 186.0(25 ℃) | + | 262 | 244/202 |
| 培氟沙星 Pefloxacin |
PEF | C17H20FN3O3 | 70458-92-3 | 5.66, 6.47 | 11.4(25 ℃) | + | 334 | 316/290 |
| 沙拉沙星 Sarafloxacin |
SAR | C20H17F2N3O3 | 98105-99-8 | 5.60, 8.20 | 14.4(25 ℃) | + | 386 | 342/299 |
| 萘啶酸 Nalidixic Acid |
NDA | C12H12N2O3 | 389-08-2 | 6.01, 8.60 | 100.0(23 ℃) | + | 233 | 215 |
| 达氟沙星 Danofloxacin |
DAN | C19H20FN3O3 | 112398-08-0 | 6.07, 8.56 | — | + | 358 | 340 |
| 司帕沙星 Sparfloxacin |
SPA | C19H22F2N4O3 | 110871-86-8 | 5.75, 8.79 | 几乎不溶 | + | 393 | 349 |
| 注: ESI是电喷雾离子源; —表示没有数据; CAS是物质唯一的数字识别号码; m/z是质子数/电荷数的比值 | ||||||||
海洋环境是废水和河流排放物产生的陆源抗生素残留的重要“汇”, 大量抗生素残留物通过河流输入、大气沉降、废水排放等方式被运输到沿海地区。由于河流运输中稀释、沉积、降解和海水稀释的影响, 与废水和河流表层水相比, 海洋环境中的FQs浓度相对较低, 总体浓度低于1 μg/L, 除了恩诺沙星(ENR)在我国黄海灵山湾海水和渤海大连沿海沉积物中的浓度分别高达6 880 ng/L[12]和2 364.8 ng/g[13](表 2)。环丙沙星(CIP)、ENR、诺氟沙星(NOR)和氧氟沙星(OFL)是海洋环境中最常见的FQs类污染物, 总体浓度和检出频率远高于其他FQs类抗生素(表 2)。其中, CIP和NOR分别在南海珠江口海水和沉积物中检出最高浓度, 分别为365 ng/L和444 ng/g[14]; ENR在黄海灵山湾海水中检出最高浓度, 为6 880 ng/L[12]; OFL在南黄海近岸海水中检出最高浓度, 为497.6 ng/L[15]。在我国近海海域中, 南海珠江口海水和沉积物中FQs的浓度较其他海域高, 黄海海水和沉积物中FQs浓度大于东海海域; 渤海近海的水生生物体中FQs浓度较高, 最高浓度达到370 ng/g[16], 主要是因为取样于高排放的海水养殖区。总体而言, 海洋环境中FQs的浓度数据较少且浓度总体较低(表 2), 可能由于FQs在环境中发生了光解、水解或生物降解等环境生物地球化学行为, 这有待未来进一步的调查研究。
| 样品类型 | 采样地点 | 采样时间 | ENR | OFL | NOR | CIP | ENO | FLU | 参考文献 |
| 水环境 | 南黄海近岸 | 2015年8月(n=30) | ND~121.2 (7.2) | ND~497.6 (25.4) | ND~21.1 (0.7) | ND~100.2 (3.3) | [15] | ||
| 南海珠江口 | 2016年7月(n=6) | 0.8~195.0 (38.7) | 32.8~381.0 (125.0) | 24.6~365.0 (103.0) | ND~463.0 (23.3) | [14] | |||
| 渤海湾 | 2016年8月(n=11) | 4.3~15.3 (5.7) | [17] | ||||||
| 东海沿海 | 2018年4月(n=13) | ND~17.7 | ND~50.8 | ND~32.2 | 0.4~27.3 | ND~1.6 | 0.1~28.0 | [18] | |
| 南海海陵湾 | 2013年9月(n=39) | ND~56.7 (2.0) | ND~13.7 (0.8) | ND~5.0 (0.3) | ND~187.0 (5.3) | [19] | |||
| 南海北部湾 | 2018年11月(n=3) | 2.7~6.6 (2.8) | 4.8~5.0 (4.9) | 5.5~13.8 (5.7) | [20] | ||||
| 台州湾近岸 | 2017年6月(n=17) | ND~19.9 (1.7) | ND~42.9 (4.2) | ND~112.0 (0.9) | [21] | ||||
| 南海北部湾 | 2015年10月(n=17) | ND~2.3 (1.3) | ND~1.9 (0.8) | 4.3~97.3 (35.7) | 5.4~182.0 (36.9) | 0.8~59.3 (16.9) | [22] | ||
| 黄海灵山湾 | ND~6 880.0 (848.9) | ND~35.6 (30) | ND~135.3 (88.3) | ND~79.0 (47.9) | [12] | ||||
| 西班牙加的斯湾沿海 | 2015年6月(n=10) | ND~122.0 | ND~34.4 | ND~207.5 | ND~211.7 | ND~3.6 | [23] | ||
| 韩国南部沿海 | 2012年6月(n=42) | ND~12.4 (6.9) | ND~0.5 (0.4) | ND~1.3 (0.9) | [24] | ||||
| 沉积物 | 渤海湾 | 2016年8月(n=11) | 0.7~36.6 (7.1) | ND~26.0 (3.0) | 1~15.8 (3.7) | [17] | |||
| 东海沿海 | 2018年4月(n=30) | ND~8.1 | ND~5.4 | ND~4.6 | ND~8.5 | [18] | |||
| 南海海陵湾 | 2013年9月(n=24) | ND~2.7 (0.7) | ND~19.4 (1.0) | ND~22.2 (1.1) | ND~4.2 (0.2) | [19] | |||
| 南海珠江口 | 2016年7月(n=6) | ND~157.0 (4.82) | 3.38~444.0 (91.6) | 0.1~104.0 (28.4) | ND~97.5 (21.5) | [14] | |||
| 南海北部湾 | 2018年11月(n=3) | 0.9~1.4 (1.1) | 2.7~2.8 (2.7) | 3.0~7.6 (6.6) | 1.1~1.6 (1.4) | [13] | |||
| 渤海大连沿海 | 2015年6月(n=21) | 7.8~2 364.8 (139.0) | ND~47.6 (26.9) | ND~15.8 (11.6) | ND~6.9 (6.2) | [13] | |||
| 生物体 | 南海北部湾 | 2018年11月(n=28) | ND~0.5 (0.2) | ND~26.0 (3.0) | 0~1.0 (0.3) | 1.0~15.8 (3.7) | [20] | ||
| 渤海近海 | 2009年8月(n=11) | 0~147.0 (5.4) | 0~242.0 (14.7) | 0.0~370.0 (18.8) | 0.0~208.0 (14.54) | 0.0~141.0 (5.7) | [16] | ||
| 注: ENR恩诺沙星; OFL氧氟沙星; NOR诺氟沙星; CIP环丙沙星; ENO依诺沙星; FLU氟甲喹; FQs含量括号的数值为平均浓度; ND未检出 | |||||||||
虽然FQs在海洋中的浓度不能引起生物的急性毒性和死亡, 但会导致慢性毒性, 引起一系列的生态环境效应。例如, 影响浮游生物的繁殖、发育和生长, 导致微生物群落结构和功能的改变, 产生抗性基因导致细菌耐药性。FQs也会干扰物质的生物地球化学循环[25], 包括氮循环、碳循环、硫循环等。物质生物地球化学循环的变化又会进一步引起海洋生态环境的破坏, 从而影响海洋生物的生存。因此, 总结FQs的前处理和分析检测方法对密切关注其在海洋环境中的残留具有重要意义。
2 样品前处理样品前处理是FQs分析的基础和关键, 主要包括萃取和分离富集等步骤(图 1), 其作用是将FQs从各类环境中提取出来, 消除环境基质的干扰, 浓缩到一定的浓度供仪器检测。样品前处理过程对数据质量影响很大, 直接影响检测分析结果的准确性、精密度和可靠性[26]。不同环境本身成分复杂且FQs残留量低, 如水体主要含有金属离子、腐殖质、酸、碱等, 沉积物主要含有腐殖质、矿物质和金属离子等, 水生生物体主要含有血液、维生素、脂肪和蛋白质等。样品前处理过程中应极力去除上述内源性化合物对色谱分离的干扰, 避免色谱柱的堵塞和劣化, 从而最大程度保障了检测数据的可靠性[27]。
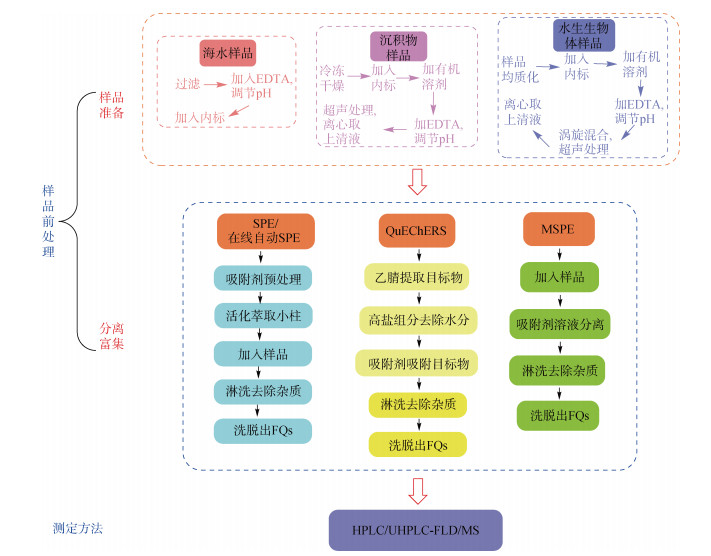 |
| 图 1 水环境样品中FQs样品前处理和检测的主要流程 Fig. 1 Process flow of fluoroquinolone sample preparation and detection in water environment samples 注: SPE表示固相萃取; QuEChERS表示快速, 简单, 便宜, 有效, 坚固、安全萃取; MSPE表示磁性固相萃取; HPLC表示高效液相色谱; UHPLC表示超高效液相色谱; MS表示质谱; FLD表示荧光检测器 |
海水样品的准备包括过滤、加入内标和乙二胺四乙酸二钠盐(Na2EDTA)、调节pH等过程, 最后保存在−20 ℃冰箱以待检测(图 1)。过滤是海水样品准备的重要环节, 一般通过0.45 μm亲水性混合纤维素酯膜、硝酸纤维素膜、玻璃纤维膜、尼龙过滤膜等去除水体中的悬浮颗粒物。生物量大的水域也可先用1 μm的膜过滤去除水体中的浮游生物, 再用0.45 μm的膜过滤去除水体中的悬浮颗粒物[18]。研究表明混合纤维素酯和硝酸纤维素膜过滤后的水体中FQs损失较少(<3.5%), 而玻璃纤维膜和尼龙过滤膜会导致FQs的显著损失(表 3)。
| 目标物 | 地点 | 样品前处理 | 检测方法 | 回收率% | 参考文献 | |
| 样品准备 | 分离富集 | |||||
| CIP、ENR、NOR、OFL | 辽东湾 | 过滤, 盐酸+Na2EDTA调节pH至3, 加入内标 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C18色谱柱 | 73.5~108 | [28] |
| CIP、ENR、NOR、OFL | 东海沿岸 | 过滤, 硫酸+Na2EDTA调节pH至3, 加入内标 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C18色谱柱 | — | [29] |
| CIP、ENR、NOR、OFL、MOX | 地中海 | 过滤, 盐酸+Na2EDTA调节pH至2.5, 加入内标 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, T3色谱柱 | 70.4~123.1 | [30] |
| LOM、ENR、OFL | 渤海湾 | 过滤, 咖啡因+柠檬酸盐缓冲液调节pH至3, 加入内标 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C8色谱柱 | 89~101 | [17] |
| CIP、ENR、NOR、OFL | 南黄海近岸 | 过滤, 硫酸+Na2EDTA调节pH至3, 加入内标 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C18色谱柱 | 72~90 | [31] |
| CIP、ENR、NOR、OFL | 中国沿海 | 过滤, 硫酸+Na2EDTA调节pH至3, 加入内标 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C18色谱柱 | — | [32] |
| CIP、NOR、OFL | 南海珠江口 | 过滤, 盐酸+Na2EDTA调节pH值至3, 加入内标 | SPE, HLB萃取柱, 甲醇洗脱 | HPLC-MS, C18色谱柱 | 70~120 | [14] |
| 注: MOX莫西沙星; LOM洛美沙星; Na2EDTA乙二胺四乙酸钠; SPE固相萃取; HLB聚合物吸附剂; UHPLC超高效液相色谱; HPLC高效液相色谱; MS质谱法; /表示无数据, 下同 | ||||||
调节pH是水体样品准备中的重要步骤。由于FQs的酸碱特性和取代基的性质差异, FQs的析出和萃取过程中的吸附高度依赖pH。在水溶液中, 含7-哌嗪基的FQs是阳离子、阴离子或两性离子, 而其他FQs是中性或阴离子[11]。对于大多数FQs, 高回收率发生在pH值为2.5~3, 如萨拉沙星(SAR)和双氟沙星(DIF)可在此pH区间内被吸附剂吸附。通过调节样品的pH, 如5.5以下, 还可以降低FQs对金属离子的络合能力。大部分研究都通过添加盐酸、硫酸或者缓冲液的方式调节pH, 而缓冲液主要是柠檬酸盐缓冲液或者McIlvaine缓冲液(柠檬酸盐-磷酸盐缓冲液), 这样可以极大地提高目标物回收率[33]。在样品中加入Na2EDTA是必须的, 它能很好地络合水体中的金属离子, 减少因FQs络合金属离子而影响萃取回收率和分析检测效果[33-34]。
2.1.2 海洋沉积物样品沉积物样品准备包括样品的冷冻干燥、加入内标、加入有机溶剂、涡旋混合、调节pH、加入Na2EDTA、超声萃取萃取、离心获得上清液(图 1)等步骤, 重复萃取离心后的沉降物3次可提高待测物的回收率。对样品进行冷冻干燥的目的是去除样品中的水分, 以便只提取吸附在沉积物中而非间隙水中的目标物[35], 因此样品中水分去除率越高越有利于目标物后续的分离富集和检测。超声萃取的原理是利用超声的空化作用、机械效应和热效应等, 释放、扩散和溶解基质内目标物, 从而提高回收率, 超声处理的时间一般为15 min。研究表明, 超声萃取提取时间的长短(提取数分钟至数小时)对于样品回收率无显著影响。然而, 通过循环多次的连续有机溶剂萃取和超声萃取可获得更高的FQs回收率和更好的样品组成[29](表 4)。
| 目标物 | 地点 | 样品前处理 | 检测方法 | 回收率% | 参考文献 | |
| 萃取/提取 | 分离富集 | |||||
| CIP、ENR、NOR、OFL | 南海北部湾 | 乙腈+柠檬酸缓冲液, 调节pH至3, 超声萃取15 min, 重复萃取3次 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C18色谱柱 | 70~90 | [22] |
| ENR、LOM、OFL | 渤海湾 | 柠檬酸盐缓冲液+Na2EDTA, 调节pH至3, 超声萃取萃取15 min, 重复萃取3次 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C8色谱柱 | 86~95 | [17] |
| CIP、ENR、NOR、OFL | 西班牙沿海 | 甲醇+McIlvaine缓冲液调节pH至3, MAE萃取 | SPE, HLB萃取柱, 甲醇、洗脱 | UHPLC-FLD, C18色谱柱 | — | [36] |
| CIP、NOR、OFL、FLU | 南海珠江口 | 乙腈+柠檬酸缓冲液, 调节pH至4, 超声萃取10 min | SPE, HLB萃取柱, 甲醇洗脱 | HPLC-MS, C18色谱柱 | 70~120 | [14] |
| CIP、ENR、NOR、OFL | 东海沿岸 | 乙腈+柠檬酸缓冲液, 调节pH至3, 超声萃取15 min, 重复萃取3次 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C18色谱柱 | — | [29] |
| 注: FLD光谱分析法 | ||||||
由于FQs与沉积物之间的强烈相互作用使FQs难以萃取, 所以目标物的萃取过程一方面要考虑基质效应, 另一方面要考虑FQs的酸碱特性, 萃取有机溶剂的选择对减少目标物的损失也至关重要[37]。研究表明, 样品稀释是克服腐殖质基质效应的有效方法, 在某些情况下, 稀释将最大限度减少基质的信号抑制作用, 增加FQs的信号强度以校正定量分析结果[38]。样品与硅藻土间的混合, 能增强萃取有机溶剂向沉积物间隙的扩散, 有利于提高FQs的回收率[39]。此外, 低pH值也有利于提高FQs的回收率。在酸性条件下, FQs和沉积物中的阴离子位点都被质子化, 有利于两者间的静电排斥, 促进了FQs的析出; 而在中性条件下FQs的回收率并不理想(30%~50%), 这是由于两性离子形式的FQs水溶性较低[40]。研究表明磷酸盐缓冲液和乙腈作为有机混合萃取溶剂, 在超声萃取下重复萃取3次, 可显著提高目标物回收率。此外, FQs可与沉积物中的阳离子形成稳定络合物, 添加螯合剂Na2EDTA可以显著提高萃取效果[41]。
2.1.3 水生生物体样品水生生物体样品的准备包括样品均质化、冷冻干燥、加入内标、加入有机溶剂、调节pH、加入Na2EDTA、混合涡旋、超声萃取、离心获得上清液等步骤(图 1), 加入有机溶剂重复萃取可提高FQs的回收率。分析检测水生生物体中的FQs, 需要通过机械或物理方法破碎固体样品, 以便目标物从细胞结构中完全释放出来, 从而溶解到有机萃取溶剂中, 该过程可加入硅藻土提高待测物的提取率[16], 也可通过超声辅助萃取技术[42]、微波辅助萃取(microwave-assisted extraction, MAE)技术进行处理[43]和加速固相萃取(accelerated solid phase extraction, ASE)技术进行处理[16]。Aufartová等[43]基于MAE和固相萃取技术(SPE), 结合超高效液相色谱, 测定了鱼类肌肉中的5种FQs, 获得的回收率>93%。Montesdeoca-Esponda等[44]使用MAE技术, 结合液相色谱串联质谱法分析了沿海沉积物和污水污泥样品中的FQs, 检测出沉积物中左氧氟沙星(LEV)、NOR、CIP和ENR中的含量范围为0.81~34.3 ng/g。在某些情况下, 破碎样品的过程一般配合磷酸盐缓冲溶液的使用, 其与乙腈、甲醇、甲酸、乙酸和草酸等有机溶剂结合使用也可提高提取率(表 5)。
| 目标物 | 生物 | 样品前处理 | 检测方法 | 回收率% | 参考文献 | |
| 萃取/提取 | 分离富集 | |||||
| CIP、ENO、ENR、NOR、OFL、 | 虾和蟹 | 甲醇+乙酸, 调节pH至3, 超声处理15 min, 重复提取3次 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, C18色谱柱 | 70~93 | [17] |
| CIP、DIF、ENR、LOM、NOR、OFL、SAR | 双壳类 | 硅藻土混合, ASE萃取 | SPE, HLB萃取柱, 甲醇洗脱 | HPLC-MS, C18色谱柱 | — | [16] |
| CIP、DAN、DIF、ENR、MAR、SAR | 鲈鱼和鲟鱼 | 磷酸二氢钠+甲酸乙腈溶液, 调节pH至7 | QuEChERS, 缓冲萃取试剂盒 | UHPLC-MS, C18色谱柱 | 72~108 | [45] |
| CIP、DAN、ENO、ENR、LEV、LOM、NOR、OFL、PEF | 金头鲷血浆 | 磷酸盐缓冲液, 调节pH至7.4 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, 核壳颗粒 | 91~115 | [46] |
| CIP、DAN、ENO、ENR、LEV、LOM、NOR、OFL、PEF | 金头鲷肌肉 | 乙腈+乙酸, 调节pH至7.4 | SPE, HLB萃取柱, 甲醇洗脱 | UHPLC-MS, 核壳颗粒 | 83~96 | [46] |
| 注: DIF双氟沙星; DAN达诺沙星; MAR马波沙星; LEV左氟沙星; PEF培氟沙星; SAR萨拉沙星 | ||||||
生物体样品成分复杂, 主要含有蛋白质、脂类和糖类等, 这些成分将显著影响FQs的回收效率, 导致目标物信号的变化, 从而影响定量结果的准确性[47]。为了有效减少生物体样品的基质效应, 萃取有机溶剂的选择至关重要[48]。生物体样品中的FQs在乙腈中有较强的溶解能力, 且在酸性条件具有较高的回收率, 因此, 生物体样品中常用的萃取溶剂一般为可以沉淀蛋白质的乙腈与酸的混合溶液, 如甲酸-乙腈溶液、乙酸-乙腈溶液、磷酸盐-乙腈溶液等[49]。研究表明, 乙腈溶液的浓度是影响鱼类FQs提取的重要因素, 使用50%、60%、75%、90%和100%乙腈溶液分别提取鱼肉样品中的FQs, 发现90%乙腈溶液效果最佳, FQs的回收率>80%; 100%乙腈溶液效果较差, 这是因为在纯有机溶剂中, 蛋白质的二级结构基本保持完整, 氢键无法被破坏, 目标物被包装成蛋白质迅速聚集在一起; 而在50%、60%和75%乙腈溶液的效果也较差, 这是由于蛋白质和目标物之间的氢键没有完全破坏, 目标物不能很好地释放[50]。
2.2 FQs样品的分离与富集样品的分离富集也称净化、浓缩, 是指将目标物与杂质分离并通过富集浓缩最终得到纯净的、可被仪器检测的目标物的过程。分离过程可去除与目标物溶解性、结构和性质类似或不同但对检测有严重干扰作用的杂质, 富集过程常常用少量洗脱溶剂洗脱痕量目标物来增大目标物的检测浓度, 从而达到提高检测精度和准确性的目的。样品分离富集方法的选择取决于具体的目标物和样品来源, 主要方法有SPE[10, 46], QuEChERS萃取[45]、MSPE[51]等(表 6)。
| 方法 | 特点 | 优点 | 缺点 |
| SPE | 吸附剂种类多 | 技术成熟、适用性强、应用最广泛 | 试剂用量大、操作步骤多 |
| QuEChERS | 硫酸镁和氯化钠的使用 | 快速、简便、廉价 | 应用较少 |
| MSPE | 磁性吸附剂的使用 | 吸附能力强、特异性强 | 成本较高 |
SPE是一种广泛使用的样品处理技术, 适用于各种环境中目标物的分离与富集。该技术可以有效地消除内源性化合物干扰, 从而获得较高纯度和浓度的FQs。SPE基于固相(吸附剂)和液相(样品)之间不同的亲和力, 其原理类似于液相色谱法的分离[52]。SPE主要包括以下步骤: (1)SPE小柱的活化, (2)样品的加入使吸附剂吸附样品中的FQs, (3)淋洗溶液淋洗以消除杂质, (4)目标物的洗脱[53]。在整个样品前处理过程中, 每个步骤的优化都极其重要且都要根据FQs的物理化学性质和样品基质展开, 包括吸附剂、淋洗溶液和洗脱溶液的选择和优化, 从而将基质效应降至最低、提高FQs的回收率。
目前可用的SPE吸附剂种类繁多, 吸附剂的选择是样品前处理成功的关键因素之一[54]。SPE中吸附剂的选择在很大程度上取决于吸附剂与FQs官能团的相互作用, 以及吸附剂与杂质的相互作用。常用的SPE吸附剂有非极性吸附剂(如C18)、混合相阳离子交换(mixed-phase cation-exchange, MPC)吸附剂和聚合物吸附剂(如ENV+和HLB)[10]。C18吸附剂是一种十八烷基功能化二氧化硅吸附剂。MPC吸附剂是一种混合模式的二氧化硅基吸附剂, 由特殊的非极性辛基和强阳离子交换剂组成, 其疏水性和阳离子交换特性能与两性FQs的带电氨基发生特异性相互作用。聚合物吸附剂ENV+是一种树脂基非极性吸附剂, 由羟基化聚苯乙烯二乙烯基苯组成, 这两种吸附剂都广泛用于极性目标物的萃取。聚合吸附剂HLB由亲水性N-乙烯基吡咯烷酮和亲脂性二乙烯基苯两种单体组合而成, 适用于酸性、中性和碱性目标物的分离富集[4]。HLB被证明是FQs最有效的萃取吸附剂之一, 具有较高的回收率和良好的回收质量, 其亲水官能团通过与FQs芳香族核心结构及可电离基团相互作用, 将FQs很好地保留在吸附柱上, 从而达到将目标物与杂质分离的目的[55]。研究表明, 在pH=3条件下使用HLB得到最佳回收率[38]。海水样品中的成分相对简单, 一般仅使用HLB就能获得较好的分离效果[56], 而沉积物样品组成复杂, 一般先使用强阴离子交换柱去除样品中带负电荷的腐殖酸和富里酸等杂质, 再使用HLB进行目标物的分离富集[57]。
吸附剂吸附目标物过程中, 也会同时吸附盐、胶体、腐殖质等干扰物, 需要加入淋洗溶液将其清除, 如甲醇、酸性甲醇、乙腈等。研究表明使用含20%甲醇的水溶液进行淋洗可获得较好的目标物回收率, 但其使用量不应超过10 mL, 过多的甲醇比例将增加基质效应[35]。甲醇水溶液在淋洗过程中也会造成少量目标物的损失, 酸性和两性FQs样品淋洗溶液中甲醇的最大浓度分别为10%和5%[38]。
选择合适的洗脱溶液同样重要, 理想的洗脱溶液应确保高效洗脱FQs, 同时不会洗脱干扰物。由于FQs的酸碱特性, 洗脱溶液的pH是一个重要的参数, 恰当的pH将抑制基质效应, 进而提高FQs的洗脱效率和回收率。例如, 研究表明在pH=6的条件下, 聚合物吸附剂洗脱效率较高, 提高了目标物的纯度和数据的准确性[58]。洗脱溶液一般为酸性甲醇溶液、含有5%铵盐的甲醇、含有0.1%甲酸的甲醇, 以及乙腈和甲醇混合溶液。一般来说, 酸性甲醇溶液可以更好地洗脱FQs, 主要是由于在酸性条件下, 质子可以竞争性地结合FQs哌嗪基上的胺基, 解离其与吸附剂中乙烯基吡咯烷酮上羰基间形成的氢键, 从而将目标物从吸附剂中洗脱下来[56]。
在线自动SPE是SPE技术的进化版, 将样品前处理和色谱分离集成到一个系统中, 从而实现在线全自动的SPE[59]。在线自动SPE减少了潜在的样品处理危险, 提高了目标物提取的重现性, 实现了高通量分析, 被逐渐应用于FQs的研究[10]。然而, 在线SPE系统可能不稳定, 因为在随后的UHPLC中, 高流速与小分析柱粒径(<2 μm)相结合会产生高背压。此外, 为了提高目标的回收率, 需要不断优化样品pH、吸附柱、进样体积和洗脱溶液等条件。Shen等[60]通过在线SPE结合UHPLC-MS对水中的33种抗生素进行分析的研究中, 优化条件为: 将样品pH调节至2~3、进样体积为5.0 mL、选用HLB作为吸附剂, 最终对所有测试化合物的检测限在0.2~1.5 ng/L范围内, 回收率为76.6%~118%, 与传统方法相比, 该方法仅需13 min即可完成样品的富集、纯化和测定。
2.2.2 QuEChERS萃取QuEChERS是一种快速样品前处理方法, 结合了乙腈液-液分离和分散固相萃取技术的优点, 其原理与SPE相似, 利用吸附剂与FQs官能团、杂质的相互作用来将它们分离, 进而达到对目标物净化和浓缩的目的[45]。QuEChERS技术的处理步骤主要有: (1)样品破碎、均质化, (2)乙腈提取目标物, (3)无水硫酸镁和氯化钠去除水分, (4)添加吸附剂吸附目标物, (5)淋洗、洗脱后的样品浓缩[61]。
无水硫酸镁和氯化钠对FQs的回收十分重要, 硫酸镁减少了样品的含水量, 而氯化钠可以减少基质组分的杂质, 从而得到更好的色谱峰。需要注意的是, 样品中加入硫酸镁产生的热量会导致部分FQs的降解, 从而影响该方法的可重复性和目标物的回收率, 可以通过控制温度缓解这个问题[5]。吸附剂的选择对QuEChERS过程具有重要影响, 其作用是去除基质效应, 获得干净的目标物, 提高FQs的回收率。目前, 常用的QuEChERS吸附剂包括N-丙基乙二胺(N-propyl ethylenediamine, PSA)和非极性吸附剂(如C18)[62]。PSA是一种弱阴离子极性吸附剂, 具有2个氨基基团, 能高效地去除样品中的脂肪酸、各种糖和色素等杂质, 还可通过氢键与羟基等官能团去除样品中多种杂质组分, 具有良好的净化效果[63]。C18用于鲈鱼、鳟鱼和鲟鱼肌肉样品中FQs的分离, 获得72%~107%的回收率[45]。淋洗、洗脱后的样品通过氮吹进行浓缩, 干燥后的残留物被重新溶解在甲醇和乙酸乙酯的混合物中, 这些溶液通常是后续色谱分离中使用的流动相或流动相组分。总的来说, QuEChERS是一种步骤少、无需过滤、设备简单和抗生素的回收率相对较高的样品前处理技术, 并越来越多地应用于各类样品中的FQs分离富集。
2.2.3 磁性固相萃取(MSPE)磁性固相萃取是一种新兴的样品分离富集技术, 因其环境友好、分离过程快速、吸附效率高、易于自动化分析而受到广泛关注[51]。MSPE只需一种磁性吸附剂, 无需额外的萃取柱, 可以避免吸附剂填料的相关问题, 如填料床堵塞和高压。同时, 磁性吸附剂通过引入外部磁场而不是过滤或高速离心从溶液中分离出来, 这大大简化了样品前处理过程。此外, 磁性吸附剂的官能团、分子形状和大小等具有独特性, 可选择性地提取单个或一组目标物, 增强了吸附剂对目标分析物的选择性, 进而消除样品的基质效应。在MSPE萃取过程中, 磁性吸附剂分散在含有待测目标物的溶液中, 在孵育一定时间后吸附待测目标物, 然后借助外部磁场实现吸附剂与溶液的分离, 最后使用洗脱溶液将目标物从吸附剂上洗脱[56]。大多数磁性吸附剂可以回收和再利用, 这可以大大节省成本和保护环境。
磁性材料的类型和粒径、pH、淋洗溶液和洗脱溶液的选择都会影响目标物的相对回收率。磁性吸附剂的材料主要由铁及其氧化物组成, 即磁铁矿(Fe3O4)、磁赤铁矿(γ-Fe3O4)以及一些钴、镍及其氧化物。吸附剂材料具有的多孔分层结构越多, 则可以表现出更好的提取性能, 因为它提供了更多的可用相互作用位点。值得注意的是, 磁性材料的大小会影响吸附效率, 一般的磁性材料直径为1~100 nm[51]。FQs是一种两性化合物, 在pH<6时, 吸附效率较低, 可能由于吸附剂上的正电荷与质子化FQs之间发生静电排斥作用。当pH值在6~8之间时, FQs以两性离子的形式存在, FQs的净电荷接近于0, 但在质子化氨基和强π-π键相互作用下, 仍然可以吸附在磁性吸附剂上。当pH>8时, FQs上的氨基被去质子化, 羧基以阴离子的形式解离, 与带负电荷的磁性吸附剂发生静电排斥作用, 此时适合将FQs将吸附剂上洗脱下来[40]。Zheng等[64]的研究表明, 在相同条件下, 含7%铵盐的甲醇溶液解吸FQs的回收率较高, 回收率在94.0%~124.4%, 其原因为碱性条件会降低FQs对吸附剂的亲和力从而促进洗脱。He等[65]使用MSPE结合HPLC-MS测定食品中FQs的研究中发现, 以甲醇/铵盐(8︰2, v/v)作为洗脱溶液的回收率高于丙酮、乙腈等, 回收率在82.4%~108.5%。
3 仪器分析方法 3.1 高效液相色谱(HPLC)高效液相色谱是一种以液体作为流动相, 将单一溶剂、或极性不同的混合溶剂等通过高压泵输入色谱柱中, 对目标物进行分离的技术。HPLC对成分复杂的样品也具有较好的分离效果, 并能准确地定性定量分析, 在FQs残留检测中应用广泛。各种FQs疏水性的差异导致了其在色谱柱中不同的迁移速率, 从而显示出不同的保留时间。此外, 色谱柱的粒径、流动相有机溶剂、梯度洗脱和样品性质等因素也可能会影响分离度, 并对峰形和灵敏度产生重要影响。
用于海洋水体、沉积物和生物体样品中FQs分离的主要为C18色谱柱, C18色谱柱可根据FQs的两性离子的极性差异对其进行分离。随着技术的发展, 2.1~5 μm粒径和50~250 mm柱长的色谱柱被广泛应用, 进一步缩短了分离时间, 提高了分辨率和灵敏度[14]。色谱柱的温度显著影响目标物、流动相和固定相之间的化学作用, 不稳定的色谱柱温度会导致保留时间的延长和洗脱顺序的变化, 还会得到不对称的峰, 因此保持色谱柱温度的恒定非常重要, 用于FQs检测的色谱柱温度通常设定在30~40 ℃[66]。
在使用HPLC分离FQs时, 通常使用强极性和弱极性溶剂组成的混合液体作为流动相进行洗脱, 水通常用作强极性溶剂, 而乙腈是最常用作弱极性溶剂, 此外还会加入0.1%~0.2%的甲酸溶液, 以提高离子化效率[67]。为了缩短分离时间, 更好地分离各类FQs, 一般采用加酸和梯度洗脱的方式, 来保障样品在分析过程中的稳定性。通常情况下, 样品被引入具有高极性溶剂比例的色谱柱中, 之后通过增加弱极性溶剂的比例, 将目标物逐渐从色谱柱中洗脱。值得注意的是, 疏水分子与固定相结合更强烈, 保留时间更长, 因而需要更高浓度的弱极性溶剂来洗脱, 但随着弱极性溶剂比例的迅速增加, 一方面提高了HPLC分离的效率, 另一方面也可能导致检测过程中测试峰的重叠[46]。
三乙胺、三溴乙酸和十二烷基硫酸钠等离子对试剂也是影响FQs保留时间的因素之一, 它们的存在一定程度上延长了色谱柱的平衡时间, 但能促进FQs与固定相的相互作用, 从而提高分离效果。色谱柱性质、离子对试剂、缓冲液和pH值等都会影响色谱峰的形状, 在调节pH、添加缓冲液等均不能抑制色谱峰的拖尾效应时, 流动相中添加的离子对试剂显得尤为重要, 将大大改善这一效应。
3.2 超高效液相色谱(UHPLC)超高效液相色谱在优化的低分散高压液相色谱系统中填充2 μm全多孔颗粒或3 μm核壳颗粒, 从而实现了快速和高分辨率的FQs分离, UHPLC已成为一种广泛使用的FQs快速分离方法, 逐渐取代了传统的HPLC。UHPLC具有更大的颗粒表面积、更短的柱长, 以及更高的操作压力和流动相流速等特点, 从而显著提高了FQs分离的效率和效果[66]。Richardson等[68]指出UHPLC色谱柱的小粒径增加了分离过程中的压力, 进而提高了FQs分离的分辨率和灵敏度, 获得更窄的测试峰。
UHPLC已广泛应用于FQs分离检测, Freitas等[69]通过UHPLC-MS的方法测定了金头鲷中的FQs, 指出该方法具有分离度好、灵敏度和分辨率高、色谱分析时间短的优点。Li等[70]改进了一种UHPLC-MS分析检测方法, 分离和测定了对虾中的21种抗生素, 包括8种FQs, 获得了良好的检测效果。Xie等[71]应用UHPLC-MS技术检测了珠江口水体、沉积物和水生生物中FQs等多种目标物, 检测限范围分别为0.1~0.3 ng/L、0.07~0.2 ng/g和0.01~1.9 ng/g。
3.3 检测方法经HPLC和UHPLC分离后, 样品往往通过质谱[46]和荧光检测器进行FQs的定量检测[45]。其中MS可以同时检测包括FQs在内的多种抗生素, 具有高灵敏度和选择性等特点, 而FLD利用了FQs的光学特性, 具有高度特异性和敏感性, 受样品基质干扰小等特点。在实际应用中, MS和FLD往往与HPLC或UHPLC串联使用, 即经过HPLC和UHPLC分离后的样品, 通过联机直接自动进入MS或FLD进行检测, 提高了检测FQs的效率[72]。
FQs的LC-MS分析一般采用电喷雾电离的正电离模式, 多反应监测模式(MRM)监测, 这是由于FQs结构中存在胺基和酮基, 这些基团在电喷雾电离的正电离模式下很容易发生质子化, 形成带正电荷的分子离子[M+H]+[72]。研究发现, 碰撞后观察到LEV、吉米沙星的主要产物离子对应于目标离子羧基上CO2的损失, GAT的产物离子由H2O或CO2的损失形成[66]。三重四极杆(triple quadrupole, QqQ)是应用最广泛的MS仪器, 其在检测浓度较高的目标物时具有优越的选择性和灵敏度, 但由于仪器分辨率较低, QqQ只能监测目标化合物的离散列表。在分析复杂基质中的痕量目标物时, QqQ质谱的选择性往往不足, 先进的高分辨率质谱作为一种有潜力的替代方法, 已被用于FQs的分析, 能够准确检测目标物[35]。此外, 与QqQ有限的预先选择离子不同, 飞行时间质谱(time of flight-mass spectrometry, TOF-MS)可以通过全扫描数据, 同时分析无限个化合物。然而, TOF-MS也存在一定的不足, 虽然它可以得到精确的数据, 但不能提供MS所需的选择性。为了弥补选择性差的缺点, TOF通常耦合四极杆成为Q-TOF, 四极杆作为一个质量过滤器, 在样品进入TOF-MS之前, 更有针对性地选择目标物的前体离子, 使其能够为前体离子和产物离子提供精确的质量[73]。
LC-FLD也是一种常用的FQs分析检测方法。FLD的特异性高, 受样品基质干扰小, 色谱图干净, 具有高特异性和灵敏度, 可简单快速地进行FQs的检测[45]。Ziarrusta等[46]指出LC-FLD在检测FQs时具有速度快、通量大、回收率高、精度准和有机溶剂消耗少等特点, 他们使用LC-FLD测定了鱼类的ENR、NOR等FQs, 检测限范围为0.1~6 ng/g, 回收率为93%~109%。选择目标物的激发波长和发射波长是LC-FLD方法的一个重要步骤, 为目标物的测定提供了更高的灵敏度和分辨率[46]。Zhou等[57]报道了水体中FQs检测的最常用激发波长为278 nm或280 nm, 发射波长为445 nm或450 nm。Payán等[74]进一步明确了各类FQs的激发波长和发射波长: NOR为278 nm和445 nm, CIP、OFL和ENR为280 nm和456 nm, MAR为300 nm和515 nm, FLU为315 nm和368 nm。此外, 研究表明目标物的荧光发射强度受基质pH的影响, pH较低时, 目标物的荧光强度和响应信号较高; 随着pH的增加, 荧光强度逐渐降低[68]。
4 研究展望近年来, 不同环境样品中FQs样品前处理和分离检测技术不断发展, 有效降低了样品的基质效应, 显著提高了FQs检测的效率、灵敏度和回收率等。在样品前处理方面, 不同环境样品中的FQs经过萃取后, 通过SPE、QuEChERS和MSPE等成熟技术进行净化和浓缩。在分离和检测方面, 常用的技术手段是在HPLC和UHPLC等方法对FQs进行分离后, 串联MS和FLD对FQs进行定性和定量分析检测。此外, 近年来新开发的免疫分析法、生物传感器技术等在快速分离和现场监测等方面展现了良好的应用前景, 但这些方法和技术尚需改进和完善。不同环境样品中FQs样品前处理和分析检测技术的研究应重点关注以下几个方面:
(1) 海洋不同介质中FQs的样品前处理与分离检测。目前FQs的样品前处理与分离检测技术的研究与应用主要集中在食品领域, 而海洋领域涉及较少。海水、沉积物和生物体样品具有组成复杂、盐分高、干扰因素多等特点, 不仅使得样品前处理过程费时费力, 也一定程度上影响了分离和检测的效率、灵敏度和回收率。针对海洋环境的特殊性, 建立和优化针对海洋不同介质中FQs样品的自动SPE技术显得尤为重要。
(2) 新型萃取吸附剂的开发。FQs的净化与浓缩是样品前处理的关键环节, 而萃取吸附剂则对确保FQs净化与浓缩质量和精度至关重要。目前的萃取吸附剂在经济性、特异性、萃取时间、可操作性等方面存在一定的不足, 而新型萃取吸附剂的开发和应用将弥补这方面的缺陷。
| [1] |
BHATT S, CHATTERJEE S. Fluoroquinolone antibiotics: Occurrence, mode of action, resistance, environmental detection, and remediation–A comprehensive review[J]. Environmental Pollution, 2022, 315: 120440. DOI:10.1016/j.envpol.2022.120440 |
| [2] |
SODHI K K, SINGH D K. Insight into the fluoroquinolone resistance, sources, ecotoxicity, and degradation with special emphasis on ciprofloxacin[J]. Journal of Water Process Engineering, 2021, 43: 102218. DOI:10.1016/j.jwpe.2021.102218 |
| [3] |
ZHANG Z C, CHENG H F. Recent development in sample preparation and analytical techniques for determination of quinolone residues in food products[J]. Critical Reviews in Analytical Chemistry, 2017, 47(3): 223-250. DOI:10.1080/10408347.2016.1266924 |
| [4] |
KHATIBI S A, HAMIDI S, SIAHI-SHADBAD M R. Current trends in sample preparation by solid-phase extraction techniques for the determination of antibiotic residues in foodstuffs: a review[J]. Critical Reviews in Food Science and Nutrition, 2021, 61(20): 3361-3382. DOI:10.1080/10408398.2020.1798349 |
| [5] |
ZHANG C Y, DENG Y C, ZHENG J F, et al. The application of the QuEChERS methodology in the determination of antibiotics in food: A review[J]. TRAC Trends in Analytical Chemistry, 2019, 118: 517-537. DOI:10.1016/j.trac.2019.06.012 |
| [6] |
李倩, 王甲, 张玉洁, 等. 动物性食品中喹诺酮类药物残留检测方法研究进展[J]. 食品安全质量检测学报, 2021, 12(8): 3016-3022. LI Qian, WANG Jia, ZHANG Yujie, et al. Research progress on determination methods of quinolone residues in animal food[J]. Journal of Food Safety and Quality, 2021, 12(8): 3016-3022. |
| [7] |
WU M H, QUE C J, XU G, et al. Occurrence, fate and interrelation of selected antibiotics in sewage treatment plants and their receiving surface water[J]. Ecotoxicology and Environmental Safety, 2016, 132: 132-139. DOI:10.1016/j.ecoenv.2016.06.006 |
| [8] |
温丽联, 宋金明, 李学刚, 等. 氟喹诺酮类合成药物的生物地球化学行为及生态环境效应[J]. 应用生态学报, 2023, 34(6): 1680-1692. WEN Lilian, SONG Jinming, LI Xuegang, et al. Biogeochemical behavior and ecological environm-ental effects of fluoroquinolones[J]. Chinese Journal of Applied Ecology, 2023, 34(6): 1680-1692. |
| [9] |
CUPRYS A, PULICHARLA R, BRAR S K, et al. Fluoroquinolones metal complexation and its environmental impacts[J]. Coordination Chemistry Reviews, 2018, 376: 46-61. DOI:10.1016/j.ccr.2018.05.019 |
| [10] |
ZHU Y J, HE P F, HU H M, et al. Determination of quinolone antibiotics in environmental water using automatic solid-phase extraction and isotope dilution ultra-performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B, 2022, 1208: 123390. DOI:10.1016/j.jchromb.2022.123390 |
| [11] |
卫承芳, 李佳乐, 孙占学, 等. 水-土壤环境中抗生素污染现状及吸附行为研究进展[J]. 生态毒理学报, 2022, 17(3): 385-399. WEI Chengfang, LI Jiale, SUN Zhanxue, et al. Research progress of antibiotic pollution and adsorption behavior in water-soil environment[J]. Asian Journal of Ecotoxicology, 2022, 17(3): 385-399. |
| [12] |
董晓, 李兆新, 孙晓杰, 等. 固相萃取-液相色谱串联质谱法同时测定养殖海水中17种喹诺酮类药物[J]. 渔业科学进展, 2017, 38(6): 127-138. DONG Xiao, LI Zhaoxin, SUN Xiaojie, et al. Simultaneous determination of seventeen quinolones in aquaculture seawater using solid-phase extraction and liquid chromatography tandem mass spectrometry[J]. Progress in Fishiery Sciences, 2017, 38(6): 127-138. |
| [13] |
DU J, ZHAO H X, WANG Y, et al. Presence and environmental risk assessment of selected antibiotics in coastal water adjacent to mariculture areas in the Bohai Sea[J]. Ecotoxicology and Environmental Safety, 2019, 177: 117-123. DOI:10.1016/j.ecoenv.2019.03.075 |
| [14] |
LI S, SHI W Z, LI H M, et al. Antibiotics in water and sediments of rivers and coastal area of Zhuhai City, Pearl River estuary, south China[J]. Science of the Total Environment, 2018, 636: 1009-1019. DOI:10.1016/j.scitotenv.2018.04.358 |
| [15] |
DU J, ZHAO H X, LIU S S, et al. Antibiotics in the coastal water of the South Yellow Sea in China: occurrence, distribution and ecological risks[J]. Science of the Total Environment, 2017, 595: 521-527. DOI:10.1016/j.scitotenv.2017.03.281 |
| [16] |
LI W H, SHI Y L, GAO L H, et al. Investigation of antibiotics in mollusks from coastal waters in the Bohai Sea of China[J]. Environmental Pollution, 2012, 162: 56-62. DOI:10.1016/j.envpol.2011.10.022 |
| [17] |
ZHANG Y P, NIU Z G, ZHANG Y, et al. Occurrence of intracellular and extracellular antibiotic resistance genes in coastal areas of Bohai Bay (China) and the factors affecting them[J]. Environmental Pollution, 2018, 236: 126-136. DOI:10.1016/j.envpol.2018.01.033 |
| [18] |
LI F F, WEN D H, BAO Y Y, et al. Insights into the distribution, partitioning and influencing factors of antibiotics concentration and ecological risk in typical bays of the East China Sea[J]. Chemosphere, 2022, 288: 132566. DOI:10.1016/j.chemosphere.2021.132566 |
| [19] |
CHEN H, LIU S, XU X R, et al. Antibiotics in the coastal environment of the Hailing Bay region, South China Sea: Spatial distribution, source analysis and ecological risks[J]. Marine Pollution Bulletin, 2015, 95(1): 365-373. DOI:10.1016/j.marpolbul.2015.04.025 |
| [20] |
WU Q, XIAO S K, PAN C G, et al. Occurrence, source apportionment and risk assessment of antibiotics in water and sediment from the subtropical Beibu Gulf, South China[J]. Science of the Total Environment, 2022, 806: 150439. DOI:10.1016/j.scitotenv.2021.150439 |
| [21] |
WANG N, SHEN W H, ZHANG S H, et al. Occurrence and distribution of antibiotics in coastal water of the Taizhou Bay, China: impacts of industrial activities and marine aquaculture[J]. Environmental Science and Pollution Research, 2022, 29(54): 81670-81684. DOI:10.1007/s11356-022-21412-6 |
| [22] |
ZHANG R L, PEI J Y, ZHANG R J, et al. Occurrence and distribution of antibiotics in mariculture farms, estuaries and the coast of the Beibu Gulf, China: Bioconcentration and diet safety of seafood[J]. Ecotoxicology and Environmental Safety, 2018, 154: 27-35. DOI:10.1016/j.ecoenv.2018.02.006 |
| [23] |
BIEL-MAESO M, BAENA-NOGUERAS R M, CORADA-FERNÁNDEZ C, et al. Occurrence, distribution and environmental risk of pharmaceutically active compounds (PhACs) in coastal and ocean waters from the Gulf of Cadiz (SW Spain)[J]. Science of the Total Environment, 2018, 612: 649-659. DOI:10.1016/j.scitotenv.2017.08.279 |
| [24] |
KIM H Y, LEE I S, OH J E. Human and veterinary pharmaceuticals in the marine environment including fish farms in Korea[J]. Science of the Total Environment, 2017, 579: 940-949. DOI:10.1016/j.scitotenv.2016.10.039 |
| [25] |
ROOSE-AMSALEG C, LAVERMAN A M. Do antibiotics have environmental side-effects? Impact of synthetic antibiotics on biogeochemical processes[J]. Environmental Science and Pollution Research, 2016, 23: 4000-4012. DOI:10.1007/s11356-015-4943-3 |
| [26] |
BITAS D, KABIR A, LOCATELLI M, et al. Food sample preparation for the determination of sulfonamides by high-performance liquid chromatography: State-of-the-art[J]. Separations, 2018, 5(2): 31. DOI:10.3390/separations5020031 |
| [27] |
张志超, 程和发. 环境介质中喹诺酮类抗生素的前处理与检测方法研究进展[J]. 环境化学, 2019, 38(1): 1-22. ZHANG Zhichao, CHENG Hefa. Recent development in sample pretreatment and detection methods for the determination of quinolones in environmental matrices[J]. Environment Chemistry, 2019, 38(1): 1-22. |
| [28] |
XIE H J, WANG X P, CHEN J E, et al. Occurrence, distribution and ecological risks of antibiotics and pesticides in coastal waters around Liaodong Peninsula, China[J]. Science of the Total Environment, 2019, 656: 946-951. DOI:10.1016/j.scitotenv.2018.11.449 |
| [29] |
LI F F, CHEN L J, CHEN W D, et al. Antibiotics in coastal water and sediments of the East China Sea: distribution, ecological risk assessment and indicators screening[J]. Marine Pollution Bulletin, 2020, 151: 110810. DOI:10.1016/j.marpolbul.2019.110810 |
| [30] |
SERRA-COMPTE A, PIKKEMAAT M G, ELFERINK A, et al. Combining an effect-based methodology with chemical analysis for antibiotics determination in wastewater and receiving freshwater and marine environment[J]. Environmental Pollution, 2021, 271: 116313. DOI:10.1016/j.envpol.2020.116313 |
| [31] |
ZHANG R J, ZHANG R L, YU K F, et al. Occurrence, sources and transport of antibiotics in the surface water of coral reef regions in the South China Sea: Potential risk to coral growth[J]. Environmental Pollution, 2018, 232: 450-457. DOI:10.1016/j.envpol.2017.09.064 |
| [32] |
LU J, WU J, ZHANG C, et al. Occurrence, distribution, and ecological-health risks of selected antibiotics in coastal waters along the coastline of China[J]. Science of the Total Environment, 2018, 644: 1469-1476. DOI:10.1016/j.scitotenv.2018.07.096 |
| [33] |
ANDREU V, BLASCO C, PIC Y. Analytical strategies to determine quinolone residues in food and the environment[J]. TRAC Trends in Analytical Chemistry, 2007, 26(6): 534-556. DOI:10.1016/j.trac.2007.01.010 |
| [34] |
HE Z Y, WANG Y H, XU Y P, et al. Determination of antibiotics in vegetables using quechers-based method and liquid chromatography-quadrupole linear ion trap mass spectrometry[J]. Food Analytical Methods, 2018, 11(10): 2857-2864. DOI:10.1007/s12161-018-1252-8 |
| [35] |
GONZÁLEZ-GAYA B, CHERTA L, NOZAL L, et al. An optimized sample treatment method for the determination of antibiotics in seawater, marine sediments and biological samples using LC-TOF/MS[J]. Science of the Total Environment, 2018, 643: 994-1004. DOI:10.1016/j.scitotenv.2018.06.079 |
| [36] |
PADRÓN-SANZ C, HALKO R, SOSA-FERRERA Z, et al. Combination of microwave assisted micellar extraction and liquid chromatography for the determination of organophosphorous pesticides in soil samples[J]. Journal of Chromatography A, 2005, 1078(1/2): 13-21. |
| [37] |
吕敏, 陈令新. 近海环境中抗生素分析样品前处理技术的研究进展[J]. 色谱, 2020, 38(1): 95-103. LV Min, CHEN Lingxin. Advances in sample pretreatment techiniques for analysis of antibotics in the coastal environment[J]. Chinese Journal of Chromatography, 2020, 38(1): 95-103. |
| [38] |
DORIVAL-GARCÍA N, ZAFRA-GÓMEZ A, CANTA RERO S, et al. Simultaneous determination of 13 quinolone antibiotic derivatives in wastewater samples using solid–phase extraction and ultra performance liquid chromatography–tandem mass spectrometry[J]. Microchemical Journal, 2013, 106: 323-333. DOI:10.1016/j.microc.2012.09.002 |
| [39] |
LI W H, SHI Y L, GAO L H, et al. Occurrence of antibiotics in water, sediments, aquatic plants, and animals from Baiyangdian Lake in North China[J]. Chemosphere, 2012, 89(11): 1307-1315. DOI:10.1016/j.chemosphere.2012.05.079 |
| [40] |
TIAN C, REN X, HE M, et al. Core-shell magnetic porous organic polymer for magnetic solid-phase extraction of fluoroquinolone antibiotics in honey samples followed by high-performance liquid chromatography with fluorescence detection[J]. Journal of Separation Science, 2022, 45(4): 874-882. DOI:10.1002/jssc.202100678 |
| [41] |
SPELTINI A, STURINI M, MARASCHI F, et al. Analytical methods for the determination of fluoroquinolones in solid environmental matrices[J]. TrAC Trends in Analytical Chemistry, 2011, 30(8): 1337-1350. DOI:10.1016/j.trac.2011.04.011 |
| [42] |
WANG H, ZHAO X Y, XU J W, et al. Determination of quinolones in environmental water and fish by magnetic metal organic frameworks based magnetic solid-phase extraction followed by high-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2021, 1651: 462286. DOI:10.1016/j.chroma.2021.462286 |
| [43] |
AUFARTOVÁ J, BRABCOVÁ I, TORRES-PADRÓN M E, et al. Determination of fluoroquinolones in fishes using microwave-assisted extraction combined with ultra-high performance liquid chromatography and fluorescence detection[J]. Journal of Food Composition and Analysis, 2017, 56: 140-146. DOI:10.1016/j.jfca.2016.12.012 |
| [44] |
MONTESDEOCA-ESPONDA S, SOSA-FERRERA Z, SANTANA-RODRÍGUEZ J J. Combination of microwave-assisted micellar extraction with liquid chromatography tandem mass spectrometry for the determination of fluoroquinolone antibiotics in coastal marine sediments and sewage sludges samples[J]. Biomedical Chromatography, 2012, 26(1): 33-40. DOI:10.1002/bmc.1621 |
| [45] |
LOMBARDO-AGÜÍ M, GARCÍA-CAMPAÑA A M, CRUCES-BLANCO C, et al. Determination of quinolones in fish by ultra-high performance liquid chromatography with fluorescence detection using QuEChERS as sample treatment[J]. Food Control, 2015, 50: 864-868. DOI:10.1016/j.foodcont.2014.10.027 |
| [46] |
ZIARRUSTA H, VAL N, DOMINGUEZ H, et al. Determination of fluoroquinolones in fish tissues, biological fluids, and environmental waters by liquid chromatography tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2017, 409(27): 6359-6370. DOI:10.1007/s00216-017-0575-4 |
| [47] |
MASIÁ A, SUAREZ-VARELA M M, LLOPIS-GONZALEZ A, et al. Determination of pesticides and veterinary drug residues in food by liquid chromatography-mass spectrometry: A review[J]. Analytica Chimica Acta, 2016, 936: 40-61. DOI:10.1016/j.aca.2016.07.023 |
| [48] |
CZYRSKI A. Analytical methods for determining third and fourth generation fluoroquinolones: A review[J]. Chromatographia, 2017, 80(2): 181-200. DOI:10.1007/s10337-016-3224-8 |
| [49] |
仇玉洁, 李晓月, 李博恩, 等. 水产品中氟喹诺酮类药物残留检测技术研究进展[J]. 湖南农业科学, 2018, 1: 115-118. QIU Yujie, LI Xiaoyue, LI Boen, et al. Progress in detection of fluoroquinolone residues in aquatic products[J]. Hunan Agricultural Sciences, 2018, 1: 115-118. DOI:10.16498/j.cnki.hnnykx.2018.001.032 |
| [50] |
GARCÍA M D G, GALLEGOS A B, VALVERDE R S, et al. Determination of (fluoro) quinolones in environmental water using online preconcentration with column switching linked to large sample volumes and fluorescence detection[J]. Journal of Separation Science, 2012, 35(7): 823-831. DOI:10.1002/jssc.201100911 |
| [51] |
JIANG H L, LI N, CUI L, et al. Recent application of magnetic solid phase extraction for food safety analysis[J]. TRAC Trends in Analytical Chemistry, 2019, 120: 115632. DOI:10.1016/j.trac.2019.115632 |
| [52] |
包懿, 刘斌, 刘洋, 等. 食品中喹诺酮类药物残留检测方法的研究进展[J]. 分析化学, 2022, 50(10): 1444-1455. BAO Yi, LIU Bin, LIU Yang, et al. Research advances of detection methods for quinolones residues in foods[J]. Chinese Journal of Analytical Chemistry, 2022, 50(10): 1444-1455. DOI:10.19756/j.issn.0253-3820.221292 |
| [53] |
PÉREZ-RODRÍGUEZ M, PELLERANO R G, PEZZA L, et al. An overview of the main foodstuff sample preparation technologies for tetracycline residue determination[J]. Talanta, 2018, 182: 1-21. DOI:10.1016/j.talanta.2018.01.058 |
| [54] |
王萌, 李佳乐, 董一慧, 等. 水体中抗生素前处理及检测方法研究进展[J]. 现代化工, 2023, 43(3): 240-244. WANG Meng, LI Jiale, DONG Yihui, et al. Research progress on pretreatment and detection methods for antibiotics in water[J]. Modern Chemical Industry, 2023, 43(3): 240-244. |
| [55] |
SOUSA J, ALVES G, ABRANTES J, et al. Analytical methods for determination of new fluoroquinolones in biological matrices and pharmaceutical formulations by liquid chromatography: a review[J]. Analytical and Bioanalytical Chemistry, 2012, 403(1): 93-129. DOI:10.1007/s00216-011-5706-8 |
| [56] |
PEIXOTO P S, TÓTH I V, SEGUNDO M A, et al. Fluoroquinolones and sulfonamides: features of their determination in water. A review[J]. International Journal of Environmental Analytical Chemistry, 2016, 96(2): 185-202. DOI:10.1080/03067319.2015.1128539 |
| [57] |
ZHOU L J, YING G G, LIU S, et al. Simultaneous determination of human and veterinary antibiotics in various environmental matrices by rapid resolution liquid chromatography–electrospray ionization tandem mass spectrometry[J]. Journal of Chromatography A, 2012, 1244: 123-138. DOI:10.1016/j.chroma.2012.04.076 |
| [58] |
YE Z Q, WEINBERG H S, MEYER M T. Trace analysis of trimethoprim and sulfonamide, macrolide, quinolone, and tetracycline antibiotics in chlorinated drinking water using liquid chromatography electrospray tandem mass spectrometry[J]. Analytical Chemistry, 2007, 79(3): 1135-1344. DOI:10.1021/ac060972a |
| [59] |
KOLE P L, VENKATESH G, KOTECHA J, et al. Recent advances in sample preparation techniques for effective bioanalytical methods[J]. Biomedical Chromatography, 2011, 25(1/2): 199-217. |
| [60] |
SHEN F, XU Y J, WANG Y, et al. Rapid and ultra-trace levels analysis of 33 antibiotics in water by on-line solid-phase extraction with ultra-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2022, 1677: 463304. |
| [61] |
REJCZAK T, TUZIMSKI T. A review of recent developments and trends in the QuEChERS sample preparation approach[J]. Open Chemistry, 2015, 13(1): 980-1010. |
| [62] |
YE S B, HUANG Y, LIN D Y. QuEChERS sample pre-processing with UPLC–MS/MS: A method for detecting 19 quinolone-based veterinary drugs in goat's milk[J]. Food Chemistry, 2022, 373: 131466. |
| [63] |
LI H F, YIN J G, LIU Y M, et al. Effect of protein on the detection of fluoroquinolone residues in fish meat[J]. Journal of Agricultural and Food Chemistry, 2012, 60(7): 1722-1727. |
| [64] |
ZHENG H B, MO J Z, ZANG Y, et al. Facile synthesis of magnetic molecularly imprinted polymers and its application in magnetic solid phase extraction for fluoroquinolones in milk samples[J]. Journal of Chromatography A, 2014, 1329: 17-23. |
| [65] |
HE X, WANG G N, YANG K, et al. Magnetic graphene dispersive solid phase extraction combining high performance liquid chromatography for determination of fluoroquinolones in foods[J]. Food Chemistry, 2017, 221: 1226-1231. |
| [66] |
KIM C, RYU H D, CHUNG E G, et al. A review of analytical procedures for the simultaneous determination of medically important veterinary antibiotics in environmental water: sample preparation, liquid chromatography, and mass spectrometry[J]. Journal of Environmental Management, 2018, 217: 629-645. |
| [67] |
王锦, 叶开晓, 田艳, 等. 固相萃取-高效液相色谱-串联质谱法同时测定环境水样中22种抗生素[J]. 色谱, 2023, 41(3): 241-249. WANG Jin, YE Kaixiao, TIAN Yan, et al. Simultaneous determination of 22 antibotics environmental water samples by solid phase extraction high performance liquid chromatography tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2023, 41(3): 241-249. |
| [68] |
RICHARDSON S D. Environmental mass spectrometry: emerging contaminants and current issues[J]. Analytical Chemistry, 2012, 84(2): 747-778. |
| [69] |
FREITAS A, LESTON S, ROSA J, et al. Multi-residue and multi-class determination of antibiotics in gilthead sea bream (Sparus aurata) by ultra high-performance liquid chromatography-tandem mass spectrometry[J]. Food Additives & Contaminants: Part A, 2014, 31(5): 817-826. |
| [70] |
LI H, KIJAK P J. Development of a quantitative multiclass/multiresidue method for 21 veterinary drugs in shrimp[J]. Journal of AOAC International, 2011, 94(2): 394-406. |
| [71] |
XIE H W, HAO H S, XU N, et al. Pharmaceuticals and personal care products in water, sediments, aquatic organisms, and fish feeds in the Pearl River Delta: Occurrence, distribution, potential sources, and health risk assessment[J]. Science of the Total Environment, 2019, 659: 230-239. |
| [72] |
MORALES-GUTIÉRREZ F, HERMO M, BARBOSA J, et al. High-resolution mass spectrometry applied to the identification of transformation products of quinolones from stability studies and new metabolites of enrofloxacin in chicken muscle tissues[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 92: 165-176. |
| [73] |
QUESADA S P, PASCHOAL J A R, REYES F G. A simple method for the determination of fluoroquinolone residues in tilapia (Oreochromis niloticus) and pacu (Piaractus mesopotamicus) employing LC-MS/MS QToF[J]. Food Additives & Contaminants: Part A, 2013, 30(5): 813-825. |
| [74] |
PAYÁN M R, LÓPEZ M Á B, FERNÁNDEZ-TORRES R, et al. Hollow fiber-based liquid phase microextraction (HF-LPME) as a new approach for the HPLC determination of fluoroquinolones in biological and environmental matrices[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 55(2): 332-341. |
 2023, Vol. 47
2023, Vol. 47


