文章信息
- 高文婧, 曲宝晓, 袁华茂, 宋金明. 2023.
- GAO Wen-jing, QU Bao-xiao, YUAN Hua-mao, SONG Jin-ming. 2023.
- 近海海洋酸化对痕量元素在沉积物-海水界面处生物地球化学特性的影响研究
- Effect of offshore ocean acidification on the biogeochemical properties of trace elements at the sediment–seawater interface
- 海洋科学, 47(9): 119-130
- Marine Sciences, 47(9): 119-130.
- http://dx.doi.org/10.11759/hykx20221113002
-
文章历史
- 收稿日期:2022-11-13
- 修回日期:2023-03-09
2. 中国科学院海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
4. 中国科学院海洋大科学中心, 山东 青岛 266071
2. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
自18世纪中叶工业革命以来, 大气CO2含量不断升高, 海洋作为地球的主要碳汇之一, 大量地吸收人类排放的CO2, 从而导致全球海洋平均pH下降了0.1[1], 这意味着海水H+浓度相对工业革命之前增加了近30%[2]。根据政府间气候变化专门委员会(IPCC)第五次评估报告, 随着海洋从大气中吸收的CO2增多, 海洋水体将越来越酸化, 到2100年H+浓度可能会相比目前再增加1~3倍, 如此快速的酸化在过去3亿年间从未有过[3]。2003年, Caldeira和Wickeet首次将这种由于海水吸收过多CO2而导致的pH降低、CO2分压增加、CO32−浓度降低的现象称为“海洋酸化”(ocean acidification)[4], 此后海洋酸化现象及其生态环境效应受到了科学界的广泛关注。大量的研究已经证实, 海洋酸化将引发包括化学环境(碳酸盐饱和度下降), 物理条件(噪音水平升高)及生物代谢(钙质壳形成困难等)各方面的一系列后果[5], 使得海洋生态环境变得更加复杂, 更加具有不确定性, 海洋酸化已成为驱动全球变化新的重要因素[6-8]。
海水中H+和CO32−是影响海洋生物地球化学过程的关键因子, 在海洋酸化的背景下, H+和CO32−浓度的降低将会深刻改变包括生物生长繁殖、生态环境健康、物质能量循环等在内的诸多过程。在以上列举的三个过程里, 痕量元素(trace elements)作为表征指标和控制因素始终贯穿其中。在海洋环境里, 痕量元素具有多变的赋存状态和复杂的循环路径, 对维持海洋生物的生命代谢, 推动海洋生源要素的循环转化, 维持生态环境与地质过程健康运转都具有十分重要的作用。痕量元素经由陆源输入和大气沉降等途径进入近海水体, 在经历一系列生物地球化学过程后, 最终进入沉积物被埋藏。在整个输入和埋藏的过程中, 沉积物—海水界面作为多种生物地球化学过程的主要场所, 对痕量元素的迁移及循环具有十分重要的作用。深入研究海洋酸化条件下痕量元素在界面处的平衡分配及在沉积物-间隙水-上覆水间的溶解释放、迁移转化, 对开展痕量元素对海洋酸化响应及控制机理的研究, 解答海洋酸化过程对沉积物-水体环境中的痕量元素产生的生态学效应至关重要。本文首先简要介绍海洋酸化的成因、发展与变化, 然后系统总结痕量元素在近海沉积物-海水界面处所发生的主要生物地球化学过程, 重点从赋存状态、迁移扩散和生物可利用性等角度分析海洋酸化对痕量元素的影响, 阐释痕量元素在未来海洋酸化背景下可能的演变趋势, 并对目前研究中存在的问题和今后的研究方向进行讨论和展望。
1 海洋酸化的化学过程与演变趋势碳是构成生命体的基本元素之一, 在全球生物地球化学循环中扮演着决定性角色。海洋是生命的摇篮, 在维持全球碳平衡以及调节气候变化方面承担着重要的角色。工业革命之前, 海洋中的碳收支主要受自然过程的影响, 海洋表层水体维持在平均pH约为8.2的碱性环境。然而工业革命以后, 随着化石燃料的广泛使用, 人为排放的大量CO2进入大气, 其中约有超过四分之一的CO2通过海-气交换作用进入海洋。
大气CO2进入海水后, 可持续发生以下化学反应:
| CO2(g)⇌CO2(aq), | (1) |
| CO2(aq)+H2O⇌H2CO3, | (2) |
| H2CO3⇌H++HCO−3, | (3) |
| HCO−3⇌H++CO2−3. | (4) |
简言之, 气体CO2(g)首先溶解于水, 成为溶解态CO2(aq), 紧接着CO2(aq)与水反应, 形成碳酸(H2CO3), 碳酸可发生两步解离反应, 分别生成H+、HCO3−和CO32−。以上各步的产物中CO2(aq)、H2CO3、HCO3−和CO32−的总和称为溶解无机碳(dissolved inorganic carbon, DIC)。在目前的海水pH条件下(pH=8.1), HCO3−约占DIC的90%, CO32−约占DIC的9%, 其余部分CO2(aq)和H2CO3总共约占1%, 两者又合称为游离态CO2(CO2*)。
当大气CO2浓度不断升高时, 反应式(1)将会持续向反应式(4)移动, 使得海水中的H+和HCO3−随之不断增加。与此同时, 不断溶解产生的CO2(aq)还会与CO32−发生如下反应:
| CO2(g)+CO32−+H2O⇌2HCO3−, | (5) |
使HCO3−进一步增加而CO32−进一步降低。H+浓度的升高以及CO32−浓度的降低, 均可促使碳酸钙CaCO3溶解
| CaCO3⇌Ca2++CO32−, | (6) |
以上就是海洋酸化的基本过程(见图 1)。
 |
| 图 1 海洋酸化基本过程示意图 Fig. 1 Schematic diagram of the basic process of ocean acidification |
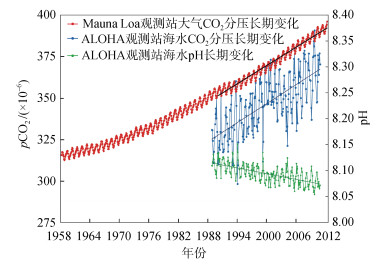
位于北太平洋夏威夷Mauna Loa观测站的CO2时间序列观测首次用连续的观测数据证实: 大气CO2含量在近50多年来持续上升; 而同时期同纬度的ALOHA观测站的结果则证实: 海洋表层pH在持续下降, 海洋表层CO2分压在不断升高(见图 2)[9]。以上是对超量CO2引发海洋酸化的强力证明。研究显示, 在过去的200万年里, 海洋表层pH均维持在8.2左右, 但自工业革命至今, 海洋表层pH已经下降了约0.1。如果人为CO2的排放速率仍维持在当前水平, 到2050年, 全球海洋表层pH将下降0.2, 到2100年将下降0.4[10-11]。不仅限于表层海洋, 海洋酸化同样会对深层海水产生影响。随着碳排放的持续加剧, 海洋酸化将逐渐从表层渗透到深层, 到2050年, 300 m深度处海水pH将下降约0.1, 到2300年, 这一深度的海水pH将进一步降低0.7, 届时3 000 m以浅的海水都将会出现酸化现象[4, 12]。
在海洋环境中, 沉积物-海水界面作为固液两相的物理分界, 实际上由海水、间隙水和沉积物三部分组成, 此界面处是海洋中物理、化学和生物特性变化最显著的区域。不同性质的陆源和海源碎屑与颗粒等首先在水体中聚集、沉降, 进而在沉积物表面堆积、埋藏, 整个过程将发生一系列的物理、生物和地球化学变化, 这些变化通常被统称为早期成岩作用[13]。伴随着早期成岩作用, 痕量元素在海水、间隙水和沉积物中将会发生形态的变化, 从而造成了其在不同介质间的迁移转化。需要特别指出的是, 由于学科范畴的差异和研究对象的不同, 不同学者对沉积物—海水界面的定义往往差别很大。本文主要关注近海环境中较为活跃的生物地球化学行为, 因此讨论的沉积物—海水界面仅表层沉积物(2 cm以内)。
2.1 赋存保留海洋中痕量元素的赋存状态是评判痕量元素迁移转化能力和生物可利用性的关键特性。越来越多的研究显示, 具备较强迁移转化能力并且能够以主要赋存状态直接对生物产生影响的痕量元素, 即“活性态(labile)”, 仅占总量很少的一部分, 但却几乎主导了痕量元素的生物作用和生态效应。本节将总结水体和沉积物中痕量元素的主要赋存状态及其变化特征。
海水中的痕量元素通过过滤操作(能否通过一定孔径的滤膜)被人为地分为溶解态(dissolved form)和颗粒态(particulate form)。随着研究的深入和技术的进步, 溶解态痕量元素又被分为自由离子态、无机络合态和有机络合态:
| [Men+]={Men+}+∑i{Men+}[Xi]+∑j{Men+}[Lj], | (7) |
式中
痕量元素易于与海水中的有机配体络合成为较稳定的络合物, 其络合强度一般用络合稳定常数β表示。痕量元素Me与有机配体L的络合反应及其络合稳定常数β的表达式为:
| Men++iLm−⇌MeL(n−i×m)i, | (8) |
| β=[MeL(n−i×m)i]/[Men+]/[Lm−]i. | (9) |
由于有机配体种类众多一般按照络合稳定常数β的大小将有机配体大体划分为两到三类(按研究惯例由强到弱可分别表示为L1, L2和L3等)。较强配体的络合稳定常数β1与较弱配体的络合稳定常数β2和β3可相差2~3个数量级。表 1总结了典型痕量元素在全球海水中的总体含量水平、相应有机配体含量与有机络合物稳定常数。
| 元素种类 | 元素含量 | 有机配体 | lgβ | 采样地点 | 参考文献 |
| Cd(Ⅱ) | 2~800 pmol/L | 100 pmol/L | 12 | 北太平洋 | [15] |
| Co(Ⅱ) | 10~100 pmol/L | 9~83 pmol/L | 11~16 | 北大西洋 | [16-18] |
| Cu(Ⅱ) | 1~10 nmol/L | 2~60 nmol/L | 8.5 | 北大西洋 | [19-22] |
| Fe(Ⅲ) | 0.2~8 nmol/L | 0.4~13 nmol/L | 19~23 | 大西洋、太平洋、地中海 | [23-26] |
| Ni(Ⅱ) | 1.7~4.3 nmol/L | 2~4 nmol/L | 17~19 | 大西洋 | [27] |
| Pb(Ⅱ) | 17~49 pmol/L | 200~500 pmol/L | 11 | 北太平洋 | [28] |
| Zn(Ⅱ) | 0.1~2 nmol/L | 1.2 nmol/L | 12 | 北太平洋 | [29] |
除有机配体之外, 海水中自由状态的痕量元素还会与无机配体形成无机配合物。虽然海水中存在含量极高的无机配体, 如Cl−、OH−、SO42−、CO32−等, 但因其与痕量元素的络合稳定常数远小于有机配体, 因此大多数痕量元素的无机络合物占总溶解态的比例较低。但也正是因为无机配体的络合稳定常数较低, 与OH−、SO42−、CO32−等配体络合的无机络合态痕量元素更易受到海洋酸化的影响, 而与Cl–络合的痕量金属无机配合则很少受到酸化的影响。根据痕量元素离子的热力学性质, Al3+、Be2+、Ga3+和In3+等主要与OH−络合; Cu2+和稀土元素等主要与CO32−络合; Ag+、Au+、Cd2+和Hg2+等主要与Cl−络合; Pb2+则可与多种无机配体络合[30]。以OH−和CO32−为例, 痕量元素Me与OH−和CO32−络合的反应式可总结为:
| Men++iH2O=Me(OH)n−ii+iH+, | (10) |
| Men++jCO2−3=Me(CO3)(n−2j)j. | (11) |
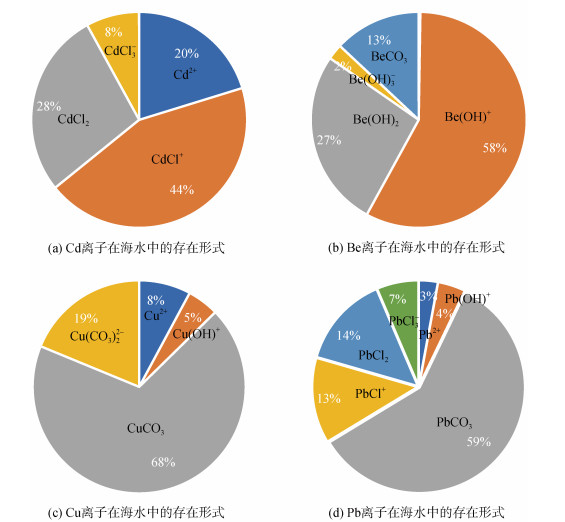
图 3以Cd, Be, Cu, Pb为例, 分别展示了典型痕量元素在海水中与无机配体的络合情况。从图中可以看出, Cd2+在海水中主要与Cl−络合, 其中CdCl+, CdCl2和CdCl3−分别占活性无机态金属总量的44%、8%和8%(图 3a)。Be2+则主要与OH–络合, 其中Be(OH)+占比58%, Be(OH)2占比27%(图 3b)。而Cu2+则主要与CO32−络合, CuCO3占68%, Cu(CO3) 22−占19%(图 3c)。Pb2+的主要无机络合形式为PbCO3, 占总活性无机态的59%, 但同时Pb2+还可以与Cl−生成3种形态的络合物, 分别是PbCl+、和PbCl3−, 这3种络合物总共占活性无机态的34%(图 3d)。
痕量元素在海洋水体中通过密切地参与生物地球化学反应, 广泛分布于纷杂的生物和化学载体之中, 实现了其从水体(液相)向颗粒(固相)的迁移转化。随着生物和非生物载体的沉降以及水体的运移输送, 溶解态与颗粒态的痕量元素通过“沉积物—海水”界面进入表层沉积物。沉积物—海水界面作为固相(沉积物)和液相(海水)的天然分界, 在极小的物理空间里完成了介质特性的转变, 因此沉积物—海水界面处的密度、粒度、pH、电位、溶解氧、元素活性等环境条件存在着十分剧烈的变化[31-32]。当水体和颗粒物将不同赋存状态且来源多样的痕量元素首次运移到沉积物表面时, 将会受到沉积物—海水界面处环境条件剧变的强烈影响, 在物理(噪音水平升高与物理扰动)、化学(碳酸盐饱和度下降)、生物(钙质壳形成困难)等过程的耦合作用下, 水体、颗粒物、间隙水和表层沉积物中的痕量元素将会在此界面处发生活跃的迁移转化, 这些变化通常会反复进行并持续一定时间, 直至环境条件最终稳定后, 相关痕量元素才会实现长久埋藏[33]。
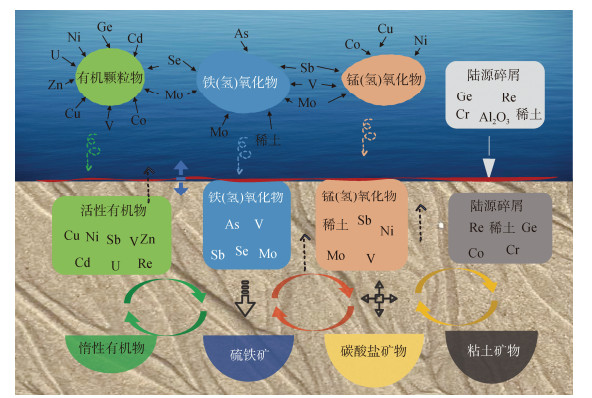
由于不同的痕量元素往往会参与特定的生物地球化学过程, 从而络合、吸附、包含于特定的配体和颗粒物之中[34], 因此痕量元素在沉积物—海水间的迁移转化实际上关键受控于痕量元素所参与的生物地球化学过程及其后续的运移输送介质(图 4)。从物质循环的角度来看, 由于Cd、Co、Cu、Mo和Ni等可密切参与生命代谢, 因而多存在于有机颗粒物中; As、Se、Sb和V等主要参与铁和锰的化学反应, 易存在于铁锰(氢)氧化物颗粒中; 而Cr、Ge和稀土元素等多直接来自于陆源物质, 所以主要存在于陆源碎屑中[35]。在沉积物—海水界面处, 伴随着有机物分解、硝酸盐还原、铁锰氧化物还原等早期成岩作用, 包含在上述颗粒态载体中的痕量元素将被释放进入上覆水和间隙水。进入上覆水的溶解态痕量元素部分会再次被生物利用, 或被颗粒态载体吸附[36], 然后通过沉降作用又回到沉积物—海水界面处。而进入间隙水的溶解态痕量元素则会与惰性有机物、自生铁硫化物(FeS, FeS2)、自生碳酸盐矿物和自生黏土矿物等结合, 并被长期埋藏。以上“吸附—沉降—释放(埋藏)”的过程反复在沉积物—海水界面发生, 构成了痕量元素的迁移转化。
有关海洋痕量元素的系统认识最早可追溯到1970s开展的GEOSECS(Geochemical Ocean Sections Study)计划[37], 而人们在更早以前就已经认识到CO2的加入将会导致海洋酸化, 但是有关海洋酸化与痕量元素相互作用的研究开展时间却并不太长。本节将在前面两节有关海洋酸化过程和痕量元素生物地球化学特性总结的基础上, 分析总结海洋酸化对痕量元素在沉积物—海水界面处生物地球化学特性的影响。
3.1 对赋存形态的影响痕量元素在海洋酸化条件下的存在形态及含量变化首先引起了人们的重视。前文的总结已表明, 痕量元素在海洋环境中并非仅以游离态存在, 而是多以无机或有机络合物的形式存在。酸化所引发的OH–和CO32–降低将使得与之络合的金属[Cu(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)、Pb(Ⅱ)、稀土等]更易解离, 进而对痕量金属在水体中的溶解度、吸附作用及氧化还原速率产生影响[30]。海水酸化所引发的氢离子、碳酸盐和氢氧化物浓度的变化会直接影响无机金属配合物的形态, 氢离子和游离态金属离子浓度的变化将影响金属配合物与溶解有机物的形态。由此评估海洋酸化对金属化学形态的影响程度可以为评估酸化对可被生物吸收的金属影响提供借鉴与支撑。
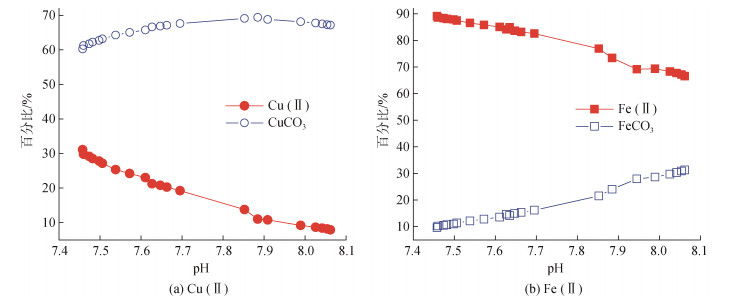
海洋环境中CO32–变化对Cu(Ⅱ)和Fe(Ⅱ)形态的影响在所有金属中都具有代表性。Millero等[30]的研究表明, 到2250年全球海水平均pH下降0.7时, CuCO3和FeCO3两种络合物的浓度均有不同程度的下降, 届时CuCO3将减少为现在浓度的90%, 而FeCO3则甚至减少为现在浓度的30%; 伴随着CO32–络合态金属含量的降低, 自由离子态金属含量则会增加, 其中Cu(Ⅱ)增加较高, 为目前的3.9倍, Fe(Ⅱ)也将增加为现在的1.3倍(图 5)。海洋酸化的另一个后果则是H+含量升高, 由于H+的正电荷效应将造成有机颗粒的表面吸附位点减少, 吸附金属能力下降, 从而抑制了有机配体的络合能力,从而改变痕量金属的有机络合形态[23]。例如Louis等[38]的研究认为, 较低的pH环境可能会使与Cu络合的有机配体位点的有效浓度降低25%; Gledhill等[39]通过建模研究了酸化对河口水体中Cu和Fe有机络合形态形成的影响, 模型结果表明随着pH值的降低, 这些金属的有机络合态浓度将减少, 无机态浓度将增加。上述过程均会使游离态金属(Mn+)绝对含量显著升高(4%~ 30%)[40]。
海洋酸化不仅可以直接通过CO32−与H+改变痕量元素的形态和含量, 还可通过影响痕量金属在海水中的氧化—还原反应速率进一步改变痕量元素的赋存状态。例如, Cu(Ⅱ)还原为Cu(Ⅰ)的反应速率常数与pH正相关, 随着海洋酸化加剧, Cu(Ⅱ)的还原速率将持续增加, 因而Cu(Ⅰ)的含量将会增加; 而Fe(Ⅱ)氧化为Fe(Ⅲ)的反应速率却与pH存在较强的负相关关系, 25 ℃条件下, 当pH从8.1降低到7.4时, 会使得Fe(Ⅱ)在海水中的半衰期从1 min增加到24 min[30], 由此使海水中生物可利用的Fe(Ⅱ)增加。由于痕量元素的生物毒性通常与其价态密切相关, 因此对于特定的痕量元素, 海洋酸化将会使其更快地向更强生物毒性的形态转化(As(Ⅴ)
沉积物作为海洋物质能量循环的关键载体, 对痕量金属在整个海洋环境中的分布、迁移、转化都具有重要意义。当金属元素以溶解态形式释放到水体中时, 可以通过各种途径转移到沉积物中, 此时沉积物既可以作为储库, 也可以作为次生污染源。根据目前的现场调查和数值模拟可以预见, 海洋酸化能够导致痕量金属从沉积物释放和有机配体中解离, 从而促使沉积物中的痕量元素向水体迁移、释放[42], 改变痕量元素在沉积物—间隙水—上覆水之间已有的分配, 进一步影响痕量元素参与的诸多重要而复杂的海洋生物地球化学过程。
金属从沉积物到孔隙水和上覆水柱迁移的主要影响因素是金属存在于沉积物中的化学形态。对海洋沉积物进行的几项研究中提到, 在高度污染的环境中, 大部分金属元素主要与有机物结合(70%~ 80%)[43-44], 那么在酸化条件下有机络合物的减少很可能会影响金属在沉积物-海水界面的释放活化和再分布。在海洋沉积物表面附近释放的痕量元素可归因于有机质在沉积物表面的降解[45-46], 尤其海洋系统中Cu和Ni的运输主要由生物对有机物的吸收和吸附控制[47-48]。由此海洋酸化对有机质的作用将大大影响痕量元素从有机物质中释放的过程。另一方面, 微生物对痕量元素的活化也会产生一定的影响, 通常是细菌通过其代谢活动加快有机物的部分分解及铁锰氢氧化物的相关溶解, 促进痕量金属从沉积物中重新移动到孔隙水中[49-50]。
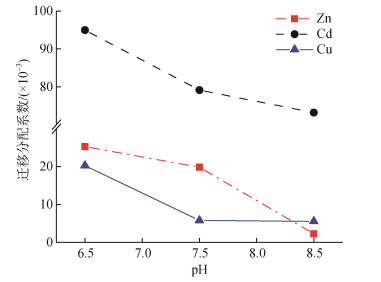
一般而言, 海洋酸化对从沉积物中向上迁移转化的痕量元素的影响与其在沉积物中的存在形态密切相关。那些稳定结合于沉积物晶格之中的元素[例如, 铝(Al)和钾(K)等]基本不受海洋酸化的影响[51], 而对于以碳酸盐结合态存在的元素, 例如钙(Ca), 镉(Cd), 铜(Cu), 铁(Fe), 锰(Mn), 镍(Ni), 铅(Pb), 锌(Zn)等, 在酸化条件下易于被释放进入周围水体成为溶解态[52], 其从沉积物向水体迁移的速率与pH呈负相关, 且同时取决于元素与沉积物固相之间的结合强度。例如酸化引起的海水pH值降低可能会增加铁的溶解度[30], 但对铁生物利用度的影响仍取决于强有机铁配体的性质[53]。图 6展示了Cd、Cu、Zn三种元素从沉积物向水体的迁移系数随pH降低而升高的现象, 分配系数定义为水中重金属浓度与沉积物中重金属浓度的比值, 表明海洋酸化将导致沉积物中的Cd、Cu、Zn向水体快速迁移。与此同时, 沉积物中不同组分对各形态痕量元素的吸附能力也会受到酸化的影响。例如, 高岭石作为痕量元素在沉积物中的主要吸附物, 其对金属阳离子的吸附受到pH的控制, pH为9时被高岭石位点吸附的Cu和Co的百分比相对较高(> 80%), 但随着pH的降低高岭石位点对两种金属的吸附减弱, 当pH降至3时, 被吸附的Cu和Co的百分比仅仅不到10%[54]。
不同痕量元素对海洋酸化的响应程度还受到pH条件的严格控制, 例如沉积物中的Fe、Mn、Zn等在中等酸化条件(pH=7.2)下就能够显著地向上覆水中释放溶解态金属; 而Cd和Pb只有在较低的pH条件下(pH=6.0)才能释放[55]。当沉积物中释放的金属再次被吸附或结合于再悬浮颗粒物中而从上覆水中清除时, 此时pH对痕量金属的影响是多方面且作用强烈的, 水体的pH不仅会影响Fe(Ⅱ)、Mn(Ⅱ)的氧化速率, 还会影响金属与有机配体和铁锰氧化物等固相的结合, 这两个过程均导致在高酸度(pH 6±1)的水体条件下金属的清除速度大于低酸度(pH 8.1±0.2)和中酸碱度(pH 7.2±0.2)的水体条件[56]。
3.3 对生物可利用性的影响痕量元素, 包括Fe、Zn、Mn、Cu、Co和Mo等对生物功能(如光合作用、呼吸作用和营养物质吸收)至关重要。痕量元素的生物可用性可以影响海水中浮游植物的生长和群落结构[57]。反过来, 浮游生物同样对海洋中痕量元素的分布、化学形态和循环有控制作用, 例如, 通过释放能与金属离子结合的生物配体, 通过生物作用将微量元素吸收到生物内部并在细胞表面还原和氧化金属[58]。痕量元素作为海洋生物赖以生存的营养与功能元素, 当其溶解态含量超过安全阈值时, 也会对浮游及底栖生物产生显著的抑制与毒害作用, 继而对海洋碳收支及营养物质循环产生深远影响[58]。首先海洋酸化会导致水体中OH−和CO32−浓度的降低, 它们可以在海水中与二价和三价阳离子形成强键, 这些阴离子的减少会使海水中游离态金属离子浓度增加, 由此直接将金属转化为对生物群更具毒性的形态[59]。其次在酸化情景下, 有机酸与痕量金属会对海洋生物群落产生一定的联合作用, 主要是强烈的加成作用(67%), 并且有相当比例的协同作用(25%)和少数拮抗作用(8%)。例如, 海洋酸化一定程度上可以缓解镉对牡蛎体内类胰蛋白酶的负面影响[60], 有研究认为这是因为H+可以在生物体细胞表面形成配体而竞争性地降低金属阳离子的可用性[61-62]。尽管海洋酸化对海洋痕量金属毒性具有一定的缓解效果, 但海洋酸化和痕量金属之间的加成、协同作用在所有联合效应中仍占主导地位[63]。
众所周知, 海洋痕量元素的毒性效应和生物可利用性并不总是与海洋环境中的元素总量有关, 还取决于痕量元素的赋存形态(包括游离态和弱络合态)以及沉积物的地球化学性质和生物的各种暴露途径。例如, Cu(Ⅱ)被证实在浓度低至10−12 mol/L时就可以对海洋浮游生物产生毒性, 但产生毒性的并不是总Cu(Ⅱ), 而是活性态的Cu(Ⅱ), 即生物可利用的Cu。根据本文前面所总结的, 海水中大部分痕量元素的无机形态只占据该类元素溶解态总量的很小的比例, 而绝大部分是以有机络合物的形式存在的。这一部分有机络合态的痕量元素在海洋酸化条件下将有相当多转化为无机络合态, 从而成为生物可利用态。同时, 海洋酸化还会促进沉积物中的痕量元素析出进入水体, 这都可显著地影响痕量元素的生物可利用性。
表 2简要总结了海洋酸化条件下痕量金属对常见水生生物的直接影响以及以特定方式改变金属对生物体的生理后果, 最终影响它们的健康和生存。结果表明, 海洋酸化会影响金属在海洋生物中的毒性、积累以及与细胞结合的程度: 低pH与高浓度Cu会诱发石莼畸变并抑制其光合作用; 低pH还会增加Zn(Ⅱ)、Cd(Ⅱ)、Cu(Ⅱ)在蛤蜊、牡蛎和乌贼等软体动物体内的生物积累, 酸化程度加重与pCO2升高协同作用导致蛤蜊和牡蛎血细胞的吞噬活性、黏附能力降低, 加剧Cd(Ⅱ)对生物免疫功能的负面影响, 并可能进一步使生物体对病原体和疾病等其他压力敏感; 另外加剧TiO2纳米颗粒对贻贝的生理功能损伤, 增强Hg(Ⅱ)对斧文蛤的急性毒性。
本文从海洋酸化的主要化学过程与变化趋势入手, 详细介绍了痕量元素在上覆水、沉积物-海水界面、沉积物中的主要赋存状态、变化特征和迁移转化的全过程。在此基础上系统梳理了海洋酸化对痕量元素赋存形态、迁移转化、生物可用性的影响, 总结了酸化条件下痕量元素生物地球化学行为的关键因素。沉积物-海水界面作为海洋物质能量循环转化的关键通道, 海洋酸化对痕量元素各种行为的影响也必将通过沉积物-海水界面这一通道而实现。关注酸化条件下痕量元素在沉积物-海水界面处的释放与沉降过程, 了解沉积物、间隙水、上覆水环境中痕量元素赋存形态、含量水平的动态变化, 这将为明确全球气候变化背景下痕量元素海洋生态效应的时空变化、掌握海洋环境中不同形态的痕量元素对环境演变的指示与反馈提供有力支撑。
与此同时, 由于海洋环境的多相性与复杂性, 有关海洋酸化对沉积物中金属环境行为的潜在影响知之甚少, 酸化可间接改变海底沉积物的条件和性质, 导致沉积物—海水界面处主要和微量元素的地球化学通量发生变化[68], 进一步影响氧化还原敏感元素的溶解度、生物利用度和毒性, 对海洋生态系统产生有害影响。除此之外, 目前对于典型污染物(重金属、有机污染物)和新型污染物与海洋酸化条件的联合毒性效应的研究也很少, 其致毒机制尚不明确。多种环境条件如低氧现象与酸化的协同作用, 及其对间隙水、上覆水中痕量元素的氧化还原特性, 对沉积物中铁锰氧化物、硫化物的生成与消耗的重要作用的关注并不充分[69-70]。若要更详细地讨论在沉积物-海水界面发生的与酸化相关的金属形态、迁移行为、生物利用性及其毒性风险的变动影响, 则在未来的研究中需要更加系统全面地将多种环境因子之间的联系与作用机制以及不同污染物之间的联合效应联系在一起, 同时采用更贴近自然环境的研究方法以了解海洋酸化对金属生物有效性的原位影响, 并对海洋酸化与重金属影响的协同作用造成的长期动态变化加以关注, 才能对海洋酸化的响应机理及其对沉积物-水界面重金属的影响变化有更加全面的理解。
| [1] |
ORR J C, FABRY V J, AUMONT O, et al. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J]. Nature, 2005, 437: 681-686. DOI:10.1038/nature04095 |
| [2] |
KERR R A. Ocean acidification unprecedented, unsettling[J]. Science, 2010, 328(5985): 1500-1501. DOI:10.1126/science.328.5985.1500 |
| [3] |
HÖNISCH B, RIDGWELL A, SCHMIDT D N, et al. The geological record of ocean acidification[J]. Science, 2012, 335(6072): 1058-1063. DOI:10.1126/science.1208277 |
| [4] |
CALDEIRA K, WICKETT M E. Oceanography: anthropogenic carbon and ocean pH[J]. Nature, 2003, 425(6956): 365. DOI:10.1038/425365a |
| [5] |
曲宝晓, 宋金明, 李学刚. 海洋酸化之时间序列研究进展[J]. 海洋通报, 2020, 39(3): 281-290. QU Baoxiao, SONG Jinming, LI Xuegang. Advances in ocean acidification time-series studies[J]. Marine Science Bulletin, 2020, 39(3): 281-290. |
| [6] |
RIEBESELL U, ZONDERVAN I, ROST B, et al. Reduced calcification of marine plankton in response to increased atmospheric CO2[J]. Nature, 2000, 407(6802): 364-367. DOI:10.1038/35030078 |
| [7] |
汪思茹, 殷克东, 蔡卫君, 等. 海洋酸化生态学研究进展[J]. 生态学报, 2012, 32(18): 5859-5869. WANG Siru, YIN Kedong, CAI Weijun, et al. Advances in studies of ecological effects of ocean acidification[J]. Acta Ecologica Sinica, 2012, 32(18): 5859-5869. |
| [8] |
徐雪梅, 吴金浩, 刘鹏飞. 中国海洋酸化及生态效应的研究进展[J]. 水产科学, 2016, 35(6): 735-740. XU Xuemei, WU Jinhao, LIU Pengfei. Research progress of ocean acidification and its ecological efficiency in China[J]. Fisheries Science, 2016, 35(6): 735-740. |
| [9] |
FEELY R A, DONEY S C, COOLEY S R. Ocean acidification: Present conditions and future changes in a high-CO2 world[J]. Oceanography, 2009, 22(4): 36-47. DOI:10.5670/oceanog.2009.95 |
| [10] |
HAUGAN P M, DRANGE H. Effects of CO2 on the ocean environment[J]. Energy Conversion and Management, 1996, 37(6/8): 1019-1022. |
| [11] |
BREWER P G. Ocean chemistry of the fossil fuel CO2 signal: The haline signal of "business as usual"[J]. Geophysical Research Letters, 1997, 24(11): 1367-1369. DOI:10.1029/97GL01179 |
| [12] |
BREITBARTH E, BELLERBY R J, NEILL C C, et al. Ocean acidification affects iron speciation during a coastal seawater mesocosm experiment[J]. Biogeosciences, 2010, 7(3): 1065-1073. DOI:10.5194/bg-7-1065-2010 |
| [13] |
吴雪停, 刘丽华, 吴能友, 等. 海洋沉积物中早期成岩作用地球化学研究进展[J]. 海洋地质前沿, 2015, 31(12): 17-26. WU Xueting, LIU Lihua, WU Nengyou, et al. Geochemistry of early diagenesis in marine sediments: Research progress[J]. Marine Geology Frontiers, 2015, 31(12): 17-26. DOI:10.16028/j.1009-2722.2015.12003 |
| [14] |
MILLERO F, PIERROT D. Speciation of metals in natural waters[M]//GIANGUZZA A, PELIZZETTI E, SAMMARTANO S. Chemistry of marine water and sediments. Berlin: Springer, 2002: 193-220.
|
| [15] |
BRULAND K W. Complexation of cadmium by natural organic ligands in the central North Pacific[J]. Limnology and Oceanography, 1992, 37(5): 1008-1017. DOI:10.4319/lo.1992.37.5.1008 |
| [16] |
ELLWOOD M J, VAN DEN BERG C M G. Determination of organic complexation of cobalt in seawater by cathodic stripping voltammetry[J]. Marine Chemistry, 2001, 75(1/2): 33-47. |
| [17] |
SAITO M A, MOFFETT J W. Complexation of cobalt by natural organic ligands in the Sargasso Sea as determined by a new high-sensitivity electrochemical cobalt speciation method suitable for open ocean work[J]. Marine chemistry, 2001, 75(1/2): 49-68. |
| [18] |
ZHANG H, VAN DEN BERG C M G, WOLLAST R. The determination of interactions of cobalt (Ⅱ) with organic compounds in seawater using cathodic stripping voltammetry[J]. Marine Chemistry, 1990, 28(4): 285-300. DOI:10.1016/0304-4203(90)90049-I |
| [19] |
VAN DEN BERG C M G. Determination of copper complexation with natural organic ligands in seawater by equilibration with MnO2 Ⅰ. Theory[J]. Marine Chemistry, 1982, 11(4): 307-322. DOI:10.1016/0304-4203(82)90028-7 |
| [20] |
SUNDA W G, KLAVENESS D, PALUMBO A V. Bioassays of cupric ion activity and copper complexation[M]//KRAMER J M, DUINKER J C (Eds.), Complexation of trace metals in natural waters, The Netherlands: Springer, 1984: 399-409.
|
| [21] |
VAN DEN BERG C M G. Determination of the complexing capacity and conditional stability constants of complexes of copper (Ⅱ) with natural organic ligands in seawater by cathodic stripping voltammetry of copper-catechol complex ions[J]. Marine Chemistry, 1984, 15(1): 1-18. DOI:10.1016/0304-4203(84)90035-5 |
| [22] |
MOFFETT J W, ZIKA R G. Solvent extraction of copper acetylacetonate in studies of copper (Ⅱ) speciation in seawater[J]. Marine Chemistry, 1987, 21(4): 301-313. DOI:10.1016/0304-4203(87)90053-3 |
| [23] |
GLEDHILL M, VAN DEN BERG C M G. Determination of complexation of iron (Ⅲ) with natural organic complexing ligands in seawater using cathodic stripping voltammetry[J]. Marine Chemistry, 1994, 47(1): 41-54. DOI:10.1016/0304-4203(94)90012-4 |
| [24] |
WU J F, LUTHER Ⅲ G W. Complexation of Fe (Ⅲ) by natural organic ligands in the Northwest Atlantic Ocean by a competitive ligand equilibration method and a kinetic approach[J]. Marine Chemistry, 1995, 50(1/4): 159-177. |
| [25] |
RUE E L, BRULAND K W. Complexation of iron (Ⅲ) by natural organic ligands in the Central North Pacific as determined by a new competitive ligand equilibration/adsorptive cathodic stripping voltammetric method[J]. Marine chemistry, 1995, 50(1/4): 117-138. |
| [26] |
VAN DEN BERG C M G. Evidence for organic complexation of iron in seawater[J]. Marine Chemistry, 1995, 50(1/4): 139-157. |
| [27] |
VAN DEN BERG C M G, NIMMO M. Determination of interactions of nickel with dissolved organic material in seawater using cathodic stripping voltammetry[J]. Science of the Total Environment, 1987, 60: 185-195. DOI:10.1016/0048-9697(87)90415-3 |
| [28] |
CAPODAGLIO G, COALE K H, BRULAND K W. Lead speciation in surface waters of the eastern North Pacific[J]. Marine Chemistry, 1990, 29: 221-233. DOI:10.1016/0304-4203(90)90015-5 |
| [29] |
BRULAND K W. Complexation of zinc by natural organic ligands in the central North Pacific[J]. Limnology and oceanography, 1989, 34(2): 269-285. DOI:10.4319/lo.1989.34.2.0269 |
| [30] |
MILLERO F, WOOSLEY R, DITROLIO B, et al. Effect of ocean acidification on the speciation of metals in seawater[J]. Oceanography, 2009, 22(4): 72-85. DOI:10.5670/oceanog.2009.98 |
| [31] |
LERMAN A. Chemical exchange across sediment-water interface[J]. Annual Review of Earth and Planetary Sciences, 1978, 6(1): 281-303. DOI:10.1146/annurev.ea.06.050178.001433 |
| [32] |
SANTSCHI P H, AMDURER M, ADLER D, et al. Relative mobility of radioactive trace elements across the sediment-water interface in the MERL model ecosystems of Narragansett Bay[J]. Journal of Marine Research, 1987, 45(4): 1007-1048. DOI:10.1357/002224087788327172 |
| [33] |
张连杰, 朱龙海, 张盼, 等. 渤海湾表层沉积物元素地球化学分布特征与影响因素[J]. 海洋科学, 2019, 43(6): 78-87. ZHANG Lianjie, ZHU Longhai, ZHANG Pan, et al. Geochemical distribution and its controlling factors of the surface sediments in the Bohai Bay[J]. Marine Sciences, 2019, 43(6): 78-87. |
| [34] |
姚佳佳, 吴瑶, 杨茹君, 等. 海水中腐殖质对溶解态铁的络合及其影响因素[J]. 海洋科学, 2022, 46(5): 169-178. YAO Jiajia, WU Yao, YANG Rujun, et al. Fe complexation by humic substances in seawater and its influencing factors[J]. Marine Sciences, 2022, 46(5): 169-178. |
| [35] |
SMRZKA D, ZWICKER J, BACH W, et al. The behavior of trace elements in seawater, sedimentary pore water, and their incorporation into carbonate minerals: A review[J]. Facies, 2019, 65(4): 1-47. |
| [36] |
MIRANDA L S, AYOKO G A, EGODAWATTA P, et al. Adsorption-desorption behavior of heavy metals in aquatic environments: Influence of sediment, water and metal ionic properties[J]. Journal of Hazardous Materials, 2022, 421: 126743. DOI:10.1016/j.jhazmat.2021.126743 |
| [37] |
CRAIG H. The GEOSECS PROGRAM: 1970─1971[J]. Earth and Planetary Science Letters, 1972, 16(1): 217-219. |
| [38] |
LOUIS Y, GARNIER C, LENOBLE V, et al. Characterisation and modelling of marine dissolved organic matter interactions with major and trace cations[J]. Marine Environmental Research, 2009, 67(2): 100-107. DOI:10.1016/j.marenvres.2008.12.002 |
| [39] |
GLEDHILL M, ACHTERBERG E P, LI K, et al. Influence of ocean acidification on the complexation of iron and copper by organic ligands in estuarine waters[J]. Marine Chemistry, 2015, 177: 421-433. DOI:10.1016/j.marchem.2015.03.016 |
| [40] |
BYRNE R H. Inorganic speciation of dissolved elements in seawater: the influence of pH on concentration ratios[J]. Geochemical Transactions, 2003, 3(2): 11-16. |
| [41] |
GAULIER C, ZHAO C Y, GUO W, et al. Trace metal speciation in North Sea coastal waters[J]. Science of the Total Environment, 2019, 692: 701-712. DOI:10.1016/j.scitotenv.2019.07.314 |
| [42] |
俞慎, 历红波. 沉积物再悬浮—重金属释放机制研究进展[J]. 生态环境学报, 2010, 19(7): 1724-1731. YU Shen, LI Hongbo. Perspectives on the release of heavy metals via sediment resuspension[J]. Ecology and Environmental Sciences, 2010, 19(7): 1724-1731. DOI:10.3969/j.issn.1674-5906.2010.07.038 |
| [43] |
HELLALI M A, ZAABOUB N, OUESLATI W, et al. Diagenetic processes and sediment–water exchanges of heavy metals in the Mejerda River Delta (Gulf of Tunis)[J]. Environmental Earth Sciences, 2015, 74(9): 6665-6679. DOI:10.1007/s12665-015-4667-1 |
| [44] |
PETRANICH E, CROCE S, CROSERA M, et al. Mobility of metal (loid) s at the sediment-water interface in two tourist port areas of the Gulf of Trieste (northern Adriatic Sea)[J]. Environmental Science and Pollution Research, 2018, 25(27): 26887-26902. DOI:10.1007/s11356-018-2717-4 |
| [45] |
FONES G R, DAVISON W, HAMILTON-TAYLOR J. The fine-scale remobilization of metals in the surface sediment of the North-East Atlantic[J]. Continental shelf research, 2004, 24(13/14): 1485-1504. |
| [46] |
TANKERE-MULLER S, ZHANG H, DAVISON W, et al. Fine scale remobilisation of Fe, Mn, Co, Ni, Cu and Cd in contaminated marine sediment[J]. Marine Chemistry, 2007, 106(1/2): 192-207. |
| [47] |
VIJAYARAGHAVAN K, JEGAN J, PALANIVELU K, et al. Biosorption of copper, cobalt and nickel by marine green alga Ulva reticulata in a packed column[J]. Chemosphere, 2005, 60(3): 419-426. DOI:10.1016/j.chemosphere.2004.12.016 |
| [48] |
VAN DE VELDE S J, HYLÉN A, KONONETS M, et al. Elevated sedimentary removal of Fe, Mn, and trace elements following a transient oxygenation event in the Eastern Gotland Basin, central Baltic Sea[J]. Geochimica et Cosmochimica Acta, 2020, 271: 16-32. DOI:10.1016/j.gca.2019.11.034 |
| [49] |
ZHU Q Z, ALLER R C, FAN Y Z. Two-dimensional pH distributions and dynamics in bioturbated marine sediments[J]. Geochimica et Cosmochimica Acta, 2006, 70(19): 4933-4949. DOI:10.1016/j.gca.2006.07.033 |
| [50] |
ZHOU C Y, GAO Y, GAULIER C, et al. Advances in understanding mobilization processes of trace metals in marine sediments[J]. Environmental Science & Technology, 2020, 54(23): 15151-15161. |
| [51] |
ARDELAN M V, STEINNES E. Changes in mobility and solubility of the redox sensitive metals Fe, Mn and Co at the seawater-sediment interface following CO2 seepage[J]. Biogeosciences, 2010, 7(2): 569-583. DOI:10.5194/bg-7-569-2010 |
| [52] |
BUYKX S E J, BLEIJENBERG M, van den HOOP M, et al. The effect of oxidation and acidification on the speciation of heavy metals in sulfide-rich freshwater sediments using a sequential extraction procedure[J]. Journal of Environmental Monitoring, 2000, 2(1): 23-27. DOI:10.1039/a907790a |
| [53] |
SHI D L, XU Y, HOPKINSON B M, et al. Effect of ocean acidification on iron availability to marine phytoplankton[J]. Science, 2010, 327(5966): 676-679. DOI:10.1126/science.1183517 |
| [54] |
PHIRI C, SHIMAZUI D, OTAKE T, et al. Geochemical behavior of heavy metals in sludge effluents and solid deposits on the Zambian Copperbelt: Implication for effluent treatment and sludge reuse[J]. Science of the Total Environment, 2021, 769: 144342. |
| [55] |
RIBA I, GARCIA-LUQUE E, BLASCO J, et al. Bioavailability of heavy metals bound to estuarine sediments as a function of pH and salinity values[J]. Chemical Speciation & Bioavailability, 2003, 15(4): 101-114. |
| [56] |
ATKINSON C, JOLLEY D F, SIMPSON S. Effect of overlying water pH, dissolved oxygen, salinity and sediment disturbances on metal release and sequestration from metal contaminated marine sediments[J]. Chemosphere, 2007, 69(9): 1428-1437. |
| [57] |
LORENZO M R, SEGOVIA M, CULLEN J T, et al. Particulate trace metal dynamics in response to increased CO2 and iron availability in a coastal mesocosm experiment[J]. Biogeosciences, 2020, 17(3): 757-770. |
| [58] |
SMETACEK V, KLAAS C, STRASS V H, et al. Deep carbon export from a Southern Ocean iron-fertilized diatom bloom[J]. Nature, 2012, 487(7407): 313-319. |
| [59] |
BOTTÉ A, SEGUIN C, NAHRGANG J, et al. Lead in the marine environment: concentrations and effects on invertebrates[J]. Ecotoxicology, 2022, 1-14. |
| [60] |
GÖTZE S, MATOO O B, BENIASH E, et al. Interactive effects of CO2 and trace metals on the proteasome activity and cellular stress response of marine bivalves Crassostrea virginica and Mercenaria mercenaria[J]. Aquatic Toxicology, 2014, 149: 65-82. |
| [61] |
FRANKLIN N M, STAUBER J L, MARKICH S J, et al. pH-dependent toxicity of copper and uranium to a tropical freshwater alga (Chlorella sp.)[J]. Aquatic Toxicology, 2000, 48(2/3): 275-289. |
| [62] |
GAO G, LIU Y M, LI X S, et al. Expected CO2-induced ocean acidification modulates copper toxicity in the green tide alga Ulva prolifera[J]. Environmental and Experimental Botany, 2017, 135: 63-72. |
| [63] |
JIN P, ZHANG J L, WAN J F, et al. The combined effects of ocean acidification and heavy metals on marine organisms: A meta-analysis[J]. Frontiers in Marine Science, 2021, 8: 801889. |
| [64] |
IVANINA A V, SOKOLOVA I M. Interactive effects of pH and metals on mitochondrial functions of intertidal bivalves Crassostrea virginica and Mercenaria mercenaria[J]. Aquatic Toxicology, 2013, 144: 303-309. |
| [65] |
宋宏策, 姜秋云, 李玲玲, 等. 不同长牡蛎群体对海水酸化的生理响应差异分析[J]. 海洋科学, 2020, 44(1): 132-141. SONG Hongce, JIANG Qiuyun, LI Lingling, et al. Analysis of physiological responses in different populations of Crassostrea gigas to seawater acidification[J]. Marine Sciences, 2020, 44(1): 132-141. |
| [66] |
IVANINA A V, HAWKINS C, SOKOLOVA I M. Immunomodulation by the interactive effects of cadmium and hypercapnia in marine bivalves Crassostrea virginica and Mercenaria mercenaria[J]. Fish & shellfish immunology, 2014, 37(2): 299-312. |
| [67] |
HU M, LIN D, SHANG Y, et al. CO2-induced pH reduction increases physiological toxicity of nano-TiO2 in the mussel Mytilus coruscus[J]. Scientific Reports, 2017, 7: 40015. |
| [68] |
王婷, 郑佳慧, 胡梦红, 等. 海洋酸化对贝类的生理生态学影响研究进展[J]. 海洋科学, 2022, 46(1): 192-202. WANG Ting, ZHENG Jiahui, HU Menghong, et al. Advances in studies on the physiological and ecological effects of ocean acidification on shellfish[J]. Marine Sciences, 2022, 46(1): 192-202. |
| [69] |
LIU W, LU G Y, WANG W X. In situ high-resolution two-dimensional profiles of redox sensitive metal mobility in sediment-water interface and porewater from estuarine sediments[J]. Science of The Total Environment, 2022, 820: 153034. |
| [70] |
MIAO C Y, XIE H H, ZHAN L S, et al. Blood pressure variability is more important than blood pressure level in determination of end-organ damage in rats[J]. Journal of Hypertension, 2006, 24(6): 1125-1135. |
 2023, Vol. 47
2023, Vol. 47