
文章信息
- 林琮皓, 袁玉婷, 谭文强, 郭占勇, 姜爱莉. 2024.
- LIN Conghao, YUAN Yuting, TAN Wenqiang, GUO Zhanyong, JIANG Aili. 2024.
- 烟酰化壳寡糖季铵盐的制备及抑菌活性研究
- Niacinated chitooligosaccharide quaternary ammonium salt: synthesis and antimicrobial activity
- 海洋科学, 48(1): 44-55
- Marine Sciences, 48(1): 44-55.
- http://dx.doi.org/10.11759/hykx20220721001
-
文章历史
- 收稿日期:2022-07-21
- 修回日期:2022-09-26
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003
2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China
海洋生物体内蕴含着多种天然活性物质, 许多都具有抑菌的功效, 以此为原料研制新型生物抑菌剂是当下海洋生物产业中的热点。甲壳素被称为几丁质、甲壳质等, 主要来源于海洋虾蟹等节肢动物的外壳[1]。壳聚糖又被称为脱乙酰甲壳素, 是由甲壳素在强碱性、高温条件下脱乙酰基得到的高分子聚合物, 具有成膜性、吸附性、抗氧化性、抗菌性、吸湿保湿性等独特的生物活性[2], 近年来在医用生物新材料等领域得到了极大的关注, 但是水溶性差限制了壳聚糖的应用[3]。壳寡糖(COS), 又叫壳聚寡糖、低聚壳聚糖, 是将壳聚糖经生物酶法或化学降解得到的一种聚合度在2~20的寡糖产品, 由氨基葡萄糖或乙酰氨基葡萄糖通过β-1, 4-糖苷键连接而成, 相比于甲壳素和壳聚糖, 它具有更高的水溶性和生物相容性、更优良的生物活性、无毒性、可生物降解性, 其应用范围从生物医药和药物材料再到环境修复[4-6]。研究发现, COS具有一定的抑菌活性, 但其抑菌能力比较温和, 将壳寡糖单独使用往往作用效果有限, 因此利用活性分子拼接原理, 通过化学修饰在COS中引入活性官能团是一种有效改善其抑菌能力的方法[7]。COS分子结构上有两类反应性基团, 分别是C-2位的氨基、C-6位的伯羟基和C-3位的仲羟基[8-9], 这些基团提供了有效的反应位点。现如今, 壳寡糖化学改性方法主要包括氨基衍生化和羟基衍生化, 氨基衍生化途径有希夫碱化、N-烷基化反应、氨基季铵盐等, 羟基衍生化途径有酯化、醚化和O-酰化等, 改性的衍生物不仅保留了COS的原有优点, 而且赋予它们增强的生物活性[10]。
季铵化壳寡糖衍生物具有优异的抑菌特性, 例如, Kim等人报道了一种含有季铵盐的壳寡糖衍生物, 发现该衍生物对变形链球菌的生长抑制率在80%以上, 说明通过引入季铵盐可以显著增强COS的抑菌活性[11]。此外, 在COS的结构中引入烷基官能团会提高化合物在细菌细胞膜上的溶解能力, 会与细胞膜表面的物质发生静电吸附作用, 从而增强抑菌性能, 有望成为应用前景广阔的绿色生物抑菌剂[12], 基于较强的抑菌性能以及便于合成等优点, 带长链烷基的COS衍生物成为研究的热点。因此, 同时具有阳离子和烷烃的COS衍生物会有显著的抑菌性能。
海洋细菌不易受恶劣生存环境的影响, 广泛存在于海洋之中, 病原性海洋细菌致病性强、感染死亡率高。随着海水养殖业的蓬勃发展, 特别是高密度养殖模式的推广, 养殖海产品感染细菌性疾病发生频率和范围也逐渐增大, 导致水体受到污染, 海产品质量和产量受到严重影响。当人类接触或食用被海洋细菌感染的鱼、虾、贝类等海产品后, 均可引起海洋细菌感染, 导致耳鼻喉和肠道疾病, 严重的会引起蜂窝组织炎和败血症[13]。此外, 由农作物致病真菌引起的果实腐烂病、霜霉病和白粉病是一种广泛存在的破坏性植物病害, 农作物真菌性病害在中国广泛分布, 不仅在田间产生危害, 还由于其潜伏侵染特性, 危害果实, 可使产量降低、失去商品价值, 严重影响生产安全[14]。目前, 许多化学合成的抑菌药物(抗生素和各种药品)由于其毒副作用而被禁用, 而天然活性物质具有毒性小、无刺激性、无致癌性、无致畸性等优点, 因此, 需要利用天然生物活性物质制备抑菌药物来部分代替一些农药和抗生素[15]。我们研究的目的是制备具有较强抑菌活性的新型壳寡糖衍生物, 可广泛用于食品、生物材料应用和医药领域。在实验中, 合成了4种烟酰化壳寡糖季铵盐。壳寡糖衍生物的化学结构通过傅里叶变换红外光谱(FT-IR)和核磁共振波谱(NMR)进行表征。特别是研究了COS衍生物中季铵盐和不同的烷基链长对抑菌活性的影响, 通过肉汤稀释法研究了对2种海洋致病细菌的抑菌活性, 采用菌丝生长速率抑制法评估了对3种植物病害真菌的体外抑菌活性。
1 实验部分 1.1 材料与仪器壳寡糖乳酸盐: 相对分子质量≤3 000, 脱乙酰度≥95%, 购自山东卫康生物医药科技有限公司; 烟酸: 纯度≥99%, 购自阿拉丁试剂(上海)有限公司; N, N’-羰基二咪唑(CDI): 纯度≥98%, 购自上海麦克林生化科技有限公司; 溴乙烷(纯度≥98%), 1-溴丙烷(纯度≥98%), 1-溴正丁烷(纯度≥98%), 1-溴正己烷(纯度≥98%)均购自阿拉丁试剂(上海)有限公司。其他化学试剂: 二甲亚砜(DMSO)、丙酮购自上海国药化学试剂有限公司, 无水乙醇购自天津市富宇精细化工有限公司。
电子天平, 瑞士Mettler Toledo公司; 集热式磁力恒温搅拌器, 郑州长城科工贸有限公司; 冷冻干燥机, 上海博医康实验试剂有限公司; 立式压力蒸汽灭菌器, 上海申安医疗器械厂; 水浴恒温振荡器, 上海博讯实业有限公司; 霉菌培养箱, 上海一恒科技有限公司; 电热恒温培养箱, 上海一恒科学仪器有限公司; 气浴恒温振荡器, 上海博讯实业有限公司; 傅里叶红外光谱仪(FTIR), 美国Nicolet公司; 500MHz核磁共振波谱仪(NMR), 瑞士Bruker公司。
1.2 合成与纯化本研究主要通过CDI催化烟酸与COS反应制备高取代度的壳寡糖烟酸接枝衍生物(COS-N), 选用溴乙烷、1-溴丙烷、1-溴正丁烷和1-溴正己烷进一步亲核取代反应合成产物, 合成路线见图 1。
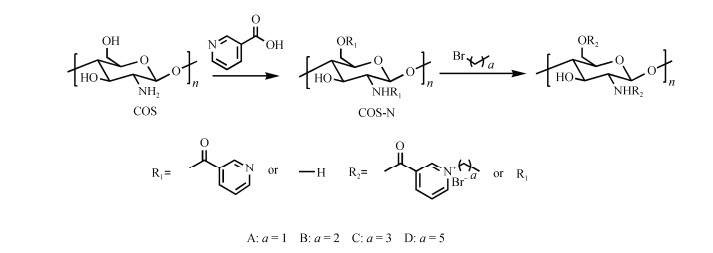 |
| 图 1 烟酰化壳寡糖季铵盐合成路线 Fig. 1 Synthesis route for cationic linear alkyl-bearing chitooligosaccharide derivatives |
39.36 g(320 mmol)烟酸分散于40 mL DMSO中, 缓慢加入52 g(320 mmol)CDI, 搅拌得到澄清溶液, 在N2氛围下, 60 ℃反应12 h。准确称取25.76 g COS溶于50 mL DMSO中, 将上一步反应的溶液缓慢滴加到壳寡糖DMSO溶液中, 继续在60 ℃下反应12 h。反应结束后冷却溶液至室温, 将反应溶液倒入500 mL丙酮中沉淀、抽滤, 所得粗产物继续用少量的DMSO复溶, 然后再用丙酮沉淀, 反复溶、沉3次, 然后所得固体再用无水乙醇洗涤3次, 最后将产物于真空冷冻干燥机中干燥至恒重, 得到壳寡糖烟酸接枝衍生物10.04 g。
1.2.2 烟酰化壳寡糖季铵盐的制备烟酰化壳寡糖季铵盐: 将1.06 g COS-N溶于6 mL DMSO中, 分别缓慢滴加8 mmol溴乙烷(0.6 mL)、1-溴丙烷(0.76 mL)、1-溴正丁烷(0.86 mL)和1-溴正己烷(1.12 mL)。N2保护下60 ℃反应24 h。反应结束后冷却至室温, 将反应后溶液缓慢倒入过量丙酮中, 沉淀析出、抽滤, 所得固体用最少量的DMSO复溶, 然后再用丙酮沉淀, 重复以上步骤3次之后并用乙醇继续洗涤3次, 冻干之后分别得到含乙基、丙基、正丁基和正己基的烟酰化壳寡糖季铵盐(A、B、C、D), 固体产物质量分别为0.74 g、1.24 g、0.88 g、1.20 g。
1.3 结构表征 1.3.1 傅里叶变换红外光谱采用溴化钾(KBr)压片法, 将样品与KBr以1∶50的比例充分研磨均匀压成薄片, 利用美国Nicolet iS50傅里叶变换红外光谱仪对薄片进行扫描, 红外波谱在4 000~500 cm–1波数范围内, 分辨率为4 cm–1, 累计32次扫描。
1.3.2 核磁共振波谱分析准确称取20.0 mg、40.0 mg样品分别用0.6 mL D2O和0.6 mL DMSO-d6进行溶解, 样品的化学表征由Bruker AVIIITM-500谱仪(500 mhz, 瑞士, Bruker)在室温下检测。以四甲基硅烷为内标, 化学位移用δ表示。
壳寡糖衍生物的取代度是通过壳聚糖主链C3-C6上的氢原子与修饰活性基团氢原子的积分比值定量计算的[16]。COS-N的取代度(D1)和四种终产物的取代度(D2)的计算公式如下:
| D1(%)=(5×IHs1)/(4×IH3−H6)×100, | (1) |
| D2(%)=(4×IHs2)/(3×IHs1)×D1, | (2) |
其中IH3-H6是COS主链H3-H6 (3.17~4.30)处氢的积分, IH s1是COS-N吡啶环(7.16~9.02)中氢的积分, IH s2是在四种终产物中末端甲基上氢的积分。
1.4 烟酰化壳寡糖季铵盐抑细菌活性实验最小抑菌浓度(minimum inhibitory concentration, MIC)和最小杀菌浓度(minimum bactericidal concentration, MBC), 为最低抑制病原微生物繁殖和有效杀灭病原微生物的药物浓度, 用于衡量抗感染药(包括抗生素、抑菌药物、化学合成药物)抑制病原微生物的能力[17]。抗感染药在体内或体外的浓度要达到或超过MIC, 才能抑制病原微生物的生长; 浓度要达到或超过MBC, 才能有效杀灭病原微生物[18]。
菌种活化: 供试菌株为柠檬假交替单胞菌(Pseudoalteromonas citrea, P. citrea)和哈维氏弧菌(Vibrio harveyi, V. harveyi)。抽取200 μL菌液于2216E液体培养基活化18 h, 然后抽取200 μL菌液在液体培养基中继续培养, 直至在600 nm波长处测试菌悬液的吸光度达0.5时, 表明细菌培养至对数期, 可用于后续实验[19]。抑菌和观察: 将COS、COS-N和四种壳寡糖衍生物先以合适的浓度在96孔板内进行连续稀释, 每个孔内再加入一定量测试菌液, 最终控制样品浓度在16, 8, 4, 2, 1, 0.5, 0.25, 0.125, 0.062 5, 0.031 25, 0.015 625和0.078 125 mg/mL。18 h培养后, 观察细菌生长情况, 与空白对照比较, 以肉眼观察培养基清亮且未见细菌生长的最低浓度判定为该药物的最低抑菌浓度(MIC)。将无细菌生长的实验孔内取5 μL菌悬液划线接种到新的琼脂平板上进行培养, 进一步确定该药物的最低杀菌浓度(MBC), 通常每个化合物重复3次实验[20]。
1.5 烟酰化壳寡糖季铵盐抑真菌活性实验因为氨基的存在, 壳寡糖表现出一定的抑菌活性, 与传统的小分子农药相比, 在活性强度方面还存在较大的差距, 化学结构改性是一种高效提升壳寡糖抑菌活性的方法[21]。以灰葡萄孢菌(Botrytis cinerea, B. cinerea)、围小丛壳(Glomerella cingulate, G. cingulate)和香蕉枯萎病菌(Fusarium oxysporum f. sp. Cubense, F. oxysporum)为供试菌株来评价烟酰化壳寡糖季铵盐的抑菌活性, 并探究不同烷基链长对壳寡糖衍生物抑制真菌活性的影响。
菌饼制备: 以上3种真菌菌株在液体培养基中复壮, 取0.2 mL菌液均匀涂布在固体培养基表面, 在霉菌培养箱中培养48 h左右, 此时可以清晰地观测到菌丝均匀的分布在培养基表面, 然后将培养基用打孔器分成直径为5 mm的菌饼供下一步使用。
抑菌实验采用菌丝生长速率抑制法[22]: 首先将分装好的固体培养基灭菌, 然后在超净工作台中, 每种样品取1.5 mL、0.75 mL、0.15 mL分别加入到对应体积为13.5 mL、14.25 mL、14.85 mL的固体培养基中, 使得每个化合物的最终测试浓度为1.0、0.5、0.1 mg/mL。加完后摇匀并趁热倒入培养皿中, 待固体培养基冷却凝固之后, 将直径5 mm的菌饼接种到培养基上。去离子水为对照组, 接种完之后, 转移到真菌培养箱中培养, 当空白组中的真菌菌丝生长到接近培养基边缘的位置时, 取出所有培养皿测量菌丝生长区域的直径, 每个样品做三组平行实验, 采用以下公式计算化合物的抑菌率(I)。
| I(%)=[1−(A−5)/(B−5)]×100, | (3) |
其中, A表示样品组真菌菌丝测量直径(mm), B表示空白组菌丝测量直径(mm), 实验重复3次, 最终结果取平均值。
2 结果与讨论本研究中, 为了促进烟酸与COS反应, 采用CDI作为催化剂对烟酸进行活化。CDI可以与羧基反应得到羰基咪唑作为中间体, 它具有很强的反应活性, 可以进一步与COS上的氨基和羟基反应形成酰胺键和酯键[23]。随后通过COS-N与溴代烷烃的亲核取代反应制备了含不同烷基链长的烟酰化壳寡糖季铵盐。
2.1 红外光谱图 2是壳寡糖、壳寡糖烟酸接枝衍生物以及4种烟酰化壳寡糖季铵盐的红外光谱图。对于原料壳寡糖(COS), 糖环上羟基(-OH)和氨基(-NH2)的伸缩振动峰在3 410 cm–1, 在2 870 cm–1处的吸收峰为C-H键的伸缩振动, 在1 600 cm–1是COS上-NH2的伸缩振动吸收峰, 特征峰出现在1 070 cm–1处可归因为糖环-C-O-的伸缩振动[24]。与COS相比, 壳寡糖烟酸接枝衍生物(COS-N)的谱图中, 在3 120 cm–1处为吡啶的振动吸收峰(C-H), 在1 730 cm–1、1 650 cm–1和1 284 cm–1处出现的新峰可以归属于酯键的伸缩振动峰(C=O)、酰胺键的伸缩振动峰(C=O)和酯键的伸缩振动峰(C-O)[25], 另外在628~740 cm–1出现了一组峰可以归因于吡啶基团的振动吸收峰(C=C), 以上结果可以初步验证烟酰化反应成功, 这说明CDI催化COS与烟酸的接技共聚反应不仅在2位氨基上形成了酰胺键, 而且还在6位羟基上生成了酯键。在四种不同烷基链长的烟酰化壳寡糖季铵盐(A、B、C、D)的红外光谱图中, 可以清楚的观察到新峰出现在1 502 cm–1处, 为季铵盐的峰[26], 在2 958~2 860 cm–1波数范围内出现的一组峰可以归因为烷烃的伸缩振动。以上结果初步证明不同链长的直链烷烃接入到壳寡糖结构中。
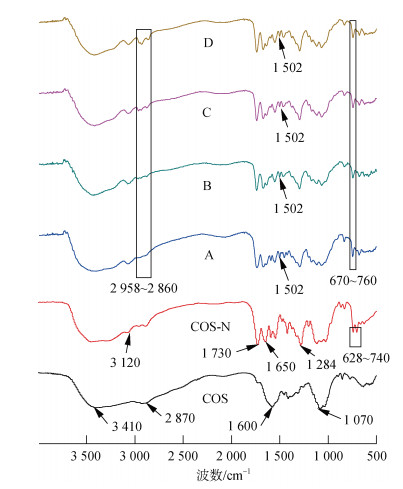 |
| 图 2 壳寡糖和壳寡糖衍生物的红外光谱图 Fig. 2 FT-IR spectra of chitooligosaccharide and its derivatives 注: COS为壳寡糖原料, COS-N为壳寡糖烟酸接枝衍生物, A为含乙基的烟酰化壳寡糖季铵盐, B为含丙基的烟酰化壳寡糖季铵盐, C为含丁基的烟酰化壳寡糖季铵盐, D为含己基的烟酰化壳寡糖季铵盐 |
核磁共振波谱是目前确定化合物结构最有效的技术。本部分介绍了合成的衍生物在室温下溶于D2O获得的1H核磁波谱结果。从图 3可得知, 壳寡糖骨架分子的H1化学位移位于5.29处, 从2.98到3.97的信号归属为壳寡糖分子骨架H2、H6、H5、H4和H3的化学位移[25]。对于中间产物COS-N, 与COS相比, 在7.29~9.00处出现了新的化学位移, 归属为吡啶环中H质子的信号峰, 可以进一步的说明COS-N合成成功[27]。
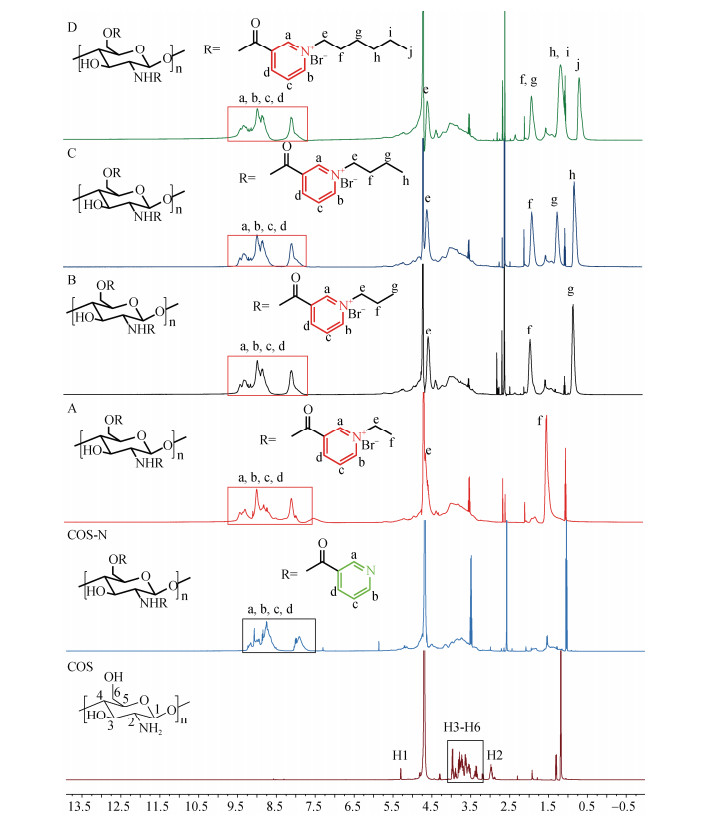 |
| 图 3 壳寡糖及衍生物的核磁共振氢谱 Fig. 3 1H NMR spectra of chitooligosaccharide and its derivatives 注: COS为壳寡糖原料, COS-N为壳寡糖烟酸接枝衍生物, A为含乙基的烟酰化壳寡糖季铵盐, B为含丙基的烟酰化壳寡糖季铵盐, C为含丁基的烟酰化壳寡糖季铵盐, D为含己基的烟酰化壳寡糖季铵盐 |
亲核反应之后, 从1H NMR波谱图中可以更加清晰地分析最终得到的四种烟酰化壳寡糖季铵盐的结构。在化合物A的1H NMR中, 4.65和1.55为新接入的烷烃上亚甲基、甲基氢的化学位移; 在B的1H NMR中, 4.57、1.95和0.85为新接入的烷烃上亚甲基、甲基氢的化学位移; 在4.60、1.90、1.25和0.81为化合物C新接入的烷烃上氢的化学位移; 在4.60、1.92、1.18和0.69为化合物D新接入长链烷烃上氢的化学位移[28]。通过以上分析, 可以确定通过COS-N为反应中间体, 利用溴代烷烃进行亲核反应制备壳寡糖衍生物的方法是可行的。
2.2.2 核磁碳谱分析化合物在室温下溶于DMSO-d6中获得的13C核磁波谱结果如图 4所示, 壳寡糖分子碳的化学位移都分布在谱图的55~105, 在101.0处的特征峰归属于C1, 在78.0至66.0出现的特征峰归属为C3, C4和C5, 在61.2和56.8的特征峰分别归属为C6和C2[29], 在177.6出现的特征峰来自于未脱乙酰部分的碳原子的信号。与COS相比, COS-N的13C谱中在125至155出现的特征峰为引入的吡啶环上的碳原子, 详细来说, 在155.2、152.2、135.7、131.5和124.2分别对应吡啶基团上的碳原子d、c、f、b和e[27], 特别是在低场区化学位移165.0左右出现的新的信号归属于酰胺键上的碳原子a。基于以上数据,可以充分地说明壳寡糖烟酸接枝衍生物合成成功。关于化合物A, B, C和D, 在129.0和148.4之间出现的共振信号归属于吡啶上的碳原子; 在化合物A的13C谱中57.4和16.7处出现的新峰归因于接入的溴乙烷上的碳原子g和h; 在化合物B的13C谱中62.7、24.6和10.6出现的特征峰归属为碳原子g、h和i; 关于化合物C, 在61.4、33.3、19.2、13.8处出现的特征峰分别对应碳原子g、h、i和j; 在化合物D的13C谱中, 在61.6、56.5、31.1、25.5、22.3和14.3出现的信号归属于碳原子g、j、i、h、k和l。基于这些数据结果, 可以进一步确定烷烃链的存在, 烟酰化壳寡糖季铵盐合成成功。
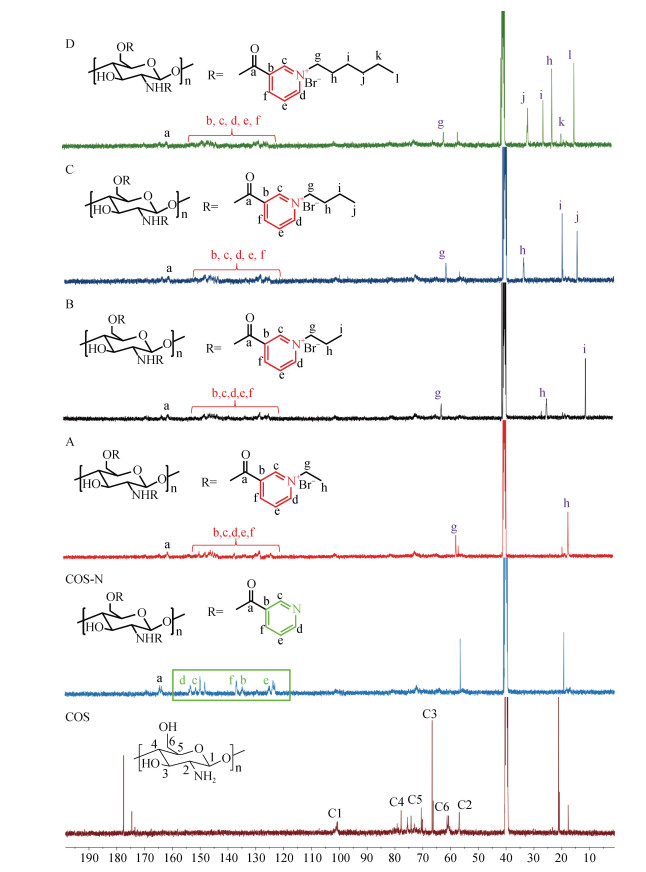 |
| 图 4 壳寡糖及衍生物的核磁共振碳谱 Fig. 4 13C NMR spectra of chitooligosaccharide and its derivatives 注: COS为壳寡糖原料, COS-N为壳寡糖烟酸接枝衍生物, A为含乙基的烟酰化壳寡糖季铵盐, B为含丙基的烟酰化壳寡糖季铵盐, C为含丁基的烟酰化壳寡糖季铵盐, D为含己基的烟酰化壳寡糖季铵盐 |
如表 1所示, COS-N的取代度达到1.80, 结果表明COS与烟酸的结合不仅在2位氨基上形成了酰胺键, 而且还在6位羟基上生成了酯键, COS-N的取代度分析结果与FT-IR光谱的结果一致。对于这4种化合物, 样品A的取代度最高为1.51, 而化合物D的取代度为0.86, 与A, B和C相比稍弱。综合红外光谱、核磁共振氢谱、碳谱以及积分结果来看, 我们采用的反应路线, COS和烟酸之间的烟酰化反应生成COS-N、COS-N与溴代烷烃进一步的亲核取代反应, 可以有效制备烟酰化壳寡糖季铵盐。
| 样品 | 取代度 |
| COS | / |
| COS-N | 1.80 |
| A | 1.51 |
| B | 1.00 |
| C | 1.08 |
| D | 0.86 |
病原性海洋细菌是水产养殖中危害较大的一类细菌性病原体, 对鱼、虾和贝类等养殖水产动物均具有致病性。此外, 受海洋致病细菌侵染的海产品还会将细菌传递给人类, 导致肠胃炎、蜂窝组织炎和败血症等疾病[30], 因此, 开发可用于水产养殖领域的抑菌剂具有重要意义。COS衍生物是一种很有前景的生态友好型糖类, 有望成为应用前景广阔的高效生物抑菌剂。我们制备了含有不同烷基链长的烟酰化壳寡糖季铵盐, 采用肉汤稀释法来评价烟酰化壳寡糖季铵盐对P. citrea和V. harveyi的抑菌活性, MIC和MBC的大小直接反映了样品对细菌生长的抑制作用, MIC和MBC数值越小就意味着化合物对细菌的抑制效果越好, 反之越差[17-18]。
COS和COS衍生物对两种病原性海洋细菌的抑菌活性如表 2和3所示。总的来说, COS原料对2种海洋致病菌几乎没有抑制活性(MIC≥16 mg/mL, MBC≥16 mg/mL)。与COS相比, COS-N也表现出极弱的活性, 对上述细菌的MIC和MBC值均大于16 mg/mL, 并没有表现出比COS更强的抑菌活性, 抑菌活性十分有限, 也就是说烟酰基的引入对壳寡糖的活性并没有显著的提升。当COS-N与不同链长的溴代烷烃发生亲核反应后, COS衍生物A、B、C和D表现出增强的抑菌活性, 对2种有害细菌的MIC值为1~0.125 mg/mL, MBC为2~0.25 mg/mL。此外, COS衍生物A对V. harveyi的MIC值为2 mg/mL, MBC值为2 mg/mL, 而样品B、C和D的MIC在1到0.125 mg/mL之间变化, MBC在2至0.25 mg/mL之间变化。COS衍生物对P. citrea的抑制规律与V. harveyi相似。
| 样品 | MIC/(mg·mL–1) | MBC/(mg·mL–1) |
| COS | > 16 | > 16 |
| COS-N | > 16 | > 16 |
| A | 2 | 2 |
| B | 1 | 2 |
| C | 1 | 1 |
| D | 0.25 | 0.25 |
| 注: MIC: 最小抑菌浓度; MBC: 最小杀菌浓度 | ||
| 样品 | MIC/(mg·mL–1) | MBC/(mg·mL–1) |
| COS | 16 | 16 |
| COS-N | > 16 | > 16 |
| A | 1 | 2 |
| B | 0.5 | 1 |
| C | 0.5 | 1 |
| D | 0.125 | 0.5 |
| 注: MIC: 最小抑菌浓度; MBC: 最小杀菌浓度 | ||
与COS和COS-N相比, 所有含烷烃的COS衍生物均具有增强的抑菌活性, 这归因于季铵盐阳离子和烷烃的引入。正电荷密度的增加对于提高抑菌活性有重要的意义, 据报道, COS季铵盐上的正电荷可以与细胞膜的阴离子成分如蛋白质和脂质相互结合, 导致细菌完整性破坏, 营养物质流失, 从而干扰细胞膜的形成, 破坏了细胞结构或者在细胞膜表面形成一层保护膜, 阻止营养成分进入细胞, 使得其具有特殊的抑菌性能[31]。赵倩等采用共培养法证实质量浓度为0.1 g/mL、0.2 g/mL和0.5 g/mL的壳寡糖对鸡源、猪源E. Coli和Salmonella均具有显著的抑菌作用, 且正电荷密度随着壳寡糖质量浓度的升高而升高, 抑菌能力逐渐增强[32]。同样的, Liu等制备了吡啶羰基壳寡糖配体, 通过菌丝生长速率法评估了其抑菌活性, 结果表明在0.8 mg/mL的浓度下, 吡啶羰基壳寡糖配体的最高抗真菌指数为78.87%[7]。此外, 对比这四种不同烷基链长的烟酰化壳寡糖季铵盐的抑菌活性, 可以发现样品对四种病原菌的抑菌结果可能为D > C > B > A。有研究认为, 由于链长的增加加强了季铵盐的亲脂性, 进一步增加了季铵盐与细菌细胞膜脂质结构的相互作用, 进而改变细菌细胞膜的通透性, 从而提高了抑菌性能[12]。孙丹等通过香叶醇溴化和取代反应两步合成香叶醇烷基改性的壳寡糖, 通过平板扩散法评估了合成的衍生物对E. coli和S. aureus的抑菌活性, 结果表明壳寡糖-M-香叶醇的抑制效果明显优于COS[33]。衍生物D的MIC在0.25~0.125 mg/mL, MBC在0.5~0.25 mg/mL变化, 尤其对V. harveyi具有最显着的抑菌作用(MIC: 0.125 mg/mL, MBC: 0.5 mg/mL)。
2.4.2 抑真菌活性分析农药的大量使用不仅会导致环境问题, 而且农药残留还会对人类健康造成危害。近年来越来越多的农药被禁用, 因此需要开发出新型、环保可降解的抑菌剂以满足现场应用需求。用壳寡糖及其衍生物作为抑菌剂, 对非靶标生物、人畜、环境相对安全, 显示出了巨大的发展潜力[7]。
在样品浓度分别为0.1、0.5和1.0 mg/mL时, 壳寡糖(COS)、壳寡糖烟酸接枝衍生物(COS-N)、烟酰化壳寡糖季铵盐(A、B、C和D)对B. cinerea、G. cingulata和F. oxysporum的相对抑制率, 分别如图 5、图 6和图 7所示。所有制备的化合物在0.1~1.0 mg/mL浓度范围内均有抑制活性, 对三种植物致病真菌的抑制作用表现了很好的浓度依赖性, 在最高测试浓度下表现了最强的抑菌活性。由图 5可以发现, 壳寡糖原料对B. cinerea的抑制活性较弱, 在浓度为1.0 mg/mL时的抑制率为15.5%; 烟酰化反应过后, 抑菌活性并没有明显的增强, 而亲核反应之后, 4种目标化合物A、B、C和D在浓度为1.0 mg/mL时对B. cinerea的抑制率分别为39.3%、39.2%、41.0%和65.7%, 明显的高于壳寡糖原料。一方面, 真菌表面一般带负电, 烟酰化壳寡糖季铵盐属于阳离子型化合物, 在真菌表面可选择性吸附带正电的有机阳离子。对阳离子化合物来说, 分子中所带的正电荷的密度越大, 则与真菌细胞表面带负电荷的物质相互作用的能力越强[12]。季铵盐的引入明显提升了壳寡糖的正电荷密度, 进而改变了原生质层的物理化学性质, 使细胞活动不正常, 改变细胞膜的通透性, 使菌体细胞内组分漏出而死亡。Hui等[34]在纳米复合材料中添加壳寡糖季铵盐, 使得抗菌能力显著提升, 季铵盐的引入促进了纳米复合材料与菌体的相互作用, 更容易破坏细菌菌体的完整性。另一方面, 直链烷烃作为一种常用抑菌材料, 最大特点就是对物质有较强的吸附作用, 其作用原理是深入菌体细胞的类脂层与蛋白层, 导致酶失活和蛋白质变性, 最终导致细胞凋亡, 因此直链烷烃对提高壳寡糖的抑菌活性有积极的作用[35]; 化合物D作为表面接枝长链烷基季铵盐的壳寡糖衍生物不仅对真菌有明显的抑菌作用, 而且其抑菌性能明显优于合成的含短链烷基的壳寡糖衍生物[36]。通过图 6、图 7可以发现, 目标化合物对G. cingulata和F. oxysporum的抑制规律与图 5基本一致, 衍生物的抑菌活性随着浓度的升高而增强; 4种目标化合物A、B、C和D在浓度为1.0 mg/mL时对G. cingulata的抑制率分别为6.6%、3.4%、18.8%、51.5%, 对F. oxysporum的抑制率分别为6.5%、13.2%、25.4%、33.2%。在合成的四种壳寡糖衍生物中, 化合物D的抑真菌活性最好, 这是因为长烷基链通过与细胞膜疏水物质如磷脂间的疏水作用, 会促进高分子链与细菌胞膜的接触而起到增强抑菌活性的作用[37]。
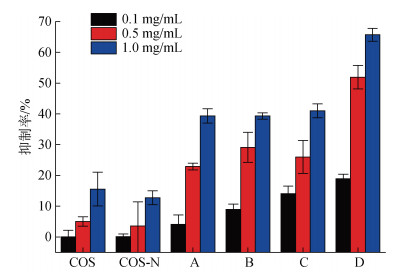 |
| 图 5 壳寡糖及其壳寡糖衍生物对灰葡萄孢菌的抑制活性 Fig. 5 Antifungal activity of chitooligosaccharide and its derivatives against Botrytis cinerea 注: COS为壳寡糖原料, COS-N为壳寡糖烟酸接枝衍生物, A为含乙基的烟酰化壳寡糖季铵盐, B为含丙基的烟酰化壳寡糖季铵盐, C为含丁基的烟酰化壳寡糖季铵盐, D为含己基的烟酰化壳寡糖季铵盐 |
 |
| 图 6 壳寡糖及其壳寡糖衍生物对围小丛壳的抑制活性 Fig. 6 Antifungal activity of chitooligosaccharide and its derivatives against Glomerella cingulate 注: COS为壳寡糖原料, COS-N为壳寡糖烟酸接枝衍生物, A为含乙基的烟酰化壳寡糖季铵盐, B为含丙基的烟酰化壳寡糖季铵盐, C为含丁基的烟酰化壳寡糖季铵盐, D为含己基的烟酰化壳寡糖季铵盐 |
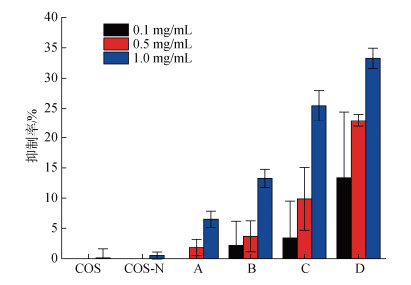 |
| 图 7 壳寡糖及其壳寡糖衍生物对香蕉枯萎病菌的抑制活性 Fig. 7 Antifungal activity of chitooligosaccharide and its derivatives against Fusarium oxysporum f. sp. Cubense 注: COS为壳寡糖原料, COS-N为壳寡糖烟酸接枝衍生物, A为含乙基的烟酰化壳寡糖季铵盐, B为含丙基的烟酰化壳寡糖季铵盐, C为含丁基的烟酰化壳寡糖季铵盐, D为含己基的烟酰化壳寡糖季铵盐 |
在本研究中, 首先制备了壳寡糖烟酸接枝衍生物作为中间体, 然后与溴代烷烃进行亲核反应, 获得了带有不同链长的烟酰化壳寡糖季铵盐衍生物。采用肉汤稀释法考察了壳寡糖衍生物对2种病原性海洋细菌的抑菌活性, 采用生长速率抑制法测试了对3种有害真菌的抑菌活性。抑菌实验表明, 季铵盐阳离子和直链烷烃的引入, 显著增强了抑菌活性。其中含有正己烷的壳寡糖衍生物表现出最强的抑菌作用, 尤其是对灰葡萄孢菌和哈氏弧菌。本文报道的方法具有制备高效、条件温和、操作简单等优点, 能够制备结构新颖、活性良好的壳寡糖衍生物, 为壳寡糖资源开发及产业化利用发展提供理论依据。此外, 衍生物的稳定性、抑菌机理等性能还需进一步研究评估。
| [1] |
MOHAN K, GANESAN A, EZHILARASI P, et al. Green and eco-friendly approaches for the extraction of chitin and chitosan: A review[J]. Carbohydrate Polymers, 2022, 287: 119349. DOI:10.1016/j.carbpol.2022.119349 |
| [2] |
TAN W Q, ZHANG J J, ZHAO X, et al. Synthesis and antioxidant action of chitosan derivatives with amino-containing groups via azide-alkyne click reaction and N-methylation[J]. Carbohydrate Polymers, 2018, 199: 583-592. DOI:10.1016/j.carbpol.2018.07.056 |
| [3] |
WANG J L, ZHUANG S T. Chitosan-based materials: Preparation, modification and application[J]. Journal of Cleaner Production, 2022, 355: 131825. DOI:10.1016/j.jclepro.2022.131825 |
| [4] |
MUANPRASAT C, CHATSUDTHIPONG V. Chitosan oligosaccharide: Biological activities and potential therapeutic applications[J]. Pharmacology and Therapeutics, 2017, 170: 80-97. DOI:10.1016/j.pharmthera.2016.10.013 |
| [5] |
HAO W T, LI K C, LI P C. Review: Advances in preparation of chitooligosaccharides with heterogeneous sequences and their bioactivity[J]. Carbohydrate Polymers, 2021, 252: 117206. DOI:10.1016/j.carbpol.2020.117206 |
| [6] |
TABAWWUM N, AHMED S, ALI M. Chitooligosaccharides and their structural-functional effect on hydrogels: A review[J]. Carbohydrate Polymers, 2021, 261: 117882. DOI:10.1016/j.carbpol.2021.117882 |
| [7] |
LIU W X, QIN Y K, LIU S, et al. Synthesis and antifungal activity of slow-release pyridinylcarbonyl chitooligosaccharide copper complexes[J]. Carbohydrate Polymers, 2022, 291: 119663. DOI:10.1016/j.carbpol.2022.119663 |
| [8] |
吴玉潇, 徐海涛, 高云华, 等. 壳寡糖的生物活性研究进展[J]. 明胶科学与技术, 2015, 35(3): 128-132. WU Yuxiao, XU Haitao, GAO Yunhua, et al. Research progress on biological activity of chitosan oligosaccharides[J]. The Science and Technology of Gelatin, 2015, 35(3): 128-132. |
| [9] |
BENCHAMAS G, HUANG G, HUANG S, et al. Preparation and biological activities of chitosan oligosaccharides[J]. Trends in Food Science & Technology, 2021, 107: 38-44. |
| [10] |
QIN Y K, LI P C, GUO Z Y. Cationic chitosan derivatives as potential antifungals: A review of structural optimization and applications[J]. Carbohydrate Polymers, 2020, 236: 116002. DOI:10.1016/j.carbpol.2020.116002 |
| [11] |
KIM J, LEE J, LEE T, et al. Synthesis of chitooligosaccharide derivative with quaternary ammonium group and its antimicrobial activity against Streptococcus mutans[J]. International Journal of Biological Macromolecules, 2003, 32: 23-27. DOI:10.1016/S0141-8130(03)00021-7 |
| [12] |
吴峻岭, 周凯运, 朱婷, 等. 含长链烷基季铵盐的纳米抑菌无机填料的合成及其在牙科复合树脂中的应用研究[J]. 华西口腔医学杂志, 2014, 32(5): 513-518. WU Junling, ZHOU Kaiyun, ZHU Ting, et al. Synthesis of a nano-antibacterial inorganic filler containing a quaternary ammonium salt with long chain alkyl and its effect on dental resin composites[J]. West China Journal of Stomatology, 2014, 32(5): 513-518. |
| [13] |
SONY M, SUMITHRA T, ANUSREE V, et al. Antimicrobial resistance and virulence characteristics of Vibrio vulnificus, Vibrio parahaemolyticus and Vibrio harveyi from natural disease outbreaks of marine/estuarine fishes[J]. Aquaculture, 2021, 539: 736608. DOI:10.1016/j.aquaculture.2021.736608 |
| [14] |
DAVIES C, WOHLGEMUTH F, YOUNG T, et al. Evolving challenges and strategies for fungal control in the food supply chain[J]. Fungal Biology Reviews, 2021, 36: 15-26. DOI:10.1016/j.fbr.2021.01.003 |
| [15] |
刘文营, 王守伟, 王俊钢, 等. 天然活性物质在肉及肉制品脂肪氧化调控中的应用研究进展[J]. 中国食品学报, 2019, 19(12): 293-303. LIU Wenying, WANG Shouwei, WANG Jungang, et al. Research progress of natural active substances applied in fat oxidation control of meat and meat products[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(12): 293-303. |
| [16] |
MI Y Q, LI Q, MIAO Q, et al. Enhanced antifungal and antioxidant activities of new chitosan derivatives modified with Schiff base bearing benzenoid/heterocyclic moieties[J]. International Journal of Biological Macromolecules, 2022, 208: 586-595. DOI:10.1016/j.ijbiomac.2022.03.141 |
| [17] |
李颖, 王贺, 张戈, 等. Sensititre YeastOne显色药敏板与微量肉汤稀释法检测曲霉体外抗真菌药物敏感性的一致性研究[J]. 中国真菌学杂志, 2020, 15(4): 197-201. LI Ying, WANG He, ZHANG Ge, et al. Comparative evaluation of Sensititre YeastOne colorimetric panel with broth microdilution method for in vitro antifungal susceptibility testing of Aspergillus[J]. Chinese Journal of Mycology, 2020, 15(4): 197-201. |
| [18] |
李秋燕, 夏志杨, 熊小敏, 等. 微量肉汤稀释法检测金黄色葡萄球菌诱导型克林霉素耐药结果分析[J]. 吉林医学, 2019, 40(11): 2466-2468. LI Qiuyan, XIA Zhiyang, XIONG Xiaomin, et al. Detection of inducible clindamycin resistance in Staphylococcus aureus by microbroth dilution method[J]. Jilin Medical Journal, 2019, 40(11): 2466-2468. |
| [19] |
曹凯欣, 邱佩佩, 贺锦灿等. 共振瑞利散射法和分光光度法快速测定3种细菌悬液的浓度[J]. 广东药科大学学报, 2019, 35(5): 619-623. CAO Kaixin, QIU Peipei, HE Jincan, et al. Rapid determination of three kinds of bacterial suspension by resonance Rayleigh scattering method and spectrophotometry[J]. Journal of Guangdong Pharmaceutical University, 2019, 35(5): 619-623. |
| [20] |
胡明, 李璐璐, 赵敏, 等. 96点阵琼脂稀释法与微量肉汤稀释法药敏试验结果的对比[J]. 中国抗生素杂志, 2018, 43(6): 729-733. HU Ming, LI Lulu, ZHAO Min, et al. Comparison of the results of 96 dot agar dilution method and broth microdilution method[J]. Chinese Journal of Antibiotics, 2018, 43(6): 729-733. |
| [21] |
TAN W Q, ZHANG J J, MI Y Q, et al. Synthesis, characterization, and evaluation of antifungal and antioxidant properties of cationic chitosan derivative via azide-alkyne click reaction[J]. International Journal of Biological Macromolecules, 2018, 120: 318-324. DOI:10.1016/j.ijbiomac.2018.08.111 |
| [22] |
TAN W Q, ZHANG J J, LUAN F, et al. Design, synthesis of novel chitosan derivatives bearing quaternary phosphonium salts and evaluation of antifungal activity[J]. International Journal of Biological Macromolecules, 2017, 102: 704-711. DOI:10.1016/j.ijbiomac.2017.04.073 |
| [23] |
VERMA SK, GHORPADE R, PRATAP A, et al. Solvent free, N, N′-carbonyldiimidazole (CDI) mediated amidation[J]. Tetrahedron Letters, 2012, 53: 2373-2376. DOI:10.1016/j.tetlet.2012.01.125 |
| [24] |
YIN N, DU R P, ZHAO F K, et al. Characterization of antibacterial bacterial cellulose composite membranes modified with chitosan or chitooligosaccharide[J]. Carbohydrate Polymers, 2020, 229: 115520. DOI:10.1016/j.carbpol.2019.115520 |
| [25] |
TAN W Q, ZHANG J J, MI Y Q, et al. Synthesis and characterization of α-lipoic acid grafted chitosan derivatives with antioxidant activity[J]. Reactive and Functional Polymers, 2022, 172: 105205. DOI:10.1016/j.reactfunctpolym.2022.105205 |
| [26] |
LI J, XIA B, XIA K, et al. Facile synthesis and characterization of cross-linked chitosan quaternary ammonium salt membrane for antibacterial coating of piezoelectric sensors[J]. International Journal of Biological Macromolecules, 2018, 120: 745-752. DOI:10.1016/j.ijbiomac.2018.08.153 |
| [27] |
JIA R X, DUAN Y F, FANG Q, et al. Pyridine-grafted chitosan derivative as an antifungal agent[J]. Food Chemistry, 2016, 196: 381-387. DOI:10.1016/j.foodchem.2015.09.053 |
| [28] |
TAN W Q, LI Q, DONG F, et al. Novel 1, 2, 3-triazolium-functionalized starch derivatives: Synthesis, characterization, and evaluation of antifungal property[J]. Carbohydrate Polymers, 2017, 160: 163-171. DOI:10.1016/j.carbpol.2016.12.060 |
| [29] |
YIN X J, LIU S, QIN Y K, et al. Metabonomics analysis of drought resistance of wheat seedlings induced by beta-aminobutyric acid-modified chitooligosaccharide derivative[J]. Carbohydrate Polymers, 2021, 272: 118437. DOI:10.1016/j.carbpol.2021.118437 |
| [30] |
ELMAHDI S, DASILVA L, PARVEEN S. Antibiotic resistance of Vibrio parahaemolyticus and Vibrio vulnificus in various countries: A review[J]. Food Microbiology, 2016, 57: 128-134. DOI:10.1016/j.fm.2016.02.008 |
| [31] |
WEI L J, LI Q, CHEN Y, et al. Enhanced antioxidant and antifungal activity of chitosan derivatives bearing 6-O-imidazole-based quaternary ammonium salts[J]. Carbohydrate Polymers, 2019, 206: 493-503. DOI:10.1016/j.carbpol.2018.11.022 |
| [32] |
赵倩, 谢全喜, 徐海燕, 等. 壳寡糖抑菌性能的研究[J]. 中国酿造, 2021, 40(3): 44-47. ZHAO Qian, XIE Quanxi, XU Haiyan, et al. Antibacterial property of oligochitosan[J]. China Brewing, 2021, 40(3): 44-47. |
| [33] |
孙丹, 乐琳, 王斌, 等. 香叶醇烷基改性壳寡糖的高效制备及表征[J]. 食品与生物技术学报, 2021, 40(5): 21-27. SUN Dan, YUE Lin, WANG Bin, et al. Facile synthesis and characterization of geraniol alkyl modified chitosan oligosaccharides[J]. Journal of Food Science and Biotechnology, 2021, 40(5): 21-27. |
| [34] |
HUI A P, YAN R, WANG W B, et al. Incorporation of quaternary ammonium chitooligosaccharides on ZnO/palygorskite nanocomposites for enhancing antibacterial activities[J]. Carbohydrate Polymers, 2020, 247: 116685. DOI:10.1016/j.carbpol.2020.116685 |
| [35] |
LIN P, CHENG C, HSIEH K, et al. Effect of alkyl chain length and fluorine content on the surface characteristics and antibacterial activity of surfaces grafted with brushes containing quaternized ammonium and fluoro-containing monomers[J]. Colloids and Surfaces B: Biointerfaces, 2021, 202: 111674. DOI:10.1016/j.colsurfb.2021.111674 |
| [36] |
ANDREICA B I, CHENG X, MARIN L. Quaternary ammonium salts of chitosan. A critical overview on the synthesis and properties generated by quaternization[J]. European Polymer Journal, 2020, 139: 110016. DOI:10.1016/j.eurpolymj.2020.110016 |
| [37] |
SAHARIAH P, BENEDIKTSSDOTTIR B E, HJALMARSDOTTIR MA, et al. Impact of chain length on antibacterial activity and hemocompatibility of quaternary N-alkyl and N, N-dialkyl chitosan derivatives[J]. Biomacromolecules, 2015, 16: 1449-1460. DOI:10.1021/acs.biomac.5b00163 |
 2024, Vol. 48
2024, Vol. 48


