
文章信息
- 濮丽丽, 王诗怡, 林志华, 王素芳, 包永波. 2024.
- PU Lili, WANG Shiyi, LIN Zhihua, WANG Sufang, BAO Yongbo. 2024.
- 采用SDS研究泥蚶血红蛋白(Tg-HbⅡ)具有过氧化物酶及抗菌活性的结构基础
- Investigation of the structural basis for peroxidase and antibacterial activity of hemoglobin from blood clam Tegillarca granosa (Tg-HbⅡ) using sodium dodecyl sulfate
- 海洋科学, 48(2): 24-32
- Marine Sciences, 48(2): 24-32.
- http://dx.doi.org/10.11759/hykx20220924001
-
文章历史
- 收稿日期:2022-09-24
- 修回日期:2023-03-06
2. 浙江万里学院生物与环境学院, 浙江省水产种质资源高效利用技术研究重点实验室, 浙江 宁波 315100;
3. 浙江万里学院宁海海洋生物种业研究院, 浙江 宁海 315604
2. Key Laboratory of Aquatic Germplasm Resources of Zhejiang, College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, China;
3. Ninghai Marine Biological Seed Industry Research Institute, Zhejiang Wanli University, Ninghai 315604, China
血红蛋白(hemoglobin, Hb)是自然界分布最广的一类血红素蛋白, 存在于脊椎动物和部分无脊椎动物中[1-2], 并发挥多种生物学功能, 如运输氧气和二氧化碳、运输硫化物、调节酸碱平衡、维持渗透压、过氧化物酶活性、抗菌作用等[3-7]。目前已发现, 牛[8]、人[9]、鳄鱼(Alligator)[10]、马[10]、蛇[10]、草鱼(Ctenopharyngodon idellus)[11]、毛蚶(Scapharca kagoshimensis)[12]和泥蚶(Tegillarca granosa)[13]等多个物种的Hb均有抗菌作用, 对革兰氏阴性的大肠杆菌(Escherichia coli)、恶臭假单胞菌(Pseudomonas putida)和革兰氏阳性的枯草芽孢杆菌(Bacillus subtilis)、坚强芽孢杆菌(Bacillusfirmus), 以及真菌白色念珠菌(Canidia albicans)表现出抗菌活性。从1958年科学家就陆续发现脊椎动物Hb的抗菌活性, 由于脊椎动物具有完善的免疫系统, 在当时及后来很长的一段时间内Hb的抗菌作用并没有引起人们的重视。无脊椎动物Hb的抗菌活性起步较晚, 虽然日益受到重视, 但是对于抗菌机理的研究还不够深入。
2002年, Kawano等[14]发现人Hb能够催化一元胺的氧化, 首次提出人Hb具有类似过氧化物酶的催化活性。随后, 细菌Hb[15]、泥蚶血红蛋白(T. granosa hemoglobin, Tg-Hb)[16]的过氧化物酶活性被陆续报道。Jiang等[17-18]检测到人Hb具有过氧化物酶活性且能产生超氧阴离子O2· –后, 推测人Hb可利用其过氧化物酶活性催化产生活性氧(reactive oxygen species, ROS)发挥抗菌作用。Qin等[11], Du等[19]研究发现微生物毒力因子(微生物胞外蛋白酶和病原体相关分子模式)能激活Hb的过氧化物酶活性, 促进O2· –的生成。Wang等[20]研究发现, Cu2+抑制泥蚶同源二聚体Hb (Tg-HbⅠ)的过氧化物酶活性时, 能使其失去抗菌活性。这些研究结果提示, Hb的抗菌活性可能与其过氧化物酶活性有关。
贝类不具有特异性免疫, 血细胞在贝类免疫中发挥着至关重要的作用, 是贝类体内抵御外来病原微生物侵袭的主要“屏障”[21]。泥蚶是一类比较特殊的血液中含Hb的蚶科贝类, 红细胞约占泥蚶血液总细胞数的90%以上, 而Tg-Hb占泥蚶血细胞可溶性蛋白的92.4%, 作者推测Tg-Hb可能在泥蚶的非特异性免疫中发挥着重要作用。泥蚶含有同源四聚体(Tg-HbⅠ)和异源四聚体(Tg-HbⅡ)两种Hb, Tg-HbⅡ约占Tg-Hb总量的60%, 是Tg-Hb的主要成分[22]。本文以Tg-HbⅡ为研究对象, 采用十二烷基硫酸钠(sodium dodecyl sulfate, SDS)研究Tg-HbⅡ具有过氧化物酶活性和抗菌活性的结构基础, 为进一步研究Tg-HbⅡ的抗菌机理奠定基础。
1 材料与方法 1.1 实验材料泥蚶取自宁海海洋与渔业科技创新养殖基地, 参照文献[22-23]报道的方法分离得到电泳纯Tg-HbⅡ。枯草芽孢杆菌(B. subtilis) ATCC 6633由浙江省水产种质资源高效利用技术研究重点实验室保存。
1.2 SDS对Tg-HbⅡ过氧化物酶活性的影响采用连续分光光度法测定过氧化物酶活性[24]。以含4 mmol·L–1愈创木酚(Sigma-Aldrich, 美国)与2 mmol·L–1过氧化氢(Aladdin, 中国上海)的0.01 mol·L–1 PBS缓冲液(pH7.2)为底物溶液, 控温25 ℃。用PBS缓冲液配制不同浓度的SDS (Solarbio, 中国北京)溶液, 分别与Tg-HbⅡ等体积混合, 使得SDS的终物质的量浓度分别为0、0.25、0.5、0.75、1.0、1.5、2.0、2.5、3.0、4.0、5.0、6.0、7.0、8.0 mmol·L–1, 混匀置于25 ℃水浴孵育2 h。向比色皿中加入1 mL预热好的底物溶液和10 μL孵育混合物, 立即混匀。利用Cary 100型紫外分光光度计(Agilent, 美国)在25 ℃、470 nm处使用动力学模式连续监测60 s内的吸光度变化。以每分钟A470 nm变化0.001所需要的酶量定义为一个酶活力单位。重复测定3次, 取平均值。未经SDS处理的Tg-HbⅡ的酶活为100%, 计算各实验组的相对酶活, 以Tg-HbⅡ的相对过氧化物酶活性对SDS浓度作图。
1.3 SDS对Tg-HbⅡ抗菌活性的影响采用琼脂扩散法测定SDS对Tg-HbⅡ抗菌活性的影响[25]。将SDS与Tg-HbⅡ等体积混合, 使得SDS的终浓度为2 mmol·L–1, 同时将2 mmol·L–1的SDS溶液作为阴性对照, 另取PBS缓冲液和Tg-HbⅡ的等体积混合液作为阳性对照, 分别置于25 ℃下孵育2 h。吸取枯草芽孢杆菌菌悬液(106 cfu·mL–1)100 μL滴加至LB固体琼脂平板上, 用涂布棒均匀涂布, 作为菌层。在每个平板中以等距离垂直放置3个牛津杯, 分别加入100 μL上述孵育混合物于相应的牛津杯中, 做好标记, 在37 ℃恒温培养箱(Yilin, 中国上海)中培养18 h后, 取出观察牛津杯周围的抑菌圈并拍照, 每组重复3次。
1.4 SDS对Tg-HbⅡ内源荧光光谱的影响将不同浓度SDS溶液与Tg-HbⅡ等体积混合, 使SDS的终物质的量浓度分别为0、0.5、1.0、2.0、3.0和4.0 mmol·L–1, 置于25 ℃水浴2 h。吸取上述混合液1 mL于石英比色皿中, 使用F-4500型荧光分光光度计(Hitachi, 日本)进行扫描, 设置激发波长为280 nm, 激发和发射狭缝宽度均为10 nm, 扫描速率为1 200 nm/min, 用不含Tg-HbⅡ的PBS缓冲液进行基线校正后在300~400 nm进行内源荧光光谱扫描。每个样品重复测定3次, 取平均值。
1.5 SDS对Tg-HbⅡ外源荧光光谱的影响以8-苯氨基-1-萘磺酸(ANS)为荧光探针检测SDS对Tg-HbⅡ表面疏水性的影响。将不同浓度的SDS溶液与Tg-HbⅡ等体积混合, 使SDS的终物质的量浓度分别为0、0.5、1.0、2.0、3.0、4.0和5.0 mmol·L–1, 置于25 ℃水浴孵育1.5 h后, 分别取上述混合液1 mL, 在避光条件下加入3 μL 40 μmol·L-1的ANS (Sigma- Aldrich, 美国)溶液, 避光孵育30 min。利用F-4500型荧光分光光度计以波长扫描方式测定外源荧光发射光谱, 设置激发波长为390 nm, 发射波长扫描范围为300~400 nm, 激发和发射狭缝宽度均为10 nm, 扫描速率为1 200 nm/min。实验重复3次, 取平均值。
1.6 SDS对紫外-可见吸收光谱的影响将不同浓度的SDS溶液与Tg-HbⅡ等体积混合, 使得SDS的终物质的量浓度分别为0、0.5、1.0、1.5、2.0、2.5和3.0 mmol·L–1, 置于25 ℃水浴孵育2 h后, 利用Cary 100型紫外分光光度计记录250~600 nm波长范围内的紫外-可见吸收光谱。以不含Tg-HbⅡ的溶液作为参比溶液。每组重复测定3次, 取平均值。
1.7 分子对接分子对接技术能从分子层面上明确SDS与Tg- HbⅡ之间的作用模式。以不等壳毛蚶(Scapharca inaequivalvis)HbⅡ的X射线晶体结构(PBD ID: 4hrr)为模板, 运用Swiss-Model在线软件(http://swissmodel.expasy.org/)对Tg-HbⅡ进行同源建模, 预测其三级结构。从蛋白质结构数据库(http://www.rcsb.org/pdb/home/home.do) SDS(PBD)获取SDS的三级结构(PBD ID: 4ib8)。运用AutoDock 4.2软件对Tg-HbⅡ与SDS进行分子对接[26]。根据化合物稳定结构能量最低的原则, 从对接结果中选择最佳对接模型。运用PyMOL 2.5软件对Tg-HbⅡ和SDS对接结果的最优构象进行可视化分析, 利用LigPlot软件展示Tg-HbⅡ与SDS相互作用的二维图像。
2 结果 2.1 SDS对Tg-HbⅡ过氧化物酶和抗菌活性的影响低浓度的SDS能抑制Tg-HbⅡ的过氧化物酶活性, 且随着SDS浓度的增大, Tg-HbⅡ的相对过氧化物酶活性逐渐降低。当SDS物质的量浓度为2 mmol·L–1时, 其相对酶活性仅为原酶活性的20%; 当SDS物质的量浓度大于2 mmol·L–1时, Tg-HbⅡ的过氧化物酶活性缓慢下降, 直至失去活性(图 1)。Tg-HbⅡ对枯草芽孢杆菌有抗菌活性, 在牛津杯的周围形成透明的抑菌圈; 用2 mmol·L–1 SDS处理Tg-HbⅡ后, 失去抗菌能力, 抑菌圈消失(图 2)。可见, 2 mmol·L–1 SDS对Tg-HbⅡ的抗菌活性具有抑制作用, 可能是因为其可以抑制80%的过氧化物酶活性。
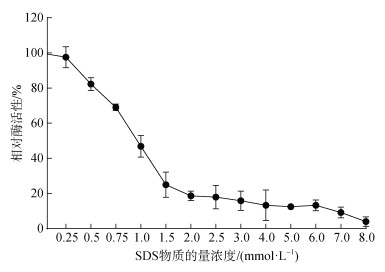 |
| 图 1 十二烷基硫酸钠(SDS)对Tg-HbⅡ过氧化物酶活性的影响 Fig. 1 Effects of SDS on the peroxidase activity of Tg-HbⅡ |
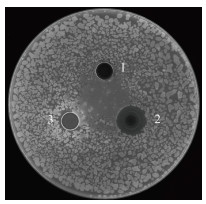 |
| 图 2 SDS对Tg-HbⅡ抗菌活性的影响 Fig. 2 Effects of SDS on the antibacterial activity of Tg-HbⅡ 注: 1. 2 mmol·L–1 SDS; 2. Tg-HbⅡ; 3. Tg-HbⅡ和2 mmol·L–1 SDS的混合溶液 |
Tg-HbⅡ的内源荧光主要来源于色氨酸(Trp)残基。随着SDS浓度的增加, Tg-HbⅡ的内源荧光强度逐渐增强, 同时最大发射波长从331 nm蓝移至323 nm (图 3), 说明SDS与Tg-HbⅡ结合使Trp残基所处微环境的极性减弱。ANS是用于检测蛋白表面疏水性的阴离子型疏水荧光探针, 当其结合到疏水区域时荧光增强。外源荧光结果显示, 随着SDS物质的量浓度的增加, 最大发射波长从482 nm红移至492 nm, 当SDS物质的量浓度为4 mmol·L–1时, ANS的荧光发射强度达到最大值, 进一步增加SDS浓度至物质的量5 mmol·L–1时, ANS荧光强度略有下降(图 4)。
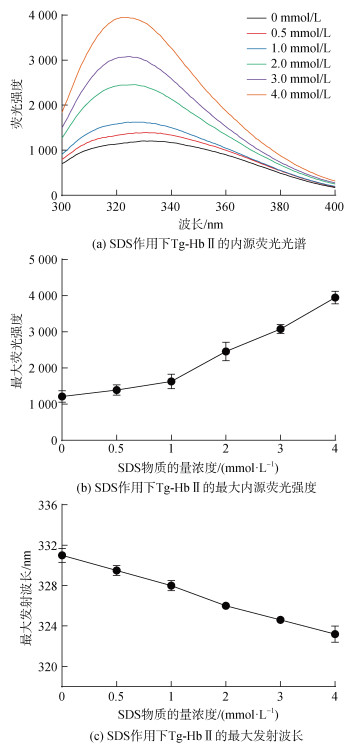 |
| 图 3 SDS对Tg-HbⅡ内源荧光光谱的影响 Fig. 3 Effects of SDS on the intrinsic fluorescence spectra of Tg-HbⅡ |
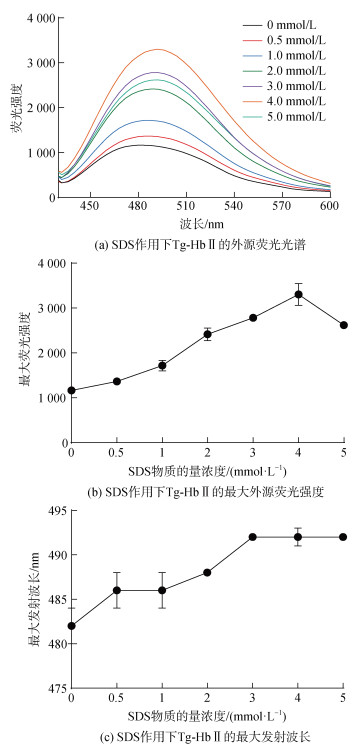 |
| 图 4 SDS对Tg-HbⅡ外源荧光光谱的影响 Fig. 4 Effects of SDS on the extrinsic fluorescence spectra of Tg-HbⅡ |
Tg-HbⅡ在250~650 nm范围内有3个特征吸收峰, 其中位于414 nm处的Soret吸收带是由血红素与组氨酸(His)配位形成的, 通常用于表征卟啉环与蛋白质构象的变化, 在500~600 nm的Q带与Tg-HbⅡ血红素辅基周围微环境的变化相关。随着SDS浓度的增大, Soret带吸收峰的强度逐渐降低, 最大吸收峰在1 mmol·L–1 SDS的存在下红移至416 nm, 当SDS物质的量浓度增加至3 mmol·L–1时, 最大吸收峰从416 nm蓝移至414 nm处(图 5)。此外, Q带的吸收强度随SDS浓度的增加而减弱并且峰形发生变化。可见, SDS分子渗透到Tg-HbⅡ疏水口袋附近的卟啉配合物, 直接作用于血红素辅基, 但未能使血红素未从Tg-HbⅡ肽链上解离。
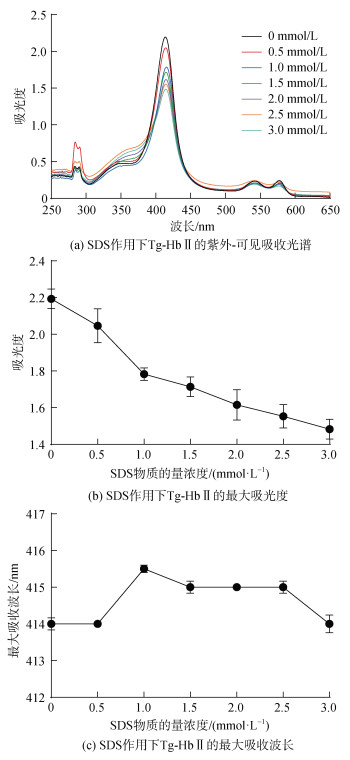 |
| 图 5 SDS对Tg-HbⅡ紫外-可见吸收光谱的影响 Fig. 5 Effects of SDS on the UV-Vis absorption spectra of Tg-HbⅡ |
通过分子对接模拟预测了SDS与Tg-HbⅡα、Tg-HbⅡβ之间结合的最优能量构象, 最低结合能分别为–2.12 kcal/mol、–2.17 kcal/mol。从分子对接结果可知, SDS能稳定结合于Tg-HbⅡα的血红素疏水腔, 其疏水性十二烷基长链与疏水腔周围的Phe52、His70、Leu74、Ala77、Phe98、His102、Ile107、Phe112和Ile115形成疏水相互作用(图 6)。Tg-HbⅡβ中有8个氨基酸参与和SDS的相互作用, 其中以疏水作用力结合的残基包括Phe54、His72、Leu76、Arg107、Ile109、Phe114和Ile117, 近端His104则与SDS的磺酸头基形成一个键长为2.70 Å的氢键(图 7), 加强了SDS与Tg-HbⅡβ间的结合能力。可见, SDS能破坏Tg-HbⅡ的疏水相互作用, 断裂血红素与近端His之间的配位键。
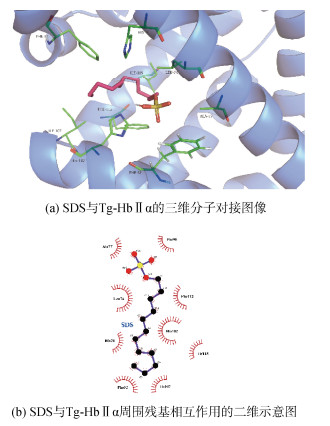 |
| 图 6 SDS与Tg-HbⅡα的分子对接 Fig. 6 Molecular docking of SDS and Tg-HbⅡα |
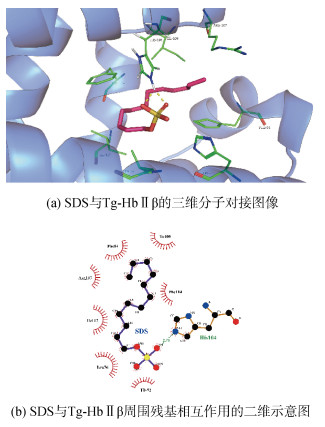 |
| 图 7 SDS与Tg-HbⅡβ的分子对接 Fig. 7 Molecular docking of SDS and Tg-HbⅡβ |
Tg-HbⅡ是由两个α亚基和两个β亚基构成的异源四聚体, 其亲水性氨基酸常位于分子表面, 而疏水性氨基酸残基埋藏在分子内部形成疏水性口袋, 血红素位于口袋里。已有研究表明, Tg-Hb的血红素口袋与天然过氧化物酶(辣根过氧化物酶、髓过氧化物酶)的活性位点具有高度相似性, 包括b型血红素、近端His、远端His和精氨酸(Arg)[16, 27]。
SDS是一类含有疏水烷基长链和亲水性磺酸头基的阴离子表面活性剂, 是研究蛋白质结构与功能关系的常用试剂[28-29]。本研究利用光谱法和分子对接技术检测到SDS优先作用于Tg-HbⅡ的血红素疏水口袋。一方面, SDS的十二烷基长链插入Tg-HbⅡ的疏水空腔并通过疏水相互作用与内部氨基酸侧链结合, 导致疏水作用被破坏和疏水性氨基酸外露, 使表面疏水性增加, ANS结合增多, 因此SDS (0.5~4 mmol·L–1)的加入增强了ANS荧光强度并使最大发射波长红移。SDS浓度增至5 mmol·L–1时反而使ANS荧光强度减弱, 可能是高浓度的SDS除了结合血红素口袋外, 还结合了Tg-HbⅡ表面的疏水氨基酸, 导致结合的ANS数量减少。这与文献报道的SDS可与ANS竞争与蛋白表面结合从而使部分ANS被释放到极性环境中导致ANS结合减弱的结果相一致[30-31]。另一方面, SDS的磺酸头基与近端His104以氢键结合, 引起血红素与近端His之间配位键的断裂, 因此, 在紫外光谱中观察到Soret带吸收强度减弱且吸收峰位移。近端His (α102-His、β104-His)和远端His (α70-His、β72-His)是已知的位于Tg-HbⅡ活性口袋中参与催化反应的氨基酸残基[16], 这4个His均参与了与SDS的相互作用, 其中有3个His与SDS形成疏水相互作用。酶促反应通常在有利于酶与底物相互作用疏水环境中进行[32]。据此可以推断, SDS主要作用于Tg-HbⅡ的血红素口袋结构而改变过氧化物酶催化反应的疏水微环境, 使过氧化物酶活性降低或丧失。这与已有研究证明的细胞色素C的过氧化物酶活性变化与蛋白展开过程中血红素部分的暴露有关一致[33]。另有报道, 脯氨酸(Pro)通过保护Tg-HbⅡ的血红素口袋结构免受Cu2+的影响, 从而使其维持一定的过氧化物酶活性和抗菌活性[34]。可见, 血红素口袋可能是维持Tg-HbⅡ的过氧化物酶活性所需的关键结构。
研究发现, 具有过氧化物酶活性的Hb能催化产生ROS起到灭菌作用[35-36]。当SDS浓度为2 mmol·L–1时, Tg-HbⅡ的血红素疏水口袋结构因被破坏而失去其过氧化物酶活性, 此时Tg-HbⅡ丧失了对枯草芽孢杆菌的抗菌活性(图 2), 说明Tg-HbⅡ的抗菌活性与其过氧化物酶活性有关。这与毛蚶血红蛋白(Scapharca subcrenata hemoglobin, Ss-Hb)发挥抗菌作用的机制可能与其过氧化物酶活性催化产生ROS有关基本一致[25]。因此, 本研究结果进一步证实了Tg-HbⅡ是利用其过氧化物酶活性发挥抗菌作用。
4 结论综上所述, SDS的疏水长链和极性头基与Tg-HbⅡ血红素疏水腔内的氨基酸残基相互作用, 改变血红素活性中心必需氨基酸所处的微环境, 破坏了维持蛋白分子构象的疏水作用, 导致Tg-HbⅡ的空间构象发生变化, 进而使Tg-HbⅡ失去过氧化物酶活性及抗菌活性。因此, Tg-HbⅡ的血红素疏水口袋对维持其构象和活性至关重要, 是Tg-HbⅡ发挥过氧化物酶活性和抗菌活性的结构基础。本研究结果为阐明Tg-HbⅡ通过其过氧化物酶活性发挥抗菌作用提供了可信依据, 为深入研究Tg-HbⅡ的抗菌机理奠定基础。
| [1] |
HARDISON R C. A brief history of hemoglobins: plant, animal, protist, and bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(12): 5675-5679. |
| [2] |
WEBER R E, VINOGRADOV S N. Nonvertebrate hemoglobins: functions and molecular adaptations[J]. Physiological Reviews, 2001, 81(2): 569-628. DOI:10.1152/physrev.2001.81.2.569 |
| [3] |
COOPER C E, SILAGHI-DUMITRESCU R, RUKENGWA M, et al. Peroxidase activity of hemoglobin towards ascorbate and urate: a synergistic protective strategy against toxicity of hemoglobin-based oxygen carriers (HBOC)[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2008, 1784(10): 1415-1420. DOI:10.1016/j.bbapap.2008.03.019 |
| [4] |
COATES C J, DECKER H. Immunological properties of oxygen-transport proteins: hemoglobin, hemocyanin and hemerythrin[J]. Cellular and Molecular Life Sciences, 2017, 74(2): 293-317. DOI:10.1007/s00018-016-2326-7 |
| [5] |
ANDERSON H L, BRODSKY I E, MANGALMURTI N S. The evolving erythrocyte: red blood cells as modulators of innate immunity[J]. The Journal of Immunology, 2018, 201(5): 1343-1351. DOI:10.4049/jimmunol.1800565 |
| [6] |
樊廷俊, 徐彬, 荆昭, 等. 动物血红蛋白结构与功能的研究进展[J]. 山东大学学报(理学版), 2011, 46(7): 1-6. FAN Tingjun, XU Bin, JING Zhao, et al. Research advances on structure and function of animal hemoglobin[J]. Journal of Shandong University (Natural Science), 2011, 46(7): 1-6. |
| [7] |
汪青, 项荣花, 包永波, 等. 动物血红蛋白研究进展[J]. 宁波大学学报: 理工版, 2011, 24(2): 20-24. WANG Qing, XIANG Ronghua, BAO Yongbo, et al. Research progress in animal hemoglobin[J]. Journal of Ningbo University (Natural Science & Engineering Edition), 2011, 24(2): 20-24. DOI:10.3969/j.issn.1001-5132.2011.02.004 |
| [8] |
HOBSON D, HIRSCH J G. The antibacterial activity of hemoglobin[J]. The Journal of Experimental Medicine, 1958, 107(2): 167-172. DOI:10.1084/jem.107.2.167 |
| [9] |
周新娥, 欧阳运薇, 潘小玲, 等. 人血红蛋白及其片段体内外抗菌活性研究[J]. 四川大学学报: 医学版, 2008, 39(3): 355-359. ZHOU Xine, OUYANG Yunwei, PAN Xiaoling, et al. Study on antimicrobial activity of human hemoglobin and its fragments both in vitro and in vivo[J]. Journal of Sichuan University (Medical Science Edition), 2008, 39(3): 355-359. DOI:10.3969/j.issn.1672-173X.2008.03.003 |
| [10] |
PARISH C A, JIANG H, TOKIWA Y, et al. Broad-spectrum antimicrobial activity of hemoglobin[J]. Bioorganic & Medicinal Chemistry, 2001, 9(2): 377-382. |
| [11] |
QIN Z D, BABU V S, LIN H Z, et al. Antibacterial activity of erythrocyte from grass carp (Ctenopharyngodon idella) is associated with phagocytosis and reactive oxygen species generation[J]. Fish & Shellfish Immunology, 2019, 92: 331-340. |
| [12] |
XU B, ZHAO J, JING Z, et al. Role of hemoglobin from blood clam Scapharca kagoshimensis beyond oxygen transport[J]. Fish & Shellfish Immunology, 2015, 44(1): 248-256. |
| [13] |
BAO Y B, WANG Q, LIN Z H. Hemoglobin of the bloody clam Tegillarca granosa (Tg-HbI) is involved in the immune response against bacterial infection[J]. Fish & Shellfish Immunology, 2011, 31(4): 517-523. |
| [14] |
KAWANO T, PINONTOAN R, HOSOYA H, et al. Monoamine-dependent production of reactive oxygen species catalyzed by pseudoperoxidase activity of human hemoglobin[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(6): 1224-1232. DOI:10.1271/bbb.66.1224 |
| [15] |
KVIST M, RYABOVA E S, NORDLANDER E, et al. An investigation of the peroxidase activity of Vitreoscilla hemoglobin[J]. JBIC Journal of Biological Inorganic Chemistry, 2007, 12(3): 324-334. DOI:10.1007/s00775-006-0190-x |
| [16] |
WANG S F, YU X P, LIN Z H, et al. Hemoglobins likely function as peroxidase in blood clam Tegillarca granosa hemocytes[J]. Journal of Immunology Research, 2017, 2017(8): 1-10. |
| [17] |
JIANG N X, TAN N S, HO B, et al. Respiratory protein- generated reactive oxygen species as an antimicrobial strategy[J]. Nature Immunology, 2007, 8(10): 1114-1122. DOI:10.1038/ni1501 |
| [18] |
JIANG N X. The role of respiratory proteins in innate immunity[D]. Beijing: Tsinghua University, 2008.
|
| [19] |
DU R J, HO B, DING J L. Rapid reprogramming of haemoglobin structure-function exposes multiple dual- antimicrobial potencies[J]. The EMBO Journal, 2010, 29(3): 632-642. DOI:10.1038/emboj.2009.380 |
| [20] |
WANG S F, YU X P, ZHANG S Q, et al. Cu2+ inhibits the peroxidase and antibacterial activity of homodimer hemoglobin from blood clam Tegillarca granosa by destroying its heme pocket structure[J]. Frontiers in Marine Science, 2021, 8: 635210. DOI:10.3389/fmars.2021.635210 |
| [21] |
周永灿, 潘金培. 贝类细胞和体液的防御机制研究进展[J]. 水产学报, 1997, 21(4): 449-454. ZHOU Yongcan, PAN Jinpei. Progress on researches of cellular and humoral defense mechanisms in molluscs[J]. Journal of Fisheries of China, 1997, 21(4): 449-454. DOI:10.3321/j.issn:1000-0615.1997.04.017 |
| [22] |
王素芳, 包永波, 施淼江, 等. 泥蚶血红蛋白的制备及其抗菌活性研究[J]. 海洋学报, 2014, 36(12): 67-73. WANG Sufang, BAO Yongbo, SHI Miaojiang, et al. Purification and antibacterial activity of hemoglobin from Tegillarca granosa[J]. Acta Oceanologica Sinica, 2014, 36(12): 67-73. DOI:10.3969/j.issn.0253-4193.2014.12.006 |
| [23] |
BAO Y, WANG J, LI C, et al. A preliminary study on the antibacterial mechanism of Tegillarca granosa hemoglobin by derived peptides and peroxidase activity[J]. Fish & Shellfish Immunology, 2016, 51: 9-16. |
| [24] |
郑丹妮, 缪林彬, 刘建锋, 等. 连续监测法测定泥蚶血红蛋白过氧化物酶活性的研究[J]. 药物生物技术, 2015, 22(2): 137-141. ZHENG Danni, MIAO Linbin, LIU Jianfeng, et al. A consecutive monitoring method for determining peroxidase activity of hemoglobin from Tegillarca Granosa[J]. Chinese Journal of Pharmaceutical Biotechnology, 2015, 22(2): 137-141. |
| [25] |
WANG S F, HUANG Y Y, LIU S, et al. Hemoglobins from Scapharca subcrenata (Bivalvia: Arcidae) likely play an bactericidal role through their peroxidase activity[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2021, 253: 110545. DOI:10.1016/j.cbpb.2020.110545 |
| [26] |
MORRIS G M, HUEY R, OLSON A J. Using autodock for ligand-receptor docking[J]. Current Protocols in Bioinformatics, 2008, 24(1): 8-14. |
| [27] |
VLASOVA I I. Peroxidase activity of human hemoproteins: keeping the fire under control[J]. Molecules, 2018, 23(10): 2561. DOI:10.3390/molecules23102561 |
| [28] |
KHAN J M, MALIK A, AHMED A, et al. SDS induces cross beta-sheet amyloid as well as alpha-helical structure in conconavalin A[J]. Journal of Molecular Liquids, 2020, 319: 114154. DOI:10.1016/j.molliq.2020.114154 |
| [29] |
HOU H, HE H W, WANG Y J. Effects of SDS on the activity and conformation of protein tyrosine phosphatase from thermus thermophilus HB27[J]. Scientific Reports, 2020, 10(1): 1-8. DOI:10.1038/s41598-019-56847-4 |
| [30] |
余晶梅, 林东强, 童红飞, 等. 荧光探针法研究牛血清白蛋白和免疫球蛋白的表面疏水特性[J]. 高校化学工程学报, 2014, 28(4): 771-776. XU Jingmei, LIN Dongqiang, TONG Hongfei, et al. Studies on surface hydrophobicity of bovine serum albumin and immunoglobulin by a fluorescence probe method[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(4): 771-776. DOI:10.3969/j.issn.1003-9015.2014.04.013 |
| [31] |
PAUL S, KUNDU M, DAS K P, et al. Unfolding studies of Escherichia coli maltodextrin glucosidase monitored by fluorescence spectroscopy[J]. Journal of Biological Physics, 2008, 34(6): 539-550. DOI:10.1007/s10867-008-9117-9 |
| [32] |
王镜岩, 朱圣庚, 徐长法. 生物化学(第3版上册)[M]. 北京: 高等教育出版社, 2002: 394. WANG Jingyan, ZHU Shenggeng, XU Changfa. Biochemistry (Volume I of the Third Edition)[M]. Beijing: Higher Education Press, 2002: 394. |
| [33] |
SHARMA R D, KANWAL R, LYNN A M, et al. High temperature unfolding of a truncated hemoglobin by molecular dynamics simulation[J]. Journal of Molecular Modeling, 2013, 19(9): 3993-4002. DOI:10.1007/s00894-013-1919-4 |
| [34] |
张顺琴, 王素芳, 陈梦玫, 等. Cu2+对泥蚶血红蛋白(Tg-HbⅡ)的过氧化物酶活性与结构的影响[J]. 海洋学报, 2018, 40(1): 106-114. ZHANG Shunqin, WANG Sufang, CHEN Mengmei, et al. Effects of Cu2+ on structure and peroxidase activity of Tegillarca granosa hemoglobin (Tg-HbⅡ)[J]. Acta Oceanologica Sinica, 2018, 40(1): 106-114. |
| [35] |
BOGDAN C. Oxidative burst without phagocytes: the role of respiratory proteins[J]. Nature Immunology, 2007, 8(10): 1029-1031. DOI:10.1038/ni1007-1029 |
| [36] |
CHENG T M, MAO S J T, LAI S T, et al. Haemoglobin-induced oxidative stress is associated with both endogenous peroxidase activity and H2O2 generation from polyunsaturated fatty acids[J]. Free Radical Research, 2011, 45(3): 303-316. DOI:10.3109/10715762.2010.532492 |
 2024, Vol. 48
2024, Vol. 48


